氮是生物圈中非常重要的元素,通过在氧化态+V和+Ⅲ之间的转换,氮元素参与了多种化合物的合成和分解,即氮的生物地球化学循环(N-cycle),N-cycle涉及大量的氧化还原反应。其中反硝化作用是将![]() 转换为N2或者
转换为N2或者![]() 的反应,亚硝酸盐还原酶(nitrite reductase,NiR,EC1.7.2.1)是该过程中的关键酶[1]。
的反应,亚硝酸盐还原酶(nitrite reductase,NiR,EC1.7.2.1)是该过程中的关键酶[1]。
亚硝酸盐还原酶将亚硝酸盐降解为N2或![]() 减少了亚硝态氮在环境中的积累。目前,根据其分子结构和包含的金属离子不同,将NiR分为两类:由nirK基因编码的铜型亚硝酸盐还原酶(CuNiR)和由nirS基因编码的细胞色素cd1-亚硝酸盐还原酶(cd1-NiR)。由nirK基因编码的CuNiR分布广泛,其分子结构在反硝化革兰氏阴性菌中研究较为透彻[2-3]。CuNiR是由3个相同亚基组成的三聚体蛋白,每个单体都包含两种类型的铜原子活性中心[4],即提供电子的T1Cu中心和起催化作用的T2Cu中心[5]。在T1Cu位置,Cu由2个His、1个Cys和轴向Met配位形成四面体几何形状;T2Cu在静息状态呈(His)3-H2O四面体几何结构[6]。CuNiR的催化机制如图1所示,
减少了亚硝态氮在环境中的积累。目前,根据其分子结构和包含的金属离子不同,将NiR分为两类:由nirK基因编码的铜型亚硝酸盐还原酶(CuNiR)和由nirS基因编码的细胞色素cd1-亚硝酸盐还原酶(cd1-NiR)。由nirK基因编码的CuNiR分布广泛,其分子结构在反硝化革兰氏阴性菌中研究较为透彻[2-3]。CuNiR是由3个相同亚基组成的三聚体蛋白,每个单体都包含两种类型的铜原子活性中心[4],即提供电子的T1Cu中心和起催化作用的T2Cu中心[5]。在T1Cu位置,Cu由2个His、1个Cys和轴向Met配位形成四面体几何形状;T2Cu在静息状态呈(His)3-H2O四面体几何结构[6]。CuNiR的催化机制如图1所示,![]() 通过与T2Cu中心的氧化形式结合而取代1个可溶性分子,并在
通过与T2Cu中心的氧化形式结合而取代1个可溶性分子,并在![]() 的1个氧原子和Asp98残基间形成氢键。当电子从T1Cu中心传递到T2Cu中心后,该氢键的质子从Asp98残基转移到底物的氧原子上形成中间产物O=N-O-H,该氧原子的N-O键随后断裂并形成产物NO,随后形成T2Cu-H2O复合物。
的1个氧原子和Asp98残基间形成氢键。当电子从T1Cu中心传递到T2Cu中心后,该氢键的质子从Asp98残基转移到底物的氧原子上形成中间产物O=N-O-H,该氧原子的N-O键随后断裂并形成产物NO,随后形成T2Cu-H2O复合物。
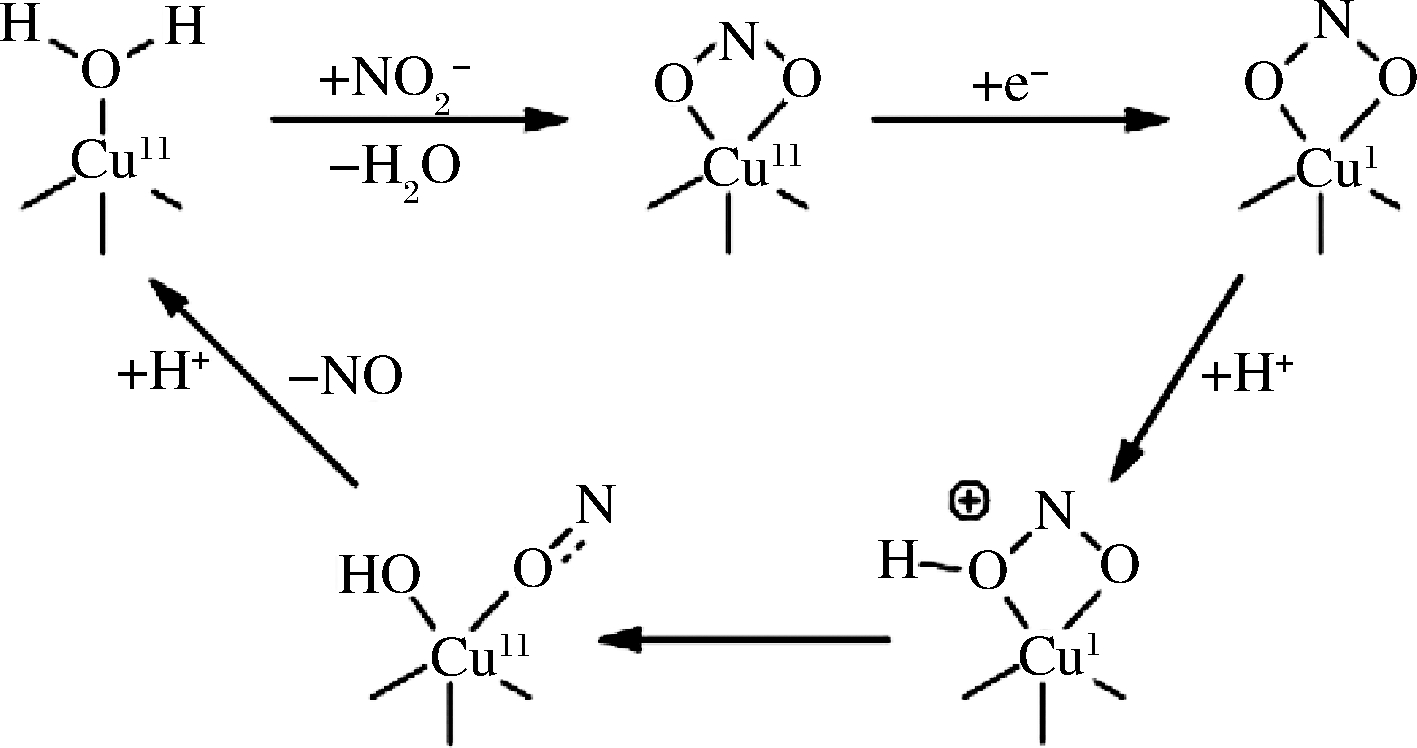
图1 CuNiR中亚硝酸盐还原的作用机理
Fig.1 The mechanism of action of nitrite reduction in CuNiR
随后,水复合材料能够重新进入催化体系并发挥其在亚硝酸盐还原中的作用[7]。HORRELL等[8]研究了CuNiR分子与结构特征,但未报道CuNiR酶学性质的研究。本研究在酸菜汤汁中分离得到1株植物乳杆菌(Lactobacillus sp.),命名为LMY-20。合成了LMY-20菌株的nir基因,并对其蛋白进行了表达纯化及酶活性质研究,重组NiR温度稳定性较好,为亚硝酸盐还原酶基因的进一步开发及利用提供理论依据。
植物乳杆菌(Lactobacillus sp. LMY-20)从东北酸菜汤汁中分离筛选得到,保藏于大连大学生命科学与技术学院辽宁省海洋微生物工程实验室;表达载体pET28a(+)和E.coli DH5α由Synbio Technologies提供;E.coli BL21(DE3)、pMD-19-T Vector、PowerMaxTM Soil DNA Isolation Kit基因组大量提取试剂盒购自TaKaRa公司;DL2000 DNA Marker、普通琼脂糖凝胶DNA回收试剂盒、限制性内切酶NcoI和XhoI、2xTaq PCR Master-Mix,购自北京TIANGEN生物公司;预染蛋白分子质量标准(PageRuler Prestained Protein Ladder),购自MBI Fermentas公司;Bradford蛋白浓度测定试剂盒,购自上海生工。其他试剂为分析纯。
MRS培养基(g/L):葡萄糖20、蛋白胨10、酵母粉4、K2HPO4 2、牛肉粉8、MgSO4 0.2、乙酸钠5、柠檬酸三铵2、MnSO4 0.05、吐温-80 1、琼脂20、pH(6.2±0.2)。
LB培养基(g/L):胰蛋白胨10、酵母浸提物5、NaCl 10。LA培养基:LB液体或固体培养基中加入终质量浓度为100 μg/mL卡那霉素。
Veriti Dx PCR扩增仪,Thermo Fisher Scientific公司;GS-158低温台式离心机,BECKMAN公司;J21-M高速冷冻离心机,BECKMAN公司;台式冷冻离心机,Eppendorf公司;CH1015超级恒温水浴槽,上海恒平仪器厂;Inazge Mlaster RVDS电泳成像系统,Parmacia Biotech公司;DYY-Ⅲ形电泳槽,北京六一仪器厂;Milli-QAcademic超纯水器、pH计,BECKMAN公司。
1.4.1 目的基因的获取与合成
Lactobacillus sp. LMY-20于MRS培养基30 ℃,160 r/min振荡培养36 h后离心富集菌体,利用基因组大量提取试剂盒提取基因组DNA。所提DNA送到北京百迈克生物科技有限公司进行DNA质量检测,并使用Illumina Hiseq X10高通量测序平台进行双端测序(PE150),建库大小为270 bp。对测序数据过滤低质量后,利用Velvet软件[9]进行初步组装得到最终基因组框架图。组装得到基因组序列总长度为3.27 Mb,GC含量为44.36%,测序深度为180×。基因预测与功能注释由RAST(rapid annotation using subsystem technology)[10]完成,选取默认参数。亚硝酸盐还原酶基因的获取由基因功能注释结果及BLAST比对NiR参考蛋白序列(ERL45402.1,AHN70577.1,ATO54837.1,AFO84709.1,GAF39669.1,WP_094784585.1,PNE49716.1,PNE49716.1,WP_005922732.1,EAV38847.1,CUW15443.1,OEG23520.1,OJG98603.1)确定,由Synbio Technologies公司对菌株LMY-20的nir基因进行基因全长合成并构建于克隆载体pMD-19-T。
1.4.2 重组表达载体pET28a-nir的构建
以pMD-19-T-nir为模板,nir-F:5-CTCGAGAAAA GACCATGGCCAA-3和nir-R:5-CTTAAGAATCCTGT TTGGAC-3为引物, PCR扩增nir基因。PCR反应条件:94 ℃变性5 min。循环参数为:94 ℃、30 s,65 ℃、45 s(即退火时每圈减少2 ℃),72 ℃、 1 min、5个循环。循环参数为:94 ℃、30 s,55 ℃、 45 s,72 ℃、1 min,72 ℃、 10 s,25个循环,PCR反应结束。PCR产物于1%琼脂糖凝胶上电泳鉴定纯度和分子质量的大小。回收PCR产物,将获得的片段经NcoI和XhoI双酶切后亚克隆至pET28a(+)载体的NcoI和XhoI位点之间,连接产物转化大肠杆菌DH5α,转化子经菌落PCR鉴定筛选出符合要求的阳性克隆,对阳性克隆进行测序NcoI和XhoI双酶切验证,将构建正确的重组质粒命名为pET28a(+)-nir。
1.4.3nir基因的表达
将构建好的表达菌株接种到LB/Kan液体培养基中,37 ℃振荡过夜培养14 h,然后分别按1%的菌液量接种于含有100 mL LB/Kan液体培养基的三角瓶中,37 ℃振荡培养4 h (菌液OD600达到0.4~0.6) 时[11],加入异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)使最终浓度为1 mmol/L,37 ℃诱导时间4 h行诱导表达;同时以空载体和未诱导作对照。将菌液8 000 r/min离心10 min,弃去上清液,沉淀菌体用PBS缓冲液(pH 7.4)洗涤2次,将洗涤后的菌体重悬于10 mL预冷的PBS缓冲液(pH 7.4) 中,超声裂解10 min,每次3 s,间隔5 s,功率200 W。然后10 000 r/min,4 ℃,离心20 min。分别上清液、沉淀为蛋白样品经变性聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE) 检测,记录并分析结果。
1.4.4 NiR蛋白包涵体的变性溶解与纯化
上述沉淀物用20 mL包涵体洗涤液(2 mol/L尿素,1‰ 曲拉通X-100(体积分数),1‰ 十二烷基肌氨酸钠(体积分数),1 mmol/L DTT,20 mmol/L Tris-HCl (pH 8.0),1 mmol/L EDTA,50 mmol/L NaCl)在4 ℃条件下洗涤3次,置8 000 r/min离心20 min;洗涤后的沉淀用10 mL蛋白质变性液(6 mol/L 尿素,1 mmol/L DTT,1%(体积分数)十二烷基肌氨酸钠)重悬包涵体,8 000 r/min离心30 min,弃掉沉淀;将上述变形后的蛋白液用复性液(20 mmol/L Tris-HCl,50 mmol/L NaCl,1 mmol/L DTT,0.1%(体积分数)曲拉通X-100, 20%(体积分数)甘油)4 ℃搅拌透析24 h后,逐渐换到终体积分数为10%甘油,4 ℃搅拌透析24 h。 透析袋中的目的蛋白包涵体经变性溶解后为粗酶液[12-13]。粗蛋白Ni+-NTA亲和层析柱(Novagen)进行亲和层析纯化[14],洗脱蛋白液4 ℃保存,蛋白样品经SDS-PAGE检测,记录并分析结果。
1.4.5 蛋白质浓度测定
蛋白浓度通过Bradford蛋白浓度测定试剂盒(bradford protein assay kit) 测定。
1.4.6 NiR酶活性的测定[15-16]
对方法1.4.4中的粗酶液和镍柱洗脱液测定酶活。NiR活性测定采用Na2S2O4-MV[15-16]法。利用甲基紫精作为人工电子供体使NiR催化![]() 还原为NO或NH3。亚硝酸盐还原酶的消耗可以通过反应液中总的亚硝酸盐量减去剩余的
还原为NO或NH3。亚硝酸盐还原酶的消耗可以通过反应液中总的亚硝酸盐量减去剩余的![]() 量得到
量得到![]() 含量可用盐酸萘乙二胺法测定,即在酸性条件下与对氨基苯磺酸发生重氮反应,生成的重氮化合物又与盐酸萘乙二胺生成了紫红色偶氮化合物,可在538 nm下显色测定。
含量可用盐酸萘乙二胺法测定,即在酸性条件下与对氨基苯磺酸发生重氮反应,生成的重氮化合物又与盐酸萘乙二胺生成了紫红色偶氮化合物,可在538 nm下显色测定。
测定酶活反应体系(500 μL)(μL):0.1 mol/L磷酸盐缓冲液(pH 6.5) 50,0.1 mol/L NaNO2 25,0.1 mol/L MV 15,0.1 mol/L Na2S2O4 80,酶液300。37 ℃水浴中反应10 min,剧烈振荡终止反应(以磷酸缓冲液为空白)。取10 μL用盐酸萘乙二胺法测定亚硝酸盐残留量。亚硝酸还原酶活力单位通过在37 ℃ 下,每分钟还原1 μmol亚硝酸盐所消耗的酶量来表示。比活力用1 mg蛋白质中酶的活力单位数来表示。
1.4.7 重组NiR的性质分析
最适反应温度:在pH 6.5的PBS缓冲溶液条件下,在4、10、20、25、30、35、37、40、50、60、70 ℃下测定酶活,以37 ℃的酶活为100%计算相对酶活。
酶的热稳定性:将酶液分别置于不同温度(4、10、20、25、30、35、37、40、50、60、70 ℃)下水浴40 min,在pH6.5的PBS缓冲溶液中和最适反应温度下检测残余酶活,并以未保温时的酶活为100%计算相对酶活。
最适反应pH值:在最适酶活反应温度下,分别用0.25 mol/L、pH 2.0、3.0、4.0、4.5、5.0、5.5、6.0的柠檬酸-柠檬酸钠缓冲液;0.25 mol/L、pH 6.5、7.0、 7.5、8.0的Tris-HCl缓冲液;分别用0.25 mol/L、pH 9.0、10.0、11.0的Na2HPO4-NaOH缓冲液中测定酶活,以pH 6.5的酶活为100%计算相对酶活,绘制酶活曲线。
酶的pH值稳定性:将酶液分别置于上述缓冲液中水浴40 min,在最适反应pH值和最适反应温度下检测残余酶活,并以未保温时的酶活为100%计算相对活性,绘制酶活曲线。
金属离子及EDTA对酶活性的影响:分别向反应体系中加入终浓度为1、5 mmol/L的Zn2+, Cu2+, Ba2+, Na+, Fe3+, Mg2+, Al3+, Mn2+及EDTA,在标准条件下测定酶活,并和不添加任何金属离子的酶活进行比较,计算相对活性,每次做3组平行实验。
1.4.8 动力学分析
在标准条件下,分别测定0.01~0.1 mol/L NaNO2存在条件下NiR的动力学参数。以Origin 8.0 对数据进行拟合,推算酶催化的Km及Vmax,依据测定蛋白含量,计算kcat及催化效率(kcat/Km),所有测定设置3个平行。
以质粒pMD-19-T-nir为模板,用引物nir-F和nir-R PCR扩增nir基因,PCR产物经1%(质量分数)琼脂糖凝胶电泳,可见约1.3 kb的特异性条带(图2),大小与预期相符(1.262 kb)。
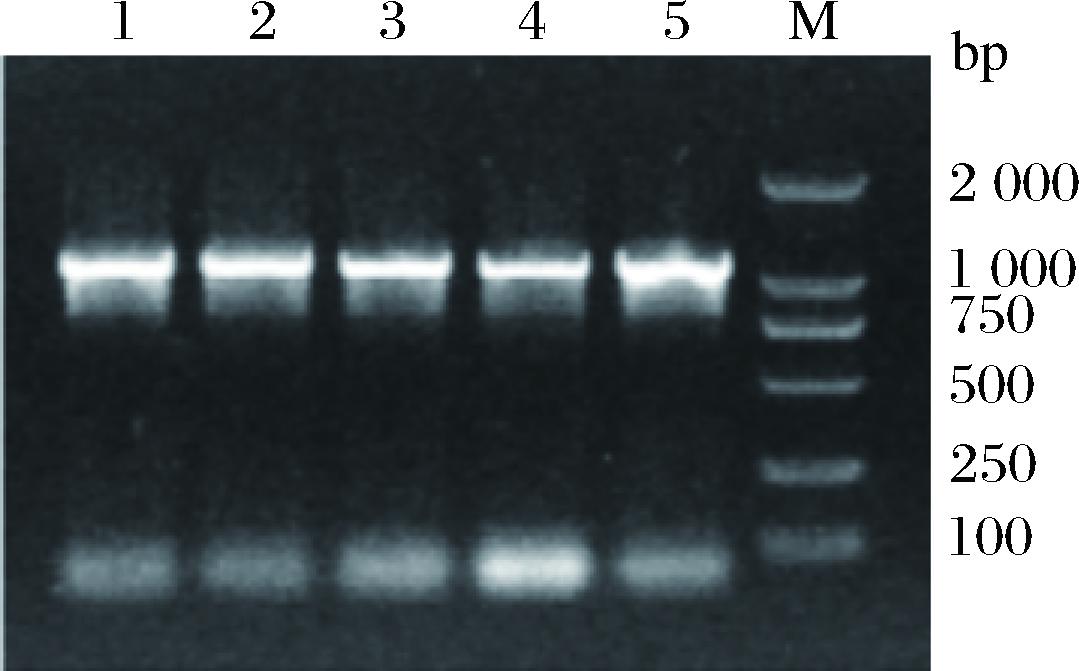
1~5-nir基因的PCR产物;M-DNA marker DL2000
图2 亚硝酸盐还原酶基因PCR产物
Fig.2 Electrophoretic profile of the PCR product ofnir
重组表达载体pET28a(+)-nir经NcoI和XhoI双酶切,1%琼脂糖凝胶电泳分析,可见约5.4 kb的载体片段和1.3 kb的目的基因片段(图3)。对重组表达载体pET28a(+)-nir进行DNA测序,结果显示插入基因序列与设计序列完全一致,成功构建了重组表达载体pET28a(+)-nir。

M-DNA marker DL5000;1-pET28a(+)-nir的
酶切产物;2-未酶切的pET28a(+)-nir
图3 重组表达质粒pET28a(+)-nir的酶切鉴定
Fig.3 Identification of the pET28a(+)-nir plasmid digested withNcoI andXhoI
将经鉴定正确的原核重组表达质粒载体pET28a(+)-nir转化至表达宿主菌E.coli BL21(DE3)中诱导表达。菌体裂解物进行SDS-PAGE电泳,由图4可知,泳道空载、未诱导宿主菌株和诱导菌株的破碎上清液均未见目的蛋白,而诱导菌株的破碎沉淀泳道约45 kDa位置处出现特异条带,与预期表达的相对分子质量(44.959 kDa)相符,说明目的蛋白NiR在宿主菌E.coli BL21(DE3)中成功表达,但只在沉淀中检测到目的蛋白,由此可知,目的蛋白NiR在大肠杆菌中以包涵体形式不可溶表达。
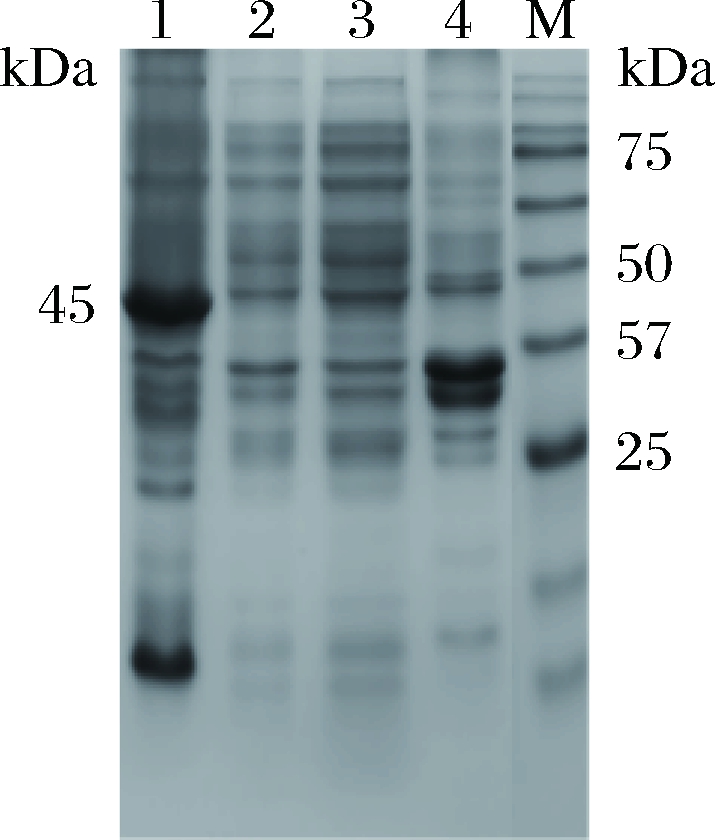
1-诱导pET28a(+)-nir/BL21(DE3)沉淀;2-诱导
pET28a(+)-nir/BL21(DE3)上清;3-未诱导pET28a(+)-nir /BL21(DE3) 沉淀;4-未诱导pET28a(+)-nir /
BL21(DE3) 上清;M-蛋白质marker
图4 目的蛋白NiR的SDS-PAGE检测结果
Fig.4 SDS-PAGE analysis of NiR protein
在低温条件下,将离心所得的包涵体先用缓冲液洗涤,除去包涵体表面杂质,再对包涵体进行溶解,收集上清液。经透析复性,去除高浓度尿素,逐渐恢复重组蛋白空间构象,复性后的蛋白为粗酶液,其NiR酶活为33.97 U/mg。
蛋白复性液通过Ni+-NTA亲和层析法纯化重组NiR(图5)。纯化NiR总蛋白含量为10.3 mg,比活力为226.48 U/mg,总活力为2 332.72 U,总回收率为63.00%,纯化倍数为7.32(表1)。
表1 重组NiR的纯化
Table 1 Summary of NiR enzyme
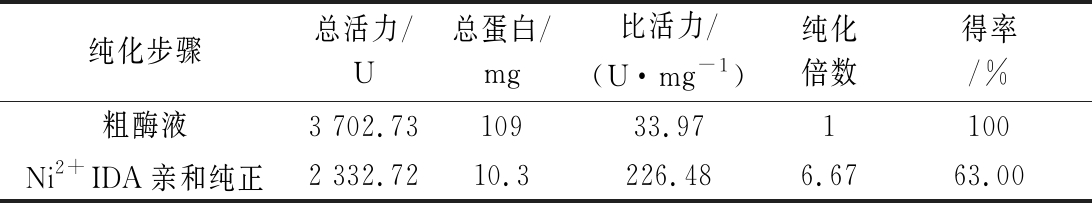
纯化步骤总活力/U总蛋白/mg比活力/(U·mg-1)纯化倍数得率/%粗酶液3 702.7310933.971100Ni2+IDA亲和纯正2 332.7210.3226.486.6763.00
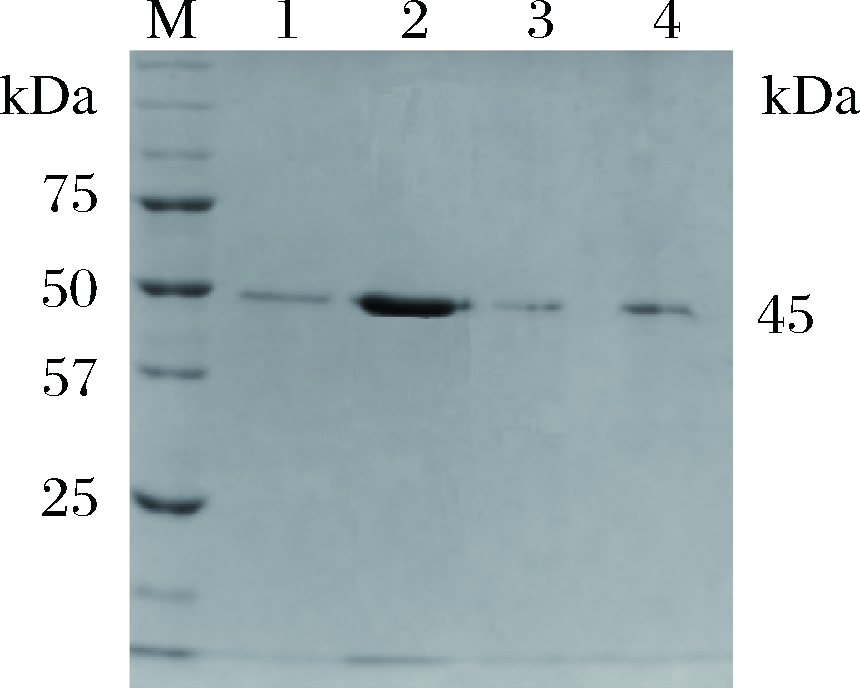
M-蛋白质marker;1~4-Ni2+柱的80、100、150、300 mmol/L咪唑溶液洗脱液
图5 纯化产物的SDS-PAGE分析
Fig.5 SDS-PAGE profile of purified NiR
2.5.1 pH对酶活性的影响
由图6-a可知,重组NiR相对酶活在pH 2.0~12.0先升高后降低,在pH为6.5时达到最大值,之后相对酶活逐渐降低,因此,重组NiR的最适pH值为6.5。在37 ℃条件下,分别采用不同pH值的PBS缓冲液孵育重组NiR,结果表明,该酶在pH 6.5~8.0的稳定性较好,相对酶活保持在60%以上。其中,在pH为7.0时最稳定(图6-b)。
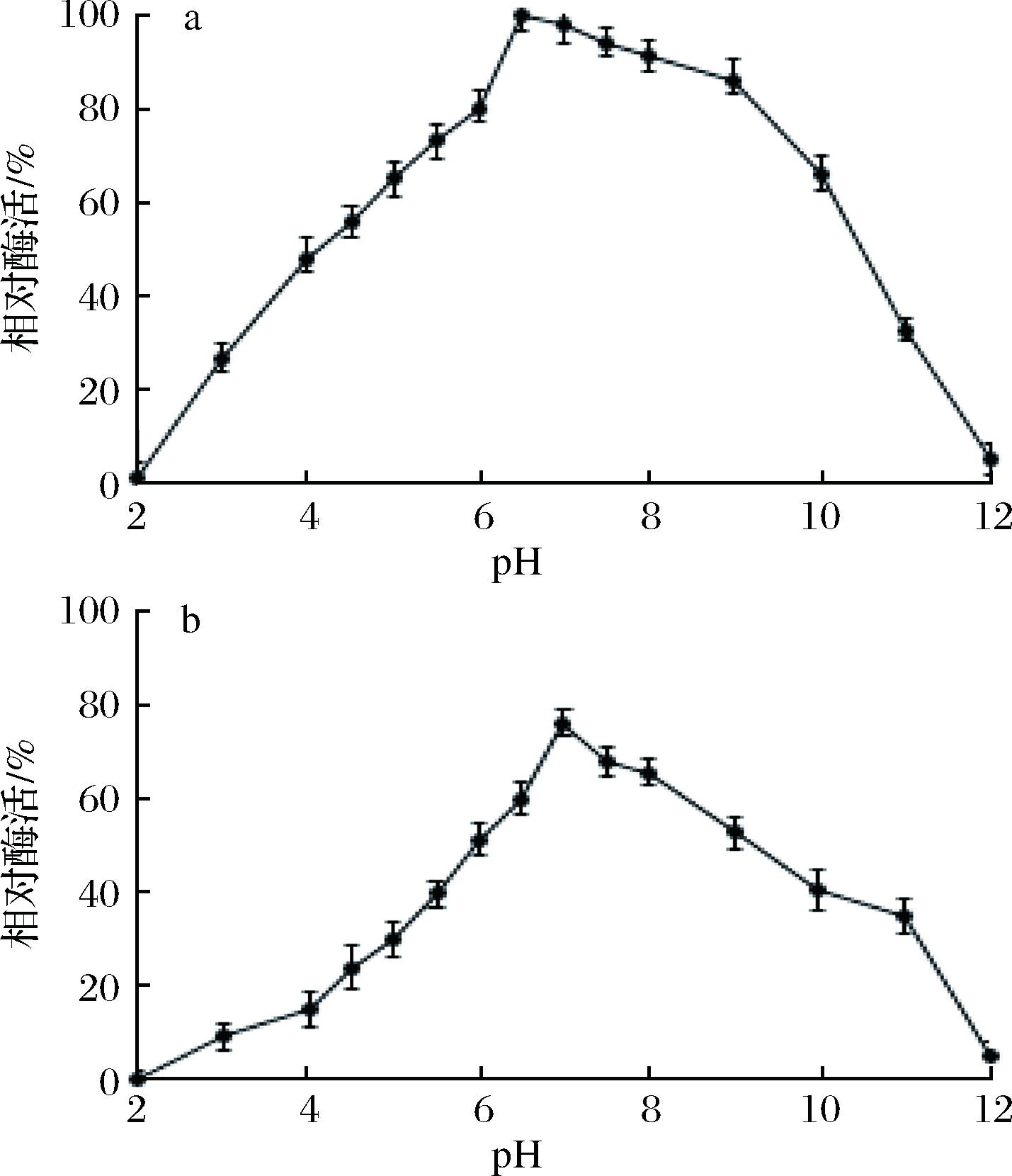
a-最适pH; b-酶的pH稳定性
图6 pH和酶的pH稳定性对重组NiR酶活力的影响
Fig.6 Effect of reaction pH and pH stability of the enzyme on NiR enzymes activity
2.5.2 温度对酶活性的影响
由图7-a可知,重组NiR最适温度为37 ℃,在25~40 ℃时具有85%以上的相对酶活。在pH 6.5条件下,分别在不同温度下孵育重组NiR,结果表明,该酶在4~40 ℃的温度稳定性较好,相对酶活保持在65%以上(图7-b),具有广泛的温度适应性。
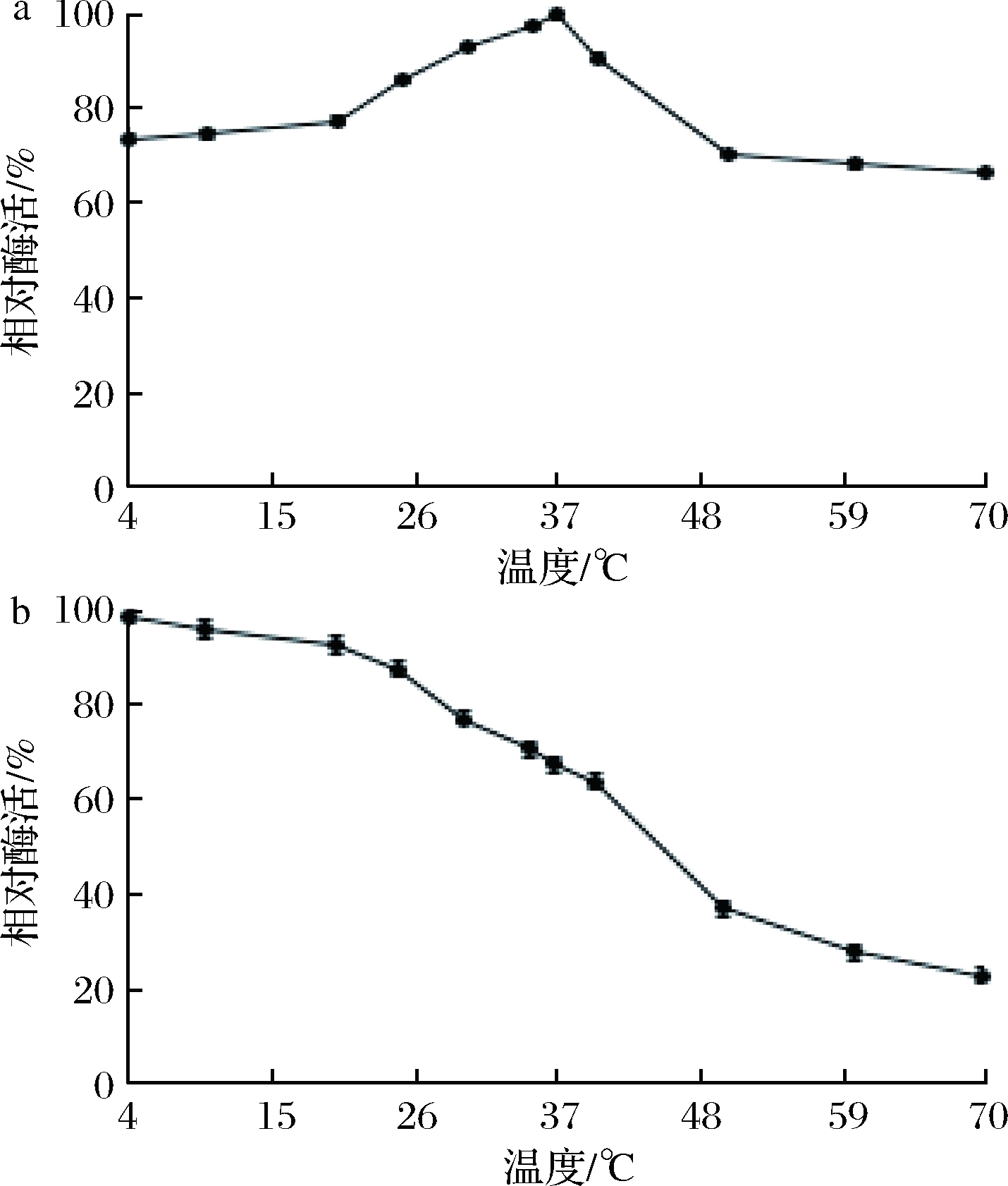
a-最适温度;b-酶的热稳定性
图7 温度和酶的热稳定性对重组NiR酶活力的影响
Fig.7 Temperature and thermal stability of the enzyme on NiR enzymes activity
2.5.3 金属离子及EDTA对酶活性的影响
Fe3+、Cu2+和Na+对重组NiR有促进作用,其中Na+促进作用明显; Mg2+、Mn2+和Zn2+对该酶的酶活力有轻微抑制作用,该酶的酶活力被Al3+、EDTA和苯甲基磺酰氧(phenylmethanesulfonyl fluoride, PMSF)强烈抑制(表2)。
在标准方法和条件下,在pH 6.5和37 ℃下研究NiR动力学参数Km和Kcat。Km和Kcat的值分别为0.38 mmol/L和0.27×103 s-1(图8)。NiR的催化效率可以用kcat/Km计算,计算值为1.4×106 mmol/(L·s)。
表2 金属离子及EDTA对酶活性的影响
Table 2 Effects of various reagents on the activity of NiR
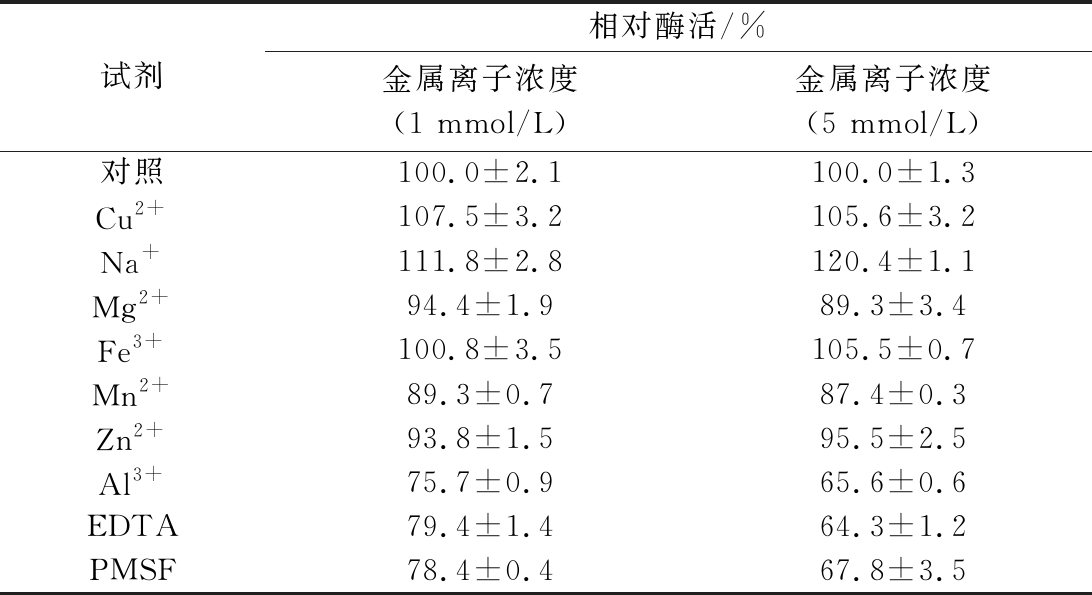
试剂相对酶活/%金属离子浓度(1 mmol/L)金属离子浓度(5 mmol/L)对照100.0±2.1100.0±1.3Cu2+107.5±3.2105.6±3.2Na+111.8±2.8120.4±1.1Mg2+94.4±1.989.3±3.4Fe3+100.8±3.5105.5±0.7Mn2+89.3±0.787.4±0.3Zn2+93.8±1.595.5±2.5Al3+75.7±0.965.6±0.6EDTA79.4±1.464.3±1.2PMSF78.4±0.467.8±3.5
注:数值为平均值±SD。
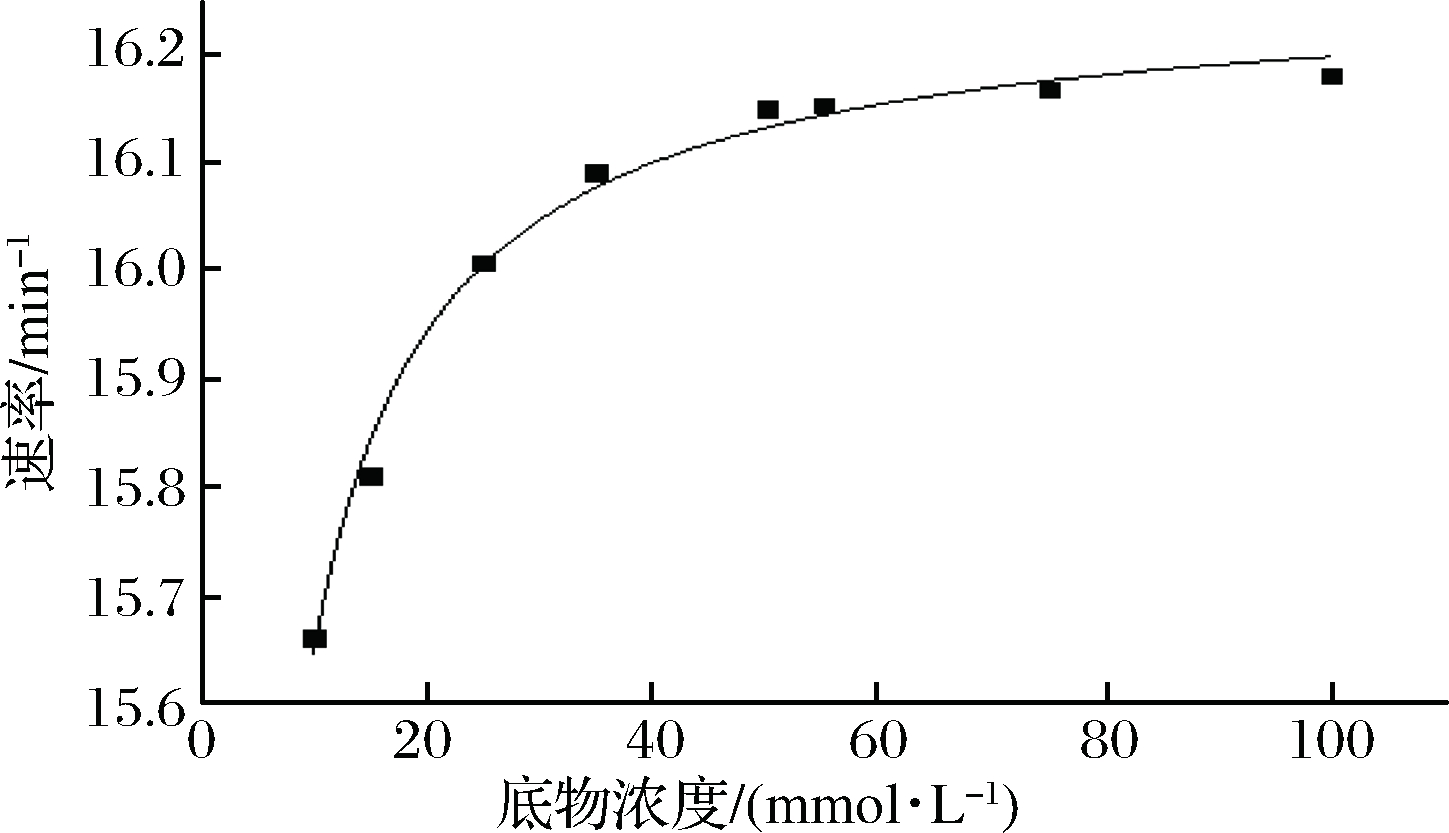
图8 在pH 6.5和37 ℃下NiR降解NaNO2的动力学
Fig.8 Kinetics of NiR degradation of nitrite at pH 6.5 and 37 ℃
亚硝酸盐还原酶大多数为胞内酶,受分离纯化技术的影响,该酶的应用受到了极大限制[17]。E.coli表达系统具有成本低、繁殖快、表达量高、遗传背景研究深入清楚以及有大量可利用的表达载体、宿主和纯化系统等优点,成为目前应用最广的表达体系[18-19]。但由于宿主蛋白的异源表达可能缺乏某些蛋白质折叠所需的辅助因子或调节蛋白折叠机制及环境不适等,使次级键在折叠过程中较难正确形成,易形成失去原有蛋白质特性和功能的包涵体[20-21]。本研究采用超声波冰浴破壁法裂解细菌,细胞破壁效果较好,用洗涤液洗涤包涵体,经变性液溶解变性,再经复性液复性,最后用镍亲和层析法得到了浓度和纯度较高的目的蛋白。
本实验中我们选择了带有NcoI酶切位点的表达载体pET-28a,该表达载体多克隆位点C端有一个能编码6个组氨酸的融合标签His-Tag,6×His通常不影响表达产物的生物学活性,因而不必通过酶水解获得目的蛋白,使表达的整个过程更为简单,同时该融合标签可用于目的蛋白的检测和纯化。在融合标签His-Tag后还相连一个终止密码子TGA,它保证了目的蛋白和His-Tag的完整表达[22-24]。截至目前,文献报道亚硝酸盐还原酶主要集中于甜菜、小麦、菠菜等植物中[17, 25],而微生物亚硝酸盐还原酶报道较少[26]。本研究成功将亚硝酸盐还原酶基因连接至原核表达载体pET-28a上,然后将重组载体pET-28a-nir转化到表达宿主E.coli BL21中,利用IPTG进行诱导表达后经SDS-PAGE检测显示为不可溶的包涵体表达,随后进行包涵体复性及镍柱亲和层析纯化蛋白,并研究了重组NiR的性质。结果表明,该酶具有广泛的温度适应性和稳定性,为NiR的应用及工业化生产奠定基础。
[1] 丁少南.植物乳杆菌中亚硝酸还原酶的研究[D].上海:上海师范大学, 2013.
[2] LINTULUOTO M, LINTULUOTO J M. DFT study on nitrite reduction mechanism in copper-containing nitrite reductase[J].Biochemistry,2016,55(1):210-223.
[3] EZZINE M, GHORBEL M H. Physiological and biochemical responses resulting from nitrite accumulation in tomato(Lycopersicon esculentum Mill.cv.Ibiza F1) [J].Journal of Plant Physiology,2006,163(10):1 032-1 039.
[4] SOLOMON E I. Spectroscopic methods in bioinorganic chemistry:Blue to green to red copper sites[J].Inorganic Chemistry,2006,42(20): 8 012-8 025.
[5] ADMAN E T,GODDEN J W, TURLEY S. The structure of copper-nitrite reductase fromAchromobacter cycloclastes at five pH values,with![]() bound and with type Ⅱ copper depleted[J]. J Biol Chem,1995,270(46):27 458-27 474.
bound and with type Ⅱ copper depleted[J]. J Biol Chem,1995,270(46):27 458-27 474.
[6] TOCHEVA E I, ROSELL F I, MAUK A G, et al. Side-on copper-nitrosyl coordination by nitrite reductase [J].Science,2004,304(5 672):867-870.
[7] TIKHONOVA T V, SLUTSKY A, ANTIPOV A N, et al.Molecular and catalytic properties of a novel cytochrome c nitrite reductase from nitrate-reducing haloalkaliphilic sulfur-oxidizing bacteriumThioalkalivibrio nitratireducens[J].Biochim Biophys Acta,2006,1 764(4):715-723.
[8] HORRELL S, KEKILLI D, STRANGE R W, et al.Recent structural insights into the function of copper nitrite reductases[J].Metallomics,2017,9(11):1 470-1 482.
[9] ZERBINO D R, BIRNEY E. Algorithms for de novo short read assembly using de Bruijn graphs[J].Genome Res,2008,18(5):821-829.
[10] AZIZ R K, BARTELS D, BEST A A, et al. The RAST Server: Rapid annotations using subsystems technology[J].BMC Genomics,2008,9(1):75.
[11] 赵东岳,林莉莉,温福利.结核分枝杆菌Rv3194c蛋白的表达、纯化及活性鉴定[J].微生物学报,2016,56(12):1 847-1 855.
[12] 赵云,朱蓓霖,汪正华,等.麦芽四糖淀粉酶基因优化表达及酶学性质分析[J].中国生物工程杂志,2013,33(5):100-106.
[13] 蔡婀娜,贺淹才,刘治江,等.重组产几丁质酶C工程菌包涵体的复性[J].河南师范大学学报(自然科学版),2011,39(1):137-141.
[14] 李美玉,曹洪玉,张庆芳,等.几丁质结合蛋白基因克隆、表达与纯化[J].中国酿造,2015,34(11):41-46.
[15] GAO H, LI C, RAMESH B, et al.Cloning,purification and characterization of novel Cu-containing nitrite reductase from theBacillus firmus GY-49[J].World J Microbiol Biotechnol, 2017,34(1):10.
[16] 陈思敏,罗彤晖,费永涛,等.蜡样芽孢杆菌Bacillus cereus LJ01中亚硝酸盐还原酶的基因克隆、表达和纯化[J].食品科学,2018,39(6):69-74.
[17] TREUSCH A H, LEININGER S, KLETZIN A, et al.Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling[J].Environ Microbiol,2005,7(12):1 985-1 995.
[18] TERPE K. Overview of bacterial expression systems for heterologous protein production:from molecular and biochemical fundamentals to commercial systems[J].Appl Microbiol Biot,2006,72(2):211-222.
[19] 黄佳明,姜宁,张爱忠.基因工程菌生产抗菌肽的研究进展[J].微生物学通报,2019,46(3): 654-659.
[20] 罗惠霞,李敏王,玉炯.包涵体蛋白复性的几种方法[J].生物技术通报,2007(5):96-98.
[21] 何庆,刘帅,周海霞.人胱抑素C大肠杆菌表达载体构建及包涵体复性研究[J].惠州学院学报,2018, 6: 29-31;38.
[22] 袁志刚, 张进平,储以微,等. 原核表达系统T7 RNA聚合酶/启动子在真核细胞中表达目的基因的实验研究[J]. 生物工程学报,2005,21(2):182-186.
[23] YANG Y Q,WANG H,LIANG M L,et al. Construction and expression of prokaryotic expression vectors fused with genes ofMagnaporthe oryzae effector proteins and mCherry[J].Genetics and Molecular Research,2015,14(3):10 827-10 836.
[24] 季爱加,宁喜斌.原核表达载体pET28a-EGFP的构建与表达[J].微生物学杂志,2011,34(1):69-73.
[25] 李爽.水稻土厌氧硝酸盐还原耦合亚铁氧化与砷氧化机制[D].广州:中国科学院大学,2018.
[26] NAKANO S,TAKAHASHI M,SAKAMOTO A,et al.The reductive reaction mechanism of tobacco nitrite reductase derived from a combination of crystal structures and ultraviolet-visible microspectroscopy[J]. Proteins,2012,80(8):2 035-2 045.