枯草芽孢杆菌SX3411产羊毛硫细菌素subtilomycin的 初步鉴定与理化特性分析
李晓然1,叶德晓1,付鸣佳1*,钟雪晴1,肖世平2,杨志海1
1(江西师范大学 生命科学学院,江西 南昌,330022) 2(江西天佳生物工程股份有限公司,江西 南昌,330200)
摘 要为了确定分离得到的枯草芽孢杆菌SX3411(Bacillus subtilis SX3411)具有产羊毛硫细菌素subtilomycin的能力和subtilomycin的理化特性。利用滤纸片扩散法检测到菌株SX3411发酵液对猪链球菌(Streptococcus suis)、枯草芽孢杆菌(非本筛选菌株)、金黄色葡萄球菌(Staphylococcus aureus)和嗜水性单胞杆菌(Aeromonas hydrophila)具有抑菌作用。通过基因簇克隆和测序,表明其中抑菌物质主要为羊毛硫细菌素subtilomycin。理化特性分析表明菌株SX3411发酵液中抑菌物质具耐热和耐酸碱特性。SDS-PAGE检测表明subtilomycin分子质量在4 kDa左右。模拟胃液对subtilomycin抑菌活性影响不大,但不耐蛋白酶K和模拟肠液的处理。该研究为进一步开发应用羊毛硫细菌素subtilomycin奠定了基础。
关键词枯草芽孢杆菌;羊毛硫细菌素;subtilomycin;理化特性
枯草芽孢杆菌(Bacillus subtilis)是自然界中存在较为丰富的一个类群,并适应了自然界的各种环境变化[1]。枯草芽孢杆菌已经形成了许多的适应环境的机制,如外源DNA的摄取、生物膜形成和芽孢形成[2-4]。因此,枯草芽孢杆菌可从许多场所和严酷的环境中分离得到[5-6]。有证据表明,枯草芽孢杆菌可活跃地生长在土壤、植物根系和各种有机体的胃肠道中。特别是对几种无脊椎动物和脊椎动物(包括人类)肠道中枯草芽孢杆菌研究表明,它可以作为动物自然生命周期的一部分在胃肠道定居[5,7-11]。
枯草芽孢杆菌中可以产生多种抗菌物质,具有较好的开发利用价值[12-14]。在枯草芽孢杆菌中产生的翻译后修饰的抗菌物质包括脂肽(lipopeptide)、糖肽(glycopeptide)和羊毛硫细菌素(lantibiotic)等[15-17]。其中枯草芽孢杆菌中可以合成多种羊毛硫细菌素(lantibiotics),羊毛硫细菌素也可称为含羊毛硫氨酸的抗生素(lanthionine-containing antibiotics)[18]。羊毛硫细菌素是在核糖体上合成,并在翻译后修饰的抗菌肽[19-21]。从枯草芽孢杆菌中已经发现多种羊毛硫细菌素,但这些羊毛硫细菌素均来源于不同的菌株。其中枯草菌素(subtilin)就来源于菌株Bacillus subtilis ATCC 6633,可形成4个甲基羊毛硫氨酸[22]。羊毛硫细菌素Ericin S和Ericin A产生菌均为B.subtilis A1/3菌株,但Ericin S的结构与枯草素的结构非常相似[23]。Entianin来自B.subtilis subsp. spizizenii DSM 15029T[24]。目前的研究中,已经采用更多的先进手段来进行羊毛硫细菌素的发掘[25]。
羊毛硫细菌素subtilomycin最初报道来源于B.subtilis strain MMA7,该菌株分离自海绵Haliclona simulans中[26],后在B.subtilis BSn5菌株中也发现有subtilomycin[27]。对B.subtilis strain MMA7中subtilomycin基因簇进行分析表明,其基因簇主要的subtilomycin合成基因包括subA(subtilomycin结构基因)、subB(羊毛硫氨酸脱水酶(lanthionine dehydratase)基因)、subC(羊毛硫氨酸合成酶(lanthionine synthetase)基因)和subP(丝氨酸蛋白酶(serine protease)基因);subT为ABC转运蛋白[26]。而通过对B.subtilis BSn5菌株中subtilomycin基因簇测序分析表明,其基因簇与B.subtilis strain MMA7中subtilomycin基因簇基本相同,但确定了一个穿膜蛋白(transmembrane protein)ApnI对subtilomycin功能是必须的[27]。我们在前期的研究中也分离到1株产subtilomycin的枯草芽孢杆菌菌株,并进行了相关的理化特性和分离纯化研究。
1 材料与方法
1.1 材料和试剂
从江西省南昌市分离获得枯草芽孢杆菌SX3411菌株(B.subtilis SX3411),保藏于中国普通微生物菌种保藏管理中心,菌种保藏号CGMCC NO.14396。其他指示菌株包括革兰氏阳性菌:猪链球菌(Streptococcus suis)、枯草芽孢杆菌(非本筛选菌株)和金黄色葡萄球菌(Staphylococcus aureus);革兰氏阴性菌:嗜水性单胞杆菌(Aeromonas hydrophila)、沙门氏杆菌(Salmonella enterica subsp.)和大肠杆菌(Escherichia coli.),均保存于本实验室。
革兰氏染色液试剂盒、芽孢染色液试剂盒,北京索莱宝科技有限公司;2×Taq PCR Master Mix,天根生化(北京)科技有限公司;E.Z.N.A. TM Bacterial DNA Kit,OMEGA BIO-TEK;SDS-PAGE凝胶配制试剂盒,博士德生物工程有限公司;胰蛋白酶、胃蛋白酶,上海蓝季生物有限公司;蛋白酶K,MERCK公司;其他生化试剂为生工生物工程股份有限公司产品,化学试剂为天津市永大化学试剂开发中心产品,均为分析纯。
1.2 培养基
LB培养基为基础培养基(g/L):蛋白胨10.0,酵母提取物5.0, NaCl 5.0,pH 7.2, 加水定容1 L, 121 ℃灭菌20 min,固体培养基每1 L加15.0 g琼脂粉。
模拟胃消化液(stimulated gastric fluid, SGF):取稀HCl(HCl 234 mL,加水稀释至1 000 mL制得)16.4 ml, 加水约800 mL与胃蛋白酶10 g,摇匀后,加水稀释成1 000 mL[28]。
模拟肠消化液(stimulated intestinal fluid, SIF):取KH2PO4 6.8 g,加水500 mL使溶解,用0.1 mol/L NaOH溶液调节pH值至6.8;另取胰酶10 g,加水适量使溶解,将两液混合后,加水稀释至1 000 mL[28]。
1.3 仪器与设备
D-37520 Osterode型台式高速离心机,美国Thermo公司;PTC-200型PCR仪,美国MJ-Research公司;ZHWY-103B型、ZHWY-2102型恒温培养振荡器,上海智城分析仪器制造有限公司;HT-1300-U超净工作台,苏净集团安泰公司;FE20型pH计,梅特勒-托利多仪器(上海)有限公司;ALO-210.2型电子天平,北京赛多利斯仪器系统有限公司。
1.4 方法
1.4.1 SX3411菌株的分离
从猪场污泥中得到的菌种样品,经过高温处理后,接种到LB固体培养基中,置于37 ℃恒温培养箱中培养过夜。观察菌落形态,挑取芽孢杆菌形态的单克隆菌落,进行后续鉴定。
1.4.2 滤纸片法测定抑菌活性
每个培养皿倾入20~30 mL LB固体培养基,凝固后,超净台上吹干冷凝水;涂布100 μL指示菌悬液, 37 ℃培养10 min。2层滤纸片(直径8 mm)轻轻黏在制备好的抑菌平板上,轻轻按压一下。取25 μL SX3411菌株的发酵液缓慢滴到滤纸片上,按照顺时针方向进行实验。加完样品后,放在4 ℃冰箱4 h以上使发酵液在琼脂糖平板上充分扩散,然后放置在37 ℃恒温培养箱培养12 h左右,定时查看抑菌圈出现的情况,做好记录和测量抑菌圈直径。新鲜LB液体培养基作为阴性对照。
1.4.3 菌体形态鉴定
将活化好的枯草芽孢杆菌SX3411划线接种至固体平板培养基中,37 ℃恒温培养24 h,按照试剂盒说明书进行革兰氏染色、芽孢染色、荚膜染色。使用光学显微镜观察菌体细胞个体形态。
1.4.4 生理生化鉴定
SX3411菌株的生理生化鉴定参照《伯杰氏菌种鉴定手册》进行试验[29]。
1.4.5 16S rDNA序列鉴定
E.Z.N.A. TM Bacterial DNA Kit试剂盒抽提SX3411菌株基因组DNA(方法见试剂盒说明书)。用南京金斯瑞生物科技有限公司合成的上下游通用引物27F和1 492R(27F: AGAGTTTGATCCTGGCTCAG; 1492R: GGTTACCTTGTTACGACTT)对枯草芽孢杆菌基因组DNA进行PCR扩增。
1.4.6 枯草芽孢杆菌菌株SX3411中subtilomycin基因簇的分子生物学鉴定
根据NCBI上给出的枯草芽孢杆菌B.subtilis strain MMA7中subtilomycin基因簇(GenBank序列号:JX912247.1)中的结构基因SubA、脱水酶基因SubB与环化酶基因SubC和丝氨酸蛋白酶基因SubP的DNA序列[26],使用Primer 5.0和Oligo 6.0软件分别设计SubA、SubB、SubC、SubP基因的引物(表1);引物送至南京金斯瑞生物科技有限责任公司合成。根据不同的鉴定DNA序列长短,进行相应的PCR扩增,PCR扩增后得到的DNA送南京金斯瑞生物科技公司测序。
1.4.7 菌株SX3411发酵产物的抗菌谱
分别取菌株SX3411在37 ℃培养了24 h的发酵液,10 000 r/min离心15 min,弃菌体取上清液,即得到抗菌物质粗提液。分别用指示菌悬液涂布平板,按滤纸片法测定抑菌活性,测定SX3411的发酵液对不同指示菌的抑菌活性。
表1 检测subtilomycin基因簇的PCR引物
Table 1 Primers used for PCR detection of subtilomycin cluster

扩增片段引物序列(5'端→3'端)片段长度/bpsubAS1ATGGAGAAGAATAATATTS2TTAGTTACAGTTACTGCA171subPPPTGACTACAAATATGAATAPDTAACAATCCTTTGATAAA975subBBPATGAATACAAAATATTTABD1GTTAGGGATTAAAACATT3 111subCCPATGCAGAAATGCAAGAATCD1ACTTATCAGAAATATCTT1 323subP-subBPPATGAATATGACTACTACAAATBD1GTTAGGGATTAAAACATT4 086subB-subCBPATGAATACAAAATATTTACD1ACTTATCAGAAATATCTT4 458subP-subB-subCPPTGACTACAAATATGAATACD1ACTTATCAGAAATATCTT5 433
1.4.8 菌株SX3411生长曲线与抑菌活性的关系
接种新鲜的SX3411菌株,37 ℃摇床200 r/min振荡培养,每隔2 h取1次发酵液在紫外分光光度计上测OD600值,记录结果。同时将所取的发酵液10 000 r/min 离心15 min,取上清液用于抑菌活性检测。以金黄色葡萄球菌为指示菌,滤纸片法检测各时间取样的抑菌效果。
1.4.9 菌株SX3411发酵所产抑菌物质热稳定性
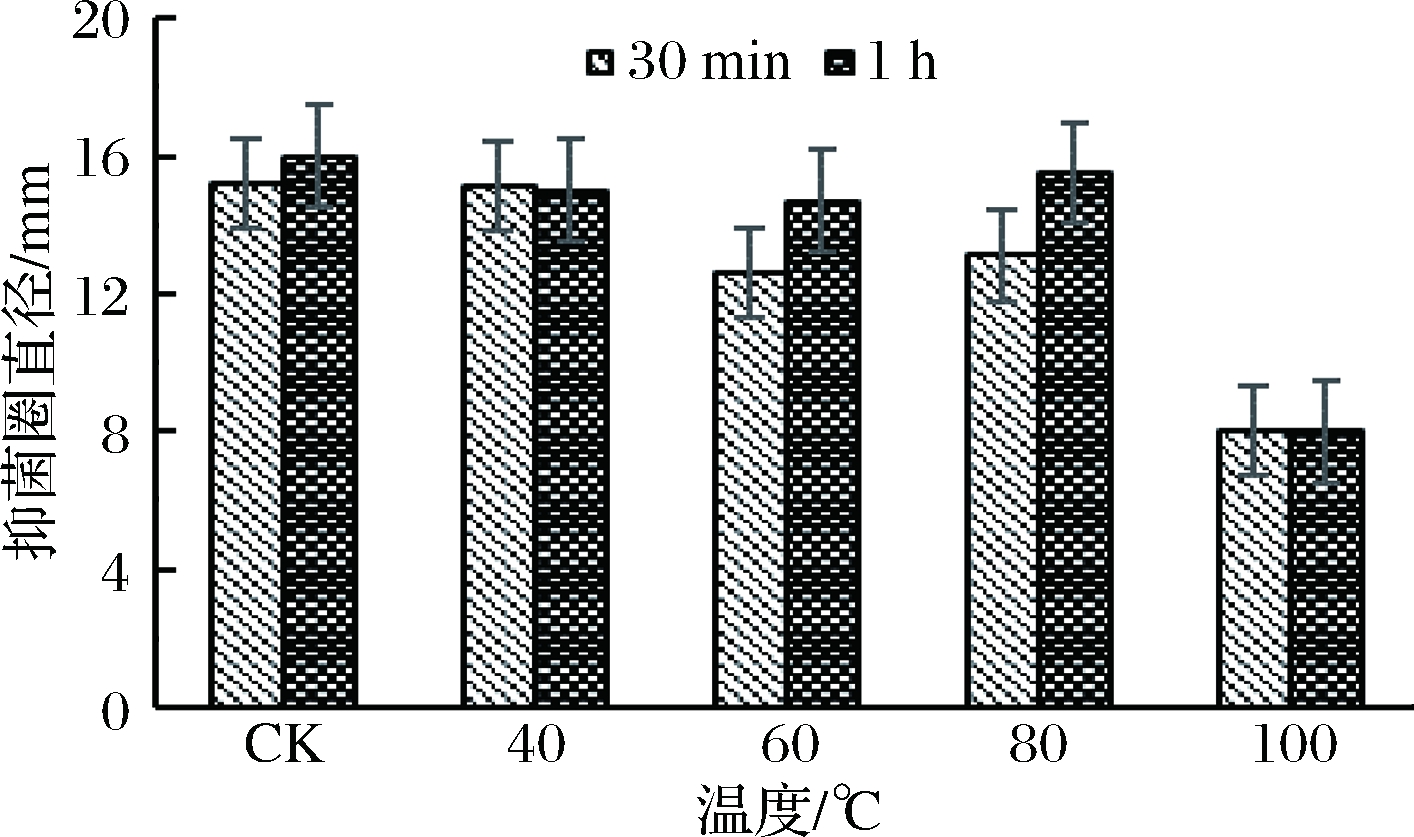
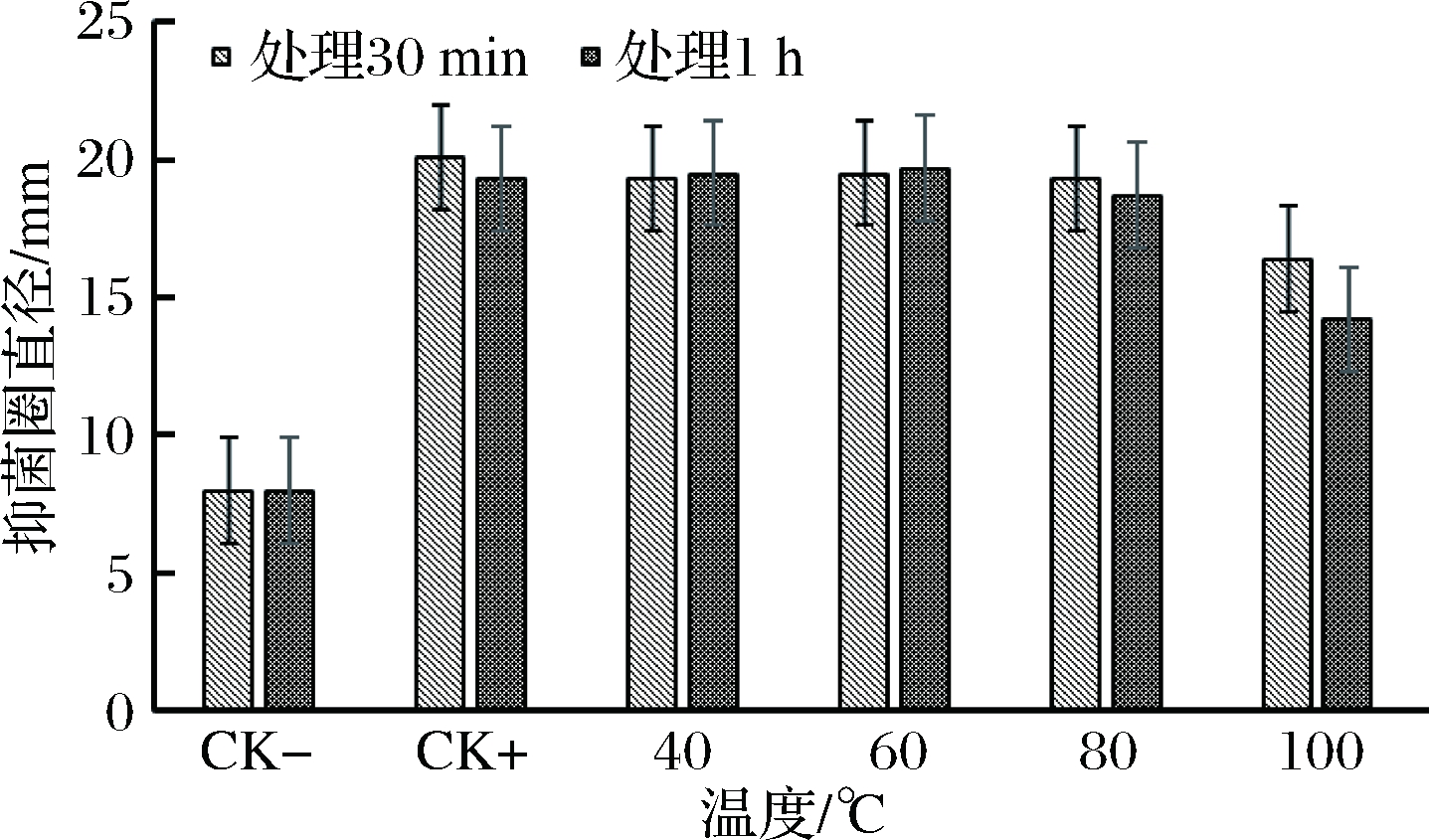
取37 ℃发酵培养24 h的SX3411菌株发酵液,分别在40、60、80和100 ℃下水浴处理30 min和1 h,以未处理的发酵液为阳性对照,灭菌新鲜的LB液体培养基为阴性对照,以金黄色葡萄球菌为指示菌株,检测不同温度对SX3411菌株发酵液抑菌活性的影响。
1.4.10 菌株SX3411发酵所产抑菌物质酸碱稳定性
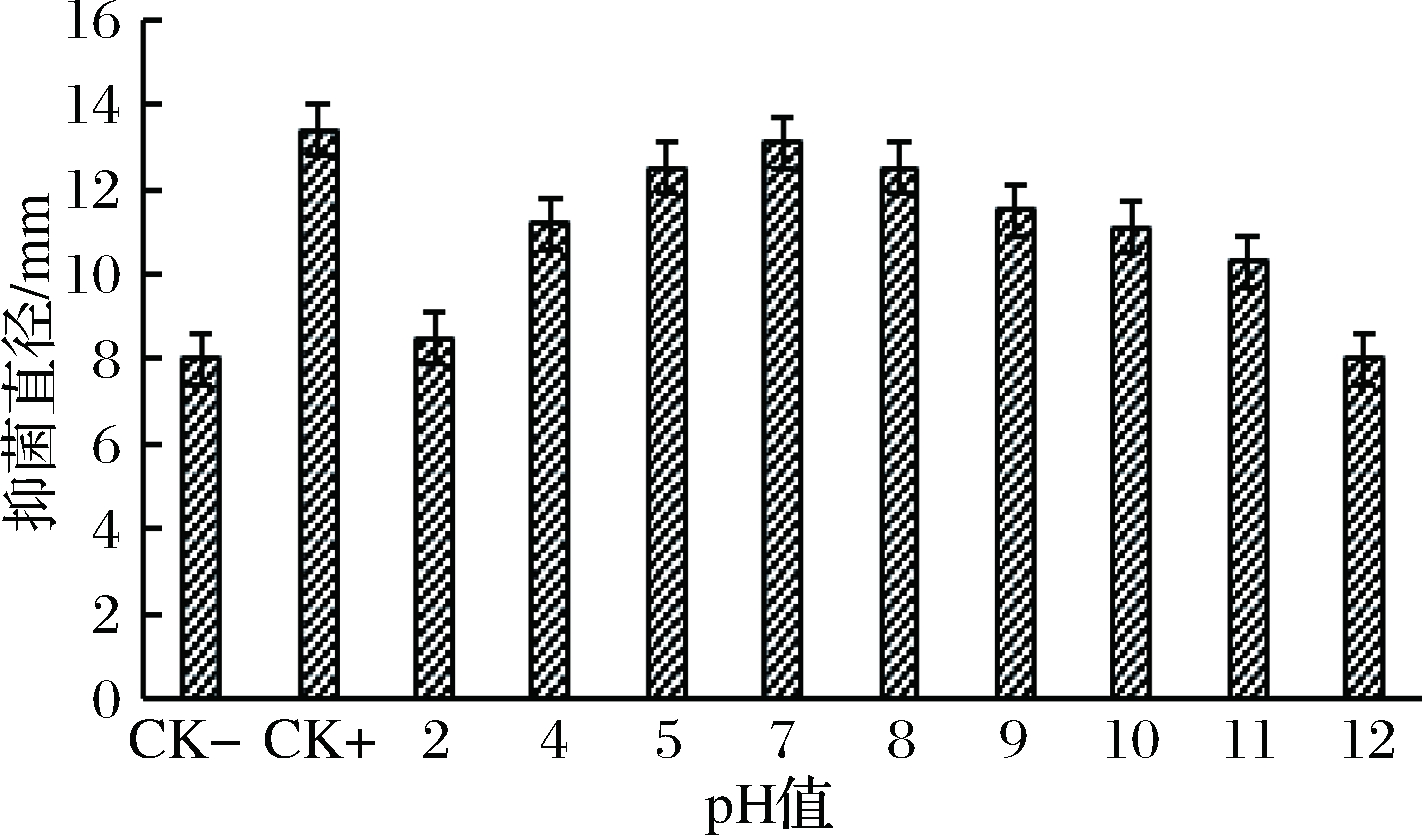
取37 ℃发酵培养24 h的SX3411菌株发酵液,分别用0.1 mol/L HCl溶液和0.1 mol/L NaOH溶液调节pH值至2、4、5、7、8、9、10和11,以不做处理的菌株发酵液作阳性对照,新鲜LB液体培养基为阴性对照,室温下处理1 h。以金黄色葡萄球菌为指示菌株,检测不同pH处理下发酵液的抑菌活性。
1.4.11 超滤法粗提subtilomycin及其抑菌活性
将枯草芽孢杆菌SX3411在37 ℃发酵培养24 h,其发酵液10 000 r/min离心15 min,弃菌体取上清液。取500 μL菌株SX3411发酵液于3 kDa超滤管中(美国Millipore公司产品),10 000 r/min离心10 min,收集管中的滤过液进行抑菌活性检测。超滤管内截留液继续加入50 mmo1/L PBS(pH 7.4)缓冲液,10 000 r/min 离心10 min,重复该步骤3次。随后将超滤得到截留液进行抑菌活性检测。同时采用15% SDS-PAGE电泳(凝胶配制见试剂盒说明书,电泳方法略)检测超滤得到的截留液。
1.4.12 硫酸铵沉淀初步纯化菌株SX3411发酵液中subtilomycin
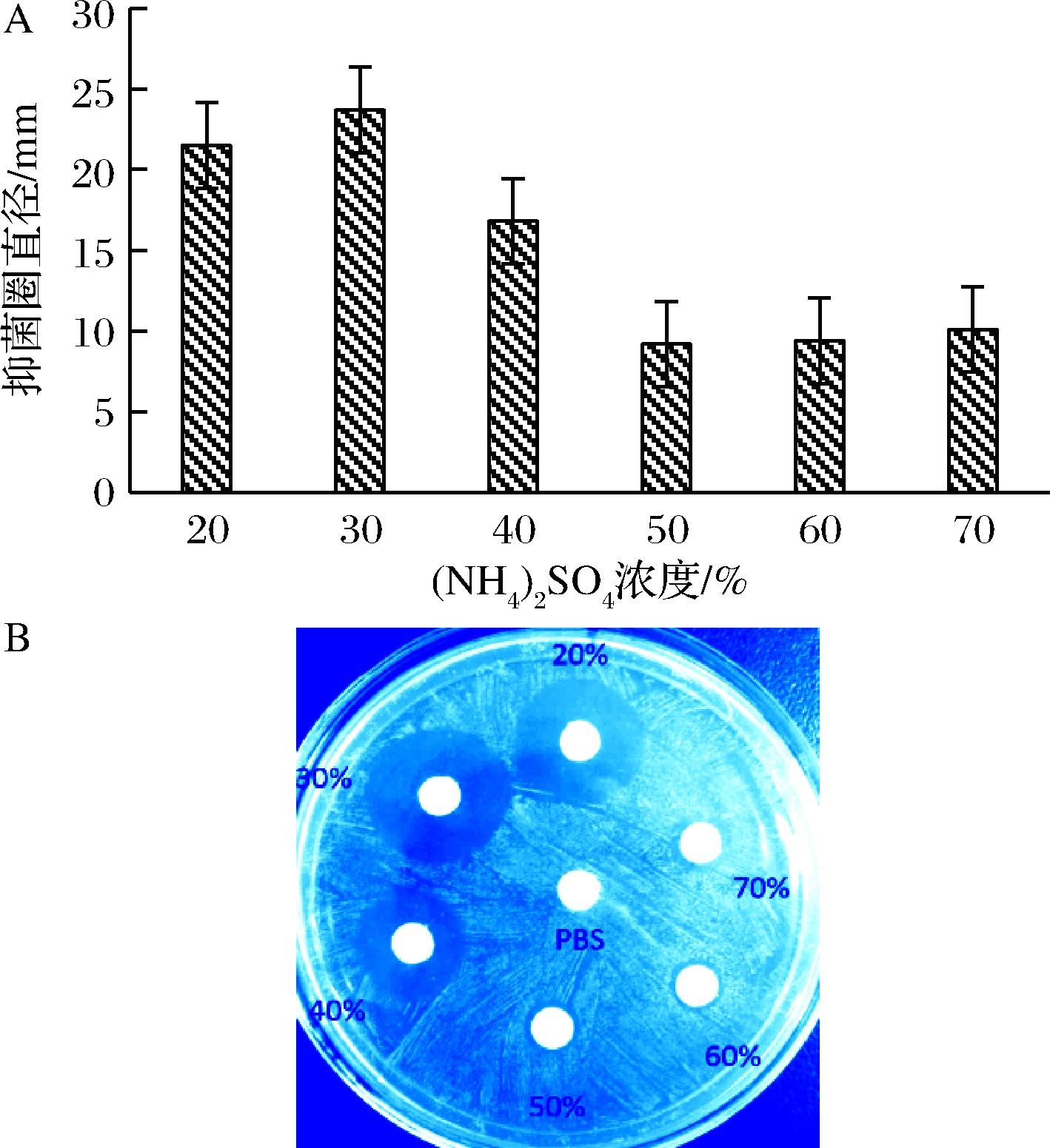
将枯草芽孢杆菌SX3411在37 ℃发酵培养24 h的发酵液10 000 r/min离心20 min取上清液。其中加(NH4)2SO4分别至20%、30%、40%、50%、60%和70%饱和度,置4 ℃下过夜。高速冷冻离心机在10 000 r/min, 4 ℃下离心20 min。每40 mL发酵液所得沉淀用2 mL浓度为50 mmo1/L PBS(pH 7.4)缓冲液悬浮。以金黄色葡萄球菌为指示菌,检测不同饱和度(NH4)2SO4沉淀所得初步纯化subtilomycin的抑菌活性。
1.4.13 初步纯化subtilomycin的温度稳定性
用30%硫酸铵饱和度初步纯化的subtilomycin,分别在40、60、80和100 ℃下各处理30 min和1 h,以未处理的初步纯化subtilomycin作阳性对照,灭菌的PBS为阴性对照,以金黄色葡萄球菌为指示菌株,检测不同温度处理对subtilomycin抑菌活性的影响。
1.4.14 初步纯化subtilomycin对蛋白酶K、模拟胃液和模拟肠液的稳定性
初步纯化的subtilomycin分别用0.5 g/L蛋白酶K、模拟胃液、模拟肠液消化处理,分别处理15和30 min。 用模拟胃液和模拟肠液为阴性对照,以金黄色葡萄球菌为指示菌株,检测不同蛋白酶处理下初步纯化subtilomycin的抑菌活性。
2 结果与分析
2.1 抑菌菌株的筛选
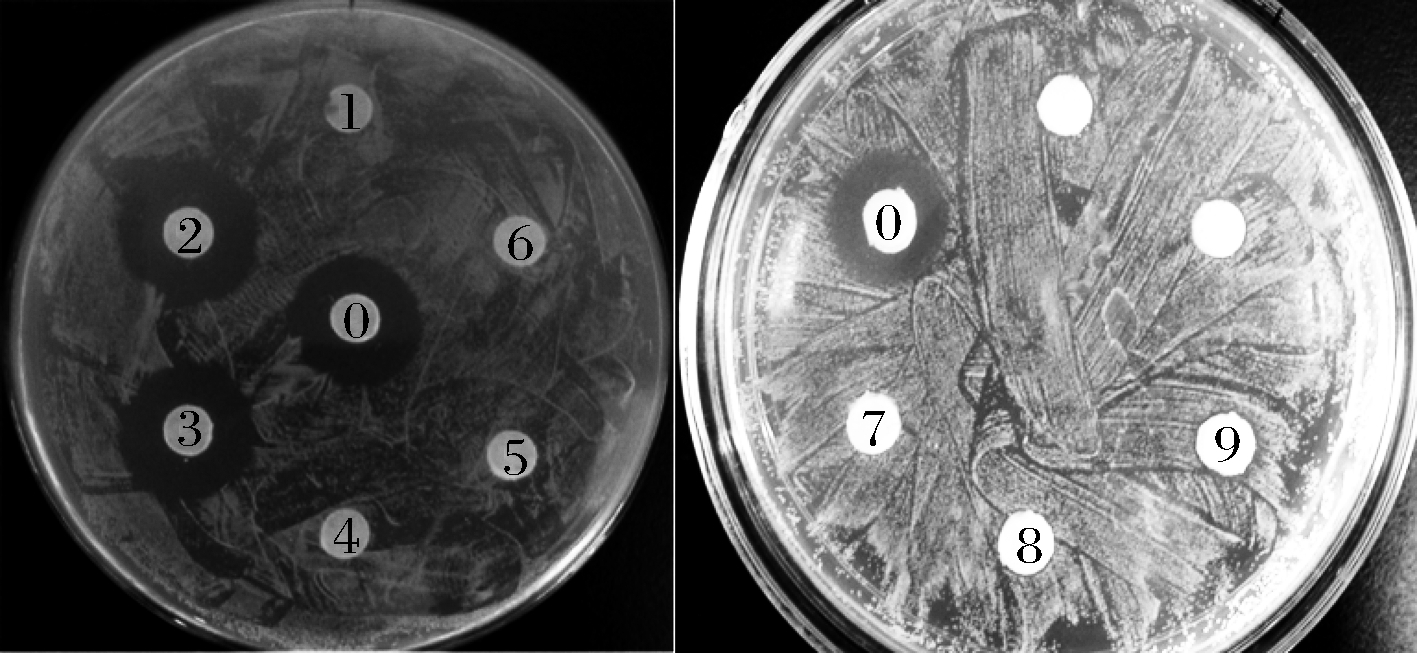
从取得的样品中获得芽孢杆菌菌落形态特征的菌株,用滤纸片扩散法检测获得的发酵液,从中筛选得到具有明显抑菌圈的菌株。经筛选比较,挑选1株抑菌效果较好的菌株(图1),命名为SX3411菌株。
2.2 菌株SX3411的形态
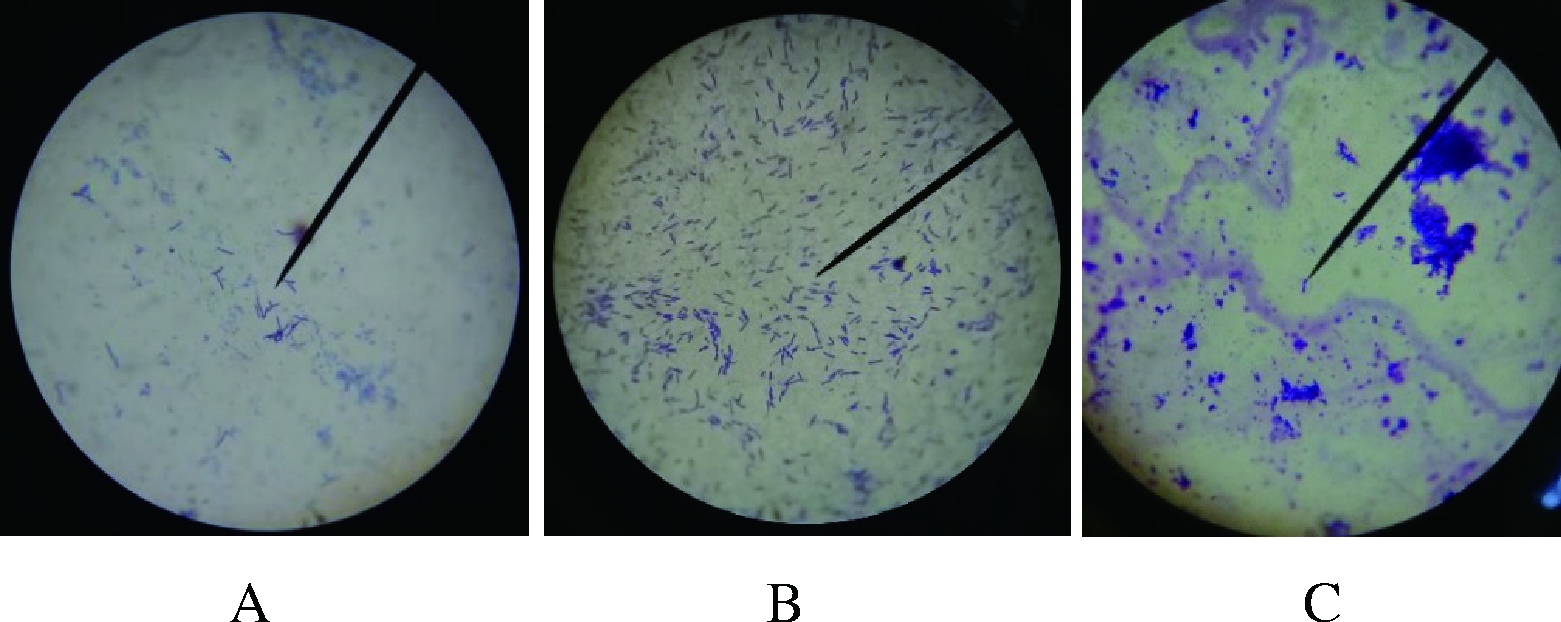
用活化好的SX3411菌种使用接种环划线接种于LB固体培养基,培养1~2 d后观察菌落形态呈现芽孢杆菌特征形态。菌体进行革兰氏染色、芽孢染色和荚膜染色,1 000×油镜下观察,菌株SX3411菌体革兰氏染色为阳性反应,菌体呈杆状(图2-A)。芽孢染色(图2-B)和荚膜染色(图2-C)均呈阳性。
2.3 菌株鉴定
2.3.1 生理生化鉴定
菌株SX3411在5 ℃下基本不生长,20 ℃下生长较缓慢,30~50 ℃下菌株生长良好,50 ℃下生长8 h即可看到菌落产生,表明为耐高温生长菌株。不同酸碱度检测表明,该菌株在pH 6~9时菌株生长较好;最适生长pH值在6~9。在NaCl质量分数为2%~5%的培养基中生长较好;丙二酸利用实验结果显示阴性;柠檬酸盐利用实验呈阳性;接触酶实验表现阳性;蔗糖发酵实验可产酸,呈阳性;葡萄糖氧化发酵实验表明菌株SX3411发酵产酸但不产气;淀粉水解实验呈阳性;MR反应呈阴性;V-P反应阳性;SX3411菌株穿刺接种,可导致明胶液化;菌株SX3411不能利用乙醇,乙醇氧化呈阴性;菌株可以利用乙酸产生碳酸,在平板中生成CaCO3,乙酸氧化呈阳性。根据《伯杰氏菌株鉴定手册》可以初步确定菌株SX3411为枯草芽孢杆菌[29]。
2.3.2 菌株SX3411的16S rDNA序列鉴定
提取菌株SX3411基因组DNA,以细菌特异的16S rDNA引物进行PCR扩增,可得到大小为1 500 bp左右DNA(图3-A),测序后得到GenBank序列号为KY848340.1。通过NCBI数据库中已知菌株的16S rDNA序列进行比对分析,构建系统发育进化树(图3-B),菌株SX3411与枯草芽孢杆菌(B.subtilis)具有较高的同源性,达到99%,可以确定菌株SX3411为枯草芽孢杆菌。
2.4 菌株SX3411中subtilomycin基因簇的分子生物学鉴定
根据subtilomycin基因簇(GenBank序列号JX912247.1)的相关基因序列设计引物,分别以枯草芽孢杆菌SX3411中的基因组DNA为模版进行PCR扩增。结果获得了subA(图4-A)、subB(图4-B)、subC(图4-C)、subP(图4-C)、subP-subB(图4-D)、subP-subB-subC(图4-E)和subB-subC(图4-E)的PCR扩增产物。扩增产物分别送DNA测序公司测序,测序结果在NCBI上进行比对,其序列与subtilomycin基因簇序列完全相同[26]。由此表明,在枯草芽孢杆菌SX3411中存在可以合成subtilomycin的基因簇。
2.5 菌株SX3411发酵产物的抗菌谱
SX3411菌株的发酵液对革兰氏阳性菌具有强抑菌活性,其中对金黄色葡萄球菌和猪链球菌的抑菌效果最明显,对枯草芽孢杆菌(非筛选菌株)也具有抑菌作用,但对于SX3411菌株本身不具有抑菌效果,这可能跟SX3411菌株本身会产生免疫蛋白有关。在检测的革兰氏阴性细菌中,只对嗜水气单胞杆菌有抑菌活性,对大肠杆菌和沙门氏菌无抑菌活性(表2)。
表2 枯草芽孢杆菌SX3411发酵液对供试菌种的抑制作用
Table 2 Antimicrobial spectrum of bacteriostatic substances produced byB.subtilis SX3411

菌种类型供试菌种 抑菌圈直径/mm抑菌圈清晰度革兰氏阳性菌枯草芽孢杆菌(B. subtilis)13.5±0.2++金黄色葡萄球菌(S. aureus)16.0±0.3+++猪链球菌(S. suis)16.5±0.3+++革兰氏阴性菌嗜水气单胞杆菌(A. hydrophi-la)14.5±0.2++沙门氏杆菌(S. enterica subsp)--大肠杆菌(E. coli)--
注:“+++”,抑菌圈完全透明;“++”,抑菌圈清晰;“+”,抑菌圈可见;“-”,无抑菌圈。
2.6 菌株SX3411发酵产物的生长曲线与抑菌物质的分泌关系
将培养好枯草芽孢杆菌SX3411的种子液(OD600约为1),按2%的接种量接种至发酵培养基,每隔2 h测定菌液OD600值,以未接种的发酵培养基为空白对照,检测SX3411菌株的生长情况(图5-A)。结果表明,0~2 h为生长停滞期,菌体数量较少,2~20 h为对数期,菌体生长迅速,呈指数增长,20~34 h为稳定期,菌体数量比较稳定,34 h后为衰退期,菌体因为营养条件和代谢物的影响,活性开始衰减(图5-A)。根据菌株的生长曲线可以掌握枯草芽孢杆菌SX3411的生长代谢规律,从而调控其生长条件,为后续的实验奠定基础。
枯草芽孢杆菌SX3411的发酵液具有抑菌作用,发酵产物分为初级代谢产物和次级代谢产物,发酵时间对枯草芽孢杆菌SX3411抑菌物质的分泌具有关联(图5-B)。抑菌物质随着菌株的生长而分泌,并随着发酵时间而慢慢积累,到8 h达到一定的抑菌效果,在20~38 h抑菌活性比较稳定,40 h后其抗菌活性出现了下降(图5-B)。可以推测枯草芽孢杆菌SX3411所产的抑菌物质,尤其是subtilomycin尽管是翻译后的修饰,但也是枯草芽孢杆菌SX3411的初级代谢产物,抑菌物质的产生与其生长相关。
2.7 菌株SX3411抑菌物质的热稳定性
菌株SX3411发酵液的抑菌活性随着温度的升高而降低,且在100 ℃时,发酵液失去抑菌活性;发酵液在40~60 ℃处理下对金黄色葡萄球菌的抑菌圈直径在12~15 mm,与未处理的原始发酵液相差不大,此期间的发酵液抑菌活性相对稳定;发酵液在80 ℃处理下,仍然具有抑菌活性(图6)。由此可知,SX3411菌株发酵液中抑菌物质具有较好的热稳定性。这与确认的发酵液中主要的抑菌物质为羊毛硫细菌素subtilomycin有关,因subtilomycin是热稳定的环肽类物质。
2.8 菌株SX3411发酵产物的酸碱稳定性
菌株SX3411发酵液抑菌活性成分在pH 5~9比较稳定,发酵液在pH 5~9处理后对金黄色葡萄球菌的抑菌圈直径均在12.0~13.0 mm,与未处理的发酵液相差不大;且此菌株发酵液在pH值为2和11处理下,对金黄色葡萄球菌仍有抑制作用,而pH值为12时,活性降低或失去抑菌活性(图7)。由此可见,SX3411菌株发酵液的抑菌活性在中性及弱碱性条件下较稳定,对酸的耐受性高于对强碱的耐受性。
2.9 超滤法粗提subtilomycin及其抑菌活性
与发酵液相比较(图8-Aa),使用3 kDa超滤管进行超滤后,截留液保存了较好的抑菌活性,可以看到明显的抑菌圈(图8-Ab),而滤过液基本没有抑菌活性,无抑菌圈产生(图8-Ac)。由此表明,枯草芽孢杆菌SX3411发酵液的抑菌活性主要体现在多肽类物质上,小分子物质基本没有抑菌活性。截留液经过SDS-PAGE电泳以后,可以看到在4 kDa左右有条带(图8-B2),初步认为是subtilomycin。发酵液原液(图8-B1)和滤过液(图8-B3)经过SDS-PAGE电泳未见明显条带。综合分析,在枯草芽孢杆菌SX3411的发酵液中,抗菌物质主要是subtilomycin。因此,在后续研究中可以以抑菌能力的大小来判断枯草芽孢杆菌SX3411的发酵液中产subtilomycin的量。
2.10 硫酸铵沉淀初步纯化菌株SX3411发酵液中的subtilomycin
枯草芽孢杆菌SX3411经过(NH4)2SO4沉淀后,其中20%、30%和40%(NH4)2SO4沉淀物有较好的抑菌效果,以30%的沉淀物抑菌效果最好,而50%、60%和70%的硫酸铵沉淀物抑菌效果不好(图9-A和9-B)。这样的结果与所报道的20%(NH4)2SO4沉淀得到subtilomycin接近一致[16]。
对这6个浓度的(NH4)2SO4沉淀物进行SDS-PAGE分析(图10),结果表明,在20%、30%和40%的硫酸铵沉淀中,可以见到4 kDa左右的电泳带,其中以30%的量最多且杂质较少(图10-A)。而在50%、60%和70%的(NH4)2SO4沉淀中可以见到较多的杂电泳带。将20%、30%和40%(NH4)2SO4沉淀进一步超滤以后再进行电泳,结果30%和20%的沉淀物电泳以后仍可见到较好的4 kDa电泳带,且含杂质也较少。由于subtilomycin是由硫醚键形成带有4个环的环肽,且含碱性氨基酸比例较高,为阳离子肽[16],因此电泳条带并不像普通蛋白质电泳带那样规整。
2.11 初步纯化subtilomycin的温度稳定性
将30%(NH4)2SO4沉淀和超滤初步纯化的subtilomycin 分别在不同温度下处理不同时间,以未处理的30%(NH4)2SO4沉淀和超滤初步纯化的subtilomycin作阳性对照,灭菌的PBS溶液作阴性对照,检测抑菌效果的变化(图11)。结果表明,与未处理初步纯化的subtilomycin相比,初步纯化的subtilomycin在40~ 80 ℃处理后抑菌活性改变不大;100 ℃处理30 min, 活性下降较少,处理1 h后,抑菌活性才有一定下降,说明枯草芽孢杆菌SX3411分泌的subtilomycin具有较好的温度耐受性(图11)。
2.12 初步纯化的subtilomycin对蛋白酶K、模拟胃液和肠液稳定性
以未处理的30%(NH4)2SO4沉淀和超滤初步纯化的subtilomycin为阳性对照,蛋白酶K、模拟胃液和模拟肠液为阴性对照,将30%硫酸铵沉淀和超滤初步纯化的subtilomycin样品用蛋白酶K、模拟胃液和模拟肠液分别处理15及30 min,对其检测抑菌活性的变化。实验结果表明,蛋白酶K、模拟肠液处理后的初步纯化的subtilomycin失去抑菌活性;模拟胃液处理15和30 min后的初步纯化的subtilomycin仍然具有抑菌活性,与未处理的初步纯化的subtilomycin相比变化不大(图12)。
3 结论
从江西省南昌市分离获得了1株细菌SX3411,经过形态鉴定、生理生化鉴定和分子生物学鉴定,确定该菌株为枯草芽孢杆菌。根据NCBI中羊毛硫细菌素subtilomycin的基因簇序列(GenBank序列号:JX912247.1)中的结构基因SubA、脱水酶基因SubB与环化酶基因SubC和丝氨酸蛋白酶基因SubP的DNA序列,设计引物对枯草芽孢杆菌SX3411中合成subtilomycin的结构基因和修饰酶基因进行了PCR的扩增和测序分析,结果证明了枯草芽孢杆菌中存在subtilomycin的基因簇,表明该菌株可以合成羊毛硫细菌素subtilomycin。
对枯草芽孢杆菌SX3411发酵液中的抑菌物质进行了生理生化和生物活性方面的研究。枯草芽孢杆菌SX3411发酵液对革兰氏阳性菌金黄色葡萄球菌、猪链球菌和枯草芽孢杆菌具有明显抑菌作用,而对革兰氏阴性菌的抑菌作用相对较弱,检测菌种中对嗜水气单胞杆菌有一定抑菌效果,对其他菌无效果。研究表明,枯草芽孢杆菌SX3411发酵液产抑菌物质与其菌体生长有密切关系,且该类抑菌活性物质具有很好的耐高温和耐酸碱的能力,其中在80 ℃处理仍保持有较好的抑菌活性,在pH 2~11有抑菌活性,在pH 5~9抑菌活性比较稳定。
采用超滤和硫酸铵沉淀的方法对枯草芽孢杆菌SX3411中的subtilomycin进行了初步纯化。在用3 kDa超滤管超滤时,经过SDS-PAGE电泳可以见到数量较多的4 kDa左右的subtilomycin存在。采用硫酸铵分步沉淀的方法,20%、30%和40%饱和度的硫酸铵沉淀可以将subtilomycin沉淀下来,其中以30%硫酸铵沉淀效果较好,获得的subtilomycin也比较纯。30%硫酸铵沉淀和超滤初步纯化的subtilomycin有非常好的抵抗高温的作用,对模拟胃液有较好的抵抗作用,但对蛋白酶K和模拟肠液的抵抗能力较弱。这些结果表明,羊毛硫细菌素subtilomycin比较适合工业化生产,且可以用于调节胃部的有害菌群。枯草芽孢杆菌SX3411也可以做为益生菌进行开发利用。
参考文献
[1] ZHANG Nan, YANG Dongqing, KENDALL J R A, et al. Comparative genomic analysis ofBacillus amyloliquefaciens andBacillus subtilis reveals evolutional traits for adaptation to plant-associated habitats[J]. Frontiers in Microbiology, 2016, 7:2 039.
[2] VLAMAKIS H, CHAI Y, BEAUREGARD P, et al. Sticking together: Building a biofilm theBacillus subtilis way[J]. Nat Rev Microbiol,2013,11(3):157-168.
[3] RAO C V, GLEKAS G D, ORDAL G W. The three adaptation systems ofBacillus subtilis chemotaxis[J]. Trends Microbiol, 2008,16(10):480-487.
[4] CAIRNS L S, HOBLEY L, STANLEY-WALL N R. Biofilm formation byBacillus subtilis: New insights into regulatory strategies and assembly mechanisms[J]. Molecular Microbiology, 2014, 93(4):587-598.
[5] HONG H A, TO E, FAKHRY S, et al. Defining the natural habitat ofBacillus spore-formers[J]. Res Microbiol, 2009, 160(6):375-379.
[6] EARL A M, LOSICK R, KOLTER R. Ecology and genomics ofBacillus subtilis[J]. Trends Microbiol,2008, 16(6):269-275.
[7] CHEN Y, CAO S, CHAI Y, et al. ABacillus subtilis sensor kinase involved in triggering biofilm formation onthe roots of tomato plants[J]. Mol Microbiol,2012, 85(3):418-430.
[8] CHEN Y, YAN F, CHAI Y, et al. Biocontrol of tomato wilt disease byBacillus subtilis isolates from naturalenvironments depends on conserved genes mediating biofilm formation[J]. Environ Microbiol,2013, 15(3):848-864.
[9] BARBOSA T M, SERRA C R, LA-RAGIONE R M, et al. Screening forBacillus isolates in the broiler gastrointestinal tract[J]. Appl Environ Microbiol,2005, 71(2):968-978.
[10] HUYNH H, KHANEJA R, BARNES I, et al.Bacillus subtilis isolated from the human gastrointestinal tract[J]. Res Microbiol, 2009, 160(2):134-143.
[11] FACUNDO A, CARLOS B, SEBASTIAN C, et al. Microbial flora, probiotics,Bacillus subtilis and the search for a long and healthy human longevity[J]. Microbial Cell, 2017, 4(4):133-136.
[12] 赵朋超,王建华,权春善,等. 枯草芽孢杆菌抗菌肽生物合成的研究进展[J]. 中国生物工程杂志, 2010,30(10):108-113.
[13] SUMI C D, YANG B W, YEO I C, et al. Antimicrobial peptides of the genusBacillus: A new era for antibiotics[J]. Can J Microbiol, 2015, 61(2):93-103.
[14] 白杰, 贠建民,祝发明,等. 枯草芽孢杆菌菌株B-3抗菌肽的分离纯化与鉴定[J]. 食品与发酵工业, 2018, 44(8):82-89.
[15] TAREQ F S, LEE M A, LEE H S, et al. Gageotetrins A-C, noncytotoxic antimicrobial linear lipopeptides from a marine bacteriumBacillus subtilis[J]. Org Lett, 2014,16(3):928-931.
[16] GONZALO C V G D, ZHU L, OMAN T J, et al. NMR structure of the S-linked glycopeptide sublancin 168[J]. ACS Chemical Biology, 2014, 9(3):796-801.
[17] ZHAO X, KUIPERS O P. Identification and classification of known and putative antimicrobial compounds produced by a wide variety of Bacillales species[J]. BMC Genomics, 2016, 17(1):882.
[18] SZEKAT C, JACK R W, SKUTLAREK D, et al. Construction of an expression system for site-directed mutagenesis of the lantibiotic mersacidin[J]. Applied and Environmental Microbiology, 2003, 69(7):3 777-3 783.
[19] SCHNELL N, ENTIAN K D, SCHNEIDER U, et al. Prepeptide sequence of epidermin, a ribosomally synthesized antibiotic with four sulphide-rings[J]. Nature, 1988, 333(6 170):276-278.
[20] AMISON P G, BIBB M J, BIERBAUM G, et al. Ribosomally synthesized and post-translationally modified peptide natural products: Overview and recommendations for a universal nomenclature[J]. Natural Product Reports, 2013, 30:108-160.
[21] MATHUR H, FIELD D, REA M C, et al. Fighting biofilms with lantibiotics and other groups of bacteriocins[J]. NPJ Biofilms and Microbiomes, 2018, 4(1):9.
[22] LIU W, HANSEN J N. The antimicrobial effect of a structural variant of subtilin against outgrowingBacillus cereus T spores and vegetative cells occurs by different mechanisms[J]. Appl Environ Microbiol,1993, 59(2):648-651.
[23] STEIN T, BORCHERT S, CONRAD B, et al. Two different lantibiotic-like peptides originate from the ericin gene cluster ofBacillus subtilis A1/3[J]. J Bacteriol, 2002,184(6):1 703-1 711.
[24] FUCHS S W, JASKOLLA T W, BOCHMANN S, et al. Entianin, a novel subtilin-like lantibiotic fromBacillus subtilis subsp. spizizenii DSM 15029T with high antimicrobial activity[J]. Applied and Environmental Microbiology, 2011, 77(5):1 698-1 707.
[25] SANDIFORD S K. Genome database mining for the discovery of novel lantibiotics[J]. Expert Opinion on Drug Discovery, 2017, 12(5):489-495.
[26] PHELAN R W, BARRET M, COTTER P D, et al. Subtilomycin: A new lantibiotic fromBacillus subtilis strain MMA7 isolated from the marine spongeHaliclona simulans[J]. Mar Drugs, 2013, 11(6): 1 878-1 898.
[27] DENG Y, LI C Z, ZHU Y G, et al. ApnI, a transmembrane protein responsible for subtilomycin immunity, unveils a novel model for lantibiotic immunity[J]. Applied and Environmental Microbiology, 2014, 80(20): 6 303-6 315.
[28] 国家药典委员会. 中华人民共和国药典:二部[M]. 北京:北京工业出版社, 2005: 771-792.
[29] R.E.布坎南,N.E.吉本斯,著. 中国科学院微生物所《伯杰细菌鉴定手册》翻译组,译.(第八版)[M]. 北京:科学出版社, 1984: 362-366.
Identification and physicochemical characterization of lantibiotic subtilomycin produced by Bacillus subtilis SX3411
LI Xiaoran1, YE Dexiao1, FU Mingjia1*, ZHONG Xueqing1, XIAO Shiping2, YANG Zhihai1
1 (College of Life Sciences, JiangXi Normal University, Nanchang 330022, China) 2 (Jiangxi Tianjia Bioengineering Co., Ltd, Nanchang 330200, China)
ABSTRACT This study was conducted to identify and characterize the lantibiotic subtilomycin produced byBacillus subtilis SX3411. The fermentation broth was found to have anti-bacterial activities againstStreptococcus suis,B.subtilis (notB.subtilis SX3411),Staphylococcus aureus, andAeromonas hydrophila. By cloning and sequencing the gene cluster, it was preliminarily determined that the main antimicrobial substance was subtilomycin, which had a molecular weight of 4 kDa. Moreover, the subtilomycin was resistant to heat, acid and alkali, while simulated gastric juice had less effect on its anti-bacterial activity. In comparison, the subtilomycin was more sensitive to protease K and simulated intestinal juice treatment. In conclusion, this study lays a foundation for further applications of lantibiotic subtilomycin.
Key words Bacillus subtilis SX3411; lantibiotics; subtilomycin; physicochemical properties
DOI:10.13995/j.cnki.11-1802/ts.020116
第一作者:李晓然(硕士研究生)与叶德晓(硕士)为共同第一作者(付鸣佳教授为通讯作者,E-mail:mingjiafu@126.com)。
基金项目:国家自然科学基金项目(31760601和31260010);江西省重点研发计划(20171BBF60007)
收稿日期:2019-01-29, 改回日期:2019-05-15