人类肠道定植着大量的微生物,其中双歧杆菌属在肠道微生物中扮演着非常重要的角色,比例约占成人粪便细菌的25%,在婴儿粪便中,双歧杆菌属的比例达到了80%[1]。双歧杆菌是人体胃肠道中益生菌群至关重要的组成部分,对调节微生态平衡及治疗人类肠道疾病有极其重要的作用。多项研究表明,双歧杆菌的酶系机制可以刺激体内抗体和细胞因子的产生,把巨噬细胞的β-半乳糖苷酶成功激活,更好地发挥其吞噬作用[2];双歧杆菌还可以产生一类活性因子,这种活性因子对人体具有免疫调节作用[3],或菌体本身就充当着一种非特异性免疫调节因子。另发现,双歧杆菌对缓解肠易激综合征[4-5]、缓解上呼吸道疾病[6]、调节神经系统[7]等均具有较好的效果。随着人的年龄增长,体内双歧杆菌的数目逐年减少,为了充分发挥其益生功能,关于双歧杆菌微生态制剂及其发酵食品的研究已成为焦点问题。
目前国内外的双歧杆菌制品主要有含双歧杆菌酸奶、双歧杆菌固体饮料、复合双歧杆菌固体饮料及双歧杆菌胶囊和片剂(主要国外市场)等。双歧杆菌冻干粉是双歧杆菌制品的主要原料,一直是益生菌工业化生产的热门菌株。但是,目前双歧杆菌的生产效率很低,它是严格厌氧菌,生长培养条件苛刻,对营养的需求也比一般菌更复杂,冻干粉工业化生产的各个阶段均可能对其活性产生影响。
双歧杆菌的工业化生产主要包括发酵液制备、离心收集菌泥、菌泥与冻干保护剂混合均质、真空冷冻干燥等工艺步骤。在双歧杆菌的分批发酵阶段,需用氮气保压保证严格的厌氧环境,待发酵结束,发酵液输送至离心机进行菌体收集。在菌体收集过程中,发酵液开始暴露在氧气环境中,且离心时间往往超过1个甚至几个小时,发酵液的空气暴露有可能对菌体的活性产生影响。在离心过程中,一方面因为离心力自带的机械作用和暴露空气造成部分菌体死亡;另一方面,部分菌体残留在上清液中而损失[8]。如果离心工艺掌握不当,超过了菌体的最大承受能力范围,就会直接导致冻干制剂活菌含量低。且在工业化生产中,菌泥的离心收集是持续进行的,即待离心结束,先得到的菌泥在与冻干保护剂混合前会一直暴露在空气中,这一环节也可能对菌体产生损伤。鉴于此,通过研究发酵液空气暴露、离心力、离心时间、离心温度和菌泥暴露空气时间对双歧杆菌离心损失率和存活率的影响,确定对菌体产生明显损伤的工艺环节对提高双歧杆菌的制备效率具有重要的意义。另外,冻干保护剂的添加虽然有研究表明能够提高菌体在冻干过程的存活率,但在冻干前与菌泥混合均质阶段也会暴露在空气中,在该阶段菌体是否会有损伤尚不清楚,添加一定量的抗氧化剂是否能够相应地降低损伤率有必要研究确认。
本文的目的是通过研究双歧杆菌工业化生产中冻干前的不同工艺阶段对双歧杆菌活性的影响,探究其死亡规律,以便针对性地改善关键工艺环节,提高双歧杆菌的制备效率。
1.1.1 菌株
两歧双歧杆菌CCFM16、青春双歧杆菌CCFM8630、短双歧杆菌CCFM683、长双歧杆菌L6,江南大学食品生物技术中心保藏。
1.1.2 试剂
脱脂乳粉,上海恒天然商贸有限公司;海藻糖,日本林原-山东优索化工科技有限公司;D-异抗坏血酸钠,江西百勤异VC钠有限公司;MRS培养基所需试剂、蔗糖、琼脂等,国药集团化学试剂有限公司。
GRP-9160型隔水式恒温培养箱,上海森信实验仪器有限公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;ZQZY-VS3型振荡培养箱,上海知楚仪器有限公司;TG16-WS型台式高速离心机,上海卢湘仪离心机仪器有限公司;AW500SG型厌氧工作站,英国依莱泰科;UV-2450紫外分光光度计,日本岛津公司。
1.3.1 双歧杆菌种子液的制备
从保菌管内分别吸取100 μL两歧双歧杆菌CCFM16、青春双歧杆菌CCFM8630、短双歧杆菌CCFM683和长双歧杆菌L6,接种到5 mL添加L-半胱氨酸盐酸盐的MRS(MRS-L)液体培养基中,置于37 ℃厌氧工作站进行活化培养36 h,连续活化2次,得各双歧杆菌的活化种子液。
1.3.2 双歧杆菌生长曲线的测定
将两歧双歧杆菌CCFM16、青春双歧杆菌CCFM8630、短双歧杆菌CCFM683和长双歧杆菌L6 4株菌种活化扩培后,分别以2%、4%、2%、2%的接种量接种于MRS-L液体培养基中,37 ℃厌氧培养,从0 h 开始,每隔2 h取样测定菌液在600 nm下的OD值,绘制24 h内生长曲线,比较生长最高活菌数,确定各自最佳收菌时间。若OD600>0.8时,需要进行一定比例的稀释,使紫外分光光度计上的读数在0.2~0.8。 同时取12、14、16、18、20、22 h的样品进行活菌计数,计数方法采用平板菌落计数法。
1.3.3 发酵液空气暴露不同时间双歧杆菌存活率的测定
将各双歧杆菌种子液接入500 mL锥形瓶MRS-L液体培养基(装液量300 mL),各菌株准备6瓶,置于37 ℃厌氧培养至各菌株的稳定期。然后从各菌株的培养液中取出3瓶,置于37 ℃振荡培养箱模拟工业化生产阶段的发酵液空气暴露;另一半样品继续放置在厌氧工作站中。每1 h测定活菌数,按照公式(1)计算双歧杆菌在不同环境、不同时间的存活率。
存活率![]()
(1)
1.3.4 不同离心条件下双歧杆菌存活率的测定
各双歧杆菌培养至稳定期后,分装至50 mL离心管,在不同的离心温度(20和4 ℃)、离心力(4 000、6 000、 8 000×g)条件下离心不同时间(10、30 min)。离心结束后,重新将菌泥与上清液振荡混匀,通过平板菌落计数法测定不同离心条件离心后活菌数。按照公式(2)计算不同离心条件各双歧杆菌的存活率。
存活率![]()
(2)
1.3.5 菌泥室温暴露不同时间双歧杆菌存活率的测定
各双歧杆菌在最适宜的离心条件下离心后,称取1 g湿菌泥立即测定菌泥活菌数,其他菌泥置于9 cm平板,菌泥厚度达到平板边沿高度(约1 cm),置于室温环境,模拟工业化生产离心后的菌泥堆积阶段。每1 h取1 g暴露室温环境的湿菌泥测定活菌数。按照公式(3)计算各双歧杆菌菌泥空气暴露不同时间的存活率。
存活率![]()
(3)
1.3.6 菌泥与保护剂混合后空气暴露不同时间双歧杆菌存活率的测定
配制100 g/L脱脂乳粉、30 g/L蔗糖、30 g/L海藻糖组成的冻干保护剂溶液,105 ℃灭菌10 min后冷却备用。各双歧杆菌最适条件下离心后,将菌泥与冻干保护剂溶液按1∶1(质量体积比)混合,快速混匀后立即测定活菌数,然后置于室温环境,模拟工业化生产菌泥与保护剂混合及铺板阶段,每1 h后取样测定菌悬液的活菌数。按照公式(4)计算菌泥与保护剂混合后空气暴露不同时间双歧杆菌的存活率。
存活率![]()
(4)
1.3.7 抗氧化剂的添加对双歧杆菌活性的影响
按1.3.6配制保护剂,无菌环境下加入10 g/L的D-异抗坏血酸钠(0.22 μm的无菌滤膜过滤除菌)。
按照1.3.6的方法测定菌泥与添加抗氧化剂的冻干保护剂混合后空气暴露3 h后各双歧杆菌的存活率。
1.3.8 数据统计与分析
试验中各项数据的测定均为3次生物学重复的平均值。实验数据平均值与标准差均采用Excel计算并作图。
在双歧杆菌的工业化生产中,发酵终点的判断非常重要。在双歧杆菌生长的不同阶段终止发酵,不仅影响离心收集菌泥中的活菌数,而且影响后续菌体的冻干存活率。众多研究已经表明,生长不同阶段的菌体具有不同的胁迫耐受能力,稳定期的细胞较延滞期和对数期的细胞具有更强的胁迫耐受能力[9]。在乳酸菌的工业化生产时,收集稳定期的菌体将更利于冻干。如,在鼠李糖乳杆菌生长的稳定期收集菌体,干燥存活率明显高于延滞期和对数期早期[10];在稳定期早期收集的酒类酒球菌SD-2a在冻干时,存活率显著高于对数期和中期的菌体[11]。双歧杆菌的生产也应该借鉴乳酸菌的生产规律,在发酵增殖的对数期、末期或稳定期收集菌体[12]。但双歧杆菌较乳杆菌对胁迫环境更加敏感,在菌体增殖至稳定期时若不及时停止发酵,进行收菌,菌体可能会较快死亡。因此,分析双歧杆菌的生长过程,应结合OD值的测定和活菌计数,综合判断最佳收菌时间(图1)。

图1 不同双歧杆菌生长过程的OD值变化
Fig.1 Changes of OD value in the growth process of differentBifidobacteria
从图1的OD值呈现的生长趋势分析,青春双歧杆菌CCFM8630和短双歧杆菌CCFM683生长至18 h时达到稳定期,菌浓度最高,之后几小时基本稳定;且此2株双歧杆菌的生长浓度均高于两歧双歧杆菌CCFM16和长双歧杆菌L6。后者均生长至20 h达到稳定期,且OD值呈现的菌浓度均低于前者,之后发酵液的OD值也基本稳定。但比较图2的活菌计数,发现虽然到达稳定期的时间与图1基本一致,但是活菌数达到最高值之后即开始降低,说明双歧杆菌较敏感,到达稳定期后因环境恶化,活菌细胞即受到影响导致活菌数开始降低。因此,双歧杆菌的收菌时间应严格控制在到达稳定期的时间,延迟收菌时间会导致菌体死亡,活菌率降低。另外,也发现虽然青春双歧杆菌CCFM8630发酵液的OD值比较高,但活菌计数很低。可能与该菌株的荚膜成分、厚度、菌体大小、菌体内容物有关,这些因素可能会影响菌体的抗逆性。
在工业化生产中,双歧杆菌的发酵通过氮气保压创造厌氧环境,确保双歧杆菌的生长。一旦发酵结束,开始进入离心阶段,发酵罐中氮气将被排掉,通过通入空气产生压力运送发酵液至离心设备。该阶段发酵液将与空气接触,且该过程根据发酵罐的大小通常需要1~3 h。在图2中已经发现,发酵液中双歧杆菌到达稳定期后活菌数就开始降低了;而双歧杆菌是严格厌氧菌,与空气的接触是否会进一步加剧菌体损失?
将培养至稳定期的各双歧杆菌分别置于厌氧环境和空气中,模拟工业化生产中发酵液空气暴露阶段对发酵液中双歧杆菌的影响。结果见表1,两歧双歧杆菌CCFM16、短双歧杆菌CCFM683和长双歧杆菌L6的发酵液空气暴露1 h,活菌数明显降低。众所周知,双歧杆菌缺乏将溶解氧转化为水分子的系统,细胞内缺乏超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性(或只有微弱活性)。在氧气存在时,一方面细胞内形成![]() 等活性氧,这些产物的大量积累,对菌体细胞的DNA、多糖、蛋白质、酶和脂质大分子等具有很大的破坏作用,最终导致菌体的死亡[13];另一方面,H2O2对双歧杆菌糖代谢相关的果糖-6-磷酸解酮酶有不可逆的抑制作用,从而抑制双歧杆菌的生长;另外,一些对氧极度敏感的双歧杆菌,只有在非常低的氧化还原电位下才能生长,氧气的存在提高了发酵液的氧化还原电位,抑制菌体,而非H2O2积累导致[14]。
等活性氧,这些产物的大量积累,对菌体细胞的DNA、多糖、蛋白质、酶和脂质大分子等具有很大的破坏作用,最终导致菌体的死亡[13];另一方面,H2O2对双歧杆菌糖代谢相关的果糖-6-磷酸解酮酶有不可逆的抑制作用,从而抑制双歧杆菌的生长;另外,一些对氧极度敏感的双歧杆菌,只有在非常低的氧化还原电位下才能生长,氧气的存在提高了发酵液的氧化还原电位,抑制菌体,而非H2O2积累导致[14]。

A-两歧双歧杆菌CCFM16;B-青春双歧杆菌CCFM8630;C-短双歧杆菌CCFM683;D-长双歧杆菌L6
图2 不同双歧杆菌生长过程的活菌数变化
Fig.2 Changes of viable cells in the growth process of differentBifidobacteria
表1 厌氧和空气暴露环境下发酵液中各双歧杆菌在不同时间的存活率
Table 1 Survival rates ofBifidobacteria in fermentation broth under anaerobic and air exposure conditions at different time
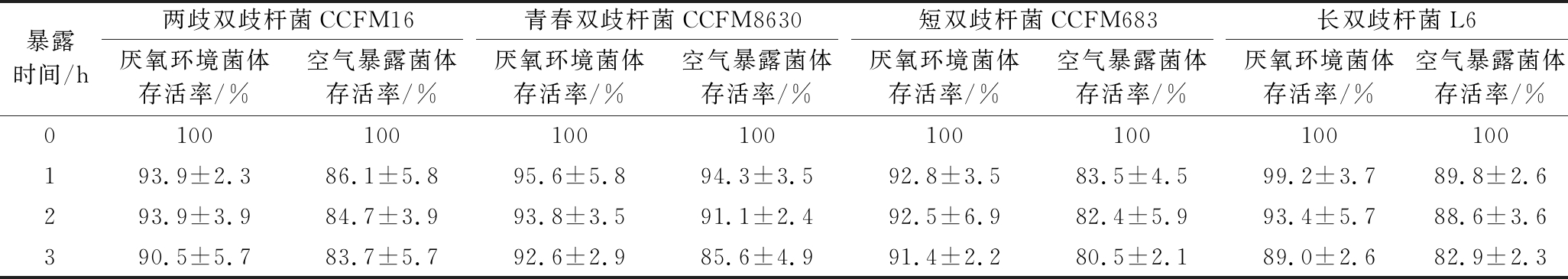
暴露时间/h两歧双歧杆菌CCFM16青春双歧杆菌CCFM8630短双歧杆菌CCFM683长双歧杆菌L6厌氧环境菌体存活率/%空气暴露菌体存活率/%厌氧环境菌体存活率/%空气暴露菌体存活率/%厌氧环境菌体存活率/%空气暴露菌体存活率/%厌氧环境菌体存活率/%空气暴露菌体存活率/%0100100100100100100100100193.9±2.386.1±5.895.6±5.894.3±3.592.8±3.583.5±4.599.2±3.789.8±2.6293.9±3.984.7±3.993.8±3.591.1±2.492.5±6.982.4±5.993.4±5.788.6±3.6390.5±5.783.7±5.792.6±2.985.6±4.991.4±2.280.5±2.189.0±2.682.9±2.3
从表1中可以看出,除青春双歧杆菌CCFM8630外,其他3株双歧杆菌在发酵液有溶氧存在时,活性均受到显著影响。虽然青春双歧杆菌CCFM8630表现出较好的耐氧能力,但发酵液空气暴露3 h后活性依然受到了影响。因此,为提高双歧杆菌工业化生产的得率,应尽可能避免发酵液与空气暴露,且减少暴露时间。
菌体收集是益生菌工业化生产的关键步骤,虽然膜滤浓缩、离心等均被研究用于菌体的收集,但是离心依然是现代工业菌体收集的主要方式。众所周知,离心会对细菌的细胞膜和胞内结构(包括DNA)产生影响,从而对菌体活性产生损伤[15]。由表2可知,离心对两歧双歧杆菌CCFM16、短双歧杆菌CCFM683和长双歧杆菌L6均产生了较严重的影响,但青春双歧杆菌CCFM8630具有较强的离心耐受能力。
表2 不同离心温度、离心时间和离心力条件下各双歧杆菌的存活率
Table 2 Survival rates ofBifidobacteria under different centrifugal temperature, centrifugal time and centrifugal force
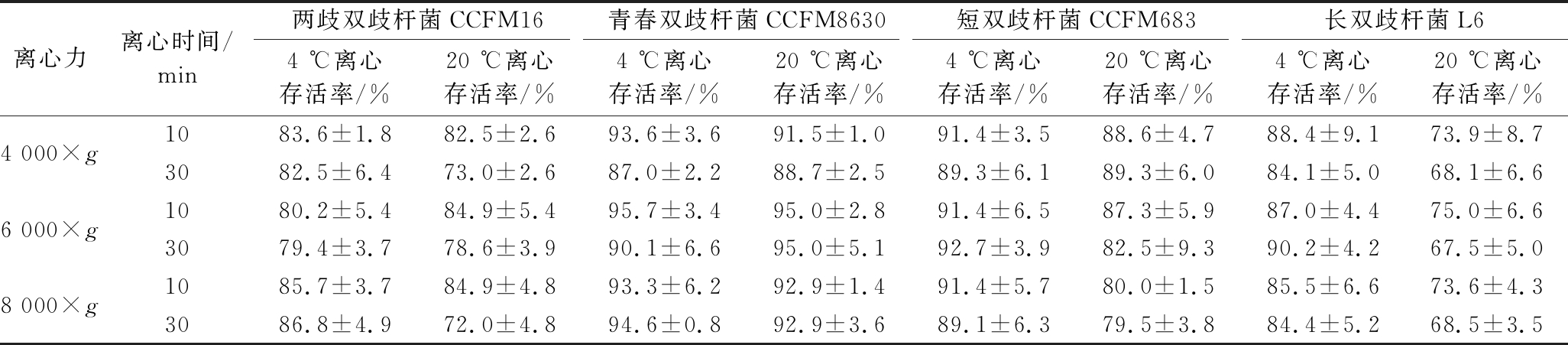
离心力离心时间/min两歧双歧杆菌CCFM16青春双歧杆菌CCFM8630短双歧杆菌CCFM683长双歧杆菌L64 ℃离心存活率/%20 ℃离心存活率/%4 ℃离心存活率/%20 ℃离心存活率/%4 ℃离心存活率/%20 ℃离心存活率/%4 ℃离心存活率/%20 ℃离心存活率/%4 000×g1083.6±1.882.5±2.693.6±3.691.5±1.091.4±3.588.6±4.788.4±9.173.9±8.73082.5±6.473.0±2.687.0±2.288.7±2.589.3±6.189.3±6.084.1±5.068.1±6.66 000×g1080.2±5.484.9±5.495.7±3.495.0±2.891.4±6.587.3±5.987.0±4.475.0±6.63079.4±3.778.6±3.990.1±6.695.0±5.192.7±3.982.5±9.390.2±4.267.5±5.08 000×g1085.7±3.784.9±4.893.3±6.292.9±1.491.4±5.780.0±1.585.5±6.673.6±4.33086.8±4.972.0±4.894.6±0.892.9±3.689.1±6.379.5±3.884.4±5.268.5±3.5
20 ℃条件下离心,双歧杆菌的存活率显著低于4 ℃ 条件离心;且离心时间30 min的菌体存活率显著低于10 min离心的菌体;而不同离心力之间存活率差异不显著。离心温度和离心时间是影响菌体活性的关键因素,而离心力不是关键因素。离心强度在一定范围内对菌体的损伤是固定的,延长离心时间,离心温度升高,会加重细胞皱缩、坍陷、胞外物质离散、细胞壁和细胞膜破坏等现象,导致菌体活性严重降低[16]。因此,为减少双歧杆菌在生产过程中的损失,应尽可能采用低温离心,且缩短离心时间。
发酵液全部离心结束,根据处理量的多少,通常需要1~3 h。在开始离心收集的菌泥,暂时移至乳化装置储备,待发酵液全部离心结束后添加保护剂进行均质乳化。在添加保护剂前菌泥会暴露在室温环境中1~3 h,以最适宜的条件离心收集菌体后,将菌泥暴露在室温环境中,模拟上述工业化生产情况,测定菌泥暴露不同时间,双歧杆菌的存活率。通过表3发现,菌泥在室温环境暴露于空气中活性显著降低。且暴露时间越长,双歧杆菌活性损失越大。两歧双歧杆菌CCFM16、青春双歧杆菌CCFM8630、短双歧杆菌CCFM683和长双歧杆菌L6的菌泥室温暴露空气1 h, 存活率分别降至(84±2.0)%、(94±2.2)%、(85±2.3)%和(93±2.3)%。菌泥暴露3 h后,4株菌的存活率显著降低,分别降至(55±3.3)%、(80±6.0)%、(72±1.6)%和(90±5.7)%。菌体在室温环境下,酶代谢虽然降低,但依然具有较高的活性。菌泥堆积缺乏营养物质,且代谢产物已在胞内积累,加速了菌体衰亡。空气中氧的渗入,进一步对菌体细胞产生毒害。长双歧杆菌L6损失较低,可能与其产生更多的胞外多糖有关,胞外多糖具有抗氧化、耐干燥、黏附等作用,可能增强该菌的抗逆性[17]。综上,低温和缩短菌体暴露时间是减少双歧杆菌生产过程活性损失的关键。
表3 室温暴露环境下各双歧杆菌菌泥在不同时间的存活率
Table 3 Survival rates ofBifidobacteriaof bacterial mud at different time in air exposure environment
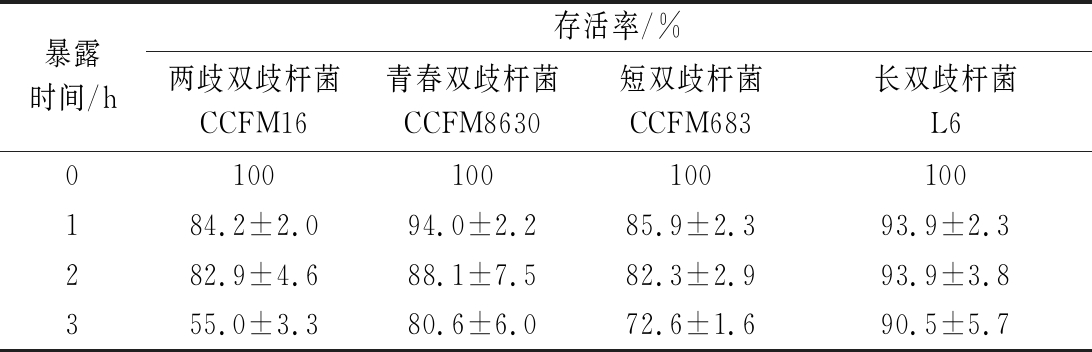
暴露时间/h存活率/%两歧双歧杆菌CCFM16青春双歧杆菌CCFM8630短双歧杆菌CCFM683长双歧杆菌L60100100100100184.2±2.094.0±2.285.9±2.393.9±2.3282.9±4.688.1±7.582.3±2.993.9±3.8355.0±3.380.6±6.072.6±1.690.5±5.7
收集菌泥结束后,菌泥与冻干保护剂在乳化罐内完成均质乳化,之后通过管路输送至冻干机房,在室温环境下完成人工或自动铺板。在菌悬液预冻成冰之前,菌体可能会利用保护剂中的碳水化合物产酸[18],均质过程中的溶氧与会增加菌体的损伤。表4结果表明,均质乳化后2 h内,菌体活性损失不显著。但3 h后,两歧双歧杆菌CCFM16和短双歧杆菌CCFM683的活性出现显著降低。青春双歧杆菌CCFM8630表现出较强的抗逆性,在发酵液空气暴露、离心、菌泥空气暴露、菌与保护剂悬液空气暴露环境下活性损失均比其他双歧杆菌低。说明了不同的双歧杆菌的抗逆性不同,面对不同阶段的加工胁迫活性保持呈现出差异。长双歧杆菌L6在离心得到菌泥后的加工阶段,表现出较强的抗逆性,表明该菌株产生的较大量的多糖具有一定的抗氧化作用,对该菌株的活性具有一定的保护作用。
尽管不同菌株的菌泥在与保护剂混合后,菌体活性损失有差异,但是3 h后均有降低。为了确保各菌株在预冻前活性损失降至最低,应尽可能提高菌泥在与保护剂混合后长时间活性的维持。
表4 空气暴露环境下各双歧杆菌菌泥混合冻干 保护剂后在不同时间的存活率
Table 4 Survival rates ofBifidobacteria in suspensions of bacteria mixed with lyoprotectant at different time in air exposure environment
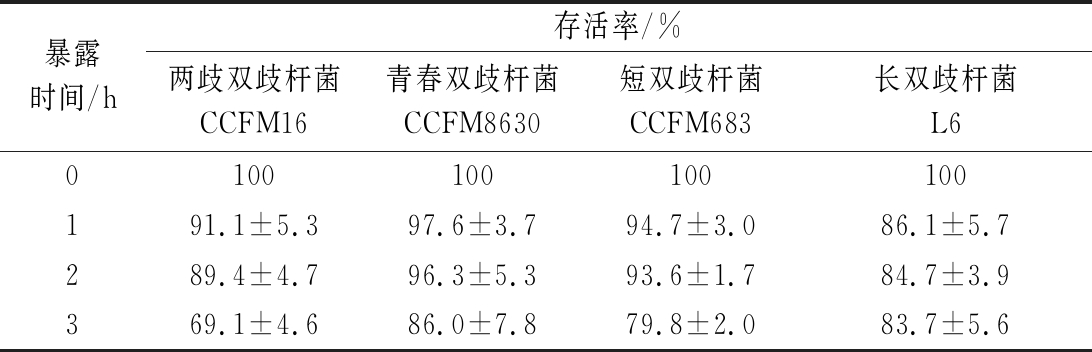
暴露时间/h存活率/%两歧双歧杆菌CCFM16青春双歧杆菌CCFM8630短双歧杆菌CCFM683长双歧杆菌L60100100100100191.1±5.397.6±3.794.7±3.086.1±5.7289.4±4.796.3±5.393.6±1.784.7±3.9369.1±4.686.0±7.879.8±2.083.7±5.6
保护剂溶液添加抗氧化剂后,显著提高了3 h后菌体的活性,均达到了85%以上(图3)。说明菌体与保护剂混合后,菌体活性的损失主要是氧化损伤,通过添加抗氧化剂可以很大程度地减少菌体损失[19]。另有研究表明,保护剂添加抗氧化剂可以提高乳酸菌的冻干存活率,甚至提高冻干菌粉的稳定性。综上,适宜地在冻干保护剂中添加适量冻干保护剂,可减少双歧杆菌的加工损失,提高双歧杆菌的生产效率。
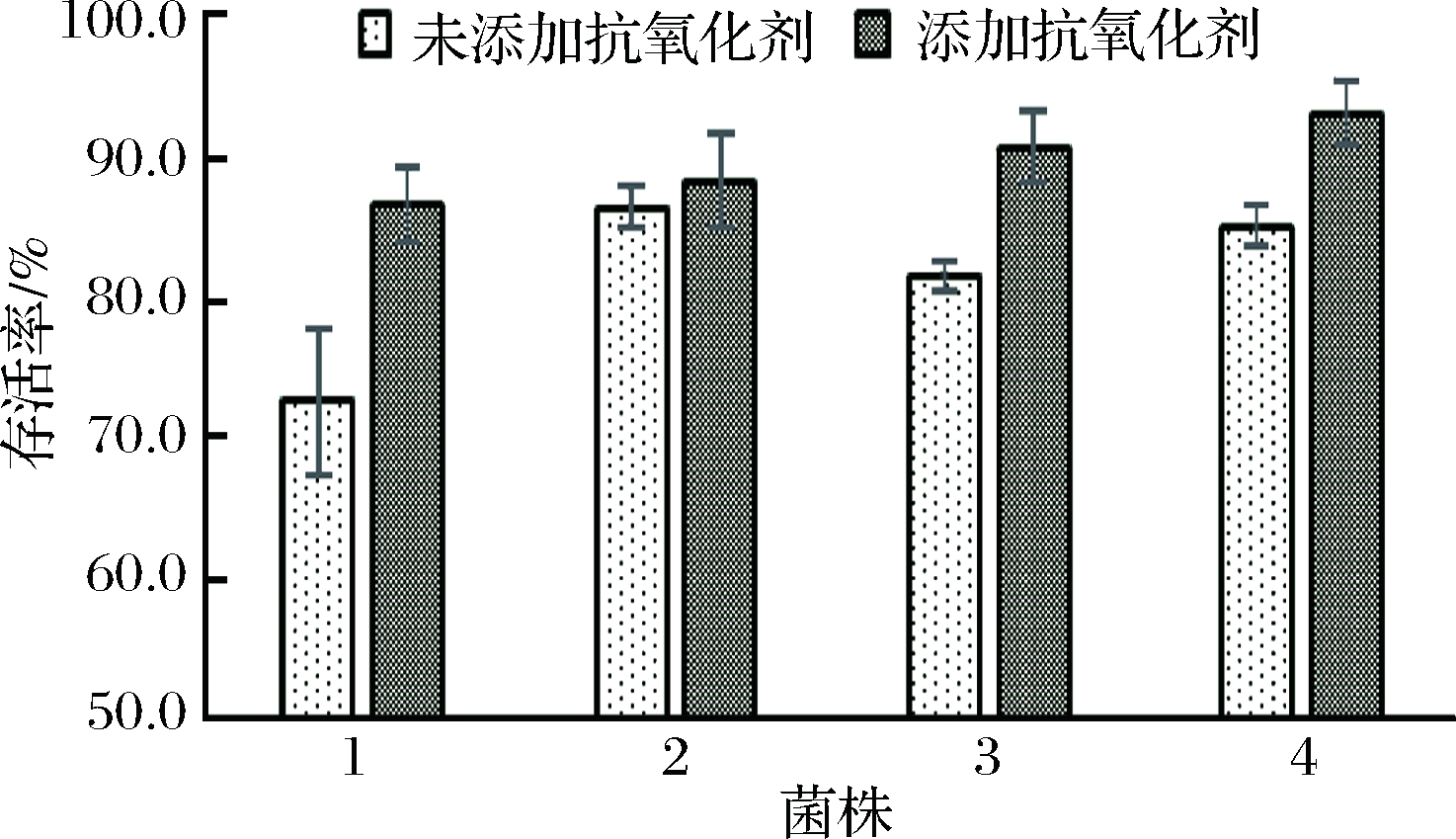
1-两歧双歧杆菌CCFM16;2-青春双歧杆菌CCFM8630; 3-短双歧杆菌CCFM683;4-长双歧杆菌L6
图3 不同双歧杆菌菌泥与不同保护剂混合3h后菌体的存活率
Fig.3 Survival rates ofBifidobacteria in suspensions of bacteria mixed with different lyoprotectant in air exposure environment for 3 h
(1)双歧杆菌发酵结束后,发酵液空气暴露对菌体细胞会产生损伤,发酵液空气暴露1 h,两歧双歧杆菌CCFM16、青春双歧杆菌CCFM8630、短双歧杆菌CCFM683和长双歧杆菌L6的菌体活性即产生10%左右的损失,暴露3 h后,4株菌的活性损失均超过20%。在双歧杆菌的生产过程中,应防止发酵液长时间空气暴露。
(2)离心作为双歧杆菌收集的主要手段,离心温度和离心时间是影响菌体活性的关键因素,而离心力在一定范围内影响不显著。4 ℃下离心4株菌的存活率显著高于20 ℃条件,离心时间30 min 4株菌的存活率低于离心10 min。双歧杆菌在生产过程中,应尽可能采用低温离心,且缩短离心时间。
(3)离心后收集的菌泥暴露于空气中,也会加速4株双歧杆菌的活性损失,且暴露时间延长,双歧杆菌活性显著降低。其中两歧双歧杆菌受影响最大,长双歧杆菌的影响最小。
(4)菌泥与保护剂混合后,长时间暴露于空气中也会对双歧杆菌产生较显著的损伤。且菌体的活性损失主要归因为氧化损伤,通过在保护剂中添加D-异 抗坏血酸钠作为抗氧化剂,能够有效缓解空气暴露对双歧杆菌活性的影响。
[1] 崔树茂. 乳酸菌的生长抑制和冻干存活的影响因素及规律[D]. 无锡:江南大学, 2017.
[2] SISTEK D, KELLY R, WICKENS K, et al. Is the effect of probiotics on atopic dermatitis confined to food sensitized children [J]. Clinical and Experimental Allergy, 2006, 36(5): 629-633.
[3] 胡会萍. 益生菌及其在功能食品中的应用[J]. 食品研究与开发, 2007, 28(2): 173-175.
[4] ALLEN A P, CLARKE G, CRYAN J F, et al.Bifidobacterium infantis 35624 and other probiotics in the management of irritable bowel syndrome. Strain specificity, symptoms, and mechanisms[J]. Current Medical Research & Opinion, 2017, 33(7):1 349-1 351.
[5] STAUDACHER H M, LOMER M C, FARQUHARSON F M, et al. A diet low in FODMAPs reduces symptoms in patients with irritable bowel syndrome and a probiotic restoresBifidobacterium species: A randomized controlled trial[J]. Gastroenterology, 2017, 153(4): 936-947.
[6] LAU A S Y, YANAGISAWA N, HOR Y Y, et al.Bifidobacterium longum BB536 alleviated upper respiratory illnesses and modulated gut microbiota profiles in Malaysian pre-school children[J]. Beneficial Microbes, 2018, 9(1): 61-70.
[7] MOYA-PÉREZ A, PEREZ-VILLALBA A, BEN TEZ-P
TEZ-P EZ A, et al.Bifidobacterium CECT 7765 modulates early stress-induced immune, neuroendocrine and behavioral alterations in mice[J]. Brain, Behavior, and Immunity, 2017, 65: 43-56.
EZ A, et al.Bifidobacterium CECT 7765 modulates early stress-induced immune, neuroendocrine and behavioral alterations in mice[J]. Brain, Behavior, and Immunity, 2017, 65: 43-56.
[8] 万红兵, 田洪涛,马晓燕,等. 直投式酸奶发酵剂制备过程中乳酸菌离心分离条件的研究[J]. 食品工业科技, 2006,27(11):69-71;75.
[9] MORGAN C A, HERMAN N, WHITE P A, et al. Preservation of micro-organisms by drying; A review[J]. Journal of Microbiological Methods, 2006, 66(2): 183-193.
[10] CORCORAN B M, ROSS R P, FITZGERALD G F, et al. Comparative survival of probiotic lactobacilli spray-dried in the presence of prebiotic substances[J]. Journal of Applied Microbiology, 2004, 96(5): 1 024-1 039.
[11] ZHANG G, FAN M, LI Y, et al. Effect of growth phase, protective agents, rehydration media and stress pretreatments on viability ofOenococcus oeni subjected to freeze-drying[J]. African Journal of Microbiology Research, 2012, 6(7): 1 478-1 484.
[12] MENG X C, STANTON C, FITZGERALD G F, et al. Anhydrobiotics: The challenges of drying probiotic cultures[J]. Food Chemistry, 2008, 106(4): 1 406-1 416.
[13] 李青青. 耐氧性双歧杆菌的筛选及其生理特性与应用研究[D].杭州:浙江大学, 2010.
[14] 柳翰凌, 康小红. 双歧杆菌厌氧机制的初步探讨[J]. 食品科技, 2008,33(3): 15-17.
[15] PETERSON B W, SHARMA P K, VAN DER MEI H C, et al. Bacterial cell surface damage due to centrifugal compaction[J]. Applied and Environmental Microbiology, 2012, 78(1):120-125.
[16] 任香芸, 何志刚,李维新,等. 直投式发酵剂制备工艺对乳酸菌存活率的影响[J]. 食品科学技术学报, 2017, 35(6): 36-41.
[17] 白少峰, 陈华海,王欣,等. 双歧杆菌胞外多糖研究进展[J]. 中国微生态学杂志, 2017, 29(10): 1 207-1 211;1 218.
[18] CUI S, HANG F, LIU X, et al. Effect of acids produced from carbohydrate metabolism in cryoprotectants on the viability of freeze-driedLactobacillus and prediction of optimal initial cell concentration[J]. Journal of Bioscience and Bioengineering, 2018, 125(5): 513-518.
[19] TRIPATHI M K, GIRI S K. Probiotic functional foods: Survival of probiotics during processing and storage[J]. Journal of Functional Foods, 2014, 9: 225-241.