表1 摇瓶与发酵罐上的L-DOPA转化参数
Table 1L-DOPA conversion parameters on shake flasks and fermenters

参数摇瓶5 L发酵罐温度/℃1515转速/(r·min-1)180200通气量/(L·min-1)-12.5反应时长/h66补料措施间歇补料连续补料
左旋多巴(3,4-2-dihydroxylphenylalanine,L-DOPA),又名3-羟基-L-酪氨酸,是一种前体药物,可通过血脑屏障进入脑循环而达中枢神经系统,在脱羧酶的作用下转变为多巴胺,从而达到治疗帕金森综合症的效果[1]。目前,L-DOPA是治疗帕金森综合症的主要药物[2]。L-DOPA的生产方法主要有植物提取法、化学合成法和生物酶催化法。植物提取法由于受到原材料来源的限制,应用较少。以香草醛和乙内酰脲为原料,经8步反应制得L-DOPA的化学合成法已经用于商业化,但由于过程繁杂且合成过程中需要大量的金属催化物,存在成本高、污染严重等问题[3-4]。生物酶法作为一种简便,高效,环境友好的新型合成方法受到了越来越多研究者的关注[5-6]。
酪氨酸酚裂解酶(tyrosine phenol-lyase,TPL,EC4.1.99.2)是依赖于磷酸吡哆醛(pyridoxal 5-phosphatemonohydrate,PLP)的多功能酶[7],在生物体内可催化L-酪氨酸发生β消去反应生成丙酮酸、苯酚和氨。该反应为可逆反应,若以邻苯二酚代替苯酚,便可在TPL催化下由邻苯二酚、丙酮酸和氨合成L-DOPA[8-10]。TPL是合成L-DOPA的关键酶,主要来源于草生欧文氏菌(Erwinia herbicola)、弗式柠檬酸菌(Citrobacter freundii)以及堆肥共生小杆菌(Symbiobacterium toebii)[11-12]等菌株,其中来源于E.herbicola和C.freundii的酶活较高[13]。20世纪70年代初,YAMADA等[14]通过菌株选育和发酵条件优化在日本味之素公司已实现了酶法合成L-DOPA的产业化应用。由于原始菌株中的TPL酶活较低,许多学者利用基因工程方法构建重组菌株,使TPL基因异源高效表达。国内对酶法合成L-DOPA的研究起步较晚。2001年,李华钟等[15]首次将来源于C.freundii的TPL基因导入到大肠杆菌(Escherichia coli),进行异源表达,并对培养基进行优化,TPL酶活较原始菌株提高了25倍,L-DOPA产量达15.36 g/L。目前,关于酶法合成L-DOPA的研究主要是通过基因工程手段对TPL基因进行改造来提高表达量以及酶活[16-17],从而提高L-DOPA的产量,高密度培养的相关报道较少。
为了满足L-DOPA生产的工业化要求,必须进一步提高TPL酶的表达量和酶活力。本文以重组菌株E.coli BL21 (DE3)为研究菌株,通过探究溶氧和补料策略提高菌体密度,在此条件下确定最佳诱导时间,大幅度提高了TPL酶活。在此基础上,以高密度获得的菌体进行全细胞催化合成L-DOPA研究,全细胞催化具有操作简便、稳定性高、成本低和方便下游分离提取等优势[18-19], 为L-DOPA的工业化生产奠定基础。
1.1.1 菌种
本实验室保存的重组大肠杆菌E.coli BL21 (DE3)。
1.1.2 培养基
种子培养基(LB)(g/L):酵母提取物5,胰蛋白胨10,NaCl 10;固体培养基添加2%(质量分数)的琼脂粉。
摇瓶发酵培养基(TB)(g/L):甘油5,蛋白胨12,酵母提取物24,K2HPO4 2.31,K2HPO4 16.37。
发酵培养基(g/L):甘油5,蛋白胨12,酵母提取物24,KH2PO4 2.31,K2HPO4 16.37,一水合柠檬酸1.1,MgSO4·7H2O 1,微量元素母液 1 mL。115 ℃灭菌20 min, 微量元素、一水合柠檬酸和MgSO4·7H2O分别单独过滤除菌。
微量元素溶液(g/L):CuCl2·2H2O 0.2,ZnSO4·7H2O 0.3,CaCl2·2H2O 1.5,CoSO4·7H2O 2.8,FeSO4·7H2O 2.8,MnCl·4H2O 2,溶于1 mol/L HCl中。
补料母液(g/L):甘油500。
T&J Atype 5 L发酵罐,上海迪必尔生物工程有限公司;ZQZY-80AS振荡培养箱,上海知楚仪器公司;高压蒸汽灭菌锅,上海民仪电子有限公司;UV-2450紫外可见分光光度计,日本岛津公司;AvantiJ-25落地式高速冷冻离心机,美国贝克曼库尔特有限公司;Agilent 1260 System高效液相色谱仪,美国安捷伦科技公司。
1.3.1 种子活化
将在-80 ℃保藏的甘油管中的菌液划线至带有卡那霉素抗性的LB固体培养基平板上。37 ℃恒温培养12 h,从平板上挑取单菌落接种于含有25 mL LB液体培养基的250 mL三角瓶中,卡那霉素终浓度为50 mol/L。37 ℃,220 r/min培养8~10 h,即为种子液。
1.3.2 摇瓶培养
将活化后的种子液以1%的接种量接种至25 mL TB培养基中,37 ℃,220 r/min培养至OD600为0.6~0.8时,降温至25 ℃,加入终浓度为0.2 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl-β-D-Thiogalactoside, IPTG)进行诱导。
1.3.3 分批培养
5 L发酵罐中,装液量2.5 L,接种量2%。接种前发酵罐内加入卡那霉素至50 μg/mL,用25%(体积分数)氨水和25%(体积分数)H3PO4控制pH值为7.0,通气量2.5 L/min。分别设置400、500、600和700 r/min四种不同的转速,考察转速对TPL表达和L-DOPA产量的影响。
1.3.4 DO-stat流加控制培养
在分批培养的基础上,采用DO-stat补料策略[20-21]向罐内流加500 g/L的甘油。有研究发现溶氧维持在30%~40%时有利于重组大肠杆菌的生长和外源蛋白的高表达,因此分别考察了20%、30%、40%和50%四个不同溶氧水平对TPL的表达的影响。
1.3.5 诱导策略的优化
在DO-stat补料的基础上,分别在菌体生长的对数前期、对数中期和对数后期加入诱导剂,以确定TPL最优表达的诱导时间。
1.3.6 粗酶液的制备及酶活测定
将发酵液于4 ℃,7 000 r/min离心10 min,收集菌体,用pH 7.0、50 mmol/L的磷酸钾缓冲液离心洗涤细胞两次。用pH 8.0、50 mmol/L的磷酸钾缓冲液重悬菌体,稀释至OD600为10,进行超声波破碎(破碎时间2 s, 间歇时间4 s),破碎10 min,离心(1 200 r/min,10 min) 所得上清液即为粗酶液。
酶活的测定见文献[9]。酶活单位定义为在30 ℃、pH 8.0的条件下,每分钟水解L-酪氨酸产生1 μmol丙酮酸所需酶的量为一个酶活单位(U)。
1.3.7 全细胞催化合成L-DOPA
将6 g/L(湿重)的菌体重悬于反应体系中,体系组成为(g/L):丙酮酸钠15,邻苯二酚10,乙酸铵30,EDTA 2,无水亚硫酸钠4,用氨水调节pH值为8.5。摇瓶水平与发酵罐水平的转化条件如表1所示。
表1 摇瓶与发酵罐上的L-DOPA转化参数
Table 1L-DOPA conversion parameters on shake flasks and fermenters

参数摇瓶5 L发酵罐温度/℃1515转速/(r·min-1)180200通气量/(L·min-1)-12.5反应时长/h66补料措施间歇补料连续补料
注:摇瓶间歇补料措施为每隔1.5 h分别补加丙酮酸钠和邻苯二酚6和4 g/L,共补料3次;发酵罐连续补料措施为丙酮酸钠与邻苯二酚补加流速分别为9和6 g/(L·h),连续补料4 h。“-”表示未检测。
1.3.8 检测方法
L-DOPA的测定:取反应结束后的转化液,加入1 mol/L HCl溶液终止反应,离心取上清,将上清液稀释20倍后采用高效液相色谱仪检测反应体系中L-DOPA的含量。
HPLC检测条件为:色谱柱:Agilent C18 (250 mm×4.6 mm,5 μm),流动相:V(乙腈)∶V(水)=2.4∶97.6,其中水溶液中含有0.08% (体积分数)的甲酸,柱温30 ℃,流速1 mL/min,检测波长280 nm。
甘油浓度的测定:采用高效液相检测[22]。
前期研究已经在摇瓶上对重组菌的生长以及TPL的表达做了较全面的优化,得到最佳接种量为1%,培养2 h加入终浓度为0.2 mmol/L的IPTG进行诱导,诱导10 h后菌体质量浓度达到21.5 g/L,酶活为0.98 U/mL。由于发酵罐与摇瓶培养环境相差很大,发酵罐的培养条件不可完全套用摇瓶条件。为了解重组菌在罐上的生长特性,首先在5 L发酵罐上进行分批发酵培养,参考摇瓶条件进行放大实验。发酵过程中菌体浓度、pH、溶氧和甘油消耗的变化曲线如图1所示。
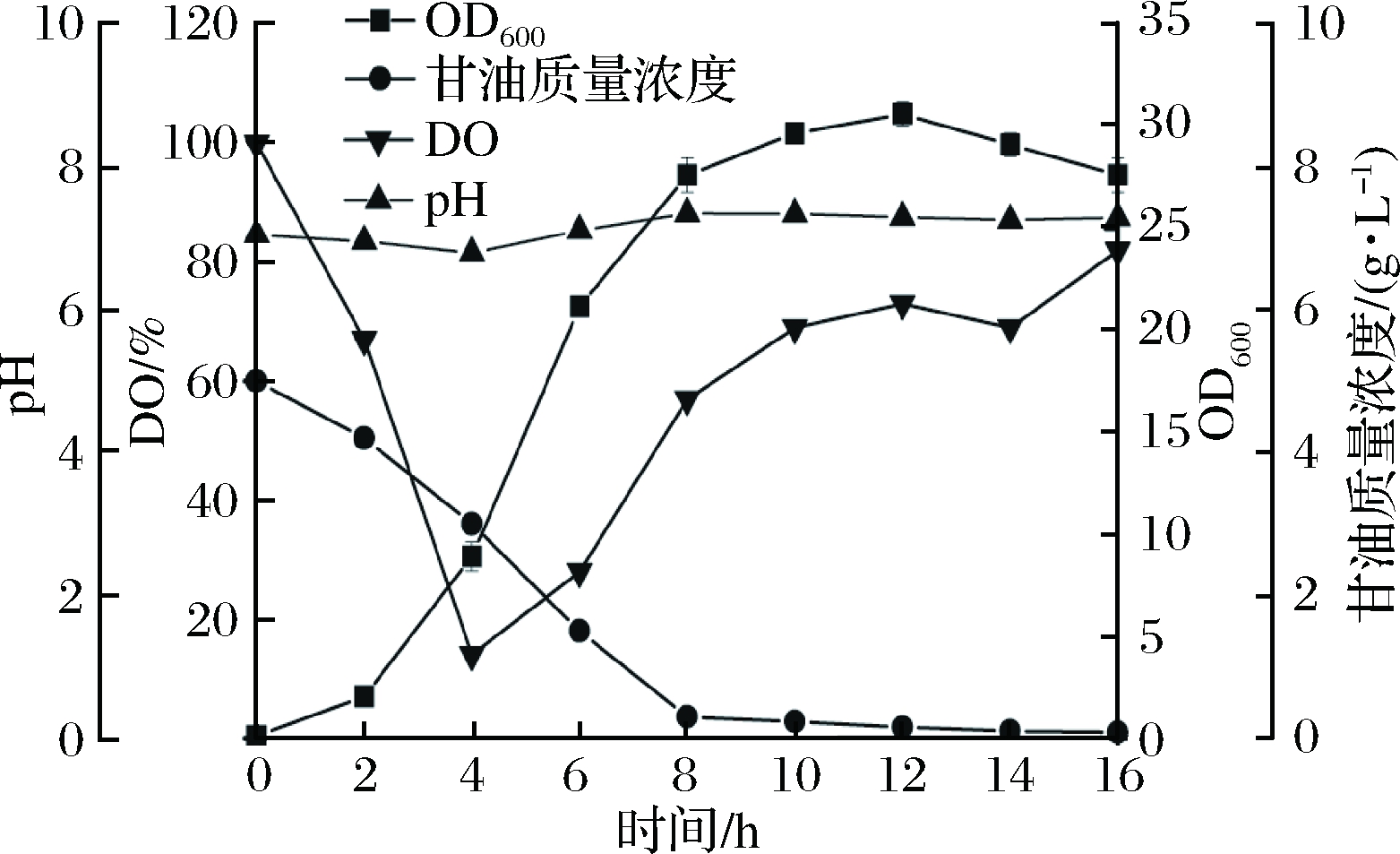
图1 重组E.coli BL21分批发酵过程曲线
Fig.1 Process curve of batch fermentation with recombinantE.coli BL21
由图1可知,0~2 h为菌体生长的延迟期,此时菌体在适应发酵罐内的培养环境,生长缓慢,甘油消耗较慢;3~8 h为菌体生长对数期,菌体浓度迅速增加,甘油消耗速率加快,溶氧浓度最低降至14%,在发酵4 h时进行降温诱导,溶氧出现回升,之后随着发酵液中甘油浓度的降低,溶氧持续升高;8~12 h为减速生长期,碳源基本耗尽,菌体生长缓慢,12 h菌体量达到最高;12~16 h细胞开始裂解,菌浓开始下降,为衰亡期。整个发酵过程中pH呈现先降低后增加的趋势,但整体波动幅度较小,较为稳定。最终菌体OD600达到31.2,TPL酶活为0.9 U/mL,全细胞反应后测得L-DOPA产量为18.3 g/L。根据分批培养结果将大肠杆菌在5 L发酵罐上的发酵周期定为12 h。
在分批培养过程中,培养温度是影响菌体生长和蛋白表达的关键因素。大肠杆菌的最适生长温度为37 ℃,而细胞发酵产酶的最适温度与菌体的最适生长温度可能存在一定差异。温度较高时,蛋白表达过快易形成包涵体。因此,酶的生产温度往往低于菌体最适生长温度。发酵过程中在诱导产酶之前,主要是追求菌体的快速生长,因此选择37 ℃进行培养;添加诱导剂时,将温度调节至15、20、25和30 ℃,考察不同诱导温度对菌体生长和TPL表达的影响(图2、图3)。
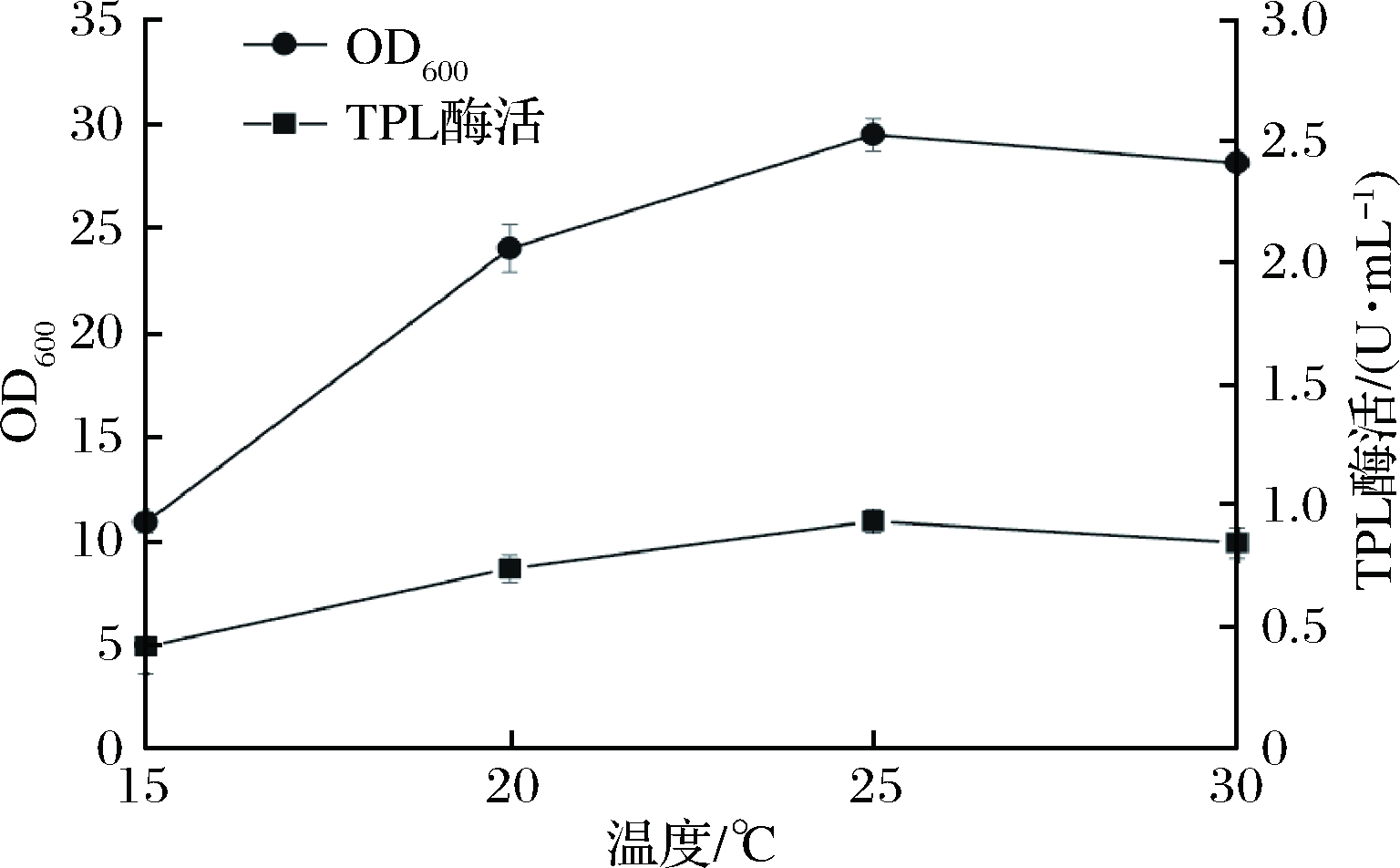
图2 诱导温度对菌体生长和TPL酶活的影响
Fig.2 Effects of induction temperature on cell growth and TPL activity
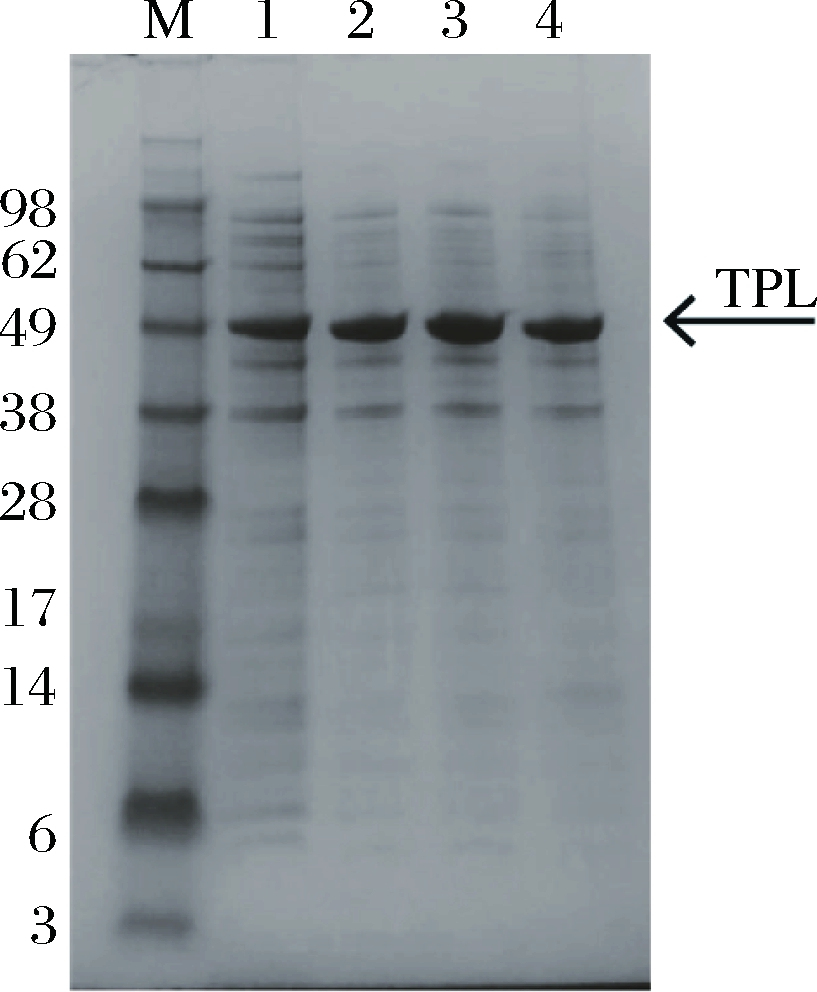
M-蛋白质marker,1~4分别代表诱导温度为15、20、25和30 ℃的全细胞蛋白电泳
图3 不同诱导温度对TPL蛋白表达的影响
Fig.3 Effects of induction temperature on TPL protein expression level
由图2可以看出,分别控制诱导温度为15、20、25和30 ℃时,诱导12 h后菌体浓度分别为11.2、23.2、29.1和28.6,TPL酶活分别为0.43、0.72、0.93和0.85 U/mL,诱导温度为25和30 ℃条件下,菌体浓度和TPL酶活都相差不大,但两者在25 ℃条件下都略高于30 ℃,并且25 ℃诱导情况下TPL蛋白表达量最高(图3)。根据以上结果,选择25 ℃为最佳诱导温度。
在发酵过程中,溶解氧浓度是影响菌体生长以及外源蛋白表达的关键因素,搅拌转速是有效调节发酵液中溶氧状态的主要条件之一,但过高搅拌转速产生的剪切力也会对菌体的生长产生影响[23-24],故在5 L发酵罐上分别设置转速为400、500、600和700 r/min,考察其对细胞生长及TPL的表达的影响,结果如图4所示。

A-甘油浓度;B-菌体浓度;C-溶氧浓度;D-TPL酶活
图4 搅拌转速对甘油浓度、菌体浓度、溶氧浓度和TPL酶活的影响
Fig.4 Effects of stirring speeds on glycerol concentration,bacteria concentration, dissolved oxygen solubility and TPL enzyme activity
不同的搅拌转速对甘油消耗速率以及溶氧浓度的变化影响不大,在发酵8 h甘油质量浓度均低于1 g/L; 对菌体生长和TPL酶活的影响较为明显。转速较低时,菌体生长过程中尤其是在对数生长期,溶氧一直维持较低的水平,限制了细胞的生长,因此转速为400 r/min时(图4-B),菌体生长速率较慢,OD600最终达到23.3,明显低于其他3种较高转速。而转速较高时,随之产生的剪切力可能会影响菌体生长,当搅拌转速为500 r/min时,相较于600 r/min (OD600=30.8)和700 r/min (OD600=32.6)更利于菌体的生长,最终获得细胞浓度为35.1,比400 r/min提高了50.6%。500 r/min 时TPL最终酶活达到1.1 U/mL,相比于400 r/min (0.9 U/mL)、600 r/min(0.93 U/mL)和700 r/min (0.82 U/mL)分别提高了22.2%、18.2%和34.1%。固定搅拌转速会使整个发酵过程中溶氧出现过高或过低的情况,均不利于菌体生长和酶的表达,后续研究中需进一步探究控制溶氧的策略。
由上述研究可发现,固定的搅拌转速在发酵前期易导致溶氧过低,菌体生长的对数期溶氧甚至会低于10%,不利于菌体生长;而发酵后期由于碳源的缺乏溶氧会维持在较高水平,而过高的溶氧浓度也不利于菌体生长和蛋白表达。为了进一步提高菌体量和TPL表达量,结合溶氧浓度调控与补料策略,采用DO-Stat反馈流加甘油将整个发酵过程中的溶氧水平控制在一个相对稳定的状态。考察了20%、30%、40%和50%四个溶氧水平对菌体的生长、TPL酶活以及多巴产量的影响。整个发酵过程在分批补料发酵模式下进行,当溶氧浓度回升到各预调控水平时开始进行DO-Stat培养,结果如图5所示。
由图5可知,采用DO-Stat反馈控制培养可以成功将发酵液中的溶氧浓度控制各设置水平(图5-C)。发现不同溶氧条件下菌体生长趋势相同,2~6 h为菌体生长的对数期,甘油迅速消耗,耗氧速率加快,之后菌体生长逐渐变慢,导致发酵液中甘油量逐渐积累(图5-A)。分别控制溶氧浓度为20%、30%、40%和50%时,得到最终菌体浓度分别为36.8、32.4、35和33.2,比较发现20%的溶氧浓度更适合菌体生长(图5-B)。
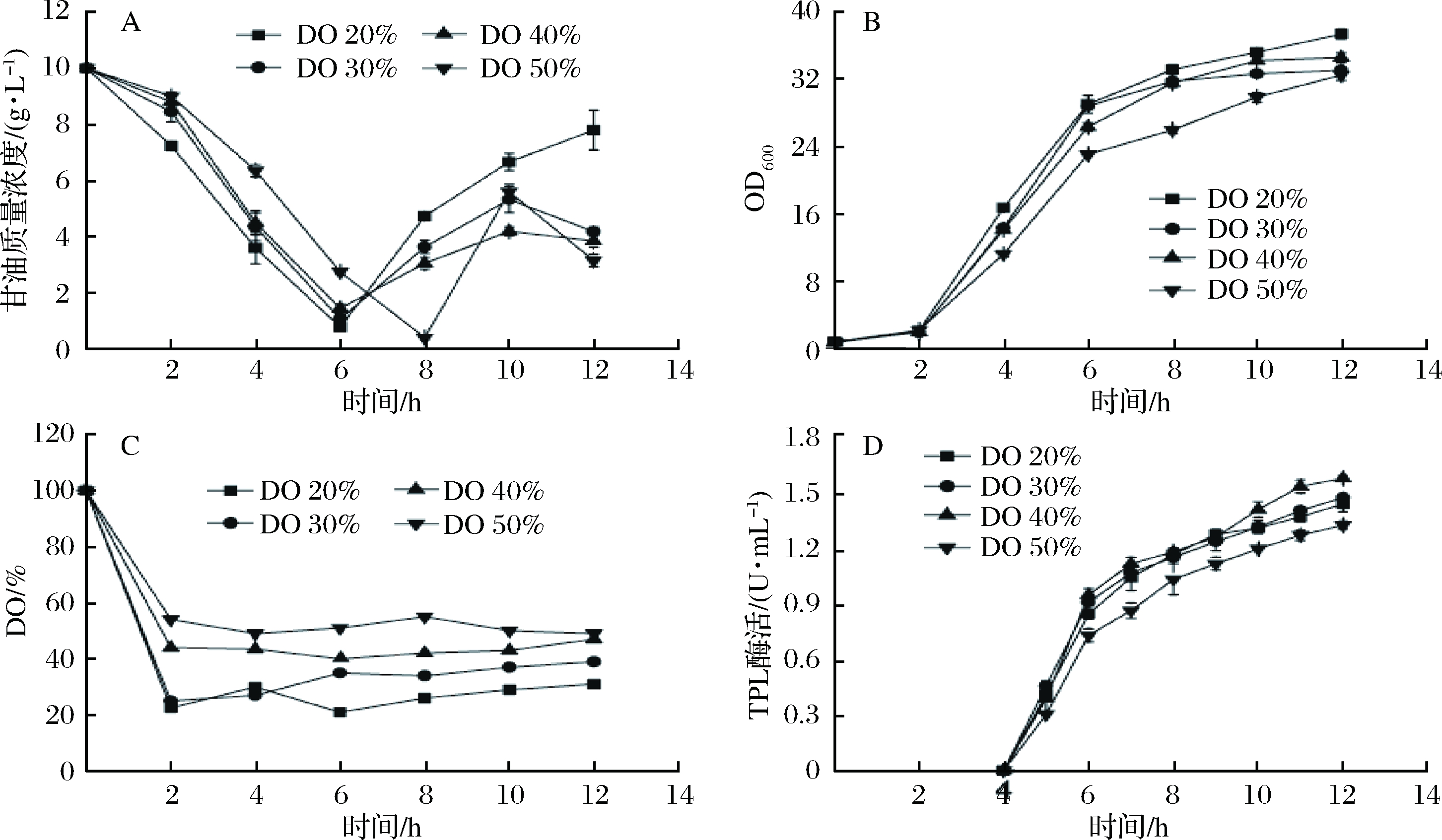
A-甘油浓度;B-菌体浓度;C-溶氧浓度;D-TPL酶活
图5 溶氧水平对甘油浓度、菌体浓度、溶氧浓度和TPL酶活的影响
Fig.5 Effects of dissolved oxygen on glycerol concentration, bacteria concentration, dissolved oxygen concentration and TPL activity
诱导后的2 h,菌体正处于生长对数期,酶活迅速提高,而当菌体进入稳定期后,随着诱导时间的延长,酶活缓慢提高,因此提前诱导时间可能会有利于酶活的提高。12 h发酵结束后,控制DO为20%时,获得的菌体浓度虽然最高,但TPL酶活为1.42 U/mL;而控制DO为30%和40%时,酶活均高于控制DO为20%时,分别为1.47和1.55 U/mL,而继续提高溶氧浓度至50%,酶活又降低至1.35 U/mL,结果表明适当的提高溶氧浓度有利于促进酶的表达。
根据上述结果,为了进一步验证不同溶氧浓度对TPL表达的影响,提出两阶段控制溶氧策略:即诱导前控制溶氧在20%,诱导后分别控制溶氧浓度在20%和40%,比较不同溶氧浓度对TPL表达的影响。诱导后每隔1 h取样,将收集的细胞进行超声破碎,取上清液进行SDS-PAGE电泳,结果见图6。
不同溶氧溶度对TPL蛋白表达的影响较大,诱导后控制溶氧在40%时TPL蛋白表达量明显高于20%的溶氧浓度。由此可见,较高的溶氧更利于TPL的表达,两阶段控制溶氧一方面能在发酵前期尽可能多的获得菌体量,另一方面又能使诱导后TPL蛋白更高效的表达。经全细胞催化后,溶氧为20%时得到的菌体催化生产L-DOPA产量为23.4 g/L;溶氧 为40%时得到的菌体催化生产L-DOPA产量为28.4 g/L。
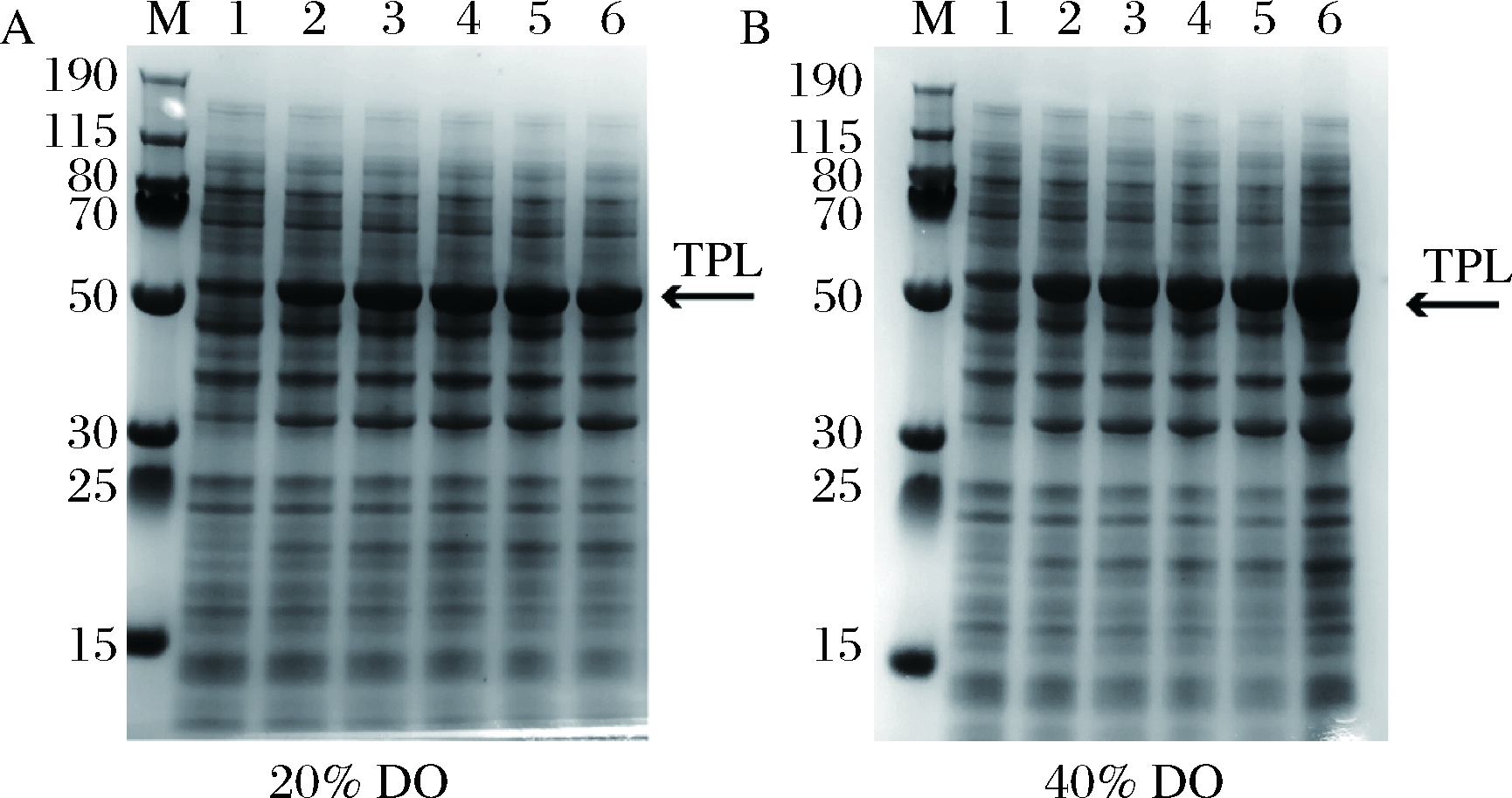
A-20% DO;B-40%DO
M-蛋白质Marker,1~6分别代表诱导1、2、3、4、5和6 h的全细胞蛋白电泳
图6 诱导后不同溶氧浓度对TPL蛋白表达的影响
Fig.6 Effects of dissolved oxygen concentration on TPL protein expression level after induction
基于2.3的研究结果,进一步研究诱导开始时间对TPL表达以及多巴产量的影响。分别在菌体生长的对数前期(OD600=7)、对数中期(OD600=14)和对数后期(OD600=25)加入IPTG进行诱导(以上3种条件诱导前DO均控制在20%左右,诱导后DO均控制在40%左右),结果如图7所示。在对数前期、中期和后期诱导所获得的最高细胞浓度分别为51.2、36.8和33.6,相比于优化前分别提高了64.1%、17.2%和7.6%,最高酶活分别为2.4、1.9和1.7 U/mL,较分批培养分别提高了170%、111%和92.2%。在前期进行诱导,菌体生长速度和TPL酶活均高于中期诱导和后期诱导,且在诱导后7 h菌体浓度达到最高,这可能由于流加甘油时间较早,且甘油总量高于其他两种诱导策略,为菌体的生长提供了充足的碳源。有报道提出诱导期间流加甘油可以促进酶的表达[20]。前期诱导时,在诱导后7 h,随着菌体浓度的下降,TPL酶活也开始降低,由此可知,提前加入诱导剂不仅提高了菌体浓度和酶活,还缩短了整个发酵周期,发酵时间可由之前的12 h缩短为10 h。进一步比较了不同诱导起始时间对多巴产量的影响,结果表明,在菌体生长的对数前期进行诱导最终获得的L-DOPA 产量最高,为34.2 g/L,相较于分批发酵提高了46.5%(图8)。
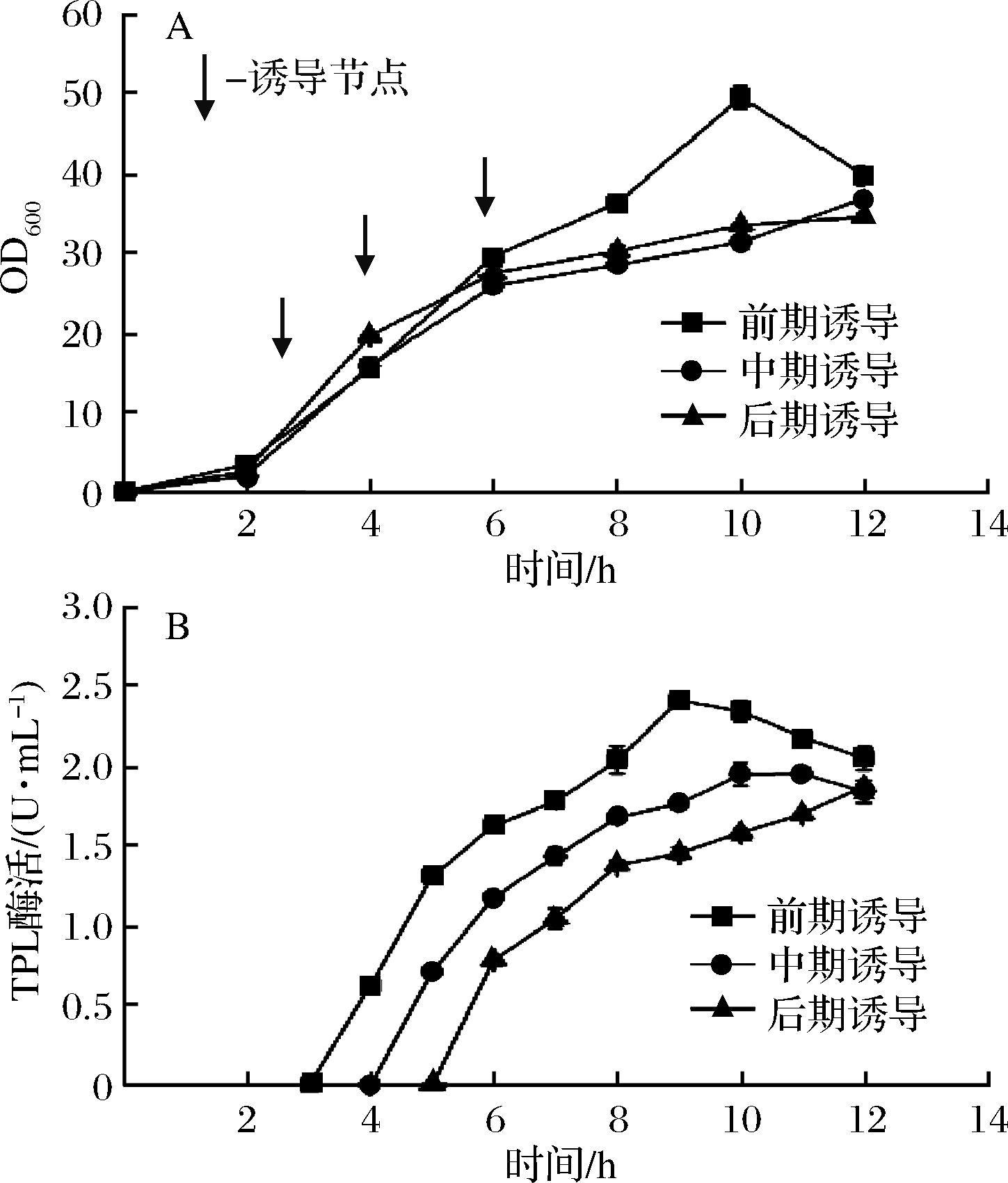
A-菌体生长;B-TPL酶活
图7 诱导起始时间对菌体生长和TPL酶活的影响
Fig.7 Effects of induction time on cell growth and TPL activity
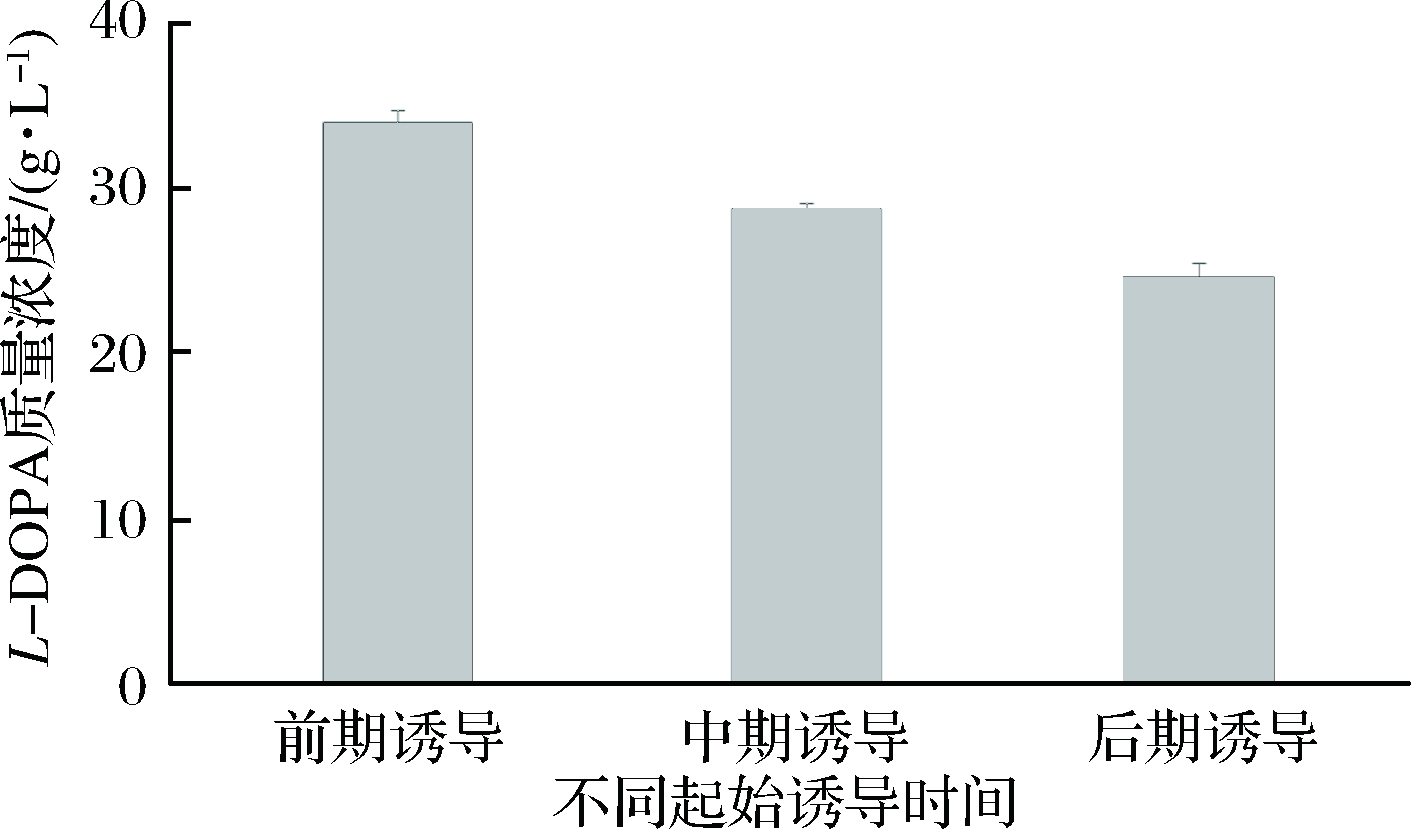
图8 诱导起始时间对L-DOPA浓度的影响
Fig.8 Effects of initial induction time onL-DOPA concentration
对分批培养、两阶段控制溶氧以及优化诱导策略后的最终结果进行了比较分析(表2)。可以看出,与分批培养相比,两阶段控制溶氧与对数前期进行诱导的培养模式,更有利于菌体的生长和重组蛋白的表达,从而使单位时间、单位发酵液体积内细胞的得率以及TPL酶活有较大幅度的增加。因此,在菌体生长阶段和酶的表达阶段,通过补加营养成分从而控制不同的溶氧水平,可实现菌体的高密度生长以及蛋白的高水平表达,从而实现L-DOPA的高产量合成。
表2 不同高密度发酵策略的参数对比
Table 2 Comparison of related parameters in high cell density cultivation for production of recombinant TPL in different stages
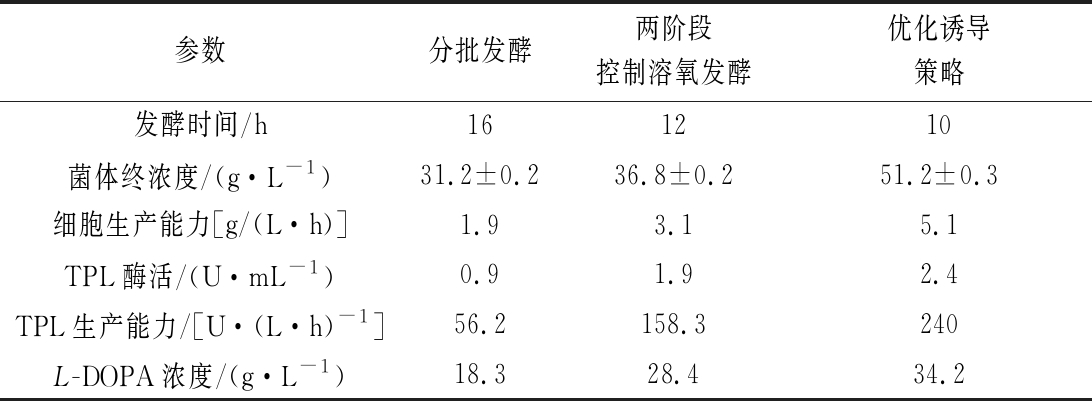
参数分批发酵两阶段控制溶氧发酵优化诱导策略发酵时间/h161210菌体终浓度/(g·L-1)31.2±0.236.8±0.251.2±0.3细胞生产能力[g/(L·h)]1.93.15.1TPL酶活/(U·mL-1)0.91.92.4TPL生产能力/[U·(L·h)-1]56.2158.3240L-DOPA浓度/(g·L-1)18.328.434.2
目前国内市场上的L-DOPA药物主要靠进口,随着中国老龄化现状的加剧,如何实现微生物酶法合成L-DOPA在国内的工业化生产已经成了亟待解决的问题。国内主要通过基因工程技术对不同来源的TPL进行定向改造以及对TPL催化合成L-DOPA的过程进行优化[25-26 ],通过提高TPL酶活最终达到L-DOPA 的高效合成。关于TPL的高密度培养鲜有报道。本文考察了溶氧和诱导策略等因素对异源表达TPL蛋白的重组大肠杆菌生长及目标产物L-DOPA产量的影响。通过确立两阶段控制溶氧策略和起始诱导时间,在5 L发酵罐上实现了重组菌株E.coli BL21 (DE3)的高密度发酵生长,并建立了分批补料培养工艺,使得TPL重组蛋白高效表达。最终得到细胞51.2 g/L,TPL酶活2.43 U/mL,结合连续流加底物策略,多巴最终产量达56.58 g/L,较分批发酵分别提高了64.1%、170%和209.2%。有关高密度培养生产TPL的优化策略对左旋多巴酶法合成的放大实验具有一定的参考意义。
[1] ONDO W, COSS P, CHRISTIE M, et al. Conversion ofL-dopa to extended releaseL-dopa (Rytary(R)) in patients with fluctuating parkinson’s disease: Predictor’s of dose[J]. Journal of Parkinson’s disease, 2019,1(9):153-156.
[2] KATZENSCHLAGER R, LEES A J. Treatment of Parkinson’s disease: Levodopa as the first choice[J]. Journal of neurology, 2002, 249 (Suppl 2): ii19-ii24.
[3] VALDÉ S R H, PUZER L, GOMES J M, et al. Production ofL-DOPA under heterogeneous asymmetric catalysis[J]. Catalysis Communications, 2004, 5 (10): 631-634.
[4] TANG Xiaoling, LIU Xiao, SUO Hui, et al. Process development for efficient biosynthesis ofL-DOPA with recombinantEscherichia coli harboring tyrosine phenol lyase fromFusobacterium nucleatum[J]. Bioprocess and Biosystems Engineering, 2018,41(9):1 347-1 354.
[5] FOOR F, MORIN N,BOSTIAN K A. Production ofL-dihydroxyphenylalanine inEscherichia-coli with the tyrosine phenol-lyase gene cloned fromErwinia-herbicola[J]. Applied and Environmental Microbiology, 1993, 59 (9): 3 070-3 075.
[6] KOYANAGI T, KATAYAMA T, SUZUKI H, et al. Hyperproduction of 3,4-dihydroxyphenyl-L-alanine (L-Dopa) usingErwinia herbicola cells carrying a mutant transcriptional regulator TyrR[J]. Bioscience Biotechnology and Biochemistry, 2009, 73 (5): 1 221-1 223.
[7] PHILLIPS R S. Chemistry and diversity of pyridoxal-5`-phosphate dependent enzymes[J]. Biochim Biophys Acta, 2015,1 854(9):1 167-1 174.
[8] PHILLIPS R S, VITA A, SPIVEY J B, et al. Ground-state destabilization by Phe-448 and Phe-449 contributes to tyrosine phenol-lyase catalysis[J]. ACS Catalysis, 2016, 6 (10): 6 770-6 779.
[9] CHANDEL M, MAZMI W. Purification and characterization of tyrosine phenol lyase fromCitrobacter freundii[J]. Appl Biochem Biotech, 2013,171 (8): 2 040-2 052.
[10] KIM D Y, RHA E, CHOI S L, et al. Development of bioreactor system forL-tyrosine synthesis using thermostable tyrosine phenol-lyase[J]. Journal of Microbiology and Biotechnology, 2007, 17 (1): 116-122.
[11] RHA E, KIM S, CHOI S L, et al. Simultaneous improvement of catalytic activity and thermal stability of tyrosine phenol-lyase by directed evolution[J]. Febs Journal, 2009, 276 (21): 6 187-6 194.
[12] LUNA-VELASCO A, FIELD J A,COBO-CURIEL A, et al. Inorganic nanoparticles enhance the production of reactive oxygen species (ROS) during the autoxidation ofL-3, 4-dihydroxyphenylalanine (L-dopa)[J]. Chemosphere, 2011,85 (1): 19-25.
[13] ZHENG Renchao, TANG Xiaoling, SUO Hui, et al. Biochemical characterization of a novel tyrosine phenol-lyase fromFusobacterium nucleatum for highly efficient biosynthesis ofL-DOPA[J]. Enzyme and Microbial Technology, 2018, 112:88-93.
[14] YAMADA H, KUMAGAI H, KASHIMA N, et al. Synthesis ofL-tyrosine from pyruvate,ammonia and phenol by crystalline tyrosine phenol lyase[J]. Biochemical and biophysical Research Communications,1972,46(2):370-374.
[15] 李华钟, 孙伟,刘吉泉,等. 弗氏柠檬酸细菌酪氨酸酚解酶基因在大肠杆菌中的克隆与表达[J]. 工业微生物, 2001,31 (3): 9-12.
[16] PHILLIPS R S, CRAIG S. Crystal structures of wild-type and F448A mutantCitrobacter freundii tyrosine phenol-lyase complexed with a substrate and inhibitors: Implications for the reaction mechanism[J]. Biochemistry, 2018,57(43): 6 166-6 179.
[17] 刘潇, 汤晓玲,郑仁朝. 生物法合成左旋多巴的研究进展[J]. 发酵科技通讯,2018, 47(3):145-150.
[18] WACHTMEISTER J, ROTHER D. Recent advances in whole cell biocatalysis techniques bridging from investigative to industrial scale[J]. Current Opinion in Bitechnology, 2016, 42:169-177.
[19] TANG Xiaoling, LU Xiafeng, WU Zheming, et al. Biocatalytic production of (S)-2-aminobutanamide by a novel d-aminopeptidase fromBrucella sp.with high activity and enantioselectivity[J]. Journal of Biotechnology,2018,266(20):20-26.
[20] WU Zufang, DU Guocheng, CHEN Jian. Effects of dissolved oxygen concentration and DO-stat feeding strategy on CoQ10 production withRhizobium radiobacter[J]. World Journal of Microbiology and Biotechnology, 2003, 19 (9): 925-928.
[21] PICOTTO L D, SGUAZZA G H, TIZZANO M A, et al. An effective and simplified DO-stat control strategy for production of rabies glycoprotein inPichia pastoris[J]. Protein Expression and Purification, 2017, 132:124-130.
[22] 张俊丽,刘龙,房峻,等. 基于DO-stat流加培养控制的L-异亮氨酸发酵条件优化[J]. 应用与环境生物学报, 2011, 17 (3): 317-320.
[23] 杨军, 梁凌宇,高雪峰,等. 基因工程菌发酵液中多种成分快速检测方法的建立[J]. 中国生物制品学杂志, 2013, 26 (12): 1 831-1 834.
[24] AMIRZADA M I, YU M, GONG X, et al. Cost-effective production of recombinant human interleukin 24 by lactose induction and a two-step denaturing and one-step refolding method[J]. Journal of industrial microbiology and biotechnology, 2014, 41 (1): 135-142.
[25] DEMIDKINA T V, FALEEV N G, PAPISOVA A I, et al. Aspartic acid 214 incitrobacter freundii tyrosine phenol-lyase ensures sufficient C-H-acidity of the external aldimine intermediate and proper orientation of the cofactor at the active site[J]. Biochimica Et Biophysica Acta Proteins and Proteomics, 2006, 1 764 (7): 1 268-1 276.
[26] SURWASE S N, PATIL S A, APINE O A, et al. Efficient microbial conversion of tyrosine toL-DOPA byBrevundimonas sp. SGJ[J]. Applied Biochemistry and Biotechnology, 2012, 167 (5): 1 015-1 028.