γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种非蛋白质氨基酸,是哺乳动物中枢神经系统中重要的抑制性神经递质[1]。研究表明,GABA具有降血压[2]、抗焦虑[3]、保护肾脏[4]、促进生长激素分泌[5]、增强免疫力[6]等生理功能。作为一种新型功能因子,GABA现已逐步应用于食品、医药、养殖等行业中。
GABA广泛分布于动物、植物和细菌中,而乳杆菌被认为是细菌中GABA的重要生产者。已报道常见的具有产GABA能力的乳杆菌包括短乳杆菌(Lactobacillus brevis)[7-9]、植物乳杆菌(Lactobacillus plantarum)[10-12]、副干酪乳杆菌(Lactobacillus paracasei)[13-14]、德氏乳杆菌(Lactobacillus delbrueckii)[15]等。乳杆菌中GABA是由L-谷氨酸或其衍生物在谷氨酸脱羧酶(glutamate decarboxylase,GAD)作用下经过不可逆脱羧而成的,和菌体自身耐酸机制有关。当受到环境的酸胁迫时,乳杆菌细胞质中的GAD消耗细胞内的H+,催化L-谷氨酸脱羧生成GABA,而位于细胞膜上的Glu/GABA反向转运蛋白则将细胞内的反应产物GABA交换到细胞外,同时将细胞外的L-谷氨酸运输到细胞内。在此过程中,乳杆菌细胞内的pH维持了稳态,从而使菌体在酸性环境中得以存活[16]。
人们观察到,不同种属乳杆菌产GABA的能力不同,同种属间的产GABA能力也有差异[15]。影响GABA产量最常见和最重要的因素是pH、温度、培养时间和培养基添加剂等。所以,现有研究大都集中在寻找最佳培养基和培养条件,以获得更高的GABA产量[17],但是对于乳杆菌产GABA的情况以及相关基因表达规律缺少系统性研究。本研究选取了8个种属68株的乳杆菌,在NCBI-GenBank数据库中对这几个种属进行基因组学调查,利用高效液相色谱法(high efficiency liquid chromatography,HPLC)比较了不同种属间产GABA能力的差异,并研究了上述乳杆菌GAD相关基因在基因水平、转录水平的差异,以期为后续产GABA菌株的筛选,GAD基因的表达调控,GABA发酵工艺的优化提供理论基础。
1 材料与方法
1.1 菌株
由发酵食品与健康人群新鲜粪便筛选得到8个种属68株乳杆菌(表2),均来自于江南大学食品学院生物技术菌种保藏中心。
1.2 培养基
MRS液体培养基,用于乳杆菌的活化;MMRS发酵培养基,用于产GABA乳杆菌的筛选。
MRS培养基成分(g/L):蛋白胨 10,牛肉膏 10,酵母粉 5,葡萄糖 20,无水乙酸钠 2,MgSO4·7H2O 0.5,MnSO4·H2O 0.25,柠檬酸氢二铵 2,K2HPO4·3H2O 2.6,Tween 80 1,pH值6.2~6.4。
MMRS培养基成分(g/L):在MRS培养基的基础上添加1.5%的L-谷氨酸钠作为GABA合成的前体物质。
1.3 材料与试剂
GABA标准品,上海阿拉丁生化科技股份有限公司;L-谷氨酸钠(L-MSG),国药集团化学试剂公司;TRIzol试剂,Qiagen公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司;2×Taq MasterMix(Dye),康为世纪生物科技有限公司;PrimeScriptTMRT试剂盒,宝日医生物技术(北京)有限公司(Takara中国);其他试剂为市售分析纯。引物合成,上海生工生物工程有限公司。
1.4 仪器与设备
高效液相色谱,美国Thermo公司;超净工作台ZHJH-C1115B,上海智诚分析仪器制造有限公司;电子天平,精密pH计FE-20,梅特勒-托利多仪器(上海)有限公司;立式压力蒸汽灭菌锅MLS-3750,日本Sanyo公司; T100PCR仪,核酸电泳仪,凝胶成像仪,美国Bio-Rad公司;CFXConnect Real-time System,美国Bio-Rad公司;冷冻高速离心机,德国Eppendorf公司;Milli-Q Reference超纯水系统,德国Millipore公司。
1.5 方法
1.5.1 产GABA乳杆菌的筛选
1.5.1.1 菌株培养条件
将实验室保藏的乳杆菌菌株进行活化,用接种环蘸取保菌管中少量菌液在MRS固体培养基上划线,平板置于37 ℃培养48 h。挑取单菌落接入5 mL的MRS液体培养基中于37 ℃培养18 h。以2%的接种量接入到10 mL的MRS液体培养基中,37 ℃培养18 h作为后续培养的种子液。取2%的种子液接种到添加了1.5%MSG的MMRS培养基中37 ℃培养48 h。
1.5.1.2 样品预处理
取不同发酵时间(6、12、24、48 h)的样品1 mL,经8 000 r/min离心5 min,将上清液稀释一定倍数,经0.22 μm微孔滤膜过滤,即可用于衍生反应。
1.5.1.3 发酵液中GABA含量的测定
本研究使用HPLC测定发酵上清液中的GABA的含量。分析条件按照国标QBT 4587—2013修改而成。色谱条件为:色谱柱Hypersil GOLD色谱柱(100 mm×2.1 mm);柱温30 ℃;进样量5 μL;流动相A为20 mmol/L醋酸钠水溶液,流动相B为V(40 mmol/L醋酸钠水溶液)∶V(乙腈)=1∶1;流速0.2 mL/min;检测波长338 nm。洗脱梯度为0~6 min,B由30%升至50%;6~11 min,B由50%升至60%;11~12 min,B由60%升至100%并保持3 min;15~16 min,B由100%降至30%;16~20 min,30% B保持4 min。
样品衍生:
(1)0.4 mol/L硼酸缓冲液的制备:准确称取2.47 g硼酸,加水约80 mL,用NaOH将pH调至10.2,用水定容至100 mL。
(2)衍生试剂的制备:称取0.1 g邻苯二甲醛(OPA),用1 mL乙腈溶解,然后加入130 μL巯基乙醇,用水定容至100 mL。
(3)样品柱前衍生:吸取衍生试剂10 μL,预处理后样品10 μL,混合均匀后在室温下反应90 s后进样。
标准曲线的配置:精确配制质量浓度为0.05、0.1、0.5、1、2、5、10 g/L的GABA标准样品,分别衍生进样后,以GABA的色谱峰面积为纵坐标,相应的质量浓度为横坐标,绘制标准工作曲线。
1.5.2 GAD相关基因序列扩增
菌体总DNA的提取采用天根细菌基因组DNA提取试剂盒,按照试剂盒说明书操作。使用软件Primer 5.0分别对GAD相关基因进行引物设计。本文所用引物如表1所示。
表1 本研究所用引物
Table 1 Primers used in this study

引物名称序列(5'→3')产物长度/bp参考文献L.brevisgadR-FL.brevisgadR-RCGTCGTCGATTCTCATGCT-TATCATTGCGGAAATGTAACT-GC123本研究L.brevisgadC-FL.brevisgadC-RCGAGCCTTTCCTTCCAGACCCGTAAGTGATCCGCAACC160本研究L.brevisgadB-FL.brevisgadB-RAGGCTAATCAAAAC-CTAGCGAACTATGTAGTAGCGC-CAAG264彭春龙等[18]L.brevisgadA-FL.brevis gadA-RGGACAATACGACGACT-TAGCCTTGAGCTCGGGTTCAATAA135WU等[19]L.plantarumgadB-FL.plantarumgadB-RAACCAGTCTTTGGTGCGCCTAACGGCTTCGGGTTCCATAT176彭春龙等[18]L.fermentumgadB-FL.fermentumgadB-RATTGGTTGGGTGCTGTGGTGGGTCCTTGGGCAGTGGGTAG385本研究16S rRNA-F16S rRNA-RACTCCTACGGGAGGCAGCAGATTACCGCGGCTGCTGG197本研究
PCR反应体系: 2×Taq MasterMix 12.5 μL,DNA模板 1 μL,上下游引物各1 μL,加ddH2O至25 μL。
PCR反应条件:94 ℃预变性5 min; 94 ℃变性 30 s, 57 ℃退火30 s,72 ℃延伸1 min,共30个循环; 72 ℃退火5 min。
1.5.3 GAD相关基因转录分析
1.5.3.1 乳杆菌RNA提取
菌株的培养同1.5.1.1分别取6,12,24和48 h的发酵液,于8 000 r/min 4 ℃离心10 min,取适量菌泥于灭酶后的研钵中,倒入适量液氮进行研磨,重复研磨3次,将粉末收集于无酶1.5 mL离心管中,加入1 mL TRIzol,混匀,置于4 ℃冰盒,以下操作均在4 ℃下完成。每个离心管加入1/5体积的三氯甲烷(提前4 ℃预冷),即200 μL,手摇振荡后,静置5 min,分层,12 000×g 4 ℃离心15 min,用枪头吸取最上层300 μL至新的无酶1.5 mL离心管中。加入300 μL等体积的异丙醇(提前4 ℃预冷),静置10 min,于12 000×g 4 ℃离心15 min,弃上清,可适当留底。加入1 mL 75%乙醇(DEPC水配制,提前4 ℃预冷)于12 000×g 4 ℃离心7 min,弃上清,可适当留底,重复1次,自然放置晾干,加入20 μL DEPC水,轻弹,混匀。取1 μL,测RNA浓度。
1.5.3.2 RNA的反转录
使用PrimeScriptTMRT试剂盒进行反转录,qRT-PCR所用引物见表1,其中16S rRNA基因作为内参基因。
RT-PCR体系为20 μL体系:1 μL模板;2 μL mix;17 μL无酶ddH2O。反应条件:37 ℃、15 min,85 ℃、5 s,4 ℃、10 min。qPCR反应条件:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火30 s,39个循环。
2 结果
2.1 不同乳杆菌产GABA能力研究
本文利用HPLC研究了由发酵食品与健康人群新鲜粪便筛选得到的8个种属68株乳杆菌,具有产GABA能力。从表2和图1可以看出,产GABA的菌株主要集中在L. brevis、L. plantarum这2个种属上,其中L. brevis发酵上清液的GABA含量可达5 000 mg/L左右, L. plantarum发酵上清液的GABA含量可达400 mg/L左右。而其余种属的菌株的发酵上清液并没有检测到GABA的存在。结果表明乳杆菌产GABA的能力具有种属特异性。同时,同一种属中有的菌株产GABA的能力高,而有的菌却基本不利用MSG产GABA。以L. brevis为例,L. brevis HY2-1、DL1-11、RS6-12均能产生较高水平的GABA,其中L. brevis DL1-11产量最高,为5 072 mg/L。但与此同时,L. brevis WX7-1、WX7-3、WX17-3的GABA的含量却很低。因此,我们认为同一种属的不同菌株产GABA能力也是不同的,具有种内特异性(表2)。
表2 不同乳杆菌产GABA能力
Table 2 Production of GABA by different lactobacilli
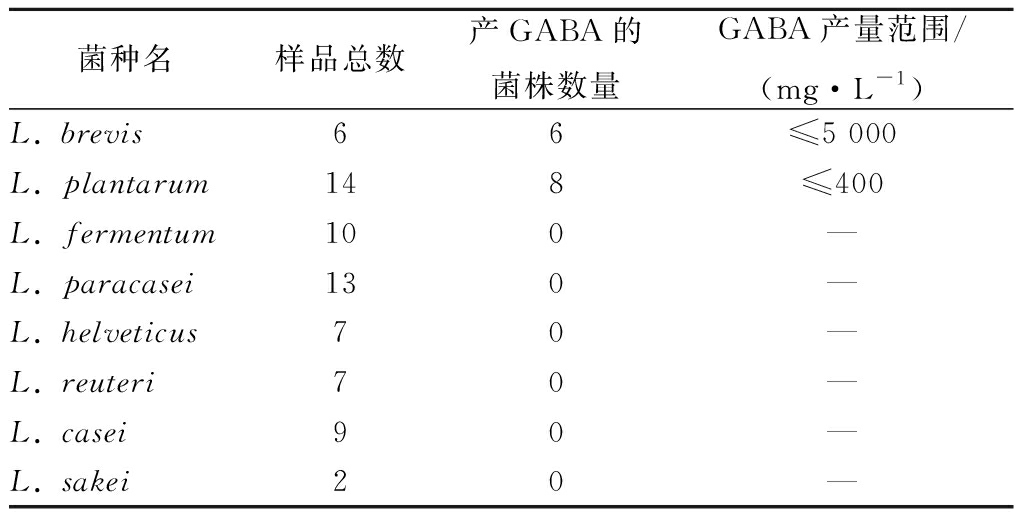
菌种名样品总数产GABA的菌株数量GABA产量范围/(mg·L-1)L. brevis66≤5 000L. plantarum148≤400L. fermentum100—L. paracasei130—L. helveticus70—L. reuteri70—L. casei90—L. sakei20—
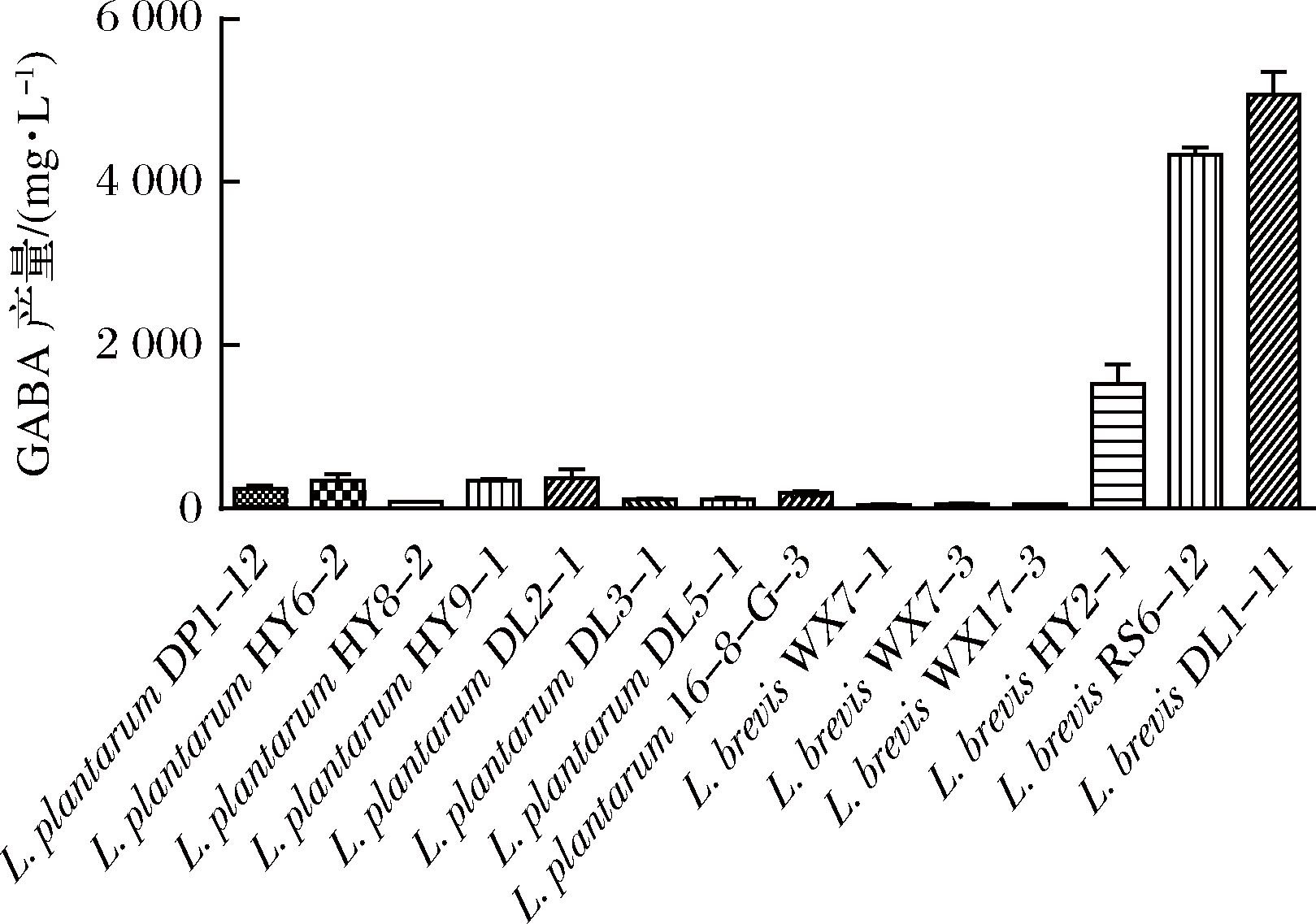
图1 不同植物乳杆菌和短乳杆菌产GABA能力图
Fig.1 Different L. plantarum and L. brevis produce GABA ability
2.2 乳杆菌GAD相关基因的基因组学调查
目前,已经报道了微生物中GABA产生主要是通过腐胺的降解(Puu和ADC途径)或谷氨酸的脱羧(GAD途径)这2种途径。然而,由于缺乏Puu和ADC途径,由腐胺降解产生的GABA在乳杆菌中并不常见[19]。gad操纵子主要由编码转录调节因子(gadR)、谷氨酸脱羧酶(gadA或gadB)和Glu/GABA反向转运蛋白(gadC)的基因组成。目前,已有超过1 000种乳酸菌已经测序并保藏在NCBI-GenBank数据库中。因此,对本研究所用的8种乳杆菌进行了基因组调查,以检测是否存在gad操纵子和编码谷氨酸脱羧酶的基因,结果如表3所示。
从表3可以看出,许多菌株携带gadA或gadB,但是gadR、gadC仅存在于有限种属的基因组中,表明它们具有种属特异性。其中,L. brevis与其他种类的乳杆菌有明显的不同:(1)具有完整的gad操纵子,(2)其基因组中有2个编码谷氨酸脱羧酶的基因(gadA和gadB)。虽然大多数L. plantarum拥有gadB基因,但在我们调查的菌株中都没有gadC。YUNES等[19]在L. plantarum 90sk的基因组发现了一种蛋白质,其与L. brevis 15f的gadC的氨基酸序列具有25%的同源性。该蛋白质在Inter-ProScan中注释为氨基酸跨膜转运蛋白,他们认为这种蛋白质在L. plantarum 90sk中可能发挥类似于Glu/GABA逆向转运蛋白的功能。尽管本研究中所用的L.reuteri均不能产GABA,但基因组学调查结果显示很多L.reuteri也含有gadB和gadC。有趣的是,SU等[20]通过基因组分析发现L.reuteri 100-23 谷氨酸代谢的基因簇中含有2个Glu/GABA反向转运蛋白(gadC1和gadC2),还含有编码的谷氨酰胺酶亚型3的基因gls3。因为谷氨酰胺可在谷氨酰胺酶的作用下生成谷氨酸,所以L.reuteri 100-23中这种特殊的谷氨酰胺脱酰胺和谷氨酸脱羧耦联形式更有助于菌体耐受酸胁迫,也具有高产GABA的潜力。此外,L. fermentum、L. reuteri在基因水平上显示其也有产GABA的潜力。对于L. paracasei、L. helveticus等种属来说,大多数菌株不含有gadB基因,这可能是本研究中上述种属的菌株不产GABA的根本原因。
表3 不同乳杆菌GAD基因分布情况
Table 3 Distribution of gad operon and genes encoding glutamate decarboxylases in the sequenced
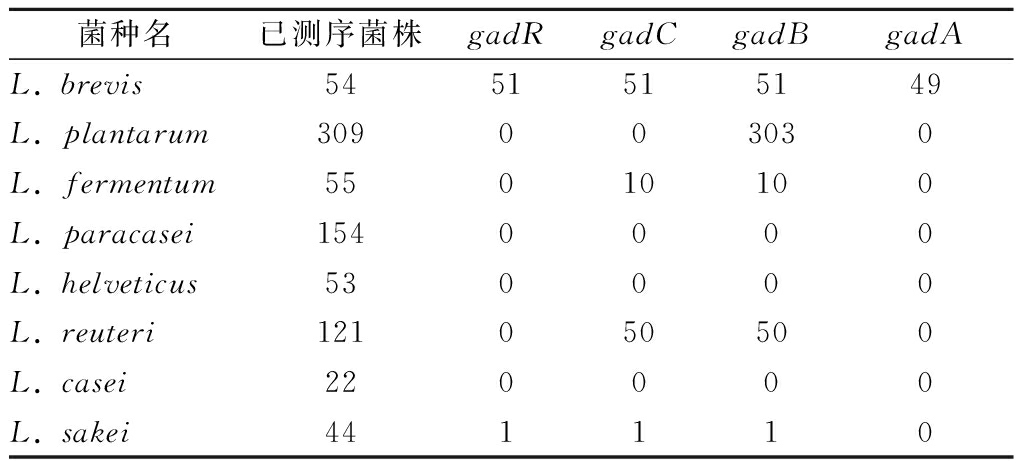
菌种名已测序菌株gadRgadCgadBgadAL. brevis5451515149L. plantarum309003030L. fermentum55010100L. paracasei1540000L. helveticus530000L. reuteri121050500L. casei220000L. sakei441110
注:基因组调查日期截止于2019年1月1日。
我们在上述拥有gadA或gadB基因的种属中各选取1株,作出其GAD系统相关基因分布图如图2-A所示, L.brevis gad操纵子同源性分析如图2-B所示。
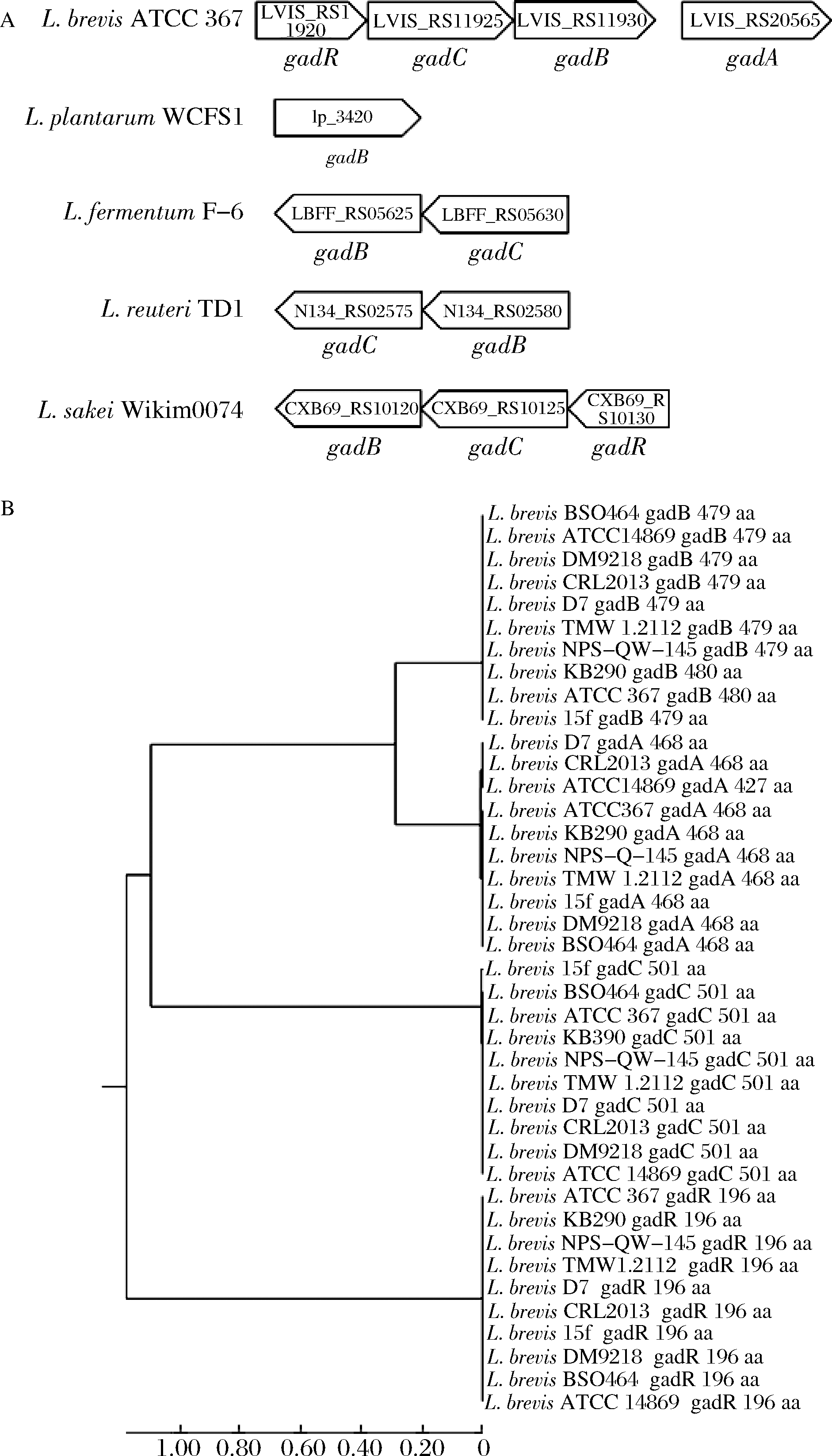
图2 乳杆菌GAD基因相对位置和短乳杆菌gad操纵子同源性分析图(A)和乳杆菌GAD基因相对位置(B)短乳杆菌gad操纵子氨基酸序列的系统进化树
Fig.2 Common distribution and arrangement of gad operon in Lactobacillus strains and Homology analysis of L.brevis GAD operon (A) Distribution of gad operon in Lactobacillus strains and (B)Phylogeny of amino acids sequences of four components in gad operon of L.brevis
可以看出,L. brevis基因组中gadR和gadC彼此接近可确保其及时共同调节gadB的转录和翻译以用于GABA生产,gadA基因位置与gadB位置较远且同源性不高,说明可能gadA与gadB的基因调控方式不同。但是gadA和gadB的共同存在可能是L. brevis高GABA合成能力的原因。
2.3 乳杆菌GAD相关基因序列扩增
为了研究本文所用乳杆菌是否拥有GAD相关基因,我们根据文献中或GenBank上不同种属已测序菌株GAD相关基因的保守区域,利用软件Primer 5.0设计种属特异性引物进行验证,结果如图3。
凝胶电泳结果显示,6株L. brevis均具有完整的GAD操纵子,在14株L. plantarum中也检测到8株拥有gadB基因,HPLC结果也表明6株没有gadB基因的菌株没有 GABA产生。而10株L. fermentum中有7株基因组中有gadC、gadB,但其发酵上清液中却没有检测到GABA。YUNES等[21]研究了21株L. fermentum产GABA能力和gadB的分布情况,发现其中只有9株含有gadB基因且所有L. fermentum均不能利用MSG产GABA。他认为这可能是由于L. fermentum 中gadB、gadC基因的突变或并未表达引起的。除了上述3种乳杆菌,其余5个种属的乳杆菌我们均未检测到gadB的存在。尽管有研究成功克隆了L. paracasei、L. sakei的gadB基因[22-23],但综合本研究的GABA产量、基因组学调查和gadB的基因的扩增结果来看,大多数L. paracasei、L. helveticus、L. casei和L. sakei是不含有gadB基因或者不具有产GABA能力的。
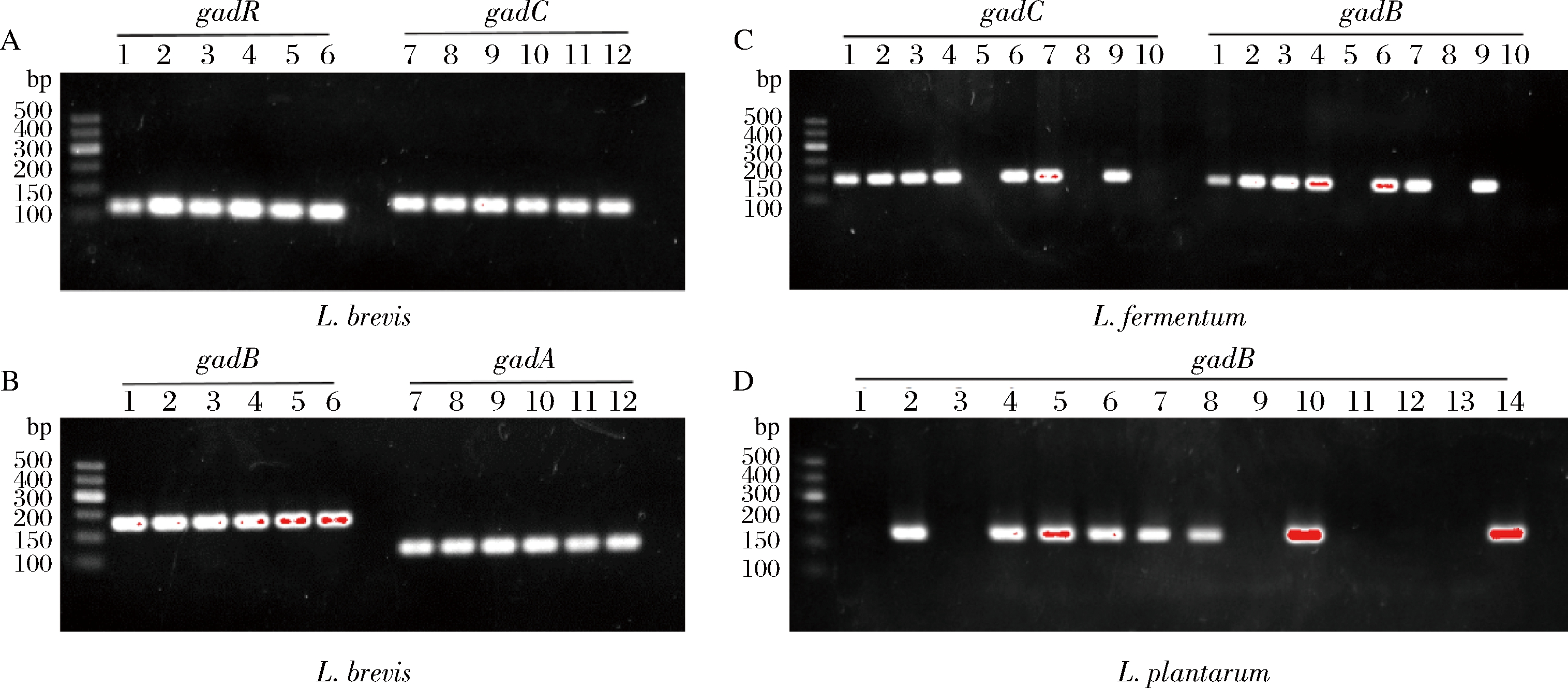
图3 (A)乳杆菌GAD基因凝胶电泳结果、(B)短乳杆菌、(C)发酵乳杆菌和(D)植物乳杆菌
Fig.3 PCR result of gad operon in (A)Lactobacillus strains,(B) L.brevis,(C) L. fermentum and(D) L. plantarum
2.4 L. brevis和L. plantarum GAD相关基因转录分析
为了研究L. brevis和L. plantarum中GAD相关基因转录水平的变化规律以及转录水平和GABA产量之间的关系,我们将可以产生GABA的菌株分别发酵6、12、24、48h并利用qRT-PCR进行相对定量,结果如图4。

图4 短乳杆菌不同生长时期GAD基因相对表达量变化(A)gadR、(B)gadC、(C)gadB和(D)gadA
Fig.4 Relative gene expression of of gad operon in L.brevis at different growth stages (A) gadR,(B)gadC,(C) gadB and (D) gadA
由于乳杆菌在生长过程中会产生乳酸等有机酸,菌体生长进入稳定期前,培养液的pH值下降很快[18]。而GAD系统是细菌对抗酸性环境的耐酸系统之一,可以维持自身代谢和细胞活力[24]。所以,L. brevis的gadB和gadC的表达量变化与菌体的生长时期相一致。随着菌体进入对数后期或稳定期,L. brevis为了耐受酸胁迫,gadB和gadC的表达量大幅增加。LI等[8]研究L. brevis NCL912在分批补料发酵过程中gadC和gadB基因表达规律时也发现了类似现象。从图4可以看出,L. brevis的gadC和gadB的相对表达量变化趋势相似,说明可能有gadC和gadB的共转录产物gadCB的存在。彭春龙等[18]设计了引物gad-P1和gad-P2,其中上游引物gad-P1位于gadC内并临近其3’端,下游引物gad-P2位于gadB内并临近其5’端,以菌体所提取mRNA的反转录cDNA为模板,对目的片段进行扩增,排除了基因组DNA污染的可能后,得到了约550 bp的目的片段,证明了gadCB的存在。在菌体不同生长时期,gadA的表达量始终处于一个平稳的状态,说明gadA可能与L. brevis耐酸系统无关。和6 h相比,6株L. brevis的gadR和gadA的变化量都很低,而gadC和gadB在12和24 h表达量迅速增加。短乳杆菌不同生长时期发酵液中GABA积累量变化如图5所示,可以看出在gadC和gadB高表达的期间,发酵液中GABA迅速积累,而在24~48 h,积累速度有所减缓,发酵液中GABA的积累速度与gadC和gadB表达量变化呈现一定的相关性,说明gadC和gadB为L. brevis产GABA的关键基因。
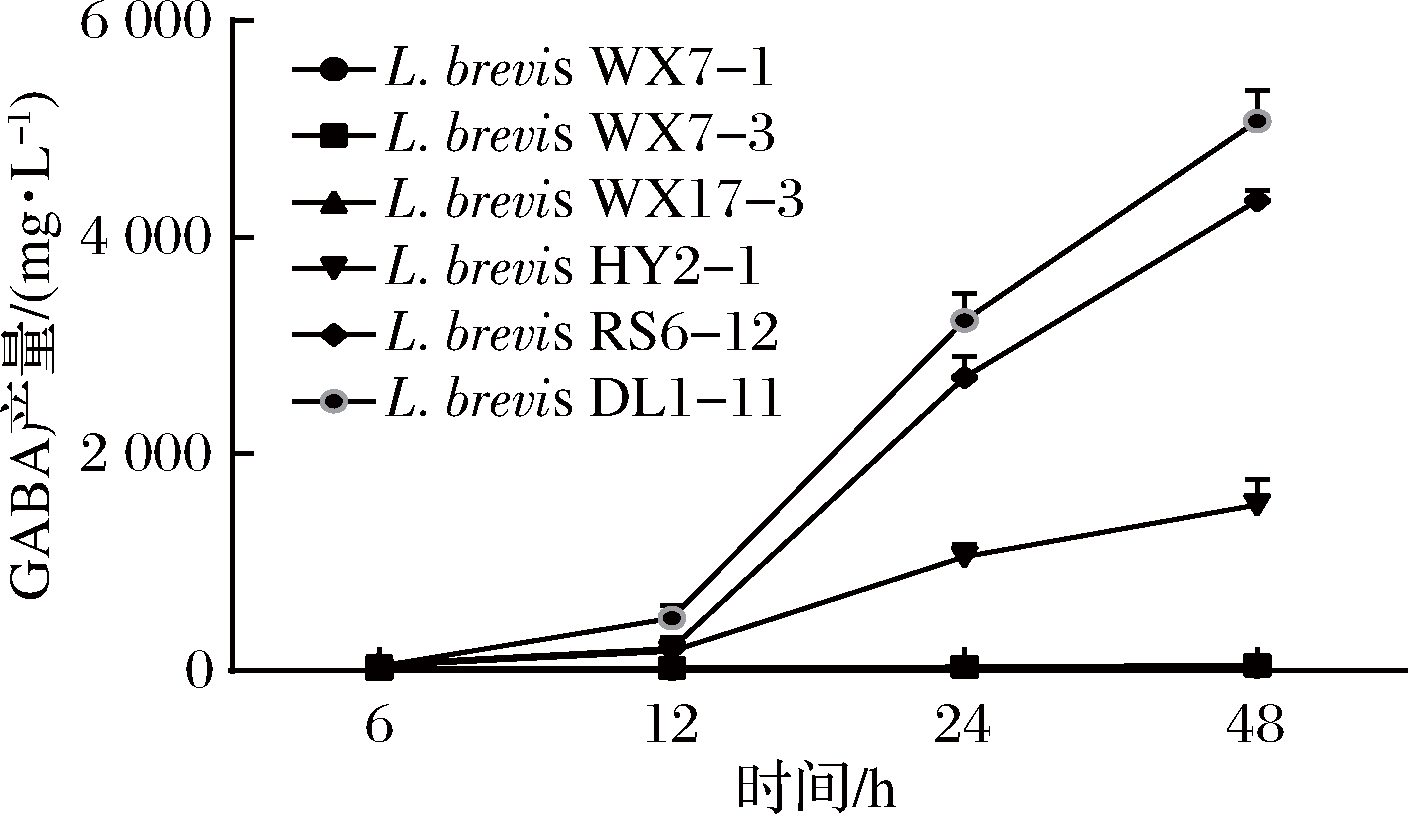
图5 短乳杆菌不同生长时期发酵液中GABA积累量变化
Fig.5 Changes of GABA accumulation in fermentation broth of L. brevis at different growth stages
本文以L. brevis WX7-1为对照,发现GABA产量较高的3株L. brevis的gadC和gadB的表达量显著地超过了低产的菌株(图6),说明L.brevis WX7-1、WX7-3、WX17-3这3株菌虽然拥有gadC和gadB基因,但其几乎不表达或表达量少,直接导致了低水平的GABA产量。值得注意的是,最高基因表达量的L. brevis RS6-12的GABA产量却没有L. brevis DL1-11的高,这可能是由于GAD酶活不同导致的,需要进一步研究。

图6 不同短乳杆菌GAD基因相对表达量比较(A)gadC和(B)gadB
Fig.6 Relative expression of GAD gene in different L. brevis strains (A) gadC and (B) gadB
L. plantarum菌体不同生长时期gadB相对表达量的结果和L. brevis类似,菌体由延滞期进入对数期,gadB表达量不断增高,在稳定期达到了高峰,进入稳定期后期,表达量开始下降(图7-A)。但以L. plantarum DL3-1为对照,gadB表达量高的菌株,GABA产量却不一定高,例如L. plantarum HY8-2的gadB表达量在4个时间点相对表达量都比较高,但是GABA的最终积累量却处于一个较低水平,说明本研究中的L. plantarumGABA产量和gadB的表达量之间的关联性没有那么密切,可能是因为除了基因表达量,L. plantarum的GABA产量还和其他一些因素有关,例如酶活性、PLP浓度和pH等[25]。
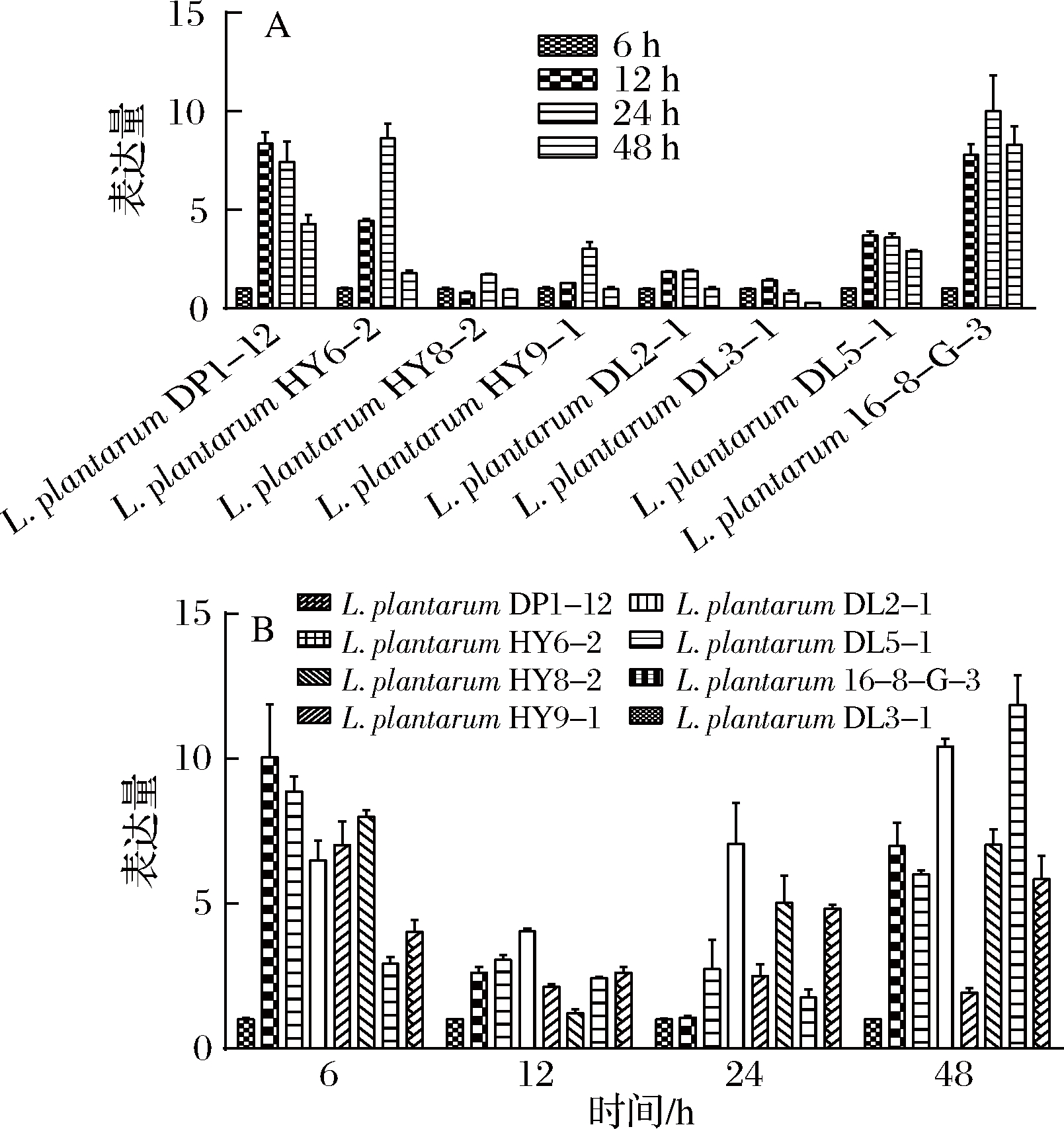
图7 植物乳杆菌gadB相对表达量(A)菌体不同生长时期相对表达量变化和(B)不同植物乳杆菌GAD基因相对表达量比较
Fig.7 Relative expression of gadB gene in L. plantarum (A) relative expression in different growth stages of L. plantarum and (B) comparison of relative expression of GAD gene in different L. plantarum strains
3 结论
根据本研究的GABA产量、基因组学调查和gadB的基因的扩增结果来看,可得到以下结论:(1)L. brevis、L. plantarum可作为产GABA菌株的主要筛选对象。(2)L. fermentum和L.reuteri的部分菌株在基因水平也有产GABA的潜力。(3)大多数L. paracasei、L. helveticus、L. casei和L. sakei不含有gadB基因或者不具有产GABA能力。L. brevis和L. plantarum GAD相关基因转录结果表明:(1)L. brevis的gadB和gadC的表达量变化与菌体的生长时期相一致,在对数后期或稳定前期达到高峰,且本研究的L. brevis高产GABA可能与gadC和gadB的高表达有关。(2)L. plantarum 的gadB的表达量也在对数后期或稳定前期达到高峰,但是GABA的产量和gadB的表达量之间相关性不强,可能受其他因素影响,有待进一步研究。
[1] BOWERY N G, SMART T G. GABA and glycine as neurotransmitters: A brief history[J]. Br J Pharmacol, 2006, 147 (Suppl 1): S109-S119.
[2] AKAMA K, KANETOU J, SHIMOSAKI S, et al. Seed-specific expression of truncated OsGAD2 produces GABA-enriched rice grains that influence a decrease in blood pressure in spontaneously hypertensive rats[J]. Transgenic Res, 2009, 18(6): 865-876.
[3] JUNG W Y, KIM S G, LEE J S, et al. Effect of feeding high gamma-aminobutyric acid-containing giant embryo black sticky rice (Oryza sativa L.) on anxiety-related behavior of C57BL/6 Mice[J]. J Med Food, 2017, 20(8): 777-781.
[4] KOBUCHI S, TANAKA R, SHINTANI T,et al. Mechanisms underlying the renoprotective effect of GABA against ischaemia/reperfusion-induced renal injury in rats[J]. Clin Exp Pharmacol Physiol, 2015, 42(3): 278-286.
[5] PINILLA L, GONZALEZ L C, TENA-SEMPERE M, et al. Cross-talk between excitatory and inhibitory amino acids in the regulation of growth hormone secretion in neonatal rats[J]. Neuroendocrinology, 2001, 73(1): 62-67.
[6] ABDOU A M, HIGASHIGUCHI S, HORIE K, et al. Relaxation and immunity enhancement effects of gamma-aminobutyric acid (GABA) administration in humans[J]. Biofactors, 2010, 26(3): 201-208.
[7] LIM H S, CHA I T, ROH S W, et al. Enhanced production of gamma-aminobutyric acid by optimizing culture conditions of Lactobacillus brevis HYE1 isolated from Kimchi, a Korean fermented food[J]. J Microbiol Biotechnol, 2017, 27(3): 450-459.
[8] LI Haixing, LI Wenming, LIU Xiaohua, et al. gadA gene locus in Lactobacillus brevis NCL912 and its expression during fed-batch fermentation[J]. FEMS Microbiol Lett, 2013, 349(2): 108-116.
[9] LYU Changjiang, ZHAO Weirui, PENG Chunlong, et al. Exploring the contributions of two glutamate decarboxylase isozymes in Lactobacillus brevis to acid resistance and gamma-aminobutyric acid production[J]. Microb Cell Fact, 2018, 17(1): 180.
[10] SHAN Y, MAN C X, HAN X, et al. Evaluation of improved gamma-aminobutyric acid production in yogurt using Lactobacillus plantarum NDC75017[J]. J Dairy Sci, 2015, 98(4): 2 138-2 149.
[11] YANG Taowei, RAO Zhiming, KIMANI B G, et al. Two-step production of gamma-aminobutyric acid from cassava powder using Corynebacterium glutamicum and Lactobacillus plantarum[J]. J Ind Microbiol Biotechnol, 2015, 42(8): 1 157-1 165.
[12] TAJABADI N, BARADARAN A, EBRAHIMPOUR A, et al. Overexpression and optimization of glutamate decarboxylase in Lactobacillus plantarum Taj-Apis362 for high gamma-aminobutyric acid production[J]. Microb Biotechnol, 2015, 8(4): 623-632.
[13] SIRAGUSA S, DE ANGELIS M, DI CAGNO R, et al. Synthesis of gamma-aminobutyric acid by lactic acid bacteria isolated from a variety of Italian cheeses[J]. Appl Environ Microbiol, 2007, 73(22): 7 283-7 290.
[14] FRANCIOSI E, CARAFA I, NARDIN T, et al. Biodiversity and gamma-aminobutyric acid production by lactic acid bacteria isolated from traditional alpine raw cow's milk cheeses[J]. Biomed Res Int, 2015: 625 740.
[15] RADHIKA D, BAJPAI V K, KWANG-HYUN B. Production of gaba (γ-aminobutyric acid) by microorganisms: A review[J]. Brazilian Journal of Microbiology, 2012, 43(4): 1 230-1 241.
[16] KRULWICH T A, SACHS G, PADAN E. Molecular aspects of bacterial pH sensing and homeostasis[J]. Nat Rev Microbiol, 2011, 9(5): 330-343.
[17] LYU Changjiang, ZHAO Weirui, HU Sheng, et al. Physiology-oriented engineering strategy to improve gamma-aminobutyrate production in Lactobacillus brevis[J]. J Agric Food Chem, 2017, 65(4): 858-866.
[18] 彭春龙, 黄俊,赵伟睿,等. 酸胁迫下短乳杆菌谷氨酸脱羧酶系统关键基因的表达及酶活性响应[J]. 高校化学工程学报, 2015(2): 359-365.
[19] WU Qinglong, TUN Heinming, LAW Yeesong, et al. Common distribution of gad operon in Lactobacillus brevis and its GadA contributes to efficient GABA synthesis toward cytosolic near-neutral pH[J]. Front Microbiol, 2017, 8: 206.
[20] SU M S, SCHLICHT S, GANZLE M G. Contribution of glutamate decarboxylase in Lactobacillus reuteri to acid resistance and persistence in sourdough fermentation[J]. Microb Cell Fact, 2011, 10 Suppl 1: S8.
[21] YUNES R A, POLUEKTOVA E U, DYACHKOVA M S, et al. GABA production and structure of gadB/gadC genes in Lactobacillus and Bifidobacterium strains from human microbiota[J]. Anaerobe, 2016, 42: 197-204.
[22] KOMATSUZAKI N, NAKAMURA T, KIMURA T, et al. Characterization of glutamate decarboxylase from a high gamma-aminobutyric acid (GABA)-producer, Lactobacillus paracasei[J]. Biosci Biotechnol Biochem, 2008, 72(2): 278-285.
[23] SA H D, PARK J Y, JEONG S J, et al. Characterization of glutamate decarboxylase (GAD) from Lactobacillus sakei A156 isolated from jeot-gal[J]. J Microbiol Biotechnol, 2015, 25(5): 696-703.
[24] DE BIASE D and PENNACCHIETTI E. Glutamate decarboxylase-dependent acid resistance in orally acquired bacteria: function, distribution and biomedical implications of the gadBC operon[J]. Mol Microbiol, 2012, 86(4): 770-786.
[25] 李理. 植物乳杆菌γ物氨基丁酸产量影响因素及代谢途径的研究[D]. 哈尔滨:东北农业大学,2015.