荞麦(Fagopyrum)是一种假谷物,分为甜荞麦(Fagopyrum esculentum)和苦荞麦(Fagopyrum tataricum)2类栽培种,此外还有一些野生荞麦品种[1]。甜荞麦起源于中国云南省西北部[2],苦荞麦起源于中国四川省西北部[3]。荞麦以其独特的营养和保健功能被誉为“五谷之王”,是一种“食药两用”的粮食珍品[4]。中国是荞麦生产大国,其中苦荞麦主要分布在四川、贵州、云南、山西、陕西、甘肃等省及江西、湖南和湖北等一些区域[5]。相对于甜荞麦来说,苦荞麦含有更为全面均衡的氨基酸,丰富的油酸、亚油酸、膳食纤维、多种维生素及微量元素等营养组分,还含有生物黄酮、高活性蛋白、抗性淀粉等丰富的生物活性成分[6],特别是含有其他谷类作物所不具有的黄酮类化合物,苦荞麦具有降血糖、降血脂、抗氧化、抗癌、抗高血压和降胆固醇等多种功能[7]。随着人们对健康及营养状况关注度增加,越来越重视苦荞的营养与药用价值,苦荞已成为一种重要的保健食品原料。
尽管苦荞含有较高的芦丁等促健康组分,但苦荞粉或苦荞产品通常因具有较强的苦味而限制了其在食品领域中的应用。在含有一定水分的情况下,苦荞麦籽粒内的芦丁水解酶被激活,将芦丁水解为具有苦味的槲皮素[5]。汽蒸、沸水煮及高温挤压处理均能有效抑制苦荞麦中槲皮素的形成,从而有效地保留苦荞麦中的芦丁[5,8]。相对于高温挤压及沸水煮,汽蒸处理操作简单且不会产生大量的废水,因而在苦荞脱苦处理方面具有一定的优势。但目前有关汽蒸处理对苦荞特性影响的研究还鲜有报道。本文主要研究汽蒸脱苦处理对苦荞麦粉特性和结构的影响,以便为汽蒸处理苦荞麦的开发与应用提供指导。
1 材料与设备
1.1 材料与试剂
苦荞麦产于2017年,由山西省农业科学院提供;淀粉总量检测试剂盒,爱尔兰Megazyme公司;光谱纯溴化钾,阿拉丁试剂公司;其他常规试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
SZ24S1不锈钢蒸锅,浙江苏泊尔股份有限公司; JYC-21ES55C 电磁炉,杭州九阳生活电器有限公司;JA12002 电子精密天平,瑞士梅特勒公司;UltraSan PRO色度仪,美国HunterLab公司;TechMaster快速黏度仪,瑞典Perten公司;Mastersizer 3000激光粒度仪,英国马尔文公司;DM2700P偏光显微镜,德国莱卡公司;Nexus 470傅里叶变换红外光谱仪,美国Thermo Nicolet公司;D8 Advance X-射线衍射仪,德国Bruker公司。
1.3 实验方法
1.3.1 荞麦汽蒸处理
当蒸锅产生蒸汽后,将适量荞麦置入蒸锅铺有纱布的蒸格上,经汽蒸处理10 min,然后室温下冷却,40 ℃烘箱干燥12 h。样品经除杂、脱壳和粉碎后过60目筛,于干燥器中室温保存备用。
1.3.2 常规成分分析
水分含量的测定参照GB/T 5009.3—2016;灰分含量的测定参照GB 5009.4—2010;粗蛋白含量测定参照GB 5009.5—2016,氮转换系数取6.25;粗脂肪含量的测定参照GB/T 5512—2008;总淀粉含量分析根据试剂盒说明书进行。
1.3.3 色度的分析
采用UltraScan PRO色度仪进行色度分析,L*表示白/黑比值(100=白色;0=黑色),b*表示黄/蓝比值(正值=黄色;负值=蓝色),a*表示红/绿比值(正值=红色;负值=绿色)。测试前用白色标准板校正色差仪,每组3个重复,结果取平均值±标准差。白度值(W)按公式(1)计算:
(1)
1.3.4 糊化特性
采用快速黏度仪(RVA)测定样品的糊化特性。分别称取2.5 g苦荞粉和25 g纯水。将样品测量罐置于RVA测试仪中,放入搅拌器。利用搅拌器上下混合均匀,使淀粉完全浸入水中后进行测试。测试程序如下:50 ℃保持90 s,0.2 ℃/s匀速升温,在95 ℃保持150 s,然后以0.2 ℃/s匀速降温,50 ℃保持90 s。测试前10 s,转速为960 r/min,然后维持为160 r/min。
1.3.5 粒径和表观形貌分析
采用激光粒度仪分析样品的粒径分布,获得大米粉样品的Dv10、Dv50、Dv90和分布跨度(Span)值,如式(2)所示。
Span=(Dv90-Dv10)/Dv50
(2)
Dv10和Dv90分别代表样品中小于该值的粒径体积占样品总体积的10%和90%;Dv50为中位径,即有50%的颗粒粒径低于此值。
采用偏光显微镜分析样品的颗粒形貌。样品用适量蒸馏水分散后涂布于载玻片上,盖上盖玻片后进行显微观察。
1.3.6 结晶特性
利用X-射线衍射仪(XRD)分析样品的结晶特征。操作电压40 kV,电流30 mA,以Cu作为靶。将样品置于样品架上,扫描速率8 °/min,收集衍射角2θ在4~50°的衍射数据。
1.3.7 傅里叶红外光谱(FTIR)
采用配备有Omnic操作软件的傅里叶变换红外光谱仪获得样品全波段扫描(400~4 000 cm-1)的FTIR谱图。将KBr晶体放入远红外快速干燥器中充分干燥,取2 mg待检测样品与200 mg KBr于研钵中,混合研磨,压片,将压片放入载片槽中。以空气为参比背景,背景扫描64次,分辨率2 cm-1,样品扫描64次。
1.3.8 数据处理
每个处理至少做3个独立的重复实验。利用SAS 8.0软件的t检验分析2组样品的差异性。用Origin 9.0进行图形绘制。
2 结果与分析
2.1 汽蒸对荞麦粉常规成分的影响
汽蒸处理对苦荞粉常规成分的影响结果如表1所示。荞麦粉的主要营养组分是淀粉,占总干物质质量的66%左右,第二大营养组分是蛋白质,占干物质质量的7%左右。汽蒸处理对苦荞麦的水分、粗脂肪及总淀粉含量影响不显著。汽蒸处理使苦荞麦粉的粗灰分含量和粗蛋白含量分别由对照的0.63%和7.05%增加到0.91%和7.42%,原因可能是处理过程中荞麦籽壳中的部分矿物质及含氮物质扩散到颖果内,进而使苦荞麦粉的粗灰分和粗蛋白含量增加。
表1 汽蒸和未处理苦荞麦常规成分含量 单位:%干基
Table 1 Compositions of streamed and untreated buckwheat flour

样品水分灰分粗脂肪粗蛋白总淀粉对照13.73±0.23a0.63±0.01b1.36±0.13a7.05±0.33b66.99±9.10a汽蒸13.51±0.06a0.91±0.02a1.32±0.05a7.42±0.08a66.71±4.00a
注:字母不同表示两者有显著差异(P<0.05)。下同。
2.2 汽蒸对荞麦粉色度的影响
汽蒸处理对苦荞粉颜色特征的影响如表2所示。汽蒸处理引起苦荞粉的亮度值(L*)和红色色调值(a*)降低,而白度值(W)和黄度值(b*)显著升高。一方面可能是汽蒸处理引起淀粉颗粒周围的蛋白质变性及脂质体熔融而分布在淀粉颗粒表面,进而使样品的亮度值降低;另一方面,汽蒸处理引起苦荞麦壳中的矿物质及色素类物质进入颖果内,进而使粉碎所得荞麦粉的黄度值升高。此外,导致多酚类化合物氧化的过氧化物酶失活能够改善粉状样品的色泽[9]。这可能是汽蒸处理引起苦荞麦粉的白度显著增加的原因。
表2 汽蒸处理对苦荞麦粉色度的影响
Table 2 Effects of streaming on color values of buckwheat flour

样品L*a*b*W对照76.98±0.01b0.91±0.02b10.28±0.13a73.54±0.27e汽蒸76.05±0.24a0.58±0.03a11.23±0.14b74.77±0.06b
2.3 汽蒸对苦荞麦粉糊化特性的影响
图1是汽蒸和对照苦荞麦粉的RVA曲线图。汽蒸和对照苦荞粉RVA曲线的总体变化趋势相似。升温初期,苦荞粉的黏度非常低且变化较小,当温度达到70 ℃左右时,淀粉颗粒无定型区受热开始膨胀及蛋白质水化,引起苦荞粉糊的黏度增加。随着加热温度进一步升高,淀粉颗粒结晶区开始熔融并发生胶凝化,直链淀粉从淀粉颗粒扩散到水中形成胶体溶液。直链淀粉与脂质复合体熔融及蛋白质变性伸展均会引起样品黏度迅速增加。当淀粉颗粒膨胀与剪切达到平衡时黏度达到峰值。在最高温度保持一段时间,淀粉颗粒崩解,黏度又降低。随温度下降,淀粉分子热运动减弱,淀粉颗粒和胶体网络收缩,流动阻力增大,导致黏度上升[10]。
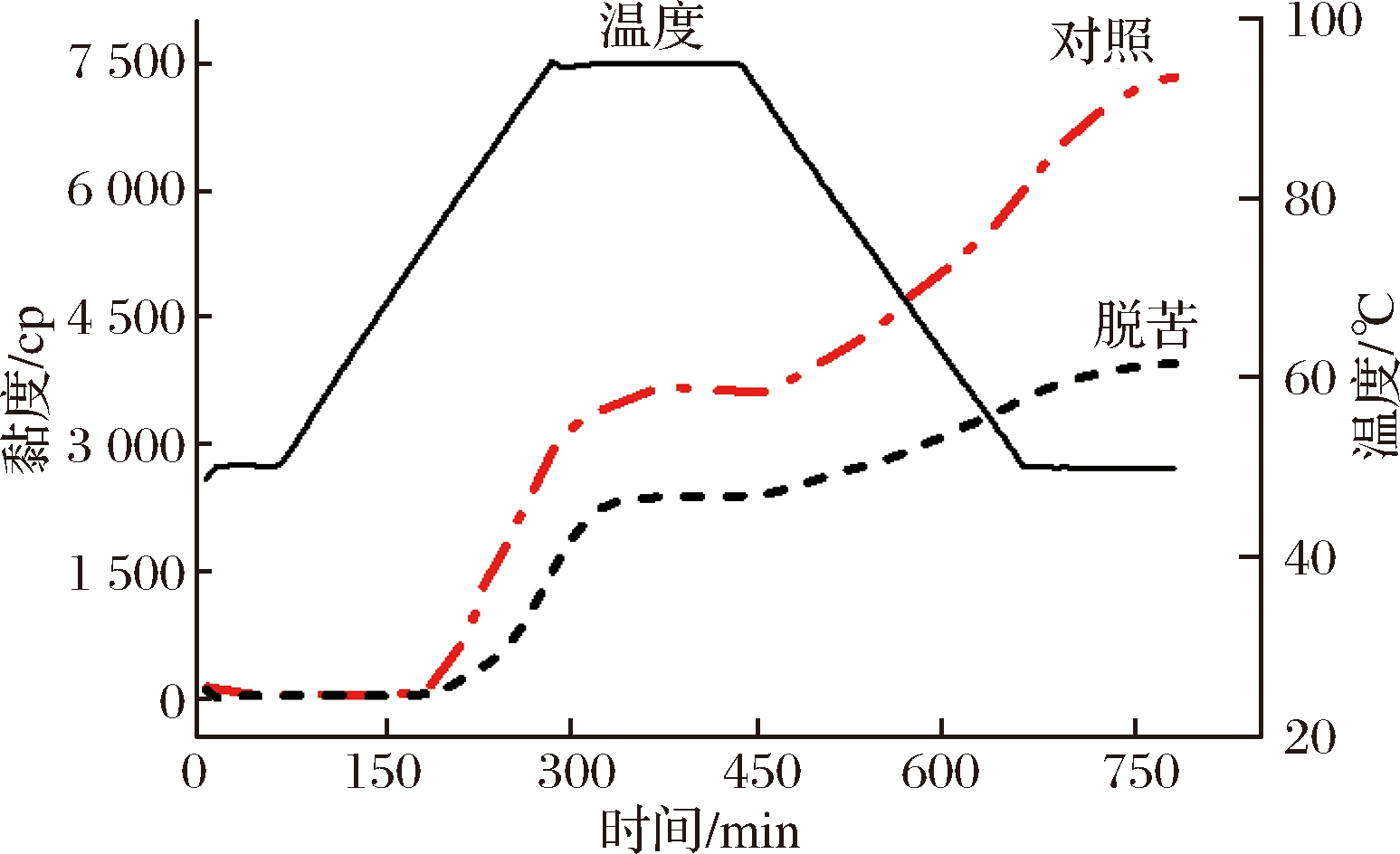
图1 荞麦粉RVA曲线图
Fig.1 RVA curve of buckwheat flour
汽蒸和对照苦荞粉的糊化特征参数如表3所示。汽蒸处理显著降低了苦荞粉的峰值黏度、回生值、崩解值和最终黏度,这可能与淀粉发生部分糊化有关,部分糊化的淀粉受热膨胀的幅度减小,进而引起糊化相关特征黏度参数减小。汽蒸处理使苦荞粉的糊化温度显著提高,可能是由于淀粉颗粒中无定型区淀粉分子在汽蒸过程中发生了交联,进而需要更多的热量使淀粉结构破坏形成凝胶糊[11]。样品糊化特征参数改变也可能与苦荞粉中蛋白、黄酮及脂质等组分发生变化有关[12]。回生值是冷却过程中淀粉分子重新定向和互作,其常用于表征淀粉糊的回生倾向性[13],回生值降低表明汽蒸处理提高了苦荞麦粉糊的稳定性。
表3 汽蒸和未处理苦荞麦粉的糊化特征参数
Table 3 Pasting properties of streamed and untreated buckwheat flour

样品峰值黏度/Pa·s低谷黏度/Pa·s崩解值/Pa·s最终黏度/Pa·s回生值/Pa·s糊化温度/℃对照3. 58±0.09b3. 51±0.09b0.07±0.01a7.21±0.189b3.70±0.11b74.28±0.07a汽蒸2.33±0.06a2.31±0.07a0.02±0.01b3.86±0.15a1.55±0.08a78.33±0.06b
2.4 汽蒸对苦荞粉粒径和表观形貌的影响
汽蒸处理及对照苦荞粉的粒径分布如图2所示。由图2可知,汽蒸处理和对照苦荞粉的粒径均表现为双峰分布,粒径在10 μm附近出现1个小峰,而在粒径100 μm附近出现1个大峰。汽蒸处理并未引起新峰出现,仅表现出大颗粒组分的比例略有增加。
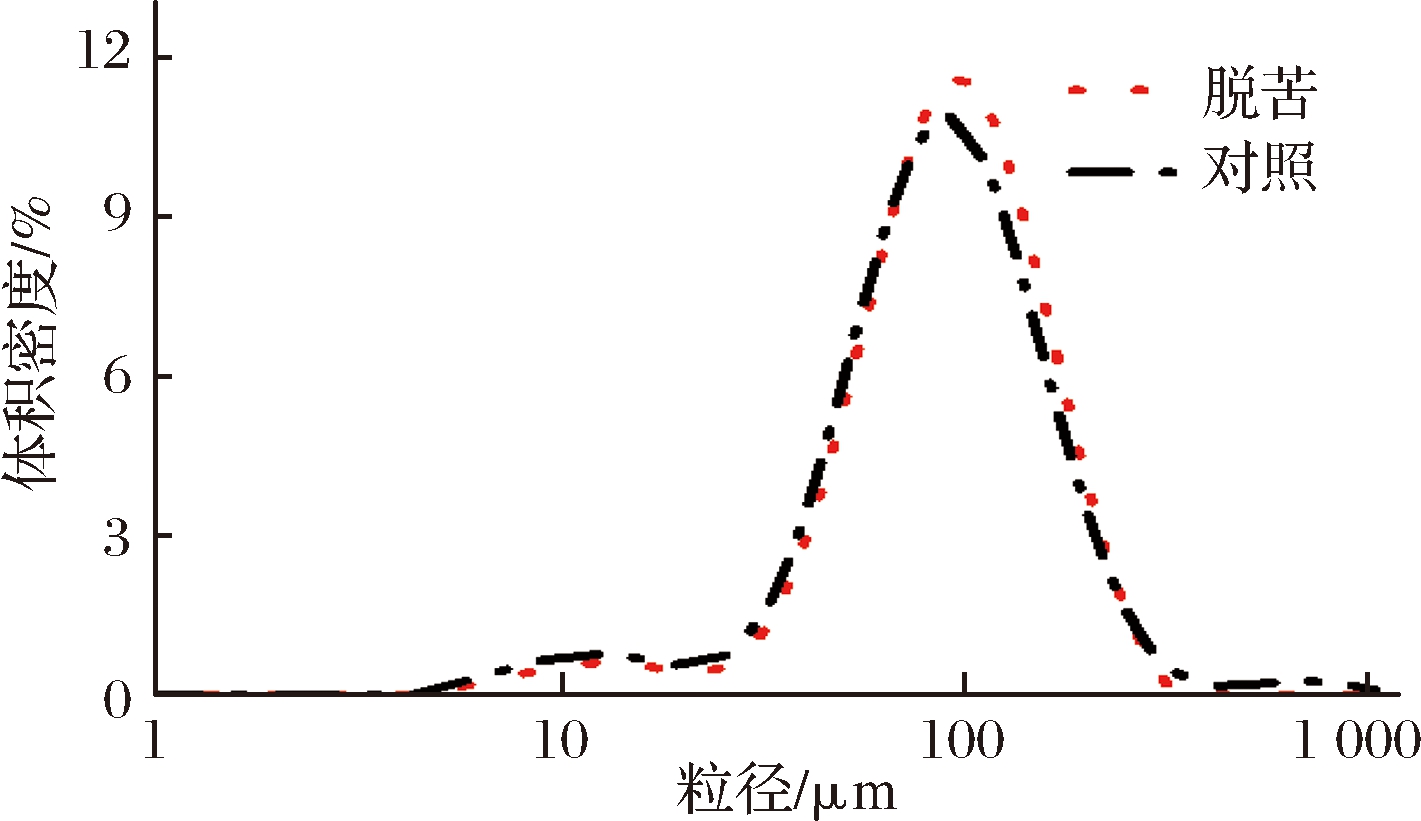
图2 汽蒸和对照苦荞粉的粒径分布图
Fig.2 Particle size distribution of streamed and untreated buckwheat flour
Dv10、Dv50、Dv90和Span等表征苦荞粉粒径大小分布特征的参数如表4所示。相对于未处理苦荞粉,汽蒸处理引起苦荞粉的粒径显著增加, Dv10、Dv50和Dv90分别增加15%、8%及9%左右,而汽蒸处理对苦荞粉的Span没有产生明显的影响。造成苦荞粉粒径增大的主要原因可能是汽蒸引起部分淀粉颗粒受热发生轻微的膨胀,进而使苦荞粉的表观粒径增大。此外,汽蒸处理导致部分淀粉颗粒发生黏连也可能是造成苦荞粉粒径增加的潜在因素。
表4 汽蒸处理对苦荞麦粉粒径参数的影响
Table 4 Effects of streaming on size characteristics of buckwheat flour

样品DV10 /μmDV50 /μmDV90 /μmSpan对照39.53±1.25a87.30±0.44a166.00±8.72a1.45±0.11a汽蒸45.23±1.89b94.30±2.82b181.67±15.01b1.45±0.11a
汽蒸和对照苦荞粉中淀粉的偏光显微镜观察结果如图3所示。苦荞淀粉表现出典型的正偏光十字特征。苦荞淀粉的粒径大小并不均一,主要存在两类不同大小的淀粉颗粒,小粒径淀粉颗粒的含量相对较低,该结果与激光粒度分析的结果相一致。汽蒸脱苦处理使淀粉颗粒的粒径略有增加,但未对苦荞淀粉晶体结构产生明显的破坏作用,该结果进一步证实汽蒸处理仅引起部分淀粉颗粒发生轻微的糊化。

图3 汽蒸和对照苦荞粉中淀粉的偏光显微镜图
Fig.3 Polarized light microscopy of in the starches of streamed and untreated buckwheat flour
2.5 汽蒸处理对苦荞粉结晶结构的影响
淀粉是苦荞粉的主要成分,占样品干物质的60%以上。苦荞粉中的淀粉主要以淀粉颗粒的形式存在,淀粉颗粒是由结晶区和无定型区组成的一种半结晶体系。结晶结构和非结晶结构在XRD谱图上表现为不同的衍射特征,非结晶区表现出弥散特征,结晶区呈现尖峰特征[14]。根据支链淀粉侧链组成双螺旋结构的不同,淀粉的晶体类型可以分为A、B和C三种类型[15]。A晶型的衍射角(2θ)在15.3°、17.0°、18.0°、19.7°、22.2°和23.4°附近出现特征衍射峰,B晶型2θ在5.5°、15.0°、17.0°、19.7°、22.2°和24.0°附近有特征衍射峰,C晶型是A晶型和B晶型的混合体,同时表现出A晶型和B晶型特征[16-17]。
由图4可知,汽蒸处理和对照苦荞粉中的淀粉均表现出典型的A型结晶特征,2θ在15°和23°附近出现明显的衍射峰,在17°和18°附近出现连在一起的双峰。2θ在20°附近有弱峰,表明样品中存在少量的V型结晶结构。样品的最强峰均出现在18°附近,汽蒸处理并未改变苦荞粉中淀粉的结晶类型。对照苦荞粉中淀粉的结晶度为34.55%,汽蒸脱苦处理苦荞粉中淀粉的结晶度为33.61%,汽蒸处理使淀粉结晶度略有降低,但t检验结果表明两者差异不显著。汽蒸处理对苦荞麦粉中淀粉的结晶结构影响较小,由于原料的水分含量较低(13.7%),短时间(10 min)高温处理并未引起淀粉发生凝胶化。有报道称,热处理淀粉发生凝胶化的程度与样品的含水量及温度有关,热处理并不能引起低水分含量淀粉发生凝胶化[18],汽蒸处理不会改变低水分含量大米等样品淀粉的结晶类型[19]。
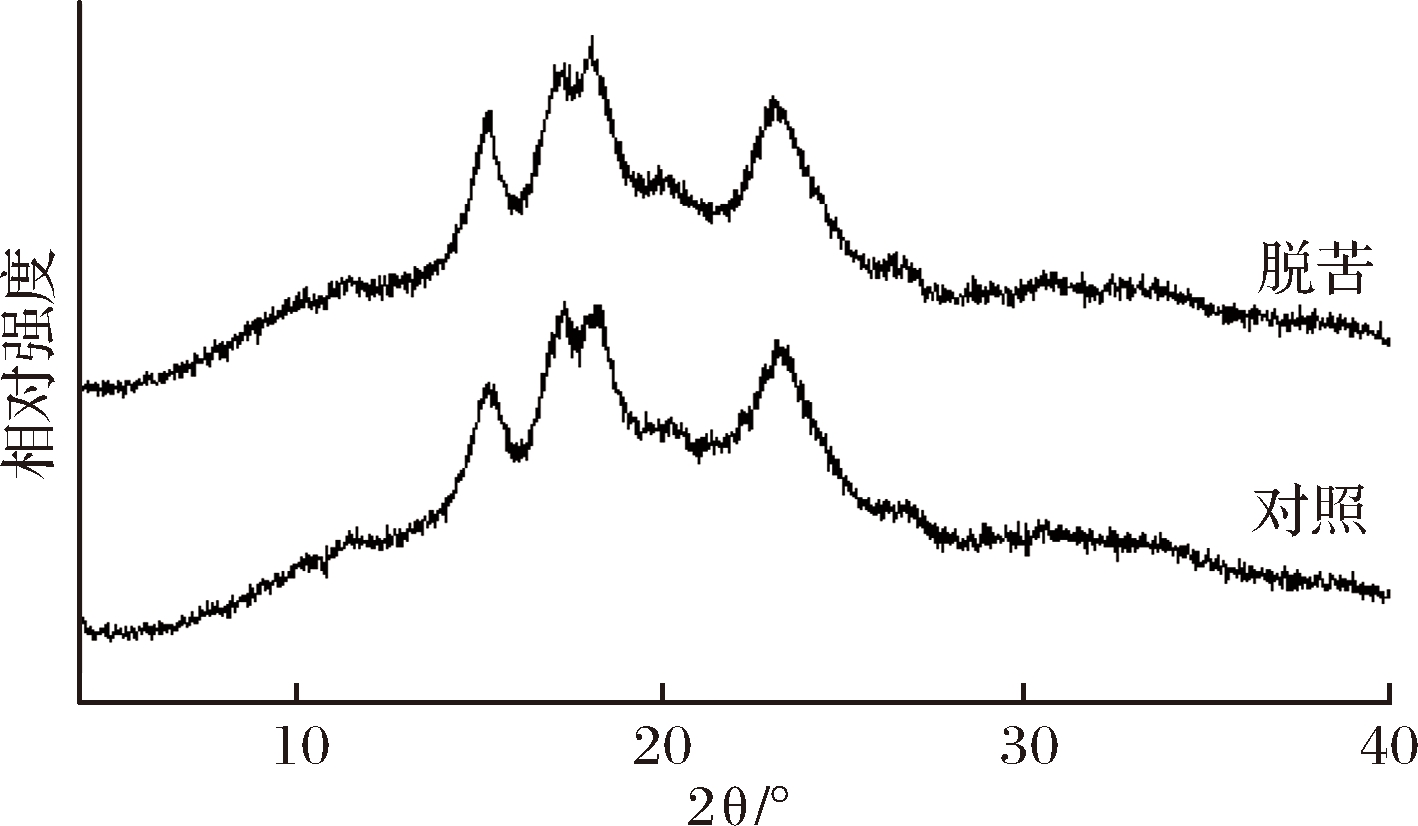
图4 汽蒸处理和对照苦荞粉的X射线衍射图
Fig.4 X-ray diffraction patterns of streamed and untreated buckwheat flour
2.6 汽蒸处理对苦荞粉FTIR的影响
对照和汽蒸脱苦处理苦荞粉的FTIR谱图的总体特征相似,如图5所示。2种样品在3 000~3 600 cm-1和2 800~3 000 cm-1波段均出现明显的吸收峰,其分别对应于O—H和C—H的伸缩振动[20]。在990~1 030 cm-1波段出现脱水葡萄糖残基C![]() O振动的典型峰[21]。从图5可以看出,汽蒸处理没有产生新峰,表明该处理并没有引起苦荞粉发生明显的化学变化,汽蒸处理主要引起苦荞的淀粉及蛋白质等组分的构象和结构发生改变。
O振动的典型峰[21]。从图5可以看出,汽蒸处理没有产生新峰,表明该处理并没有引起苦荞粉发生明显的化学变化,汽蒸处理主要引起苦荞的淀粉及蛋白质等组分的构象和结构发生改变。

图5 汽蒸处理和对照苦荞粉的FTIR图
Fig.5 FTIR patterns of streamed and untreated buckwheat flour
FTIR图谱中1 700~1 610 cm-1处和1 550~1 500 cm-1处波段分别为蛋白质酰胺Ⅰ带和酰胺Ⅱ带的典型谱峰。酰胺Ⅰ带是由蛋白质酰胺键的C![]() O伸缩振动及N—H振动引起的典型吸收特征,酰胺Ⅱ带是由C—N与耦合的N—H伸缩振动产生的吸收峰。酰胺Ⅰ带可用于研究蛋白质的二级结构特征[22]。参考文献[23],利用Peakfit软件对1 700~1 610 cm-1处波段进行分峰拟合,获得苦荞粉中蛋白质二级结构的信息,如表5所示。汽蒸处理引起苦荞粉中蛋白质的α-螺旋和β折叠结构含量降低,而无规则结构含量显著增加,β-转角结构的含量变化不显著。该结果表明汽蒸处理引起苦荞粉中蛋白质发生伸展解折叠,转变为较为松散的构象形态。
O伸缩振动及N—H振动引起的典型吸收特征,酰胺Ⅱ带是由C—N与耦合的N—H伸缩振动产生的吸收峰。酰胺Ⅰ带可用于研究蛋白质的二级结构特征[22]。参考文献[23],利用Peakfit软件对1 700~1 610 cm-1处波段进行分峰拟合,获得苦荞粉中蛋白质二级结构的信息,如表5所示。汽蒸处理引起苦荞粉中蛋白质的α-螺旋和β折叠结构含量降低,而无规则结构含量显著增加,β-转角结构的含量变化不显著。该结果表明汽蒸处理引起苦荞粉中蛋白质发生伸展解折叠,转变为较为松散的构象形态。
表5 汽蒸处理和对照苦荞粉中蛋白质二级结构及淀粉红外指数
Table 5 Secondary structures of protein (%) and ratio of A1047/A1022 of starch in streamed and untreated buckwheat flour

样品β-折叠/%无规卷曲/%α-螺旋/%β-转角/%A1047/A1022对照32.88±0.76b17.47±0.65a16.93±0.42b32.72±1.58a0.90±0.01b汽蒸27.93±2.51a27.0±2.20b13.88±1.46a31.17±1.78a0.87±0.00a
FTIR可用于检测淀粉分子结构的有序性,其包括淀粉结晶区以外的分子螺旋结构。波段900~1 300 cm-1区间的吸收带是由高度耦合的C![]() O和C—C振动产生,该区域对淀粉分子链的有序性和无定型构型的改变非常敏感。可用于分析淀粉的短程有序结构特征。1 047 cm-1和1 022 cm-1处的红外吸收分别显示淀粉结晶区和无定型区的结构特征,其比值可表征淀粉颗粒中短程有序结构与无定型结构的比例[24-25]。如表5所示,对照苦荞粉在1 047 cm-1与1 022 cm-1波数处吸收强度比值为0.90,汽蒸脱苦处理样品在该处吸收强度的比值为0.87,t检验结果表明两者的红外指数差异达到显著水平,表明汽蒸脱苦处理对苦荞粉中淀粉短程有序结构产生了破坏作用。汽蒸处理引起苦荞麦淀粉的短程有序结构略有降低,可能是引起无定型区内分子螺旋结构发生了无序化。
O和C—C振动产生,该区域对淀粉分子链的有序性和无定型构型的改变非常敏感。可用于分析淀粉的短程有序结构特征。1 047 cm-1和1 022 cm-1处的红外吸收分别显示淀粉结晶区和无定型区的结构特征,其比值可表征淀粉颗粒中短程有序结构与无定型结构的比例[24-25]。如表5所示,对照苦荞粉在1 047 cm-1与1 022 cm-1波数处吸收强度比值为0.90,汽蒸脱苦处理样品在该处吸收强度的比值为0.87,t检验结果表明两者的红外指数差异达到显著水平,表明汽蒸脱苦处理对苦荞粉中淀粉短程有序结构产生了破坏作用。汽蒸处理引起苦荞麦淀粉的短程有序结构略有降低,可能是引起无定型区内分子螺旋结构发生了无序化。
3 结论
汽蒸处理能够有效使芦丁糖苷水解酶失活,进而抑制芦丁水解为具有苦味的槲皮素且对苦荞粉的脂肪、淀粉等营养组分含量的影响不显著,由于种皮中的矿物质及含氮物质成分向颖果中扩散而显著增加了汽蒸苦荞粉的粗灰分和粗蛋白的含量。汽蒸处理改变了苦荞粉中淀粉无定型区分子链间的相互作用方式及引起蛋白质分子构象变得松散,进而导致苦荞粉糊化时的特征黏度参数均降低,而糊化温度升高。可能由于使引起多酚类化合物氧化的过氧化物酶失活,汽蒸处理苦荞粉的白度值升高。由于样品含水量较低及处理时间相对较短,汽蒸处理对苦荞粉中淀粉的结晶类型及结晶度的影响不显著,而无定型区淀粉分子螺旋结构受到一定程度的破坏,表现为淀粉的短程有序结构含量略有降低。红外光谱图谱中并未出现新的吸收峰,表明汽蒸处理未引起苦荞粉发生明显的化学变化。
[1] OHNISHI O. Search for the wild ancestor of buckwheat I. Description of new Fagopyrum (Polygonaceae) species and their distribution in China and the Himalayan hills[J]. Fagopyrum, 1998, 15: 18-28.
[2] OHNISHI O. Discovery of the wild ancestor of common buckwheat[J]. Fagopyrum, 1991, 11: 5-10.
[3] OHNISHI O. Search for the wild ancestor of buckwheat III. The wild ancestor of cultivated common buckwheat, and of tatary buckwheat[J]. Economic Botany, 1998, 52(2): 123-133.
[4] 朱云辉, 郭元新. 我国苦荞资源的开发利用研究进展[J]. 食品工业科技, 2014, 35(24):360-365.
[5] ZHOU Meiliang, KREFT I, WOO S H, et al. Molecular breeding and nutritional aspects of buckwheat[M]. San Diego: Academic Press, 2016.
[6] 王世霞, 刘珊, 李笑蕊,等. 甜荞麦与苦荞麦的营养及功能活性成分对比分析[J]. 食品工业科技, 2015, 36(21):78-82.
[7] 谭平艳, 郭皖北. 苦荞黄酮的生理功能及其作用机制的研究进展[J]. 医学综述, 2018, 24(8):1 627-1 632.
[8] LI Dan, LI Xiaoli, DING Xiaolin, et al. A process for preventing enzymatic degradation of rutin in tartary buckwheat (Fagopyrum tataricum Gaertn) Flour[J]. Food Science & Biotechnology, 2008, 17(1):118-122.
[9] ZHANF Nachuan, Gao Yuqi, Tong Litao, et al. Superheated steam processing improved the qualities of oats flour and noodles[J]. Journal of Cereal Science, 2018, 83: 96-100.
[10] FITZGERALD M A, MARTIN M, WARD R M, et al. Viscosity of rice flour: A rheological and biological study[J]. J Agr Food Chem, 2003, 51(8): 2 295-2 299.
[11] ELESSANDRA da R Z, DIAS A R G. Impact of heat-moisture treatment and annealing in starches: A review[J]. Carbohydrate Polymers, 2011, 83(2): 317-328.
[12] SUN Xiaojing, LI Wenhao, HU Yayun, et al. Comparison of pregelatinization methods on physicochemical, functional and structural properties of tartary buckwheat flour and noodle quality[J]. Journal of Cereal Science, 2018, 80: 63-71.
[13] COZZOLINO D. The use of the rapid visco analyser (RVA) in breeding and selection of cereals[J]. Journal of Cereal Science, 2016, 70:282-290.
[14] 韩文芳, 熊善柏, 李江涛,等. 糯米淀粉的晶体性质和糊化特性[J]. 中国粮油学报, 2015, 30(8):48-53.
[15] ZHANG Binjia, CHEN Ling, LI Xiaoxi, et al. Understanding the multi-scale structure and functional properties of starch modulated by glow-plasma: A structure-functionality relationship[J]. Food Hydrocolloids, 2015, 50: 228-236.
[16] XU Xiaojuan, CHEN Yongzhi, LUO Zhigang, et al. Different variations in structures of A-and B-type starches subjected to microwave treatment and their relationships with digestibility[J]. LWT, 2019, 99: 179-187.
[17] HE Wei, WEI Cunxu. Progress in C-type starches from different plant sources[J]. Food Hydrocolloids, 2017, 73: 162-175.
[18] ZAVAREZE E D R , DIAS A R G. Impact of heat-moisture treatment and annealing in starches: A review[J]. Carbohydrate Polymers, 2011, 83(2):317-328.
[19] WU Jianyong, MCCLEMENTS D J, CHEN Jun, et al. Improvement in storage stability of lightly milled rice using superheated steam processing[J]. Journal of Cereal Science, 2016, 71:130-137.
[20] KIZILl R, IRUDAYARAJ J. Discrimination of irradiated starch gels using FT-Raman spectroscopy and chemometrics[J]. J Agr Food Chem, 2006, 54(1): 13-18
[21] FANG Jianmin, FOWLER P A, TOMKINSON J, et al. The preparation and characterisation of a series of chemically modified potato starches[J]. Carbohydrate Polymers, 2002, 47(3): 245-252.
[22] LINDON J C, TRANTER G E, KOPPENAAL D. Encyclopedia of spectroscopy and spectrometry[M]. San Diego: Academic Press, 2016.
[23] 贾丹. 青鱼肌肉蛋白质及其凝胶特性的研究[D]. 武汉:华中农业大学, 2016.
[24] SHRESTHA A K, NG C S, LOPEZ-RUBIO A, et al. Enzyme resistance and structural organization in extruded high amylose maize starch[J]. Carbohydrate Polymers, 2010, 80(3): 699-710.
[25] BIE Pingping, PU Huayin, ZHANG Binjia, et al. Structural characteristics and rheological properties of plasma-treated starch[J]. Innovative food science & emerging technologies, 2016, 34: 196-204.