直链麦芽低聚糖是一种特殊的功能性淀粉糖,它通常是指由3~10个葡萄糖单元以α-1,4-糖苷键连接而成的寡糖聚合体,是一种集营养与功能于一体的新型淀粉糖[1]。直链麦芽低聚糖具有极易溶于水、黏度高、甜度低、保湿能力强而吸湿性小等特性,食品加工适应性良好,在改善食品质地和风味以及延长面包和速冻食品保质期方面有较好的应用[1-2];同时,直链麦芽低聚糖不会引起餐后血糖的迅速升高,可以为人体缓慢持续地提供能量,赋予其独特的生理功效,在特殊疾病患者的食疗和功能性运动运料的开发中有较好的应用前景[1]。据报道,直链麦芽低聚糖(麦芽三糖到麦芽六糖)还可以作为磷酸寡糖合成的前体,促进机体对钙的吸收[3];直链麦芽六糖也可参与治疗细菌感染疾病,有效消除多药耐药性细菌对人体的威胁[4]。直链麦芽低聚糖生成酶(maltooligosaccharide-forming amylase, MFA酶)是生产直链麦芽低聚糖的主要酶制剂,可水解淀粉中的α-1,4-糖苷键生成直链麦芽低聚糖。另外,在传统的淀粉糖生产工艺中,玉米淀粉的质量分数一般控制在20%~35%[5],在淀粉酶解过程中只有极少部分的水被消耗[6],这导致在淀粉糖生产过程中产生大量的能耗和水耗,以及大量的工业废水[7]。解决上述问题最直接的方法是提高淀粉的初始浓度[8]。杨倩雯和曲世洋等[9-10]研究了底物浓度对酶法生产麦芽糖和葡萄糖的影响,而底物浓度对MFA酶酶解玉米淀粉生产直链麦芽低聚糖的研究还未见报道。目前美国、日本等少数发达国家已实现直链麦芽低聚糖的工业化生产,但国内未见相关产业的发展[11]。因此,有必要对酶法生产直链麦芽低聚糖的工艺进行深入研究,并探究玉米淀粉初始浓度对酶法制备直链麦芽低聚糖的影响。
本实验室已成功构建了来源于嗜热脂肪芽孢杆菌(Bacillus stearothermophilus STB04)的直链麦芽低聚糖生成酶(Bst-MFA酶) (GenBank: AIV43245.1)的枯草芽孢杆菌(Bacillus subtilis WB600)表达系统,并研究了Bst-MFA酶酶解低质量分数(5%)玉米淀粉的产物合成情况[12],以高质量分数玉米淀粉为底物的酶解产物合成情况还未研究。因此,本研究以不同质量分数玉米淀粉为底物,探究底物初始质量分数对Bst-MFA酶酶解玉米淀粉生产直链麦芽低聚糖的影响,并探究相关机理。
1 材料与方法
1.1 材料与试剂
玉米淀粉(水分含量11.85%),购于山东大宗生物开发股份有限公司;直链麦芽低聚糖生成酶(Bst-MFA酶)为本实验室发酵所得;酵母粉和蛋白胨购于英国Oxoid公司;麦芽三糖(G3)、麦芽四糖(G4)、麦芽五糖(G5)、麦芽六糖(G6)、麦芽七糖(G7)标准品,购于上海惠诚生物科技有限公司;其他试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
A560型双光束紫外可见分光光度计,上海翱艺仪器有限公司;RW 20 digital Ika搅拌器,德国IKA集团;HPAEC-PAD配有脉冲电流检测器的高效阴离子交换色谱,美国Thermo Scientific有限公司;Viscograph-PT100型布拉班德黏度仪,德国Brabender公司;低场核磁共振成像分析仪,苏州纽迈分析仪器股份有限公司;RVA快速旋转黏度仪,澳大利亚Newport Scientific公司。
1.3 实验方法
1.3.1 Bst-MFA酶酶活的测定
Bst-MFA酶酶活的测定采用3,5-二硝基水杨酸(DNS)法[13]。以C6H8O7-Na2HPO4缓冲液(10 mmol/L,pH 5.0)配制的1%可溶性淀粉溶液作为底物,在0.90 mL底物中加入100 μL稀释后的酶液,60 ℃下反应15 min,加入1.0 mL DNS溶液终止反应,沸水浴中显色5 min后立即冰浴冷却,于540 nm下测定吸光值,根据葡萄糖标准曲线计算出体系中还原糖含量。以每分钟生成1 μmol还原糖(以葡萄糖计)所需的酶量定义为1个酶活单位(U)。
1.3.2 玉米淀粉的酶解
配制质量分数分别为10%、20%、30%、35%、40%、45%和50%(以干基计)的玉米淀粉200 g,用0.1 mol/L的盐酸调节pH至5.0,60 ℃保温15 min,按底物干基加入Bst-MFA酶 20 U/g,以2.0 ℃/min的速率从60 ℃升温至90 ℃,保温30 min,然后以10 ℃/min的速率将温度降为65 ℃,并开始计时,定时取样测定相关指标。
1.3.3 Bst-MFA酶酶解玉米淀粉产物分析
取一定质量酶解后的样品,沸水浴30 min灭酶[14]、定容、离心(10 000 r/min,10 min),上清液过0.22 μm水系滤膜,稀释一定倍数后用高效阴离子交换色谱-脉冲安培法(high performance anion-exchange chramatograph-amperemetric detection, HPAEC-PAD)分析产物组成[15]。
HPAEC-PAD的分析条件为:超纯水、0.25 mol/L NaOH、1 mol/L NaAc溶液三元梯度淋洗,色谱柱CarboPac PA 200,流速0.5 mL/min,柱温35 ℃,进样体积10 μL。分析指标为直链麦芽低聚糖含量、产率和G1~G7(G1和G2分别表示葡萄糖和麦芽糖)中各糖组分的质量分数(其他组分由于缺乏相应的标准品,未做定量分析),按公式(1)、(2)和(3)计算:
(1)
式中:G,酶解液中目的产物的含量,mg/g;ρ1,酶解液中目的产物的质量浓度,mg/mL;ω(淀粉),淀粉的质量分数;m,取样质量,g。
(2)
式中:Y,酶解液中目的产物的产率,%;m1,取样质量,mg。
(3)
式中:ω,酶解液中目的产物的质量分数,%;c,酶解液中G1~G7的质量浓度,mg/mL。
1.3.4 液化过程黏度的测定
参考刘文静[16]的实验方法,并做部分修改。配制质量分数分别为10%、20%、30%、35%、40%、45%和50%(以干基计)的玉米淀粉300 g,用0.1 mol/L的盐酸调节pH至5.0,60 ℃保温15 min,加入Bst-MFA酶 20 U/g干基玉米淀粉,搅拌均匀后倒入布拉班德黏度仪的测量杯中,测定程序为:以2.0 ℃/min的速率从60 ℃升温至90 ℃,保温30 min,再以3.5 ℃/min的速率降温至65 ℃,保温30 min,转速为75 r/min,得到一条玉米淀粉液化过程黏度曲线。
1.3.5 碘蓝值的测定
碘蓝值的测定参考BIJTTEBIER[17]的方法并做部分修改。配制质量分数分别为10%、20%、30%、35%、40%、45%和50%(以干基计)的玉米淀粉200 g,用0.1 mol/L的盐酸调节pH至5.0,60 ℃保温15 min,按底物干基加入Bst-MFA酶 20 U/g,开始反应计时,以2.0 ℃/min的速率从60 ℃升温至90 ℃,取酶解不同时间的样品,沸水浴30 min灭酶,用去离子水定容至100 mL。
取适量定容后的样品于离心管中,用去离子水补足4.75 mL,加入0.25 mL碘液(0.2%KI和0.02%I2)充分混匀后避光稳定15 min,于620 nm下测定吸光度,以糊化后原淀粉的吸光度(单位质量)为100%计算样品的相对碘蓝值。
1.3.6 玉米淀粉水分子运动性分析
用低场核磁共振技术[18]测定不同浓度玉米淀粉糊化过程中不同结合状态水分子的运动特性。配制质量分数分别为10%、20%、30%、35%、40%、45%和50%(以干基计)的玉米淀粉,取一定体积移入玻璃样品瓶内,搅拌均匀后放入恒温水浴锅,以2 ℃/min的速率升温至90 ℃,并保温30 min,将制备好的样品用低场核磁共振成像分析仪中的硬脉冲回波序列CPMG(carr-purcell-meiboom-gillsequence)测定不同结合状态水分子的运动特性。
低场核磁共振技术分析条件参考XU[19]的方法,并做适当修改,具体为:25 mm直径射频线圈,磁场强度0.28 T,共振频率21 MHz,信号强度2,重复采样等待时间3 500 ms,重复采样次数2,回波个数9 000,回波时间1.000 ms,通过反演可得出样品中不同结合状态水分的横向弛豫时间T21和T22。
1.3.7 糖化过程黏度的测定
取一定量酶解不同时间的样品于RVA铝盒中,按设定程序立刻测定样品的黏度,得到糖化过程中样品的黏度变化曲线。
测定程序:铝盒温度65 ℃,转速300 r/min,测定时间3 min。
1.3.8 数据处理
实验结果为3次独立实验的平均值,用平均值和标准偏差表示。采用Origin Pro软件分析数据和作图,用SPSS软件(单因素方差分析、Student-Newman-Keuls程序)进行统计学分析(P<0.05)。
2 结果与讨论
2.1 底物质量分数对直链麦芽低聚糖含量和产率的影响
本研究所用Bst-MFA酶是一种可以水解淀粉生成以G5和G6为主产物的直链麦芽低聚糖生成酶。本实验以不同质量分数(10%~50%)的玉米淀粉为底物,研究底物浓度对酶解的影响,而酶解产物中直链麦芽低聚糖含量和产率是衡量酶解作用的重要指标,不同质量分数玉米淀粉酶解过程中G1~G7含量的变化如图1所示。随着底物质量分数的增加,反应过程中G1~G7的含量呈现逐渐增加的趋势(图1-a)。对于不同底物质量分数的反应体系,酶解24 h时,G1~G7的含量达到最高,当底物质量分数为10%时,G1~G7的含量为91.25 mg/g;底物质量分数为20%~45%时,G1~G7的含量依次增加,当底物质量分数为45%时,体系中G1~G7的含量达到最大,为344.47 mg/g,相当于10%底物质量分数时的3.7倍,这说明提高玉米淀粉的初始质量分数可以增加反应体系中直链麦芽低聚糖的固形物含量,达到降低能耗的目的。然而,继续增加底物质量分数至50%时,反应体系中直链麦芽低聚糖的含量不再继续增加。
Bst-MFA酶酶解不同浓度玉米淀粉时主产物G5和G6的含量变化趋势(图1-b)与G1~G7相同,酶解24 h时G5和G6的含量已达到最大,当底物质量分数为10%时,体系中G5和G6的含量为45.02 mg/g;增加底物质量分数至30%时,体系中G5和G6的含量明显高于低质量分数体系;继续提高玉米淀粉质量分数至45%时,G5和G6的含量达到最大,为192.33 mg/g,相当于10%底物质量分数时G5和G6含量的4.27倍,高于相同底物质量分数下G1~G7含量的增加程度,可见提高玉米淀粉的初始质量分数可以明显增加反应体系中主产物G5和G6的含量。

图1 不同质量分数玉米淀粉反应过程中直链麦芽低聚糖含量的变化曲线
Fig.1 Changes of malt oligosaccharide content during the reaction at different concentrations of corn starch
Bst-MFA酶酶解不同质量分数玉米淀粉24 h时的直链麦芽低聚糖产率如图2所示。

图2 不同浓度玉米淀粉反应24 h时的直链麦芽低聚糖产率
Fig.2 Malt oligosaccharide yield produced by different concentrations corn starch at 24 h
随着玉米淀粉质量分数的增加,G1~G7的产率和主产物G5和G6的产率均逐渐降低。当玉米淀粉质量分数为10%时,G1~G7的产率为91.25%,说明体系中玉米淀粉几乎全部转化为G1~G7,主产物G5和G6的产率也高达54.95%;随着玉米淀粉质量分数的增加,G1~G7的产率逐渐降低,底物质量分数增加至45%及以上时,G1~G7的产率明显降低,底物质量分数为50%时,G1~G7的产率只有68.47%,主产物G5和G6的产率也仅为36.56%,相比10%底物质量分数时降低了33.47%。
2.2 底物浓度对直链麦芽低聚糖产物组成的影响
不同浓度玉米淀粉酶解24 h时产物中直链麦芽低聚糖组成如表1所示。玉米淀粉经Bst-MFA酶酶解后,产物以G5和G6为主,体系中还存在部分G2和G3,以及少量的G1、G4和G7。玉米淀粉质量分数由10%增加到45%的过程中,G1~G4的质量分数无显著性差异,主产物G5和G6的质量分数呈现逐渐降低的趋势,而G7的质量分数逐渐增加;当玉米淀粉质量分数继续增大至50%时,G1~G7中各小分子糖的质量分数与45%质量分数体系无显著性差异,但G1~G7和主产物G5、G6的产率明显降低。可见,随着底物质量分数的提高,Bst-MFA酶对玉米淀粉的酶解程度降低,导致主产物质量分数下降以及聚合度较大的线性低聚糖的增多。一方面,随着底物质量分数的提高,体系黏度增大导致Bst-MFA酶对淀粉酶解不充分;另一方面,Bst-MFA酶的作用方式在不同质量分数底物下可能存在差异,因此,有必要进一步探究主产物质量分数降低的原因。
表1 底物质量分数对直链麦芽低聚糖产物组成的影响
Table 1 Effect of the substrate concentration on product composition of malt oligosaccharide

底物质量分数/%各组分的质量分数/%G1G2G3G4G5G6G7103.03±0.07a11.46±0.30a15.25±0.20a7.05±0.18a28.46±0.46d33.87±0.11c0.88±0.26a203.15±0.08a12.09±0.32a15.59±0.11a6.72±0.26a27.29±0.48d33.44±0.09b1.72±0.18b302.94±0.13a11.81±0.10a15.57±0.07a6.53±0.11a25.38±0.17c33.76±0.20c4.01±0.09c352.71±0.20a11.61±0.18a15.57±0.05a6.37±0.09a23.65±0.46b33.46±0.18bc6.64±0.27d402.39±0.16a11.44±0.08a15.62±0.24a6.42±0.28a23.03±0.12a33.26±0.14b7.83±0.34e452.19±0.10a11.22±0.16a15.61±0.36a6.44±0.01a22.82±0.24a32.80±0.11a8.92±0.44f502.32±0.18a11.04±0.11a15.52±0.10a6.40±0.08a22.54±0.22a32.51±0.19a9.65±0.32f
注:表中同一列中不同字母表示存在显著性差异(P<0.05)。
2.3 底物质量分数对水分子运动性的影响
氢核(1H)多为低场核磁共振技术的研究对象,根据1H在磁场中所具备的自旋特性,其将以非辐射的方式从高能态向低能态转变,弛豫时间的测量多用氢质子的横向弛豫时间T2来表示,由于体系中氢质子主要来源于水分子,故可以通过弛豫时间的变化来分析不同体系中水分子的运动特性[20]。在不同的反应体系中T2弛豫时间的长短不同,证明质子所处的化学环境不同,即水分子的自由度不同。T2弛豫时间越短,表明水分的自由度越低,水分子与物质结合越紧密;T2弛豫时间越长表明水分子的自由度越高,故可以通过测定不同体系的T2弛豫时间来间接表明体系中水分子的运动状态[21]。习惯上将弛豫时间较短的水分子称为结合水,这部分水一般通过氢键作用力与其他物质结合在一起,结合水几乎没有流动性;将弛豫时间较长的水分子称为自由水,这部分水的流动性较强,可以充当反应的介质。
不同质量分数玉米淀粉在90 ℃下加热30 min,用低场核磁共振仪的硬脉冲回波序列CPMG分析不同体系样品中水分子的运动状态,通过反演拟合发现不同质量分数玉米淀粉均表现出两个不同的自旋-自旋弛豫时间,说明体系中存在两种流动性不同的水分,T21表示与玉米淀粉分子紧密结合的水分的横向弛豫时间,即结合水的自旋-自旋弛豫时间,结合越紧密弛豫时间越短,水分子的流动性越差;T22表示体系中流动性较强的自由水的自旋-自旋弛豫时间[22]。
不同质量分数玉米淀粉在90 ℃下保温30 min后质子的弛豫时间如图3所示。结合水的横向弛豫时间T21随底物质量分数的增加逐渐下降(图3-a),表明随着底物浓度的提高,玉米淀粉对水分子的束缚能力逐渐增强,水分子的流动性逐渐降低。当底物质量分数为10%~40%时,T21高于25 ms,玉米淀粉对水分子的束缚作用较小,对Bst-MFA酶酶解玉米淀粉几乎没有影响;当底物质量分数高于40%时,体系T21继续降低,玉米淀粉对水分子的束缚作用明显增强,严重阻碍了水分子的流行性,使得直链麦芽低聚糖的产率明显下降。
随着玉米淀粉质量分数的增加,自由水的横向弛豫时间T22明显下降(图3-b)。当底物质量分数低于30%时,T22高于1 500 ms,Bst-MFA酶作用于玉米淀粉时有充足的自由水可以利用,自由水对Bst-MFA酶酶解反应几乎没有影响,因此直链麦芽低聚糖的产率较高,产物中主产物的质量分数较高;当质量分数为30%~40%时,反应体系T22低于1 000 ms,自由水含量的减少使得Bst-MFA酶对玉米淀的酶解作用不够充分,导致直链麦芽低聚糖的产率降低;当底物质量分数高于40%时,T22进一步下降,说明体系中的自由水进一步减少,不足以提供酶促反应所需水分,导致直链麦芽低聚糖的产率明显下降,产物中主产物质量分数降低。
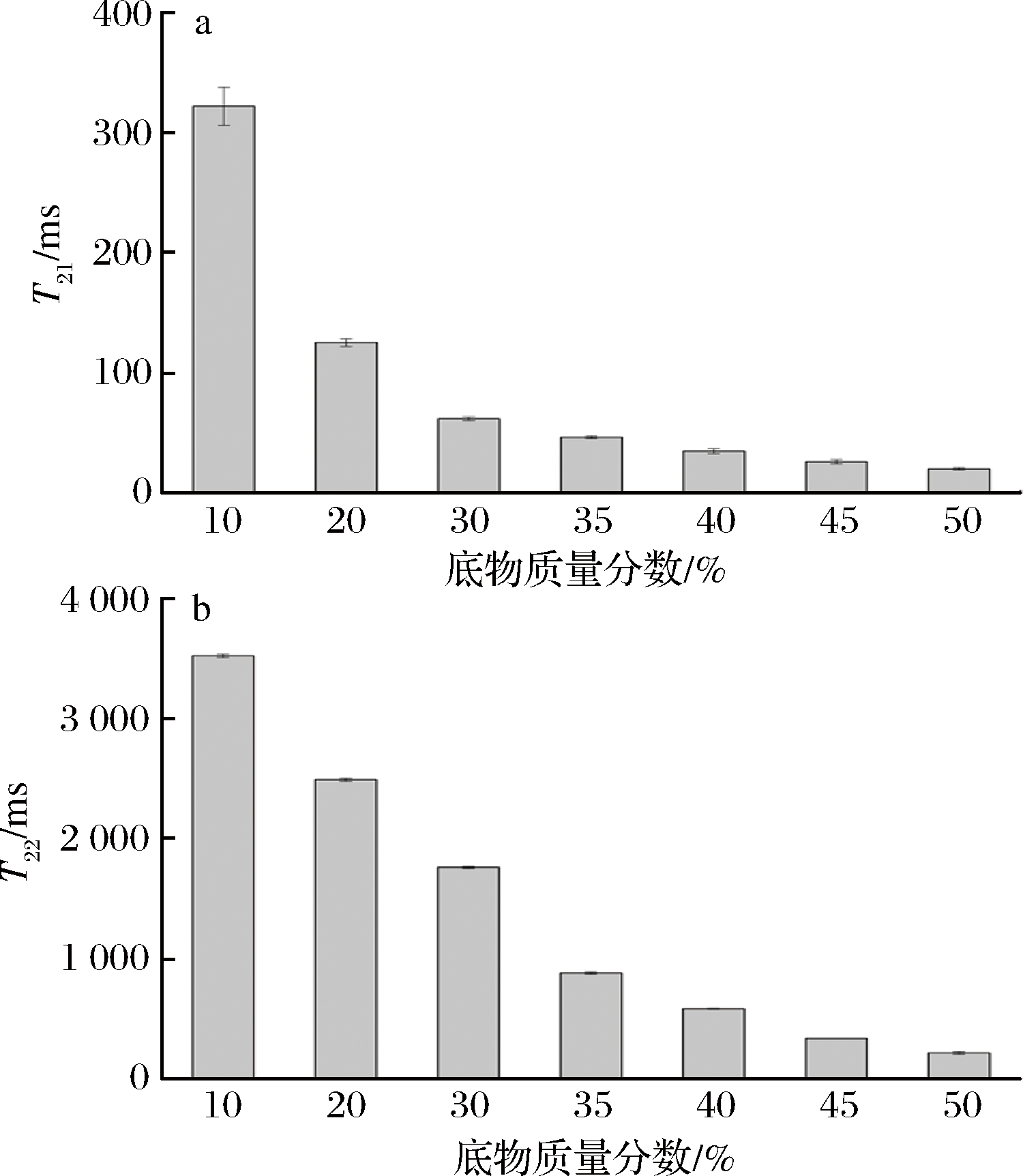
图3 不同质量分数玉米淀粉结合水T21和自由水T22的弛豫时间
Fig.3 The bound water T21 and free water T22 relaxation time of corn starch milk with different concentrations
2.4 底物质量分数对液化过程中体系黏度的影响
Bst-MFA酶不能作用于生淀粉,故玉米淀粉必须经过糊化才能被水解,随着底物浓度的提高,糊化过程中体系黏度逐渐变大导致不能搅拌均匀,因此必须加入Bst-MFA酶进行液化以降低体系的黏度。
不同质量分数玉米淀粉糊化、液化过程中体系黏度变化如图4所示,随着玉米淀粉初始质量分数的增加,其峰值黏度也逐渐升高,高黏度持续时间逐渐延长。当玉米淀粉质量分数为10%和20%时,液化过程中体系黏度增幅较小,黏度对Bst-MFA酶作用的影响不显著,这是因为反应体系中水分子的横向弛豫时间较长(图3),可为Bst-MFA酶酶解淀粉提供充足的水分;质量分数由20%逐渐增加到40%的过程中,液化液的峰值黏度增长迅速且高黏度持续时间明显增长,黏度的增加使酶解体系不易搅拌和混合均匀,这可能是Bst-MFA酶酶解高质量分数玉米淀粉时酶解效率和产物产率降低的主要原因之一。与40%玉米淀粉相比,质量分数为45%时玉米淀粉在糊化和液化过程中的黏度增加并不显著,但高黏度持续时间明显加长,且最终液化液的黏度高于其他质量分数体系。同时,当底物质量分数为45%时,在淀粉糊化、液化过程中的黏度曲线(峰值黏度附近)会出现波动现象,这可能与高黏度下反应体系未搅拌均匀有关。当玉米淀粉质量分数升高至50%时,60 ℃时已较难搅拌与混合均匀,在糊化、液化过程中出现结块现象导致黏度曲线无法测定,这可能是因为50%的玉米淀粉由于水分含量过低,在糊化、液化过程中淀粉颗粒的天然半结晶结构破坏程度较小,抗酶解性能增加[23],从而导致Bst-MFA酶的酶解效率显著降低。
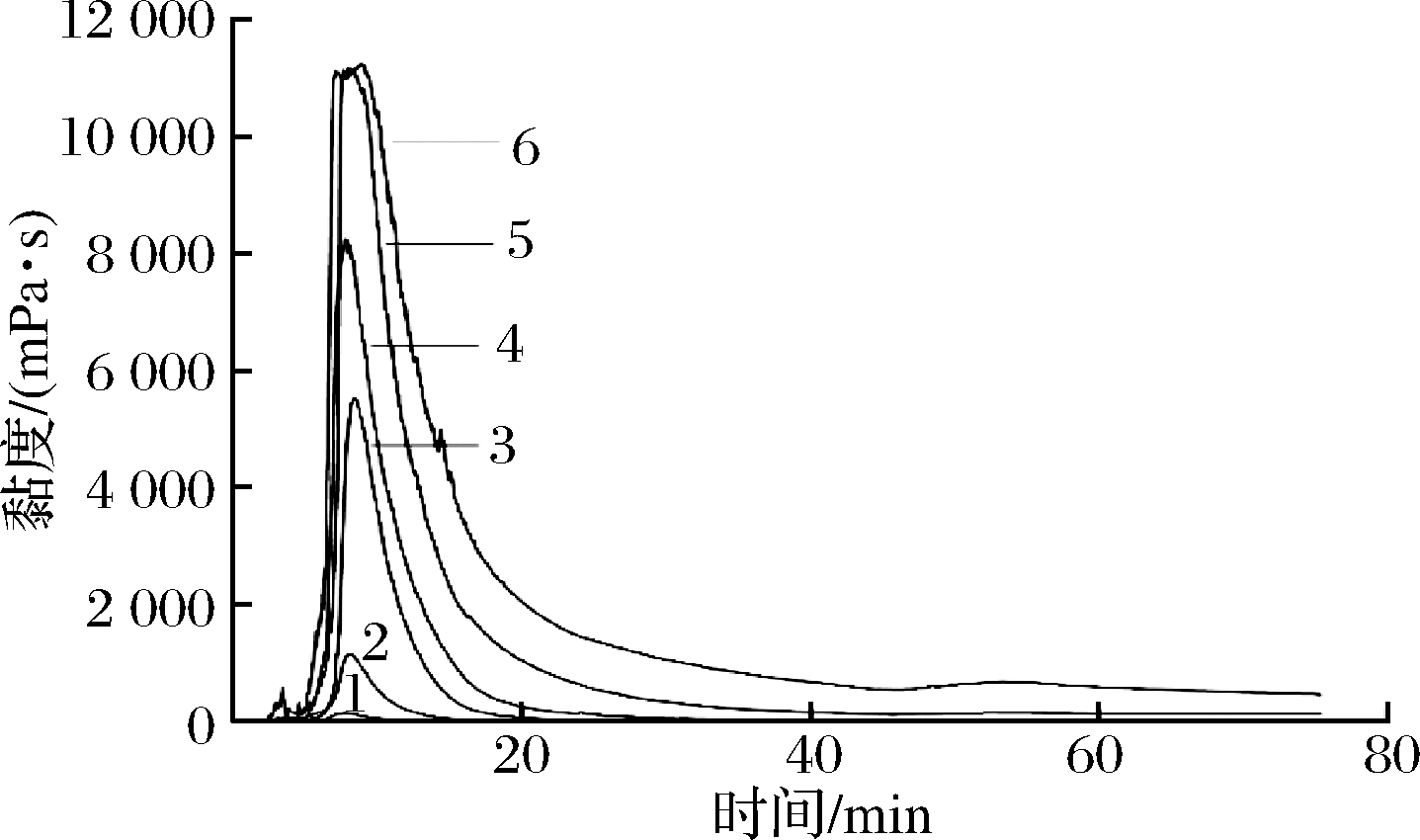
图4 不同质量分数玉米淀粉液化过程中黏度变化曲线
Fig.4 Viscosity curves of corn starch milk at different concentrations during liquification
注:曲线1,2,3,4,5,6分别表示玉米淀粉浓度为10%,20%,30%,35%,40%,45%。
2.5 底物质量分数对液化产物相对碘蓝值的影响
直链淀粉和支链淀粉均可以和I2形成络合物[24]而显色,因此淀粉酶解产物的碘蓝值可以用来反映其与碘形成络合物能力的强弱。通常,当寡糖链的聚合度大于12时才可以和I2形成络合物并显色,且显色强度与聚合度有关,因此,通过测定淀粉反应过程中酶解产物的碘蓝值,可以推断淀粉水解产物的链段聚合度和分子量大小[25],从而判断玉米淀粉水解程度。
不同质量分数玉米淀粉酶解反应过程中的相对碘蓝值变化如图5所示。通常,在玉米淀粉水解过程中,体系的相对碘蓝值会迅速降低。BAILEY等[25]发现,当麦芽糊精聚合度小于12时不能与I2结合显色。由图5可知,当底物质量分数为10%时,反应过程中酶解产物的相对碘蓝值迅速降低,反应50 min后几乎不能检测样品碘蓝值,说明体系中水解产物的分子量较小、链长较短,淀粉分子已被充分水解。随着底物质量分数的升高,相同反应时间样品的相对碘蓝值逐渐增加,当玉米淀粉质量分数为20%~45%时,相同反应时间各样品相对碘蓝值逐渐增加,但增幅相对较小;当玉米淀粉质量分数升高至50%时,淀粉酶解产物相对碘蓝值明显高于其他反应体系,反应120 min后水解产物相对碘蓝值仍有11.08%。KONG等[26]用耐高温α-淀粉酶液化不同质量分数玉米淀粉时发现,当底物质量分数为10%时,酶水解底物的模式表现出接近TAKA淀粉酶(严格内切)的内切作用模式,淀粉分子的内链被攻击,淀粉水解产物的相对碘蓝值下降较快;当底物质量分数升高至45%时,酶对底物的作用模式更倾向于多重攻击,即在反应前期,酶更多地作用于淀粉分子的外链,导致水解产物的相对碘蓝值降低不明显。由表1可知,当底物质量分数升高时,最终产物中G7的质量分数高于其他低质量分数反应体系,结合图5相对碘蓝值随玉米淀粉质量分数的变化趋势,推测Bst-MFA酶作用于不同质量分数的玉米淀粉时可能表现出与耐高温α-淀粉酶相同的作用模式,其详细的作用机理有待进一步分析。

图5 不同质量分数玉米淀粉反应过程中相对碘蓝值的变化
Fig.5 The relative blue value of corn starch milk at different concentrations during reaction
2.6 底物浓度对糖化过程中体系黏度的影响
Bst-MFA酶可以依次完成对玉米淀粉的液化和糖化过程来制备直链麦芽低聚糖[10]。不同浓度玉米淀粉糖化过程中体系黏度变化如图6所示。在玉米淀粉糖化过程中,体系黏度逐渐降低,且随玉米淀粉质量分数的提高,糖化过程中反应体系的黏度下降速率逐渐加快。当玉米淀粉质量分数为10%~40%时,体系黏度一直处于较低水平,黏度对Bst-MFA酶水解玉米淀粉的影响并不明显;当底物质量分数升高至45%时,糖化反应前期体系黏度较大,反应8 h后体系黏度明显下降并趋于稳定,黏度的降低使得Bst-MFA酶酶解玉米淀粉分子的速度加快,体系中直链麦芽低聚糖的含量逐渐增多;当玉米淀粉质量分数升高至50%时,糖化起始阶段体系黏度高达1 925 mPa·s,为45%质量分数起始黏度的3.58倍,反应12 h后体系黏度虽降为起始时的37.51%(722 mPa·s)并趋于稳定,但稳定后黏度仍明显高于其他反应体系。随底物质量分数的增加,糖化过程中黏度升高带来的负面影响严重抑制了Bst-MFA酶对玉米淀粉的催化水解,导致直链麦芽低聚糖的产率明显降低。
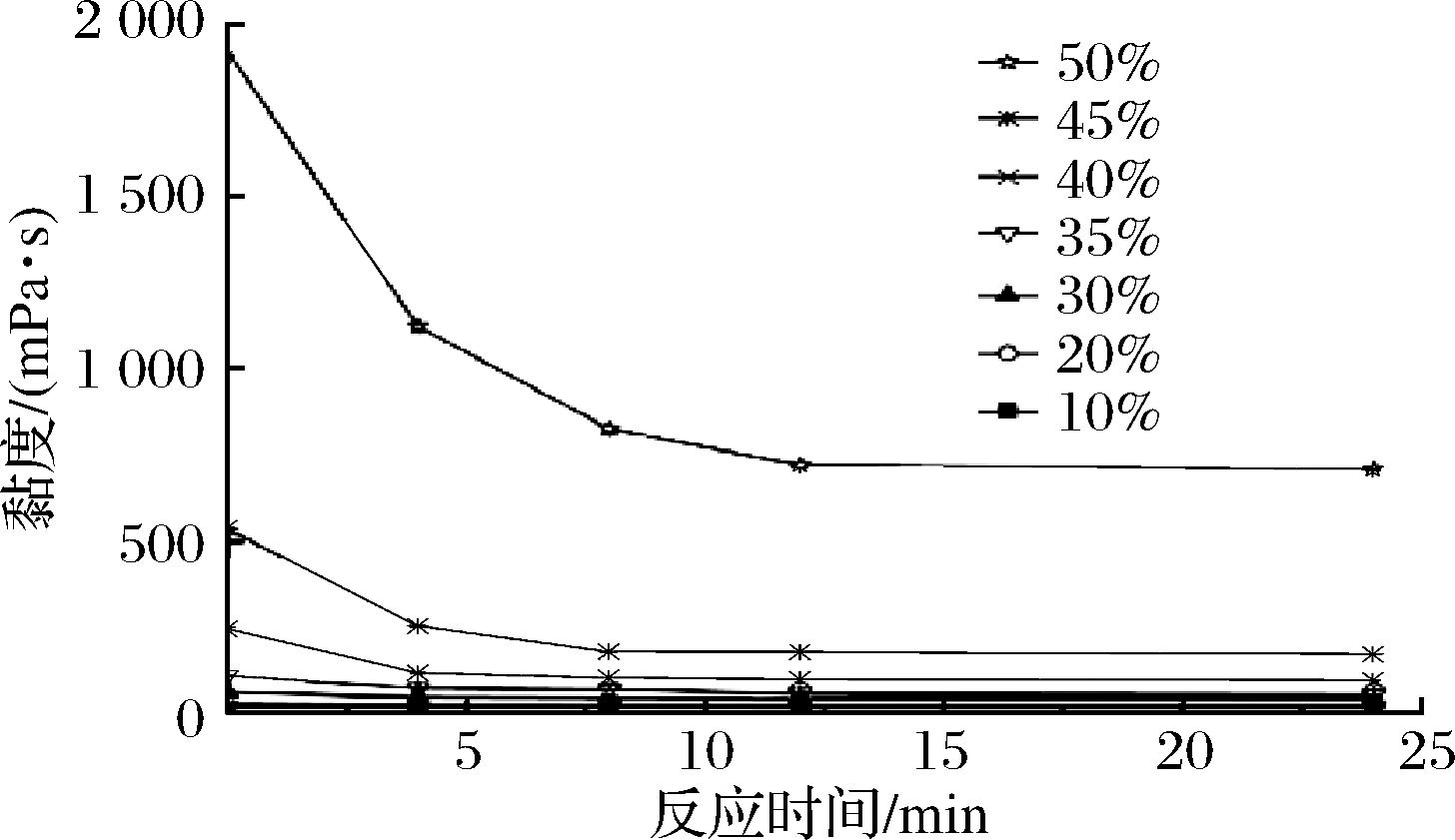
图6 不同质量分数玉米淀粉糖化过程中黏度曲线变化
Fig.6 Viscosity curve of maltodextrin with different concentration during saccharification
3 结论
在Bst-MFA酶酶解玉米淀粉生产直链麦芽低聚糖的过程中,玉米淀粉的初始质量分数对酶解反应有重要影响,以不同质量分数玉米淀粉为底物的酶解反应规律存在差异。随着底物质量分数的提高,玉米淀粉经Bst-MFA酶水解24 h后产生的直链麦芽低聚糖和主产物G5、G6的含量均呈逐渐增加的趋势,而直链麦芽低聚糖的产率逐渐降低。玉米淀粉质量分数由10%提高至45%时,产物中G1~G7的含量由91.25 mg/g增加至344.47 mg/g,提高了2.78倍,继续提高质量分数至50%时,G1~G7的含量不再继续增加;而玉米淀粉质量分数由10%提高至50%过程中,酶解24 h后产物中G1~G7的产率由91.25%逐渐减少至68.74%,降低了24.67%。另外,随着玉米淀粉质量分数的提高,反应24 h后产物中G5和G6的质量分数逐渐下降,而G7等大分子的质量分数逐渐增加。其主要机理是:随着玉米淀粉质量分数的提高,体系中淀粉分子密度变大,Bst-MFA酶与淀粉分子碰撞几率增加,直链麦芽低聚糖含量逐渐升高,但底物质量分数的增加伴随着液化和糖化过程中体系黏度的增大,水分子运动性降低,体系中的自由水明显减少,导致Bst-MFA酶对玉米淀粉分子的水解不够充分,直链麦芽低聚糖的产率逐渐降低。另外,Bst-MFA酶在不同质量分数玉米淀粉中的酶解作用模式可能存在差异,这也是导致直链麦芽低聚糖产率降低的原因之一,还有待于进一步研究加以验证。
[1] 张百胜.麦芽低聚糖在食品生产中的应用[J].农产品加工(学刊),2007(7):108-109.
[2] ALI M B,MHIRI S,MEZGHANI M,et al.Purification and sequence analysis of the atypical maltohexaose-forming α-amylase of the B. stearothermophilus US100[J].Enzyme & Microbial Technology,2001,28(6):537-542.
[3] 毛跟年,杨亚洲,许牡丹,等.磷酸寡糖前体——麦芽低聚糖制备工艺的研究[J].陕西科技大学学报:自然科学版,2003,21(6):21-24.
[4] PANG Xin,XIAO Qicai,CHENG Yi,et al.Bacteria-responsive nanoliposomes as smart sonotheranostics for multidrug resistant bacterial infections[J].ACS Nano,2019,13(2):2 427-2 438.
[5] YUN J W,LEE M G,SONG S K.Continuous production of isomalto-oligosaccharides from maltose syrup by immobilized cells of permeabilized Aureobasidium pullulans[J].Biotechnology Letters,1994,16(11):1 145-1 150.
[6] MARCHAL L M,TRAMPER J.Hydrolytic gain during hydrolysis reactions;implications and correction procedures[J].Biotechnology Techniques,1999,13(5):325-328.
[7] QUAX W J,MRABET N T,LUITEN R G,et al.Enhancing the thermostability of glucose isomerase by protein engineering[J].Bio/technology,1991,9(8):738-742.
[8] 彭丹丹,复合酶液化高浓度玉米淀粉乳的研究[D].无锡:江南大学,2015.
[9] 杨倩雯.高浓度底物条件下酶法生产麦芽糖浆工艺的研究[D].无锡:江南大学,2017.
[10] 曲世洋,李才明,顾正彪,等.底物浓度对糖化反应过程的影响[J].食品与发酵工业,2014,40(3):8-12.
[11] PAN Sihui,DING Ning,REN Junyan,et al. Maltooligosaccharide-forming amylase: Characteristics, preparation, and application[J].Biotechnology Advances,2017,35(5):619-632.
[12] 潘思惠.直链麦芽低聚糖生成酶在枯草芽孢杆菌中的分泌表达及其酶学性质与产物合成研究[D].无锡:江南大学,2018.
[13] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Biochemistry,1959,31(3):426-428.
[14] 刘文静,李兆丰,顾正彪,等.微波预处理对玉米淀粉液化的影响[J].食品与发酵工业,2013,39(1):21-25.
[15] ROUSSEL X,LANCELON-PIN C,VIKS-NIELSEN A,et al.Characterization of substrate and product specificity of the purified recombinant glycogen branching enzyme of Rhodothermus obamensis[J].Biochimica et Biophysica Acta (BBA)-General Subjects,2013,1 830(1):2 167-2 177.
[16] 刘文静.酶法液化高浓度玉米淀粉乳的研究[D].无锡:江南大学,2013.
[17] BIJTTEBIER A,GOESAERT H,DELCOUR J A. Temperature impacts the multiple attack action of amylases[J].Biomacromolecules,2007,8(3):765-772.
[18] CHENG Shasha,ZHANG Tan,YAO Li,et al.Use of low field-NMR and MRI to characterize water mobility and distribution in Pacific oyster (Crassostrea gigas) during drying process[J].Drying Technology,2017,36(5):630-636.
[19] XU Danping,HONG Yan,GU Zhengbiao,et al.Effect of high pressure steam on the eating quality of cooked rice[J].LWT-Food Science and Technology,2019,104:100-108.
[20] LI Chun,ZHANG Luda,REN Fazheng,et al. Study on different chilling factors influencing water-holding capacity of pork based on low-field nuclear magnetic resonance(LF-NMR)[J].Transactions of the Chinese Society of Agricultural Engineering,2012,28(23):243-249.
[21] 闫晓蕾.山梨糖醇在香肠制品中的持水作用研究[D].无锡:江南大学,2012.
[22] 张莉莉,张涛,姜晓明,等.水分状态对鱼糜凝胶高温处理热稳定性的影响[J].食品与发酵工业,2013,39(2):56-61.
[23] 赵骏倢.高效液化糖化高浓度玉米淀粉关键酶系的优化[D].长春:吉林大学,2015.
[24] GOESAERT H,BIJTTEBIER A,DELCOUR J A.Hydrolysis of amylopectin by amylolytic enzymes:Level of inner chain attack as an important analytical differentiation criterion[J].Carbohydrate Research,2010,345(3):397-401.
[25] BAILEY J M,WHELAN W J.Physical properties of starch.I.Relationship between iodine stain and chain length[J].Journal of Biological Chemistry,1961,236(4):969-973.
[26] KONG Haocun,ZOU Yingying,GU Zhengbiao,et al.Liquefaction concentration impacts the fine structure of maltodextrin[J].Industrial Crops and Products,2018,123:687-697.