核桃花又称核桃纽、长寿菜、龙须菜,是核桃种植生产的主要副产物之一,每株成熟的核桃树可产4~5 kg核桃花[1-2]。中国是世界上核桃生产大国,核桃的种植面积和产量均居世界上首位。截止2017年底,我国核桃栽培面积已达1亿亩,核桃产量414万t,可产核桃花50万t,其中仅云南种植面积就达4 300万亩,可产核桃花20万t。
核桃花具有较高的开发价值[3],蛋白质高达21%,K、Fe、Mn、Zn、Se及β-胡萝卜素、核黄素、抗坏血酸、维生素E等含量较高,氨基酸组成全面、丰富[3-4]。此外,核桃花还具有较强的生物活性,如核桃花的甲醇提取物具有较强的抗氧化活性、抗菌活性[5-7]以及抗溶血活性[8];其乙醇提取物可以预防糖尿病大鼠的肝损害、降低其血糖水平[9-10]、抑制肿瘤细胞增殖[11-13]等。我国民间一直有药用和食用核桃花的传统,并将其称为长寿食品。贵州省和云南省少数民族地区将核桃花作为特色蔬菜,其制作的菜肴气味清香,口感鲜嫩清脆。
但目前我国对核桃花的开发利用较少,除少量食用和饲用外,大部分都被丢弃。核桃花中富含生物活性物质,在加工过程中极易发生褐变,导致产品感官品质下降,营养物质损失[14],严重影响核桃花的商品价值。为提高核桃花的产品质量和经济效益,需要对其进行护色处理[15-16]。本实验旨在筛选出适合核桃花护色的护色剂,并优化护色工艺,为开发利用核桃花资源提供理论依据。
1 材料与方法
1.1 材料与仪器
核桃花,购于云南楚雄大姚县。乙酸锌(Zn(Ac)2)、乙二胺四乙酸二钠(EDTA-2Na)、Na2CO3、抗坏血酸(VC)、CaCl2、L-半胱氨酸(L-Cysteine)等,均为食用级。
SC-80型轻便色彩色差计,北京康光仪器有限公司;DHG-9240A型电热恒温鼓风干燥箱,上海齐欣科学仪器有限公司;BSA224S型电子天平,赛多利斯科学仪器(北京)有限公司;UV-1000紫外可见分光光度计,北京莱伯泰科技仪器有限公司;XA-3型样品粉碎机,常州市春秋电子仪器有限公司。
1.2 试验方法
1.2.1 护色
将核桃花以清水冲洗2遍,然后在配置好的护色剂溶液中护色一定时间,取出沥干表面水分,在50 ℃下干燥3 h,然后密封于室温下待用。
1.2.2 色差值(ΔE)的测定
准确称取护色后干燥的核桃花1.0 g,剪碎,加入20 mL去离子水,研磨成浆,过滤,收集滤液,采用轻便色彩色差计测量核桃花滤液的L*,a*,b*值。L*代表样品的明度,L*值越大,颜色越白;a*代表样品的红绿值,其中+a*为红,-a*为绿;b*代表样品的黄蓝值,其中+b*为黄,-b*为蓝,由护色前后样品的L*,a*,b*的差值ΔL、Δa、Δb,可计算出样品的总色差值ΔE[17]。ΔE可表示样品的色泽变化程度,ΔE值越大,色泽变化越大,护色效果越差。ΔE的计算见公式(1)[18]:
(1)
式中:ΔL、Δa、Δb分别为护色前后样品L*,a*,b*的差值。
1.2.3 褐变强度(BD)的测定
采用消光值法[19-20]。取1.2.2中收集的滤液,采用分光光度计法在410 nm处测量吸光度值A410,结果以A410×10表示褐变程度。
1.2.4 护色剂的确定
分别选用了3 mg/mL Zn(Ac)2、EDTA-2Na、Na2CO3、VC、CaCl2、L-Cysteine,对核桃花进行护色试验,同时以不加护色剂的去离子水为空白对照,测定色差值和褐变强度,选取护色效果较好的几种单护色剂,然后进行复配试验,以确定最佳护色剂组合。
1.2.5 单因素试验
以1.2.4中确定的最佳护色剂组合,分别考察护色剂质量浓度(0.5、1.0、3.0、5.0、8.0、10.0、12 mg/mL)、护色时间(1、2、4、6、8、10 h)、护色温度(15、25、40、60、80、100 ℃)对核桃花护色效果的影响。
1.2.6 Box-Benhnken中心组合实验设计
在单因素试验的基础上,建立3因素3水平的Box-Benhnken中心组合试验[21],以色差值、褐变强度为响应值,各因素的3个水平采用-1、0、1进行编码,如表1。
表1 响应曲面设计实验因素水平和编码表
Table 1 Independent variables and their levels used in the response surface design
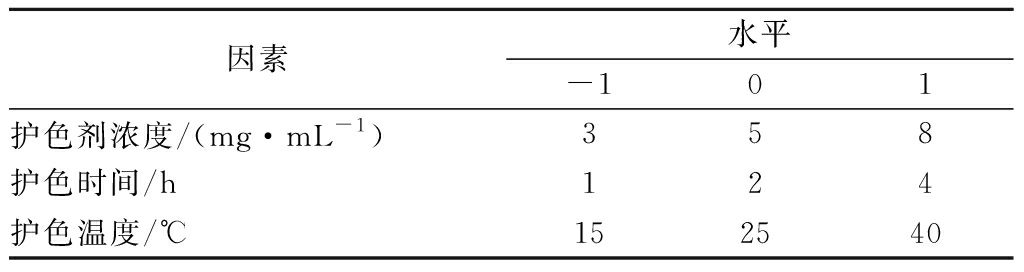
因素水平-101护色剂浓度/(mg·mL-1)3 5 8护色时间/h124护色温度/℃152540
1.3 数据处理
每组参数均设置3组重复,试验数据均以平均值±标准差的形式表示,采用SPSS Statistics 19软件进行差异显著性分析,运用Design-Expert 8.0.6软件进行响应面设计,并由Origin 7.5软件绘制试验结果图。
2 结果与分析
2.1 护色剂的确定
2.1.1 单一护色剂的护色效果
各护色剂对核桃花的护色效果见表2。相同浓度下,各处理组ΔE大小顺序为:CaCl2
表2 单一护色剂的护色效果
Table 2 Effects of single browning inhibitors on walnut flower color
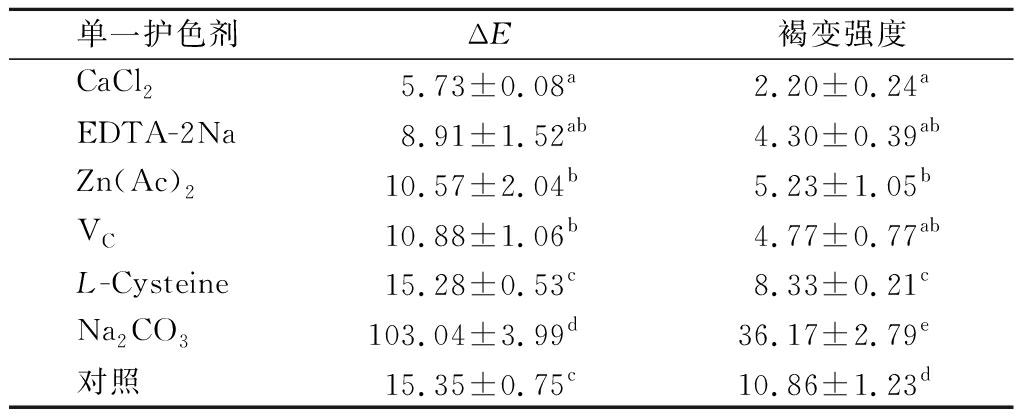
单一护色剂ΔE褐变强度CaCl25.73±0.08a2.20±0.24aEDTA-2Na8.91±1.52ab4.30±0.39abZn(Ac)210.57±2.04b5.23±1.05bVC10.88±1.06b4.77±0.77abL-Cysteine15.28±0.53c8.33±0.21cNa2CO3103.04±3.99d36.17±2.79e对照15.35±0.75c10.86±1.23d
注:同一列不同小写字母上标表示差异显著性(P<0.05)。
2.1.2 复合护色剂的护色效果
复合护色剂对核桃花的护色效果见表3。相同浓度下,两两复配的复合护色剂护色效果普遍优于三三复配的复合护色剂。两两配对的复合护色剂ΔE的大小依次是:EDTA-2Na+CaCl2
表3 复合护色剂的护色效果
Table 3 Effects of complex browning inhibitors on Walnut flower color
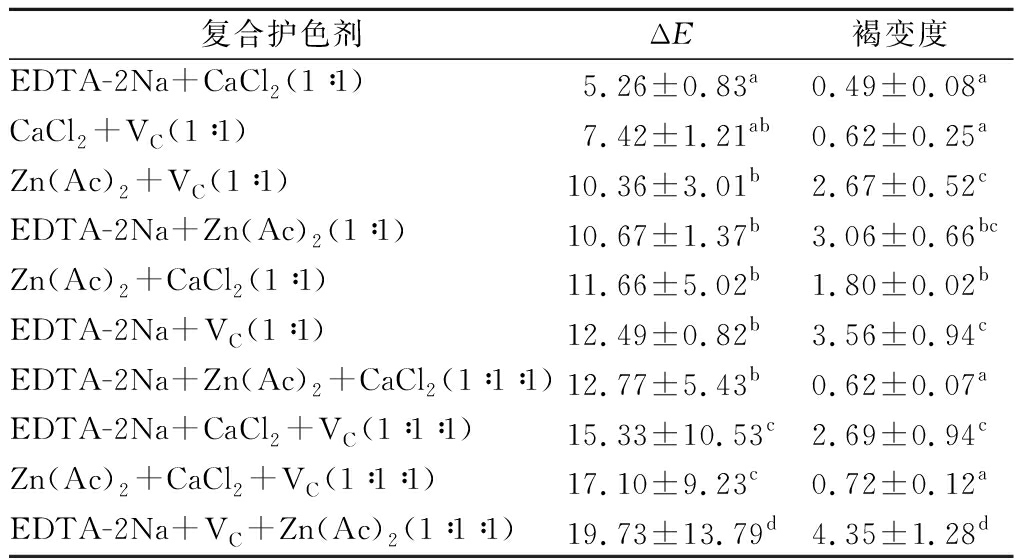
复合护色剂ΔE褐变度EDTA-2Na+CaCl2(1∶1)5.26±0.83a0.49±0.08aCaCl2+VC(1∶1)7.42±1.21ab0.62±0.25aZn(Ac)2+VC(1∶1)10.36±3.01b2.67±0.52cEDTA-2Na+Zn(Ac)2(1∶1)10.67±1.37b3.06±0.66bcZn(Ac)2+CaCl2(1∶1)11.66±5.02b1.80±0.02bEDTA-2Na+VC(1∶1)12.49±0.82b3.56±0.94cEDTA-2Na+Zn(Ac)2+CaCl2(1∶1∶1)12.77±5.43b0.62±0.07aEDTA-2Na+CaCl2+VC(1∶1∶1)15.33±10.53c2.69±0.94cZn(Ac)2+CaCl2+VC(1∶1∶1)17.10±9.23c0.72±0.12aEDTA-2Na+VC+Zn(Ac)2(1∶1∶1)19.73±13.79d4.35±1.28d
注:复合护色剂的比例均为质量比;同一列不同小写字母上标表示差异显著性(P<0.05)。
2.2 单因素试验
2.2.1 护色剂浓度对核桃花护色效果的影响
复合护色剂浓度对核桃花的护色效果见图1。
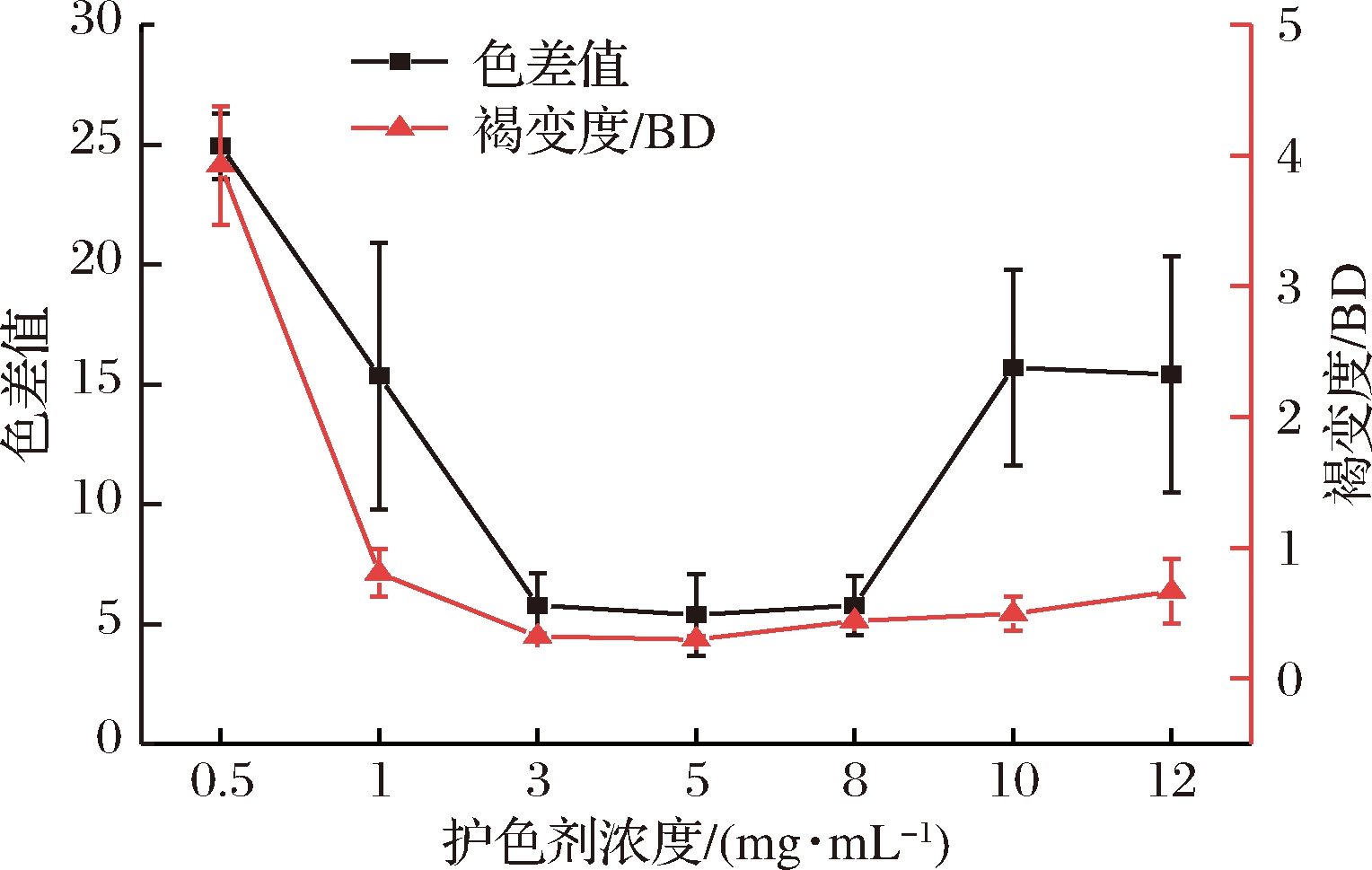
图1 护色剂浓度对核桃花护色效果的影响
Fig.1 Effect of concentration of browning inhibitors on the color protection effect of walnut flower
由图1可知,随着护色剂浓度的增加,护色效果呈先下降后增加的趋势。当护色剂质量浓度小于3 mg/mL时,色差值和褐变强度逐渐降低;质量浓度在3~8 mg/mL时,色差值和褐变强度基本呈直线状,趋于稳定;当护色剂质量浓度达到5 mg/mL时,色差值和褐变度均达到最小值,此时护色效果最佳;质量浓度在8~12 mg/mL时,色差值和褐变强度又有所上升。原因可能是随着Ca2+和EDTA-2Na质量浓度增加,其抑制褐变能力增强;但当护色剂浓度过大时,产生的果胶酸钙过多导致护色效果变弱。因此选取5 mg/mL为最佳护色质量浓度。
2.2.2 护色时间对核桃花护色效果的影响
护色时间对核桃花的护色效果见图2。由图2可知,随着护色时间的延长,核桃花的褐变度没有显著变化(P>0.05),但色差值呈逐渐增大的趋势。这可能是由于在护色开始时护色剂对核桃花中各种酶类以及维生素等起到了抑制作用,但随着护色时间的延长,核桃花中的酶类发生酶促褐变,多酚、维生素等与氧气接触发生了非酶褐变,导致后期颜色的逐渐变化。因此选择2 h为最佳护色时间。
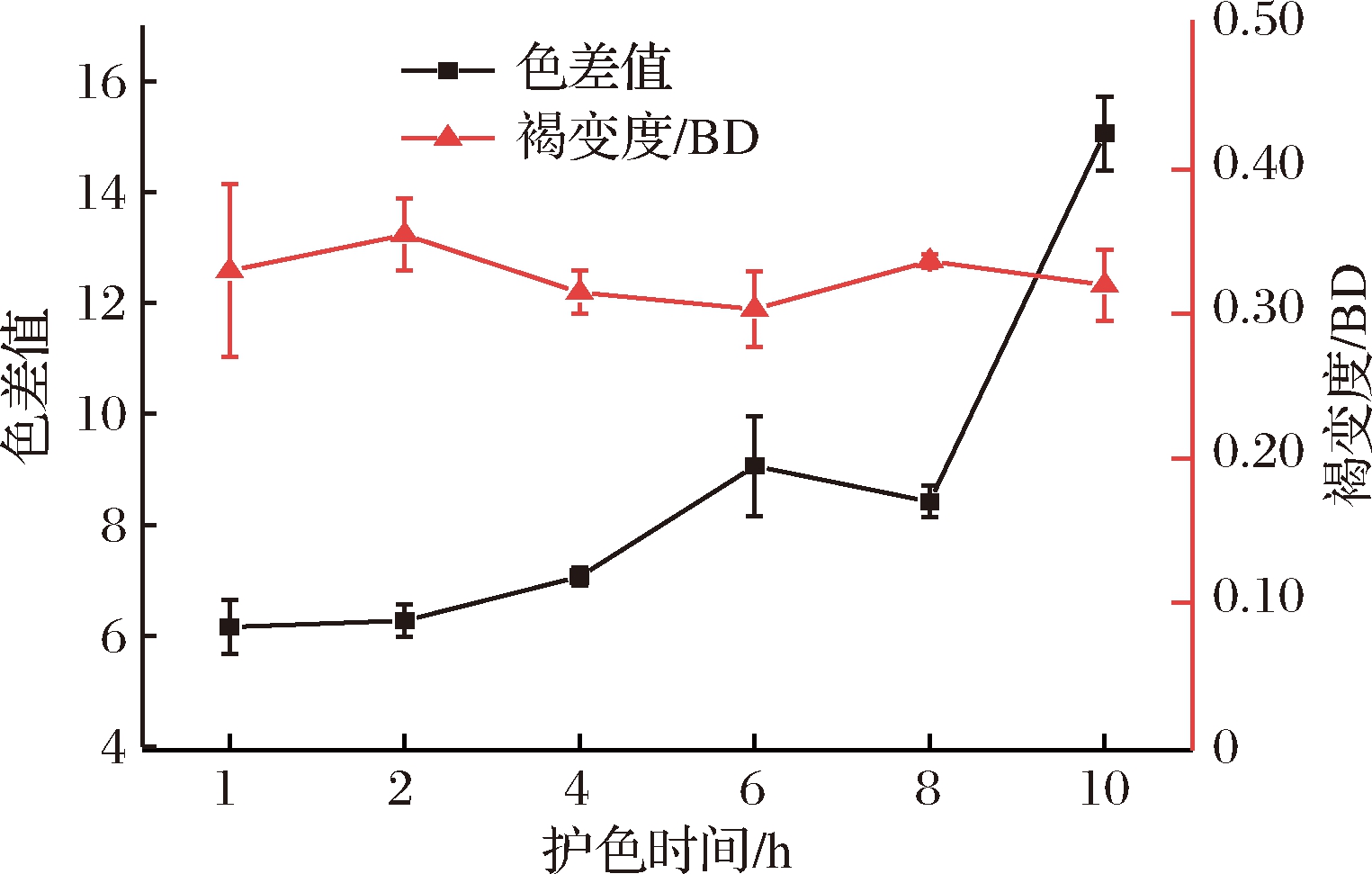
图2 护色时间对核桃花护色效果的影响
Fig.2 Effect of color protection time on the color protection effect of walnut flower
2.2.3 护色温度对核桃花护色效果的影响

图3 护色温度对核桃花护色效果的影响
Fig.3 Effect of color protection temperature on the color protection effect of walnut flower
由图3可知,随着护色温度的升高,护色效果总体呈先下降后上升的趋势。当护色温度为25 ℃时其色差值和褐变度均达到最小值,这可能是由于高温会破坏核桃花中的叶绿素,导致其颜色变深。因此选择25 ℃为最佳护色温度。
2.3 Box-Benhnken中心组合试验结果及数据分析
2.3.1 Box-Benhnken中心组合试验设计方案及结果
根据单因素试验结果,以核桃花色差值、褐变度为响应值,以护色剂浓度(A)、护色时间(B)、护色温度(C)为自变量,采用Design-Expert 8.0.6软件建立3因素3水平中心组合试验,其试验方案和结果如表4所示。
表4 Box-Behnken试验设计和结果
Table 4 Box-Behnken design and results
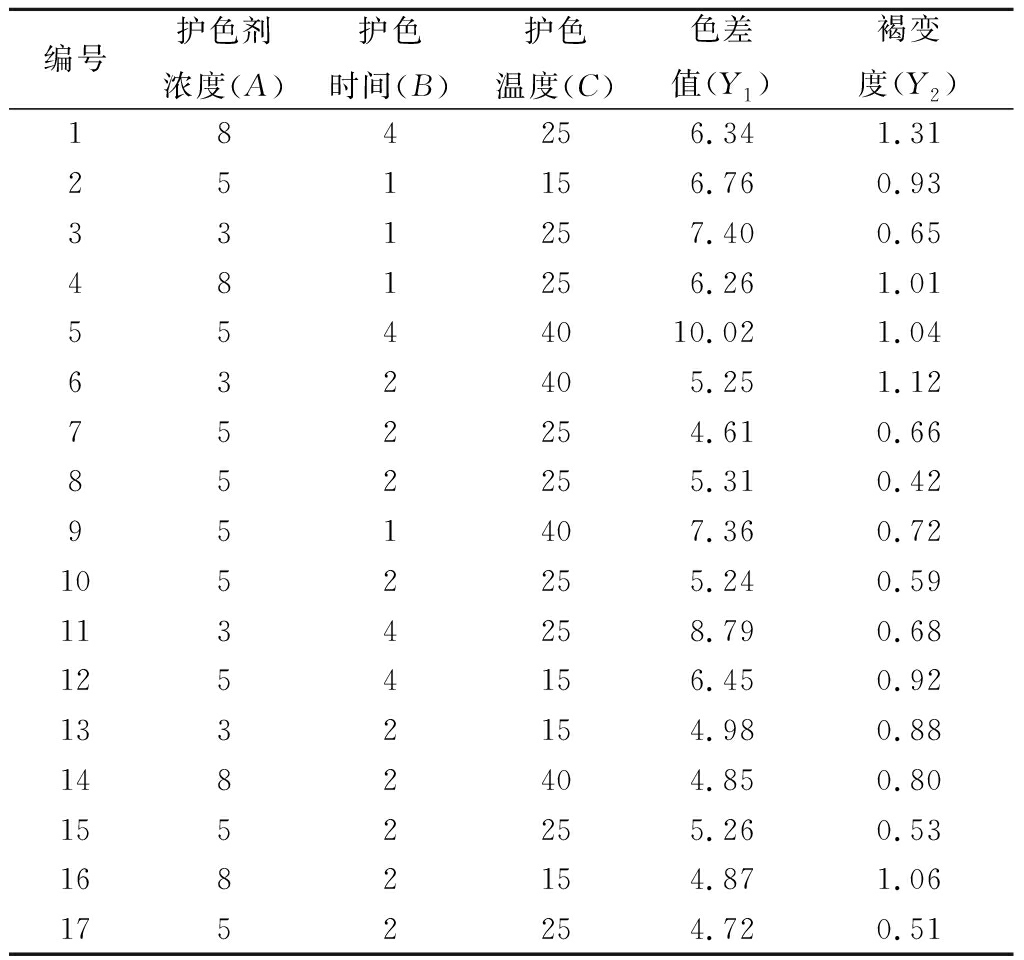
编号护色剂浓度(A)护色时间(B)护色温度(C)色差值(Y1)褐变度(Y2)184256.341.31251156.760.93331257.400.65481256.261.015544010.021.04632405.251.12752254.610.66852255.310.42951407.360.721052255.240.591134258.790.681254156.450.921332154.980.881482404.850.801552255.260.531682154.871.061752254.720.51
2.3.2 回归方程拟合及方差分析
通过Design Expert 8.0.6软件对表4中试验结果进行响应面回归分析,得到该实验的回归模型方程Y1=11.90+0.33A-5.90B-0.08C-0.12AB-2.37AC+0.05BC-0.02A2+1.23B2+5.47E-4C2、Y2=2.61-0.26A-0.50B-0.06C+0.03AB-4.48E-3AC+3.79E-3BC+0.03A2+0.06B2+1.42E-3C2。响应值Y1、Y2模型系数显著性结果和方差分析结果见表5。
回归模型方程Y1的![]() 回归模型方程Y2的
回归模型方程Y2的![]() 由方差分析可知两个回归方程模型均显著(P<0.05),表明该模型与实际拟合良好,试验方法可靠,失拟项均不显著(P>0.05),说明所得方程与实际拟合中非正常误差所占比例较小,可用此模型对核桃花护色效果进行分析和预测。结果显示,各因素对响应值Y1显著性排序为C>A>B;对响应值Y2显著性排序为A>B>C。
由方差分析可知两个回归方程模型均显著(P<0.05),表明该模型与实际拟合良好,试验方法可靠,失拟项均不显著(P>0.05),说明所得方程与实际拟合中非正常误差所占比例较小,可用此模型对核桃花护色效果进行分析和预测。结果显示,各因素对响应值Y1显著性排序为C>A>B;对响应值Y2显著性排序为A>B>C。
表5 回归模型方差分析和系数显著性检验
Table 5 Variance analysis and significance test of regression model
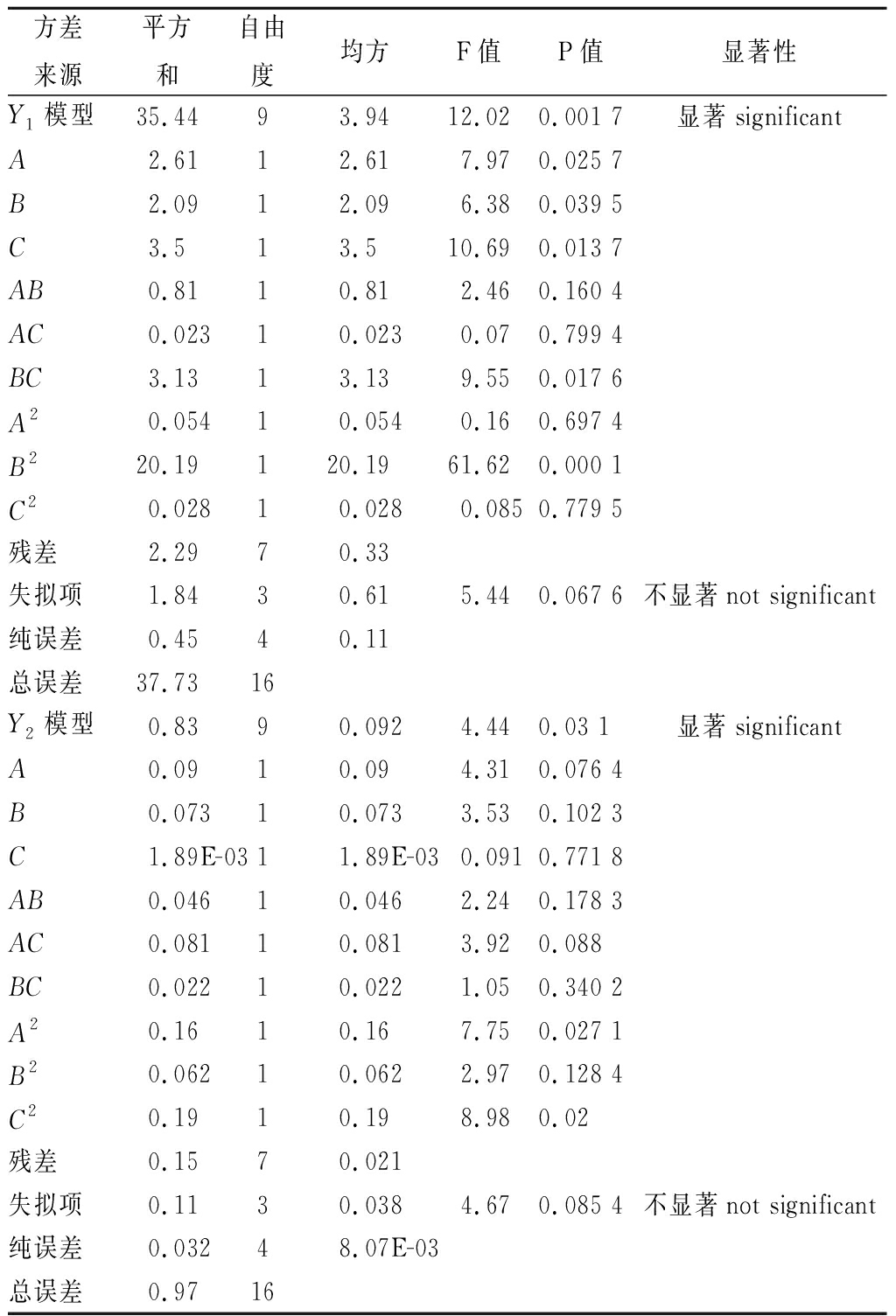
方差来源平方和自由度均方F值P值显著性Y1模型35.4493.9412.020.001 7显著significantA2.6112.617.970.025 7B2.0912.096.380.039 5C3.513.510.690.013 7AB0.8110.812.460.160 4AC0.02310.0230.070.799 4BC3.1313.139.550.017 6A20.05410.0540.160.697 4B220.19120.1961.620.000 1C20.02810.0280.0850.779 5残差2.2970.33失拟项1.8430.615.440.067 6不显著not significant纯误差0.4540.11总误差37.7316Y2模型0.8390.0924.440.03 1显著significantA0.0910.094.310.076 4B0.07310.0733.530.102 3C1.89E-0311.89E-030.0910.771 8AB0.04610.0462.240.178 3AC0.08110.0813.920.088BC0.02210.0221.050.340 2A20.1610.167.750.027 1B20.06210.0622.970.128 4C20.1910.198.980.02残差0.1570.021失拟项0.1130.0384.670.085 4不显著not significant纯误差0.03248.07E-03总误差0.9716
2.3.3 响应面图分析
根据响应值的3D曲面图,分析各因素对核桃花护色效果的影响及各因素的交互作用。图4中所示为因素的交互作用及对核桃花护色效果的影响。其中图4-c和图4-e曲面相对陡峭说明因素之间的交互作用较明显,与方差分析结果相符。
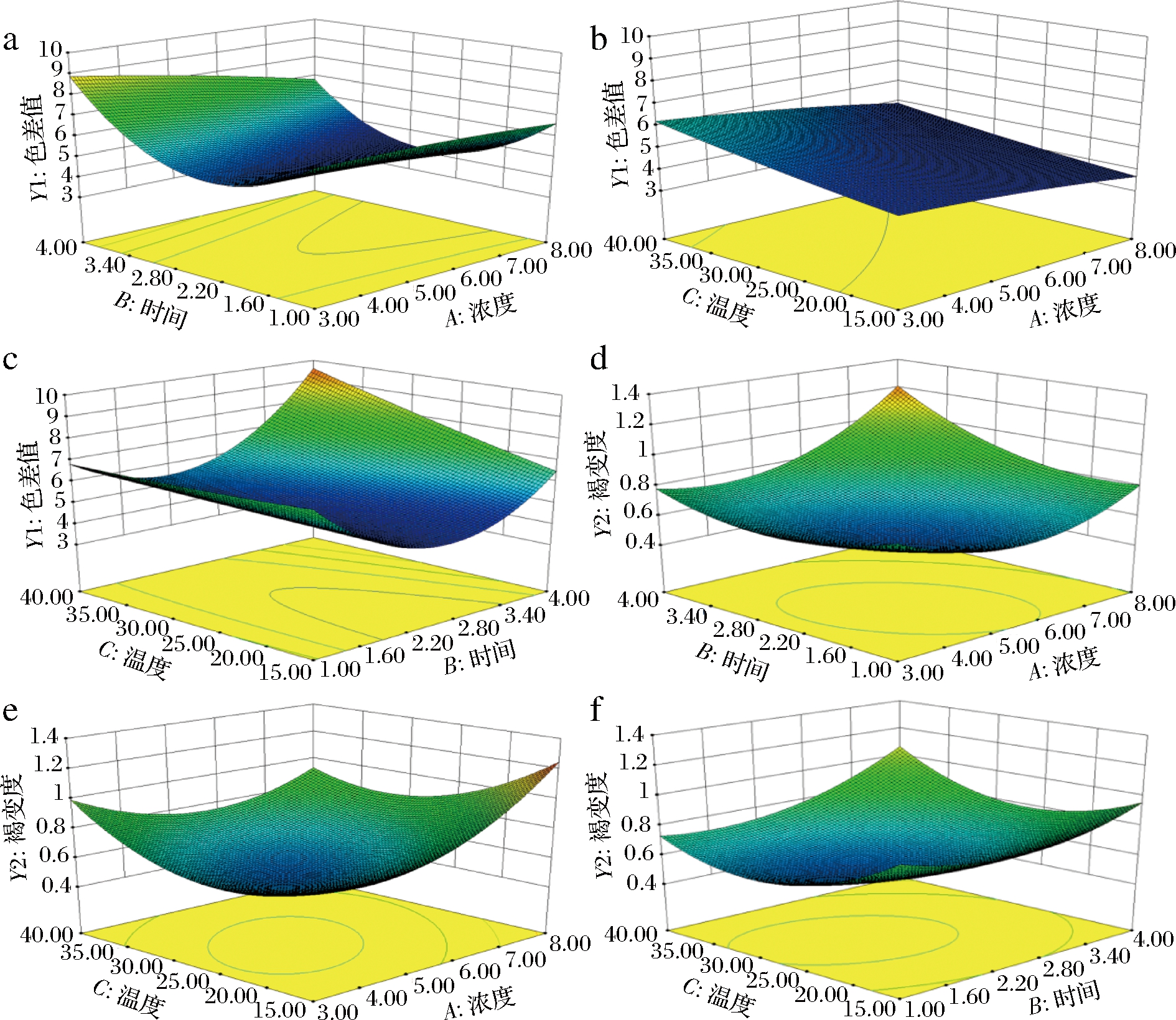
a-护色剂浓度与护色时间对色差值影响的响应面图;b-护色剂浓度与护色温度对色差值影响的响应面图;c-护色时间与护色温度对色差值影响的响应面图;d-护色剂浓度与护色时间对褐变程度影响的响应面图;e-护色剂浓度与护色温度对褐变程度影响的响应面图;f-护色时间与护色温度对褐变程度影响的响应面图
图4 两因素的交互作用对护色效果的响应面图
Fig.4 Response surface plots of variable parameters on the color protection effect
2.3.4 试验验证
采用Design Expert软件同时对2个方程求导可知,当护色剂浓度为5.23 mg/mL、护色时间为2.3 h、护色温度为25.5 ℃时,其理论色差值和褐变度均最低,分别为4.86和0.54,护色效果最佳。对该优化条件进行验证试验,平行3次,在该条件下色差值为4.84、褐变度为0.49,接近理论值,证明该模型可行。
3 结论
考察了实际生产中常用的几种护色剂对核桃花的护色效果,发现EDTA-2Na与CaCl2按1∶1复配后的护色效果最佳。
采用Design Expert软件对核桃花护色工艺进行优化,得到了核桃花护色的最佳工艺:复合护色剂浓度为5.23 mg/mL、护色时间为2.3 h、护色温度为25.5 ℃。此条件下的核桃花护色效果最佳,其色差值和褐变度最低,分别为5.26和0.49。本研究为抑制核桃花的褐变现象提供了一定的参考价值,对其加工利用有一定帮助。
核桃花富含丰富的营养物质和活性组分,但其在护色过程中各营养物质和活性组分是否发生变化尚不可知,下一步将在护色工艺对核桃花的营养和功能活性等影响做深入研究。
[1] WANG C, ZHANG W, PAN X. Nutritional quality of the walnut male inflorescences at four flowering stages[J]. Journal of Food and Nutrition Research, 2014,2(8):457-464.
[2] 韩本勇, 任英. 核桃花的开发利用研究[J]. 民营科技, 2014(8):240.
[3] 杨葵华, 吕瑞. 核桃花的枝干、花朵中Fe、Mn、Zn含量的比较[J]. 食品研究与开发, 2016,37(1):161-163.
[4] 陈朝银, 赵声兰,曹建新,等. 核桃花营养成份的分析[J]. 中国野生植物资源, 1999(2):45-47.
[5] MUZAFFER U, PAUL V I. Phytochemical analysis, in vitro antioxidant and antimicrobial activities of male flower of Juglans regia L.[J]. International Journal of Food Properties, 2018,21(1):360-371.
[6] SHARMA P, RAVIKUMAR G, KALAISELVI M, et al. In vitro antibacterial and free radical scavenging activity of green hull of Juglans regia[J]. J Pharm Anal, 2013,3(4):298-302.
[7] ZHAO M H, JIANG Z T, LIU T, et al. Flavonoids in Juglans regia L. leaves and evaluation of in vitro antioxidant activity via intracellular and chemical methods[J]. The Scientific World Journal,2014:303878.
[8] EBRAHIMZADEH M A, NABAVI S F, NABAVI S M. Antihemolytic activity and mineral contents of Juglans regia L. flowers[J]. European Review for Medical and Pharmacological Sciences, 2013,17(14):1 881-1 883.
[9] HOSSEINI E, KARIMZADEH K, VESSAL M, et al. Effects of a hydroalcoholic extract of walnut male flowers on streptozocin diabetic rats[J]. Healthmed, 2012,6(12):4 253-4 257.
[10] BAHARVAND-AHMADI B, BAHMANI M, TAJEDDINI P, et al. An ethno-medicinal study of medicinal plants used for the treatment of diabetes[J]. Journal of Nephropathology, 2016,5(1):44-50.
[11] 李倩. 核桃花中选择性抑制肿瘤细胞生长活性成分的研究[D]. 北京:北京协和医学院, 2017.
[12] ARVIND SINGH N, SUAIB L, SUCHITA S, et al. Antiproliferative and antioxidant activities of Juglans regia fruit extracts[J]. Pharmaceutical Biology, 2011,49(6):669-673.
[13] 刘冬, 万红霞,孙海燕. 中国主要水果抑制肝癌HepG2细胞和结肠腺癌Caco-2细胞增殖活性评价[J]. 现代食品科技, 2015,31(4):23-28.
[14] MU OZ A, CAMINITI I M, PALGAN I, et al. Effects on Escherichia coli inactivation and quality attributes in apple juice treated by combinations of pulsed light and thermosonication[J]. Food Research International, 2012,45(1):299-305.
OZ A, CAMINITI I M, PALGAN I, et al. Effects on Escherichia coli inactivation and quality attributes in apple juice treated by combinations of pulsed light and thermosonication[J]. Food Research International, 2012,45(1):299-305.
[15] 田淑贤, 黄宇彤. 山野菜护色工艺的研究[J]. 食品工业科技, 1994,15(4):19-21.
[16] 张京芳, 王冬梅,刘鑫. 干制香椿褐变的控制研究[J]. 中国食品学报, 2009,10(2):144-148.
[17] 郭嘉明, 吕恩利,陆华忠,等. 荔枝果皮色差a*值与其他品质指标的关联性[J]. 现代食品科技, 2014,30(10):68-73.
[18] 徐吉祥, 楚炎沛. 色差计在食品品质评价中的应用[J]. 现代面粉工业, 2010(3):43-45.
[19] 王清章, 刘怀超,孙颉. 莲藕贮藏中褐变度及多酚氧化酶活性的初步研究[J]. 中国蔬菜, 1997(3):6-8.
[20] PIZZOCARO F, TORREGGIANI D, GILARDI G. Inhibition of apple polyphenol oxidase (PPO) by ascorbic, citric acid and sodium chloride[J]. Journal of Food Processing & Preservation, 2010,17(1):21-30.
[21] HUNTER J S, HUNTER W G. Statistics for experimenters: Design, innovation, and discovery[J]. Technometrics, 2006,101(476):1 720-1 721.
[22] SAPERS G M, GARZARELLA L, PILIZOTA V. Application of browning inhibitors to cut apple and potato by vacuum and pressure infiltration [J]. Journal of Food Science, 2010,55(4):1 049-1 053.
[23] 陈大明. 软包装金针菇护色技术试验[J]. 食用菌, 2004(6):42-43.
[24] LEIVA F J, SAENZ-DíEZ J C, MARTíNEZ E, et al. Environmental impact of agaricus bisporus cultivation process[J]. European Journal of Agronomy, 2015,71:141-148.
[25] 胡小松, 李积宏,刘文英,等. 马铃薯丝加工中的褐变因素及其控制[J]. 食品科学, 1994,15(5):35-42.
[26] LAMBRECHT H S. Sulfite substitutes for the prevention of enzymatic browning in foods: ACS Symposium Series, 1995[C].
[27] 莫开菊, 程超,王纯杰. 柠檬酸-氯化钙对糖姜片护色效果的研究[J]. 食品研究与开发, 2004,25(6):37-39.