来源于成团泛菌(Pantoea agglomerans)的苯丙氨酸氨基变位酶(phenylalanine aminomutase, PaPAM)可催化α-苯丙氨酸转化为(S)-β-苯丙氨酸[1-2],(S)-β-苯丙氨酸是合成抗生素andrimid[2]的重要组成物质之一,具有较高的经济价值。然而野生型的PaPAM热稳定性较差,酶活也较低,尤其是当温度超过50 ℃,酶活力显著下降,处理1 h后剩余酶活只有30%左右,酶活低也是限制其生产应用的一个障碍,因此现阶段还不能满足大规模加工工艺需求,其工业应用受到限制[3-4]。
苯丙氨酸氨基变位酶(phenylalanine aminomutase,PAM,EC: 5.4.3.10)是MIO(4-methylideneimidazole-5-one)家族酶成员之一,MIO是一种新的内源性辅因子,经过翻译后修饰系统将氨基酸侧链基团转化而成的[5-6]。目前认为MIO依赖性酶的转氨机制是Friedel-Crafts[7-9],经两步反应:第一步反应,MIO进攻底物的苯环,使苯环瞬间丧失芳香性,形成带正电荷的中间体,活化α位的质子,苯丙氨酸脱去氨基,形成不饱和酸(反式肉桂酸),MIO形成MIO-NH2中间复合物;第二步反应,中间复合物氨基和氢质子交给反式肉桂酸的不饱和双键的β位,形成β-苯丙氨酸,完成催化过程。因此,如果反应在催化完第一步后就结束了,体现的是苯丙氨酸裂解酶活性;如果完成这两步催化反应,则体现的是苯丙氨酸氨基变位酶活性。在MIO依赖型酶中,酶活中心上方覆盖的loop环的柔性大小对酶学性质起着重要的作用[10]。例如,BARTSCH等[11]将T. chinensis来源的PAM(TcPAM)酶活中心上覆盖的loop环柔性增大,loop的灵活性提高,酶活中心构象不稳定会导致肉桂酸中间体从酶活中心释放出来,增大了loop环的柔性,成功将氨基变位酶的活性变成氨基裂解酶的活性。反之,降低这些loop环的柔性、提高其稳定性,反应产生的中间体就不易从酶活中心释放出去,有利于上述两步反应中的第二步反应进行[12],有利于提高苯丙氨酸氨基变位酶的活性以及热稳定性。同时,催化产生(R)-β-苯丙氨酸的TcPAM,其酶活以及热稳定性都优于PaPAM,所以将PaPAM的氨基酸序列突变为TcPAM上的相应氨基酸,有望改进PaPAM的催化性质。
此外,多项研究表明[13-14],定点突变改造酶分子氨基酸组成,可有效提高酶的热稳定性。WU[15]将T. chinensis来源PAM的319 位带负电荷的谷氨酸突变成不带电荷的甲硫氨酸,获得突变酶PaPAM-Q319M,酶的区域选择性发生改变,氨基偏向添加在底物不饱和双键的β位。NAIK等[16]发现以下的氨基酸置换可能改变酶的热稳定性,比如带正电荷极性氨基酸之间的置换(赖氨酸Lys置换精氨酸Arg)、极性氨基酸置换非极性氨基酸(丝氨酸Ser置换丙氨酸Ala)以及极性氨基酸之间的置换(甘氨酸Gly置换丙氨酸Ala)。在酶的α-螺旋结构中,酶分子表面的丙氨酸与甘氨酸互换可导致疏水作用的增加,进而有可能导致酶分子稳定性的提高。另一种情况下,KHURANA[17]将酶分子表面的疏水氨基酸变为亲水氨基酸,提高了脂肪酶的稳定性。JAOUADI[14]通过优化丝氨酸蛋白酶表面电荷与电荷之间的相互作用提高了其热稳定性。
本文尝试改变P. agglomerans来源PAM酶活中心上方loop环上的氨基酸及与其相互作用位点氨基酸,分别突变为不同类型的氨基酸,降低loop环的柔性,以期稳定酶活中心的结构,提高酶的热稳定性及酶活。本研究为苯丙氨酸氨基变位酶的进一步应用奠定了基础。
1 材料与方法
1.1 菌株、质粒以及培养基
实验室保藏的Escherichia coli JM109以及E. coli BL21(DE3)菌株分别用于重组质粒的构建和基因表达。化学合成P. agglomerans来源的苯丙氨酸氨基变位酶的基因序列,并克隆到表达载体pET-28a的限制性酶切位点EcoR I和Hind III之间,得到重组质粒pET-28a-PAM。
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,加入抗生素(卡那霉素)的质量浓度为50 μg/mL。
1.2 材料与仪器
α-苯丙氨酸、β-苯丙氨酸,Sigma公司;蛋白纯化镍柱、蛋白纯化仪器,AKTA公司;高效液相色谱,日立公司;PCR仪器,BIO-RAD公司;多功能酶标仪,Bioteck公司;pH计,梅特勒-托利多仪器(上海)有限公司。
1.3 实验方法
1.3.1 基因操作
以质粒pET-28a-PAM为模板,采用定点突变(重叠延伸)方法突变野生PaPAM基因。相关引物如表1所示。PCR得到的基因产物用Dpn I酶消化以降解质粒模板,然后转化至E. coli JM109感受态细胞中。重组质粒经基因测序验证正确后,转化至E. coli BL 21(DE3)中构建PAM突变体表达菌株。
1.3.2 PaPAM酶的表达
挑取重组菌株单菌落接种于含5 mL质量浓度为50 μg/mL的卡那霉素LB培养基,37 ℃、200 r/min振荡培养10 h。将上述种子液培养物按体积分数为1%的接种量接种于含卡那霉素质量浓度50 μg/mL的LB培养基,37 ℃、200 r/min振荡培养至菌液OD600值为0.6~0.8,加入IPTG至终浓度0.1 mmol/L,20 ℃诱导培养16~20 h。
表1 本研究所用引物序列
Table 1 Oligonucleotide primers used in this study

引物名称基因序列(5’-3’)D73A-上AGCATGGTTAGTGCTGAACGTGTGATTTATGGTGTGD73A-下AATCACACGTTCAGCACTAACCATGCTTTCCAGAATD73E-上AGCATGGTTAGTGAAGAACGTGTGATTTATGGTGTGD73E-下AATCACACGTTCTTCACTAACCATGCTTTCCAGAATD73K-上AGCATGGTTAGTAAAGAACGTGTGATTTATGGTGTGD73K-下AATCACACGTTCTTTACTAACCATGCTTTCCAGAATV76S-上AGCATGGTTAGTGATGAACGTTCGATTTATGGTGTGV76S-下GCTGGTATTCACACCATAAATCGAACGTTCATCACTV76D-上AGCATGGTTAGTGATGAACGTGATATTTATGGTGTGV76D-下GCTGGTATTCACACCATAAATATCACGTTCATCACTV76C-上AGCATGGTTAGTGATGAACGTTGCATTTATGGTGTGV76C-下GCTGGTATTCACACCATAAATGCAACGTTCATCACTY90I-上AGCATGGGTGGTTTCGTTAACATTATTGTTCCGATTY90I-下TGCTTTTGCAATCGGAACAATAATGTTAACGAAACCY90V-上AGCATGGGTGGTTTCGTTAACGTTATTGTTCCGATTY90V-下TGCTTTTGCAATCGGAACAATAACGTTAACGAAACCY90F-上AGCATGGGTGGTTTCGTTAACTTTATTGTTCCGATTY90F-下TGCTTTTGCAATCGGAACAATAAAGTTAACGAAACCI91H-上ATGGGTGGTTTCGTTAACTATCATGTTCCGATTGCAI91H-下GCTTGCTTTTGCAATCGGAACATGATAGTTAACGAAI91M-上ATGGGTGGTTTCGTTAACTATTGGGTTCCGATTGCAI91M -下GCTTGCTTTTGCAATCGGAACCCAATAGTTAACGAAI91V-上ATGGGTGGTTTCGTTAACTATGTTGTTCCGATTGCAI91V -下GCTTGCTTTTGCAATCGGAACAACATAGTTAACGAAA95N-上ATTGTTCCGATTAATAAAGCAAGCGAACTGCAGAATA95N -下TTCGCTTGCTTTATTAATCGGAACAATATAGTTAACA95G -上ATTGTTCCGATTGGAAAAGCAAGCGAACTGCAGAATA95G -下TTCGCTTGCTTTTCCAATCGGAACAATATAGTTAACA95R-上ATTGTTCCGATTCGAAAAGCAAGCGAACTGCAGAATA95R-下TTCGCTTGCTTTTCGAATCGGAACAATATAGTTAACA439T-上GCAGAAAGCCGTACAAGCTGTATGCCGATGAGCATTA439T-下CGGCATACAGCTTGTACGGCTTTCTGCGGTAATGCTA439Y-上GCAGAAAGCCGTTACAGCTGTATGCCGATGAGCATTA439Y-下CGGCATACAGCTGTAACGGCTTTCTGCGGTAATGCTA439W-上GCAGAAAGCCGTTGGAGCTGTATGCCGATGAGCATTA439W-下CGGCATACAGCTCCAACGGCTTTCTGCGGTAATGCTF455Q-上AGCCTGAGTACCACCGGTGATCAACAGGATATTGTGF455Q-下ACCAAAGCTCACAATATCCTGTTGATCACCGGTGGTF455N-上AGCCTGAGTACCACCGGTGATAATCAGGATATTGTGF455N-下ACCAAAGCTCACAATATCCTGATTATCACCGGTGGTF455R-上AGCCTGAGTACCACCGGTGATCGTCAGGATATTGTGF455R-下ACCAAAGCTCACAATATCCTGACGATCACCGGTGGTG462W-上ATTGTGAGCTTTTGGCTGGTTGCAGCACGTCGTGTTG462W-下TGCTGCAACCAGCCAAAAGCTCACAATATCCTGAAAG462N-上ATTGTGAGCTTTAATCTGGTTGCAGCACGTCGTGTTG462N-下TGCTGCAACCAGATTAAAGCTCACAATATCCTGAAAG462A-上ATTGTGAGCTTTGCTCTGGTTGCAGCACGTCGTGTTG462A-下TGCTGCAACCAGAGCAAAGCTCACAATATCCTGAAA
1.3.3 重组蛋白的纯化和鉴定
离心收集培养后的重组菌体,按浓缩5倍体积比例重悬于蛋白结合缓冲溶液(50 mmol/L Na2HPO4、50 mmol/L NaH2PO4、500 mmol/L NaCl、20 mmol/L咪唑),超声破碎细胞,12000 r/min离心50 min,上清用0.22 μm滤膜过滤,获得粗酶液。用10 倍柱体积的结合缓冲溶液平衡5 mL的His Trap HF柱,取20 mL破碎上清液上样,用10倍柱体积的结合缓冲溶液洗去非特异性吸附的蛋白质,用8倍柱体积的500 mmol/L咪唑缓冲液线性洗脱蛋白质,收集样品后用透析袋密封,置于1/15 mol/L Na2HPO4和KH2PO4缓冲液(pH 8.5) 中4 ℃透析过夜,去除残余咪唑,获得纯酶。用SDS-PAGE方法[18]分析鉴定粗酶液和纯化后蛋白的纯度。
1.3.4 蛋白浓度的测定
蛋白质含量采用常规的Bradford法[19]测定。
1.3.5 酶活的测定
野生型酶和突变体纯酶在使用前调成相同的蛋白浓度。在1/15 mol/L Na2HPO4和KH2PO4缓冲液(pH 8.5)中加入200 μL 20 mmol/L α-苯丙氨酸为底物、再加入100 μg纯酶,反应终体积为0.5 mL,50 ℃下反应30 min,100 ℃灭活20 min。酶活力单位定义为:在50 ℃、pH 8.5、底物终浓度为8 mmol/L时,30 min内将1 μmol α-苯丙氨酸转化为1 μmol β-苯丙氨酸所需的酶量。
1.3.6 最适温度的测定
分别在30、40、50、60、70 ℃下测定酶的活性,将最高的酶活力定义为100%,绘制得相对酶活随温度变化曲线。
1.3.7 热稳定性的测定
在50 ℃分别保温30、60、90、120 min,以及在60 ℃条件下分别保温10、20、30 min,测定残留酶活性。定义保温0 min所测得的酶活为100%,绘制得相对残留酶活随温度变化曲线。
1.3.8 最适pH值的测定
在不同pH值的缓冲液中测定野生型酶和突变体酶的活性,定义最高酶活力值为100%,绘制得相对酶活随pH值变化曲线。其中pH 7.0~9.0缓冲液为50 mmol/L磷酸盐缓冲液,pH 9.0~11.0缓冲液为50 mmol/L Na2CO3缓冲液。
1.3.9 动力学常数的测定
以浓度范围为1~20 mmol/L α-苯丙氨酸为底物,在50℃下反应30 min,测量β-苯丙氨酸的生成反应速率,通过软件GraphPad Prism 5拟合得到Km与Vmax值,然后再根据Kcat = Vmax / [Enzyme]求得Kcat及催化效率常数Kcat/Km。
1.3.10 底物和产物的测定
底物反应后经0.22 μm有机滤膜过滤,用高效液相色谱检测。检测器为紫外检测(波长为210 nm),色谱柱为Diamonsil 5 μm C18(2)250 mm×4.6 mm,流动相为V(0.1%甲酸溶液)∶V(乙腈)=9∶1,检测时间为25 min,柱温为40 ℃,流速为0.5 mL/min,进样量为10 μL。
2 结果与分析
2.1 突变位点的选择
对不同来源PAM一级序列进行比对,获得了PaPAM的非保守氨基酸位点(图1)。

图1 P.agglomerans与T.chinensis来源的PAM序列比对
Fig.1 Sequence alignment of PAM
注:箭头所指为突变位点
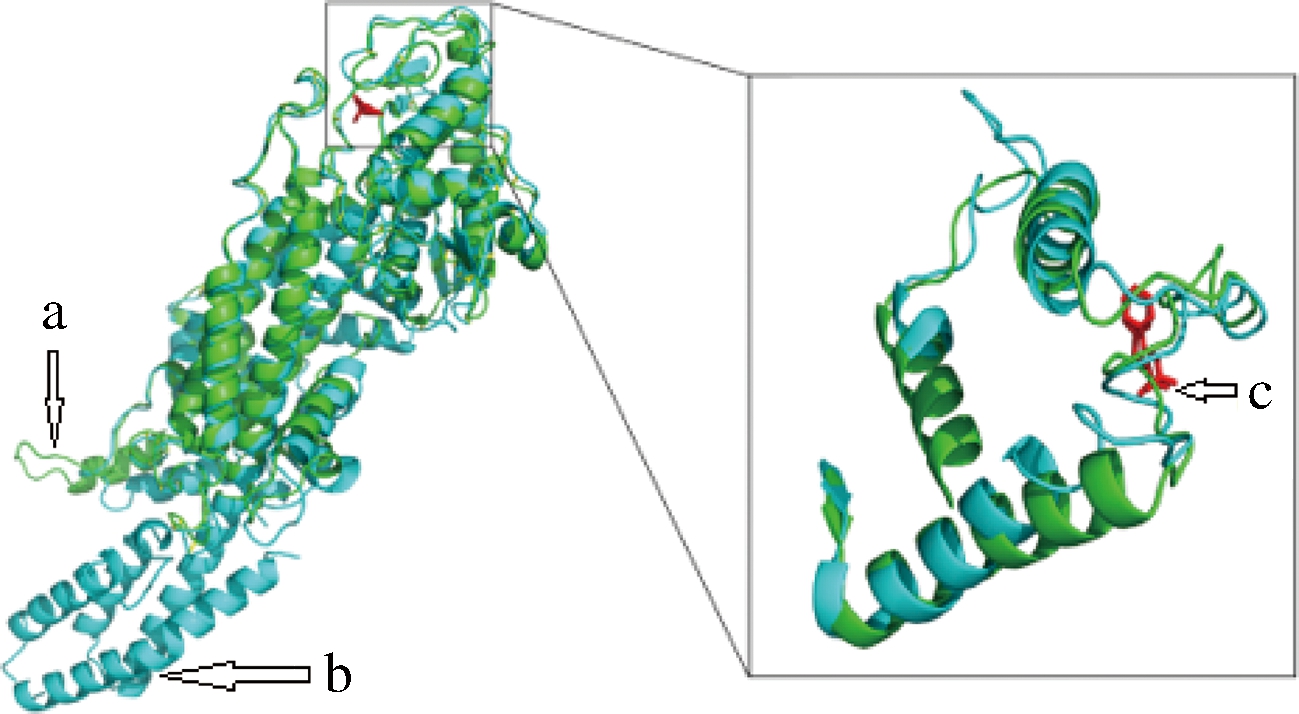
T. chinensis来源PAM的78位、92位、93位氨基酸对酶活中心上方loop环的柔性影响较大[11],本研究将P. agglomerans来源PAM的三级晶体结构与其进行比对(图2),发现2种来源酶的酶活中心结构高度相似,PaPAM上对应位点分别为76位、90位、91位(图3-a),且都为非保守位点。此外,选取PaPAM酶活中心上方其他loop环、且非保守位点73位、95位、439位、462位和455位进行突变(图3-b)。上述位点分别突变为不同类型的氨基酸,包括中性非极性氨基酸(甘氨酸、丙氨酸、色氨酸、缬氨酸、苯丙氨酸、甲硫氨酸)、带正电荷极性氨基酸(精氨酸、赖氨酸、组氨酸)和中性极性氨基酸(天冬酰胺、苏氨酸、酪氨酸、丝氨酸、半胱氨酸)、带负电荷极性氨基酸(谷氨酸)。突变点在三级结构中分布如图3所示。
a-P. agglomerans;b-T. chinensis;c-底物
图2 P.agglomerans与T.chinensis来源的PAM三级晶体结构比对
Fig.2 Third order crystal structure comparison of P.agglomerans and T. chinensis
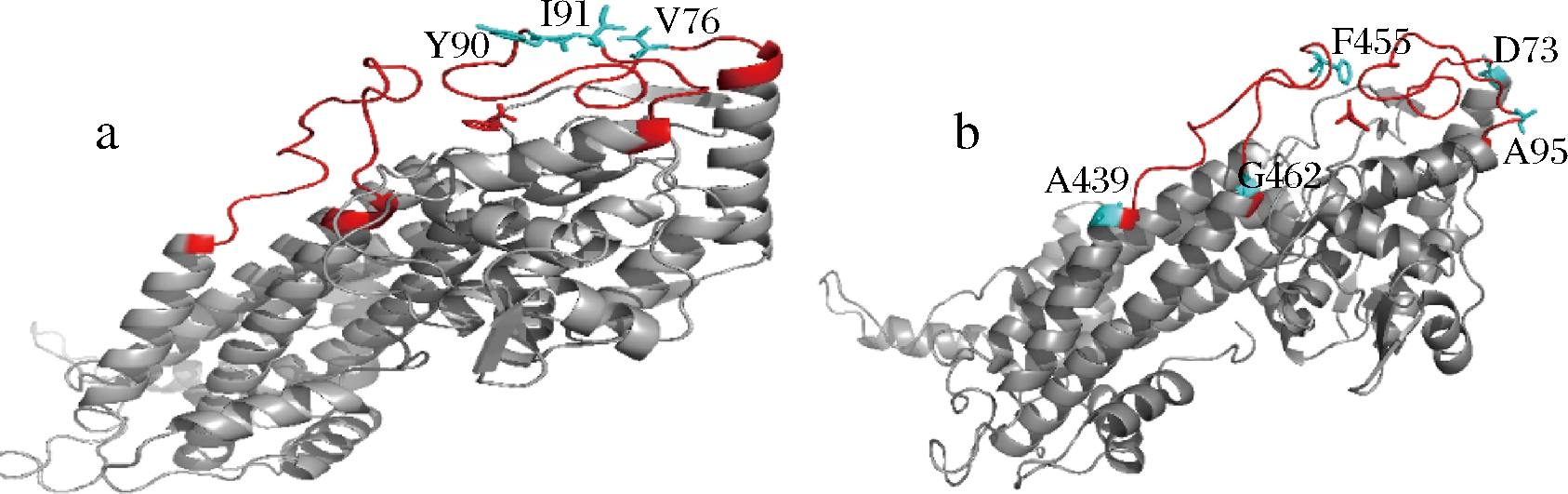
a-对比结果位置;b-loop两端位置
图3 突变位点在苯丙氨酸氨基变位酶三维结构中的分布
Fig.3 The distribution of mutants in PAM three-dimensional structure
注:数字所示为突变位点
2.2 单点突变的结果初步筛选
突变体纯酶液分别测定酶活,结果如图4-a所示。所有突变点中,A95R、I91M突变体的酶活比原酶有显著提高。439位的丙氨酸、455位苯丙氨酸和462位的甘氨酸距离酶活中心较近,经过突变后酶分子失活。
突变体纯酶液于50 ℃处理60 min后,测定剩余酶活,以分析其热稳定性。如图4-b所示,野生型PaPAM经过处理后仅剩余30%酶活,而多个突变体热稳定性明显提高,其中,突变体I91M、A95R的热稳定性明显提高,剩余酶活分别达到了83%、43%。如图4-c所示,60 ℃处理20 min后,野生型PaPAM经过处理后仅剩余40%酶活,而多个突变体热稳定性明显提高,其中,突变体I91M剩余酶活达到了88%。
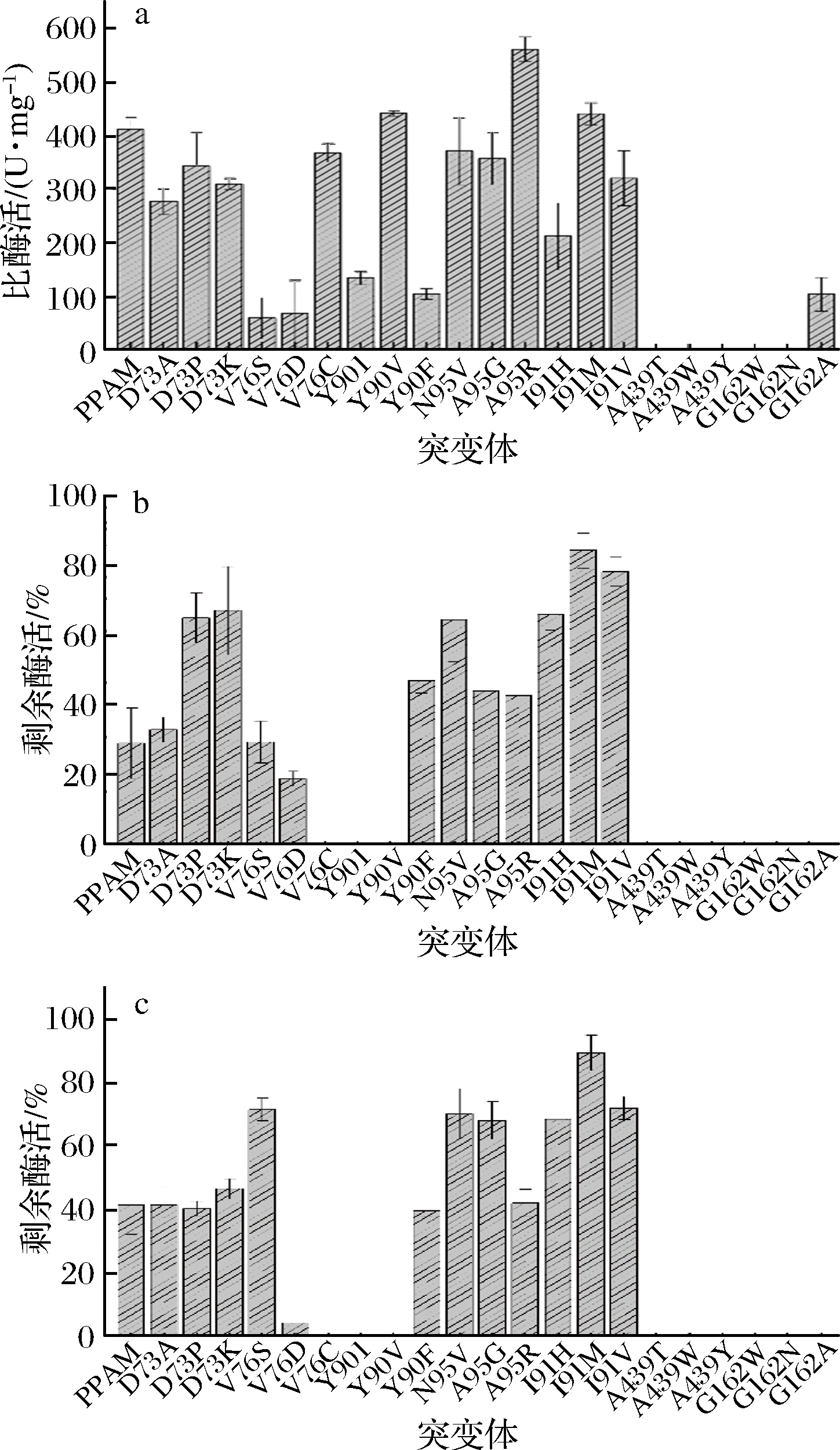
a-酶活筛选;b-50 ℃稳定性筛选; c-60 ℃稳定性筛选
图4 突变体初步筛选结果
Fig.4 Preliminary screening of single mutants
突变体I91M, A95R热稳定性提高,可能是由于稳定了酶活中心所覆盖的loop稳定性,导致结构变得更加稳定。因此,文本选择酶活提高的A95R和热稳定性显著提高的I91M突变体进行后续实验。
2.3 突变体酶学性质表征
将野生型PaPAM以及突变体I91M、A95R进行酶学表征。如图5-a所示,野生型PaPAM和A95R突变体的最适温度为50 ℃,而突变体I91M的最适反应温度提高到55 ℃;如图5-b,突变体的最适pH并未发生偏移。
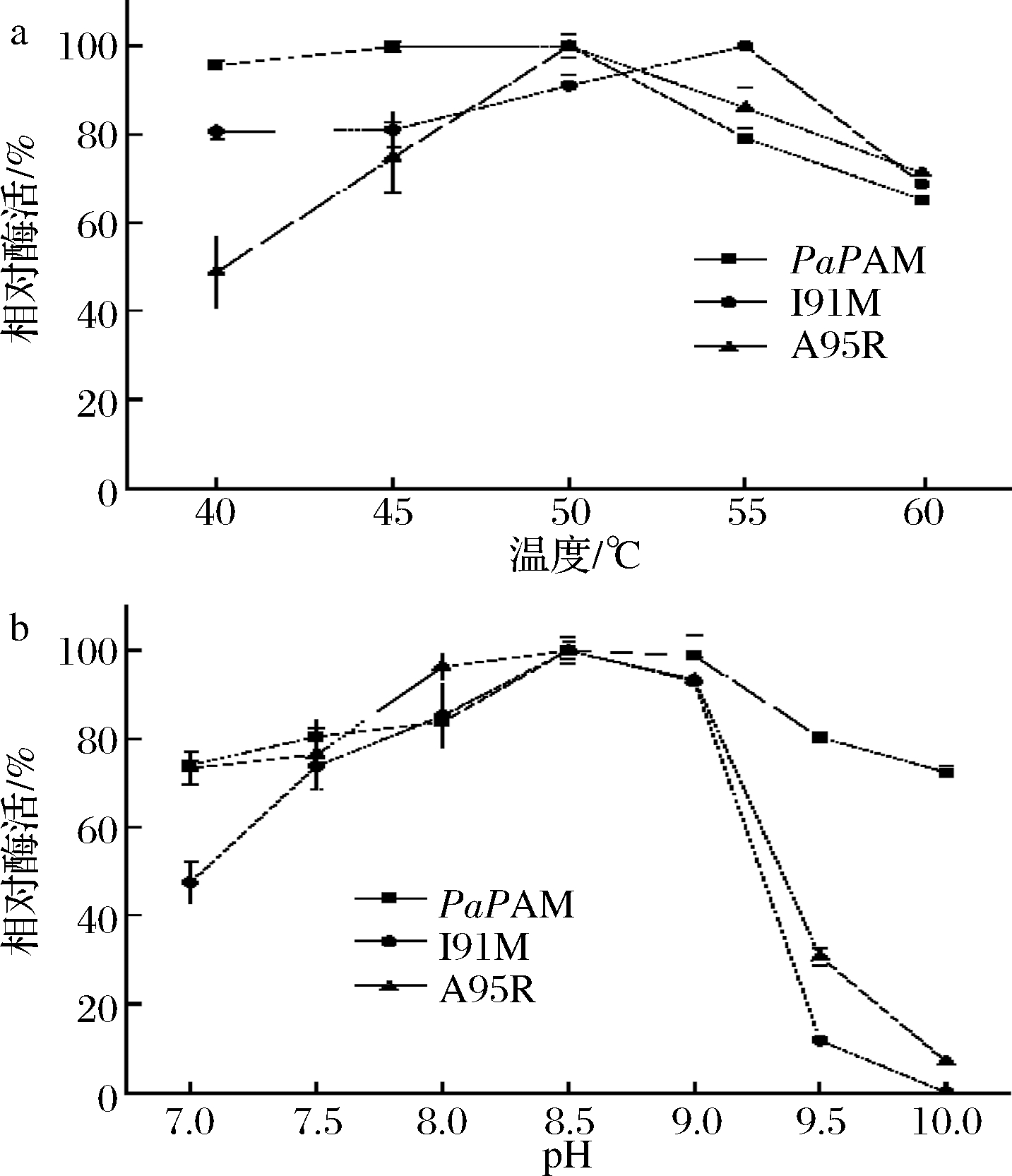
a-最适温度曲线;b-最适pH曲线
图5 最适反应条件的测定
Fig.5 Determination of the optimum reaction conditions
如图6所示,2个突变体的热稳定性明显提高,其中I91M在50 ℃保温60 min可残留83%酶活,而野生型PaPAM仅残余30%酶活。I91M突变体在50 ℃下的半衰期提高为107.59 min(表2),比野生型酶PaPAM(50 ℃下的半衰期仅为26 min)提高了4倍。
2.4 动力学常数的测定
为了研究催化活性,测定了突变体酶的动力学常数(如表3)。2种突变体Km值均大于野生型PaPAM,说明与底物的亲和能力减弱,可能原因是酶活中心的氨基酸突变影响了酶活中心与底物结合的周围环境所致。然而,突变体的Kcat均比野生型PaPAM提高了2倍以上,可能原因是稳定的酶活中心构象更有利于氨基变位的第二步反应进行[11]。
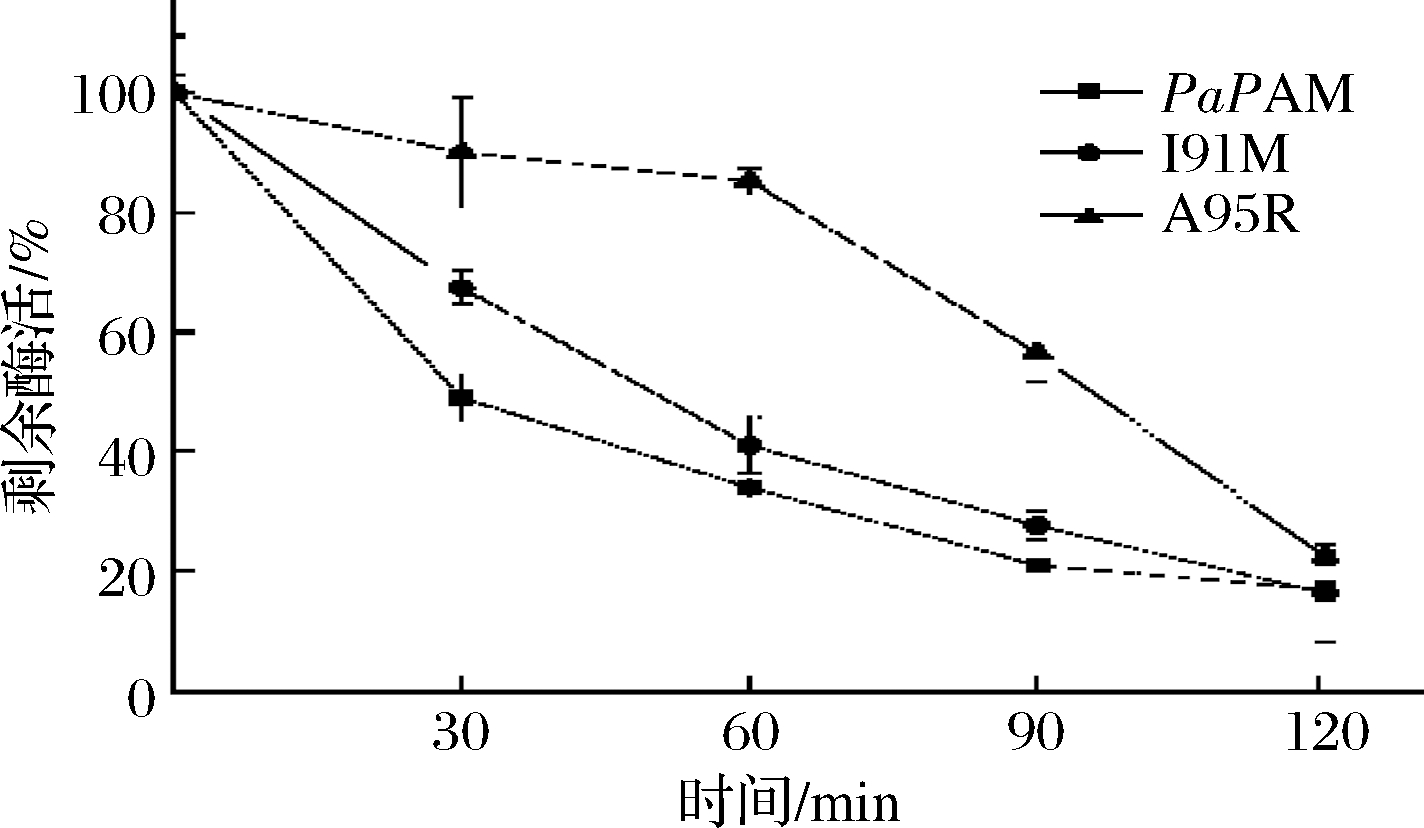
图6 热稳定性的测定原始酶与突变体的热稳定性(在50 ℃下残余酶活随时间变化)
Fig.6 Determination of the thermal stability of wild-type PAM and mutants were determined by monitoring residual activities over time (0 to 120 min) at 50 ℃
表2 野生型与突变体酶的半衰期值
Table 2 Half-life of wild-type PaPAM and mutants

酶半衰期/minPaPAM26.65±0.59I91M107.59±0.88A95R46.65±0.14
表3 野生型酶与突变体酶的动力学参数以及比酶活
Table 3 Kinetic parameters and specific activities of wild-type PAM and mutants
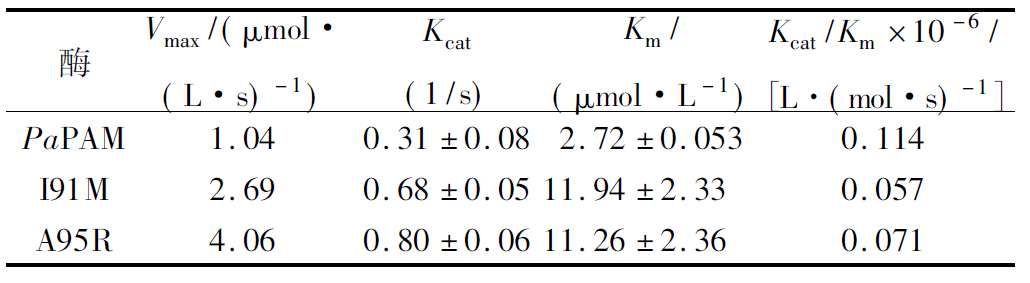
酶Vmax/(μmol·(L·s)-1)Kcat(1/s)Km/(μmol·L-1)Kcat/Km×10-6/[L·(mol·s)-1]PaPAM1.040.31±0.082.72±0.0530.114I91M2.690.68±0.0511.94±2.330.057A95R4.060.80±0.0611.26±2.360.071
另外,I91M的稳定性提高较多,但是Kcat值却不如A95R突变体高,原因可能是突变后的甲硫氨酸与底物氨基酸的苯环形成稳定的S/Π作用导致稳定性增加[12],酶活不高的原因可能是甲硫氨酸的硫原子同时参与形成配位键,增强了底物羧酸盐结合口袋[15],不利于底物与酶活中心附近氨基酸的质子传递。
3 讨论
本文通过基因定点突变构建重组的苯丙氨酸氨基变位酶突变体,通过筛选得到催化活性和热稳定性都显著提高的突变体I91M、A95R。其中I91M的热稳定性提高明显,50 ℃保温1 h,剩余酶活由野生型酶的30%左右提高至83%左右,并且其酶活比原始酶略有提高。
目前,在MIO依赖型酶中,催化因子Tyr所在的柔性区Tyr-loop对酶学性质起着相当重要的作用[10]。张帆[20]通过改变loop的柔性成功使苯丙氨酸氨基裂解酶的最适pH发生偏移,更适应酸性环境,并对治疗苯丙酮尿症(phenylketonurics, PKU)具有实际应用。
本文探究苯丙氨酸氨基变位酶催化中心上所覆盖的2个柔性loop环的稳定性对酶性质的作用,通过筛选loop环上的突变体,改善了酶的稳定性。该方法可作为一种改善酶稳定性的有效策略,为其他酶的改造提供参考。相信基于对蛋白酶三级结构的分析,在未来可以解析更多的蛋白酶催化机制,发现更多的应用。
[1] SUSAN S U W, NISHANKA D R, KEVIN D W,et al.Insights into the mechanistic pathway of the Pantoea agglomerans phenylalanine aminomutase[J], 2012, 124: 2 952-2 956.
[2] RATNAYAKE N D, WANNINAYAKE U, GEIGER J H, et al.Stereochemistry and mechanism of a microbial phenylalanine aminomutase[J].Journal of the American Chemical Society,2011, 133(22):8 531-8 533.
[3] SEBASTIAN B, UWE T B.Einfluss einer einzelnen Aminosäure auf den Reaktionsmechanismus von ammonium-lyasen und -mutasen[J].Angewandte Chemie International Edition,2009,121(18):3 412-3 415.
[4] WALKER K D,KLEKKTE K,AKIYAM T,et al. Cloning, heterologous expression, and characterization of a phenylalanine aminomutase involved in taxol biosynthesis[J]. Journal of Biological Chemistry, 2004, 279(52):53 947-53 954.
[5] HUANG S X,LOHMAN J R,HUANG T,et al.A new member of the 4-methylideneimidazole-5-one-containing aminomutase family from the enediyne kedarcidin biosynthetic pathway[J].Proceedings of the National Academy of Sciences,2013,110(20):8 069-8 074.
[6] RETEY J. Discovery and role of methylidene imidazolone, a highly electrophilic prosthetic group[J].Biochim Biophys Acta,2003,1647(1-2):179-184.
[7] SCHUSTER B, RETEY J.The mechanism of action of phenylalanine ammonia-lyase: the role of prosthetic dehydroalanine[J].Passedover by Nature and Science,1995,92(18):8 433-8 437.
[8] CHRISTIANSON C V,MONTAVON T J,FESTIN G M, et al.The mechanism of MIO-based aminomutases in beta-amino acid biosynthesis[J].Journal of the American Chemical Society,2007,129(51):15 744-15 745.
[9] WANK K,HOU Q,LIU Y.Insight into the mechanism of aminomutase reaction:A case study of phenylalanine aminomutase by computational approach[J].Journal of Molecular Graphics & Modelling,2013,46(46C):65-73.
[10] COOKE H A, CHRISTIANSON C V, BRUNER S D.Structure and chemistry of 4-methylideneimidazole-5-one containing enzymes [J].Current Opinion in Chemical Biology,2009,13(4):460-468.
[11] BARTSCH S, WYBENGA G G, JANSEN M, et al.Redesign of a phenylalanine aminomutase into a phenylalanine ammonia lyase[J].Chem Cat Chem,2013,5:1 797-1 802.
[12] DOURADO D F A R, POHLE S, CARVAIHO A T P,et al.Rational design of a (S)-selective-transaminase for asymmetric synthesis of (1S)-1-(1,1′-biphenyl-2-yl)ethanamine[J].ACS Catalysis,2016,6:7 749-7 759.
[13] KREIJ A D,BURG B V D,VENEMA G,et al.The effects of modifying the surface charge on the catalytic activity of a thermolysin-like protease[J]. Journal of Biological Chemistry, 2002, 277(18):15 432.
[14] JAOUADI B,AGHAJARI N,HASER R,et al.Enhancement of the thermostability and the catalytic efficiency of Bacillus pumilus CBS protease by site-directed mutagenesis[J].Biochimie,2010,92(4):360.
[15] WU B,SZYMANSKI W,WYBENGA G G, et al.Mechanism-Inspired engineering of phenylalanine aminomutase for enhanced β-regioselective asymmetric amination of cinnamates[J].Angewandte Chemie International Edition,2012,51(2):482-486.
[16] NAIK R R,KIRKPATRICK S M,STONE M O.The thermostability of an α-helical coiled-coil protein and its potential use in sensor applications[J].Biosensors and Bioelectronics,2001,16:1 051.
[17] KHURANA J,SINGH R,KAUR J.Engineering of Bacillus lipase by directed evolution for enhanced thermal stability:effect of isoleucine to threonine mutation at protein surface[J].Molecular Biology Reports,2011,38(5):2 919.
[18] 曹佐武. 有效分离1 kDa小肽的Tricine-SDS-PAGE方法[J].中国生物工程杂志,2004, 24(1):74-76.
[19] BRADFORD MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2): 248-254.
[20] ZHANG F, HUANG N, ZHOU L, et al.Modulating the pH-activity profiles of phenylalanine ammonia-lyase from Anabaena variabilis by modification of center-near surface residues [J].Applied Biochemistry and Biotechnology,2017,183:699-711.