白酒独特的生产工艺和风味特征使其成为世界蒸馏酒的典型代表,是中国最具民族文化特色的产品之一,在我国拥有庞大的消费群体和文化基础[1]。芝麻香型白酒作为我国传统白酒的创新香型,以独特的清浓酱融合的风味特点和优雅的芝麻香而闻名,符合白酒淡雅、爽净的消费趋势[2-4]。高温大曲作为芝麻香型白酒酿造的微生物载体和糖化发酵剂,为白酒酿造提供了丰富的微生物菌种、生物酶类以及独特的芝麻香味成分和前体物质,是芝麻香型白酒特殊风味形成的关键因素之一[5-7]。微生物作为大曲制备的关键性因素,以功能基因为基础产生多种生物酶类和香味成分及其前体物质,对白酒独特风味的形成具有重要作用[8-11]。
高温大曲中的功能菌与白酒产香关系密切,采用16S rRNA基因克隆文库技术分析芝麻香型白酒高温大曲,结果表明,在大曲入房时以泛菌属(Pantoea)为优势类群,随着制曲时间的延长,温度升高,高温放线菌(Thermoactinomyces)等耐高温菌属成为优势菌系,其变化趋势与品温较一致,呈现先升高再降低的趋势[12];16S rRNA基因高通量测序结果也表明在高温大曲中高温放线菌为优势类群[13]。通过ARDRA技术和分离培养方法可从高温大曲中获得普通高温放线菌(T. vulgaris)、中间型高温放线菌(T. intermedius)、大曲高温放线菌(T. daqus)等多株高温放线菌属菌种[14]。该属微生物常见于自然界高温场所,具备耐高温特性,适应大曲发酵中的高温环境,具备开发高温淀粉酶、蛋白酶、酯酶、脱氢酶和多酚氧化酶等潜力[15-18],可促进蛋白降解产生多种氨基酸,为酯化反应及美拉德反应提供前体物质,促进芝麻香风味的形成,在芝麻香白酒酿造中起到重要作用[19-23]。这些微生物作用均与功能基因紧密相关,高温大曲为白酒酿造提供丰富的微生物资源和功能基因,明析高温放线菌中功能基因在大曲制备过程中的分布及变化规律,有助于深入解析该菌属在大曲及白酒酿造过程的作用机制。
但目前对芝麻香型白酒高温大曲的研究主要集中在菌种的分离筛选及微生物群落结构分析上,对于芝麻香型大曲制备过程中特定菌种的功能基因组成及动态变化规律研究还处于起步阶段。为此,本研究针对芝麻香型白酒高温大曲的制备过程,应用宏基因组学分析技术,揭示白酒酿造高温大曲中高温放线菌及其功能基因的组成及动态变化规律,为高温大曲中特定功能酶系及菌株的筛选提供理论基础,为解析高温放线菌在白酒酿造中的具体功能作用及定向调控提供技术支撑,对探究芝麻香白酒风味物质形成机理、提升芝麻香型白酒生产品质具有重要意义。
1 材料与方法
1.1 实验材料
1.1.1 试剂
E.Z.N.A.TM Soil DNA Kit DNA提取试剂盒,Omega Bio-tek, Inc., USA;MGIEasy DNA文库制备试剂盒,深圳华大智造科技有限公司;Qubit® dsDNA HS Assay Kit试剂盒,赛默飞世尔科技(中国)有限公司;DNA Marker,北京全式金生物技术有限公司;Gold View,北京塞百盛基因技术有限公司;实验中所使用的各种其他无特别说明的化学试剂均为进口或国产分析纯产品。
1.1.2 仪器与设备
BGISEQ-500基因测序仪,深圳华大智造科技有限公司; Centrifuge 5424 R台式高速冷冻离心机,德国Eppendorf公司;Eppendorf微量移液器,德国Eppendorf公司;HH-3A电热恒温水浴锅,常州国华电器;DG-Ⅲ型双稳数显电泳仪,北京鼎国生物技术发展公司;DYY-Ⅲ型水平电泳槽,北京六一仪器厂;紫外/可见凝胶成像系统,Bio-Rad公司。
1.2 实验方法
1.2.1 样品采集
2017年7月开展山东扳倒井股份有限公司18#曲房大曲的跟踪采样工作,根据不同发酵时期的发酵特点结合大曲发酵过程的操作工艺,对大曲制备过程中各个工艺阶段样品进行采集,工艺阶段包括入房(A,32 ℃)、入房第2天(B,34.5 ℃)、一翻前(C,入房4 d,41.3 ℃)、一翻(D,入房5 d,42.7 ℃)、一翻后(E,入房6 d,40.7 ℃)、二翻前(F,入房7 d,41.0 ℃)、二翻(G,入房8 d,41.7 ℃)、二翻后(H,入房9 d,45.5 ℃)、顶温(I,入房29 d,60.0 ℃)、出房(J,入房36 d,36.3 ℃);采用五点法在曲房的四周和中间各取一块曲样,共5块大曲,粉碎曲样,采用四分法进行随机取样,样品均分为两部分,一部分用于微生物菌群分析,另一部分用于理化指标分析[17-18]。对取样时发酵时间、曲样品温、曲房环境温度及相对湿度变化进行记录。采用山东扳倒井股份有限公司企业标准《大曲评分标准》(BDJ/JW—WSW-06)及《酿酒大曲通用分析方法》(QB/T 4257—2011)对大曲样品水分、酸度、糖化力、发酵力、液化力和酯化力等理化性质进行测定。
1.2.2 大曲总DNA提取
采用E.Z.N.A.TM Soil DNA Kit提取第2批取样的18#曲房大曲总DNA。基因组提取操作流程按照试剂盒说明书进行。
1.2.3 宏基因组测序
1.2.3.1 DNA文库构建及测序
采用Qubit® dsDNA HS Assay Kit试剂盒检测大曲总DNA样品的浓度,进而采用MGIEasy DNA文库制备试剂盒构建测序文库,操作流程严格按照使用说明书进行。
1.2.3.2 DNA文库测序
采用BGISEQ-500基因测序仪对构建的DNA文库进行测序,操作流程按照使用说明书进行。
1.2.4 宏基因组数据分析
1.2.4.1 数据质控过滤
利用metaWRAP软件(v1.0.2) 结合SOAPnuke(v1.5.6)软件完成下机数据的质控过滤,由于大曲中主要原料为小麦,在提取DNA过程中会引入小麦DNA,从而造成宿主污染,通过比对小麦基因组序列去除大曲DNA样品中宿主序列,免除小麦宿主序列对后续分析的干扰。
1.2.4.2 宏基因组De Novo拼接
metaWRAP软件(v1.0.2)整合了metaSPAdes和megaHIT两个用于宏基因组组装的软件,使用metaSPAdes完成宏基因组拼接。
1.2.4.3 基因预测及基因集构建
首先使用metaGeneMark(v2.10)在组装结果中预测开放阅读框(ORFs),然后将不用样品预测出的基因合并在一起,使用CD-Hit进行聚类(序列相似度在95%以上),以去除冗余序列。以大曲宏基因组注释基因为基础,将高温放线菌属中典型种的基因组序列在大曲宏基因组注释基因数据中进行比对,得到高温放线菌属功能基因分布情况。
1.2.4.4 物种组成分析
利用metaWRAP软件(v1.0.2)结合Kraken(V2.0.7-beta)软件完成物种组成分析。
1.2.4.5 基因注释分析
利用GhostKOALA将数据在线提交至KEGG数据库完成KEGG pathway分析;预测的基因使用blast与CAZy数据库比对得到碳水化合物活性酶基因信息。
1.2.5 数据统计处理
相关数据的统计及绘图利用Excel和R(v3.5.0)等完成。利用R语言中的Hmisc包开展数据的相关性分析,利用R语言中的performance analytics包开展相关性分析结果的可视化。
2 结果与分析
2.1 大曲中高温放线菌属的分布及变化规律
采用BGISEQ-500基因测序仪对大曲宏基因组样品进行测序,原始数据经质控过滤、去宿主序列、拼接组装后,所得contig数量维持在5 000以上,平均contig长度大于2 000 bp,满足后续物种及基因注释要求。
高温放线菌属(Thermoactinomyces)菌种在各样品中随入房时间的变化趋势与品温变化有较高的一致性,入房时基本无高温放线菌属菌种分布,随着入房时间延长,大曲品温升高,高温放线菌属也随之富集,在大曲顶温过后温度下降时,其相对丰度也呈下降趋势(图1)。这可能与高温环境对不耐热微生物的淘汰作用有关,也与高温放线菌属菌种生长特性一致,在品温40 ℃以上时,高温放线菌属菌种生长良好,有利于其在大曲中的富集。

图1 高温放线菌属在各样品中的分布及变化情况
Fig.1 Distribution and variation of Thermoactinomyces in Daqu samples
以高温放线菌属的分布情况与大曲理化性相关性分析表明,水分、酸度、液化力、品温、入房时间均与大曲高温放线菌属显著相关,其与大曲理化性质等环境因子的相关性处于较强的水平,与水分、酸度呈显著负相关关系,与液化力、品温及入房时间呈显著正相关关系(表1)。
表1 大曲核心微生物与理化性质相关性分析
Table 1 Correlation analysis between core microbiome and physicochemical properties of Daqu
菌属水分酸度糖化力发酵力液化力酯化力品温入房时间Thermoactinomyces-0.864-0.889//0.716/0.7160.831
注:只标注显著相关的因素,非显著相关的因素为空白。
由表1可见,大曲中高温放线菌属与大曲理化性质具备相互影响的可能性,也表明大曲的理化因素如发酵力、液化力、品温等对于大曲中微生物群落具备潜在的调节作用,详细了解两者的相关关系,有助于解析微生物对大曲品质的作用,可为定向调控大曲中微生物组成进而提升大曲品质提供理论基础。
2.2 大曲中高温放线菌功能基因的分布及变化规律
以大曲宏基因组注释基因为基础,将高温放线菌属中典型种的基因组序列在大曲宏基因组注释基因数据中进行比对,得到高温放线菌属的功能基因分布,结果表明在大曲宏基因数据中共比对到1 449个KEGG注释基因(图2)。KEGG注释的基因主要分为genetic information processing(210),environmental information processing(160),metabolism(666)(global and overview maps、carbohydrate metabolism、amino acid metabolism、nucleotide metabolism、engry metabolism、lipid metabolism、metabolism of cofactors and vitamins),cellular process(78)、organismal system(41)、human diseases(81)6个主要功能组别。其中与metabolism相关的基因数量约占被注释全部基因的45.96%。metabolism中具有较多基因数目的代谢途径有carbohydrate metabolism、amino acid metabolism、nucleotide metabolism等途径,与细胞基本代谢相关。
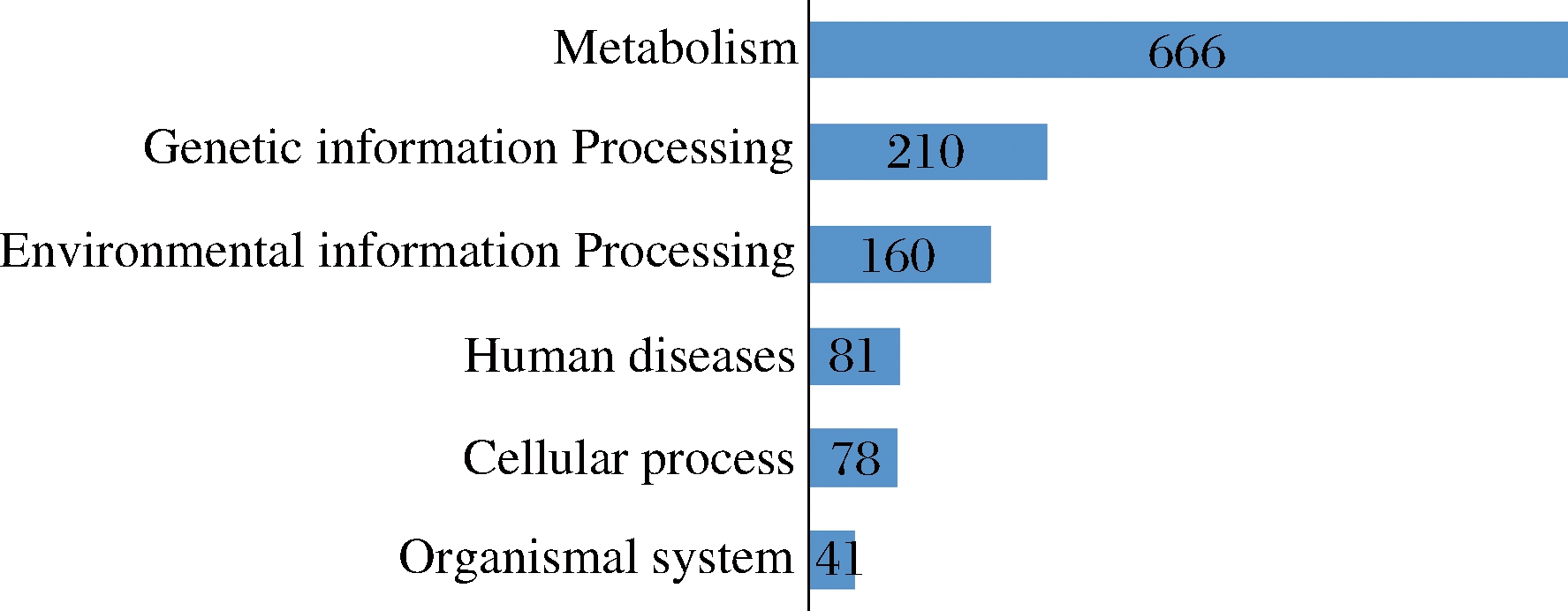
图2 高温放线菌在大曲宏基因组中比对到的KEGG注释基因数量
Fig.2 Annotation of Daqu metagenomic genes in KEGG database
对高温放线菌基因在各工艺阶段大曲样品中的分布和变化情况统计如图3,入房至二翻的工艺阶段,其占宏基因组的相对丰度总量相似,在二翻后、顶温及出房大曲中功能基因相对丰度升高,这与该菌属的相对丰度分布较为一致。入房大曲中,转运ATP酶(K02112)、精氨基琥珀酸裂解酶(K01755)、丙酮酸激酶(K00873)为优势基因,这些基因主要参与微生物的基础代谢,涉及微生物的氧化磷酸化反应、氨基酸代谢反应以及糖酵解反应。
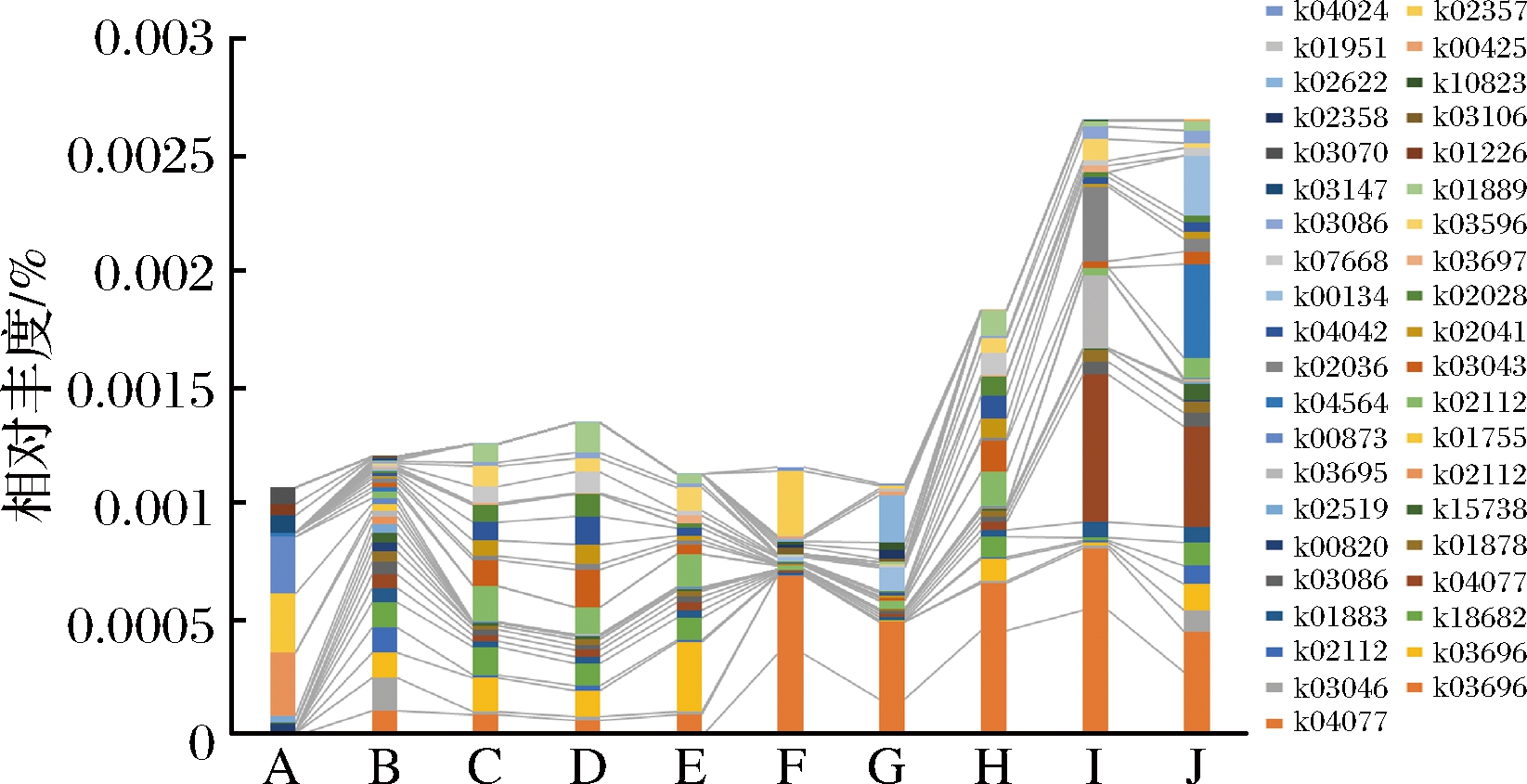
图3 各工艺阶段大曲中高温放线菌KEGG注释基因分布
Fig.3 Distribution of Thermoactinomyces genes annotated in KEGG database in Daqu with different fermentation stages (10 genes with the highest relative abundance in each sample were selected)
随入房时间延长大曲品温升高,碱性磷酸酶蛋白(Clp, K03695)、groEL分子伴侣(K04077)、磷酸转运系统ATP结合蛋白(pstB, K02036)等成为优势基因(图4),Clp属于热休克蛋白HSP100家族,在高温胁迫下可与其他结构不稳定的蛋白结合促进蛋白质的稳定性,防止蛋白质凝聚变性,并可协同其他分子伴侣修复变形的蛋白,在抵抗高温胁迫过程中起到重要作用[24-25]。groEL分子伴侣属于热休克蛋白HSP60家族,可提高蛋白质的正确折叠与组装效率,在热胁迫的变性蛋白恢复过程中发挥重要作用[26-27]。pstB属于ABC转运子家族,可以结合并水解ATP,可为细胞的磷酸转运系统提供能量,参与磷的转运功能,与细胞生物活性密切相关[28]。这些与微生物耐热相关的基因菌存在随温度升高而上升的趋势,说明随大曲品温升高,高温放线菌启动了相应的耐热应答机制,相关耐热基因含量提升,为其在高温环境中的生存提供良好的物质基础。
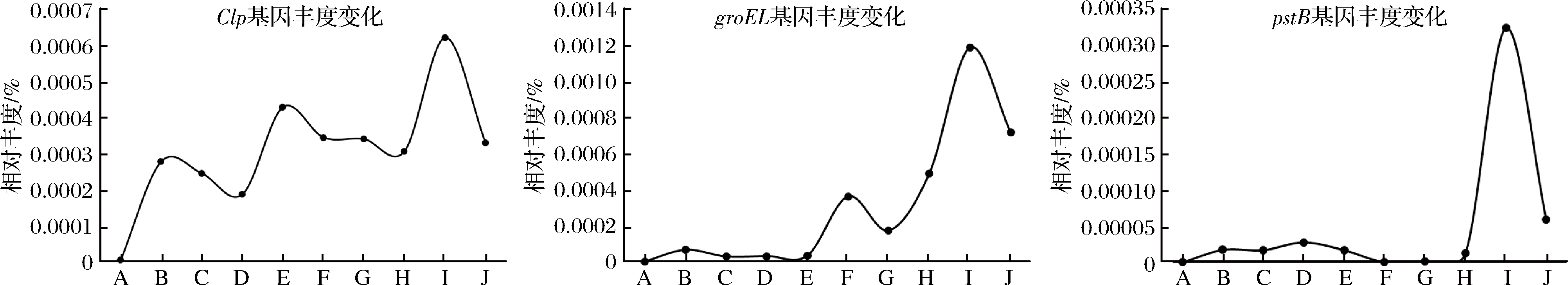
图4 各工艺阶段大曲中高温放线菌耐热基因分布
Fig.4 Distribution of Clp, groEL and pstB genes of Thermoactinomyces in Daqu samples
相关性分析显示,Clp, groEL, pstB基因和高温放线菌丰度及大曲品温之间,均呈显著正相关关系(图5)。
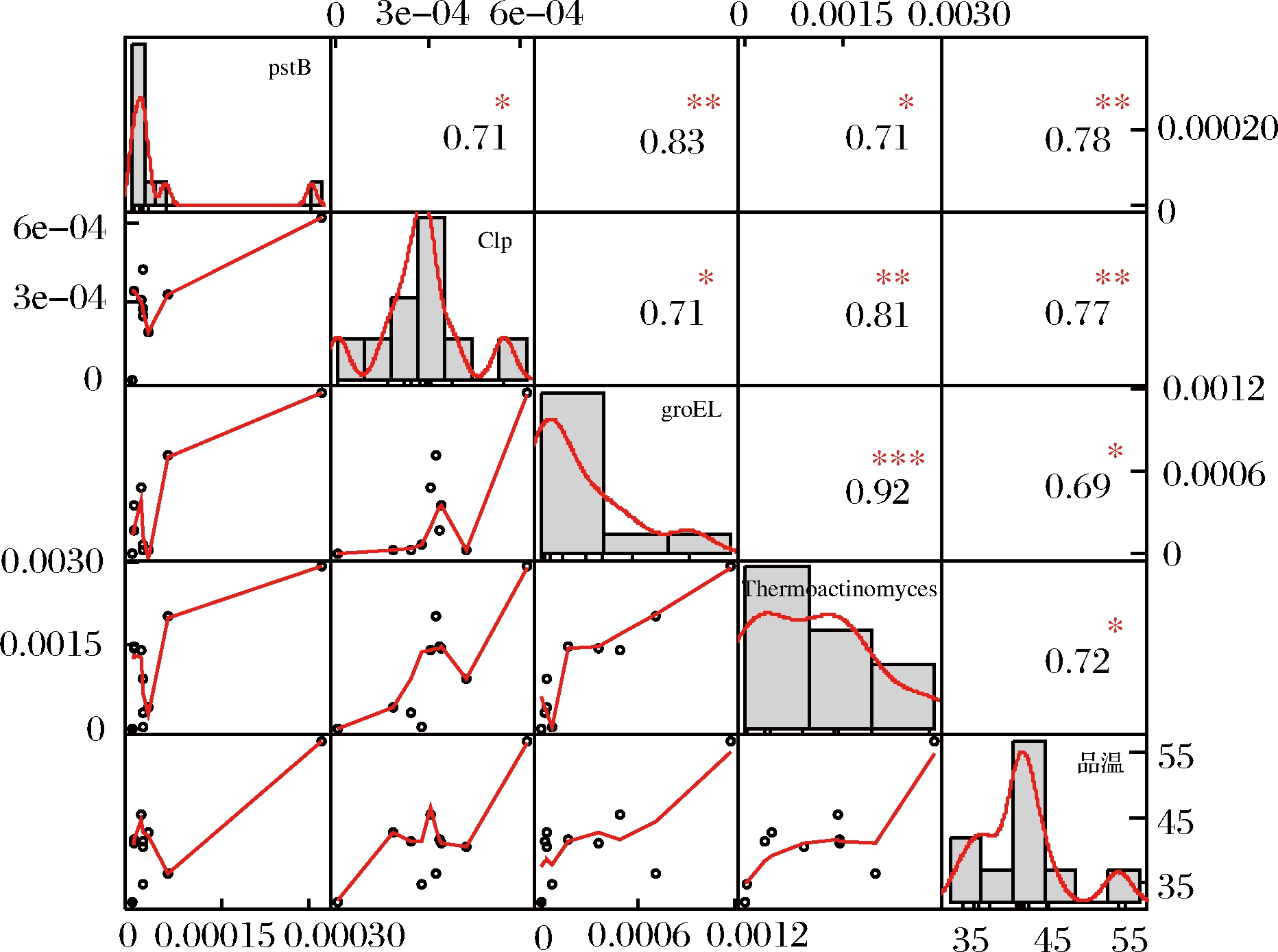
图5 Clp, groEL, pstB基因、高温放线菌丰度和大曲品温的相关性分析
Fig.5 Correlation analysis of Clp, groEL, pstB genes,Thermoactinomyces and Daqu temperature
这也说明了这些潜在耐热基因的丰度与高温放线菌保持较高的一致性,都在大曲品温提升时,高温放线菌相对丰度升高,相应的耐热基因数量也呈现增高趋势,从而提升高温放线菌在高温下的生存能力进而发挥其功能作用。
大曲作为白酒酿造的糖化发酵剂,含丰富的碳水化合物活性酶,解析其中相关酶的基因分布及变化规律,有助于明析其对原料碳水化合物的代谢能力及作用机制,为进一步研究大曲中微生物的作用机制及调控技术奠定理论基础。以大曲宏基因组的碳水化合物活性酶数据库(CAZy)注释基因为基础,高温放线菌在其中共比对到17个基因,主要分为糖基水解酶(GH,8个)、糖酯酶(GE,4个)、糖基转移酶(GT,4个)、碳水化合物结合结构域(CBM,1个)(图6)。
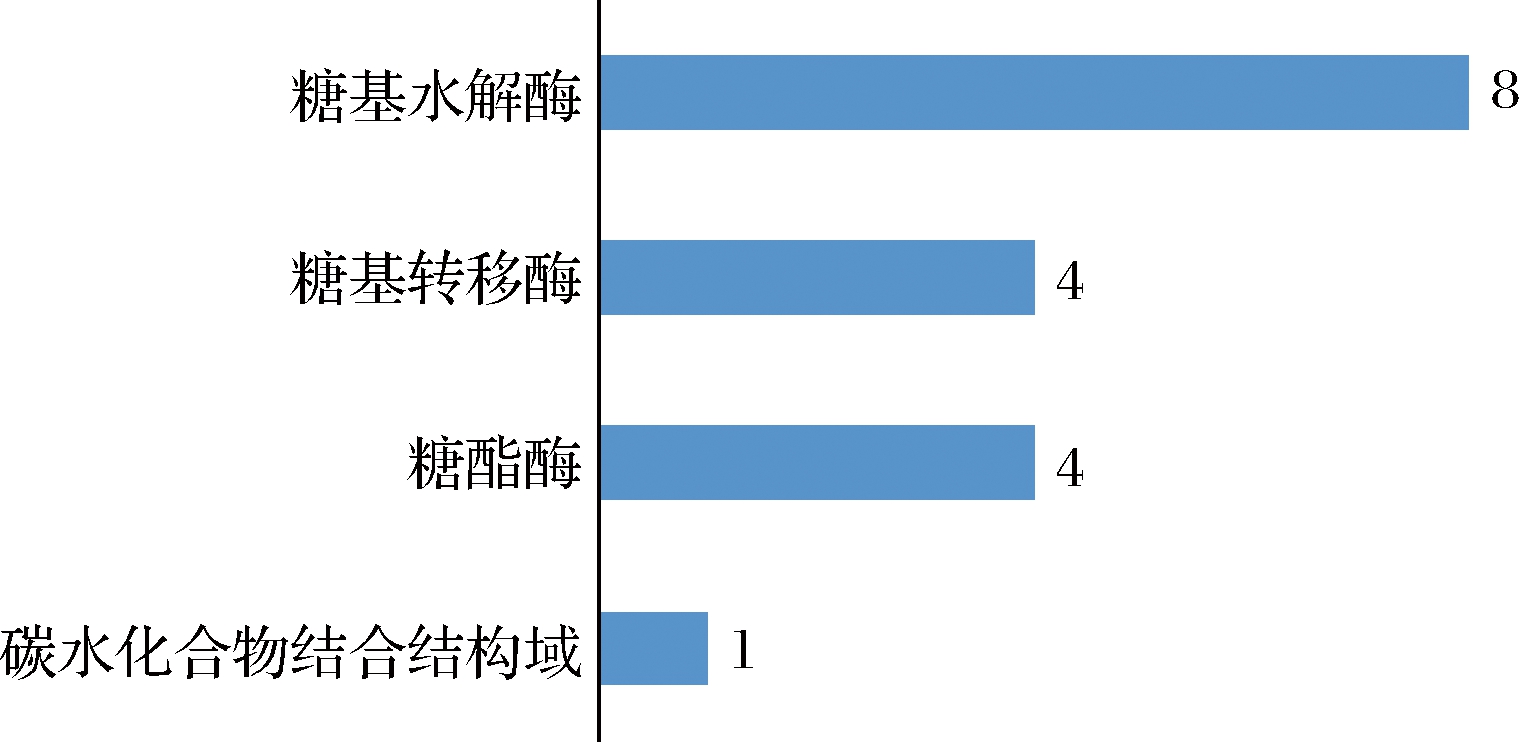
图6 高温放线菌在大曲宏基因组中比对到的CAZy注释基因数量
Fig.6 Annotation of Daqu metagenomic genes in CAZy database
高温放线菌CAZy注释基因在入房至二翻前的工艺阶段占宏基因组的相对丰度总量相似,在二翻之后大曲中功能基因相对丰度逐渐升高,出房曲中碳水化合物活性酶基因的种类和丰度达到峰值(图7),预示高温放线菌相关碳水化合物代谢能力在出房曲中大幅提升,也有助于大曲发挥相应功能作用。入房大曲中,高温放线菌只有α-淀粉酶基因分布,随制曲时间延长,大曲高温放线菌中碳水化合物活性酶基因数量与种类增多,出房大曲中相关基因达17种,主要由α-淀粉酶、乙酰基木聚糖酯酶和葡萄糖苷酶等组成,这些基因的富集可促进大曲原料中的碳水化合物的降解,为微生物生长提供必要的能量及代谢底物。
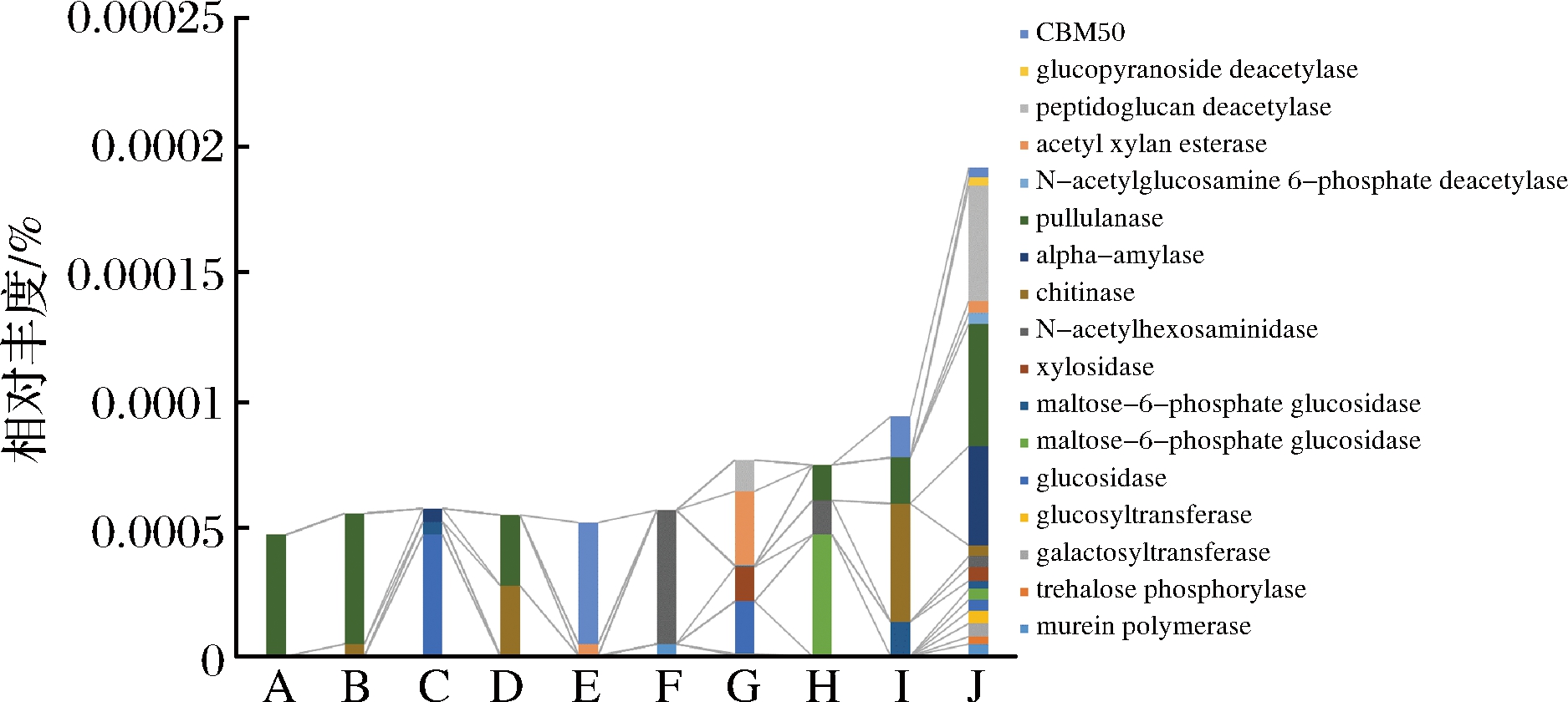
图7 各工艺阶段大曲中高温放线菌CAZy注释基因分布
Fig.7 Distribution of Thermoactinomyces genes annotated in CAZy database in Daqu with different fermentation stages
相关性分析显示,高温放线菌中糖基水解酶(GH)、糖基转移酶(GT)基因与大曲糖化力显著正相关,糖基水解酶(GH)、糖基转移酶(GT)、糖酯酶(GE)基因与大曲酯化力显著正相关(图8),可见高温放线菌中碳水化合物活性酶相关基因对大曲糖化力与酯化力的提升有潜在的促进作用,也预示了高温放线菌具备潜在的碳水化合物降解能力,促进大曲中原料的利用,有助于提升大曲发酵品质。入房时间与糖基水解酶(GH)基因、糖基转移酶(GT)基因、CZAy注释基因、高温放线菌丰度、糖化力及酯化力均显著正相关,与水分、酸度显著负相关,说明随大曲发酵时间延长,大曲本身水分降低,酸度下降,其中高温放线菌丰度上升,碳水化合物降解相关基因逐渐富集,糖化力与酯化力提升,促使大曲发酵成熟。
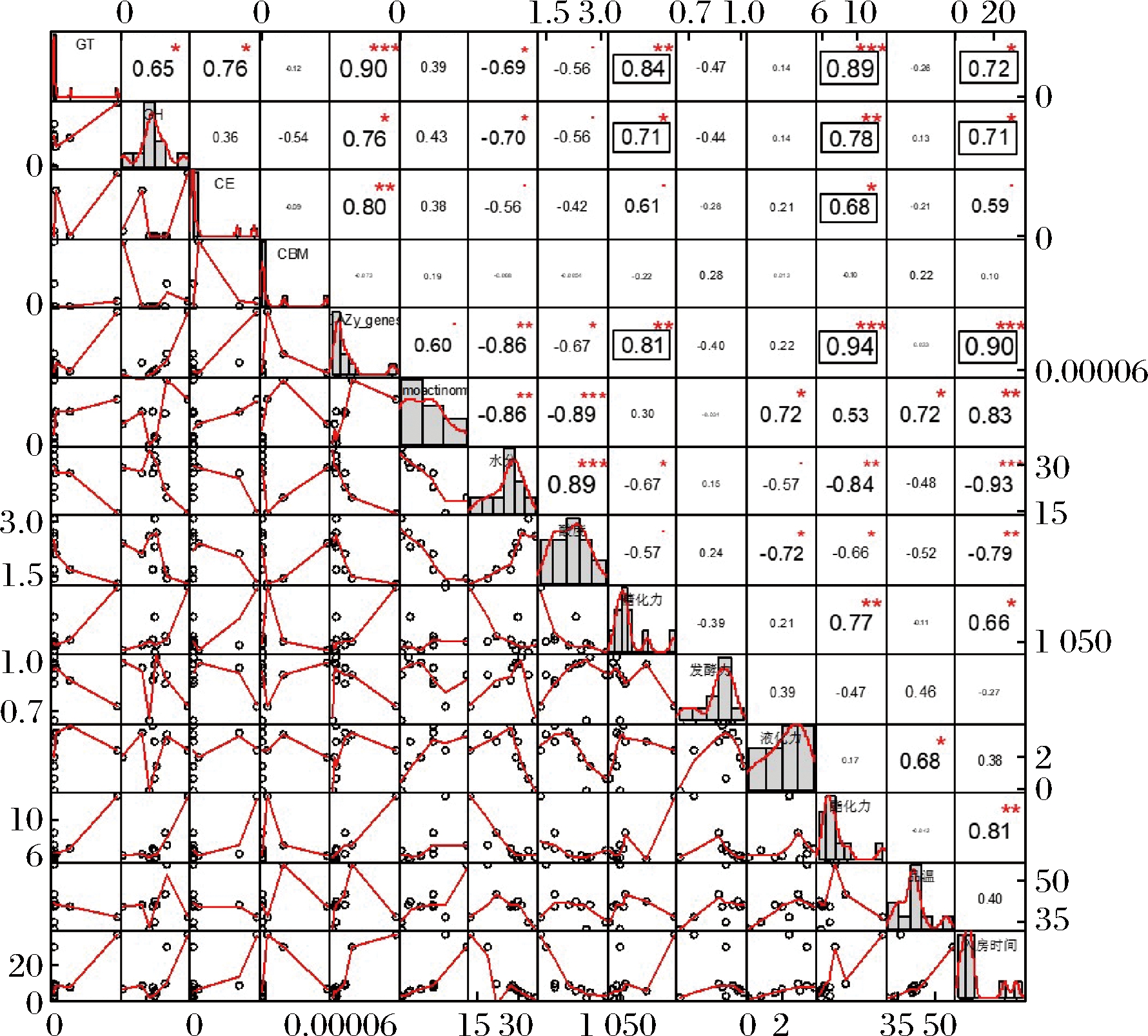
图8 高温放线菌CAZy注释基因与理化性质相关性分析
Fig.8 Correlation analysis between Thermoactinomyces genes annotated in CAZy database and physicochemical properties of Daqu
3 结论
本研究以芝麻香型白酒高温大曲为研究对象,通过宏基因组测序技术解析了其制备过程中高温放线菌属及其功能基因的动态变化规律,结果表明高温放线菌属在大曲入房时基本无分布,随着大曲品温升高,高温放线菌属也随之富集,整体呈现先升高再降低的变化过程,其变化趋势与品温呈显著正相关关系;高温放线菌功能基因在入房大曲中以转运ATP酶、精氨基琥珀酸裂解酶、丙酮酸激酶为优势基因,随入房时间延长大曲品温升高,Clp碱性磷酸酶蛋白、groEL分子伴侣、磷酸转运系统ATP结合蛋白等潜在耐热基因成为优势基因,从而有效提升高温放线菌在高温下的生存能力,为其在大曲中发挥相关功能奠定基础。入房时间与CZAy注释基因、高温放线菌丰度、糖化力及酯化力均显著正相关,与水分、酸度显著负相关,糖基水解酶、糖基转移酶基因与大曲糖化力与酯化力显著正相关,说明大曲发酵过程中水分与酸度降低,其中高温放线菌丰度上升,碳水化合物降解相关基因逐渐富集,促进大曲糖化力与酯化力提升,初步揭示了高温放线菌及其功能基因与大曲理化性质的关系,为微生物及高温大曲在白酒酿造中的功能作用解析及定向调控提供技术支撑,对提升芝麻香型白酒生产品质具有重要意义。
[1] 韩金宏, 励建荣. 我国白酒行业的现状和发展前景[J]. 农产品加工, 2006(2):50-52.
[2] 高传强, 阳飞,张华山. 芝麻香型白酒微生物菌群及风味物质研究进展[J]. 微生物学通报, 2017, 44(4):940-948.
[3] 来安贵, 赵德义,曹建全. 芝麻香型白酒的发展历史、现状及发展趋势[J]. 酿酒, 2009, 36(1):91-93.
[4] 车明秀, 胡明燕,王骏,等. 芝麻香型白酒风味物质主体成分研究进展[J]. 酿酒科技, 2016(11):97-99.
[5] 杨代永, 范光先,汪地强,等. 高温大曲中的微生物研究[J]. 酿酒科技, 2007(5):37-38.
[6] 沈怡方. 芝麻香型白酒的生产实践总结[J]. 酿酒, 2017, 44(1):3-6.
[7] 岳腾飞, 程伟,张杰,等. 芝麻香型白酒的酿造生产及其工艺创新研究进展[J]. 酿酒, 2018,45(2):6-10.
[8] ZHENG X W, YAN Z, HAN B Z, et al. Complex microbiota of a Chinese “ Fen ” liquor fermentation starter (Fen-Daqu), revealed by culture-dependent and culture-independent methods[J]. Food Microbiology, 2012, 31(2):293-300.
[9] WANG C L, SHI D J, GONG G L. Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J]. World Journal of Microbiology & Biotechnology, 2008, 24(10):2 183-2 190.
[10] 王世伟, 王卿惠,芦利军,等. 白酒酿造微生物多样性、酶系与风味物质形成的研究进展[J]. 农业生物技术学报, 2017, 25(12):2 038-2 051.
[11] 李斌, 闫志鹏,李慧星,等. 基于高通量测序技术的浓香型和芝麻香型白酒酒曲细菌群落结构分析[J]. 中国酿造, 2018,37(8):148-152.
[12] 姚粟, 葛媛媛,李辉,等. 利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J]. 食品与发酵工业, 2012, 38(6):1-6.
[13] 梁晨, 杜海,徐岩. 大曲贮存过程中原核微生物群落结构及风味成分演替规律[J]. 微生物学通报, 2017, 44(2):384-393.
[14] 葛媛媛, 姚粟,刘洋,等. 芝麻香型白酒高温大曲嗜热细菌群落研究[J]. 食品与发酵工业, 2012, 38(11):16-19.
[15] 冯慧军, 翟磊,程坤,等. 高温放线菌属研究进展[J]. 食品与发酵工业, 2017, 43(11):257-261.
[16] 李豆南, 黄魏,王晓丹,等. 酱香型大曲中高温放线菌的筛选及风味成分分析[J]. 食品科学, 2018, 39(6):171-176.
[17] 李元迎, 李万贵,苑鹏飞. 耐高温菌群发酵技术实现农作物秸秆资源化[J]. 科技风, 2017(7):226-226.
[18] 李贤柏. 朗酒高温大曲产酱香细菌的研究[J]. 重庆师范大学学报:自然科学版, 1997(4):20-23.
[19] 张书田, 杨军山. 美拉德反应产物对白酒酿造的贡献[J]. 酿酒科技, 2009(6):78-80.
[20] 施安辉, 李丽莉,卞建平,等. 徐坊芝麻香型酒专用大曲中主要微生物的分布、优势菌种的鉴定及代谢产物的初步分析[J]. 山东食品发酵, 2010(1):8-10.
[21] SU Y, YANG L, HUI L, et al. Bacterial communities during the process of high-temperature Daqu production of roasted sesame-like flavour liquor[J]. Journal of the Institute of Brewing, 2015, 121(3):440-448.
[22] 戴奕杰, 李宗军,田志强. 酱香型白酒大曲和糟醅的真菌多样性分析[J]. 现代食品科技, 2018,34(7):97-104.
[23] 周健, 郭志,明红梅,等. 优质中高温浓香型大曲主要香味成分的初步研究[J]. 酿酒科技, 2014(4):11-14.
[24] LEE S, SOWA M E, WATANABE Y, et al. The structure of ClpB: A molecular chaperone that rescues proteins from an Aggregated state [J]. Cell, 2003, 115(2):229-240.
[25] MISHRA R C, GROVER A. ClpB/Hsp100 proteins and heat stress tolerance in plants[J]. Critical Reviews in Biotechnology, 2015, 36(5):1.
[26] SIGLER P B, XU Z, RYE H S, et al. Structure and function in groEL-mediated protein folding[J]. Annual Review of Biochemistry, 1998, 67(67):581-608.
[27] ASHRAF R, MUHAMMAD M A, RASHID N, et al. Cloning and characterization of thermostable GroEL/GroES homologues from Geobacillus thermopakistaniensis and their applications in protein folding.[J]. Journal of Biotechnology, 2017, 254:9-16.
[28] DUWAT P, EHRLICH S D, GRUSS A. Effects of metabolic flux on stress response pathways in Lactococcus lactis.[J]. Molecular Microbiology, 2010, 31(3):845-858.