凝结芽孢杆菌(Bacillus coagulans)是一种新型益生菌,菌体为杆状,芽孢位于一端,属于革兰氏阳性菌,兼性厌氧。因具有产芽孢能力,其与传统的乳杆菌、双歧杆菌等益生菌相比,具有耐胃酸、耐胆盐、耐热、易贮藏等独特的优点[1-2]。此外它还具有改善宿主肠道菌群[3]、调节免疫和缓解炎症[4]等生理功能。目前,国内外用凝结芽孢杆菌生产的产品主要包括饲料、保健品和药品等,在加拿大、美国、澳大利亚和新西兰等国家,凝结芽孢杆菌还被广泛应用于饮料、烘焙食品、糖果等生产中。2016年中国国家卫生计生委将凝结芽孢杆菌列入《可用于食品的菌种名单》中,而目前凝结芽孢杆菌在食品领域中的研究与应用相对较少。
凝结芽孢杆菌的芽孢体具有高抗逆性,可抵抗胃酸和胆盐,从而能够顺利进入肠道,在肠道中萌发增殖。其分泌的L-乳酸能刺激肠壁蠕动,降低肠道pH,有利于抑制有害菌的生长,并促进双歧杆菌等有益菌的生长和繁殖。此外,其产生的B族维生素、氨基酸、短链脂肪酸等物质能促进肠道蠕动,提高膳食纤维的利用率,加速排便。凝结芽孢杆菌TBC 169活菌片已经成功应用于儿童、孕妇和产褥期妇女等人群便秘的临床治疗中[5-7]。有研究表明,有便秘倾向的健康人群服用凝结芽孢杆菌lilac-01菌株后排便频率明显增加,且粪便的尺寸、颜色、气味等性质得到显著改善[8]。此外,凝结芽孢杆菌 GBI-30,6086对便秘的缓解功效也已得到众多临床文献支持[9],该菌株已通过美国GRAS认定。实验室前期分离得到的凝结芽孢杆菌B.C-39菌株,经动物试验证明也具有缓解便秘的功能。
低聚果糖、低聚半乳糖和菊粉等水溶性膳食纤维作为益生元能够促进肠道中有益菌的生长,其对便秘的治疗效果已经得到研究证实。赵晶晶[10]对307例便秘患者进行人体试食试验,结果表明,服用7 d低聚果糖后,便秘患者的排便次数和粪便含水量显著升高,粪便性状得到有效改善。另有研究发现[11-12],便秘人群服用菊粉或低聚半乳糖连续4周后,排便频率显著提高,且粪便更加柔软 。将其与双歧杆菌、乳杆菌等益生菌复配使用时,能够进一步提高便秘的治疗效果[13-14]。
通过将凝结芽孢杆菌B.C-39芽孢与低聚果糖、低聚半乳糖和菊粉复配,得到一种复合微生态制剂,凝结芽孢杆菌GBI-30,6068作为对照,利用动物试验评价该复合制剂对便秘的缓解效果,以期为凝结芽孢杆菌在功能性食品领域的开发、应用与推广奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
凝结芽孢杆菌B.C-39,江南大学食品生物技术中心菌种保藏库。
GBI-30(凝结芽孢杆菌GBI-30,6068)由美国Schiff公司生产的Digestive Advantage益生菌胶囊分离得到。
1.1.2 主要试剂
低聚果糖(95%)、低聚半乳糖(90%),保龄宝生物股份有限公司;菊粉(99%),维乐夫集团;盐酸洛哌丁胺胶囊,西安杨森制药有限公司;活性炭粉,生工生物工程(上海)股份有限公司;小鼠 P 物质(SP)、内皮素(ET-1)、生长抑素(SS)、胃动素(MTL)、胃泌素(Gas)和血管活性肠肽(VIP)ELISA试剂盒,南京森贝伽生物科技有限公司;阿拉伯树胶粉、乙酸、丙酸、丁酸、异丁酸、戊酸,国药集团化学试剂公司。墨汁按照文献方法配制[15]。
1.2 仪器和设备
PB300-N 电子天平,Mettler Toledo;真空冷冻干燥机,美国 LABCONCO 公司;气相色谱-质谱联用仪,日本岛津公司;Milli-Q 水净化系统,密理博(中国)有限公司;Multiscan Go 多功能酶标仪,美国Thermo公司。
1.3 试验方法
1.3.1 动物试验设计
小鼠为购于上海斯莱克公司的7周龄雄性SPF级BALB/c小鼠。动物试验方案经江南大学伦理委员会批准(JN.No20180615b1101001),并按照欧盟指导方针(2010/63/EU)执行。饲养环境保持在(23± 2)℃,相对湿度在(50±10)%,12 h光照12 h黑夜交替。30只小鼠随机分成空白组、模型组、GBI-30组、B.C-39组和复合组,每组6只,其中B.C-39组为仅含凝结芽孢杆菌B.C-39的对照组,旨在验证此菌株对便秘的缓解效果。适应7d后,空白组每天灌胃无菌生理盐水,其余各组小鼠灌胃盐酸洛哌丁胺(10 mg/kg b.w),1 h 后空白组和模型组灌胃无菌生理盐水,GBI-30组、B.C-39组灌胃对应的芽孢生理盐水悬液 (5×108 CFU/mL) ,复合组灌胃复配制剂生理盐水悬液(B.C-39芽孢5×108 CFU/mL,低聚果糖0.8 g/kg b.w,低聚半乳糖0.8 g/kg b.w,菊粉1.92 g/kg b.w),灌胃体积均为0.2 mL,连续14 d。低聚糖、菊粉剂量选择的主要依据是人体每日推荐量,低聚糖5 g/d,菊粉12 g/d,人的体重以60 kg计,相当于低聚糖0.08 g/(d·kg b.w),菊粉0.192 g/(d·kg b.w),凝结芽孢杆菌B.C-39芽孢人体有效量1×107 CFU/d。小鼠的灌胃剂量按人体使用剂量的10倍计算,即凝结芽孢杆菌B.C-39芽孢1×108 CFU,低聚果糖0.8 g/kg b.w,低聚半乳糖0.8 g/kg b.w,菊粉1.92 g/kg b.w。
1.3.2 小鼠体质量、食物和水摄入量的测定
1~14 d每天均进行小鼠体重、采食量、饮水量的检测。
1.3.3 小鼠粪便粒数、重量和水分含量的测定
第0、7、14天,灌胃结束后小鼠立即单只单笼放置3 h,收集粪便,计颗粒数,称重,冻干后记录干质量。
粪便水分含量![]()
(1)
1.3.4 小鼠肠道运动能力的测定
第13天,小鼠禁食过夜,空白组小鼠灌胃无菌生理盐水,其余各组灌胃盐酸洛哌丁胺(10 mg/kg b.w),1 h 后,所有小鼠灌胃含相应受试制剂的墨汁,灌胃体积均为0.2 mL。随后动物立即转移到干净的笼子,随意摄入食物和水。记录从灌胃墨汁到第1颗黑色粪便排出的时间。
第14天,小鼠禁食过夜,灌胃方法同第13天,30 min后,小鼠腹腔注射氯胺酮(100 mg/kg b.w)麻醉,取血后脱颈椎处死,开腹,小心地取出从幽门到盲肠的整个小肠,测量墨汁行进的距离和小肠全长。
小肠推进率![]()
(2)
1.3.5 小鼠血清胃肠调节肽的测定
将收集到的小鼠血液静置 2 h,3 000×g离心15 min后获得血清,参照相应试剂盒说明书进行试验,根据标准曲线计算血清中胃动素(motilin,MTL)、胃泌素(gastrin,Gas)、内皮素(endothelin-1,ET-1)、生长抑素(somatostatin,SS)、P 物质(substance P,SP)和血管活性肠肽(vasoactive intestinal peptide,VIP)的浓度。
1.3.6 小鼠肠道短链脂肪酸的测定
根据毛丙永[16]的方法,利用GC-MS测量小鼠冻干粪便中的短链脂肪酸含量。使用Rtx-Wax 柱(30 m×0.25 μm×0.25 μm),载气、流速、分流比、进样量、进样温度和 GC 升温程序的设置与毛丙永[16]的方法一致,质谱分析为全扫描模式。通过外标法制得标准曲线,小鼠粪便样品经冻干、饱和NaCl浸泡、H2SO4(10%)酸化、无水乙醚萃取后,上机检测,根据标准曲线计算样品中各种短链脂肪酸和总酸的浓度。
1.3.7 数据分析
数据表示为“平均值±标准差”,数据绘图用GraphPad Prism 5完成。用SPSS(22版)中的单因素ANOVA 和 Duncan’s多量程检验进行显著性分析。P<0.05,在统计学意义上具有差异。
2 结果与讨论
2.1 复合微生态制剂对体质量、食物摄入量和饮水量的影响
体质量、摄食量和饮水量是评估小鼠便秘症状的重要参数。但在洛哌丁胺诱导的便秘小鼠模型中,这些参数变化趋势不同,这可能与动物品系及洛哌丁胺用量等因素有关。WINTOLA[17]研究证实,灌胃洛哌丁胺的小鼠会出现体重下降,食物和水的摄入量减少,而LEE[18]的研究结果说明洛哌丁胺对这些参数无显著影响。
由图1可知,空白组小鼠体质量持续增长,模型组和治疗组小鼠体质量先呈下降趋势,其中模型组下降最严重,第8天起体重又逐渐上升。试验末期进行的小鼠首次排黑便试验需禁食过夜,导致第13天各组小鼠体质量均有所降低,禁食结束后体质量上升。结果表明,灌胃GBI-30、B.C-39和复合制剂均能抑制便秘引起的小鼠体质量的降低,且随时间延长自然恢复与微生态制剂治疗都能使小鼠体质量恢复增长趋势。复合组增长幅度较低可能与灌胃制剂的饱腹感造成的采食量降低有关。洛哌丁胺会引起小鼠水摄入量降低,由图2和3可知,GBI-30、B.C-39及复合制剂对小鼠食物和水摄入量无显著影响,与WINTOLA[17]的研究结果一致。
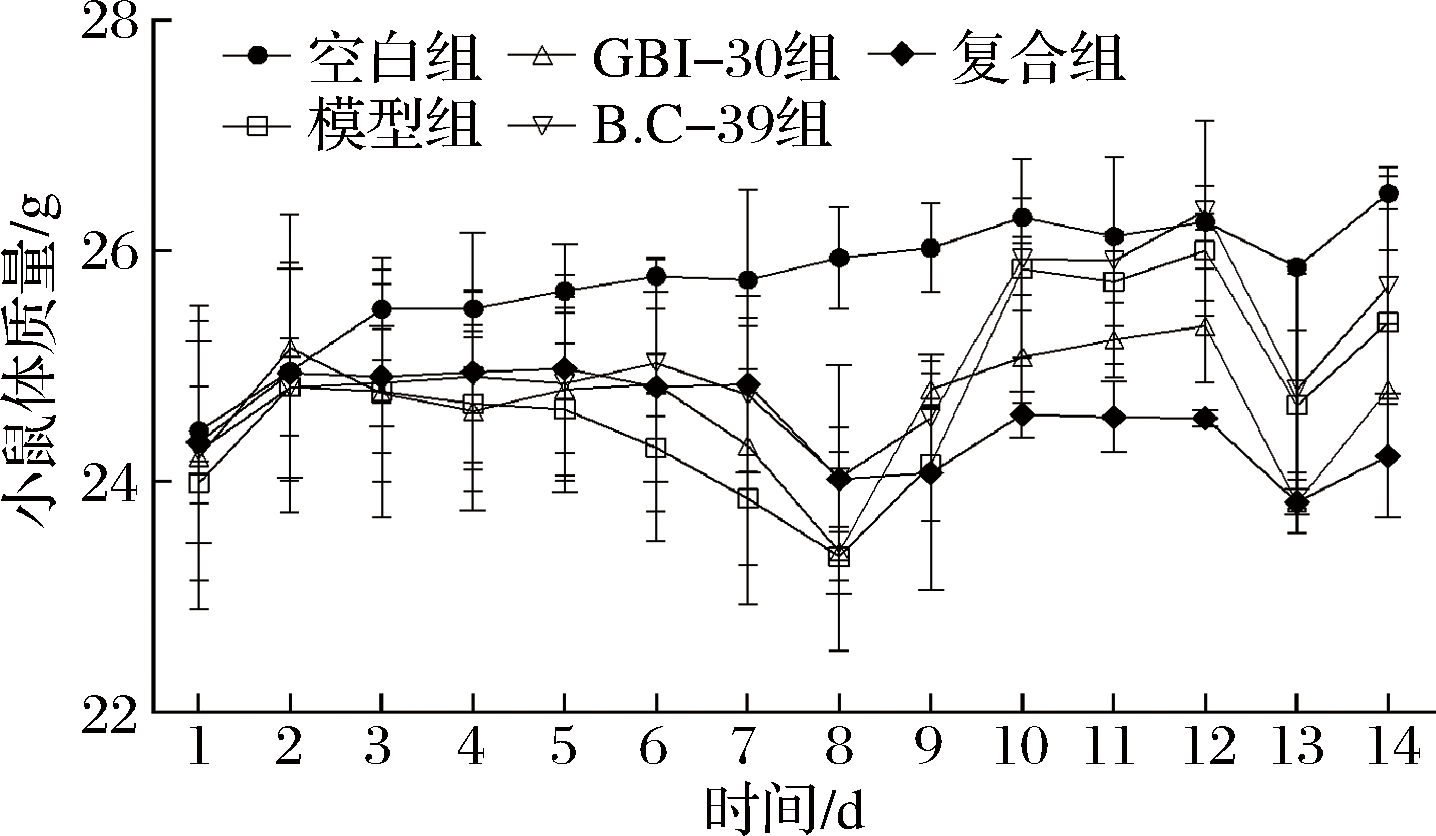
图1 试验期间各组小鼠体质量变化情况
Fig.1 Changes in body weight of mice in each group during experiments
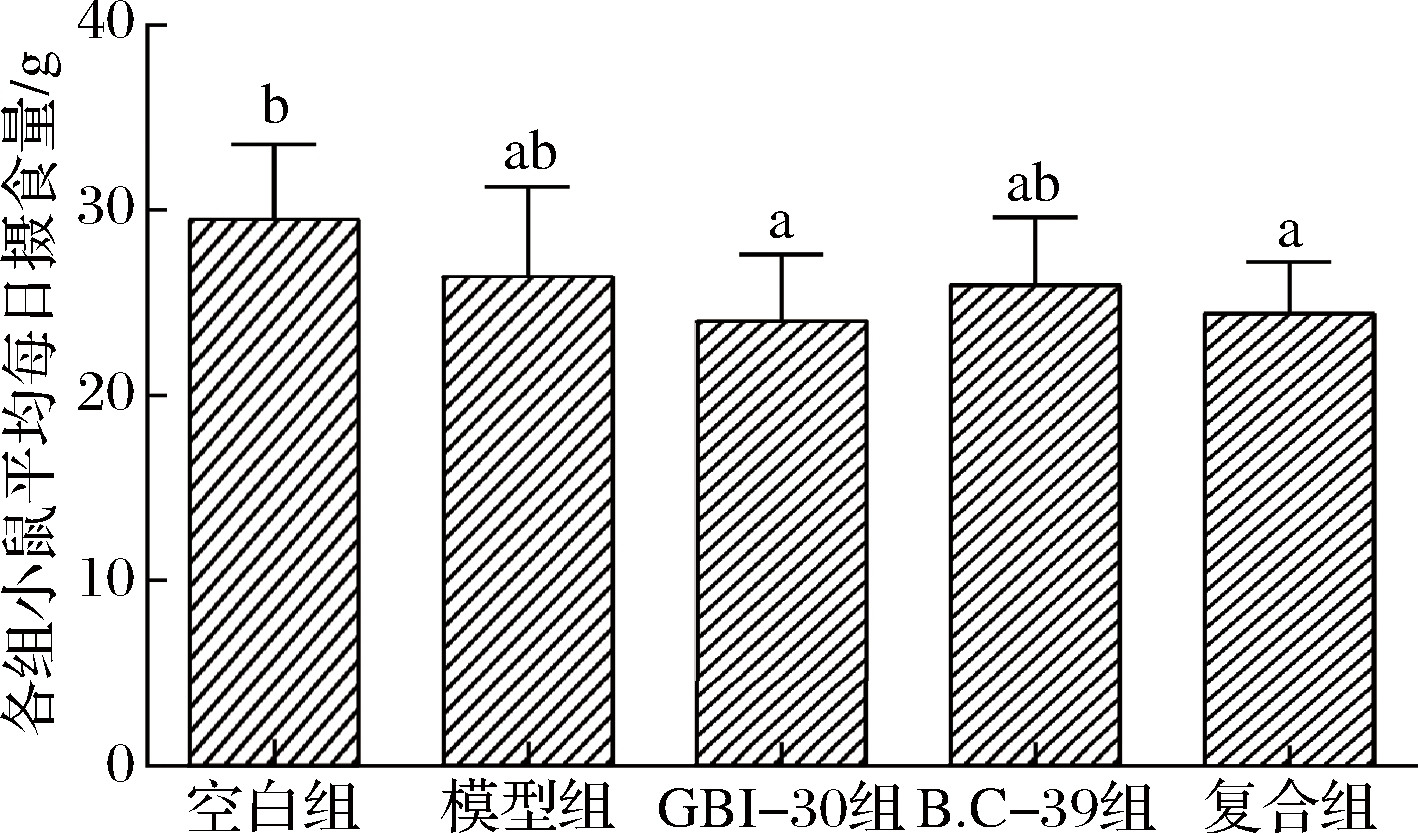
图2 试验期间各组小鼠摄食量情况
Fig.2 Food intake of mice in each group during the experiment 注:字母不同表示组间差异显著(P<0.05),图3同
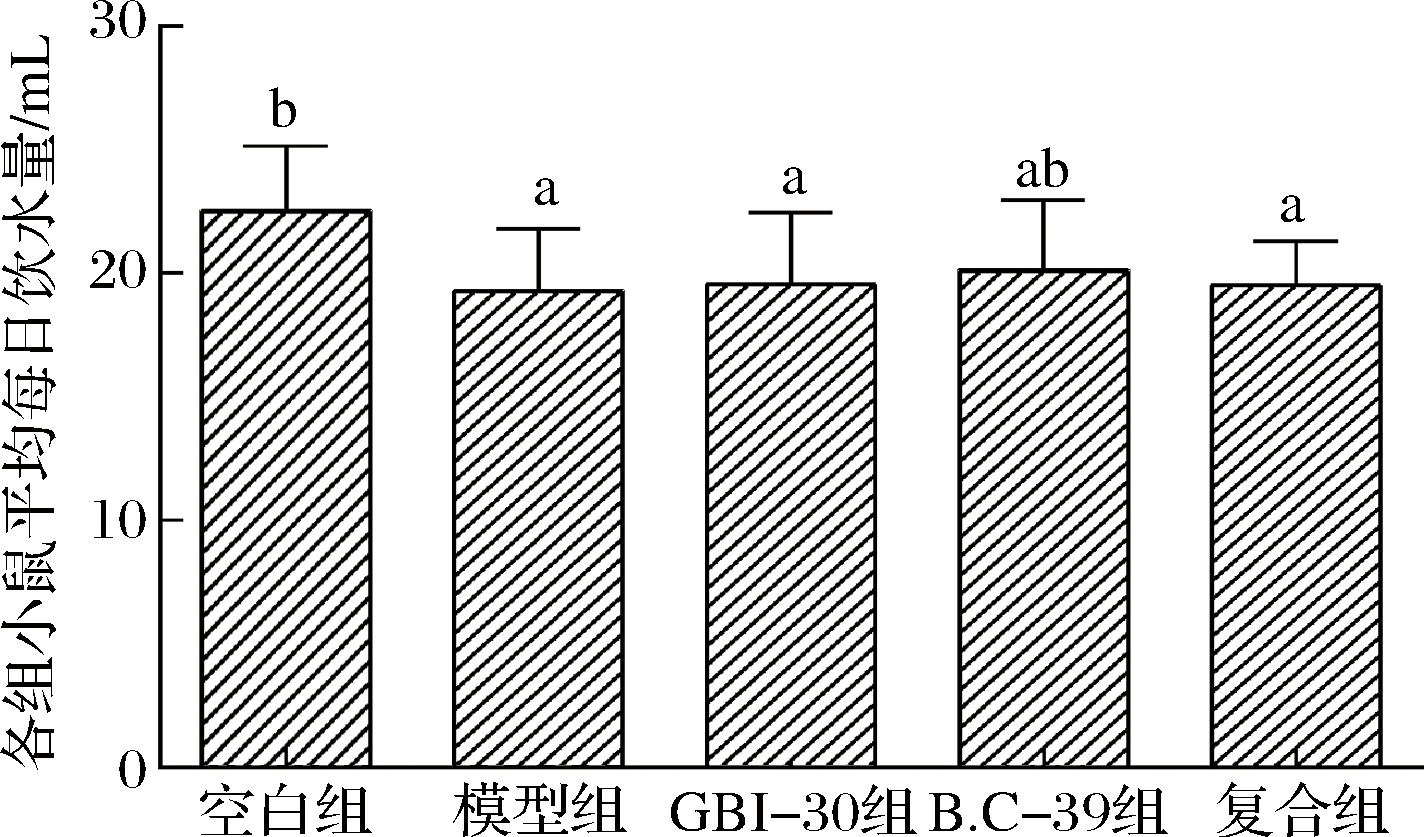
图3 试验期间各组小鼠饮水量情况
Fig.3 Water intake of mice in each group during the experiment
2.2 复合微生态制剂对小鼠粪便粒数、质量和水分含量的影响
便秘的症状包括排便频率降低,粪便坚硬干结、难排出等。本试验通过检测小鼠3 h排便颗粒数、粪便干质量/体质量和粪便水分含量,评价小鼠的便秘程度。
如图4~6所示,第0天,各组小鼠粪便参数无显著差异(P>0.05)。随造模时间的延长,模型组粪便颗粒数、粪便干质量/体质量和含水量呈下降趋势。第14天GBI-30组、B.C-39组和复合组排便指标显著高于模型组(P<0.05),其中复合组最高,该结果与丛丽敏等[19]研究结果一致。凝结芽孢杆菌B.C-39芽孢制剂能显著缓解洛哌丁胺引起的排便频率和粪便水分含量的降低,且与低聚果糖、低聚半乳糖和菊粉复配使用时有效果更强的趋势,可能原因是复合微生态制剂中的低聚果糖、低聚半乳糖和菊粉成分的水溶性极强,在肠道中能通过吸收水分增加粪便质量和润滑度,从而有助于粪便运输和排出[20],增强了复合制剂的通便效果。
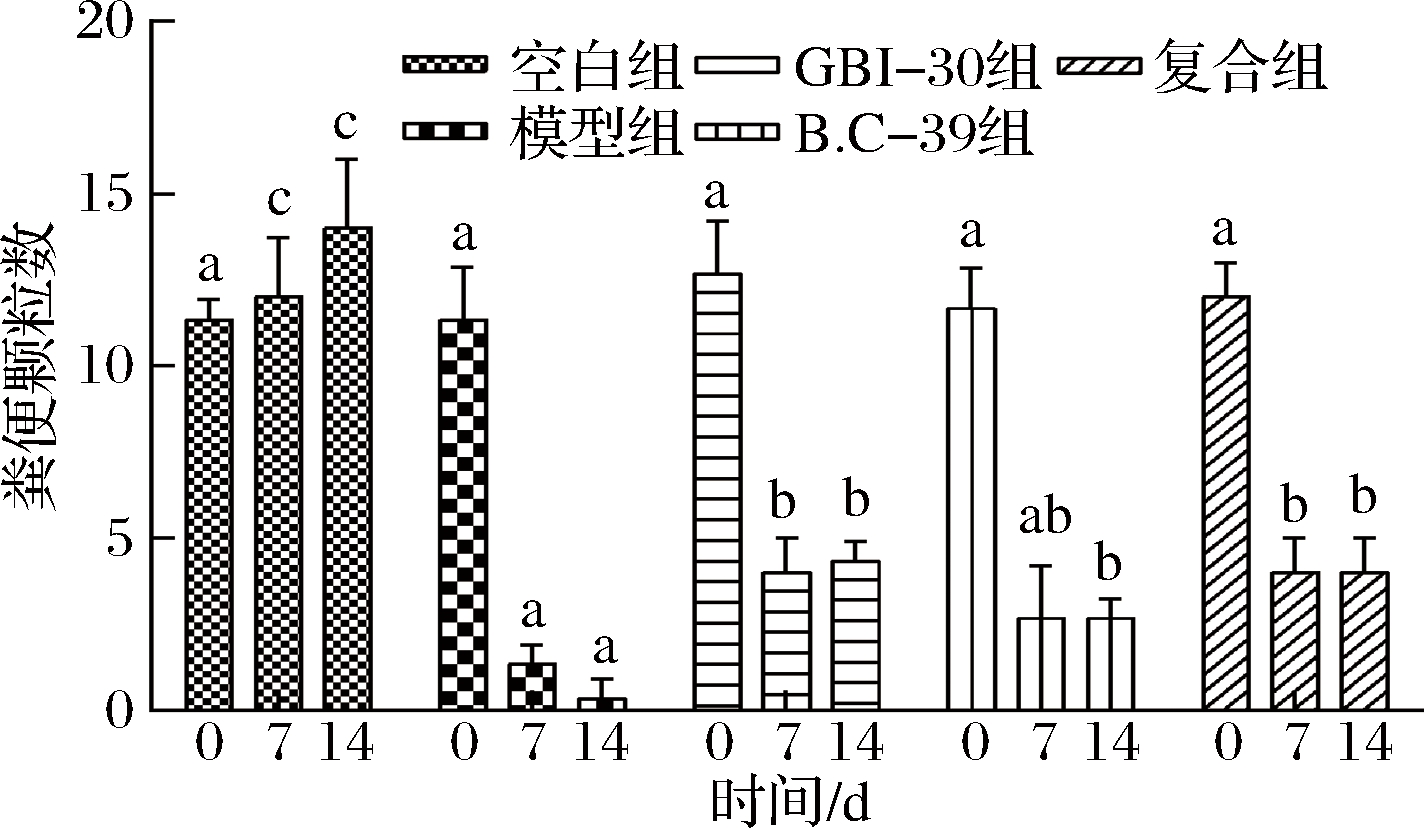
图4 各组小鼠排便颗粒数
Fig.4 Fecal pellet numbers of mice in each group
注:同一天柱形图上的字母不同表示组间差异显著(P<0.05),图5、6同

图5 各组小鼠粪便干重/体重
Fig.5 Dry fecal weight/body weight of mice in each group
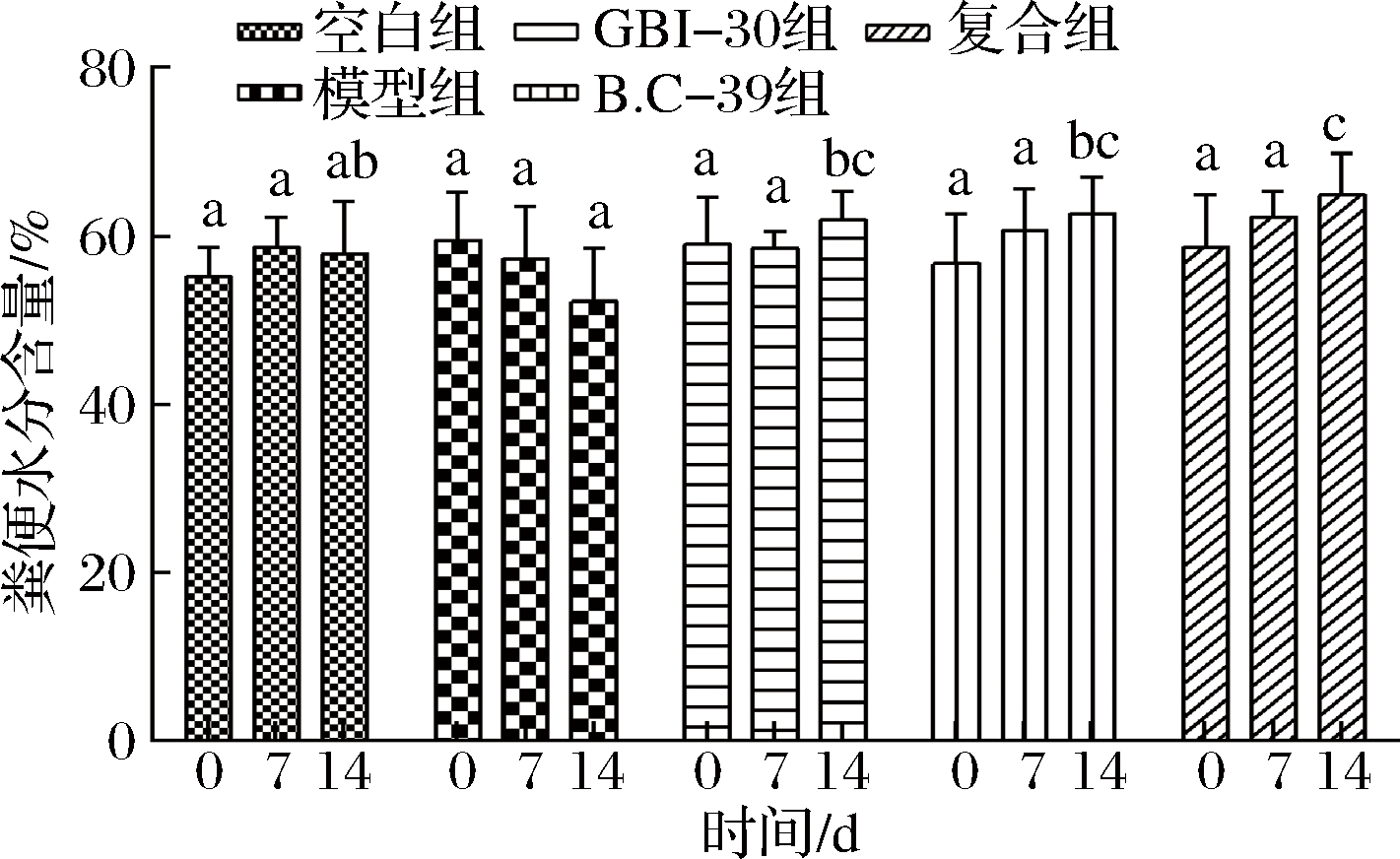
图6 各组小鼠粪便水分含量
Fig.6 Water content of defecation of mice in each group
2.3 复合微生态制剂对小鼠肠道运动能力的影响
小肠推进率可直接反映小肠的运动能力[21]。洛哌丁胺能抑制肠道蠕动,延迟肠道内容物的输送。由图7可知,模型组小鼠小肠推进率(45%)显著低于空白组(P<0.05),说明使用洛哌丁胺诱导的小鼠便秘模型造模成功。治疗组的各组小鼠小肠推进率显著高于模型组(P<0.05),其中复合组最高(88.9%),其次是B.C-39组(P<0.05)。该结果表明,凝结芽孢杆菌GBI-30,6086、B.C-39和复合制剂均能显著缓解洛哌丁胺对小肠蠕动的抑制作用。食糜在整个肠道中的转运时间可通过检测小鼠排首粒黑便的时间来确定[21]。由图8可知,GBI-30组、B.C-39组和复合组排首粒黑便的时间均显著短于模型组(193 min),其中复合组用时最短(68 min),GBI-30组次之。小肠推进率试验表明,B.C-39组促进小肠蠕动的能力优于GBI-30组,但本试验结果表明GBI-30组整个肠道的转运能力优于B.C-39组,可能原因是不同菌株的主要作用位点不同。小肠推进率仅反映小肠运动能力,而排首粒黑便的时间除受小肠运动能力影响外,还受食糜在结肠中水分和电解质的吸收、粪便对直肠黏膜的充盈刺激等排便的各个环节的影响[21],推测B.C-39主要作用位点集中在小肠,而GBI-30,6086在排便的各个环节均发挥积极作用,导致B.C-39小肠推进率更高,而GBI-30,6086排出首粒黑便的时间更短。可见,凝结芽孢杆菌B.C-39能促进便秘小鼠的肠道运动,与低聚果糖、低聚半乳糖和菊粉复配有增效作用,使其优于GBI-30,6086对照菌株。
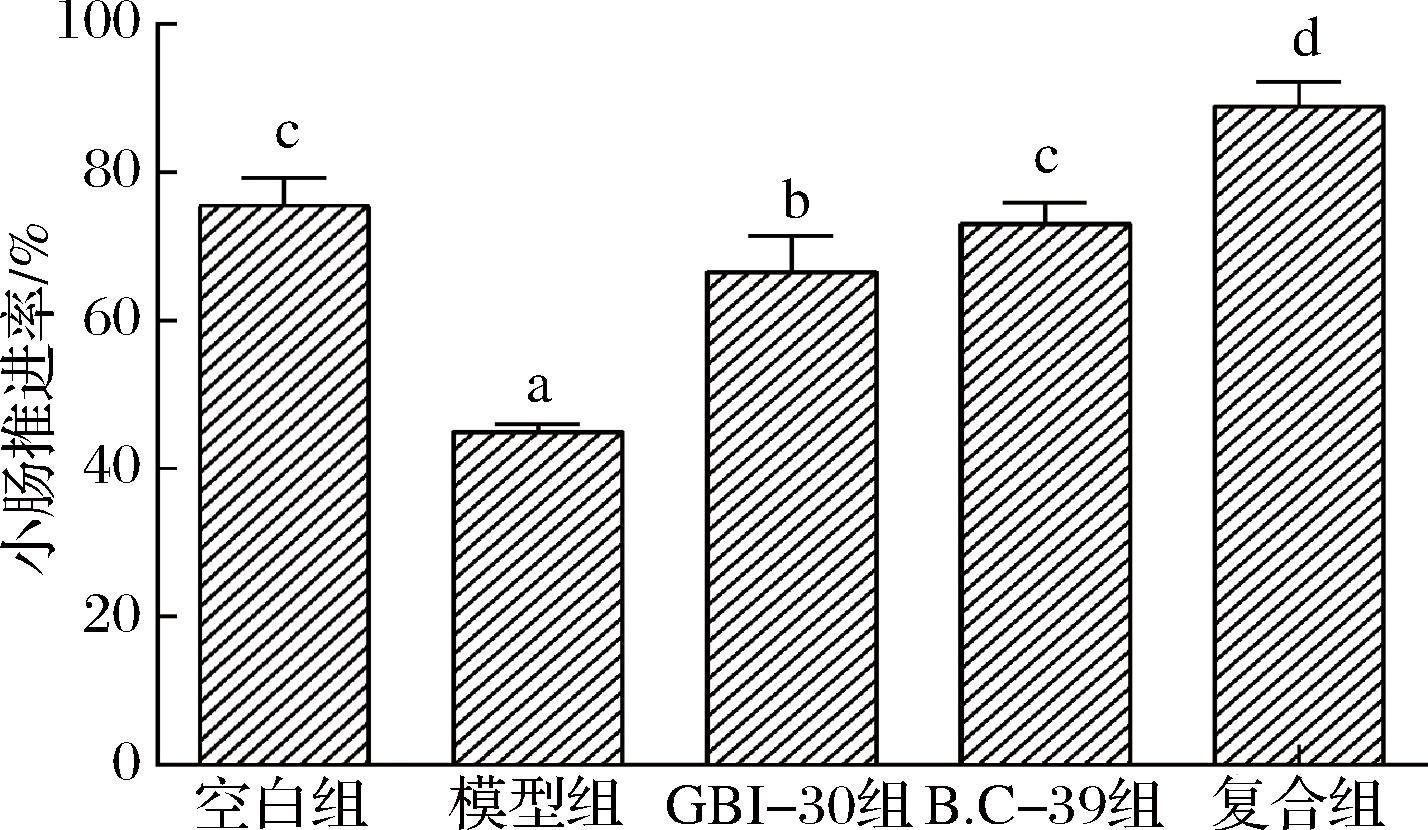
图7 各组小鼠小肠推进率
Fig.7 The small intestinal transit rate of mice in each group
注:柱形图上的字母不同表示组间差异显著(P<0.05)
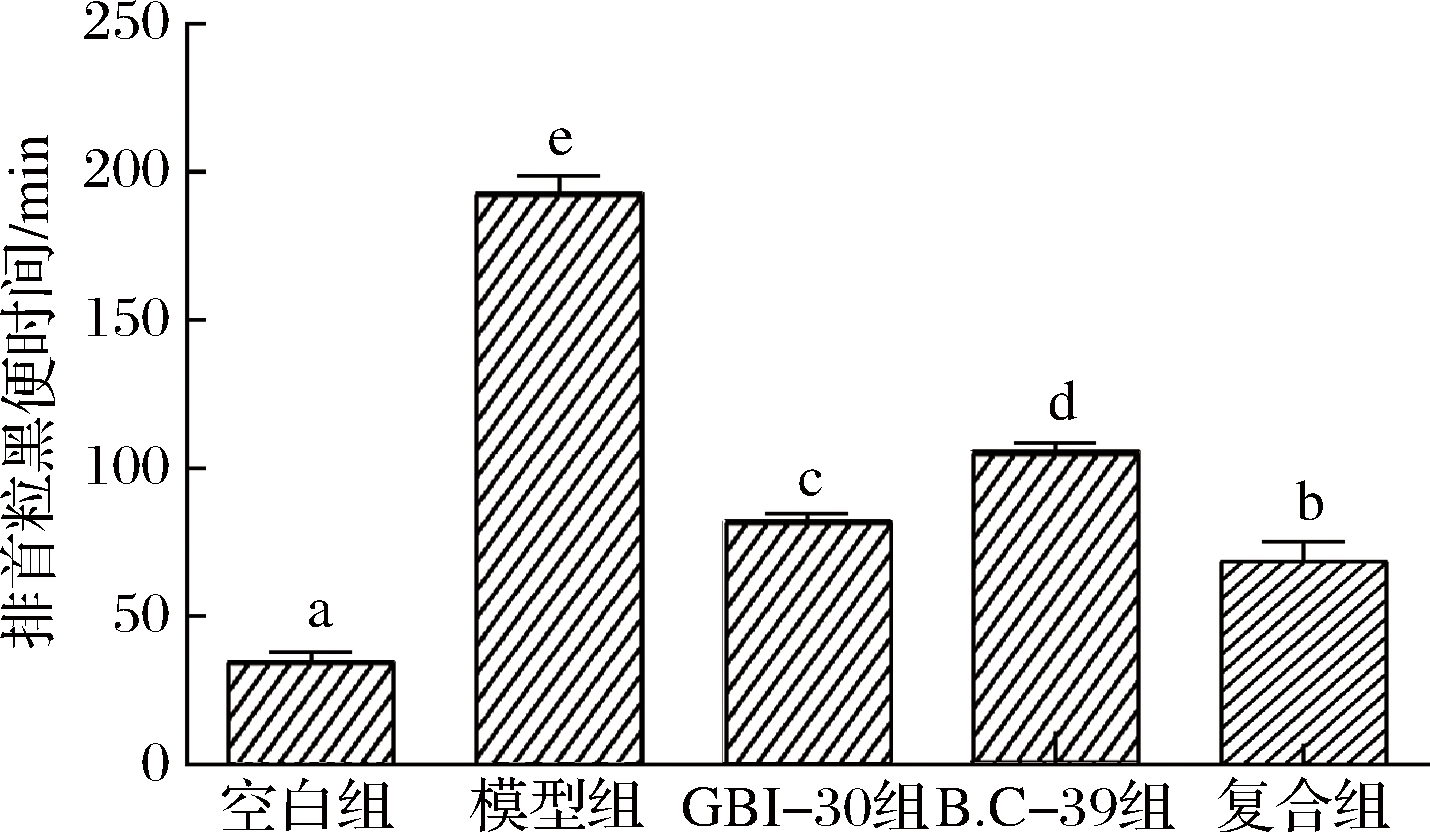
图8 各组小鼠排首粒黑便时间
Fig.8 First black stool defecation time of mice in each group
注:柱形图上的字母不同表示组间差异显著(P<0.05)
2.4 复合微生态制剂对小鼠血清中胃肠调节肽的影响
胃肠调节肽在调节胃肠道运动方面起着非常重要的作用,胃肠调节肽的水平与便秘程度密切相关[22]。其中MTL、Gas和SP为兴奋性递质,而ET-1、SS和VIP为抑制性递质。MTL主要作用于上消化道,能促进胃肠运动[23]。Gas能刺激胃酸、胰液和肠液的分泌,促进胃黏膜细胞增殖和胃肠运动,抑制幽门括约肌收缩[24]。ET-1在维持心血管功能稳态和胃肠功能等方面起重要作用。SP能刺激胃肠道平滑肌收缩,SP水平升高能加快胃肠道收缩和运动[25]。VIP是调节肠道蠕动的重要因子。SS能抑制MTL、Gas等的释放,减少消化液的分泌[26]。
各组小鼠血清中胃肠调节肽水平如表1所示,相比模型组,GBI-30组、B.C-39组和复合组显著增高了小鼠血清中Gas、MTL、SP等兴奋性递质的水平(P<0.05),并显著降低了VIP、ET-1、SS等抑制性递质的水平(P<0.05)。复合组对Gas、MTL、SP、VIP、ET-1的恢复能力与B.C-39组相比无显著差异, 降低SS的能力优于B.C-39。与GBI-30组相比,复合组对MTL和VIP的恢复能力更优。以上结果说明便秘严重影响了小鼠体内胃肠激素水平,口服凝结芽孢杆菌B.C-39复合微生态制剂可明显改善便秘引起的胃肠调节肽的分泌失调。
表1 各组小鼠血清中胃肠调节肽的水平 单位:ng/L
Table 1 Levels of gastrointestinal regulatory peptides in serum of mice in each group

指标空白组模型组GBI-30组B.C-39组复合组Gas38.9±1.5c23.1±1.6a34.7±0.9b34.4±0.4b37.3±2bcMTL152.8±1.3c126.7±4.5a143.4±2.6b153.2±1c157.7±3.9cSP139.4±4.3cd29.2±5.2a148.2±7.3d129.5±3.5b135.8±3bcVIP29.0±0.9a45.6±2.3d39.9±2.6c36.4±3bc33.7±2.6bET-156.7±2.1a79.6±1.9c63.8±3.3b65.9±2.9b60.6±3.4abSS41.5±2.1a68.2±2.5c41.3±4a49.0±3.2b42.0±5.6a
注:同行肩标的不同字母表示不同组之间存在显著差异(P<0.05)。
2.5 复合微生态制剂对小鼠粪便短链脂肪酸的影响
乙酸、丙酸、正丁酸和异丁酸等短链脂肪酸(short chain fatty acids,SCFAs)的含量是益生菌缓解便秘效果的重要评价指标之一。SCFAs是肠道微生物的最终代谢产物,可降低肠道pH值,抑制致病菌的生长,促进有益菌的增殖,从而改善肠道微环境;SCFAs为肠黏膜细胞提供能量来源,促进肠上皮细胞增殖,有利于维护肠屏障,抵抗炎症,缓解便秘[21]。研究表明乙酸、丙酸等有机酸可直接刺激肠壁神经,加快肠道蠕动;乙酸是微生物的主要代谢产物,其浓度的增加可使肠管内渗透压增大,肠道内水分吸收增加,提高粪便质量和润滑度,使其更易于运输与排出[27]。
由表2可知,B.C-39组和复合组各种SCFAs及总酸的含量均高于模型组,复合组丙酸、正丁酸、总酸含量显著高于B.C-39组。表明口服凝结芽孢杆菌B.C-39及其复合微生态制剂能增加肠道SCFAs含量,且复合制剂效果优于B.C-39,可能原因是SCFAs含量与微生物的发酵底物有关,复合制剂中低聚果糖、低聚半乳糖和菊粉不能被动物或人体消化吸收,从而能够顺利到达结肠,增加了微生物的发酵底物量,进而SCFAs的产量也有所增加。结合肠道运动能力试验结果综合分析,表明便秘程度与肠道中SCFAs含量具有相关性,与WANG[26]、 RANILLA等[28]、季超等[29]研究结果一致。
表2 各组小鼠粪便中短链脂肪酸的含量 单位:μmol/g
Table 2 Short-chain fatty acid content in feces of mice in each group
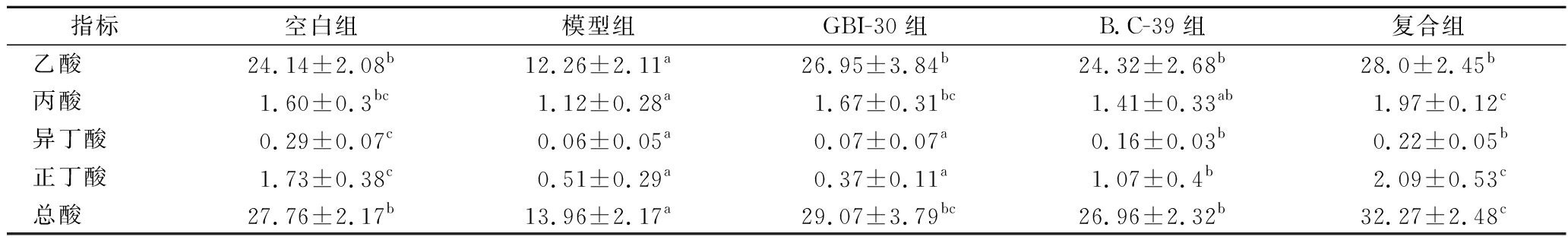
指标空白组模型组GBI-30组B.C-39组复合组乙酸24.14±2.08b12.26±2.11a26.95±3.84b24.32±2.68b28.0±2.45b丙酸1.60±0.3bc1.12±0.28a1.67±0.31bc1.41±0.33ab1.97±0.12c异丁酸0.29±0.07c0.06±0.05a0.07±0.07a0.16±0.03b0.22±0.05b正丁酸1.73±0.38c0.51±0.29a0.37±0.11a1.07±0.4b2.09±0.53c总酸27.76±2.17b13.96±2.17a29.07±3.79bc26.96±2.32b32.27±2.48c
注:同行肩标的不同字母表示不同组之间存在显著差异(P<0.05)。
3 结论
本试验通过建立洛哌丁胺诱导的小鼠便秘模型,探讨了凝结芽孢杆菌B.C-39及其复合微生态制剂对便秘的缓解效果。结果表明,B.C-39和复合制剂均起到了缓解便秘的作用,复合制剂对便秘症状的改善效果优于B.C-39。复合微生态制剂能够显著增加便秘小鼠的排便颗粒数、粪便质量和水分含量,提高肠道内容物在小肠中的推进速率,缩短小鼠首粒黑便的排出时间。此外,灌胃B.C-39复合制剂使便秘小鼠Gas、MTL、SP、VIP、ET-1和SS等胃肠激素的分泌趋于正常,并增加小鼠肠道内SCFAs的含量。可见,凝结芽孢杆菌B.C-39芽孢复合制剂能够有效缓解盐酸洛哌丁胺引起的小鼠便秘。
[1] KONURAY G, ERGINKAYA Z. Potential use of Bacillus coagulans in the food industry[J]. Foods, 2018, 7(6): 92-102.
[2] MA K, MAEDA T, YOU H, et al. Open fermentative production of L-lactic acid with high optical purity by thermophilic Bacillus coagulans using excess sludge as nutrient[J]. Bioresource Technology, 2014, 151: 28-35.
[3] HALDAR L, GANDHI D N. Effect of oral administration of Bacillus coagulans B37 and Bacillus pumilus B9 strains on fecal coliforms, Lactobacillus and Bacillus spp. in rat animal model[J]. Veterinary World, 2016, 9(7): 766-772.
[4] SUDHA M R, ARUNASREE K M. Anti-inflammatory and immunomodulatory effects of Bacillus coagulans unique IS2[J]. International Journal of Probiotics and Prebiotics, 2015, 10(1): 31-36.
[5] 韩金凤. 凝结芽孢杆菌TBC169片治疗小儿便秘应用意义探析[J]. 医药, 2015(11): 251-251.
[6] 张丽霞, 沈华祥, 曹云飞, 等. 小麦纤维素颗粒联合凝结芽孢杆菌活菌片治疗晚期妊娠便秘的临床观察[J]. 中国微生态学杂志, 2016, 28(11): 1 333-1 336.
[7] 彭丽钦, 李立. 凝结芽孢杆菌活菌片预防产褥期便秘的临床观察[J]. 中国微生态学杂志,2014(8): 953-955.
[8] MINAMIDA K, NISHIMURA M, MIWA K, et al. Effects of dietary fiber with Bacillus coagulans lilac-01 on bowel movement and fecal properties of healthy volunteers with a tendency for constipation[J]. Bioscience Biotechnology Biochemistry, 2015, 79(2): 300-306.
[9] NYANGALE E P, FARMER S, KELLER D, et al. Effect of prebiotics on the fecal microbiota of elderly volunteers after dietary supplementation of Bacillus coagulans GBI-30, 6086[J]. Anaerobe, 2014, 30: 75-81.
[10] 赵晶晶. 低聚果糖液润肠通便功能的毒理学及人体试食评价[D]. 兰州: 兰州大学, 2017.
[11] MICKA A, SIEPELMEYER A, HOLZ A, et al. Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial[J]. International Journal of Food Science and Nutrition, 2017, 68(1): 82-89.
[12] BELELI C A, ANTONIO M A, DOS SANTOS R, et al. Effect of 4'galactooligosaccharide on constipation symptoms[J]. Journal De Pediatria, 2015, 91(6): 567-573.
[13] WAITZBERG D L, LOGULLO L C, BITTENCOURT A F, et al. Effect of synbiotic in constipated adult women-a randomized, double-blind, placebo-controlled study of clinical response[J]. Clinical Nutrition, 2013, 32(1): 27-33.
[14] NAKABAYASHI I, NAKAMURA M, KAWAKAMI K, et al. Effects of synbiotic treatment on serum level of p-cresol in haemodialysis patients: a preliminary study[J]. Nephrol Dial Transplant, 2011, 26(3): 1 094-1 098.
[15] 中华人民共和国卫生部卫生法制与监督司编印.保健食品检验与评价技术规范[M],2003.
[16] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D]. 无锡: 江南大学, 2015.
[17] WINTOLA O A, SUNMONU T O, AFOLAYAN A J. The effect of Aloe ferox Mill. in the treatment of loperamide-induced constipation in Wistar rats[J]. BMC Gastroenterol, 2010, 10: 95-99.
[18] LEE H Y, KIM J H, JEUNG H W, et al. Effects of Ficus carica paste on loperamide-induced constipation in rats[J]. Food and Chemical Toxicology, 2012, 50(3-4): 895-902.
[19] 丛丽敏. 益生菌联合膳食纤维改善便秘[D]. 大连: 大连医科大学, 2016.
[20] GÉLINAS P. Preventing constipation: a review of the laxative potential of food ingredients[J]. International Journal of Food Science and Technology, 2013, 48: 445-467.
[21] 王琳琳. 双歧杆菌对便秘的影响及其作用机理研究[D]. 无锡: 江南大学, 2017.
[22] SJÖLUND K, FASTH S, EKMAN R, et al. Neuropeptides in idiopathic chronic constipation (slow transit constipation)[J]. Neurogastroenterology and Motility, 1995, 9(3): 143-150.
[23] FEIGHNER S D, TAN C P, MCKEE K K, et al. Receptor for motilin identified in the human gastrointestinal system[J]. Science, 1999, 284: 2 184-2 188.
[24] SUO H, ZHAO X, QIAN Y, et al. Therapeutic effect of activated carbon-induced constipation mice with Lactobacillus fermentum Suo on treatment[J]. Int J Mol Sci, 2014, 15(12): 21 875-21 895.
[25] LI C, MICCI M A, MURTHY K S, et al. Substance P is essential for maintaining gut muscle contractility: a novel role for coneurotransmission revealed by botulinum toxin[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 306(10): G839-G848.
[26] WANG L, HU L, XU Q, et al. Bifidobacterium adolescentis exerts strain-specific effects on constipation induced by loperamide in BALB/c mice[J]. International Journal of Molecular Sciences, 2017, 18(2):318-339.
[27] WERF M J, VENEMA K. Bifidobacteria: genetic modification and the study of their role in the colon[J]. Journal of Agricultural and Food Chemistry, 2001, 49(1): 378-383.
[28] Ranilla M J, Carro M D. Evaluation of Bacillus subtilis biopreparations as growth promoters in chickens[J]. Cuban Journal of Agricultural Science, 2013, 47(1):61-66.
[29] 季超, 任清, 李飞. 地衣芽孢杆菌代谢燕麦β-葡聚糖的初步研究[J]. 食品科技, 2015, 40(12): 7-14.