近年来,由于食用或饮用被食源性致病菌污染了的食品或饮品引起的疾病频发,食品安全受到国际社会越来越多的重视,成为公众所关心的热点[1]。餐饮食品是导致各类食物中毒和食源性疾病发生的主要来源,其中导致水产品、肉类及凉拌即食食品腐败变质的是革兰氏阴性铜绿假单胞菌(Pseudomonas aeruginosa)[2-4]。同时,铜绿假单胞菌也是一种机会致病菌,是引起免疫力低下患者慢性感染的常见病原体[5];常会引起呼吸系统感染,尿路感染,肠道传染病感染,伤口形成绿色脓液等[6-7]。铜绿假单胞菌已成为危害人类健康的重要污染源之一。
牡丹(Paeonia suffruticosa Andr.,PSABE)除了其根皮(牡丹皮)是一种重要的中药外,牡丹花也有重要的食用和药用价值,具有清热解毒、活血等功效[8]。目前,国内外研究表明,牡丹花中含有没食子酸、芍药苷、山奈酚3,7-二-O-葡萄糖苷、1,2,3,4,6-O-五没食子酰基葡萄糖等有效成分,具有较强的抗肿瘤、清除自由基,抗氧化等活性[9-11]。然而迄今为止,牡丹花抑菌活性方面的研究报道甚少,关于牡丹花的抑菌机理尚未见报道。因此,本研究以铜绿假单胞菌为试验菌,探究牡丹花蕾提取物对铜绿假单胞菌的抑菌活性及其抑菌机理,以期为牡丹花蕾提取物应用于水产品及肉类等食品保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
P. aeruginosa ATCC 27853,本研究室保藏。
牡丹花蕾,无锡市中药店;N-苯基-1-萘胺(NPN)、14%三氟化硼甲醇溶液,Alaladin;KOH、NaCl、无水Na2SO4、甲醇、正己烷、戊二醛、无水乙醇,为国产分析纯。
1.2 仪器与设备
DHG-9075A电恒温鼓风干燥箱,上海精宏实验设备有限公司;R220E真空旋转蒸发仪,瑞士步琦工业有限公司;12Plus低温冷冻干燥机,美国Labconco公司;synergy H4多功能酶标仪,美国伯腾仪器有限公司;Thermos-21R高速冷冻离心机,上海沪粤明科学仪器有限公司;F-7 000荧光分光光度计,日本Hitachi公司;TSQ8000三重四级杆气质联用仪,美国赛默飞世尔科技有限公司;SU8220冷场发射扫描电子显微镜,日本Hitachi公司。
1.3 方法
1.3.1 牡丹花蕾提取物制备
牡丹花蕾去除表面损伤和微生物污染部分,在60 ℃下烘干至恒重,研磨成细粉。在体积分数70%乙醇、60 ℃、料液比1∶20(g∶mL)的条件下浸提2 h,真空过滤收集滤液,重复2次。40 ℃真空旋转蒸发浓缩,将浓缩物在4 ℃静置24 h,上清液使用低温冷冻干燥机干燥得干粉,置于4 ℃密封储存。
1.3.2 最低抑制浓度和最低杀死浓度测定
参照微量稀释法[12],在无菌96孔平底微量培养板中,取100 μL稀释的牡丹花蕾提取物(终浓度100、50、25、12.5、6.25、3.12、1.56、0.78和0 mg/mL)与菌体浓度为1×108 CFU/mL细菌悬浮液混合,37 ℃培养24 h后,于600 nm处检测光密度。光密度变化值<0.05,认为是抑制菌体生长的最低浓度,并被定义为最低抑制浓度(minimum inhibition concentration, MIC)。从大于最低抑制浓度的孔中吸取100 μL细菌悬浮液均匀涂布于新鲜LB琼脂平板上,37 ℃传代培养24 h后,以每个平板菌落数少于5个定义为最低杀死浓度(minimum bactericide concentration, MBC)。
1.3.3 抑菌圈及抑菌活性稳定性研究
将100 mg/mL的牡丹花蕾提取物用浓度为0.1 mol/L NaOH和HCl溶液调成 9个pH值梯度: 2.0、3.0、4.0、5.0、6.0、7. 0、8.0、9.0、10.0;100 mg/mL牡丹花蕾提取物分别在20、40、60、80、100 ℃下30 min,用琼脂滤纸片扩散法[13]测定抑菌效果。将100 μL菌体浓度为1×108 CFU/mL细菌悬浮液均匀涂布于LB琼脂培养基表面,待表面稍干后将浸渍了10 μL牡丹花蕾提取物(相当于1 mg剂量)的6 mm无菌滤纸圆盘贴于最上层,以无菌生理盐水作为阴性对照,每个组3个平行,37 ℃培养24 h后,通过测量抑制区直径(diameter of the inhibition zone, DIZ)评估pH值和温度对牡丹花蕾提取物抑菌活性的影响。
1.3.4 生长曲线测定
参照WU等[14]方法稍作修改。将培养至对数中期的铜绿假单胞菌转接到含不同浓度(终浓度分别为1/8MIC,1/4MIC,1/2MIC,MIC和MBC)牡丹花蕾提取物的LB液体培养基中,置于37 ℃条件下培养,每隔2 h测定OD600的光密度。
1.3.5 细胞膜脂肪酸分析
将铜绿假单胞菌培养至对数期中后期,加入牡丹花蕾提取物(终浓度为MIC和MBC),以无菌生理盐水作为对照;在37 ℃孵育3 h后,4 ℃ 4 000×g离心15 min,收集细胞,用PBS洗涤2次后待用。根据HUANG等[15]的方法进行脂肪酸甲酯化反应,气相色谱-质谱(GC-MS)鉴定膜脂肪酸。色谱条件:TG-5石英毛细管柱(30 m×0.25 mm,0.25 μm),升温程序:初始温度为50 ℃,保持1 min,以10 ℃/min升温至200 ℃,再以3 ℃/min升温至250 ℃,最后以10 ℃/min升温至280 ℃、保持8 min;载气(He)流速为2.0 mL/min,进样口温度为220 ℃;进样量为1 μL;分流比为5∶1。质谱条件:电子轰击离子源;电子能量70 eV;离子源温度230 ℃;四级杆温度150 ℃;接口温度280 ℃;质量扫描范围m/z 29~450。
1.3.6 对细胞膜膜蛋白影响
铜绿假单胞菌细胞膜蛋白的荧光光谱测定参照WANG等[16]的方法并稍有修改,在1×108 CFU/mL的细胞悬浮液中加入不同浓度的KI(终浓度分别为0、0.5×10-2、1.0×10-2、1.5×10-2、2.0×10-2、2.5×10-2、3.0×10-2 mol/L)和牡丹花蕾提取物(终浓度分别为0、1/64MIC、1/32MIC、1/16MIC、1/8MIC、1/4MIC、1/2MIC、MIC、MBC),25 ℃温育1 h,258、280和296 nm的固定激发波长下记录细菌样品的发射光谱。
1.3.7 细胞膜通透性测定
参照NING等[17]方法稍作修改,将不同浓度牡丹花蕾提取物(1/8MIC,1/4MIC,1/2MIC,MIC和MBC)加入菌体浓度为1×108 CFU/mL的细胞悬液中,37 ℃温育1 h。在4 ℃下4 000×g离心15 min收集细胞,用PBS洗涤2次并调节菌体浓度为1×108 CFU/mL,加入N-苯基-1-萘胺(NPN),使NPN终浓度为0.1 mol/L,用荧光分光光度计测定随时间变化的荧光强度,直到强度不再变化。荧光光度计仪器参数设置为:激发光波长350 nm,发射光波长420 nm,缝隙宽度5 mm,电压500 mV。
1.3.8 扫描电镜观察
参考SHI等[18]的方法观察细胞形态变化。
2 结果与分析
2.1 牡丹花蕾提取物对铜绿假单胞菌的抑菌活性及其稳定性
牡丹花蕾提取物对铜绿假单胞菌的DIZ、MIC及MBC分别为(15.71±0.25)mm,3.13和6.25 mg/mL;提取物对铜绿假单胞菌抑菌活性的pH值和温度稳定性如图1所示。由图1-A可以看出,在常温下pH 2.0~7. 0,牡丹花蕾提取物具有较好的稳定性,抑菌圈直径在15.42~16.02 mm,在弱碱(pH 8.0~10.0)条件下抑菌活性稍有下降, pH为10.0时,抑菌圈直径为自然条件(pH 4.5)的93.04%。由图1-B可知,牡丹花蕾提取物(自然pH)经较低温度(20~60 ℃)处理30 min后,抑菌活性较稳定,抑菌圈直径处于15.73~15.88 mm;当温度>80 ℃,抑菌圈直径略有变小,100 ℃时降至最高值的 88.77%。结果表明,牡丹花蕾提取物对pH值和温度不敏感,具有较好的稳定性。
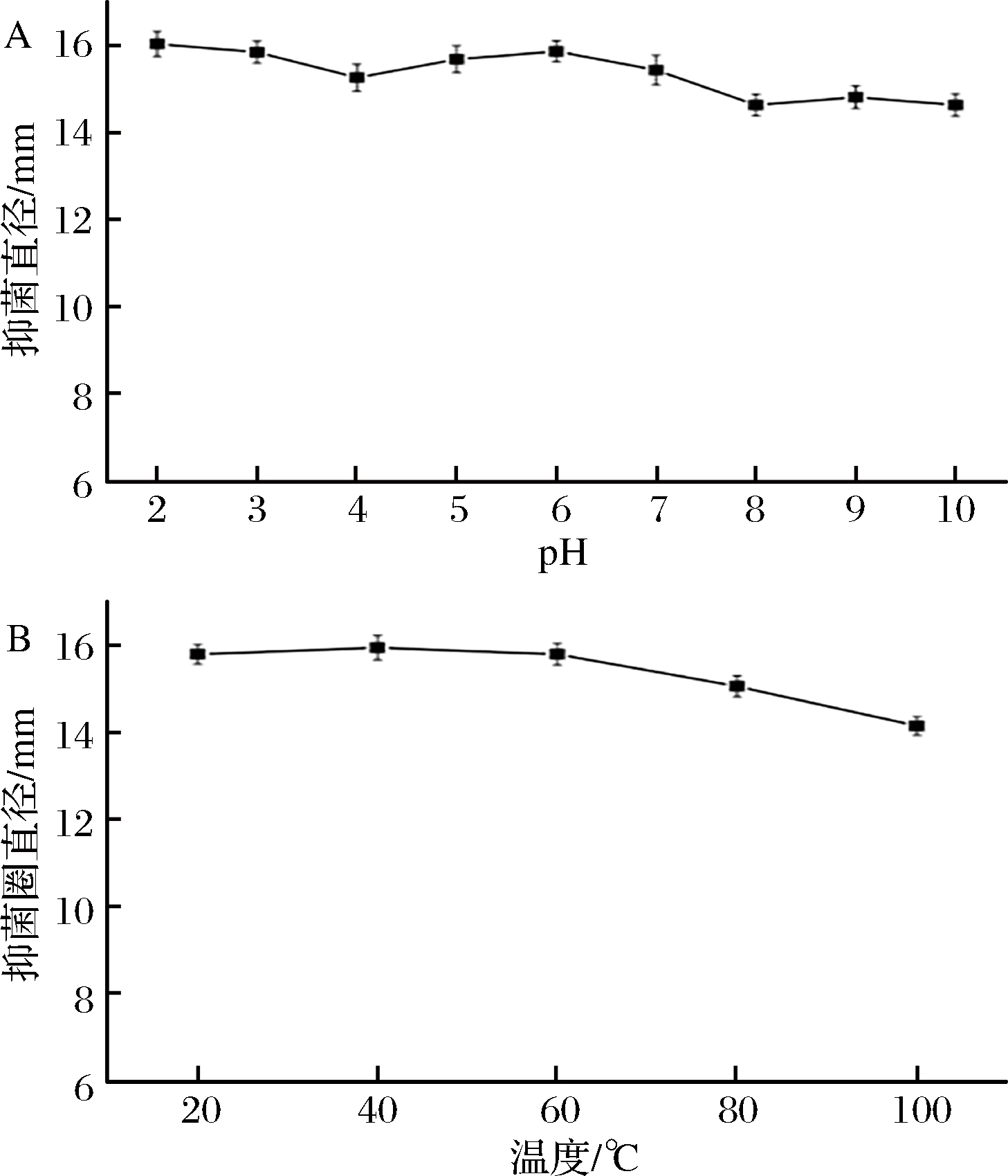
图1 牡丹花蕾提取物对铜绿假单胞菌抑菌活性pH(A)和温度(B)稳定性
Fig.1 Stability of antibacterial activity of P. suffruticosa extract under different pH (A) and temperature (B)
2.2 牡丹花蕾提取物对铜绿假单胞菌细胞生长影响
如图2所示,在LB培养基中加入浓度为1/8MIC和1/4MIC的牡丹花蕾提取物,铜绿假单胞菌细胞的生长基本不受影响。但当添加浓度为MIC的牡丹花蕾提取物,铜绿假单胞菌细胞的生长受到显著抑制,与对照相比,延滞期延长,且最终的菌体量仅为对照的12%。此外,当添加浓度为MBC时,细胞生长被完全抑制,导致细胞死亡。
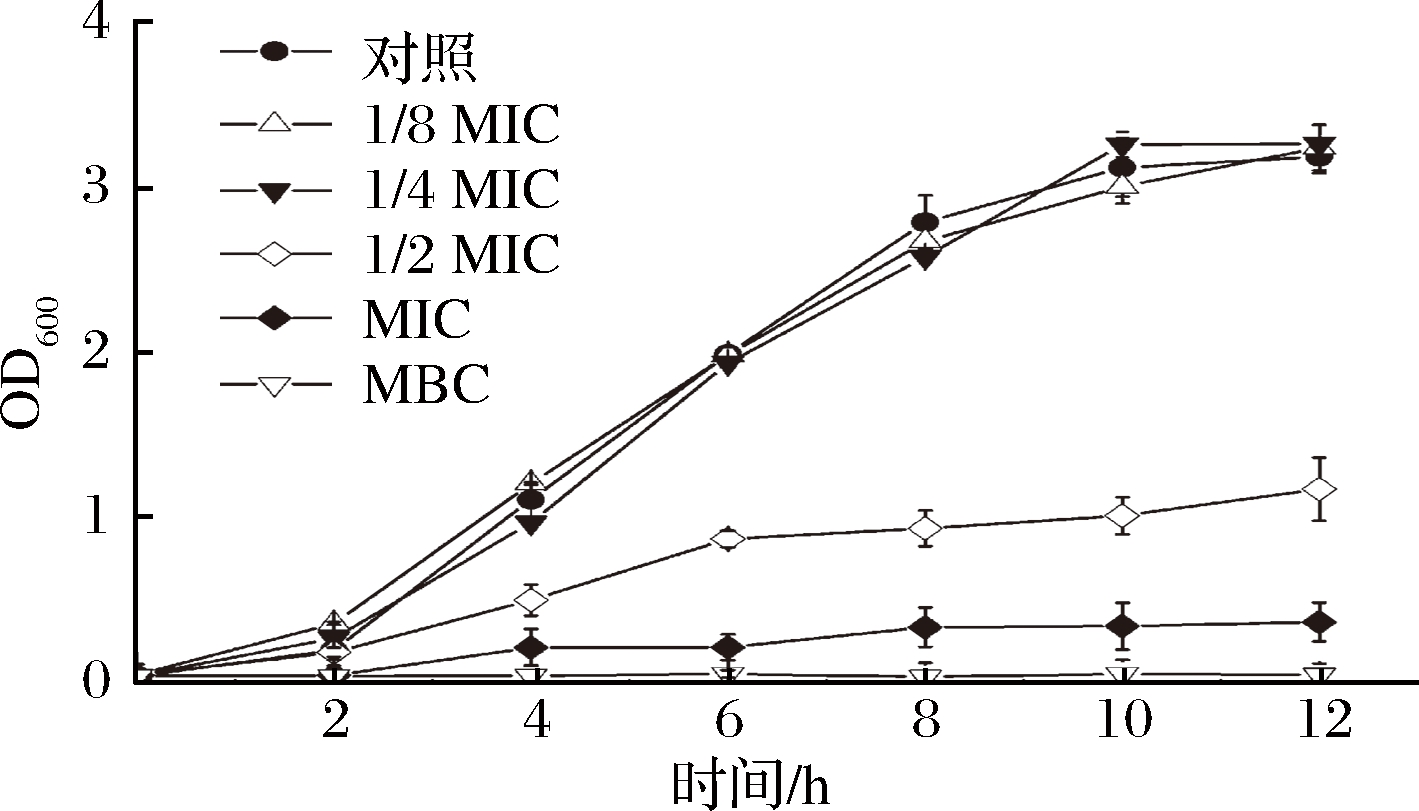
图2 不同浓度牡丹花蕾提取物下铜绿假单胞菌细胞生长曲线
Fig.2 Growth curves of P. aeruginosa under different concentrations of P. suffruticosa Andr. buds extract
2.3 铜绿假单胞菌细胞膜脂肪酸组成和含量变化
不同浓度牡丹花蕾提取物下对铜绿假单胞菌细胞膜脂肪酸组成和含量变化如图3所示,细胞膜脂肪酸分为饱和脂肪酸(saturated fatty acids, SFAs),单不饱和脂肪酸(monounsaturated fatty acids, MUFAs),多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)。从图3-A可以看出,在提取物0、MIC和MBC浓度下饱和脂肪酸的相对含量分别为43.73%、46.38%和47.11%,呈上升趋势;单不饱和脂肪酸的相对含量分别为56.27%、53.36%和52.38%,呈下降趋势。
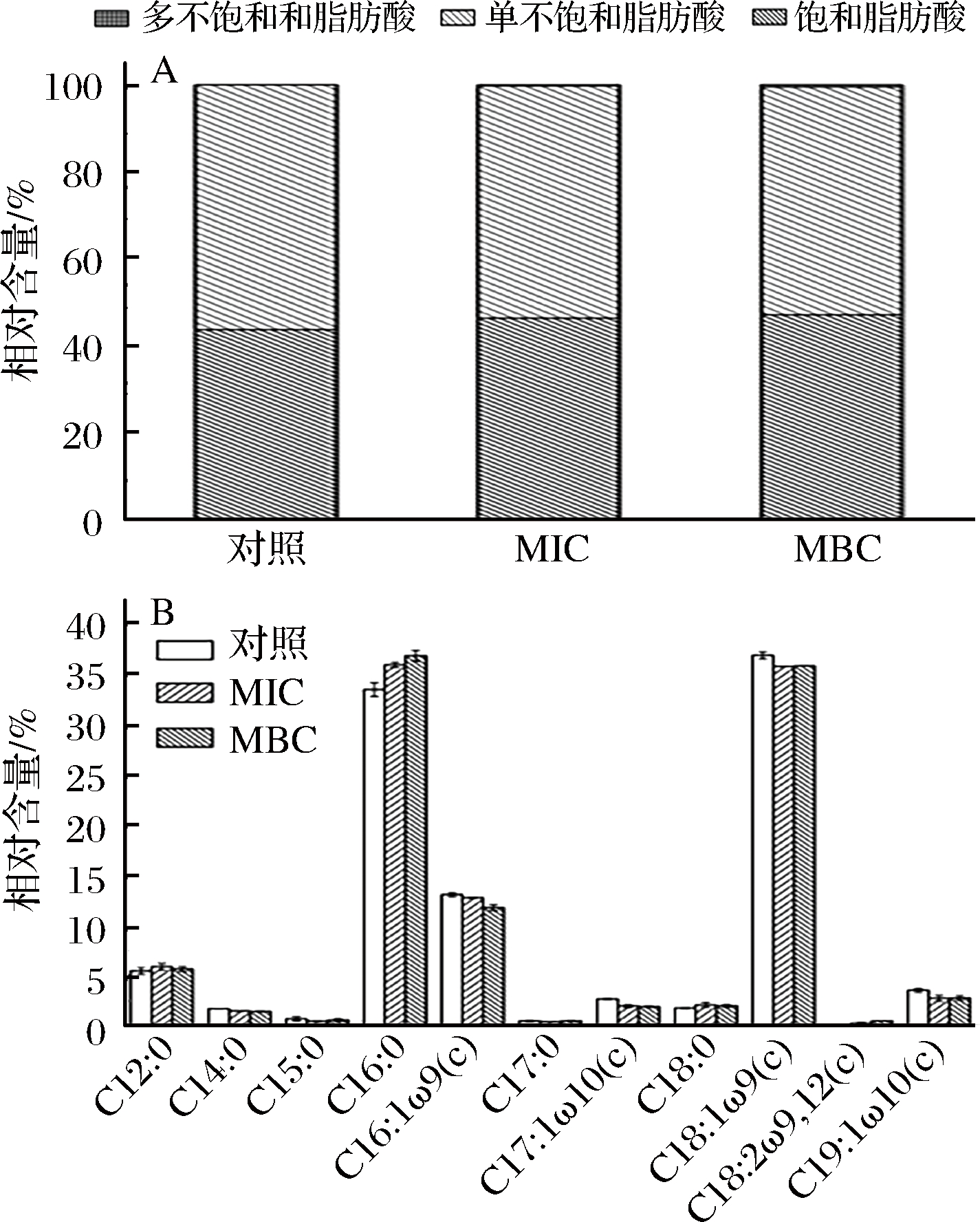
图3 牡丹花蕾提取物不同浓度下铜绿假单胞菌细胞膜脂肪酸变化
Fig.3 The changes of cell membrane fatty acid of P. aeruginosa cells under different concentrations of P. suffruticosa buds extract
即在MIC和MBC浓度下,饱和脂肪酸相对含量分别提高了6.06%和8.19%,而单不饱和脂肪酸相对含量分别降低了5.17%和6.91%。这种变化主要是由于十六烷酸(C16∶0)和十八烷酸(C18∶0)相对含量增加,如图3-B所示,在MBC浓度下,C16∶0和C18∶0的相对含量分别从33.31%、1.79%增加到36.89%、2.10%;相反的,单不饱和脂肪酸包括(Z)-9-十六碳烯酸(C16:1ω9(c))、顺式-10-十七碳烯酸(C17∶1ω10(c))、(Z)-9-十八碳烯酸(C18∶1ω9(c))和顺-10-十九碳烯酸(C19∶1ω10(c)),相对含量分别从13.08%、2.70%、36.93%和3.56%下降到11.78%、1.92%、35.89%和2.78%。膜的流体性质与膜脂肪酸的组成和比例有关[19]。通常,低熔点脂肪酸(单不饱和脂肪酸) 增加膜流动性,而高熔点脂肪酸(饱和脂肪酸)降低膜流动性[20]。结果表明饱和脂肪酸相对含量增加,单不饱和脂肪相对含量降低,这种改变导致细胞膜刚性增加,膜流动性降低,细胞形态和功能发生变化,容易引起细胞死亡。另一方面,细胞膜脂肪酸不饱和程度也可在一定程度影响铜绿假单胞菌的群集运动能力[21]。因此,细胞膜脂肪酸组成的改变导致细胞膜脂肪酸不饱和程度下降,这可能在一定程度上影响了铜绿假单胞菌生物膜的形成,降低了细胞膜的流动性,从而影响了群集运动能力,降低了其感染能力。
2.4 铜绿假单胞菌膜蛋白的结构和构象改变
膜蛋白是细胞膜中最重要的组成部分之一,它具有多种细胞功能,包括受体结合、信号传递、扩散、膜结合酶活性以及细胞与细胞间的通讯[22]。膜蛋白中含有苯丙氨酸(Phe)、色氨酸(Trp)和酪氨酸(Tyr)等氨基酸,可以在膜蛋白中发出荧光。KI是一种荧光猝灭剂,只猝灭膜蛋白表面残留的荧光,不能影响位于膜蛋白内部或缝隙中残基的荧光光谱,因此,可以定性地确定Phe、Tyr和Tyr残基在蛋白质中的位置[23-24]。图4-A、图4-B和图4-C分别显示了KI在258、280和296 nm的固定激发波长对Phe、Trp和Tyr残基的荧光发射光谱的影响,随着KI的增加,Phe的荧光强度显著下降,Trp和Tyr残基的荧光猝灭效果不明显,表明Phe的残留主要位于膜外,而Trp和Tyr的残基主要位于膜内。从图5可以看出,在不同浓度牡丹花蕾提取物下,Phe、Trp和Tyr残基的最大发射强度逐渐降低,并伴随着明显的红移,这些结果表明牡丹花蕾提取物与膜蛋白结合,改变了细胞膜膜蛋白的结构和构象,使Phe、Trp和Tyr残基变得更加亲水,导致细胞膜功能障碍和细胞损伤。
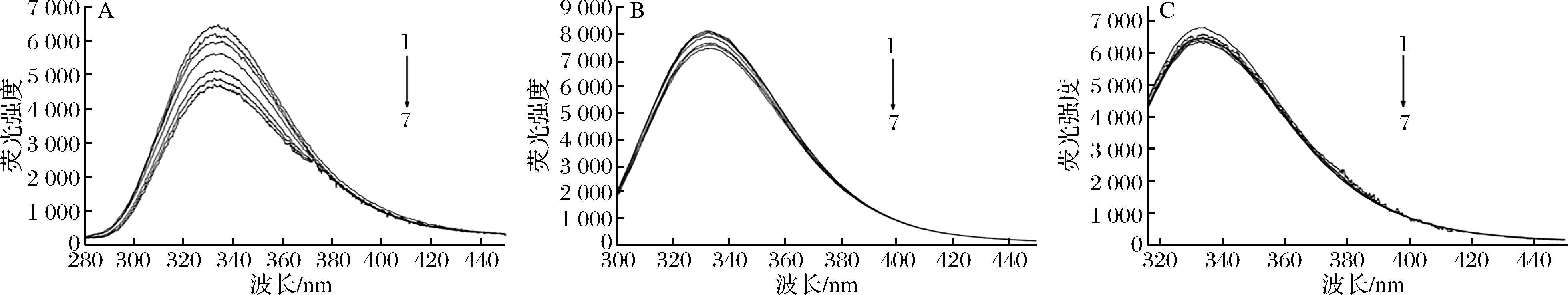
图4 不同浓度KI下铜绿假单胞菌膜蛋白氨基酸残基苯丙氨酸(A),色氨酸(B)和酪氨酸(C)荧光光谱
Fig.4 Fluorescence spectra of amino acid residues Phe(A),Trp(B) and Tyr(C) of P. aeruginosa membrane proteins
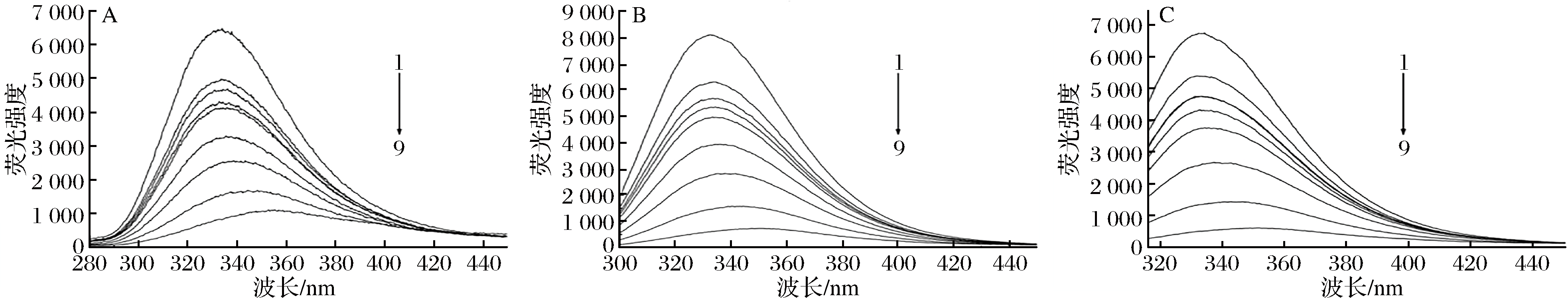
图5 不同浓度牡丹花蕾提取物下铜绿假单胞菌膜蛋白氨基酸残基苯丙氨酸(A),色氨酸(B)和酪氨酸(C)荧光光谱
Fig.5 Fluorescence spectra of amino acid residues Phe(A),Trp(B) and Tyr(C) of P. aeruginosa membrane proteins at the different concentrations of P. suffruticosa buds extract
2.5 铜绿假单胞菌细胞外膜的通透性
革兰氏阴性菌由内膜和外膜两层膜包被,完整的外膜是渗透性屏障,不包括疏水性荧光探针,如N-苯基-1-萘胺(NPN),在水环境中发出微弱的荧光,一旦受损,它就可以进入细胞外膜的疏水性环境(膜内部磷脂层),产生明显的荧光[25-26]。因此,铜绿假单胞菌细胞对NPN的摄取能力反映了牡丹花蕾提取物作用下细胞外膜通透性变化。如图6显示,在低浓度1/8MIC,1/4MIC和1/2MIC处理下,NPN荧光吸收值显著升高,说明细胞外膜通透性明显增大,当浓度达到1/2MIC,细胞外膜通透性最大。在MBC处理后,NPN荧光吸收值反而下降,这时观察铜绿假单胞菌细胞悬浮液,形成不均匀的絮状物。由于NPN要进入细胞外膜的疏水环境中才能发光,但在MBC浓度下,膜结构遭到破坏,细胞裂解,NPN将无法进入疏水性环境,从而导致NPN的荧光吸收值下降。因此,在低浓度下提取物增大细胞膜通透性,当浓度达到MIC,部分细胞膜受损,浓度增大到MBC时细胞破裂,导致细胞死亡。
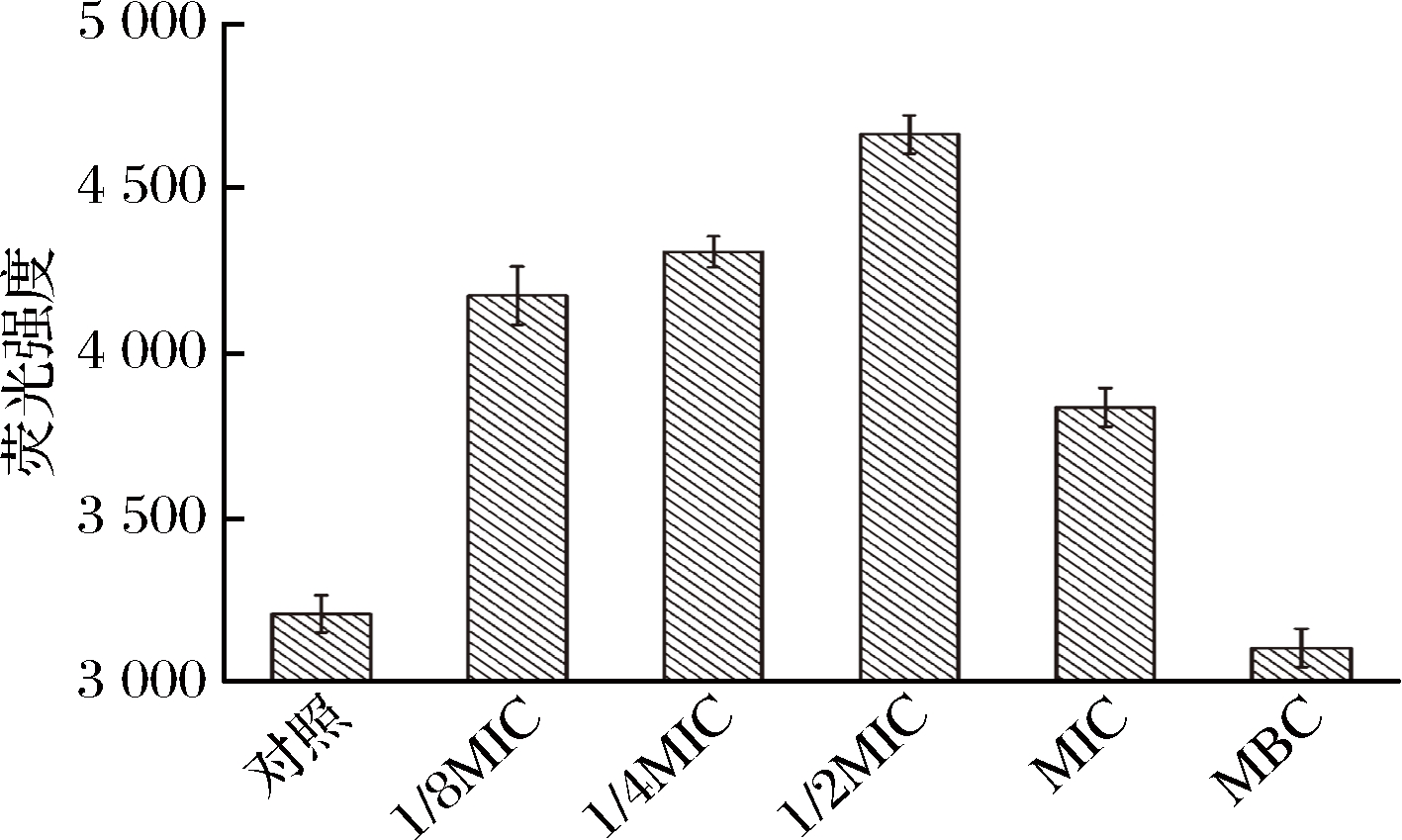
图6 不同浓度牡丹花蕾提取物处理铜绿假单胞菌后摄取NPN的荧光吸收值
Fig.6 NPN uptake of P. aeruginosa treated with different concentrations of P. suffruticosa buds extract
2.6 铜绿假单胞菌的细胞形态变化
从图7-A中可以看出,正常铜绿假单胞菌细胞具有规则的细胞形态,呈杆状分布,结构完整,见完整的细胞壁,大量的铜绿假单胞菌黏附,连接成片,见多聚分泌物,呈膜状包裹的典型生物膜性状。
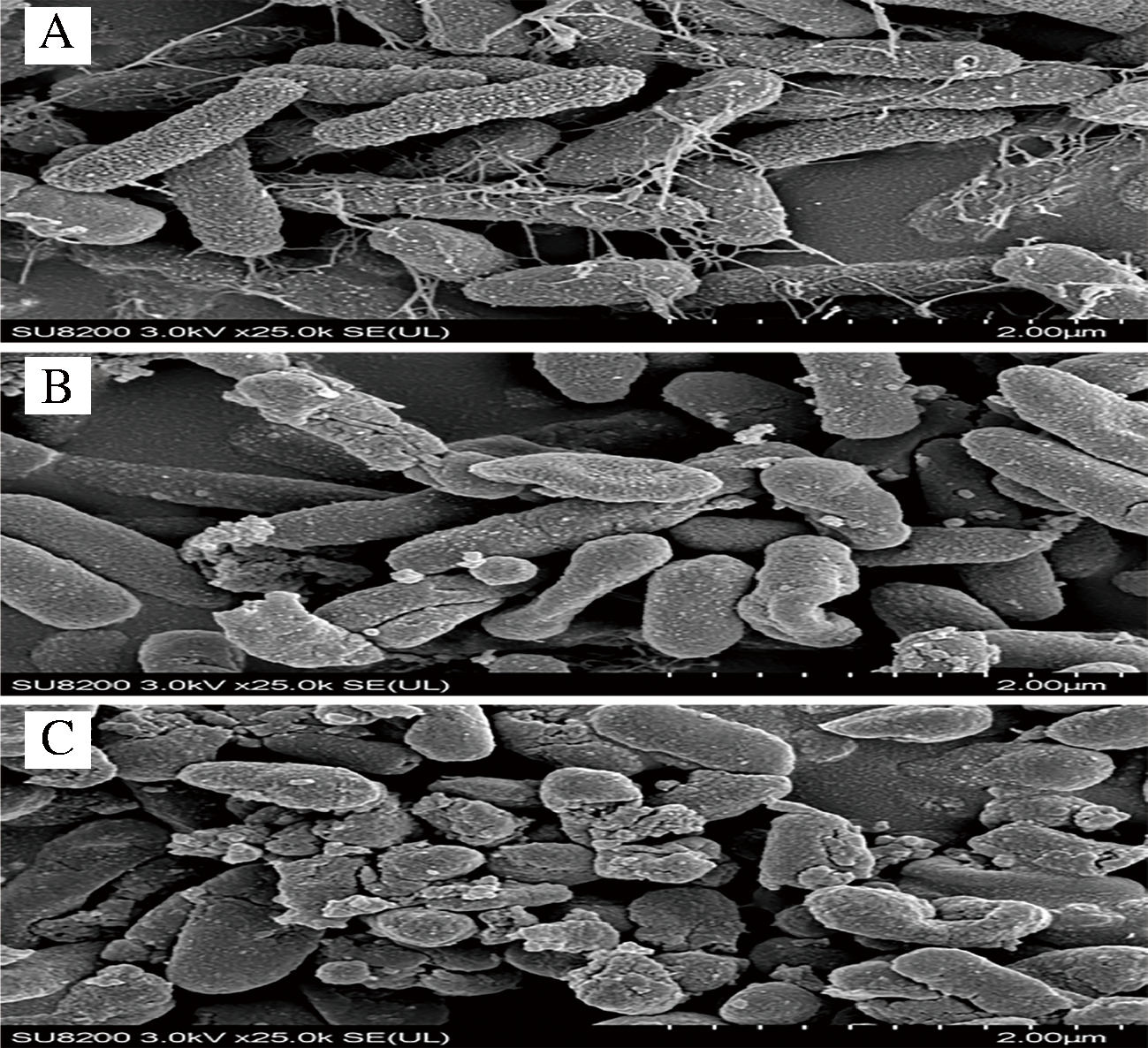
A-对照;B-MIC处理;C-MBC处理
图7 不同浓度牡丹花蕾提取物处理铜绿假单胞菌后扫描电镜显微照片
Fig.7 SEM photomicrographs of P. aeruginosa treated with different concentrations of P. suffruticosa buds extract
图7-B显示,通过浓度MIC牡丹花蕾提取物处理3 h后,细胞形态发生了明显变化,无明显细胞壁,细胞变短,绝大部分细胞发生萎缩并出现凹陷,部分细胞出现干瘪或空洞,且无可见生物膜;浓度为MBC牡丹花蕾提取物处理3 h后结果如图7-C所示,细胞形态完全破坏,大部分细胞裂解,出现大量细胞碎片。说明牡丹花蕾提取物抑制铜绿假单胞菌细胞生长,清除生物膜,破坏细胞壁和细胞膜,最终导致细胞死亡。
3 结论
本研究以铜绿假单胞菌为试验菌,初步探讨了牡丹花蕾提取物的抑菌活性及抑菌机理。结果表明,牡丹花蕾提取物对铜绿假单胞菌的最低抑制浓度和最低杀死浓度分别为3.13和6.25 mg/mL,且具有较好的稳定性;牡丹花蕾提取物使铜绿假单胞菌细胞膜饱和脂肪酸相对含量增加,单不饱和脂肪酸相对含量降低,导致膜流动性降低;通过改变膜蛋白结构和构象使细胞膜功能发生障碍和细胞损伤;同时可破坏细胞膜完整性和增加细胞外膜的通透性,最终导致细胞死亡。因此,牡丹花蕾提取物可以作为一种新型的具有应用前景的植物源防腐保鲜剂。
[1] 樊永祥, 刘秀梅. 食源性疾病控制与餐饮食品安全管理[J]. 环境卫生学杂志, 2006,33(3):170-175.
[2] 卢士玲, 李开雄,徐幸莲. 不同生物保鲜剂对冷鲜肉抑菌效果的研究进展[J]. 肉类研究, 2008(2):38-41.
[3] 黄旭镇, 朱军莉,赵二科,等. LC-MS/MS检测水产品源致病菌和腐败菌群体感应AHLs信号分子[J]. 水产学报, 2014,38(7):1 040-1 047.
[4] 蔡双福, 张琴,黄耀雄. 食品中铜绿假单胞菌的监测分析[J]. 中国卫生检验杂志, 2015,25(6):875-876.
[5] KORA A J, ARUNACHALAM J. Assessment of antibacterial activity of silver nanoparticles on Pseudomonas aeruginosa and its mechanism of action[J]. World J Microbiol Biotechnol, 2010,27(5):1 209-1 216.
[6] GEETHALAKSHMI R, JAGADISH C S, SARADA D. Antibacterial activity of flavonoid isolated from Trianthema decandra against Pseudomonas aeruginosa and molecular docking study of FabZ[J]. Microbial Pathogenesis, 2018,121:87-92.
[7] RYBTKE M, HULTQVIST L D, GIVSKOV M, et al. Pseudomonas aeruginosa biofilm infections: community structure, antimicrobial tolerance and immune response[J]. J Mol Biol, 2015,427(23):3 628-3 645.
[8] 游玉明, 杨帆,熊运海. 牡丹花的综合利用与开发前景[J]. 北方园艺, 2011,1:67-69.
[9] LI Chonghui, DU Hui, WANG Liangsheng, et al. Flavonoid composition and antioxidant activity of tree peony (Paeonia section moutan) yellow flowers[J]. Journal of Agricultural and Food Chemistry, 2009,57(18):8 496-8 503.
[10] 王晓, 时新刚,郑成超,等. 牡丹花提取物清除活性氧及对·OH引发的DNA损伤的保护作用[J]. 食品与发酵工业, 2004,30(7):55-58.
[11] JIAO J, SUN L, GUO Z, et al. Antibacterial and anticancer PDMS surface for mammalian cell growth using the Chinese herb extract paeonol(4-methoxy-2-hydroxyacetophenone)[J]. Sci Rep, 2016,6(1):38 973-38 983.
[12] COCKERILL F R, WIKER M A, ALDER J, et al. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically [M]. Ninth Edition M07-A9. Pennsylvania, USA: Clinical & Laboratory Standards Institute, 2012.
[13] ZHANG Y B, LIU X Y, WANG Y F, et al. Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J]. Food Control, 2016,59:282-289.
[14] WU Y, BAI J, ZHONG K, et al. A dual antibacterial mechanism involved in membrane disruption and DNA binding of 2R,3R-dihydromyricetin from pine needles of Cedrus deodara against Staphylococcus aureus[J]. Food Chem, 2017,218:463-470.
[15] HUANG M N, LU X Y, ZONG H, et al. Bioproduction of trans-10,cis-12-conjugated linoleic acid by a highly soluble and conveniently extracted linoleic acid isomerase and an extracellularly expressed lipase from recombinant Escherichia coli strains[J]. Journal of Microbiology and Biotechnology, 2018,28(5):739-747.
[16] WANG L H, WANG M S, ZENG X A, et al. Membrane and genomic DNA dual-targeting of citrus flavonoid naringenin against Staphylococcus aureus[J]. Integrative Biology, 2017,9(10):820-829.
[17] NING Y, YAN A, YANG K, et al. Antibacterial activity of phenyllactic acid against Listeria monocytogenes and Escherichia coli by dual mechanisms[J]. Food Chemisity, 2017,228:533-540.
[18] SHI C, SUN Y, ZHENG Z, et al. Antimicrobial activity of syringic acid against Cronobacter sakazakii and its effect on cell membrane[J]. Food Chemisity, 2016,197:100-106.
[19] ROSANGEIA D, NIKKI H, GAIL B, et al. Changes in membrane fatty acids composition of microbial cells induced by addiction of thymol, carvacrol, limonene, cinnamaldehyde, and eugenol in the growing media[J]. J Agric Food Chem, 2006,54: 2 745-2 749.
[20] BEALES N. Adaptation of microorganisms to cold temperatures, weak acid preservatives, low pH, and osmotic stresss:A review[J]. Comprehensive Reviews in Food Science & Food Safety, 2004,3(1):1-20.
[21] 于非非, 余祥勇,于海英,等. 异油酸含量对铜绿假单胞菌群集运动能力的影响[J]. 微生物学报, 2015,55(12):1 600-1 007.
[22] XING K, CHEN X G, LIU C S, et al. Oleoyl-chitosan nanoparticles inhibits Escherichia coli and Staphylococcus aureus by damaging the cell membrane and putative binding to extracellular or intracellular targets[J]. International Journal of Food Microbiology, 2009,132(23):127-133.
[23] SHI Y G, ZHU Y J, SHAO S Y, et al. Alkyl ferulate esters as multifunctional food additives: Antibacterial activity and mode of action against Escherichia coli in vitro[J]. Journal of Agricultural and Food Chemistry, 2018,66(45):12 088-12 101.
[24] LIU M, LIU Y, CAO M J, et al. Antibacterial activity and mechanisms of depolymerized fucoidans isolated from Laminaria japonica[J]. Carbohydr Polym, 2017,172:294-305.
[25] YARAKSA N, ANUNTHAWAN T, THEANSUNGNOEN T, et al. Design and synthesis of cationic antibacterial peptide based on Leucrocin I sequence, antibacterial peptide from crocodile (Crocodylus siamensis) white blood cell extracts[J]. The Journal of Antibiotics, 2014,67(3):205-212.
[26] HELANDER I M, MATTILA S T. Fluorometric assessment of gram-negative bacterial permeabilization[J]. J Appl Microbiol, 2000,88(2):213-220.