豆粕因其富含蛋白质,被广泛应用为饲用蛋白原料,但直接饲喂蛋白质生物转化率较低,而导致其转化效率低的原因是在于抗营养因子的存在[1-2]。抗营养因子不仅破坏了饲料本身的营养价值和可利用效率[3],还大大降低了家禽的生产性能。因此需要将豆粕中大分子蛋白转变成肽类物质和氨基酸等小分子物质,进而提高饲料蛋白的利用率。酶解法和微生物发酵法[4]是现在被广泛用于处理豆粕的两种方法。
酶解法利用蛋白酶将大分子蛋白分解为小分子物质。其具有肽类物质含量高、免疫活性强等[5]特点,但在酶解过程易产生苦味物质[6],影响饲料产品的适口性。微生物发酵法是通过发酵产生的蛋白酶发挥作用,此外在发酵过程会产生大量有机酸及香味物质,对于改善饲料适口性,调节动物肠道健康具备积极意义[7-8],但单一的微生物发酵法,蛋白酶的量较低,无法满足实际生产需求。
菌酶协同发酵即在酶解工艺的处理下加入一定量的乳酸菌、酵母菌、芽孢菌、甚至霉菌等益生菌进行发酵[9],这些益生菌在发酵过程会产生多种香味物质,可以对饲料产品的苦味起到调节作用[10-12]。同时也可以克服单独利用微生物发酵产酶不足的问题,这对于饲料的制备具有重大意义。而相较于其他益生菌,乳酸菌作为发酵菌种具有独特的优势,它能够利用饲料中的糖代谢生成乳酸及其他各种有机酸,降低饲料的pH值,从而发挥抑菌作用,延长饲料产品的保质期,同时发酵产生的多种有机酸也增加了饲料的营养性和适口性[13-14]。
本研究采取菌酶协同发酵法制备豆粕饲料。选用了产酸量高的植物乳杆菌作为发酵菌种,同时选用了碱性蛋白酶、中性蛋白酶、酸性蛋白酶3种蛋白酶制剂对豆粕进行酶解,综合考虑发酵豆粕的小肽含量和有机酸含量的变化情况,对菌酶协同发酵豆粕的工艺进行了优化。
1 材料与方法
1.1 菌株
植物乳杆菌DY6(CCTCC2017138)、副干酪乳杆菌DY2(CCTCC2017303)、鼠李糖乳杆菌DY4(CCTCC 2017279)、乳酸片球菌 DY5(CCTCC2017280),保藏于中国典型培养物保藏中心;植物乳杆菌DY1和鼠李糖乳杆菌DY3, 为实验室保藏。
1.2 主要试剂
乙酸钠、K2HPO4、MgSO4·7H2O、MnSO4·4H2O、柠檬酸三铵、豆粕、酸性蛋白酶、中性蛋白酶、碱性蛋白酶,购自山东和实集团有限公司;H2SO4、ZnSO4、CuSO4、三氯乙酸、SDS-PAGE凝胶制备试剂盒。
1.3 培养基
MRS培养基(g/L):胰蛋白胨10.0,牛肉膏8.0,酵母浸出粉4.0,葡萄糖20.0,K2HPO4 2.0,柠檬酸三铵2.0,醋酸钠5.0,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,吐温-80 1 mL,蒸馏水1 L,pH 6.3~6.5,1×105 Pa灭菌30 min。
1.4 仪器与设备
SHP-300FE,智能生化培养箱上海三发科学仪器有限公司; PL2002电子天平,METTLER TOLIDO公司;5804R冷冻离心机,德国Eppendorf公司;5424台式高速离心机,德国Eppendorf公司;高效液相色谱仪chromaster,日本日立公司; GelDoc凝胶成像仪,美国Bio-Rad公司。
1.5 实验方法
1.5.1 菌株活化
将实验室保藏菌种按照体积分数为1%的接种量接种到MRS培养基,37 ℃活化24 h,按照同样的方式活化2~3代,继续于MRS培养基中培养,得到乳酸菌的菌液。
1.5.2 豆粕固态发酵
将风干的豆粕、水、糖蜜、蛋白酶以及对数期的植物乳杆菌菌液按不同的的配比混合均匀后置于经无菌处理的自封袋中,封口置于37 ℃培养箱中发酵48 h。
1.5.3 发酵菌株的筛选
将风干的豆粕、水、糖蜜、及对数期的乳酸菌菌液按(所述水的加入量占豆粕总质量的50%、糖蜜原液的加入量占豆粕总质量的3%、菌液接种量占豆粕总质量的5%)比例混合均匀后置于无菌处理的自封袋中,37 ℃培养箱中发酵48 h。55 ℃烘干、粉碎,测定样品中小肽、有机酸、总酸含量。
1.5.4 蛋白酶的选择
将风干的豆粕、水、糖蜜、及不同的蛋白酶按(所述水的加入量占豆粕总质量的50%、糖蜜原液的加入量占豆粕总质量的3%、蛋白酶加入量占豆粕总质量的1%)比例混合均匀后置于无菌处理的自封袋中,37 ℃培养箱中培养48 h,55 ℃烘干、粉碎,测定样品中小肽含量。
1.5.5 菌酶协同发酵工艺优化
1.5.5.1 豆粕菌酶酵解的方法
将风干的豆粕、水、糖蜜、蛋白酶及对数期的乳酸菌菌液按(所述水的加入量占豆粕总质量的50%、糖蜜原液的加入量占豆粕总质量的3%、菌液接种量占豆粕总质量的5%、蛋白酶2 500 U/g)比例混合均匀后置于无菌处理的自封袋中,37 ℃培养箱中发酵48 h。
1.5.5.2 菌液接种量对发酵豆粕的影响
选取最佳菌株和蛋白酶,控制水、糖蜜、及蛋白酶的添加量不变,分别接种质量分数为1%、2%、3%、4%、5%的菌液37 ℃发酵48 h,55 ℃烘干、粉碎,测定样品中小肽含量和有机酸含量。
1.5.5.3 加酶量对发酵豆粕的影响
控制水、糖蜜、及菌液的添加量不变,分别添加125、625、1 250、1 875、2 500 U/g的蛋白酶37 ℃发酵48 h,55 ℃下烘干、粉碎,测定小肽含量和有机酸含量。
1.5.5.4 发酵温度对发酵豆粕影响
控制水、糖蜜、蛋白酶及菌液的添加量不变,分别设置发酵温度为30、37、40、45 ℃,发酵48 h,55 ℃烘干、粉碎,测定小肽含量和有机酸含量。
1.5.5.5 发酵时间对发酵豆粕影响
在基础酵条件上,控制其他因素不变,分别设定 0、12、24、36、48、60、72 h,经烘干、粉碎后测定小肽含量和有机酸含量。
1.5.6 正交实验
发酵工艺优化采用4因素3水平正交试验,共设9个处理,每个处理3个重复,选择接种量、酶添加量、处理温度和发酵时间4个因素进行正交试验,因素水平见表1,经烘干、粉碎后测定小肽含量和有机酸含量,随后筛选出较优组合。
表1 发酵工艺的筛选因素与水平
Table 1 Screening factors and levels of fermentation process

水平因素温度/℃酶量/(U·g-1)接种量/%发酵时间/h1351 2503362371 8754483402 500560
1.5.7 发酵豆粕指标测定
1.5.7.1 小肽含量的测定
采用方乐等[15]的方法测定发酵前后豆粕的小肽含量。
1.5.7.2 粗蛋白含量的测定
称取1 g豆粕样品,0.2 g CuSO4,6 g K2SO4混合均匀放入消化管中,加入H2SO4 10 mL,将消化管放到消化装置上消化(420 ℃,2 h),将消化好的样品用凯氏定氮仪测定。
1.5.7.3 总酸含量的测定
发酵后的豆粕进行烘干粉碎,每5 g样品加50 mL的去离子水,用旋涡振荡仪振荡15 min,6 000 r/min离心5 min,取10 mL上清液,加入40 mL蒸馏水,滴加3滴酚酞指示剂,用标定过的0.1 mol/L NaOH滴定至微红。按公式(1)计算总酸质量分数L(折算成乳酸)[16]:
(1)
式中:L,总酸质量分数,%;c,NaOH溶液的浓度,mol/L;V,样品滴定消耗的NaOH体积,mL;V0空白滴定消耗的NaOH体积,mL;90.08,乳酸的摩尔质量,g/mol;m,样品质量,g。
1.5.7.4 蛋白质体外消化率的测定
采用李清晓等[17]的方法测定发酵前后豆粕蛋白的体外消化率如公式(2)。
(2)
式中:D,蛋白质体外消化率,%;m1未酶解粗蛋白质量,g;m2酶解后粗蛋白质量,g。
1.5.7.5 有机酸含量的测定
取1 g豆粕于50 mL离心管中,加入10 mL去离子水,旋涡振荡15 min,10 000 r/min离心5 min,取上清,经0.22 μm滤膜过滤后,进行液相检测[18]。
1.5.7.6 豆粕大分子蛋白降解情况分析
称取1 g豆粕并添加10 mL浓度为0.2 mol/L NaOH,混合均匀并搅拌15 min,于10 000 r/min离心6 min,吸取上清液1 mL,稀释10倍后作为样品。取50 μL样品液,加10 μL蛋白上样缓冲液,沸水浴5 min,12 000 r/min离心5 min,取上清10 μL上样,分析豆粕大分子蛋白降解情况。
2 结果与分析
2.1 发酵菌株的选择
2.1.1 小肽含量分析
豆粕经过不同乳酸菌发酵后的小肽含量见图1。
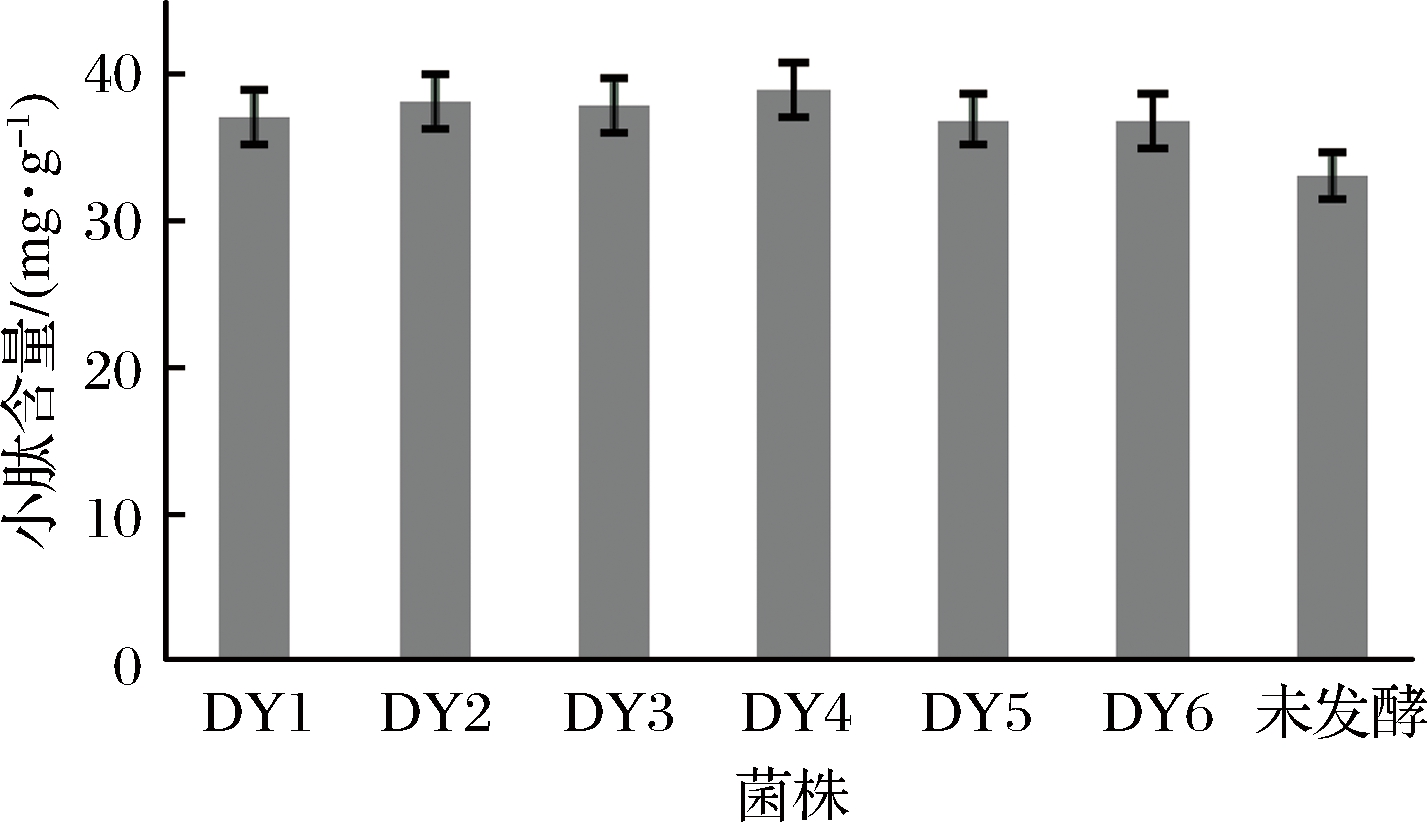
图1 不同菌株发酵后对小肽含量的影响
Fig.1 Effects of different strains on the content of small peptides after fermentation
未经乳酸菌发酵的豆粕原料小肽含量为33.09 mg/g,由图1可知,经过不同菌株发酵后小肽含量都有所上升,其中经副干酪乳杆菌DY2发酵后的豆粕中小肽含量为38.33 mg/g,经植物乳杆菌DY6发酵后的豆粕中小肽含量为36.86 mg/g,与对照组相比,小肽含量分别提高22.3%、18.5%。但总体来看,单纯用乳酸菌发酵豆粕,小肽含量提高较少。
2.1.2 有机酸含量分析
豆粕经过不同乳酸菌发酵后的产酸情况见图2,由图可知经不同菌株发酵后,植物乳杆菌DY6总酸质量分数最高,为2.3%,而饲料添加剂中,酸化剂的添加量一般在0.025%~3%,因此植物乳杆菌DY6优异的产酸性能可以替代或者部分替代饲料中酸化剂的使用。另外,植物乳杆菌DY6发酵产物中有机酸种类丰富,其中的乙酸、乳酸、柠檬酸、苹果酸都具有改善饲料适口性和调节动物肠道菌群的作用。综合其产酸情况和分解蛋白情况,选取植物乳杆菌DY6为发酵菌株。
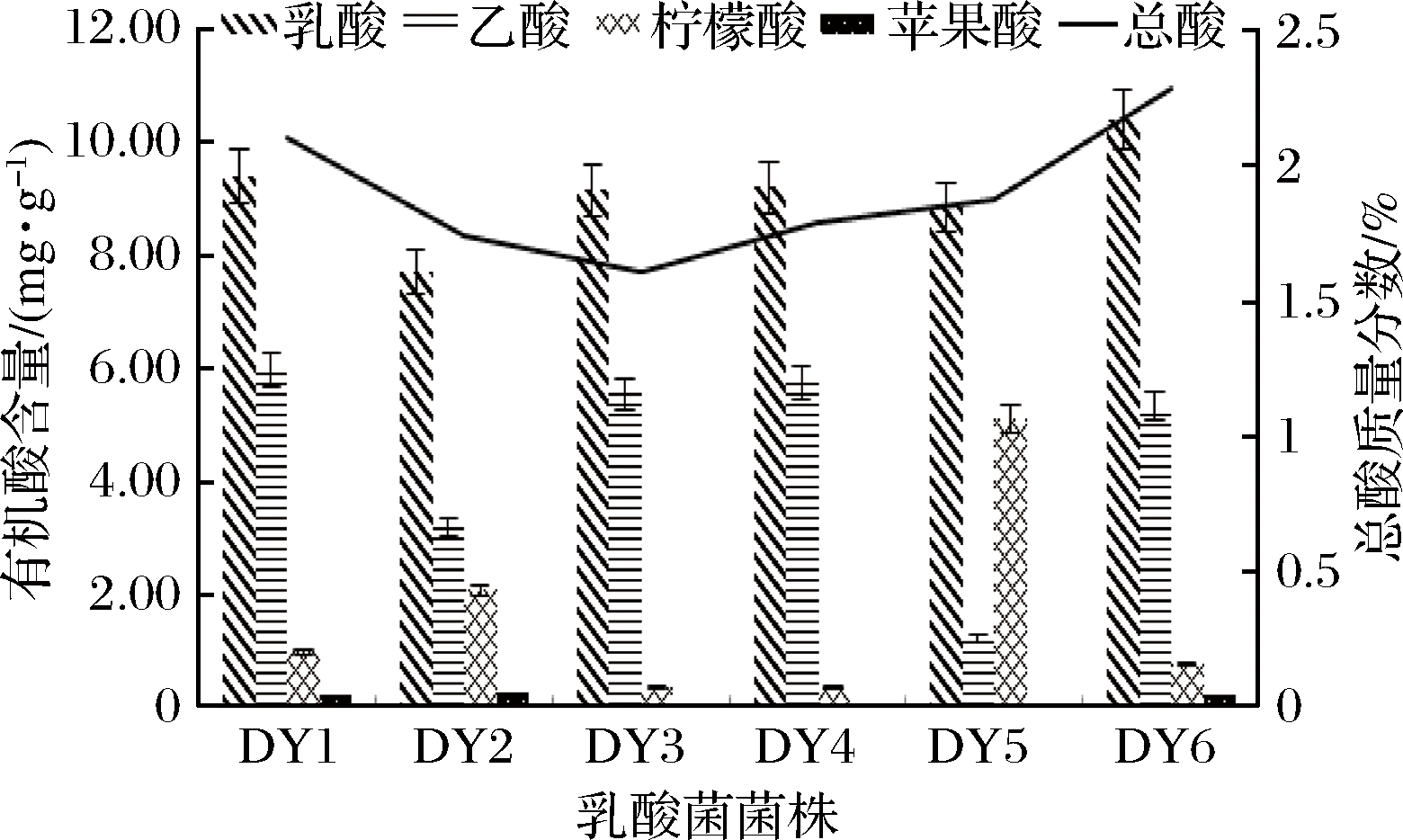
图2 不同菌株发酵后对有机酸和总酸含量的影响
Fig.2 Effects of different strains on the contents of organic acid and total acid after fermentation
2.2 蛋白酶的选择
选用不同的蛋白酶在其合适的水解条件下处理豆粕,酶解后小肽含量见图3。

图3 豆粕经不同蛋白酶酶解后小肽含量
Fig.3 Small peptide content after hydrolysis of soybean meal by different proteases
豆粕经蛋白酶处理后,小肽含量显著提高,远高于单纯利用乳酸菌发酵,其中利用中性蛋白酶处理后小肽含量最高,达104.25 mg/g,比对照组小肽含量提高了215%,因此选取中性蛋白酶进行菌酶协同发酵。
2.3 菌酶协同发酵豆粕工艺探究
2.3.1 菌液接种量对发酵豆粕的影响
菌液接种量对发酵豆粕的影响见图4,小肽含量随菌液接种量的上升而提高,在接种量为5%时趋于稳定。其中乳酸、丙酸在接种量5%条件下含量最高,乙酸含量变化不明显,而柠檬酸在接种量2%的条件下含量最高,综合小肽含量和产酸情况,最终选取5%的接种量为最适菌液接种量。
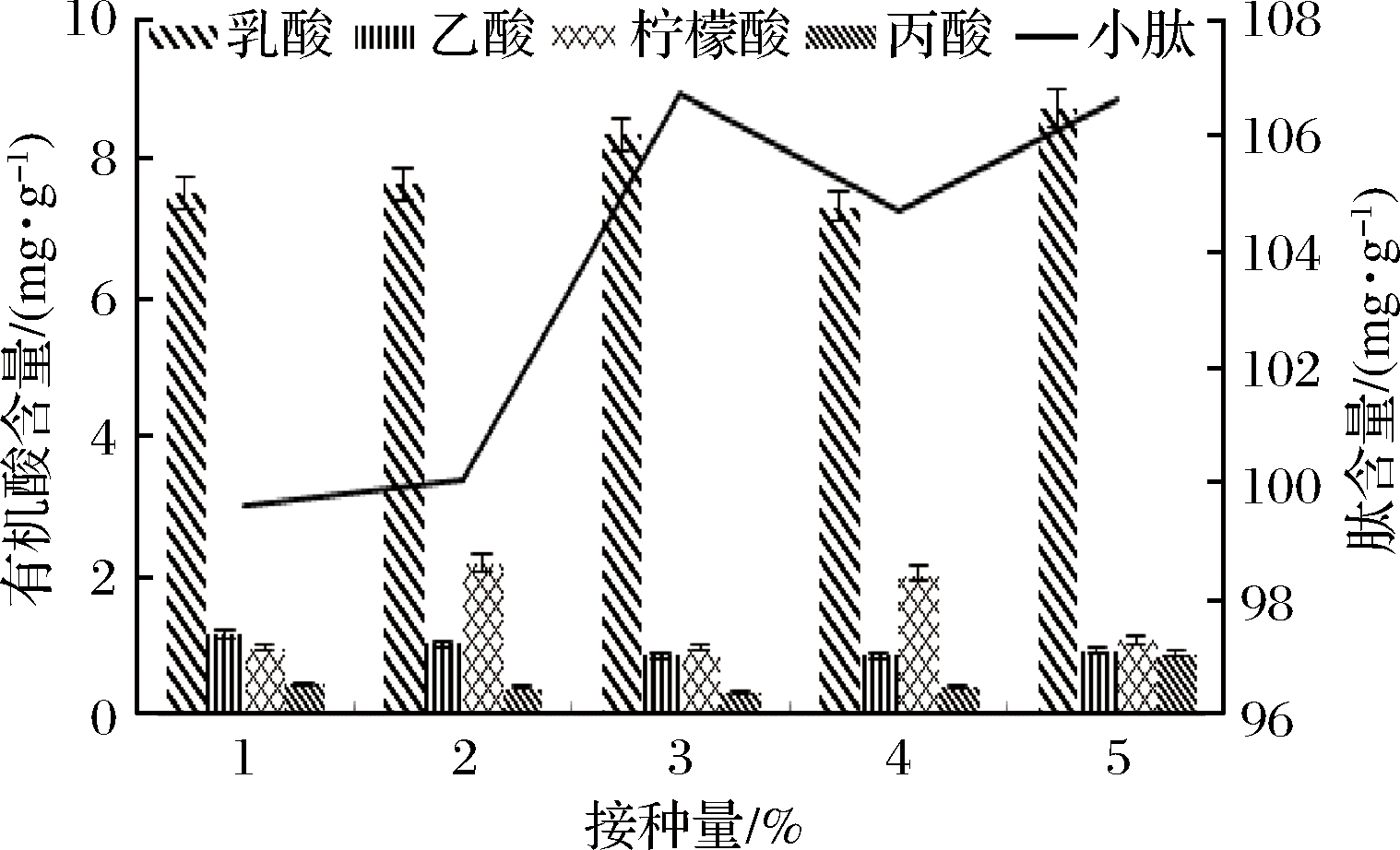
图4 菌液接种量对有机酸和小肽含量影响
Fig.4 Effect of inoculum amount on contents of organic acid and small peptide
2.3.2 加酶量对发酵豆粕的影响
由图5可知,当加酶量小于1 250 U/g时,小肽含量随加酶量的增加而提高,在加酶量为1 250 U/g的时候小肽含量趋于稳定。而在加酶量为1 250 U/g时乳酸、丙酸含量最高分别达到了10.07 mg/g和3.34 mg/g, 另外柠檬酸、乙酸含量适中,同时考虑到成本因素,控制加酶量,选择1 250 U/g为其最适加酶量。
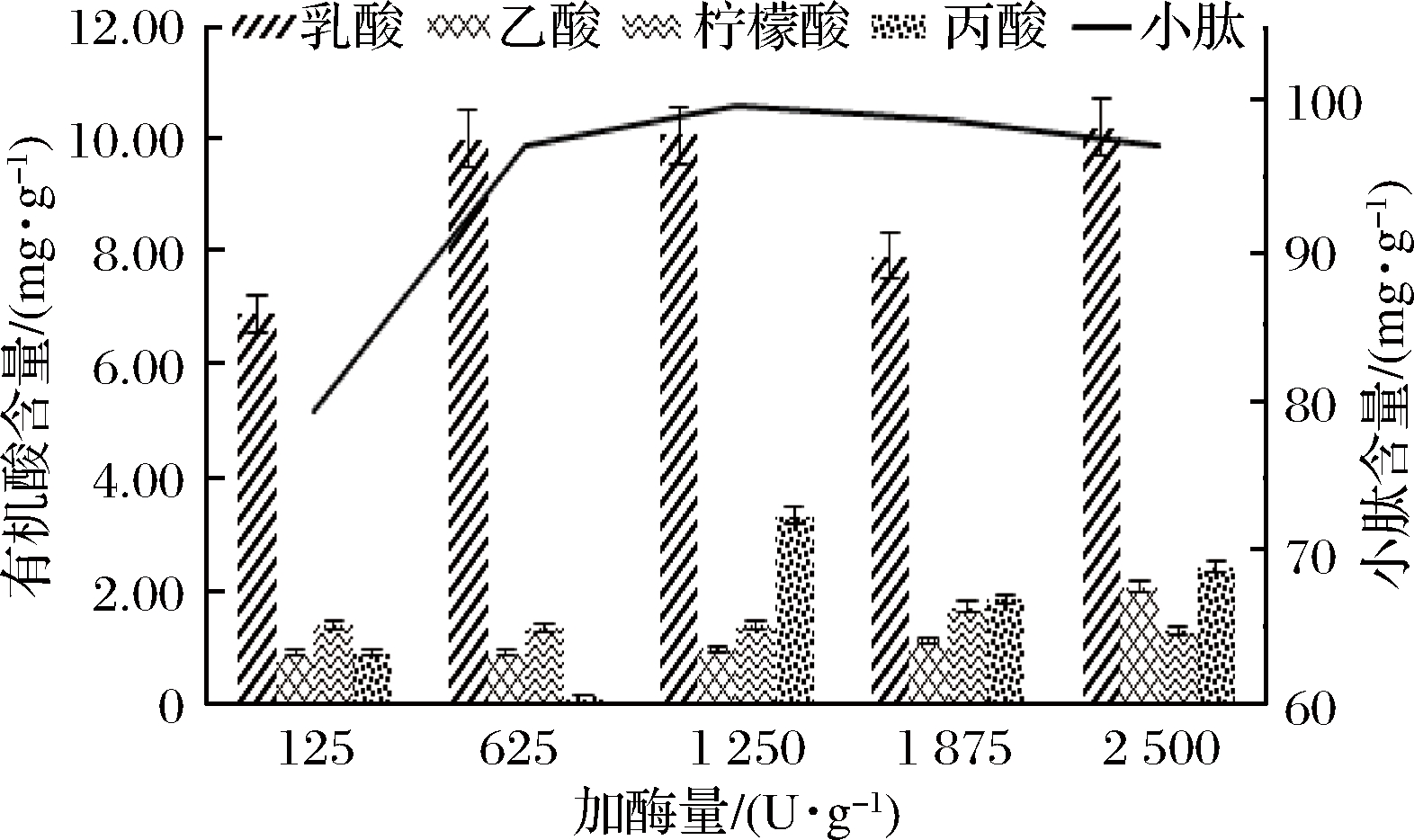
图5 酶添加量对有机酸和小肽含量影响
Fig.5 Effect of enzyme dosage on content of organic acid and small peptide
2.3.3 发酵温度对发酵豆粕影响
如图6所示,发酵温度40 ℃条件下小肽含量最高,为109.78 mg/g,在35、37 ℃条件下小肽含量差别不大,可见40 ℃适合中性蛋白酶酶解,说明相对较高的温度可使得中性蛋白酶的酶活增强。而有机酸含量在37 ℃最高,其中乳酸含量最高,符合植物乳杆菌在37 ℃生长最佳的情况。40 ℃的发酵温度下,虽然小肽含量高,但其有机酸含量处于较低水平,因此综合小肽含量和有机酸含量,确定最适发酵温度37 ℃。
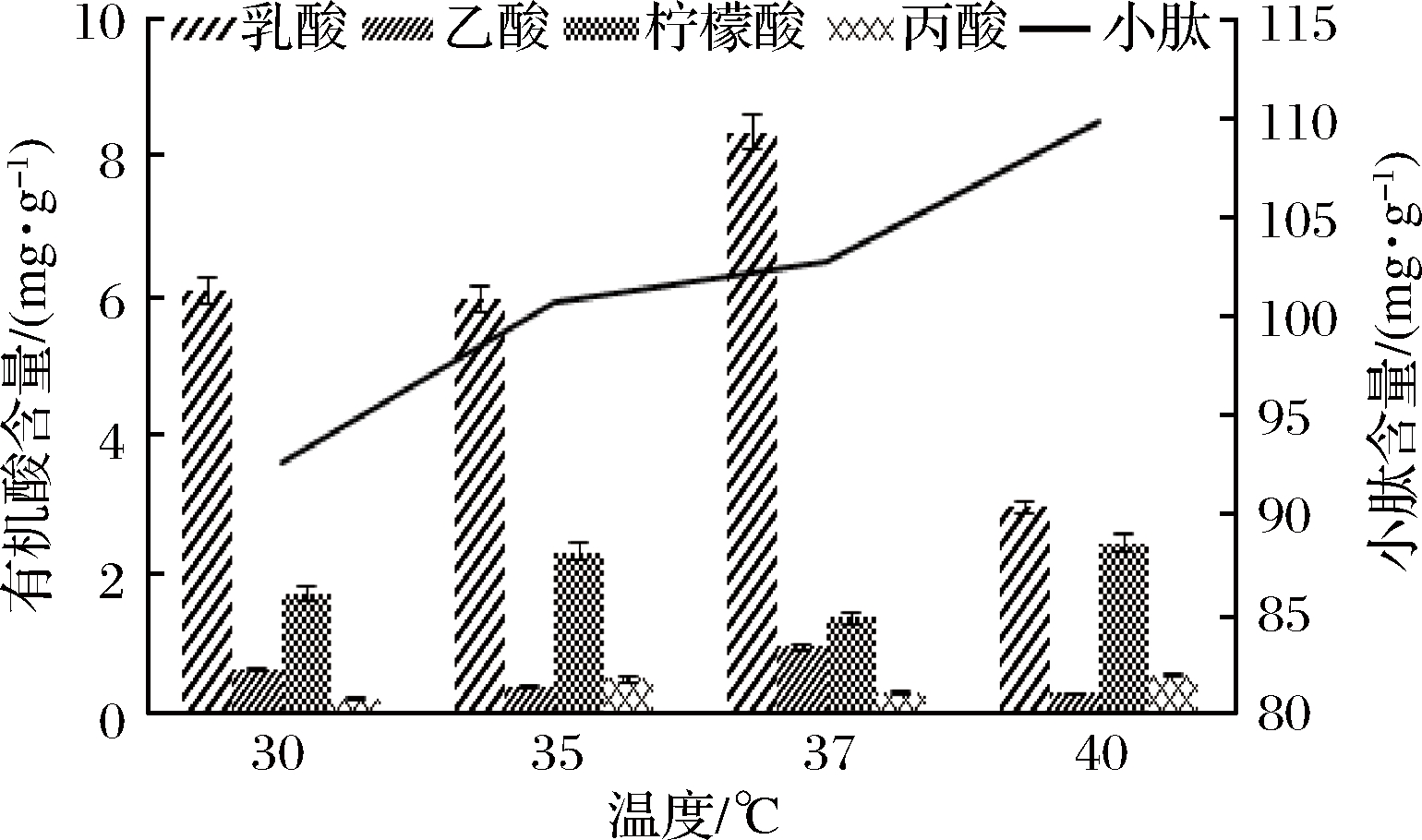
图6 发酵温度对小肽和有机酸含量影响
Fig.6 Effect of fermentation temperature on contents of small peptide and organic acid
2.3.4 发酵时间对发酵豆粕影响
由图7可知,在一定发酵时间内,小肽含量随发酵时间的增加而提高,发酵36 h后小肽含量达到108.71 mg/g,36 h之后,随发酵时间的增加,小肽含量基本不变。4种有机酸含量随着发酵时间的不断增加而增加,发酵至36 h,柠檬酸、乙酸、丙酸的含量趋于稳定,发酵48 h乳酸含量较之前有显著提高,并在发酵48 h后各种有机酸含量也趋于稳定。因此根据小肽含量和有机酸含量确定最适发酵时间为48 h,较好地控制了发酵时间,降低了成本。
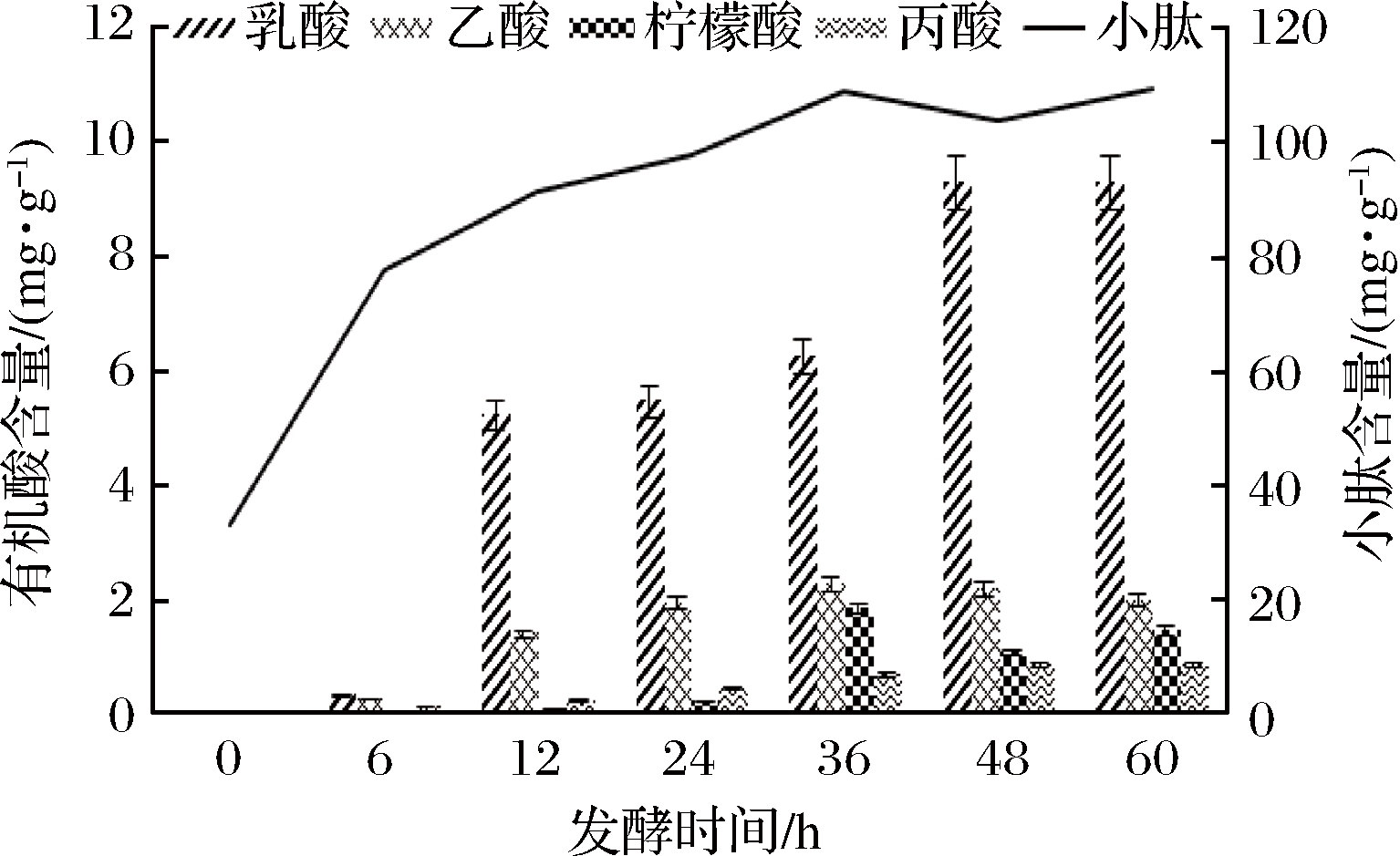
图7 发酵时间对有机酸含量影响
Fig.7 Effect of fermentation time on contents of organic acid and small peptide
2.4 正交实验结果分析
以小肽含量和总酸含量为指标,选取接种量、酶添加量、温度和发酵时间,进行4因素3水平正交实验验,结果见表2。结果显示,以小肽含量为指标时,影响因素依次为发酵时间>温度>接种量>酶添加量。最优条件为处理温度40 ℃,接种量5%,酶添加量1 250 U/g发酵时间48 h。
表2 以小肽和总酸含量为基础的正交实验测定结果
Table 2 Results of orthogonal experiments based on contents of small peptide and total acid
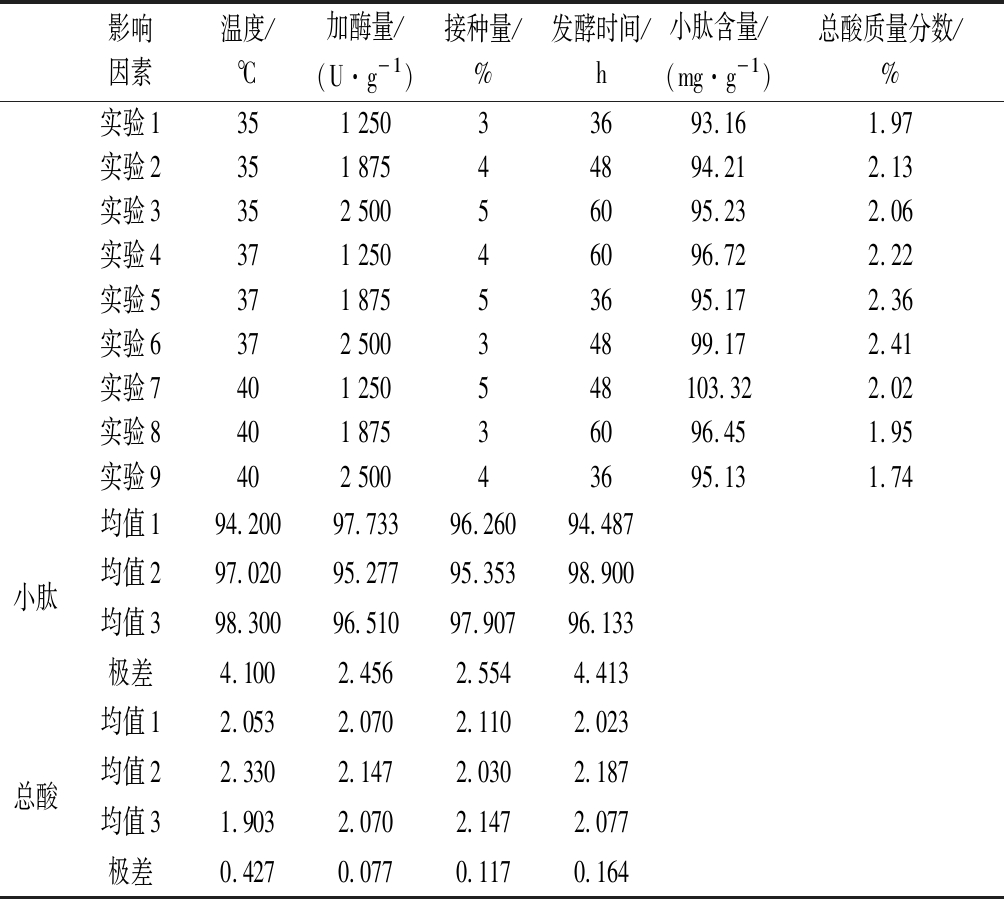
影响因素温度/℃加酶量/(U·g-1)接种量/%发酵时间/h小肽含量/(mg·g-1)总酸质量分数/%实验1351 25033693.161.97实验2351 87544894.212.13实验3352 50056095.232.06实验4371 25046096.722.22实验5371 87553695.172.36实验6372 50034899.172.41实验7401 250548103.322.02实验8401 87536096.451.95实验9402 50043695.131.74小肽均值194.20097.73396.26094.487均值297.02095.27795.35398.900均值398.30096.51097.90796.133极差4.1002.4562.5544.413总酸均值12.0532.0702.1102.023均值22.3302.1472.0302.187均值31.9032.0702.1472.077极差0.4270.0770.1170.164
以总酸含量为指标,影响因素依次为温度>发酵时间>接种量>酶添加量。最优条件为处理温度37 ℃, 发酵时间48 h,接种量5%,酶添加量1 875 U/g。通过两者数据分析,酶添加量对小肽含量和总酸含量影响小,并考虑成本,所以选取酶添加量为1 250 U/g,另外处理温度对小肽含量和总酸含量影响较大,根据单因素和正交实验结果发现在处理温度为40 ℃时小肽含量最高但其总酸含量极低,而在37 ℃时小肽含量仅次于40 ℃,差距不大,而其产酸情况最佳,在兼具降解能力的同时提高了饲料的营养价值。最终确定的最佳发酵方案为:酶添加量1 250 U/g,处理温度37 ℃,接种量5%,发酵时间48 h。
2.5 蛋白降解情况分析
豆粕蛋白降解情况见图8,由图8可知,原豆粕中存在抗原蛋白,豆粕中抗原蛋白主要由7S球蛋白和11S球蛋白组成,7S球蛋白中的α’、α、β亚基分子质量分别为68、67和57 kDa,11 大豆球蛋白的A3亚基、酸性亚基A以及碱性亚基B的分子质量分别为44、39和17 kDa。由植物乳杆菌单独进行发酵豆粕,豆粕中抗原蛋白未能得到有效降解,通过中性蛋白酶酶解和植物乳杆菌协同发酵豆粕,可以发现两种抗原蛋白得到有效降解,其中7S蛋白基本被完全降解,11S酸性亚基得到有效降解,且分子质量小于31 kDa的蛋白显著增多,表明豆粕中的抗原蛋白得到有效降解,豆粕更易被吸收。
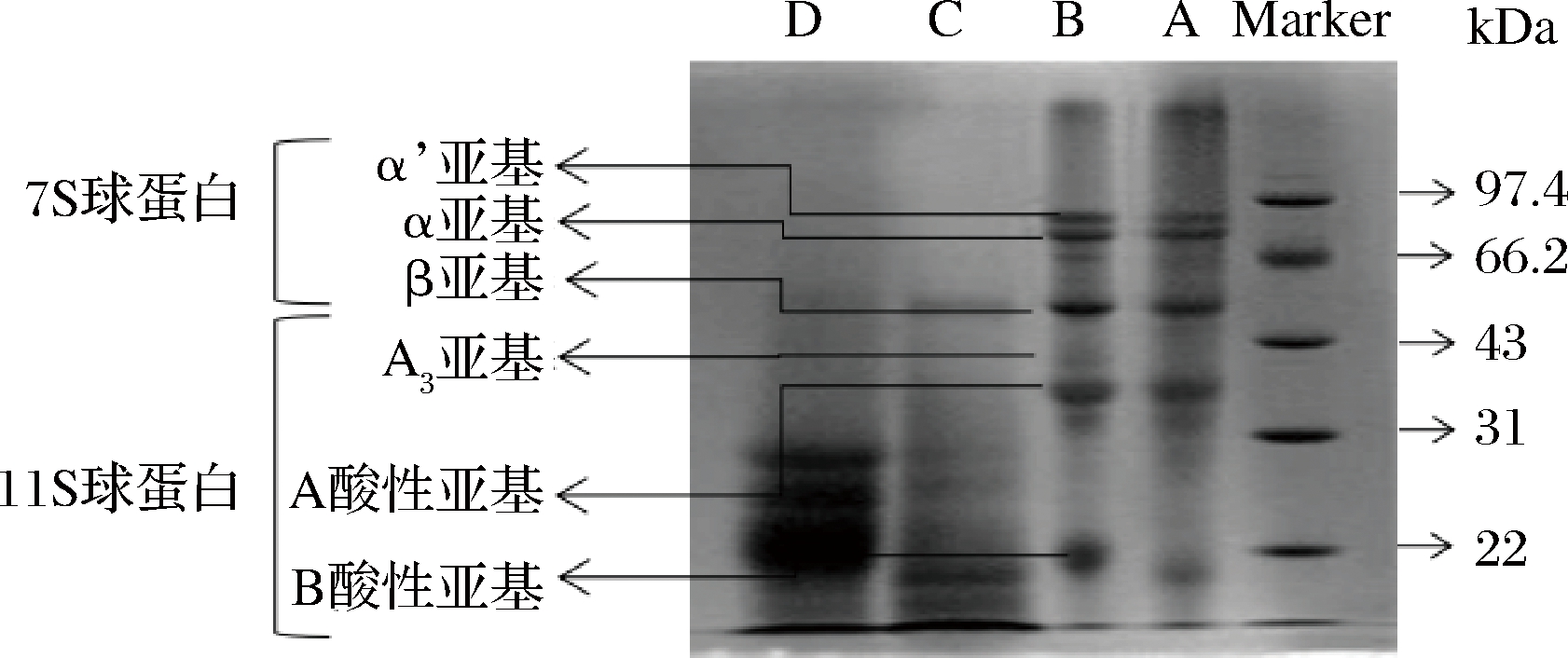
A-未发酵豆粕;B-植物乳杆菌单独发酵豆粕;C-中性蛋白酶单独发酵豆粕;D-菌酶协同发酵豆粕(5%接种量,发酵温度37 ℃,加酶量1 250 U/g,发酵时间48 h)
图8 发酵豆粕中蛋白的降解情况
Fig.8 Protein degradation in fermented soybean meal
2.6 发酵豆粕指标测定
发酵豆粕的各项测定结果见下表3,由表可知豆粕经过3种方式处理,各项指标均有所提高,其中菌酶协同发酵样品的各项指标提高最多。粗蛋白质量分数由原来的46.87%提高到了53.10%。豆粕的肽含量最高达到了107.21 mg/g。而总酸质量分数提高到了2.50%。蛋白质体外消化率由原来的51.95%提高到了69.8%。综上所述,菌酶协同发酵豆粕优于其他2种单独处理豆粕的方式,它既能有效分解抗原蛋白,又能产生多种小分子酸,提高了饲料的适口性。通过酶解法酶解豆粕虽然可以有效分解大豆蛋白成为小肽,但在酶解过程会产生苦味。而菌酶协同在兼具有效降解蛋白的同时,通过乳酸菌产生的有机酸、香味物质等可有效改善饲料的口味,降低苦味的影响。郑裴等[19]利用植物乳杆菌对豆粕进行固态发酵,发现主要的抗营养因子得到降解,氨基酸含量趋于平衡,口感和色泽得到了较大改善。张煜等[20]菌酶协同发酵饲料后,有效降解了抗原蛋白,提高了乳酸含量,从而提高了饲料养分消化率。
表3 发酵豆粕各项指标
Table 3 Indicators of fermented soybean meal
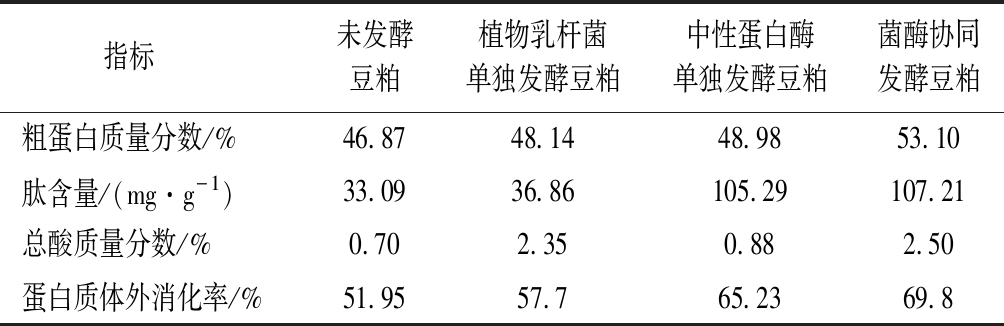
指标 未发酵豆粕植物乳杆菌单独发酵豆粕中性蛋白酶单独发酵豆粕菌酶协同发酵豆粕粗蛋白质量分数/%46.8748.1448.9853.10肽含量/(mg·g-1)33.0936.86105.29107.21总酸质量分数/%0.702.350.882.50蛋白质体外消化率/%51.9557.765.2369.8
3 讨论
豆粕常用的处理方式包括微生物发酵和蛋白酶处理,本研究采用菌酶协同发酵处理豆粕,既能够很好地去除抗原蛋白又增加了饲料的适口性,本研究综合考虑蛋白分解情况、产有机酸情况,以及发酵工艺成本,确定了工艺条件为:接种量5%,酶添加量1 250 U/g, 发酵温度37 ℃,发酵时间48 h。菌酶协同发酵工艺处理豆粕,可有效降解豆粕中大分子蛋白,提高发酵豆粕的各项指标,粗蛋白含量、肽含量、总酸含量、蛋白质体外消化率这4个指标都优于通过乳酸菌或酶单独处理的工艺,与未发酵豆粕相比,粗蛋白含量提高了6.23%,肽含量提高了223%,总酸含量提高了1.8%,蛋白质体外消化率提高了17.85%。
据报道,通过蛋白酶分解豆粕蛋白可以得到分子质量较小的肽类物质,其中的一些成分还具有较好的免疫活性。常用的蛋白酶有酸性蛋白酶、碱性蛋白酶、中性蛋白酶,风味蛋白酶等。通过风味蛋白酶酶解大豆分离蛋白,可以显著提高其体外消化率[21],降低抗原蛋白的抗原活性[22]。酸性蛋白酶和中性蛋白酶则因其价格便宜,且具有一定的脱苦作用,在饲料工业常作为酶解豆粕的酶制剂[23],但由于多肽自身结构问题不可避免地会导致苦味的存在,大大影响产品的适口性。因此通过微生物发酵辅助酶解蛋白,不仅可以降低饲料中抗营养因子的含量,还可以大大提高饲料的适口性。乳酸菌在微生物发酵过程中,可以提高发酵产品游离氨基酸的量,并产生叶酸,核黄素,有机酸,维生素等。另外其可以有效地抑制肠道内腐败菌生长,提高机体的免疫力。菌酶协同工艺表现出了极大的优势,也成为了关注热点。张煜等[20]通过菌酶协同发酵显著改善了玉米-豆粕饲料的品质,并大大提高了猪的采食量。蔡国林等[16]利用植物乳杆菌和蛋白酶发酵花生粕,大分子蛋白得到显著降解,必需氨基酸得到提高,改善了花生粕的品质。周爽等[24]利用枯草芽孢杆菌和中性蛋白酶协同发酵豆粕,大大提高了其肽含量,提高了饲料的适口性。可以看出,菌酶协同处理能够有效地提高饲料品质,具有广泛应用前景。
目前对豆粕的固态发酵主要集中在单菌发酵和混菌发酵上,混菌发酵可以弥补单菌发酵的不足,有助于提高豆粕的营养和降低生长抑制因子[25],但混菌发酵控制精度要求高,菌株相互影响,发酵过程复杂。本研究主要集中在单菌发酵工艺的研究,后续可进行混菌发酵工艺的优化,此外,在酶的选择上,也可进行多种酶复合作用的研究,从而筛选出更优发酵工艺。
[1] 马文强, 冯杰,刘欣. 微生物发酵豆粕营养特性研究[J]. 中国粮油学报, 2008, 23(1): 121-124.
[2] 王小明, 杨艳艳,杨在宾,等. 微生物发酵降解豆粕抗营养因子的应用研究[J]. 猪业科学, 2017,34 (11): 90-92.
[3] 王威, 孙世军,赵巧义. 固态发酵大豆粕工艺研究现状及其工业应用[J]. 粮食与油脂, 2013,26 (6): 14-16.
[4] 马静. 微生物发酵豆粕产活性大豆肽饲料的研究进展[J]. 饲料工业, 2016, 37(8): 27-31.
[5] 黄明媛, 宋敏,魏秋群. 蛋白酶对豆粕的酶解研究[J]. 广东饲料, 2017, 26(3): 19-22.
[6] CHOM J, UNKLESBAY N, HSIEH F H, et al. Hydrophobicity of bitter peptides from soy protein hydrolysates[J]. Journal of Agricultural & Food Chemistry, 2004, 52(19): 5 895-5 901.
[7] DREWNOWSKI A, GOMEZ-CARNEROS C. Bitter taste, phytonutrients, and the consumer: A review[J]. Am J Clin Nutr, 2000, 72(6): 1 424-1 435.
[8] 何玉华, 刘忠军.乳酸菌发酵豆粕对水貂日粮消化的影响[J].吉林农业科技学院学报,2009,18(4):6-9
.[9] 王芳, 贾万利,张浩男,等. 混合菌发酵对豆粕品质的影响[J]. 甘肃农业大学学报, 2017, 52(4): 45-51.
[10] MAEDA Y, OKUDA M, HASHIZUME K, et al. Analyses of peptides in sake mash: Forming a profile of bitter-tasting peptides[J]. Journal of Bioscience & Bioengineering, 2011, 112(3): 238-246.
[11] XU Chong, WANG He, YANG Fei, et al. Effect of an inoculant and enzymes on fermentation quality and nutritive value of erect milkvetch (Astragalus adsurgens Pall.) silages[J]. Journal of Animal & Feed Sciences, 2011, 20(3): 449-460.
[12] 王乃富. 乳酸菌发酵酶解豆粉及其生物活性研究[D]. 无锡:江南大学, 2007.
[13] HRISTOV A N, MCALLISTER T A. Effect of inoculants on whole-crop barley silage fermentation and dry matter disappearance in situ[J].Journal of Animal Science, 2002, 80(2):510-516.
[14] 陆春波, 毛银,李国辉,等. 植物乳杆菌DY6主要抑菌代谢物的分析和鉴定[J]. 微生物学通报, 2019.DOI:10.13344/j.mic20biol.china.180720
[15] 方乐, 葛向阳,汤江武,等. 菌酶协同处理豆粕制备饲用小肽的研究[J]. 中国饲料, 2011 (5): 17-20;27.
[16] 蔡国林, 郑兵兵,王刚,等. 微生物发酵提高花生粕营养价值的初步研究[J]. 中国油脂, 2010, 35(5): 31-34.
[17] 李清晓, 李忠平,庄苏,等. 豆粕粉碎粒度与蛋白质体外消化率的关系研究[J]. 家畜生态学报, 2005, 26(5): 28-31.
[18] ZHAO Mei, HUANG Dixuan, ZHANG Xi, et al. Metabolic engineering of Escherichia coli for producing adipic acid through the reverse adipate-degradation pathway[J]. Metabolic Engineering, 2018, 47: 254-262.
[19] 郑裴, 吕峰,徐玉霞,等. 植物乳杆菌发酵豆粕及其抗营养因子的研究[J]. 安徽农学通报, 2009, 15(10):63-64;137.
[20] 张煜, 石常友,王成,等. 菌酶协同发酵改善玉米-豆粕型饲料营养价值的研究[J]. 中国粮油学报, 2018,33(3):70-77.
[21] 田杰, 柴莎莎,胡传荣,等. 风味蛋白酶酶解大豆分离蛋白及对其功能特性影响研究[J]. 中国油脂, 2015, 40(10):11-14.
[22] 王章存, 王佩,安广杰,等. 风味蛋白酶水解大豆分离蛋白的抗原性及功能特性变化[J]. 中国粮油学报, 2018, 33(3): 48-52.
[23] 刘慧珍. 豆粕适度酶解研究[D].无锡:江南大学, 2007.
[24] 周爽, 张青,齐晓芬,等. 枯草芽孢杆菌和中性蛋白酶协同发酵豆粕方法的研究[J]. 食品工业, 2016,37 (9): 163-168.
[25] 杨柳, 王磊,张一,等. 混菌固态发酵豆粕的工艺优化[J]. 饲料工业, 2016, 37(9):49-52.