粉丝是我国具有悠久历史的传统美食,深受各族人民的喜爱。传统的粉丝制作原料主要是绿豆淀粉,近年来由于绿豆价格上涨,以薯类淀粉为原料的粉丝市场占有量不断上升。传统的薯类淀粉粉丝生产工艺一般需要加入明矾,以提高粉丝的韧性。过量摄入明矾会损害人体健康[1],因此寻找合适的明矾替代物是一个关系我国人民群众健康的重要研究课题。近年来研究者尝试了黄原胶、魔芋胶、复合磷酸盐等多种明矾替代物[2-5],这在一定程度上解决了明矾的问题。本文作者在前期工作中通过用普鲁兰酶处理芡糊,建立了一种完全不使用明矾的薯类淀粉粉丝制作方法,所制作的粉丝质量与添加明矾的粉丝基本一致[6]。普鲁兰酶的处理可以提高芡糊中直链淀粉的含量,这可能是其提高粉丝质量的关键原因。有研究表明直链淀粉溶液在温度下降时发生不可逆凝胶化和结晶,形成淀粉的短期回生现象[7-8]。回生是粉丝制作中的重要环节,芡糊制作和后期粉丝成型晾干都涉及短期回生,这与淀粉凝胶形成和凝胶软硬度直接相关,进而影响粉丝的品质[9]。谭洪卓等[5]研究了不同添加剂对甘薯粉丝回生的影响,其中明矾对于甘薯淀粉糊的保持强度、最终黏度和回生值的影响最为明显,但其指标仍未超过绿豆淀粉。绿豆粉丝中含有35%以上的直链淀粉,使其凝胶强度大,粉丝韧性高,且回生产生的紧密结构也使绿豆淀粉不易糊汤,因此绿豆粉丝的质量普遍好过红薯粉丝和马铃薯粉丝[10-11]。可见,提高淀粉中直链淀粉含量是提高粉丝质量的有效手段。普鲁兰酶的作用只是增加淀粉中直链淀粉的含量,而酶只是一种蛋白质,加热变性后与普通的蛋白质并没有实质性的区别。直链淀粉和蛋白质都是薯类淀粉的正常成分,因此从食品安全的角度考虑,普鲁兰酶是一种理想的明矾替代物。本文作者前期建立的以普鲁兰酶替代明矾的粉丝制作方法存在缺陷是其普鲁兰酶的用量比较大,关键原因是目前市售普鲁兰酶都是针对淀粉制糖工艺开发的酸性普鲁兰酶,而粉丝的芡糊为中性,因此酶的活性难以充分发挥。来自嗜热脂肪土芽孢杆菌(Geobacillus stearothermophilus)的普鲁兰酶基因GsP的表达产物为一种I型中性普鲁兰酶[12],理论上更适合粉丝制作的工艺条件。枯草芽胞杆菌(Bacillus subtilis)是一种公认为食品安全(generally recogniczed as safe, GRAS)的微生物,以此为宿主生产的重组酶液更适合于粉丝制作,本文报道GsP基因在不同枯草芽孢杆菌宿主菌中的表达及其产物在粉丝制作中的应用情况。
1 材料与方法
1.1 菌株与质粒
大肠杆菌(Escherichia coli)JM/09/pLac03-GsP[12]、B. subtilis WB600、1A717,均由本实验室保藏;表达载体pUP43是一种大肠杆菌-芽孢杆菌穿梭载体,为无锡先秦生物科技有限公司产品,该质粒以P43启动子控制外源基因的表达,载体在芽孢杆菌中的复制原点及卡那霉素抗性均来源于芽孢杆菌载体pUB110。含有表达载体pUP43的大肠杆菌JM109/pUP43、本文构建的B.subtillis 1A717/pUP43-GsP和B.subtillis WB600/pUP43-GsP均已保藏在江南大学中国高校工业微生物资源数据平台,保藏编号分别为:CICIM B6941、B6924和B6925。
1.2 主要试剂
限制性内切酶Spe I、Sal I,赛默飞世尔科技有限公司;连接酶、蛋白分子质量标准,宝生物工程(大连)有限公司;质粒小量提取试剂盒,北京博大泰克生物技术有限公司产品;PCR产物纯化回收试剂盒、胶回收试剂盒,康宁生命科学(吴江)有限公司;普鲁兰糖,上海阿拉丁生化科技股份有限公司;TB培养基,北京吉美生物科技有限公司;马铃薯淀粉(生粉、食品级),宁夏固原成盛淀粉有限公司产品;食用盐,淮牌食用盐;其他试剂购自国药集团化学试剂有限公司。
1.3 普鲁兰酶表达载体的构建
根据GsP基因的序列,设计引物如下:

引物中带下划线部分为内切酶识别位点,双下划线部分为核糖体结合位点。
以插入了嗜热脂肪土芽孢杆菌普鲁兰酶基因GsP的重组质粒pLac03-GsP[12]为模板,以Pgsp1、Pgsp2为引物PCR扩增得到GsP基因片段。将扩增得到的GsP片段纯化后用Spe I和Sal I酶切,与经同样酶切的表达载体pUP43载体连接,连接产物转化大肠杆菌JM109感受态细胞,转化子提取质粒后酶切验证并测序。
1.4 表达普鲁兰酶重组菌株的构建
使用Spizizen法[13],将表达载体pUP43-GsP分别转化菌株B. subtillis 1A717和B. subtillis WB600,在含15 mg/L卡那霉素的LB平板上30 ℃培养检出转化子,转化子划线分离后提取质粒。由于芽孢杆菌中提取的质粒的酶切图谱不够清晰,将转化子中提取的质粒转化大肠杆菌,从大肠杆菌中再次提取质粒后酶切电泳验证。以同样的方法,将质粒pUP43分别转化菌株B. subtillis 1A717和B. subtillis WB600构建对照菌株。枯草芽孢杆菌中提取质粒的方法同文献[14]。
1.5 重组菌普鲁兰酶的表达与检测
取重组菌株B.subtillis 1A717/pUP43-GsP、B.subtillis WB600/pUP43-GsP及对照菌株单菌落接种于20 mL含有15 mg/L卡那霉素抗性的LB液体培养基中,37 ℃、200 r/min摇瓶培养12 h后,接种于50 mL 的TB培养基中37 ℃、200 r/min摇瓶发酵,接种量为2%。每隔8 h取一次样,检测OD600后离心取上清液检测酶活。所有试验均做5个平行样。SDS-PAGE凝胶电泳检测方法与普鲁兰酶酶活测定方法同文献[15]。
1.6 粉丝制作工艺
称取50 g马铃薯淀粉,加入50 mL、55 ℃的水将其制成悬液,再加入350 mL沸水制成芡糊。加入2 g食盐和450 g生马铃薯淀粉和面,成团后取出,裹上保鲜膜放置10 min,在粉丝机中压成丝。粉丝机压出的丝直接进入水已经沸腾的煮丝锅中煮丝约1 min后,捞出用冷水冷却,理丝晾干。其中明矾粉丝是在淀粉水悬液制成后加入相当于粉丝淀粉总质量0.1%的 明矾,待明矾充分溶解后进入后续步骤。添加普鲁兰酶的粉丝是在芡糊制成后在芡糊中加入一定量酶液,在50 ℃保温30 min。HN-2006粉丝机购自永康市博宁工贸有限公司。
1.7 断条率、膨润度和煮沸损失率计算方法
截取100 根长20 cm无损伤的成品粉丝,放在3 L去离子水中煮沸20 min。根据公式(1)计算粉丝断条率。
断条率![]()
(1)
式中:煮后粉丝条数是指煮后依然保持全长的粉丝的条数。
截取长度5 cm自然晾干的粉丝若干,在60 ℃烘箱中烘干至恒重,称取约5 g为初始质量m1(g)。将上述粉丝放入盛有200 mL沸腾去离子水的烧杯中,煮沸20 min,过程中不断加水保持水量不变。煮好后将烧杯在冰水中冷却,取出粉丝,用滤纸吸取表面水分,称取含水粉丝的质量m2(g),再将含水粉丝置于60 ℃烘箱中烘干至恒重m3(g),膨润度和蒸煮损失率如公式(2)、(3)。
膨润度![]()
(2)
蒸煮损失率![]()
(3)
上述试验均做2个平行样。
2 结果与分析
2.1 表达载体pUP43-GsP的构建
以含有GsP基因的重组质粒pLac03-GsP为模板,以Pgsp1、Pgsp2为引物PCR扩增获得2.2 kb的扩增产物,产物大小与GsP基因一致。扩增片段与表达载体pUP43连接获得重组质粒。由图1-a中泳道1可见,重组质粒用Spe I、Sal I酶切获得2.2 kb和6.7 kb 的2个片段,片段大小分别与GsP基因和载体pUP43一致,符合重组质粒pUP43-GsP应有特点(图1-b)。
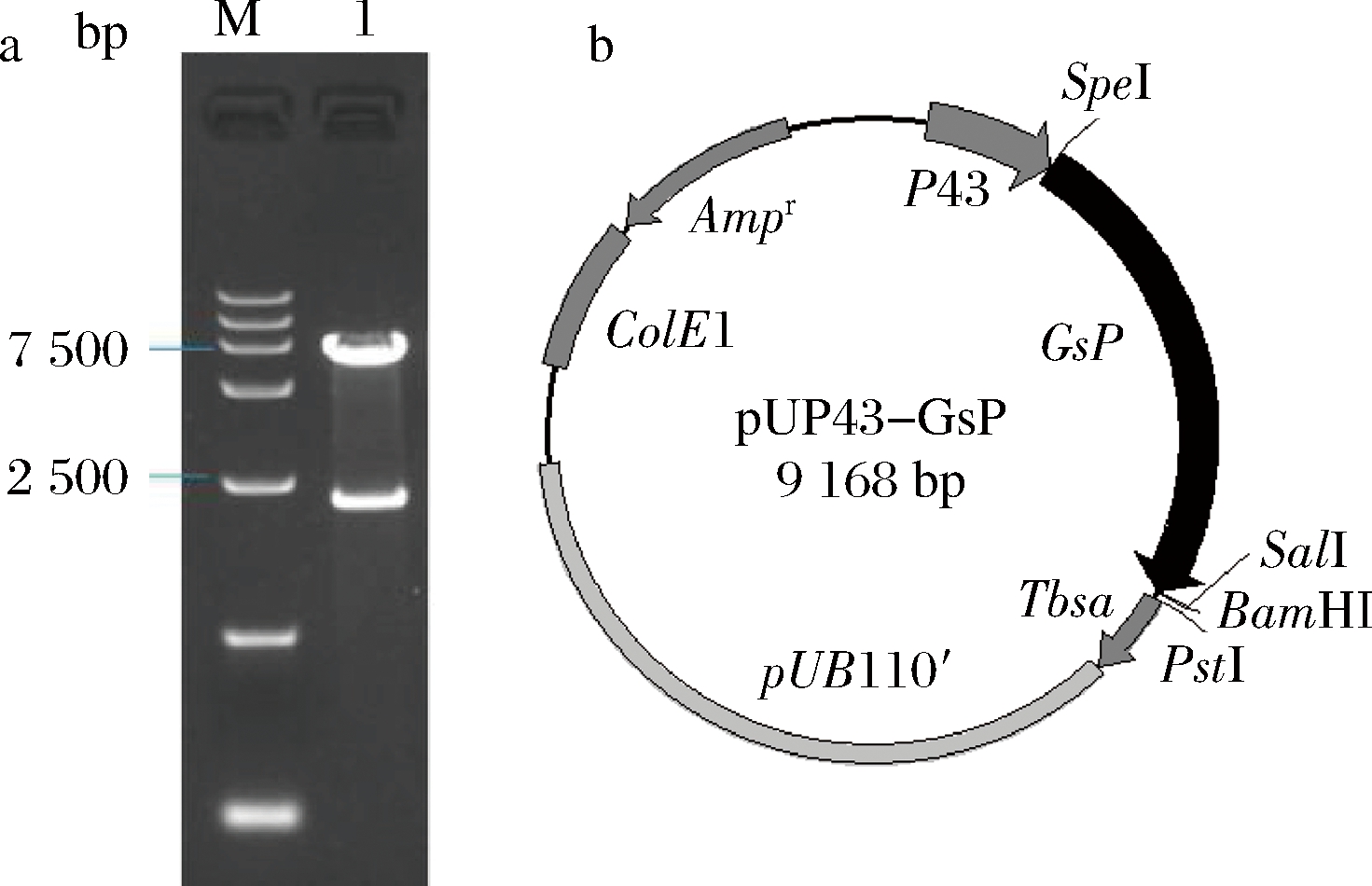
a-酶切验证电泳图谱;b-物理图谱M-marker; 1-pUP43-GsP/Spe I+Sal I
图1 质粒pUP43-GsP酶切验证电泳图谱和物理图谱
Fig.1 The restriction analysis of pUP43-GsP and map of the plasmid pUP43-GsP
2.2 GsP基因在枯草芽孢杆菌中的表达
将重组质粒pUP43-GsP和空质粒pUP43分别转化B. subtillis 1A717和B. subtillis WB600,在卡那霉素平板上检出转化子。4种转化子各取一个菌落划线分离后提取质粒,转化大肠杆菌后再进一步提取质粒验证,结果显示,从2种重组枯草芽孢杆菌中得到的质粒的酶切图谱与图1完全一致,测序结果也显示质粒中插入片段的序列与GsP完全一致。将上述重组质粒的转化子分别命名为B. subtillis 1A717/pUP43-GsP、B. subtillis WB600/pUP43-GsP,分别简称为1A717/pUP43-GsP和WB600/pUP43-GsP。空质粒的转化子命名为B. subtillis 1A717/pUP43、B. subtillis WB600/pUP43,分别简称为1A717/pUP43和WB600/pUP43。将此4株重组菌在TB培养基中摇瓶发酵,间隔12 h分别取发酵上清液和细胞破碎液检测酶活。结果显示,含重组质粒的重组菌1A717/pUP43-GsP和WB600/pUP43-GsP的发酵液有明显的普鲁兰酶酶活,发酵至36 h时酶活分别达到74和55 U/mL。含空质粒的2个重组菌上清液在标准条件下均未检测到酶活,但当检测温度下降至30 ℃时可以检测到微弱的酶活,这可能是枯草芽孢杆菌自身普鲁兰酶基因的表达产物。上述4株菌的细胞破碎液均未检测到普鲁兰酶酶活,可见GsP是一种胞外蛋白。发酵上清液的SDS-PAGE分析结果如图2。

M-marker; 1-1A717/pUP43-GsP发酵液上清; 2-WB600/pUP43-GsP发酵液上清; 3-1A717/pUP43发酵液上清; 4-WB600/pUP43发酵液上清
图2 重组菌胞外蛋白SDS-PAGE分析
Fig.2 SDS-PAGE analysis of extracellular protein of different recombinants
相比含空质粒的对照菌株,1A717/pUP43-GsP和WB600/pUP43-GsP发酵上清均含有一明显的差异表达条带,大小约为81 kDa,这一条带与GsP蛋白的理论分子质量一致,也与大肠杆菌JM109/pLac03-GsP表达的普鲁兰酶GsP一致[12],这进一步证明两株重组菌均成功表达了GsP蛋白。进一步将上述4株重组菌的细胞破碎液进行SDS-PAGE电泳,结果显示,含重组质粒的重组菌和含空质粒的对照菌的蛋白条带没有明显差异,这进一步证明在枯草芽孢杆菌中,GsP基因的表达产物可以全部分泌到细胞外。将1A717/pUP-GsP和WB600/pUP43-GsP的发酵上清液进行蛋白纯化。用纯酶进行酶学性质分析,结果显示,两种枯草芽孢杆菌表达的重组GsP的酶学性质与前文报道的大肠杆菌表达的GsP[12]完全一致,对此本文不再赘述。将纯酶送上海生工生物技术服务公司进行蛋白质N-端分析,结果显示,酶的N-端前6个氨基酸序列为Met-Leu-His-Ile-Ser-Arg,该序列与根据GsP基因序列推测的蛋白序列一致[12]。
2.3 GsP在两种枯草芽孢杆菌宿主中的表达
重组菌1A717/pUP43-GsP和WB600/pUP43-GsP在TB培养基中的生长及产酶情况如图3、图4所示。

图3 重组菌在TB培养基中的生长曲线
Fig.3 Cell growth curves of the recombinant strains in TB medium

图4 重组菌株发酵上清液酶活增长曲线
Fig.4 Extracellular enzyme activity growth curves of the recombinant strains
由图3可见,1A717/pUP43-GsP生长速度明显高于WB600/pUP43-GsP,最终达到的细胞密度也是前者大于后者,这可能与WB600蛋白酶基因缺失有关[16]。
由图4可见,1A717/pUP43-GsP前期产酶速度明显高于WB600/pUP43-GsP,这与前者细胞生长快是一致的。在48 h后,1A717/pUP43-GsP的酶活迅速下降,这可能源于枯草芽孢杆菌蛋白酶对外源蛋白的降解。WB600/pUP43-GsP的前期酶活增长较慢,但酶活增长一直持续到64 h,然后才开始缓慢下降。WB600/pUP43-GsP发酵酶活最高为126 U/mL,比1A717/pUP43-GsP的最高酶活(91 U/mL)高出38%,可见WB600更有利于GsP酶活的积累,这与前人的研究结果是一致的[17]。进一步将两种重组菌发酵获得的上清液4 ℃保存,检测2种酶液的保存稳定性。结果显示,1A717/pUP43-GsP上清液的酶活半衰期不到2 d,而WB600/pUP43-GsP上清液的酶活半衰期大约为36 d。WB600/pUP43-GsP发酵产生的酶液的保存稳定性显著高于1A717/pUP43-GsP的酶液,可见枯草芽孢杆菌胞外蛋白酶对GsP有很强的降解,缺失蛋白酶基因的WB600菌株是更适合用于GsP表达的宿主菌。
2.4 两种GsP对马铃薯粉丝质量的影响
将2种普鲁兰酶发酵液用超滤设备浓缩,其中1A717/pUP43-GsP发酵液最终酶活为1 121 U/mL,WB600/pUP43-GsP最终酶活为1 252 U/mL。上述两种普鲁兰酶分别简称为GsP1a和GsPwb,用于粉丝制作实验。
在传统粉丝的制作工艺基础上,在芡糊制作完成后,加入普鲁兰酶酶液在50 ℃水浴反应30 min,其他步骤不变。实验结果如表1、表2所示。
表1 GsP1a不同添加量对马铃薯粉丝质量的影响
Table1 Effects of GsP1a on the vermicelli quality of potato flour

酶用量/(U·g-1淀粉)煮丝情况断条率/%彭润度/%蒸煮损失率/%0严重并条无法检测无法检测无法检测0.5部分并条23±6735±317.6±1.21部分并条5±1777±238.2±0.61.5少量并条1±1794±219.1±0.63少量并条0.5±0.5763±99.6±0.86少量并条1±1757±179.2±0.5加明矾少量并条2.5±0.5614±77.9±0.8
注:煮丝情况是指粉丝制作过程中的煮丝阶段的情况,其中严重并条是指粉丝条在沸水中互相黏连并条,并条的粉丝在随后的理丝阶段无法手工分开,或分开后形成大量表面损伤,最终无法得到合格的粉丝;部分并条是指并条的粉丝在10%以内,并可以在理丝阶段手工分开;少量并条是指煮丝时并条粉丝一般在2%以内。
表2 GsPwb不同添加量对马铃薯粉丝质量的影响
Table 2 Effects of GsPwb on the vermicelli quality of potato flour

酶用量/(U·g-1淀粉)煮丝情况断条率/%彭润度/%蒸煮损失率/%0严重并条无法检测无法检测无法检测0.5部分并条21±3745±377.1±0.71部分并条5±2804±438.8±0.51.5少量并条5.5±1.5798±258.1±0.33部分并条11±2782±67.9±0.66严重并条无法检测无法检测无法检测加明矾少量并条2±2625±117.30
由表1、表2可知,在不添加明矾或其他添加剂的条件下,以土豆淀粉为原料按传统工艺制作粉丝时,在煮丝阶段,粉丝之间会发生严重的并条,无法获得合格的粉丝。适量添加普鲁兰酶处理芡糊后,煮丝阶段并条问题可以得到解决,但两种普鲁兰酶的作用效果有明显差异。按芡糊中1.5 U/g淀粉使用GsP1a使用普鲁兰酶后,并条问题基本消失,粉丝成品的断条率也接近于0,增加酶的用量虽然并不能进一步改进工艺和成品质量但也没有明显的负面影响。使用GsPwb的情况则不同,按1.5 U使用GsPwb后,并条问题基本消失,但成品粉丝仍有少量断条现象。继续增加GsPwb后,并条现象反而更严重而且成品断条率上升。本文使用的2种枯草芽孢杆菌宿主菌1A717和WB600的一个重要差异是前者的淀粉酶基因被敲除而后者淀粉酶基因正常,由此重组酶GsPwb酶液中很可能混有宿主菌WB600产生的α-淀粉酶。为了验证这一点,我们将10 g/L的可溶性淀粉分别与GsPwb和GsP1a反应,结果显示,前者在反应大约15 min后反应液与碘液的蓝色反应消失,而后者反应液与碘液混合后始终为深蓝色。从以上实验结果看,GsPwb中含有一定量的α-淀粉酶,这可能会导致芡糊中的淀粉链过度降解从而使芡糊的凝聚力下降,因此GsPwb在粉丝制作中的应用效果不如GsP1a。
3 讨论
本文用枯草芽孢杆菌为宿主菌实现了GsP的高效表达,对酶活和蛋白的检测结果均显示,重组蛋白全部分泌到细胞外。一个有趣的现象是本文使用的表达载体pUP43并没有信号肽编码区,用信号肽分析软件Signal对GsP氨基酸序列进行分析也未发现明显的Sec途径或Tat途径的信号肽。序列比对发现,GsP与枯草芽孢杆菌的普鲁兰酶[18](简称BsP)氨基酸序列有50%的同源性,很可能是同一类分子,而BsP的N端有两个相邻的精氨酸,为典型的Tat途径信号肽。因此,GsP很可能是通过Tat途径分泌到细胞外的。本文对2种宿主菌表达的重组GsP蛋白纯化后进行N端序列分析,结果显示,重组酶的N端是以起始翻译密码子编码的Met开始,并且包括其后共计6个氨基酸残基的序列与按照基因序列推测的蛋白序列完全一致。这说明GsP在芽孢杆菌中一定不是通过Sec途径分泌的,因为通过这一途径分泌的蛋白在分泌过程中其N端信号肽是被切除的[19],而通过Tat途径分泌的蛋白则一般不存在N端信号肽切除的现象[20]。
本文用2种宿主菌B. subtillis 1A717和B. subtillisWB600分别进行了GsP的表达,结果显示,两种宿主菌均能实现GsP的高效分泌表达,以WB600为宿主的表达水平高于1A717,前者表达的重组酶的稳定性也明显高于后者。从一般意义上讲,WB600是一种更适合于GsP表达的宿主菌,但应用实验却获得了完全相反的结果,粉丝制作过程中降低并条现象和降低粉丝成品断条率方面,1A717表达的重组酶GsP1a的表现均明显优于GsPwb。综合两种芽孢杆菌表达GsP的情况和酶的应用性进行分析不难看出,如果能够将B.subtillis WB600菌株的淀粉酶基因敲除则有可能获得一种既能实现GsP的高效分泌表达,重组酶酶液性能又能满足粉丝制作要求的重组菌。
重组酶GsP1a用于粉丝制作时,其最适用量大约为每克芡糊淀粉中加入1.5 U。芡糊淀粉大约占粉丝淀粉总质量的10%,即粉丝的每克总淀粉中使用的GsP只有0.15 U,按本文制备的GsP1a酶活1 121 U/mL计算,每克淀粉中酶液的用量为0.013%(质量分数),这个添加量远低于明矾或其他明矾替代物的添加量。如果进一步考虑酶液中大部分成分为水,那么实际干物质的添加量更小,因此从食品安全角度考虑,使用GsP1a处理芡糊是一种制作无明矾粉丝的理想方法。
[1] 杨正林, 傅四清. 面食及淀粉类食品中铝含量调查[J]. 中国食品卫生杂志, 2015, 27(A1): 37-39.
[2] 杨志华, 王德宝, 李美君,等. 焦磷酸钠无矾粉条的研制及品质特性分析[J]. 食品科技, 2015(4): 241-247.
[3] KAUR A, SHEVKANI K, SINGH N, et al. Effect of guar gum and xanthan gum on pasting and noodle-making properties of potato, corn and mung bean starches[J]. Journal of Food Science & Technology, 2015, 52(12): 8 113-8 121.
[4] LI X, XING Y, SUN Q, et al. Effect of food gums on properties of pea starch and vermicelli prepared from pea starch[J]. Starch - Stärke, 2015, 67(5-6): 399-406.
[5] 谭洪卓, 谭斌, 刘明,等. 甘薯粉丝生产中添加剂对甘薯淀粉回生的影响[J]. 食品科学,2008, 29(6): 133-138.
[6] 沈微, 肖亚朋, 王兵波,等. 一种以淀粉支链水解酶替代明矾的酶法粉丝制作方法:中国, 201510439893.4[P]. 2015-12-02.
[7] MILES M J, MORRIS V J, ORFORD P D, et al. The roles of amylose and amylopectin in the gelation and retrogradation of starch[J]. International Journal of Food Engineering, 1985, 135(2): 271-281.
[8] WANG S, LI C, COPELAND L, et al. Starch retrogradation: A comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(5): 568-585.
[9] 张垚. 明矾改善土豆粉品质的机理研究和无矾土豆粉的生产工艺优化[D]. 郑州:河南农业大学, 2017: 16-30.
[10] 陈洪兴, 顾正彪,洪雁. 粉丝的原料、生产工艺及发展趋势[J]. 食品工业科技, 2003, 24(7): 94-96.
[11] 黄倩, 高金梅,郭洪梅,等. 3种杂豆淀粉回生过程的理化特性研究[J]. 食品研究与开发, 2017, 38(10): 22-27.
[12] 肖亚朋, 沈微,李婷霖,等. 嗜热脂肪土芽孢杆菌普鲁兰酶基因的异源表达及重组酶性质[J]. 食品与发酵工业, 2017, 43(5): 30-36.
[13] ANAGNOSTOPOULOS C, SPIZIZEN J. Requirements for transformation in Bacillus subtils [J]. Journal of Bacteriology, 1961, 81(5): 741-746.
[14] 沈微, 俞玲,陈献忠,等. 麦芽糖α-淀粉酶基因在枯草芽孢杆菌中的分泌表达[J]. 食品与发酵工业, 2011, 37(6): 1-5.
[15] 王兵波, 沈微,钱灵紫,等. 一种密码子优化的酸性普鲁兰酶基因在巴斯德毕赤酵母中的高效表达[J]. 食品与发酵工业, 2016, 42(7): 9-15.
[16] WU X C, LEE W, TRAN L, et al. Engineering a Bacillus subtilis expression-secretion system with a strain deficient in six extracellular proteases[J]. Journal of Bacteriology, 1991, 173(16): 4 952-4 958.
[17] WONG S L, YE R, NATHOO S. Engineering and production of streptokinase in a Bacillus subtilis expression-secretion system[J]. Applied and Environmental Microbiology, 1994, 60(2): 517-523.
[18] MALLE D, ITOH T, HASHIMOTO W, et al. Overexpression, purification and preliminary X-ray of pullulanase from Bacillus subtilis strain 168[J]. Acta Crystallographica Secttion F: Structural Bioligy Communications, 2006, 62(4): 381-384.
[19] SIMOMEN M, PALVA I. Protein secretion in Bacillus species[J]. Microbiology Reviews, 1993, 57(1): 109-137.
[20] BERKS B C, SARGENT F, PALMER T. The tat protein export pathway[J]. Molecular Microbiology, 2000, 35(2): 260-274.