黑茶是一种独特的微生物发酵茶,其生产仅限于中国和日本[1-2]。黑茶包括普洱茶、茯砖茶、青砖茶和黑毛茶。黑茶质量和风味与参与茶叶发酵的微生物密切相关[3]。研究发现普洱茶在渥堆过程中有黑曲霉、青霉、根霉、灰绿曲霉、酵母等微生物存在,黑曲霉约占微生物总数的80%左右,普洱茶发酵渥堆过程中黑曲霉代谢产生的有机酸和酶对普洱茶品质的形成有着重要的作用[4-5]。目前,发酵型茶中活性物质关注较多的是生物碱类、多酚类、有机酸、黄酮类、醌类等[1],对阿魏酸(ferulic acid,FA)的研究还较少。FA是植物中普遍存在的一种酚酸。FA具有抗氧化活性、抗动脉粥样硬化、抗血栓、降低胆固醇和降血脂等许多生物功能[6]。阿魏酸酯酶(EC 3.1.1.73 feruloyl esterase,FAE),是羧酸酯水解酶的一个亚类,其主要生物功能是水解多糖与FA连接的酯键,释放FA[7-8]。刘闫等[9]报导了冠突散囊菌产FAE及其在黑毛茶可释放FA的实验结果,但是其FA含量极低。本课题组前期的研究及其他学者的报导都已证实FAE与木聚糖酶协同降解植物细胞壁时,植物细胞壁中释放的FA是仅木聚糖酶或FAE单独作用的多倍,且能同时释放FA和具有生物活性的低聚木糖(xylooligosaceharides,XOS)[10-13]。将这一思想应用于茶叶发酵的研究,本文报道了在晒青毛茶中添加FAE及木聚糖酶,发酵毛茶制备富含FA和XOS的黑茶实验结果。
1 材料与方法
1.1 材料与试剂
晒青毛茶,云南普洱宁普景迈茶厂;黑曲霉,实验室保藏菌种;麦麸、次粉,厦门海嘉面粉有限公司;木聚糖酶、茶氨酸标准品(纯度≥98%),大连美仑生物技术公司;甲醇(色谱纯),美国Sigma-Aldrich公司;阿魏酸乙酯标准品(纯度≥97%)、木糖(纯度≥98%)、FA标准品(纯度99%),美国Macklin公司;木聚糖标准品,爱尔兰Megazyme公司;琼脂,安徽Biosharp公司;(NH4)2SO4(分析纯),英国Oxoid公司;MgSO4(分析纯),上海国药集团;其他材料均为市售。
1.2 仪器与设备
DELTA pH计,上海Mettler Toledo公司;4K15高速冷冻离心机,美国Sigama公司;SB-3200DT超声仪,宁波新芝生物科技公司;LC-2010高效液相色谱仪,日本Shimadzu公司;C18色谱柱(5 μm,4.6 mm×250 mm),美国Thermo Electron公司;UV-6100紫外分光光度计,上海美谱达公司。
1.3 实验方法
1.3.1 FAE粗酶液的制备
按课题组已建立的方法制备FAE粗酶液[14]。菌种为实验室自行筛选的黑曲霉。
1.3.2 木聚糖酶粗酶液的制备
按课题组已建立的方法制备[13]。
1.3.3 发酵黑茶的制备
取500 mL三角瓶,121 ℃灭菌15 min,每组3个平行实验,按表1加入各材料,对照组为6 mL的无菌水,28 ℃培养8 d。每天定时从锥形瓶中取样,40 ℃恒温干燥后测定酶化发酵茶叶中活性物质的变化。
表1 晒青毛茶的酶化发酵制备黑茶实验
Table 1 Preparation of black tea by enzymatic fermentation of sun-dried tea
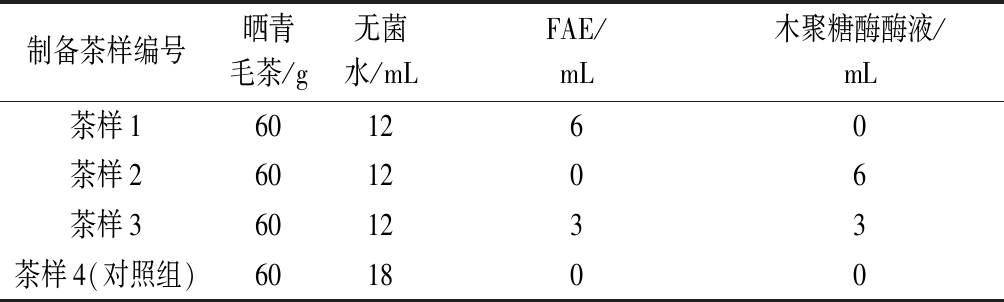
制备茶样编号晒青毛茶/g无菌水/mLFAE/mL木聚糖酶酶液/mL茶样1601260茶样2601206茶样3601233茶样4(对照组)601800
注:FAE、木聚糖酶酶活均为75 U/mL。
1.3.4 检测方法
(1)茶汤的pH值测定
取发酵的茶样1 g,按质量加入50倍煮沸的去离子水,浸泡5 min,过滤,取茶汤,冷却至25 ℃,测pH值[15]。
(2)茶叶水浸出物含量的测定
按《GB/T 8305—2013茶水浸出物的测定》[16]分析。
(3)还原糖含量的测定
称取1 g固体茶叶粉末,按质量加入8倍水,50 ℃ 浸提1 h,用8层纱布过滤,将滤液在4 ℃、10 000 r/min 下离心10 min,取上清液,用DNS法测还原糖含量[17]。
(4)游离氨基酸含量的测定
按《GB/T 8314—2013茶游离氨基酸总量的测定》[18]分析。
(5)FAE酶活力的测定
按课题组已建立的方法测定[13]。酶活定义:在50 ℃、pH 6.0条件下,每分钟酯解阿魏酸甲酯,生成1 μmol阿魏酸所需酶量定义为1个酶活力单位(U)。
(6)FA含量的测定
称重1 g茶叶,加入甲醇10 mL,超声处理30 min,4 ℃下10 000 r/min离心15 min,取上清液,经0.22 μm膜过滤3次后,HPLC法测定FA含量[19]。
(7)茶叶感官评审
按《GB/T 23776—2018 茶叶感官审评方法》[20],请职业评茶员评定。
(8)XOS含量测定
采用HPLC法。色谱柱为AminexHPX-42A柱,柱温85 ℃,示差折光检测器,流动相为超纯水,流速0.6 mL/min[13]。
2 结果与分析
2.1 发酵后晒青毛茶功效成分的变化
2.1.1 茶叶活性物质含量变化分析
发酵8 d后,测定了茶样的水浸出物质量分数、游离氨基酸质量分数及茶汤pH值,结果如表2所示。
表2 发酵后茶叶的活性物质含量
Table 2 Active substance content of fermentation tea
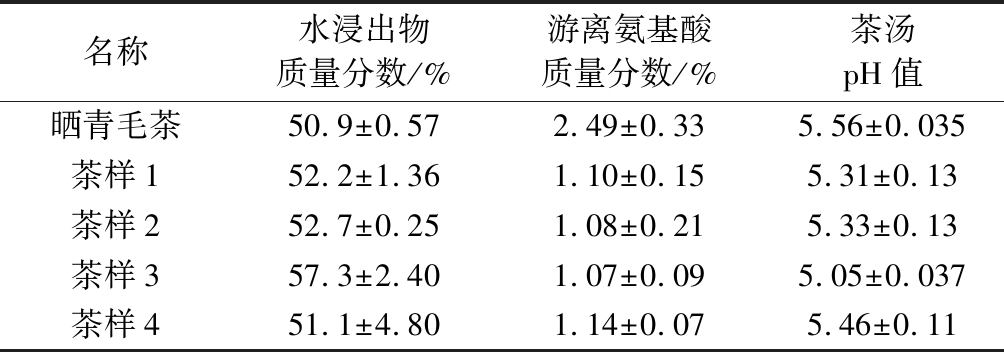
名称水浸出物质量分数/%游离氨基酸质量分数/%茶汤pH值晒青毛茶50.9±0.572.49±0.335.56±0.035茶样152.2±1.361.10±0.155.31±0.13茶样252.7±0.251.08±0.215.33±0.13茶样357.3±2.401.07±0.095.05±0.037茶样451.1±4.801.14±0.075.46±0.11
如表2所示,发酵8 d后,添加FAE和木聚糖酶的茶样3其含水浸出物质量分数最高,为57.3%,高于晒青毛茶(50.9%)及其他茶样的水浸出物含量。茶样1、茶样2及茶样4水浸出物含量接近,说明单独添加FAE或木聚糖酶对茶样的水浸出物影响不大,而添加FAE和木聚糖酶的茶样3比空白茶样4高6.2%,说明在FAE和木聚糖酶的协同作用下,茶叶可释放出更多的水溶性物质。茶叶的品质由茶叶水浸出物含量决定,水浸出物中的生化成分、种类以及比例越高,则茶叶品质越高[21]。实验表明,在茶叶中添加FAE以及木聚糖酶有助于提高水浸出物含量,从而提高茶叶的品质。
酶化发酵后4个茶样的游离氨基酸远低于晒青毛茶(2.49%),均下降了50%以上。这是因为氨基酸在茶叶发酵的过程中与儿茶素和糖类相互作用,发生了一系列的氧化、降解等转化反应,且氨基酸作为氮源物质被微生物利用,故晒青毛茶在发酵过程中氨基酸呈下降趋势[22]。其中同时添加了FAE和木聚糖酶的茶样3含游离氨基酸质量分数最低,为1.07%,这是因为在FAE和木聚糖酶的协同作用下,植物中的木质纤维降解较为彻底,茶叶中有更多的糖类和酚酸被释放出来,且互相反应,造成了发酵过程中茶样3中的氨基酸下降较其他两个茶样更多。吕海鹏等[23]报导氨基酸在发酵结束后除了蛋氨酸和脯氨酸有提高以外,其余的氨基酸都大幅度降低,降幅达到80%以上,总氨基酸较原料减少50%左右,这与本研究结果相同。
发酵后茶样的pH值在5.05~5.46,低于晒青毛茶的pH值5.56,说明发酵后茶汤中的H+增多,使原本呈弱碱性的去离子水在浸泡茶叶之后呈酸性,与郭桂义等[24]的研究一致。研究表明,有机酸是糖类分解代谢的中间产物,在茶叶冲泡过程中大多数可被浸出到茶汤中,成为影响茶汤香气和滋味品质的主要成分之一[25]。茶样3的pH值最低,可能是茶样3 FA释放量最高导致。
2.1.2 还原糖含量变化分析
经测定晒青毛茶的还原糖质量分数为2.97%。如图1所示,随着发酵时间的变化,4个茶样还原糖的含量先升高后降低,发酵第6天时还原糖含量皆最高。这是因为实验时尽管没有另外添加发酵菌种,但晒青毛茶及空气中的微生物在茶叶发酵过程中生长代谢,将茶叶中的大分子碳水化合物分解成小分子的可溶性糖类物质[26]。在第6天时还原糖又缓慢下降,这是因为到发酵后期茶叶中的可溶性糖与氨基酸发生了美拉德反应,使还原糖含量下降[27]。图1也显示,在4个茶样中添加FAE和木聚糖酶的茶样3含还原糖质量分数最高,为4.97%,8 d后还保持在3.77%左右。这可能是由于在FAE和木聚糖酶的协同作用下,茶叶中木质纤维降解相对于单独添加FAE或木聚糖酶的茶样1和茶样2更易降解,从而释放更多的可溶性糖类[7]。
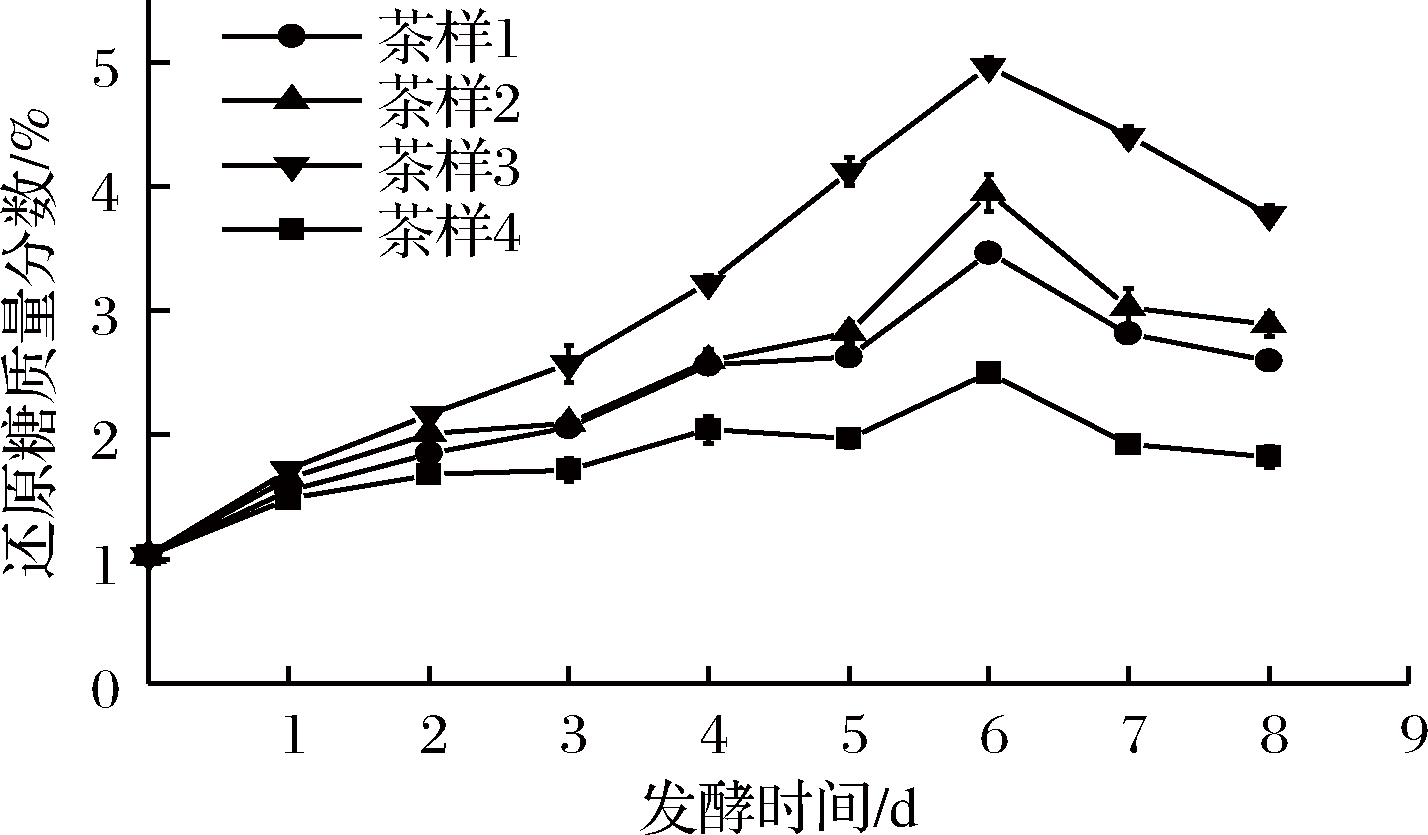
图1 发酵后茶叶还原糖含量随时间的变化
Fig.1 Changes of reducing sugar content in tea leaves with different times of fermentation
2.1.3 FA含量变化分析
晒青毛茶的FA含量为487.3 μg/g。如图2所示,4个茶样的FA的含量都高于晒青毛茶,且随着发酵时间的延长FA含量增大,在第5天FA含量最高,随后呈下降趋势,茶样1的FA含量比茶样2和茶样4高,添加了FAE和木聚糖酶的茶样3的FA含量最高,为1 120 μg/g, 较空白对照茶样4高出180.29 μg/g,比晒青毛茶高出632.7 μg/g。课题组前期将FAE应用于麦糟及纤维饲料的降解,结果表明单独添加FAE及木聚糖酶都可释放FA,且在FAE和木聚糖酶的协同作用下可明显提高了FA的释放率,但随着时间的延长,由于FA易分解、易氧化的特性,FA释放量随后下降[28]。本实验结果与课题组前期的研究结果一致。
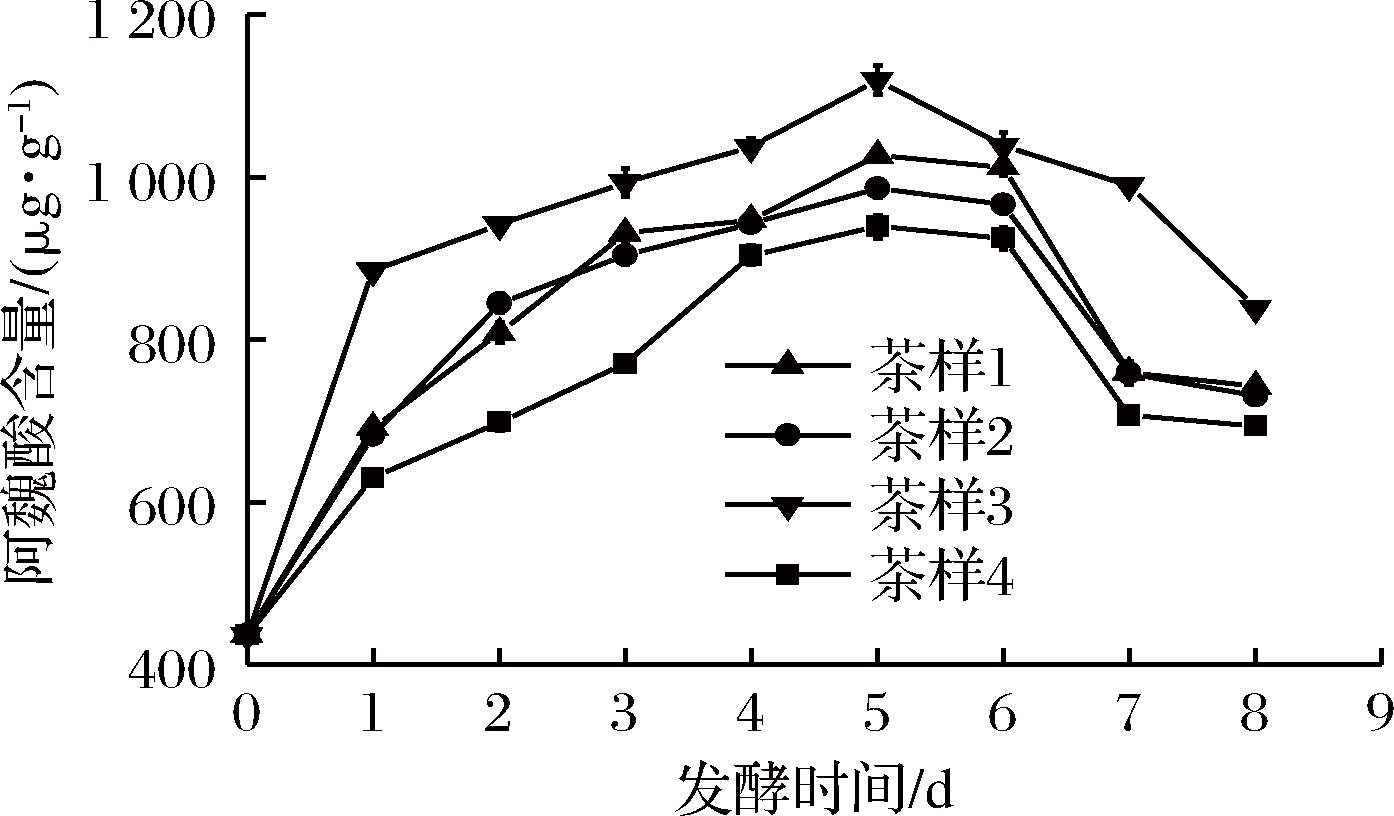
图2 发酵时间对茶叶的FA含量的影响
Fig.2 Effect of fermentation time on FA content in tea
2.1.4 XOS含量变化分析
经测定晒青毛茶的低聚木糖含量为1.82 μg/g。如图3所示,4个茶样的XOS的含量都高于晒青毛茶,且随着发酵时间的延长,XOS含量增大,在第6天XOS含量最高,随后呈下降趋势,且同时添加了FAE和木聚糖酶的茶样3的XOS含量最高,为4.05 μg/g,较空白对照茶样4高出1.02 μg/g,比晒青毛茶高出2.23 μg/g。说明单独加入FAE或木聚糖酶与空白对照茶样4相比,可少量释放XOS,且FAE与木聚糖酶有协同作用,有助于茶叶中的木质纤维降解,本实验室的前期研究也表明FAE有利于麦糟及纤维饲料中XOS的释放[28]。本实验结果与课题组前期的研究结果一致。
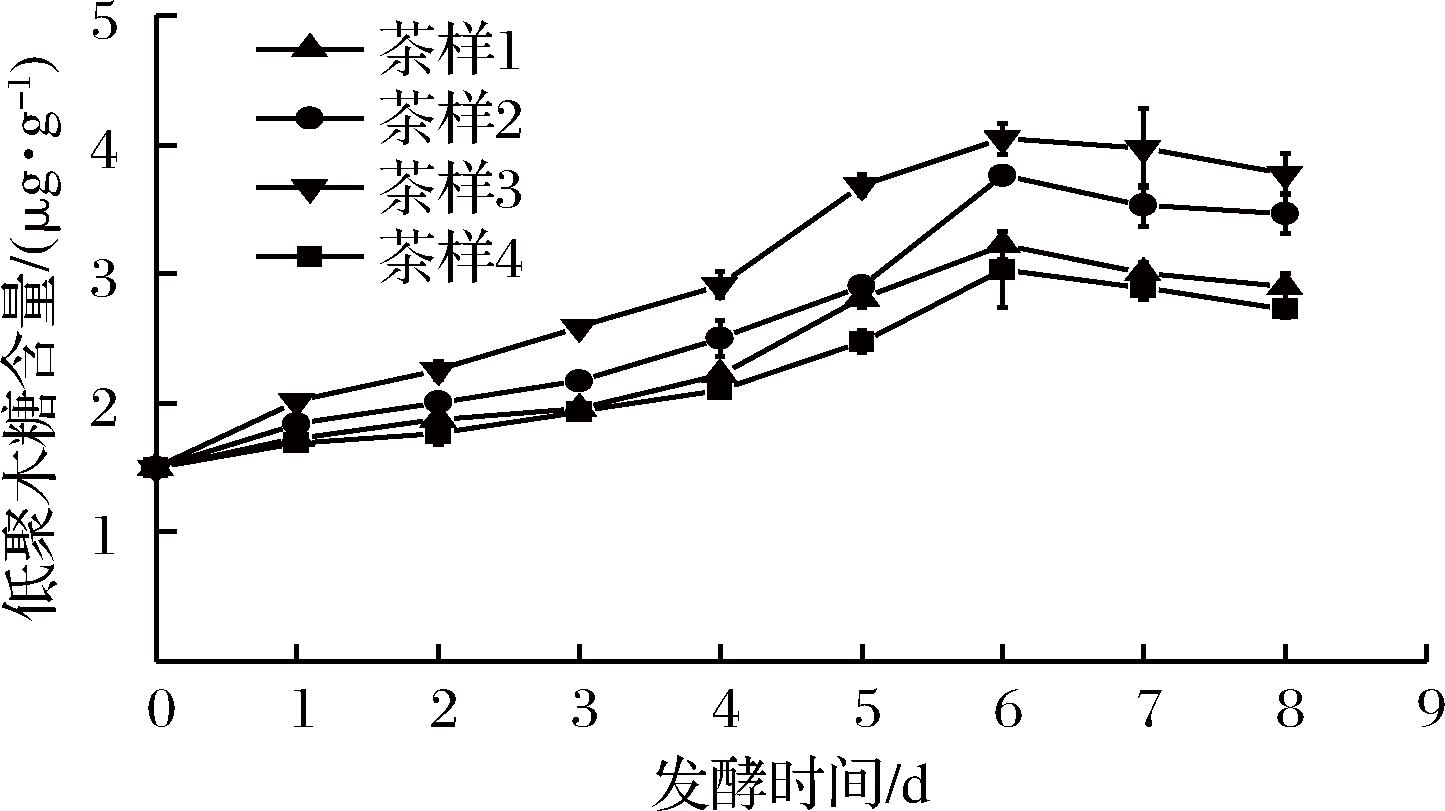
图3 发酵时间对茶叶XOS含量的影响
Fig.3 Effect of fermentation time on XOS content in tea
2.2 茶叶感官评审结果
评茶员从外形、香气、滋味、汤色、叶底5个方面对茶样进行感官评审比较,结果见表3。
经过发酵后的4个茶样,与晒青毛茶相比,其皆颜色较深,香气更浓郁,苦涩减弱,汤色由黄绿变为褐红。其中茶样3的茶汤香气更为丰富和醇厚,评分最高。
表3 不同条件发酵茶叶的感官评审
Table 3 Sensory evaluation of fermented tea under different conditions

茶类外形(20分)内质(80分)形状(5分)整碎(5分)净度(5分)色泽(5分)香气(25分)滋味(30分)汤色(15分)叶底(10分)总分/分茶样1紧结匀整匀净红褐、润、较显毫陈香浓纯醇厚回甘红浓、尚明亮红褐尚嫩85茶样2紧结匀整匀净褐、润、较显毫陈香尚纯浓厚回甘橙黄明亮红褐尚嫩84茶样3紧结匀整匀净红褐、润、较显毫陈香浓厚浓醇回甘褐红、尚明亮红褐尚嫩89茶样4紧结匀整匀净褐、润、较显毫陈香尚纯醇和回甘黄浓明亮红褐欠嫩81
3 结论
本实验表明发酵后茶汤的pH值及游离氨基酸含量都呈下降的趋势,游离氨基酸含量下降了50%左右。发酵8 d后茶叶的水浸出物、还原糖、FA及XOS均比晒青毛茶高。发酵后4个茶样的FA及XOS含量皆随着时间的增加先升高后下降,且同时添加了FAE和木聚糖酶的茶样3在第5天FA最高达到1.12 mg/g,在第6天XOS最高可达4.05 μg/g。发酵结束的第8天FA和XOS分别可达838.9 μg/g及3.78 μg/g,比不添加任何酶的茶样分别高20.9%及38.6%。从茶样感官评分 来看,同时添加了FAE和木聚糖酶的茶样3感官评分也最高。因此,在晒青毛茶发酵过程中,同时添加FAE和木聚糖酶,尽管对茶叶的pH值、还原糖、水浸出物、游离氨基酸、FA、XOS等有着不同程度的影响,但可明显提高茶叶中的具有生物活性物质的FA和XOS含量,有利于提高茶叶的品质和附加值。
[1] ZHENG W J, WAN X C, BAO G H. Brick dark tea: A review of the manufacture,chemical constituents and bioconversion of the major chemical components during fermentation[J].Phytochemistry Reviews,2015, 14(3):499-523.
[2] ZHU Y F, CHEN J J, JI X M, et al.Changes of major tea polyphenols and production of four new B-ring fission metabolites of catechins from post-fermented Jing-Wei Fu brick tea[J]. Food Chemistry, 2015, 170: 110-117.
[3] ABE M,TAKAOKA N,IDEMOTO Y, et al.Characteristic fungi observed in the fermentation process for Puer tea[J]. International Journal of Food Microbiology, 2008,124(2):199-203.
[4] LI Q, CAI S, LI Y, et al. Biochemical components associated with microbial community shift during the pile-fermentation of primary dark tea [J].Frontiers in Microbiology,2018, 9(1 509):1-13.
[5] ZHANG W,YANG R,FANG W,et al.Characterization of thermophilic fungal community associated with pile fermentation of Pu-erh tea[J]. International journal of food microbiology, 2016, 227:29-33.
[6] DAM SIO A R L,BRAGA C M P. Biomass-to-bio-products application of feruloyl esterase from Aspergillus clavatus[J].Appl Microbiol Biotechnol,2013, 97(15):6 759-6 767.
SIO A R L,BRAGA C M P. Biomass-to-bio-products application of feruloyl esterase from Aspergillus clavatus[J].Appl Microbiol Biotechnol,2013, 97(15):6 759-6 767.
[7] BRAGA C M P, DA-SILVA D P, DA-SILVA L D J, et al.Addition of feruloyl esterase and xylanase produced on-site improves sugarcane bagasse hydrolysis[J]. Bioresource Technology,2014,170(5):316-324.
[8] OLIVEIRA D M, MOTA T R, OLIVA B.et al. Feruloyl esterases:Biocatalysts to overcome biomass recalcitrance and for the production of bioactive compounds[J].Bioresource Technology,2019,278:408-423.
[9] 刘闫,胡茂丰,刘素纯.冠突散囊菌产阿魏酸酯酶及其发酵麸皮和黑毛茶形成阿魏酸的研究[J].农产品加工,2015,4(8):1-3;6.
[10] BEGO A B, G
A B, G MEZ-CORDOVÉS C,SANCHO A I,et al.Growth and release of hydroxycinnamic acids from Brewer’s spent grain by Streptomyces avermitilis CECT 3339[J].Enzyme and Microbial Technology, 2003, 32(1):140-144.
MEZ-CORDOVÉS C,SANCHO A I,et al.Growth and release of hydroxycinnamic acids from Brewer’s spent grain by Streptomyces avermitilis CECT 3339[J].Enzyme and Microbial Technology, 2003, 32(1):140-144.
[11] DE-OLIVEIRA D M,SALVADOR V H, MOTA T R,et al.Feruloyl esterase from Aspergillus clavatus improves xylan hydrolysis of sugarcane bagasse[J].AIMS Bioengineering, 2017,4 (1): 1-11.
[12] YU P, MCKINNON J J, CHRISTENSEN D A. Improving the nutritional value of oat hulls for ruminant animals with pretreatment of a multienzyme cocktail: In vitro studies[J].Journal of Animal Science 2005, 5 (83):1 133-1 141.
[13] 李夏兰,程珊影,杨道秀,等.阿魏酸酯酶和木聚糖酶协同降解麦糟[J].化工进展,2012, 31(5):1 096-1 102;1 108.
[14] 罗云,王镇发,梅胜,等.阿魏酸酯酶酶化发酵饲料饲喂三元猪的影响[J].食品与生物技术学报, 2018,37(5):527-534.
[15] 郭桂义,葛国平.不同茶类茶汤pH值的研究[J].食品科技,2012,37(5):74-76.
[16] 中华人民共和国国家质量监督检验检疫总局. GB/T 8305—2013,茶水浸出物测定[S].北京:中国标准出版社,2013.
[17] 李环,陆佳平,王登进.DNS法测定山楂片中还原糖含量的研究[J].食品工业科技,2013,34(18):75-77.
[18] 中华人民共和国国家质量监督检验检疫总局.GB/T 8314—2013,茶水浸出物测定[S].北京:中国标准出版社,2013.
[19] 李夏兰,范韵敏,方柏山.来自桔青霉的阿魏酸酯酶的分离纯化、理化性质[J].微生物学报,2010,50(8):1 058-1 064.
[20] 中华人民共和国国家质量监督检验检疫总局.GB/T 23776—2018,茶水浸出物测定[S].北京:中国标准出版社,2018.
[21] 白玉艳,赵艳,王白娟.云南勐库大叶种普洱茶水浸出物含量的研究[J].食品工业,2013(6):14-16.
[22] 张秀秀.外源氨基酸和糖对普洱茶品质的影响[D]. 广州:华南理工大学,2012.
[23] 吕海鹏,谷记平,林智,等.普洱茶的化学成分及生物活性研究进展[J].茶叶科学,2007,27(1):8-18.
[24] 郭桂义,邵静娜,王在群,等.信阳毛尖茶汤pH值的初步研究[J].食品科技,2011,36(3):92-94.
[25] 刘盼盼,钟小玉,许勇泉,等.茶叶中有机酸及其浸出特性研究[J].茶叶科学,2013,33(5):405-410.
[26] ZHANG L,ZHANG Z Z,ZHOU Y B,et al.Chinese dark teas: Postfermentation, chemistry and biological activities[J]. Food Research International,2013, 53(2):600-607.
[27] 冯超浩,刘通讯.不同潮水量条件下普洱茶渥堆过程化学成分的变化[J].食品科学,2013,34(7):135-139.
[28] YU P, MAENZ D D, MCKINNON J J, et al. Release of ferulic acid from oat hulls by Aspergillus ferulic acid esterase and Trichoderma xylanase[J].Journal of Agricultural & Food Chemistry,2002, 50(6):1 625-1 630.