罗非鱼是世界上第二大养殖鱼类[1],深受我国消费者的青睐。但是其强烈的鱼腥气味,限制了高品质罗非鱼鱼肉制品的发展。
鱼肉中腥味物质主要来自于环境污染、脂质氧化、生理作用或微生物作用[2]。新鲜鱼肉中的腥味物质主要来自于对环境中的相关化合物的富集作用;鱼肉在贮藏过程中会发生一系列生化反应产生低阈值挥发性化合物,这些气味化合物混合一体,相互影响,从而产生不愉快的腥味。环境污染及生化反应使得鱼肉产生腥味是不可避免的,通过特定方式进行气味掩盖或抑制腥味产生是解决鱼腥味问题的关键。
大蒜在食品调味中被广泛应用。相较于大蒜乙醇提取物[3]、大蒜油[4]、萝卜和姜水提取物[5],大蒜水提取物含有较稳定和较高浓度的水溶性有机硫化物,具有更高的抗氧化活性。同时,化学表征大蒜中的硫化物具有抗菌作用[6]。除此之外,大蒜的中的皂苷、酚类物质、凝集素(糖蛋白)能增强其抗氧化和抗菌作用[7]。
目前,国内外集中研究调味食材对新鲜鱼肉的去腥效果上,而很少研究其对贮藏鱼肉的影响。本文研究了大蒜水提取物对新鲜罗非鱼和贮藏的罗非鱼肉的感官、微生物、脂质氧化的影响,并对挥发性物质进行了研究。旨在探究大蒜对罗非鱼肉腥味具有掩盖作用的同时,是否还具备抑制贮藏鱼肉腥味产生的作用,以期为大蒜水提物作为贮藏鱼肉的脱腥剂提供数据支持和理论依据。
1 材料与方法
1.1 材料与试剂
新鲜罗非鱼,体重约0.9~1.1 kg,购自广州市华润万家超市;蒜(产于山东),购自广州市华润万家超市。
1.2 仪器与设备
DZ500/2D真空包装机,温州新泰包装机械厂;明鉴SPX型智能生化培养箱,宁波江南仪器厂;LDZX-75KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;超净工作台,苏州净化设备有限公司;QP2010 plus气质(GC-MS)联用仪,日本岛津公司;固相微萃取装置(DVB-CAR-PDMS 65 μm),美国Supelco公司。
1.3 方法
1.3.1 大蒜提取液的制备
参考文献[8],适当修改。将生蒜清洗沥干,精确称取100 g生蒜与100 mL无菌水水混合均浆,用无菌水定容至1 L,浸渍30 min,在40 ℃,200 W,40 kHz条件下超声30 min,用纱布抽真空过滤,制备成质量浓度为10 g/L的大蒜提取液原液。按比例稀释制备质量浓度为8、6、4 g/L的大蒜水提取液。
1.3.2 样品预处理
将罗非鱼击晕、宰杀、去皮,切成重约20 g鱼片(20 cm×30 cm×1 cm),分别用质量浓度为0、4、6、8、10 g/L的大蒜提取液,比重(1∶3,g∶g) 浸泡鱼片25 min,取出沥干,进行真空包装。样品分成两部分:(1)用于新鲜鱼肉的指标测定;(2)作为于4 ℃条件下冷藏5 d的指标测定。
1.3.3 指标测定
1.3.3.1 硫代巴比妥酸值测定
参考BUEGE等[9]及YARNPAKDEE等[10]测定硫代巴比妥酸值,略作修改。将5 g鱼肉样品与25 mL含有0.375 g/L硫代巴比妥酸,15 g/L三氯乙酸和0.25 mol/L HCl溶液一起均质,振荡30 min,沸水浴10 min, 室温下以3 600 r/min离心20 min。在532 nm 处测量上清液的吸光度。使用浓度范围为0至6 mg/L的1,1,3,3-四甲氧基丙烷制备标准曲线。TBARS由标准曲线方程y=0.415 8x-0.008 1(R2=0.999 7)计算,结果以丙二醛(malondialdehyde,MDA) mg/kg表示。
1.3.3.2 菌落总数的测定
参照GB 4789.2—2016《食品微生物学检验菌落总数测定》。在蒜汁处理液及培养基中均未检出微生物。
1.3.3.3 感官评价
样品均分开放入蒸煮袋中蒸熟,以腥味为主要指标。分值范围(0~9),9代表品质最佳。评价人员共10名,均经专业培训,评价过程独立完成。最终结果以分值扩大10倍处理。
1.3.4 HS-SPME分析[11]
用均质机将上诉样品绞碎,用分析天平准确称取4 g(精确到0.001 g)样品,置于20 mL含有8 mL的饱和食盐水的萃取瓶中,旋紧盖子,斡旋转子摇匀,于40 ℃平衡15 min,再插入DVB-CAR-PDMS固相微萃取纤维于40 ℃恒温水浴中萃取30 min,拔出立即插入GC进样口,以260 ℃解析2 min。在进样前,将纤维置于270 ℃进样口中,用氦气流调节1 H,以避免样品之间的残留问题。
1.3.5 GC-MS分析方法
GC条件:色谱柱为HP-5MS,30×0.25 mm;氦气流速:1.5 mL/min,不分流进样;进样口温度250 ℃;升温程序:35 ℃保持3 min,以3 ℃/min的速度升温至70 ℃,再以10 ℃/min升温至200 ℃,最后以20 ℃/min 速度升温至260 ℃,保持5 min。
MS条件:离子源:70 eV;离子温度230 ℃;接口温度250 ℃,质量采集范围30~400 amu。
1.3.6 关键腥味化合物的确定
相对气味活度值(ROAV)是根据气味活度值(OAV)计算而来,用于评估各组分对总体风味的贡献度,是确定关键风味化合物的主要方法。OAV定义为组分的浓度与其气味阈值之比。参考SONG等[12]文献,如式(1)所示。
(1)
式中:Crmax是组分的相对浓度,在该浓度下它对总体的风味的贡献最大。Tmax是相应的气味阈值,μg/kg。
1.3.7 数据分析
所得数据与MS谱库(NIST 14)及Wiley谱库进行检索比较,取相似度高于80%进行定性鉴定。利用面积归一法对各成分进行定量分析。SPSS 20.0统计分析软件进行方差分析,Duncan多重比较进行数据间的显著性差异分析,差异显著水平为0.05。Origin软件进行制图。
2 结果与分析
2.1 蒜汁处理对罗非鱼肉TBARS的影响
脂肪氧化是鱼肉产生腥味的主要原因之一[13]。丙二醛是鱼肉中的多不饱和脂肪酸氧化产生的代谢产物,是评估脂肪氧化程度的常用指标,也是评估鱼肉气味恶化的重要指标[14]。由图1可知,在新鲜罗非鱼中,处理组相较于未处理组,TBARS均无显著性差异。这可能是因为处理时间短,鱼肉中的酶(超氧化氢酶、过氧化氢酶和谷胱甘肽过氧化物酶等)及非酶物质(抗坏血酸、谷胱甘肽、α-生育酚、类胡萝卜素等)保护了脂质免受氧化损伤[15]。罗非鱼经冷藏处理后,TBARS随蒜汁浓度增加呈下降趋势;与对照组相比,大蒜提取液处理组的TBARS均显著下降(P<0.05)。鱼肉中丙二醛含量达到1 mgMDA/kg,就会出现令人难以接受的腥臭味[16]。罗非鱼是低脂鱼,在本研究中,所有的处理组丙二醛值均未达到这一极限值,新鲜鱼肉贮藏5 d后,其丙二醛含量为0.323 mg MDA/kg,尽管这一值低于1 mgMDA/kg,但鱼肉中已产生了明显的腥臭味。蒜汁处理组能够显著降低丙二醛含量,其腥臭味也变得越不明显,说明蒜汁可以抑制脂质氧化,从而抑制腥味的产生。水溶性的S-烷基半胱氨酸,硫代亚磺酸盐,阿霍烯,乙烯基二硫化物以及油溶性烯丙基硫化物是大蒜主要的生物活性物质[17],这些物质的硫非共价双键起主要的清除自由基(DPPH自由基和ABTS自由基)作用,从而实现其抗氧化活性[18]。BINTORO等[19]报道了蒜汁可以抑制冷藏牛肉的脂肪氧化,并减缓了TBARS的增加,这与本研究结果相似。
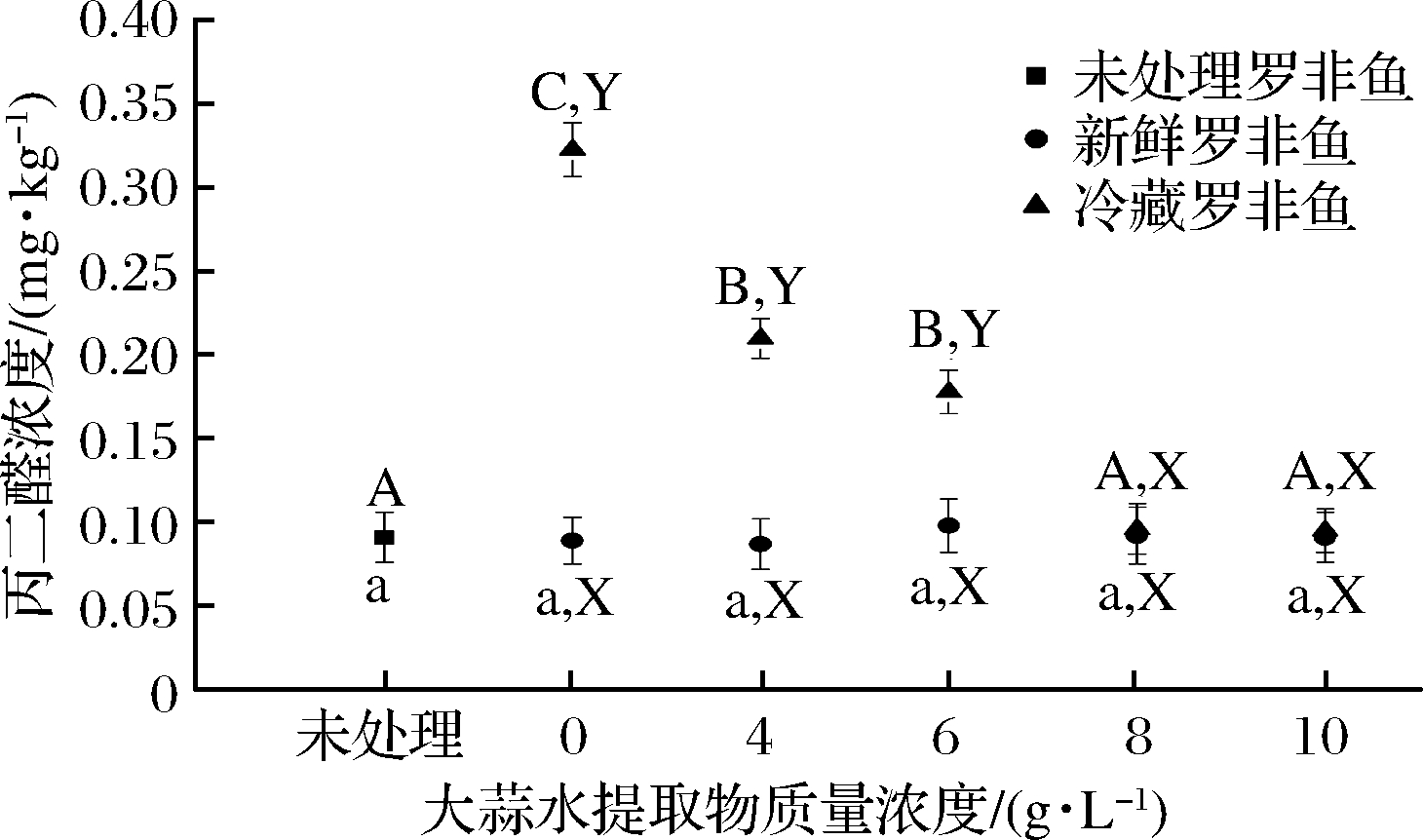
图1 大蒜水提取物质量浓度对罗非鱼肉丙二醛(MDA)含量的影响
Fig.1 Effect of concentration of aqueous extract of garlic on MDA content of tilapia fillets
注:不同的大写字母(A-D)表示不同质量浓度大蒜水提取处理的冷藏罗非鱼肉之间具有显著性差异(P<0.05);不同的小写字母(a-c)表示不同质量浓度大蒜水提取处理的新鲜罗非鱼肉之间具有显著性(P<0.05)差异;不同的大写字母(X,Y)表示新鲜罗非鱼肉与冷藏罗非鱼肉之间具有显著性(P<0.05)差异。下同。
2.2 蒜汁处理对罗非鱼菌落总数的影响
由图2可知,与未处理新鲜罗非鱼肉相比,在蒜汁浸泡完成后,菌落总数并无明显变化(P>0.05)。这可能有两点原因:(1)大蒜质量浓度过低,大蒜提取物超过一定的质量浓度才有强的杀菌效果[20];(2)大蒜处理时间过短,大蒜提取物的杀菌具有时间和质量浓度依赖性[21-22]。罗非鱼在冷藏处理后,相较于0 g/L组,4 g/L组的大蒜提取液处理组菌落总数无显著变化(P>0.05),而较高浓度(6~10 g/L)的大蒜提取液可以显著抑制微生物的生长(P<0.05)。在本研究中,在蒜汁质量浓度较低时,对微生物生长无明显抑制效果,可能有两点原因:(1)其质量浓度未达到最小抑菌质量浓度;(2)大蒜含有促生长因子,一定程度会促进微生物生长,HAYAT等[23]报道大蒜水提物中存在生长促进因子,可以促进番茄细胞的分裂繁殖,从而促进番茄生长。较低质量浓度蒜汁其营养成分也可被微生物所利用,因此作为营养物质的作用和杀菌作用具有拮抗效应,从而导致较差的抑菌效果。当大蒜提取液质量浓度增大时,表现出明显的抑菌效果,这可能是大蒜中的3-乙烯基-1,2-二硫杂环己-5-烯、3-乙烯基-1,2-二硫杂环己-4-烯可以改变细胞膜的通透性并破坏细胞后的结构完整性,使细胞内容物外溢,从而导致微生物死亡[24],同时,大蒜中的硫化物可通过与巯基酶相互作用,抑制乙酰辅酶A合成酶活性,诱导细胞氧化还原电位转移,通过氧化途径诱导细胞凋亡等途径达到抗菌的目的。当蒜汁质量浓度为6~10 g/L时,随着质量浓度的增加,其抑菌变化不明显,这与GOLDSTEIN等[25]报道较高质量浓度提取液时对抑制大肠杆菌生长不明显的结果一致。这可能是因为蒜的抑菌作用具有时间依赖性[26],即当质量浓度达到最小抑菌质量浓度,再增加剂量,抗菌作用不再增强。

图2 大蒜水提取物质量浓度对罗非鱼肉菌落总数的影响
Fig.2 Effect of concentration of aqueous extract of garlic on colony-forming units of tilapia fillets
2.3 感官评价
由图3可知,罗非鱼在经蒜汁处理后,与未处理罗非鱼相比,罗非鱼随着蒜汁的增加,6 g/L时达到最大值,随后逐渐减小,则质量浓度为6和8 g/L时,新鲜鱼肉和贮藏鱼肉的腥味可接受度较高,说明该浓度可以很好地掩盖罗非鱼腥味,使得罗非鱼肉风味较好。罗非鱼在经冷藏处理后,随着蒜汁质量浓度的增大,其感官评定的变化趋势与新鲜罗非鱼的变化趋势一致,但整体而言,感官评定显著低于新鲜罗非鱼(P<0.05), 这与贮藏过程中鱼肉会发生生化反应从而导致腥味增强的结论相一致。在冷藏罗非鱼肉中,感官评价呈现“倒V”趋势,与微生物变化呈“V型”及TBARS变化具有一定的一致性,说明蒜汁的掩盖作用及抑制脂质氧化、微生物生长作用,共同改善了罗非鱼肉的腥气味。
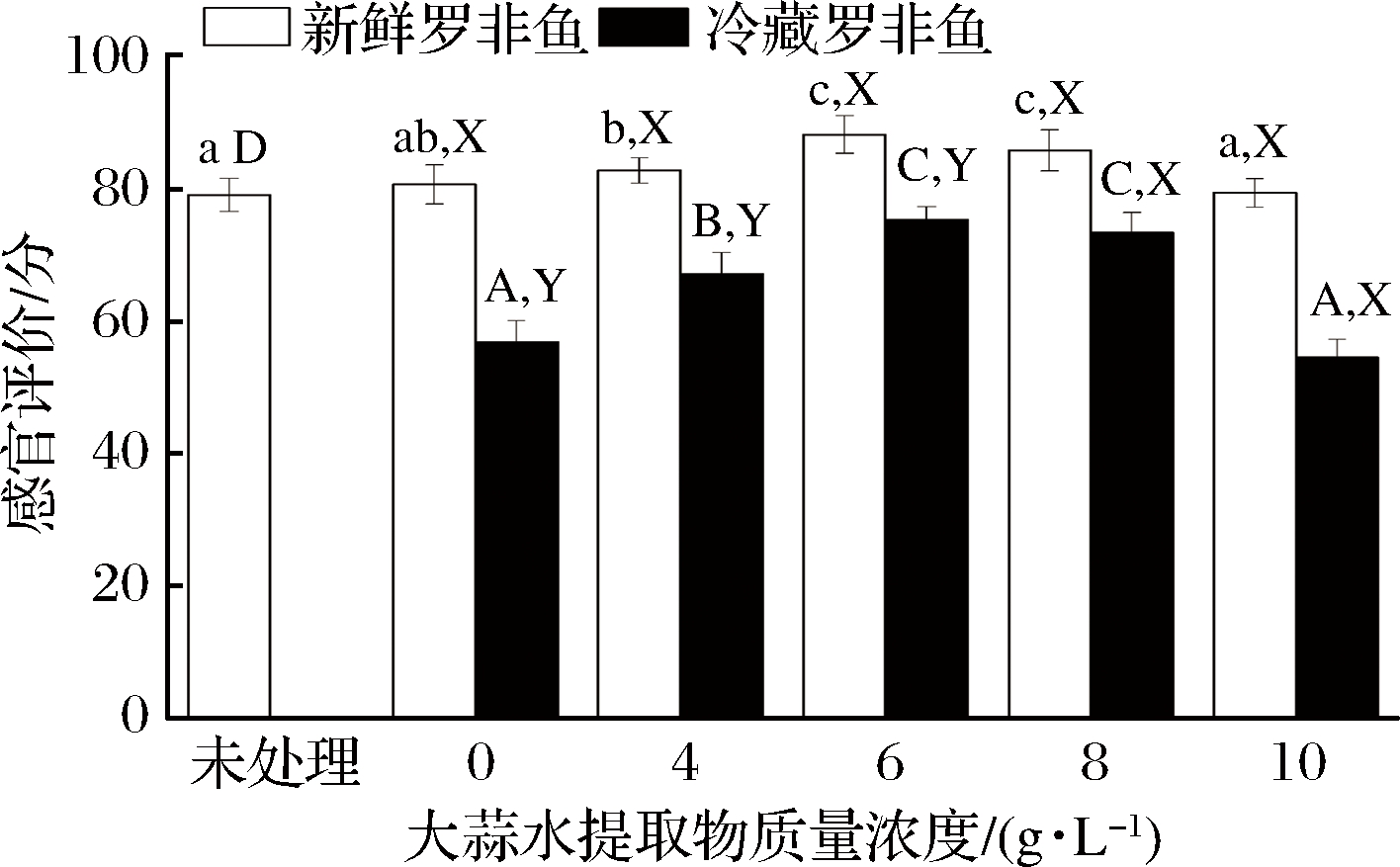
图3 大蒜水提取物质量浓度对罗非鱼肉感官评价的影响
Fig.3 Effect of concentration of aqueous extract of garlic on sensory evaluation of tilapia fillets
结合感官评价、TBARS值及菌落总数,筛选大蒜提取物质量浓度(6 g/L)为较好的处理组,进行下一步挥发性成分的分析。
2.4 大蒜提取液对罗非鱼片挥发性成分变化影响
2.4.1 罗非鱼肉脱腥前后及贮藏后挥发性物质的GC-MS分析
经GC-MS分析可知,大蒜对罗非鱼肉挥发性物质的色谱峰数量和峰面积有一定的影响,罗非鱼鱼片经过大蒜处理后色谱峰数量和峰面积增加,部分峰面积减少或消失。在蒜处理组中出现了新的特征峰,这些峰与蒜汁处理液组中的特征峰相似,这可能是由于大蒜的特征风味物质引起的,而峰的减少和消失可能是因为蒜汁对某些物质的脱除作用。罗非鱼经贮藏后,挥发性物质的色谱峰数量和面积均高于新鲜罗非鱼片,这可能是罗非鱼肉在冷藏过程中发生脂质氧化,生化反应及微生物作用,使得产生新的物质。
2.4.2 蒜处理罗非鱼肉主要挥发性物质的比较分析
2.4.2.1 醇类
醇类包括饱和醇和不饱和醇。其中不饱和醇的气味阈值低于饱和醇,因此其气味贡献度更大[12]。1-辛烯-3-醇是主要的不饱和醇之一,主要是EPA在1,5-脂氧合酶作用下氧化产生的,具有较低的气味阈值,对鱼肉腥味形成起重要的作用[27]。由表1可知,4组样品中共检测出4种醇类:正已醇、1-辛烯-3-醇、1-庚醇、1-辛醇,这些物质都是腥味物质。其中1-辛烯-3-醇的相对含量最高,并且在贮藏5 d后,该物质相对含量增加,这与前人结果一致[28]。蒜汁处理组,1-辛烯-3-醇相对含量呈下降趋势,对鱼肉风味的整体贡献度减少,说明蒜确实具有改善鱼肉气味的作用。相较于新鲜鱼肉,冷藏鱼肉醇类化合物减少,这与检测到的醛类种类增加相一致,这可能是醇类发生了氧化产生醛类。
2.4.2.2 醛类
如表1所示,所有样品中共检测到了19种醛,其中相对分子含量较小的醛类物质如己醛、庚醛、苯甲醛、辛醛、壬醛、反-2-辛烯醛等可能是由脂质氧化产生[29]。也有学者认为,己醛、庚醛、辛醛、壬醛和癸醛是由腐败菌的产生[30-31]。呈腥味的醛类主主要有己醛,庚醛,壬醛,庚醛,癸醛,反式-2-癸烯醛,(E,E)-2,4-癸二烯醛,(E,E)-2,4-壬二烯醛,反式-2-辛醛。其中己醛在所有样品中相对含量均最高,是主要的挥发性活性醛,是由油酸、亚油酸和花生四烯酸氧化产生的不饱和醛如2,4-癸二烯醛降解而来[32-33]。罗非鱼经冷藏处理后,醛类物质的种类呈增多趋势,这可能与贮藏过程中脂质氧化和微生物代谢有关。与未处理组相比,蒜汁处理组中醛类种类增加,这可能是高分子质量的不饱和醛裂解产生,也有可能是醇的氧化产生;醛类相对总含量减少,这可能是蒜处理后增加了总峰面积,使得相对含量下降,还有可能是蒜中的活性成分多为含有双键的硫化物,与醛发生反应,减少了醛含量。此外,蒜汁处理可以抑制脂质氧化和微生物作用,蒜汁抑制了醛类物质的生成,从而引起罗非鱼中总醛类物质的下降。总而言之,蒜汁处理可以减少醛类物质占鱼肉挥发性物质的比重,改善鱼肉的风味。
2.4.2.3 烃类
如表1所示,共检测到12种烃类物质。烃类化合物主要来自脱羧反应和脂肪酸碳链的分裂过程,或者来自鱼肉中的胡萝卜和不饱和脂肪酸的二次氧化反应[34-36]。烷烃具有较高的阈值,对风味的影响较小。正如表1数据所示,冷藏罗非鱼肉中的烷烃种类比新鲜鱼肉多,这与烃类化合物来源途径多样性相符合。经蒜处理后烃类总相对含量变小,主要原因是烃类物质的降解。其中萘是一种多环芳香烃,它主要来自环境[37],其处理前后相对含量变化不大。
2.4.2.4 环境来源成分
在所有样品中均检测到了1-石竹烯、β-紫罗兰酮、苯酚类化合物及1,2-苯二甲酸,这些物质均由鱼体从环境中富集而来。其中1-石竹烯呈现土腥味、草腥味,主要来自鱼饲料及浮游植物[38];苯酚类及其衍生物是一类合成酚类抗氧化剂和其分解产物的物质,来自受污染的水体[39]。
据报道, 2,4-二叔丁基苯,2,6-二叔丁基苯醌,是来自工厂污染物[40]。醌类物质是由酚脱氢形成。1,2-苯 二甲酸被认为是水体中的具有异味的有机污染物[41]。
表1 罗非鱼肉脱腥前后及贮藏后挥发性风味物质的GC-MS分析结果
Table 1 GC-MS analytical results of volatile flavor compounds from tilapia fillets before after deodorization and after cold storage
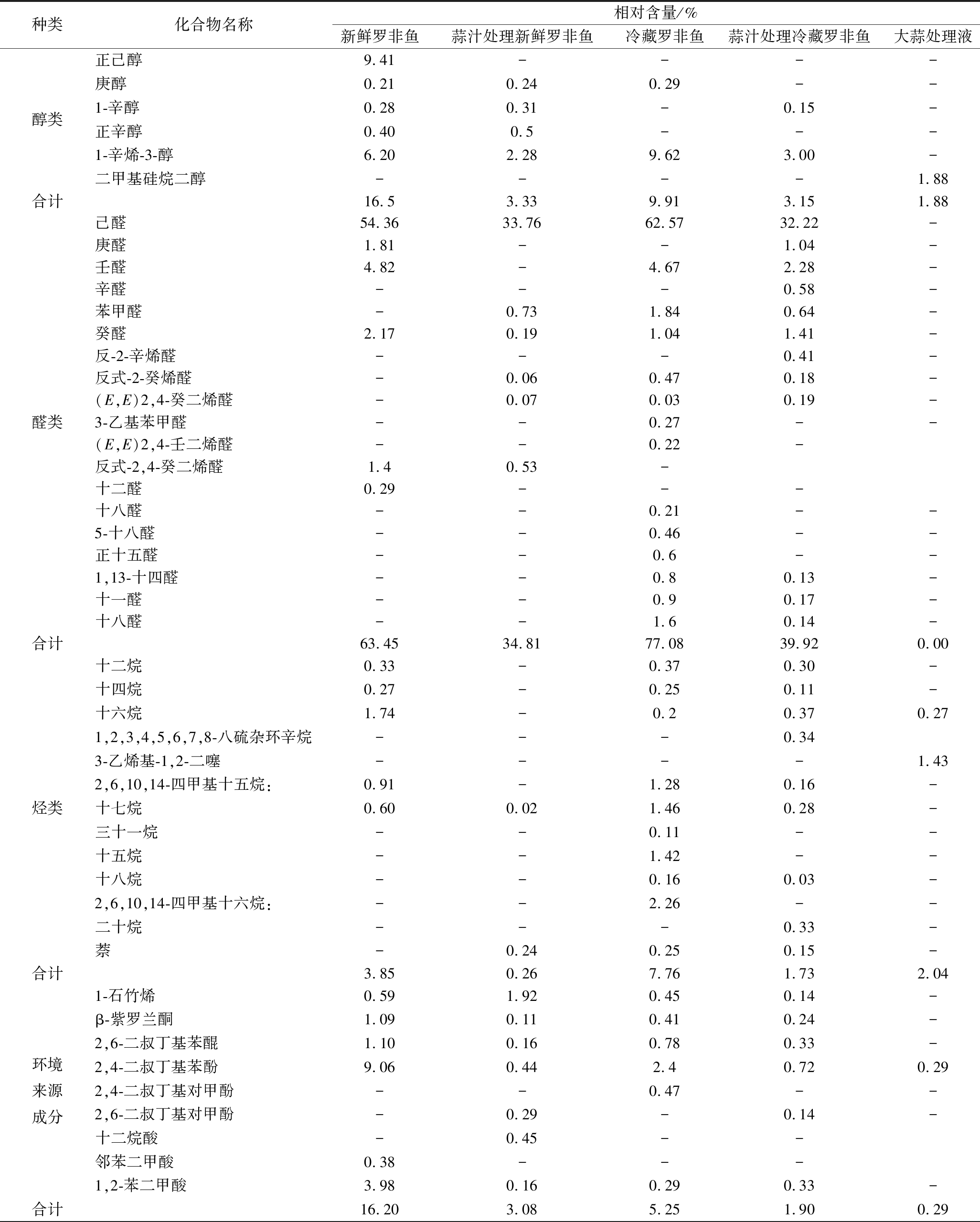
种类化合物名称相对含量/%新鲜罗非鱼蒜汁处理新鲜罗非鱼冷藏罗非鱼蒜汁处理冷藏罗非鱼大蒜处理液醇类正己醇9.41----庚醇0.210.240.29--1-辛醇0.280.31-0.15-正辛醇0.400.5---1-辛烯-3-醇6.202.289.623.00-二甲基硅烷二醇----1.88合计16.53.339.913.151.88醛类己醛54.3633.7662.5732.22-庚醛1.81--1.04-壬醛4.82-4.672.28-辛醛---0.58-苯甲醛-0.731.840.64-癸醛2.170.191.041.41-反-2-辛烯醛---0.41-反式-2-癸烯醛-0.060.470.18-(E,E)2,4-癸二烯醛-0.070.030.19-3-乙基苯甲醛--0.27--(E,E)2,4-壬二烯醛--0.22-反式-2,4-癸二烯醛1.40.53-十二醛0.29---十八醛--0.21--5-十八醛--0.46--正十五醛--0.6--1,13-十四醛--0.80.13-十一醛--0.90.17-十八醛--1.60.14-合计63.4534.8177.0839.920.00烃类十二烷0.33-0.370.30-十四烷0.27-0.250.11-十六烷1.74-0.20.370.271,2,3,4,5,6,7,8-八硫杂环辛烷---0.343-乙烯基-1,2-二噻----1.432,6,10,14-四甲基十五烷:0.91-1.280.16-十七烷0.600.021.460.28-三十一烷--0.11--十五烷--1.42--十八烷--0.160.03-2,6,10,14-四甲基十六烷:--2.26--二十烷---0.33-萘-0.240.250.15-合计3.850.267.761.732.04环境来源成分1-石竹烯0.591.920.450.14-β-紫罗兰酮1.090.110.410.24-2,6-二叔丁基苯醌1.100.160.780.33-2,4-二叔丁基苯酚9.060.442.40.720.292,4-二叔丁基对甲酚--0.47--2,6-二叔丁基对甲酚-0.29-0.14-十二烷酸-0.45--邻苯二甲酸0.38---1,2-苯二甲酸3.980.160.290.33-合计16.203.085.251.900.29
续表1

种类化合物名称相对含量/%新鲜罗非鱼蒜汁处理新鲜罗非鱼冷藏罗非鱼蒜汁处理冷藏罗非鱼大蒜处理液硫化物及其他物质烯丙基硫醚-5.23-6.944.23烯丙基甲基二硫醚-7.21-3.2010.58二烯丙基二硫醚-8.21-8.107.50二烯丙基三硫醚-1.21-0.453.77烯丙基三硫醚-0.11-0.122.33甲基2-丙烯基二硫醚1.230.442.11烯丙基甲基三硫醚-1.65-0.681.22二烯丙基四硫醚0.16-0.110.133-乙烯基-1,2-二硫杂环己-4-烯-1.25-2.144.333-乙烯基-1,2-二硫环己-5-烯-0.88-1.210.681-丙烯-0.2--1.93(Z)-1(甲硫基)-1-1丙烯-7.13-5.500..811,2-二硫杂环戊二烯-0.51-0.21-5-甲基-1,2,3,4-四氢异喹啉-0.16-0.292.021H-环丙萘-0.11--3.614-甲基-1,2,3,4-四氢异喹啉-0.21--2.18二甲基三硫醚-0.35-0.271.433,4-二甲基噻吩-0.22-0.120.35合计0.0058.520.0053.3095.79
注:-未检出;下表同。
由表1可知,1-石竹烯、β-紫罗兰酮在所有样品中相对含量差异不大;新鲜鱼肉中苯酚类化合物,经蒜汁和冷藏处理后,其相对含量降低。这可能是因为酚被氧化形成苯酚-挥发性复合物,这类复合物没有气味或者具有不同的香气[42],对改善鱼肉气味具有一定程度的贡献。
2.4.2.5 硫化物及其他
在未处理的罗非鱼样品中,未检测到硫化物,在蒜汁处理的罗非鱼样品中,均检测到硫化物。在蒜汁处理液中,共检测到1种醇类(二甲基硅烷二醇);3种烃类(十六烷、1,2,3,4,5,6,7,8-八硫杂环辛烷和3-乙烯基-1,2-二噻烷);其他的大部分挥发性成分为硫化物,其中相对含量较高的烯丙基硫醚、烯丙基甲基二硫醚、二烯丙基二硫醚、二烯丙基三硫醚、烯丙基三硫醚、3-乙烯基-1,2-二硫杂环己-4-烯,是蒜汁的主体风味物质,这与ROSE等[43]报道的结果相一致,这些物质均在蒜汁处理的罗非鱼样品中检测到。在蒜汁处理液中,挥发性物质成分与罗非鱼肉腥味物质成分无交叉,故蒜汁处理液成分不干扰罗非鱼肉腥味物质成分的变化。蒜汁处理后,赋予了罗非鱼蒜的特征风味,使得罗非鱼中腥味物质相对含量下降,从而对罗非鱼肉的腥味起到一定的掩盖作用。
2.5 关键腥味成分的确定
根据SONG等报道[12],关键气味化合物由ROAV指数确定,范围从0到100。ROAV≥1的挥发性化合物是关键气味化合物,0.1≤ROAV <1的化合物对鱼肉气味具有改性作用[44-45]。感官阈值和挥发性物质的风味描述列于表2。己醛含量最高,感官阈值为5 μg/kg, 表明对整体风味贡献最大。因此,己醛的相对气味活性值(ROAV max)定义为100。
如表2所示,虽然某些醛类、醇类物质只呈现不愉快气味,但是对增强鱼肉腥气味具有一定程度作用[46-47],且其ROAV大于1,对鱼肉整体风味具有改性作用。醇类物质主要赋予罗非鱼土腥味,醛类物质主要赋予草腥味。蒜汁处理对新鲜罗非鱼和贮藏罗非鱼肉的腥味主体成分具有一定影响。新鲜罗非鱼中的腥味物质主要是正己醇、正辛醇、1-辛烯-3-醇、己醛、庚醛、壬醛、癸醛。蒜处理的新鲜鱼肉腥味物质主要是正辛醇、1-辛烯-3-醇、苯甲醛、反式-2-癸烯醛、(E,E)2,4-癸二烯醛。冷藏鱼肉中的腥味物质主要是1-辛烯-3-醇、庚醛、辛醛、苯甲醛、反式-2-癸烯醛、(E,E)2,4-癸二烯醛、(E,E)2,4-壬二烯醛。蒜处理的冷藏鱼肉腥味物质主要有1-辛烯-3-醇、己醛、庚醛、壬醛、苯甲醛、癸醛、反-2-辛烯醛、(E,E)2,4-癸二烯醛、反式-2-癸烯醛。蒜汁处理后,主体成分的ROAV值减少,进一步说明蒜汁对罗非鱼腥味有改善效果,但是蒜汁对罗非鱼肉的腥味物质种类并未有明显影响,说明蒜汁处理对脱除罗非鱼腥味物质的效果一般。
表2 罗非鱼肉脱腥前后及贮藏后关键腥味成分
Table 2 GC-MS analytical results of relative fishy odor compounds from tilapia fillets before after deodorization and after cold storage

物质 风味描述气味阈值/(μg·kg -1)新鲜鱼肉未处理组新鲜鱼肉处理组冷藏鱼肉未处理组冷藏鱼肉处理组正己醇草腥味5.615.46---庚醇土腥味5.40.360.660.43-1-辛醇土腥味1250.020.04-0.02正辛醇刺激味0.66.1312.34--1-辛烯-3-醇土腥味1.538.0222.5151.2531.04己醛草腥味5100.00100100100庚醛草腥味2.85.95-33.935.76壬醛草腥味1.140.30--32.17辛醛辛辣味0.6--4.900.22苯甲醛苦杏仁41.7-3.602.773.31癸醛草腥味36.650.94-7.29反-2-辛烯醛草腥味3---2.36反式-2-癸烯醛油脂味2.7-8.8937.5627.93(E,E)2,4-癸二烯醛草腥味0.1-10.372.4029.48(E,E)2,4-壬二烯醛草腥味0.1--17.58<0.01反式-2,4-癸二烯醛草腥味0.1-<0.010.530.39萘木、土腥味21<0.010.060.030.041-石竹烯草腥味640.090.470.060.04β-紫罗兰酮草腥味600.170.030.050.06
2.6 蒜处理对罗非鱼肉挥发性物质百分比的影响
由图4可知,新鲜鱼肉和冷藏鱼肉主要风味成分是醛类物质,由表2可知,这些醛类化合物对腥味的产生具有重要作用。经蒜汁处理后,罗非鱼肉中的醛类物质百分比下降,而蒜的风味物质百分比增加,同时伴随感官评分的增加,说明蒜汁对罗非鱼腥味主要通过掩盖作用,从而整体上提高了鱼肉的风味品质。
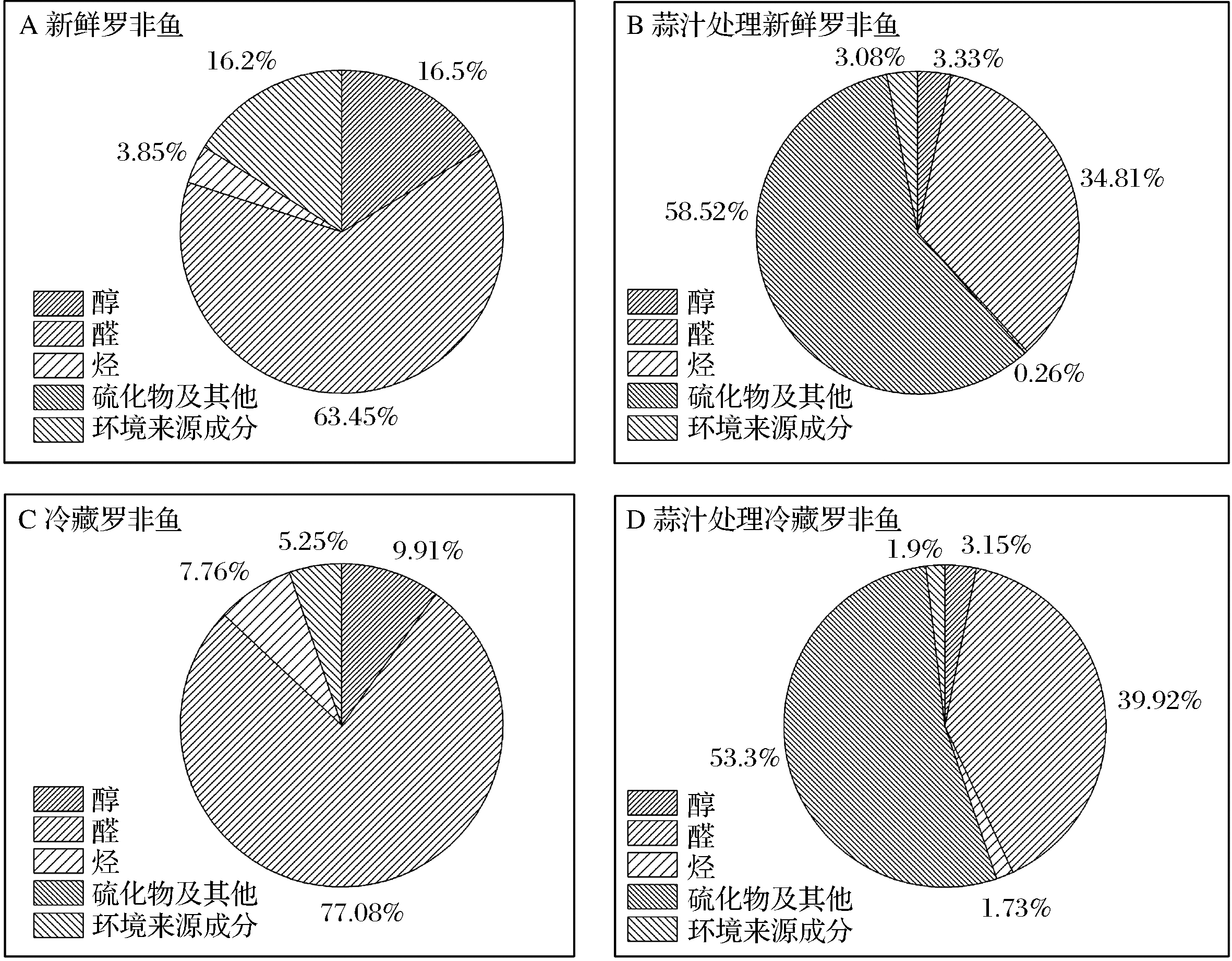
图4 罗非鱼肉脱腥前后及贮藏后挥发性物质百分比
Fig.4 Percent of volitle compounds of tilapia fillets before, after deodorization and after cold storage
3 结论
蒜汁处理可以抑制罗非鱼的脂质的氧化和微生物的生长,并且适当质量浓度(6 g/L)的大蒜提取液可以改善罗非鱼的感官评分。分析6 g/L蒜汁质量浓度处理罗非鱼的腥味物质,发现鲜罗非鱼肉的主要腥味物质可能是己醛、庚醛、壬醛、葵醛、正己醇、正辛醇、1-辛烯-3-醇;罗非鱼经贮藏后主要腥味物质可能是己醛、庚醛、辛醛、反式-2-癸烯醛、(E,E)2,4-癸二烯醛、苯甲醛、(E,E)2,4-壬二烯醛、1-辛烯-3-醇。蒜汁提取液处理的罗非鱼(新鲜及贮藏)的主体腥味物质相对含量分别从63.45%、77.08%降至34.81%、39.32%。蒜汁提取液不止可以直接掩盖罗非鱼腥味,还可以控制抑制脂质氧化和微生物的生命活动,从而抑制腥味的产生。本研究结果说明大蒜处理可改善鱼产品的风味,在海鲜加工和贮藏中具有潜在的前景。
[1] WANG M, LU M. Tilapia polyculture: A global review[J]. Aquaculture Research, 2016, 47(8): 2 363-2 374.
[2] SELLI S, PROST C, SEROT T. Odour-active and off-odour components in rainbow trout (Oncorhynchus mykiss) extracts obtained by microwave assisted distillation-solvent extraction[J]. Food Chemistry, 2009, 114(1): 317-322.
[3] SHIN J H, CHOI D J, LEE S J, et al. Changes of physicochemical components and antioxidant activity of garlic during its processing[J]. Journal of Life Science, 2008, 18(8): 1 123-1 131.
[4] DEWI A D R, KUSNADI J, SHIH W L. Comparison of the main bioactive compounds and antioxidant activity from garlic water-soluble and garlic oil[J]. KnE Life Sciences, 2017, 3(5): 20-34.
[5] SOMMAN A, SIWARUNGSON N. Comparison of antioxidant activity and tyrosinase inhibition in fresh and processed white radish, garlic and ginger[J]. Journal of Food Measurement and Characterization, 2015, 9(3): 369-374.
[6] ROSE P, WHITEMAN M, MOORE P K, et al. Bioactive S-alk (en) yl cysteine sulfoxide metabolites in the genus Allium: The chemistry of potential therapeutic agents[J]. Natural Product Reports, 2005, 22(3): 351-368.
[7] AMAGASE H, PETESCH B L, MATSUURA H, et al. Intake of garlic and its bioactive components[J]. The Journal of Nutrition, 2001, 131(3): 955S-962S.
[8] CAO Y, GU W, ZHANG J, et al. Effects of chitosan, aqueous extract of ginger, onion and garlic on quality and shelf life of stewed-pork during refrigerated storage[J]. Food Chemistry, 2013, 141(3): 1 655-1 660.
[9] BUEGE J A, AUST S D. Methods in Enzymology[M]. Academic Press, 1978, 52: 302-310.
[10] YARNPAKDEE S, BENJAKUL S, NALINANON S, et al. Lipid oxidation and fishy odour development in protein hydrolysate from Nile tilapia (Oreochromis niloticus) muscle as affected by freshness and antioxidants[J]. Food Chemistry, 2012, 132(4): 1 781-1 788.
[11] IGLESIAS J, MEDINA I, BIANCHI F, et al. Study of the volatile compounds useful for the characterisation of fresh and frozen-thawed cultured gilthead sea bream fish by solid-phase microextraction gas chromatography-mass spectrometry[J]. Food Chemistry, 2009, 115(4): 1 473-1 478.
[12] SONG G, DAI Z, SHEN Q, et al. Analysis of the changes in volatile compound and fatty acid profiles of fish oil in chemical refining process[J]. European Journal of Lipid Science and Technology, 2018, 120(2): 1 700 219.
[13] YARNPAKDEE S, BENJAKUL S, KRISTINSSON H G. Lipid oxidation and fishy odour in protein hydrolysate derived from Nile tilapia (Oreochromis niloticus) protein isolate as influenced by haemoglobin[J]. Journal of the Science of Food and Agriculture, 2014, 94(2): 219-226.
[14] PAPASTERGIADIS A, MUBIRU E, VAN LANGENHOVE H, et al. Malondialdehyde measurement in oxidized foods: Evaluation of the spectrophotometric thiobarbituric acid reactive substances (TBARS) test in various foods[J]. Journal of Agricultural and Food Chemistry, 2012, 60(38): 9 589-9 594.
[15] BIRNIE-GAUVIN K, COSTANTINI D, COOKE S J, et al. A comparative and evolutionary approach to oxidative stress in fish: A review[J]. Fish and Fisheries, 2017, 18(5): 928-942.
[16] CONNELL J J, Methods of Assessing and Selecting for Quality. In: Control of Fish Quality[M]. 3rd ed. Oxford: Fishing News Books, 1990: 122-150.
[17] KAMEL A, SALEH M. Recent studies on the chemistry and biological activities of the prganosulfur compounds of garlic (Allium sativum)[J]. Chemistry, 2000, 23: 455-485.
[18] LOCATELLI D A, NAZARENO M A, FUSARI C M, et al. Cooked garlic and antioxidant activity: Correlation with organosulfur compound composition[J]. Food Chemistry, 2017, 220: 219-224.
[19] BINTORO V P, LEGOWO A M, PURNOMOADI A, et al. Garlic antioxidant (Allium sativum L.) to prevent meat rancidity[J]. Procedia Food Science, 2015, 3: 137-141.
[20] YADAV S, TRIVEDI N A, BHATT J D. Antimicrobial activity of fresh garlic juice: An in vitro study[J]. Ayu, 2015, 36(2): 203.
[21] BAKRI I M, DOUGLAS C W I. Inhibitory effect of garlic extract on oral bacteria[J]. Archives of oral biology, 2005, 50(7): 645-651.
[22] IWALOKUN B A, OGUNLEDUN A, OGBOLU D O, et al. In vitro antimicrobial properties of aqueous garlic extract against multidrug-resistant bacteria and Candida species from Nigeria[J]. Journal of Medicinal Food, 2004, 7(3): 327-333.
[23] HAYAT S, AHMAD H, ALI M, et al. Aqueous garlic extract stimulates growth and antioxidant enzymes activity of tomato (Solanum lycopersicum)[J]. Scientia Horticulturae, 2018, 240: 139-146.
[24] CHEN C, LIU C H, CAI J, et al. Broad-spectrum antimicrobial activity, chemical composition and mechanism of action of garlic (Allium sativum) extracts[J]. Food Control, 2018, 86: 117-125.
[25] GOLDSTEIN G, KELLING O, SERPA G, et al. Garlic and onion extracts enhance the yield of T2 bacteriophage in E. coli[J]. Research & Reviews: A Journal of Biotechnology, 2015, 5(2): 8.
[26] MARCHESE A, BARBIERI R, SANCHES-SILVA A, et al. Antifungal and antibacterial activities of allicin: A review[J]. Trends in Food Science & Technology, 2016, 52: 49-56.
[27] GUAN W, REN X, LI Y, et al. The beneficial effects of grape seed, sage and oregano extracts on the quality and volatile flavor component of hairtail fish balls during cold storage at 4 ℃[J]. LWT-Food Science and Technology, 2019,101:25-31.
[28] NING-PING T, WU R, ZHOU P G, et al. Characterization of odor-active compounds in cooked meat of farmed obscure puffer (Takifugu obscurus) using gas chromatography-mass spectrometry-olfactometry[J]. Journal of Food and Drug Analysis, 2014, 22(4): 431.
[29] RABE S, KRINGS U, BERGER R G. Influence of oil-in-water emulsion characteristics on initial dynamic flavour release[J]. Journal of the Science of Food and Agriculture, 2003, 83(11): 1 124-1 133.
[30] CASABURI A, NASI A, FERROCINO I, et al. Spoilage-related activity of Carnobacterium maltaromaticum strains in air-stored and vacuum-packed meat[J]. Applied and Environmental Microbiology, 2011,71(20):7 382-7 393.
[31] ARGYRI A A, MALLOUCHOS A, PANAGOU E Z, et al. The dynamics of the HS/SPME-GC/MS as a tool to assess the spoilage of minced beef stored under different packaging and temperature conditions[J]. International Journal of Food Microbiology, 2015, 193: 51-58.
[32] CAPRINO F, MORETTI V M, BELLAGAMBA F, et al. Fatty acid composition and volatile compounds of caviar from farmed white sturgeon (Acipenser transmontanus)[J]. Analytica Chimica Acta, 2008, 617(1-2): 139-147.
[33] NIETO G, BA
 N S, GARRIDO M D. Effect of supplementing ewes’ diet with thyme (Thymus zygis ssp. gracilis) leaves on the lipid oxidation of cooked lamb meat[J]. Food Chemistry, 2011, 125(4): 1 147-1 152.
N S, GARRIDO M D. Effect of supplementing ewes’ diet with thyme (Thymus zygis ssp. gracilis) leaves on the lipid oxidation of cooked lamb meat[J]. Food Chemistry, 2011, 125(4): 1 147-1 152.
[34] LIU J K, ZHAO S M, XIONG S B, et al. Influence of recooking on volatile and non-volatile compounds found in silver carp Hypophthalmichthys molitrix[J]. Fisheries Science, 2009, 75(4): 1 067-1 075.
[35] LINDER M, ACKMAN R G. Volatile compounds recovered by solid-phase microextraction from fresh adductor muscle and total lipids of sea scallop (Placopecten magellanicus) from Georges Bank (Nova Scotia)[J]. Journal of Food Science, 2002, 67(6): 2 032-2 037.
[36] CHUNG H Y, YUNG I K S, MA W C J, et al. Analysis of volatile components in frozen and dried scallops (Patinopecten yessoensis) by gas chromatography/mass spectrometry[J]. Food Research International, 2002, 35(1): 43-53.
[37] HOSSAIN M A, YEASMIN F, RAHMAN S M M, et al. Naphthalene, a polycyclic aromatic hydrocarbon, in the fish samples from the Bangsai river of Bangladesh by gas chromatograph-mass spectrometry[J]. Arabian Journal of Chemistry, 2014, 7(6): 976-980.
[38] PODDUTURI R, PETERSEN M A, MAHMUD S, et al. Potential contribution of fish feed and phytoplankton to the content of volatile terpenes in cultured pangasius (Pangasianodon hypophthalmus) and Tilapia (Oreochromis niloticus)[J]. Journal of Agricultural and Food Chemistry, 2017, 65(18): 3 730-3 736.
[39] LIU R, SONG S, LIN Y, et al. Occurrence of synthetic phenolic antioxidants and major metabolites in municipal sewage sludge in China[J]. Environmental Science & Technology, 2015, 49(4): 2 073-2 080.
[40] SHIRAISHI H, CARTER D S, HITES R A. Identification and determination of tert-alkylphenols in carp from the trenton channel of the Detroit River, Michigan, USA[J]. Biomedical & Environmental Mass Spectrometry, 1989, 18(7): 478-483.
[41] WANG H, WANG C, WU W, et al. Persistent organic pollutants in water and surface sediments of Taihu Lake, China and risk assessment[J]. Chemosphere, 2003, 50(4): 557-562.
[42] CASTADA H Z, MIRONDO R, SIGURDSON G T, et al. Deodorization of garlic odor by spearmint, peppermint, and chocolate mint leaves and rosmarinic acid[J]. LWT-Food Science and Technology, 2017, 84: 160-167.
[43] ROSE P, MOORE P K, ZHU Y Z. Garlic and gaseous mediators[J]. Trends in Pharmacological Sciences, 2018,39(7):624-634.
[44] BORDIGA M, PIANA G, COÏSSON J D, et al. Headspace solid-phase micro extraction coupled to comprehensive two-dimensional with time-of-flight mass spectrometry applied to the evaluation of N ebbiolo-based wine volatile aroma during ageing[J]. International Journal of Food Science & Technology, 2014, 49(3): 787-796.
[45] SUN L, CHEN J, LI M, et al. Effect of star anise (Illicium verum) on the volatile compounds of stewed chicken[J]. Journal of Food Process Engineering, 2014, 37(2): 131-145.
[46] LIU S, LIAO T, MCCRUMMEN S T, et al. Exploration of volatile compounds causing off-flavor in farm-raised channel catfish (Ictalurus punctatus) fillet[J]. Aquaculture International, 2017, 25(1): 413-422.
[47] MCCRUMMEN S T, WANG Y, HANSON T R, et al. Culture environment and the odorous volatile compounds present in pond-raised channel catfish (Ictalurus punctatus)J. Aquaculture International, 2018, 26(2): 685-694.