近年来,食品安全问题在全球已经成为备受关注的问题,水产品由于其丰富的营养价值在全球范围内都很受欢迎[1-2],但同时也由于其营养成分有利于腐败微生物和常见的食源性疾病病原体的生长和繁殖,海产品的安全和营养价值在贮藏和运输的过程比肉类等其他食品下降更快[3-7]。目前,化学防腐剂是延长货架期的主要手段之一,但由于消费者对化学添加剂的担忧,要求食品工业在保证产品的质量的同时,少添加甚至不添加化学防腐剂,使用更多的天然防腐剂来保证食品的安全[8-11]。
微生物能够产生具有抑菌性代谢产物,可以作为生物防腐剂抑制腐败菌和致病菌的生长,从而达到延长食品货架期和提高食品安全性的目的[12-13]。乳酸菌通常被认为是安全的微生物(generally regarded as safe,GRAS),在代谢中可产生有机酸、H2O2、细菌素等多种抑制性化合物[14-16]。乳酸菌生产的细菌素是由核糖体合成的蛋白质化合物,能够抑制多种微生物,已被证明可有效地控制病原菌和腐败菌的繁殖[17-20]。乳酸链球菌素是目前市场上最重要的、也是唯一商业化的细菌素,作为一种安全、天然的食品防腐剂已被50多个国家用作食品防腐剂[14]。
在过去的研究中,从不同食物中分离出产细菌素的乳酸菌及细菌素的表征进行了广泛的研究,然而关于鱼类产品中存在的乳酸菌的研究较少[21]。为了延长水产品的货架期,提高其品质,选用属于水产品及其加工环境中存在的乳酸菌微生物群是有利的方法,因为它们已经适应这些环境,同时也不易产生一些新的气味[22]。因此本研究旨在从花鲈鱼肠道中分离出抑菌性较强的产细菌素乳酸菌,为水产品保鲜和天然防腐剂的开发应用提供借鉴和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
花鲈鱼购买于上海芦潮港水产品市场,0.5 h内低温运输至实验室。解剖时体表完好,肠道完整,无明显食糜。
1.1.2 主要试剂及培养基
乳酸菌成套生化鉴定管、H2O2、革兰氏染色液试剂盒、MRS琼脂培养基、MRS肉汤培养基、脑心浸液肉汤(BHI)、平板计数琼脂(PCA),青岛高科园海博生物技术有限公司;过氧化氢酶、胰蛋白酶、蛋白酶K购自生工生物工程(上海)股份有限公司;胃蛋白酶、溴甲酚紫,国药集团化学试剂有限公司;细菌DNA基因组提取试剂盒,天根生化科技(北京)有限公司。
1.1.3 指示菌
MGHY1、 MGHY2、MGHY3、MGHY4、MGHY5、MGHY6、MGHY7、MGHY8、MGHY9、MGHY10、MGHY11、MGHY12、MGHY13、MGHY14、MGHY15、MGHY16、MGHY17均分离自美国红鱼(经16s鉴定后,通过NCBI比对,其最相似菌见表1),金黄色葡萄球菌(CMCC(B) 26003)、金黄色葡萄球菌(CCTCC AB 91093)、金黄色葡萄球菌(实验室保存)、大肠杆菌O157:H7(ATCC 43889)、大肠杆菌(实验室保存)、腐败希瓦氏菌模式菌株(DSM6067)、腐败希瓦氏菌(分离自凡纳滨对虾)、荧光假单胞菌(ATCC13525)、荧光假单胞菌(分离自三文鱼)、单核细胞增生李斯特菌标准菌株(ATCC19115)、植物乳杆菌,上述菌株均由上海海洋大学食品学院保存。
表1 美国红鱼中的分离菌株
Table 1 Bacterial isolates from red drum

分离菌株GenBank数据库中最相似菌MGHY 1Pseudomonasfragi strain D12MGHY 2Pseudomonas sp. strain JDMARC17 1MGHY 3Shewanella morhuae strain U1417MGHY 4Shewanella sp. Pdp11MGHY 5Pseudomonasfragi strain D20MGHY 6Pseudomonas fluorescens strain KBL17MGHY 7Shewanella sp. Raj-4MGHY 8Pseudomonas sp. strain DNE-S2MGHY 9Pseudomonas fluorescens strain KBL17MGHY 10Pseudomonascedrina strain Y37MGHY 11Pseudomonasfragi strain B7MGHY 12Aeromonas salmonicida strain AF-1MGHY 13Pseudomonasfragi strain ICE353
1.2 实验方法
1.2.1 乳酸菌的分离纯化与初筛
参照董韩博等[23]的方法对乳酸菌进行分离纯化。无菌环境下取出花鲈鱼肠道,用手术剪刀充分剪碎,加入含有25 mL的无菌生理盐水中重复充分振荡摇匀,制成原液,吸取1 mL用作稀释梯度。取原液和10-1、 10-2、10-3、10-4、10-5、10-6六个稀释梯度涂布于添加了溴甲酚紫的MRS固体培养基中,在30 ℃培养48~72 h,挑取能够使平板由紫色变为黄色的单菌落,再在添加了溴甲酚紫的MRS平板上划线分离纯化,划线培养3~4次直至纯化。
挑单菌落于MRS肉汤培养基中,在30 ℃下培养18 h,再以1%接种量至MRS肉汤培养基中扩大培养,在30 ℃下培养32 h,培养好之后离心(8 000 r/min,20 min) 取上清液,经0.22 μm微孔滤膜除去菌体,得到无细胞上清液,4 ℃保存备用。
利用牛津杯法对乳酸菌进行初筛[24]。在BHI液体培养基中分别接种大肠杆菌O157:H7(ATCC 43889),30 ℃条件下培养12 h之后,吸取1mL用无菌生理盐水进行梯度稀释,取100 μL稀释度为10-3的菌液均匀涂布在PCA平板培养基中,再在无菌条件下将牛津杯(内径6 mm,外径8 mm)均匀放置在平板上,稍微轻轻下压,使其与平板培养基接触面无空隙,然后吸取200 μL发酵液于杯中, 30 ℃下培养18 h,观察并用游标卡尺测量抑菌圈,挑选抑菌圈最大的乳酸菌株进行后续研究。
1.2.2 产细菌素乳酸菌的复筛
(1)排除有机酸的干扰
在酸性条件下,细菌素的抑菌活性较强,因此为了排除有机酸的干扰,用pH值相同的乳酸和乙酸溶液分别进行抑菌实验,设3组平行[25]。根据用pH值相同的乳酸和乙酸溶液得出的抑菌圈直径的大小来判断是否存在其他抑菌活性物质。
(2)排除H2O2的干扰
用6 mol/L NaOH和6 mol/L HCl溶液将获得的乳酸菌菌株的发酵液调节至H2O2酶最适的pH值之后,添加过氧化氢酶至终质量浓度为1 g/L,37 ℃下温育1 h,再将pH值调回原始pH值进行牛津杯抑菌实验,重复3次,并以未经酶处理的发酵上清液作为对照。若酶解后的上清液抑菌圈未显著减小,则说明发酵液中存在其他抑菌物质。
(3)蛋白类抑菌物质的确定
用6 mol/L NaOH和6 mol/L HCl将获得的乳酸菌菌株的发酵液分别调节至胰蛋白酶、胃蛋白酶、蛋白酶K的最适pH值(胰蛋白酶8.00、胃蛋白酶2.00、 蛋白酶K 8.00)之后,在37 ℃下温育1 h,再将pH值调回原始pH值进行牛津杯抑菌实验,重复3次。并以未经酶处理的发酵上清液作为对照。若酶解后的上清液抑菌圈显著减小,则说明抑菌物质为蛋白类。
1.2.3 菌株的鉴定
(1)生理生化鉴定
根据乳酸菌成套生化鉴定管试剂说明书对菌株进行生理生化鉴定。
(2)16S rDNA鉴定
将乳酸菌菌株用MRS肉汤培养基活化之后,培养至对数期,使用细菌DNA基因组提取试剂盒提取乳酸菌的基因组DNA。利用提取的乳酸菌基因组DNA为模板,采用扩增细菌16S rDNA的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′),对乳酸菌的16S rDNA进行PCR扩增,得到的PCR产物用2%琼脂糖凝胶电泳检测,并进行测序。
(3)系统发育树构建
将测序所得的基因序列在GenBank数据库中进行BLAST同源性比对分析,利用MEGA5.1软件构建系统发育树。
1.3 抑菌谱的测定
采用牛津杯法测定产细菌素乳酸菌的抑菌谱,利用1.1.3中的菌体作为指示菌。
2 结果与分析
2.1 乳酸菌的分离与初筛
从花鲈鱼的肠道中,共分离出18株革兰氏阳性、过氧化氢酶阴性的疑似乳酸菌菌株。将初筛得到的菌株,以大肠杆菌O157:H7(ATCC 43889)为指示菌,用牛津杯法进行抑菌发现,编号为HL7的疑似乳酸菌菌株对大肠杆菌O157:H7(ATCC 43889)的抑菌圈明显。因此,选用HL7为后续研究菌株。
2.2 产细菌素乳酸菌的复筛
乳酸菌在发酵过程中可产生有机酸、H2O2、细菌素等多种抑制性化合物,通过用pH值相同的乳酸和乙酸溶液以及经过氧化氢酶处理的发酵液的抑菌直径与未经过处理的发酵液抑菌直径进行比较来判断HL7菌株为产生细菌素菌株。由表2可见,与发酵液相同pH值的乳酸和乙酸溶液没有抑菌作用,由此可判断发酵液中的抑菌物质不是有机酸。酸排除试验之后,经过氧化氢酶处理的发酵液抑菌性仅仅下降10%,所以H2O2不是主要的抑菌物质。用胰蛋白酶、胃蛋白酶、蛋白酶K处理发酵液进行抑菌性实验发现,经胰蛋白酶处理的发酵液抑菌圈未明显减小,但经胃蛋白酶和蛋白酶K处理之后的发酵液没有抑菌性,由此可以推测该抑菌物质虽然对胰蛋白酶不敏感,但对胃蛋白酶和蛋白酶K敏感,依然可初步确定为蛋白类物质。
表2 不同处理发酵液的抑菌活性
Table 2 The antibacterial activity of the fermentation broth under different treatments

样品 抑菌直径/mm发酵上清液16.58±0.33乳酸-乙酸-过氧化氢酶处理的发酵液14.86±0.21胰蛋白酶处理的发酵液15.04±0.30胃蛋白酶处理的发酵液-蛋白酶K处理的发酵液-
注:“-”表示未显示抑菌圈。
2.3 菌株的鉴定
根据乳酸菌成套生化鉴定管试剂说明书对该菌株进行生化鉴定,其生化鉴定结果见表3。由表3可知该菌株能够发酵七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、菊糖、乳糖,不能利用棉子糖和马尿酸钠。该结果表明该菌株可以发酵多种糖,符合乳酸菌的特性;而七叶苷水解实验为阳性也初步判定该菌株为肠球菌[26]。
表3 生化鉴定结果
Table 3 Results of biochemical identification

产品名称 结果判断七叶苷阳性纤维二糖阳性麦芽糖阳性甘露醇阳性水杨苷阳性山梨醇阳性蔗糖阳性棉子糖阴性菊糖阳性乳糖阳性1%马尿酸钠阴性
将HL7菌株利用细菌DNA基因组提取试剂盒提取乳酸菌的基因组DNA之后,进行16S rDNA的PCR扩增之后进行测序,将测序结果在NCBI(http://www.ncbi.nlm.nih.gov/)上进行序列相似性比对,根据序列〗的比对结果,利用MEGA5.1软件构建该菌株的系统发育树。由图1可知,HL7和Enterococcus faecalis TY1(CPO31027.1)菌株在同一分支上,序列相似性达到99%,因此该菌株命名为Enterococcus faecalis HL7。

图1 菌株HL7根据16S rDNA序列构建的系统发育树
Fig.1 Phylogenetic tree of HL7 constructed based on 16S rDNA sequence analysis
2.4 菌株的抑菌谱
为验证该菌株在海产品保鲜上的适用性,利用多种来源于海产品的腐败菌和致病菌作为指示菌,采用牛津杯法检测Enterococcus faecalis HL7发酵上清液的抑菌谱。其结果表明该发酵上清液能有效抑制多种腐败菌和致病菌,在海产品保鲜上具有很大潜力,抑菌结果见表4。
表4 HL7发酵上清液的抑菌谱
Table 4 Inhibition spectrum of fermented supernatant of HL7
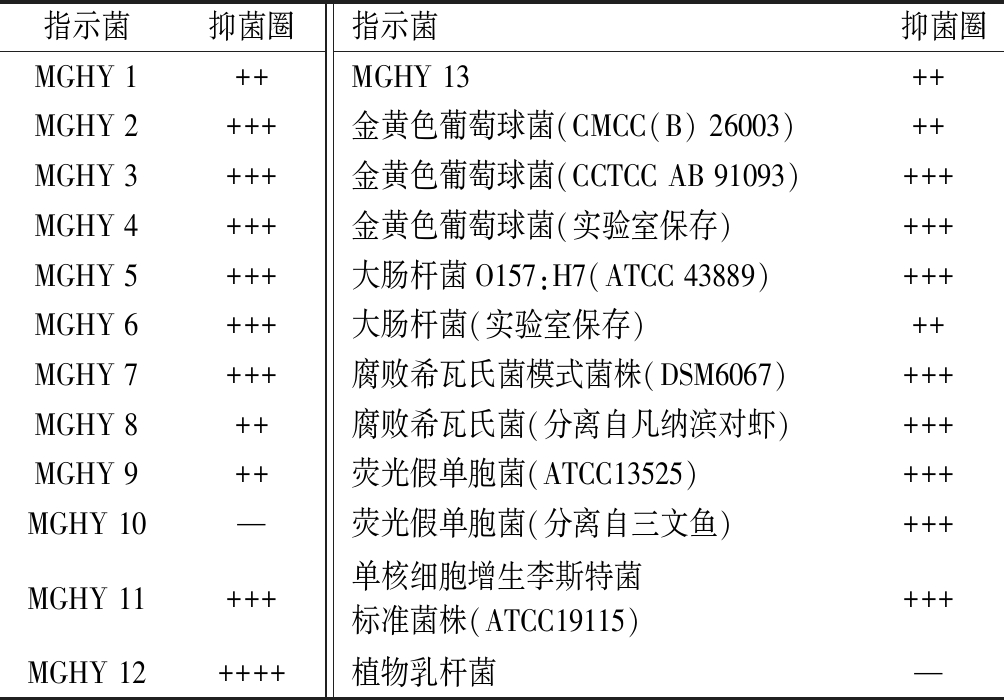
指示菌抑菌圈指示菌抑菌圈MGHY 1++MGHY 13++MGHY 2+++金黄色葡萄球菌(CMCC(B) 26003)++MGHY 3+++金黄色葡萄球菌(CCTCC AB 91093)+++MGHY 4+++金黄色葡萄球菌(实验室保存)+++MGHY 5+++大肠杆菌O157:H7(ATCC 43889)+++MGHY 6+++大肠杆菌(实验室保存)++MGHY 7+++腐败希瓦氏菌模式菌株(DSM6067)+++MGHY 8++腐败希瓦氏菌(分离自凡纳滨对虾)+++MGHY 9++荧光假单胞菌(ATCC13525)+++MGHY 10—荧光假单胞菌(分离自三文鱼)+++MGHY 11+++单核细胞增生李斯特菌标准菌株(ATCC19115)+++MGHY 12++++植物乳杆菌—
注: “ - ”表示无抑菌性; “ + ”表示抑菌圈直径< 10 mm; “ + + ”表示抑菌圈直径 10~15 mm; “ + + + ”表示抑菌圈直径 15~20 mm;“ + ++ + ”表示抑菌圈直径> 20 mm。
3 结论
经过对样本中的乳酸菌进行初筛和复筛,本研究从花鲈鱼肠道中分离得到1株乳酸菌经16S rDNA分子鉴定并建立系统发育树,鉴定为Enterococcus faecalis。通过排除有机酸和H2O2的干扰以及蛋白酶敏感实验,可以确定抑菌物质为蛋白类活性物质。根据该菌株发酵液抑菌谱试验,发现其发酵液对多种来源于海产品的腐败菌和致病菌具有抑制作用,为其作为海产品生物保鲜提供了有力的支持。此外,对于Enterococcus faecalis的细菌素还需要进一步的研究,利用合适的方法将该细菌素进行分离纯化研究其结构特征。
[1] 励建荣, 仪淑敏,李婷婷,等. 水产品保鲜材料和杀菌技术研究进展[J]. 中国渔业质量与标准, 2016,6(1): 1-11.
[2] JASOUR M S, EHSANI A, MEHRYAR L, et al. Chitosan coating incorporated with the lactoperoxidase system: An active edible coating for fish preservation[J]. Journal of the Science of Food and Agriculture, 2015, 95(6): 1 373-1 378.
[3] G MEZ-ESTACA J, L
MEZ-ESTACA J, L PEZ-CABALLERO M E, MART
PEZ-CABALLERO M E, MART NEZ-BARTOLOMÉ M A, et al. The effect of the combined use of high pressure treatment and antimicrobial edible film on the quality of salmon carpaccio [J]. International Journal of Food Microbiology, 2018, 283: 28-36.
NEZ-BARTOLOMÉ M A, et al. The effect of the combined use of high pressure treatment and antimicrobial edible film on the quality of salmon carpaccio [J]. International Journal of Food Microbiology, 2018, 283: 28-36.
[4] CHENG Junhu, SUN Dawen, ZHU Zhiwei. Effects of frozen storage condition abuse on the rextural and chemical properties of grass carp (Ctenopharyngodon idella) fillets [J]. Journal of Food Processing and Preservation, 2017, 41(1): e13002.
[5] 张英梅, 张振华,林贵凤,等. 预测微生物学与水产品的安全控制[J]. 安徽农学通报, 2013,19(11): 25-26.
[6] PAW D, Fresh and lightly preserved seafood[C]//Man C M D, Jones A A. Shelf life evaluation of foods, USA: Aspen Publish_ers Inc, 2000:110-139.
[7] SHOKRI S, EHSANI A, JASOUR M S. Efficacy of Lactoperoxidase system-whey protein coating on shelf-life extension of rainbow trout fillets during cold storage(4 ℃) [J]. Food and Bioprocess Technology, 2015, 8(1):54-62.
[8] CASABURI A, DI MARTINO V, FERRANTI P, et al. Technological properties and bacteriocins production by Lactobacillus curvatus 54M16 and its use as starter culture for fermented sausage manufacture [J]. Food Control, 2016, 59: 31-45.
[9] LYU Xinran, DU Jingfang, JIE Yu, et al. Purification and antibacterial mechanism of fish-borne bacteriocin and its application in shrimp (Penaeus vannamei) for inhibiting Vibrio parahaemolyticus [J]. World Journal of Microbiology and Biotechnology, 2017,33(8): 156.
[10] 吕欣然, 白凤翎,励建荣.乳酸菌生物保鲜在水产品中的应用研究进展[J]. 食品工业科技, 2014,35(2):340-345.
[11] GALOTTO M J, VALENZUELA X, RODRIGUEZ F, et al. Evaluation of the effectiveness of a new antimicrobial active packaging for fresh Atlantic salmon (Salmo Salar L.) shelf life[J]. Packaging Technology and Science, 2012, 25(6):363-372.
[12] HWANHLEM N, H-KITTIKUN A. Biopreservation of Seafood by Using Bacteriocins and Bacteriocinogenic Lactic Acid Bacteria as Potential Bio-control Agents[M].Beneficial Microorganicsms in Agriculture, Aquaculture and Other Areas: Springer Cham, 2015:183-213.
[13] 王硕, 谢晶,刘爱芳.生物保鲜技术在海产品中的应用及展望[J]. 包装工程, 2017, 38(1): 137-142.
[14] HWANHLEM N, JAFFR S E, DOUSSET X, et al. Application of a nisin Z-producing Lactococcus lactis subsp. lactis KT2W2L isolated from brackish water for biopreservation in cooked, peeled and ionized tropical shrimps during storage at 8 ℃ under modified atmosphere packaging[J]. European Food Research and Technology, 2015, 240(6):1 259-1 269.
S E, DOUSSET X, et al. Application of a nisin Z-producing Lactococcus lactis subsp. lactis KT2W2L isolated from brackish water for biopreservation in cooked, peeled and ionized tropical shrimps during storage at 8 ℃ under modified atmosphere packaging[J]. European Food Research and Technology, 2015, 240(6):1 259-1 269.
[15] 雷涛.生物防腐剂在食品加工中的应用[J].食品安全导刊,2017(36):44.
[16] HA T Q, HOA T M T. Selection of lactic acid bacteria producing bacteriocin[J]. Journal of Vietnammese Environment, 2016, 5(8):271-276.
[17] LYU Xinran, MA Huanhuan, SUN Mengtong, et al. A novel bacteriocin DY4-2 produced by Lactobacillus plantarum from cutlassfish and its application as bio-preservative for the control of Pseudomonas fluorescens in fresh turbot (Scophthalmus maximus) fillets[J]. Food Control, 2018, 89:22-31.
[18] HWANHLEM N, IVANOVA T, BISCOLA V, et al. Bacteriocin producing, Enterococcus faecalis, isolated from chicken gastrointestinal tract originating from Phitsanulok, Thailand: Isolation, screening, safety evaluation and probiotic properties[J]. Food Control, 2017, 78:187-195.
[19] ZOU Jiong, JIANG Han, CHENG Hui, et al. Strategies for screening, purification and characterization of bacteriocins[J]. International Journal of Biological Macromolecules, 2018, 117:781-789.
[20] MARCOS B, AYMERICH T, GARRIGA M, et al. Active packaging containing nisin and high pressure processing as post-processing listericidal treatments for convenience fermented sausages[J]. Food Control, 2013, 30(1):325-330.
[21] G MEZ-SALA B, MU
MEZ-SALA B, MU OZ-ATIENZA E, S
OZ-ATIENZA E, S NCHEZ J, et al. Bacteriocin production by lactic acid bacteria isolated from fish, seafood and fish products [J]. European Food Research and Technology, 2015. 241(3): 341-356.
NCHEZ J, et al. Bacteriocin production by lactic acid bacteria isolated from fish, seafood and fish products [J]. European Food Research and Technology, 2015. 241(3): 341-356.
[22] JEPPESEN V F, HUSS H H. Characteristics and antagonistic activity of lactic acid bacteria isolated from chilled fish products [J]. International Journal of Food Microbiology, 1993, 18(4): 305-320.
[23] 董韩博, 谢晶,钱韻芳,等, 带鱼肠道中抑菌性乳酸菌的筛选和抑菌效应分析[J]. 食品与发酵工业, 2016, 42(12): 32-37.
[24] MIAO Jianyin, GUO Haoxian, OU Yangwen, et al. Purification and characterization of bacteriocin F1, a novel bacteriocin produced by Lactobacillus paracasei subsp. tolerans FX-6 from Tibetan kefir, a traditional fermented milk from Tibet, China [J]. Food Control, 2014, 42: 48-53.
[25] 孙杰, 姜杰,冯彬斌,等. 一株产细菌素乳酸菌的筛选及其细菌素特性研究[J]. 食品与发酵工业, 2018, 44(9): 48-52.
[26] 府伟灵. 氯化钠-七叶苷水解试验快速鉴定肠球菌[J]. 临床检验杂志, 1989(1): 20.