随着人们生活水平的提高,消费者对于食品的品质、营养、风味和货架期等方面的要求也在逐渐提高。已有研究表明,水产品在贮藏的过程中发生了一系列的生物化学反应,导致肌肉品质的下降,而温度正是影响其新鲜度和货架期最重要的可控因素[1]。低温贮藏是水产品保鲜普遍采用的一种方法,通过抑制多种微生物的生长繁殖和鱼体自身酶的活性来减缓肌肉在贮藏过程中鲜度的降低速率[2],同时能较好地保持粗脂肪、粗灰分等营养物质的含量[3-4]。类似的结果在鲫鱼[5]、齐口裂腹鱼[6]、鲢[7]、团头鲂[8]、小黄鱼[9]、南方大口鲇[10]等鱼类中得到印证。目前,有关鱼类死后肌肉在不同贮藏温度下的变化主要集中在品质方面,而有关其营养成分变化的研究相对较少。
白乌鳢(Opniocepnalus argus var)又叫白甲乌鳢,俗称白乌鱼、白鱼,体色较浅呈灰白色,主要分布在四川省嘉陵江中下游流域[11]。白乌鳢肌肉中的必需氨基酸组成均衡、多不饱和脂肪酸及矿物质含量丰富,有着一定的保健功能和促进伤口愈合等功效[12],同时与乌鳢相比,具有较高的营养价值,特别是高不饱和脂肪酸[13-14]。又因其肉质肥美,口感较佳,具有一定观赏价值,从而深受消费者的喜爱,为我国重要的经济养殖鱼类之一。目前,仅有少量关于白乌鳢肌肉化学组成成分的研究[14-15],有关其在不同贮藏温度过程中肌肉品质和营养成分变化的研究还未见报道。
因此,本文采用白乌鳢作为试验对象,研究其肌肉品质和营养成分在4、0和-20 ℃贮藏24、48和72 h后的变化情况,为白乌鳢的短期储存选择合适的温度及预测其在不同贮藏温度下的保鲜期提供一定的参考。
1 材料与方法
1.1 试验材料
试验用白乌鳢购买于四川省内江市农业科学院水产研究所,共30尾,鱼的平均体重为(309.46±16.78) g,平均体长为(30.10±1.26) cm,于运回当天进行取样。将试验鱼敲击头部致晕,去除鳞片和内脏,取脊椎两侧全部肌肉,用无菌水洗净擦干,去皮后切成2~3 cm肉片放入样品袋。随机选择3尾鱼的肌肉作为新鲜对照组,直接测定样品的各项指标;其余27尾鱼的肌肉随机分成3组(9尾/组),分别置于4、0和-20 ℃条件下保存,每隔24 h取样。每组每次随机取3尾鱼的肌肉测定各指标,每个指标均重复测定3次。
1.2 试验方法
pH值的测定:参照GB/T 9695.5—2008《肉与肉制品pH测定》的方法;
剪切力、持水力、明度、红度和黄度的测定:参考NY/T 2793—2015《肉的食用品质客观评价方法》;
含水量的测定:参照GB 5009.3—2010《食品中水分的测定》的直接干燥法;
TVB-N含量的测定:参考GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》的半微量定氮法;
粗蛋白的测定:参照GB/T 5009.5—2010《食品中蛋白质的测定》的半微量凯氏定氮法;
粗脂肪的测定:参考GB/T 14772—2008《食品中粗脂肪的测定》的索氏抽提法;
粗灰分的测定:参照GB/T 5009.4—2010《食品中灰分的测定》的方法;
氨基酸的测定:参照GB/T 5009.124-2003《食品中氨基酸的测定》的方法;
脂肪酸的测定:参考GB/T 9695.2—2008《肉与肉制品脂肪酸测定》的气相色谱法;
矿物质的测定:参照采用NY/T 1653—2008《食品中微量元素的测定》中的电感耦合等离子发射光谱法。
1.3 数据处理
试验数据均以平均值±标准误差(mean±SD)表示。使用SPSS 16.0进行多重比较分析。每个指标重复测定3次。
2 结果与分析
2.1 肌肉品质分析
本次试验测定的肌肉品质指标有pH、红度、明度、黄度、持水率、剪切力和TVB-N(见表1)。已有研究表明,部分水产品肌肉的pH值随着鲜度的降低而降低[16]。如表1所示,不同贮藏温度下,随着贮藏时间的增加pH值呈下降趋势,且在相同贮藏时间中,贮藏温度越高,pH值则越低,24 h后差异显著(P<0.05)。 此外,在4 ℃条件下贮藏72 h,肌肉的pH值略有上升。该试验结果与陈思等[17]关于白鲢鱼片在不同贮藏温度下鲜度和品质变化的研究结果一致。贮藏前期导致pH下降的原因可能是肌肉中的糖原分解产生乳酸及伴随着ATP分解产生游离磷酸基、肌苷酸等[18],而低温则抑制了相关酶的活性,使得pH下降速度变慢。随着贮藏时间的延长,4 ℃贮藏条件下的肌肉pH略有上升,可能是与微生物繁殖过程中产生胺类等碱性物质有关,具体机制还有待进一步研究。
红度、明度和黄度则表示肌肉表面的色泽,经常被用来评价肌肉的新鲜程度,与人的感官评定相比,红度、明度和黄度使感官指标量化,提高了数据的准确性。由表1可以看出,肌肉的明度、黄度值均随贮藏时间的延长而显著增加,而红度值显著降低(P<0.05)。尤其在4℃的贮藏条件下,红度、明度和黄度值变化最大。随着肌肉品质的下降,肌肉表面会变得缺乏光泽,该结果与青鱼[18]、虹鳟[19]的研究结果相似。因此,低温有利于保持白乌鳢肌肉的色泽。
持水力是指肌肉受到外力作用下保持肌肉原有水分的能力[20]。本次试验以蒸煮损失率来判定白乌鳢肌肉的持水能力,结果表明,蒸煮损失率随着贮藏时间的延长而升高,肌肉在4 ℃贮藏条件下蒸煮损失率上升速度最快,且48 h后差异显著(P<0.05)。在0 ℃和-20 ℃条件下的蒸煮损失率变化相对平缓。该试验结果表明,低温有利于维持白乌鳢肌肉的持水力。国内外已有研究表明,肌肉在贮藏过程中,随着贮藏时间的延长,蛋白质结构逐渐被破坏,导致持水力的下降,可以间接地反映出肌肉品质[21-23]。
鱼肉剪切力的测定可以直观地反映出鱼肉质地的优劣[24],贮藏温度及冻结过程是造成鱼肉质地变化的主要原因[25-26]。由表1可以看出,在4 ℃贮藏环境中,鱼肉的剪切力从24 h后开始显著下降(P<0.05)。在0 ℃和-20 ℃的贮藏环境下剪切力下降速度相对较缓慢,分别在72 h后达到差异显著(P<0.05)。在4 ℃和0 ℃贮藏条件下,白乌鳢肌肉可能是受到内源性酶和微生物的作用导致肌肉蛋白质的降解,从而使剪切力下降,温度越低则越能减缓此过程[18]。但在-20 ℃贮藏条件下,可能是由于肌肉中的游离水形成冰晶,使肌肉组织发生冻结浓缩和体积膨胀的变化,同样会使得肌肉蛋白质变性,导致肌肉剪切力的下降[4]。
TVB-N表示肌肉蛋白质在细菌和内源性酶的作用下分解产生的胺类、氨等碱性含氮物质,常作为评价肉类腐败程度的常用指标[27]。根据GB 2736.3—1994中卫生标准要求,淡水鱼的挥发性盐基氮的质量分数限量值不能高于20 mg/100g。本次试验结果表明,白乌鳢肌肉在4、0和-20 ℃条件下贮藏72 h后TVB-N值分别为13.01、10.46、9.95 mg/100 g,均符合卫生标准要求。贮藏过程中,相同贮藏时间内,TVB-N随着温度的升高而升高,相同贮藏温度下,随着时间的延长而升高。在4 ℃的贮藏条件下,随着时间延长,24 h后TVB-N显著升高(P<0.05),0和-20 ℃ 贮藏条件下的上升趋势则较为平缓。该研究结果与宋永令等[8]在团头鲂上的研究结果一致。因此,低温贮藏能有效减缓TVB-N的升高速度,有利于保持白乌鳢肌肉的品质。
表1 不同贮藏温度下白乌鳢肌肉的pH、明度、红度、黄度、持水率、剪切力以及TVB-N的变化
Table 1 Change of pH,whiteness,redness,yellowness,water holding rate,shear force and TVB-N for Opniocepnalus argus var muscle under the different storage temperature

贮藏温度/℃贮藏时间/hpH值红度(a)明度(L)黄度(b)蒸煮损失率/%剪切力/NTVB-N/[mg·(100 g)-1]407.06±0.03a-1.50±0.31a42.90±3.70d5.58±2.53c0.77±0.01c7.87±2.04a9.13±0.15d246.71±0.10by-1.60±0.26b46.47±2.67c6.28±0.28c0.83±0.06c7.03±1.86b10.23±0.03c486.26±0.22cy-1.66±0.04by50.30±0.75bx7.70±1.09bx0.91±0.09bx6.52±1.53bc11.47±0.17bx726.35±0.22cy-1.78±0.56cz57.13±3.66ax9.53±1.79ax0.98±0.03ax5.86±2.01cy13.01±0.16ax007.06±0.03-1.50±0.31a42.90±3.70b5.58±2.53b0.77±0.017.87±2.04a9.13±0.15b246.99±0.15x-1.55±0.14a43.80±2.97b6.10±1.41b0.78±0.077.55±1.38a9.51±0.04b486.91±0.22x-1.57±0.06ax45.60±1.75aby6.84±1.78aby0.81±0.04y7.18±2.21a9.81±0.12aby726.83±0.04x-1.69±0.24by47.28±3.33ay7.06±0.41ay0.83±0.07y6.93±1.88bx10.46±0.13ay-2007.06±0.03-1.50±0.3142.90±3.705.58±2.530.77±0.017.87±2.04a9.13±0.15247.02±0.04x-1.52±0.0243.21±2.025.83±0.590.79±0.097.31±1.23a9.39±0.06486.97±0.01x-1.53±0.11x44.30±1.12y6.12±4.05y0.82±0.01y7.03±1.58a9.63±0.11y726.94±0.08x-1.57±0.21x45.73±0.56y6.41±0.91y0.87±0.03y6.81±1.62bx9.95±0.08y
注:同一列中,a、b、c表示相同贮藏温度不同贮藏时间之间差异显著(P<0.05),x、y、z表示相同贮藏时间不同贮藏温度之间差异显著(P<0.05)。下表同。
2.2 常规营养组分分析
本次试验结果表明,白乌鳢肌肉随着贮藏时间的延长,其水分、粗灰分、粗蛋白和粗脂肪具有不同程度的下降。其中在4 ℃的贮藏条件下,肌肉的4种常规营养成分的下降幅度最大,48 h后差异显著(P<0.05), 在0和-20 ℃贮藏条件下各营养组分含量变化较小。贮藏72 h后,0 ℃贮藏条件下肌肉各营养组分含量与-20 ℃贮藏条件下的肌肉相比差异不显著(P>0.05)(见表2)。该试验结果表明低温有助于减慢肌肉各常规营养成分含量的降低速度,较好地保持白乌鳢肌肉的营养价值。其原因可能是低温能减少某些微生物的生长活动及酶的活性,从而减慢对蛋白质,脂肪等营养物质的分解速度,同时能较好地保持肌肉的结合水能力,保持较高的含水量。食品中的粗灰分有常量和微量元素,这些元素在贮藏过程中变化极小,该含量随着贮藏时间的延长而降低的原因可能与肌肉持水力的下降有关,随着水分的流失而降低。该试验结果与在酱鱼[28]、草鱼[4]上的研究结果一致。
表2 不同贮藏温度下白乌鳢肌肉常规营养组分的变化
Table 2 Change of conventional nutritive composition for Opniocepnalus argus var muscle under the different storage temperature

贮藏温度/℃贮藏时间/h含水率/%粗灰分/%粗蛋白/%粗脂肪/%4077.81±0.88a4.45±0.32a12.11±1.10a9.56±1.71a2474.23±1.66a4.41±0.45a12.03±1.66a9.21±1.21a4862.44±1.34by4.23±0.14ab11.05±1.45by8.26±0.33by7251.33±1.48cy4.11±0.33by10.02±1.03cy7.55±1.02cy0077.81±0.884.45±0.3212.11±1.109.56±1.712475.65±0.794.43±0.4012.10±1.109.47±1.014872.32±1.27x4.40±0.1812.04±1.22x9.32±0.91x7269.84±1.25x4.39±0.50x11.86±1.06x9.11±0.98x-20077.81±0.884.45±0.3212.11±1.109.56±1.712476.59±1.274.44±0.2312.11±1.079.53±1.214875.62±0.89x4.42±0.4112.08±1.03x9.51±1.06x7272.31±1.20x4.41±0.26x12.05±1.25x9.45±0.92x
2.3 氨基酸组成及含量变化
如表3所示,白乌鳢肌肉中共检测出17种氨基酸,其中有7种必需氨基酸,2种半必需氨基酸和8种非必须氨基酸。试验结果显示氨基酸的总量随着贮藏时间的增加呈现先升高后降低的趋势。其中-20 ℃ 贮藏条件下的肌肉氨基酸总量随时间的变化差异不显著(P>0.05)。0 ℃条件下贮藏72h后,氨基酸总量变化差异不显著(P>0.05)。在4 ℃贮藏条件下,肌肉氨基酸的变化下降趋势最明显,48 h后白乌鳢肌肉的氨基酸总量呈显著性下降(P<0.05)。肌肉中必需氨基酸与氨基酸总量的比值(EAA/TAA)随着贮藏时间的延长而逐渐降低,贮藏72 h后4、0和-20 ℃贮藏条件下EAA/TAA分别为38.76、40.35、40.57。在EAA/TAA的值上,0 ℃和-20 ℃的值均大于40%,与WHO/FAO规定的EAA/TAA=40%最接近[29]。贮藏过程中,氨基酸总量先升高后降低的原因可能是汁液损失导致含量升高。随着温度的升高,微生物的生长和繁殖活动增强,导致肌肉中氨基酸在微生物酶的作用下分解速度加快。因此,低温有利于抑制微生物的活动,从而减慢氨基酸的分解速度,维持白乌鳢肌肉的营养成分。
表3 不同贮藏温度下白乌鳢肌肉氨基酸含量的变化 单位:%(质量分数)
Table 3 Change of amino acids content for Opniocepnalus argus var muscle under the different storage temperature

氨基酸 4 ℃0 ℃-20 ℃新鲜肌肉24 h48 h72 h新鲜肌肉24 h48 h72 h新鲜肌肉24 h48 h72 h天门冬氨酸Asp9.03±1.029.18±0.988.97±0.558.84±0.879.03±1.029.08±1.059.02±1.128.97±1.069.03±1.029.04±0.889.06±1.219.02±0.67谷氨酸Glu8.70±1.01a8.85±0.98a8.79±1.21a7.52±1.06by8.7±1.018.76±1.148.72±0.888.66±0.75x8.7±1.018.72±0.868.75±0.918.71±0.95x胱氨酸Cys1.34±0.03a1.35±0.10ax1.18±0.04bz1.07±0.01cz1.34±0.03a1.29±0.06ay1.23±0.05aby1.18±0.03by1.34±0.031.32±0.08xy1.29±0.05x1.28±0.04x丝氨酸Scr3.30±0.21a3.25±0.25a2.90±0.16by2.58±0.13cz3.3±0.21a3.32±0.09a3.28±0.10abx3.23±0.08by3.3±0.213.31±0.143.35±0.18x3.38±0.07x甘氨酸Gly4.65±0.11a4.78±0.09a4.54±0.13ay3.12±0.56by4.65±0.114.69±1.054.61±1.12x4.58±0.98x4.65±0.114.66±0.674.68±1.29x4.63±0.87x组氨酸His2.17±0.06a2.23±0.04ax1.92±0.02by1.52±0.05cy2.17±0.06a2.12±0.07ay2.06±0.04abx2.01±0.07bx2.17±0.062.15±0.06y2.14±0.12x2.11±0.08x精氨酸Arg6.30±0.95a6.38±0.68a6.18±1.01a5.78±0.95by6.3±0.956.35±0.466.31±0.576.25±0.65x6.3±0.956.33±0.826.31±0.746.28±1.11x苏氨酸Thr∗∗3.81±0.15a3.88±0.12a3.39±0.09by2.96±0.05cz3.81±0.15a3.86±0.11a3.80±0.08abx3.75±0.09bx3.81±0.153.82±0.133.80±0.07x3.77±0.09x丙氨酸Ala4.72±0.21a4.82±0.23a4.29±0.16by3.22±0.14cy4.72±0.214.76±0.114.68±0.21x4.62±0.13x4.72±0.214.74±0.154.72±0.17x4.70±0.18x脯氨酸Pro2.95±0.05b3.11±0.08a2.67±0.12cy2.08±0.06dy2.95±0.05b3.06±0.04a2.91±0.11bx2.85±0.23cx2.95±0.052.98±0.102.96±0.09x2.91±0.07x络氨酸Tyr2.64±0.03a2.72±0.05a2.41±0.06by2.08±0.01cy2.64±0.03a2.69±0.04a2.64±0.13ax2.58±0.07bx2.64±0.032.66±0.052.62±0.09x2.59±0.04x缬氨酸Val∗∗4.08±0.17a4.15±0.13a3.88±0.09b3.17±0.11cy4.08±0.17a4.13±0.13a4.07±0.08a3.88±0.23bx4.08±0.174.09±0.154.06±0.174.02±0.13x蛋氨酸Met∗∗2.32±0.06a2.25±0.04a2.09±0.05b1.8±0.02cy2.32±0.06a2.25±0.07b2.21±0.06b2.16±0.08cx2.32±0.06a2.31±0.04a2.25±0.03ab2.23±0.05bx异亮氨酸Ile∗∗3.95±0.13a3.85±0.09a3.67±0.15by3.31±0.08cz3.95±0.13a3.92±0.11a3.89±0.16ax3.61±0.21by3.95±0.133.92±0.133.88±0.24x3.86±0.12x亮氨酸Leu∗∗6.05±0.45a6.13±0.58a5.68±0.23b4.68±0.34cy6.05±0.456.09±0.226.06±0.166.02±0.33x6.05±0.456.06±0.216.08±0.196.09±0.16x苯丙氨酸Phe∗∗3.40±0.14a3.41±0.09a2.88±0.07by2.65±0.10cy3.40±0.14a3.37±0.08a3.33±0.16ax3.28±0.15bx3.40±0.143.39±0.113.36±0.15x3.35±0.09x赖氨酸Lys∗∗7.80±0.65a7.93±0.54a6.46±0.49b5.36±0.33cy7.80±0.657.85±0.427.74±0.347.69±0.28x7.80±0.657.81±0.217.79±0.257.75±0.36x氨基酸总量WTAA77.21±3.15a78.27±2.86a71.90±3.21by61.74±2.95cy77.21±3.1577.59±1.9576.56±2.46x74.32±3.01x77.21±3.1577.31±2.4377.10±1.68x76.58±1.57x必需氨基酸WEAA31.41±1.01a31.60±1.10a28.05±0.98b23.93±0.79cy31.41±1.0131.47±1.0331.10±1.0529.39±2.95x31.41±1.0131.40±1.0231.22±0.8831.07±1.06x半必须氨酸WHEAA8.47±0.23a8.61±0.19a8.10±0.15b7.30±0.20cy8.47±0.238.47±0.248.37±0.238.26±0.18x8.47±0.238.48±0.158.45±0.138.39±0.19x非必需氨基酸WNEAA37.33±1.05a38.06±1.11a35.75±1.08b30.51±1.06cy37.33±1.0537.65±1.0737.09±1.0536.67±0.98x37.33±1.0537.43±1.1937.43±1.1437.12±1.04x鲜味氨基酸WDAA27.10±0.98a27.63±0.87a26.59±1.03a22.70±0.94by27.10±0.9827.29±0.9327.03±0.8426.83±1.13x27.10±0.9827.16±0.6527.21±1.0627.06±1.08xWEAA/NEAA84.141 441 283.026 799 7978.461 538 4678.433 300 5684.141 441 283.585 657 3783.850 094 3782.874 284 1684.141 441 283.889 927 8783.409 301 983.701 508 62WEAA/TAA40.681 258 940.373 067 5939.012 517 9338.759 313 2540.681 258 940.559 350 4340.621 734 5940.347 8491 840.681 258 940.615 703 0140.492 866 4140.571 950 9WDAA/TAA35.099 080 4335.300 881 5636.981 919 3336.767 087 7935.099 080 4335.172 058 2535.305 642 3635.621 348 9135.099 080 4335.131 289 6135.291 828 7935.335 596 76WBCAA/AAA1.714 981 731.690 191 3881.834 951 4561.785 61.714 981 731.728 606 3571.745 952 6771.716 645 4891.714 981 731.715 853 6591.726 600 9851.735 403 27
注:**表示必需氨基酸;同一行中,a、b、c、d表示相同贮藏温度不同贮藏时间之间差异显著(P<0.05),x、y、z表示相同贮藏时间不同贮藏温度之间差异显著(P<0.05),下表同。
2.4 脂肪酸组成及含量变化
如表4所示,白乌鳢肌肉样品中共检测出11种脂肪酸,其中棕榈酸、油酸、硬脂酸和亚油酸的含量较高。随着贮藏时间的延长,各脂肪酸整体呈现下降的趋势。在4 ℃贮藏条件下,除棕榈酸、油酸外,其余脂肪酸均随时间的延长而呈显著性下降(P<0.05)。0 ℃ 贮藏条件下,仅肉豆蔻酸、花生酸和二十碳五烯酸在24 h后呈显著性下降(P<0.05),其余脂肪酸含量随时间的延长差异不显著(P>0.05)。而-20 ℃贮藏下肌肉各脂肪酸含量差异均不显著(P<0.05)。此外,从脂肪酸类型比较而言,4 ℃贮藏下肌肉的饱和脂肪酸、总单不饱和脂肪酸、总多不饱和脂肪酸的含量均随时间的延长呈显著性的下降(P<0.05)。0和-20 ℃的各类脂肪酸的下降趋势相对较平缓。可能是随着贮藏时间的延长,微生物对脂肪的氧化分解作用使脂肪酸含量下降,而低温能抑制微生物的活动。已有研究表明,食物中的多不饱和脂肪酸不仅具有调节人体脂质代谢、血液黏稠度的功能,还可以调节心脏功能和增强防御系统[30]。SIMOPOULOS等[31]和KINSELLA等[32]的研究表明,n-3/n-6的比例越高,预防心血管和神经系统疾病的效果越好,同时可以降低癌症和心血管疾病发生的风险。在本次试验中,4、0和-20 ℃贮藏72 h后n-3/n-6的比值分别为0.70、0.72、 0.73。同时,鱼类作为人体获取EPA和DHA的重要来源,高含量的EPA+DHA对预防中风、心血管等疾病具有较好的效果[33-34]。在贮藏过程中,EPA+DHA从高到低的顺序为-20 ℃>0 ℃>4 ℃。本次试验结果表明,低温贮藏有利于减少白乌鳢肌肉营养的损失。
表4 不同贮藏温度下白乌鳢肌肉脂肪酸含量的变化 单位:%(质量分数)
Table 4 Change of fatty acid content for Opniocepnalus argus var muscle under the different storage temperature
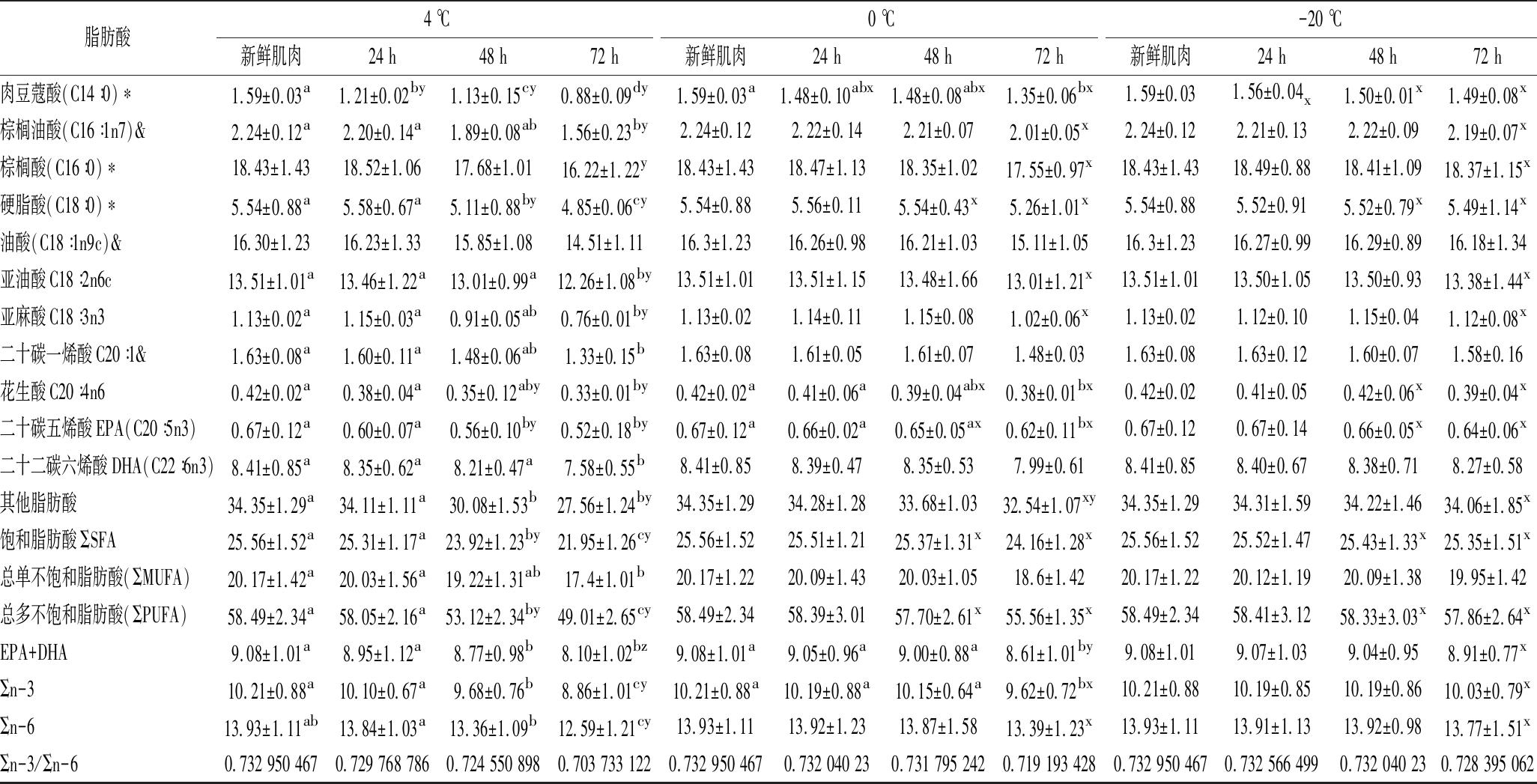
脂肪酸4 ℃0 ℃-20 ℃新鲜肌肉24 h48 h72 h新鲜肌肉24 h48 h72 h新鲜肌肉24 h48 h72 h肉豆蔻酸(C14∶0)∗1.59±0.03a1.21±0.02by1.13±0.15cy0.88±0.09dy1.59±0.03a1.48±0.10abx1.48±0.08abx1.35±0.06bx1.59±0.031.56±0.04x1.50±0.01x1.49±0.08x棕榈油酸(C16∶1n7)&2.24±0.12a2.20±0.14a1.89±0.08ab1.56±0.23by2.24±0.122.22±0.142.21±0.072.01±0.05x2.24±0.122.21±0.132.22±0.092.19±0.07x棕榈酸(C16∶0)∗18.43±1.4318.52±1.0617.68±1.0116.22±1.22y18.43±1.4318.47±1.1318.35±1.0217.55±0.97x18.43±1.4318.49±0.8818.41±1.0918.37±1.15x硬脂酸(C18∶0)∗5.54±0.88a5.58±0.67a5.11±0.88by4.85±0.06cy5.54±0.885.56±0.115.54±0.43x5.26±1.01x5.54±0.885.52±0.915.52±0.79x5.49±1.14x油酸(C18∶1n9c)&16.30±1.2316.23±1.3315.85±1.0814.51±1.1116.3±1.2316.26±0.9816.21±1.0315.11±1.0516.3±1.2316.27±0.9916.29±0.8916.18±1.34亚油酸C18∶2n6c13.51±1.01a13.46±1.22a13.01±0.99a12.26±1.08by13.51±1.0113.51±1.1513.48±1.6613.01±1.21x13.51±1.0113.50±1.0513.50±0.9313.38±1.44x亚麻酸C18∶3n31.13±0.02a1.15±0.03a0.91±0.05ab0.76±0.01by1.13±0.021.14±0.111.15±0.081.02±0.06x1.13±0.021.12±0.101.15±0.041.12±0.08x二十碳一烯酸C20∶1&1.63±0.08a1.60±0.11a1.48±0.06ab1.33±0.15b1.63±0.081.61±0.051.61±0.071.48±0.031.63±0.081.63±0.121.60±0.071.58±0.16花生酸C20∶4n60.42±0.02a0.38±0.04a0.35±0.12aby0.33±0.01by0.42±0.02a0.41±0.06a0.39±0.04abx0.38±0.01bx0.42±0.020.41±0.050.42±0.06x0.39±0.04x二十碳五烯酸EPA(C20∶5n3)0.67±0.12a0.60±0.07a0.56±0.10by0.52±0.18by0.67±0.12a0.66±0.02a0.65±0.05ax0.62±0.11bx0.67±0.120.67±0.140.66±0.05x0.64±0.06x二十二碳六烯酸DHA(C22∶6n3)8.41±0.85a8.35±0.62a8.21±0.47a7.58±0.55b8.41±0.858.39±0.478.35±0.537.99±0.618.41±0.858.40±0.678.38±0.718.27±0.58其他脂肪酸34.35±1.29a34.11±1.11a30.08±1.53b27.56±1.24by34.35±1.2934.28±1.2833.68±1.0332.54±1.07xy34.35±1.2934.31±1.5934.22±1.4634.06±1.85x饱和脂肪酸ΣSFA25.56±1.52a25.31±1.17a23.92±1.23by21.95±1.26cy25.56±1.5225.51±1.2125.37±1.31x24.16±1.28x25.56±1.5225.52±1.4725.43±1.33x25.35±1.51x总单不饱和脂肪酸(ΣMUFA)20.17±1.42a20.03±1.56a19.22±1.31ab17.4±1.01b20.17±1.2220.09±1.4320.03±1.0518.6±1.4220.17±1.2220.12±1.1920.09±1.3819.95±1.42总多不饱和脂肪酸(ΣPUFA)58.49±2.34a58.05±2.16a53.12±2.34by49.01±2.65cy58.49±2.3458.39±3.0157.70±2.61x55.56±1.35x58.49±2.3458.41±3.1258.33±3.03x57.86±2.64xEPA+DHA9.08±1.01a8.95±1.12a8.77±0.98b8.10±1.02bz9.08±1.01a9.05±0.96a9.00±0.88a8.61±1.01by9.08±1.019.07±1.039.04±0.958.91±0.77xΣn-310.21±0.88a10.10±0.67a9.68±0.76b8.86±1.01cy10.21±0.88a10.19±0.88a10.15±0.64a9.62±0.72bx10.21±0.8810.19±0.8510.19±0.8610.03±0.79xΣn-613.93±1.11ab13.84±1.03a13.36±1.09b12.59±1.21cy13.93±1.1113.92±1.2313.87±1.5813.39±1.23x13.93±1.1113.91±1.1313.92±0.9813.77±1.51xΣn-3/Σn-60.732 950 4670.729 768 7860.724 550 8980.703 733 1220.732 950 4670.732 040 230.731 795 2420.719 193 4280.732 950 4670.732 566 4990.732 040 230.728 395 062
注:*表示饱和脂肪酸;&表示单不饱和脂肪酸。
2.5 矿物质组成及含量变化
如表5所示,白乌鳢肌肉中矿物质含量以K、P最高,其次为Ca、Na和Mg。在4 ℃贮藏条件下,Ca、P、Fe和Cu含量随着贮藏时间的延长呈显著性的下降(P<0.05),0和-20 ℃贮藏条件下的肌肉中各矿物质含量变化差异不显著(P>0.05)。在贮藏过程中,肌肉矿物质含量的下降可能是由于贮藏过程中汁液流失导致的。肌肉中的常量元素和微量元素在维持集体的正常生理功能和保障人体健康方面具有重要作用[35]。丰富的K、Na能维持细胞内渗透压和体液的酸碱平衡,Ca元素可以促进骨骼的生长,P元素则是组成细胞不可缺少的成分,对维持机体渗透压和酸碱平衡具有重要的作用[36-37]。Fe元素作为血红蛋白的重要组成成分,对血液输送氧气和交换氧气具有重要作用,Cu元素则在生物体内参与维持正常的造血机能、促进黑色素形成等多种生理活动和代谢过程[38-39]。因此,低温能减少贮藏过程中矿物质元素的损失,而保持白乌鳢肌肉的营养价值。
表5 不同贮藏温度下白乌鳢肌肉矿物质含量的变化 单位:mg/kg
Table 5 Change of some minerals content for Opniocepnalus argus var muscle under the different storage temperature
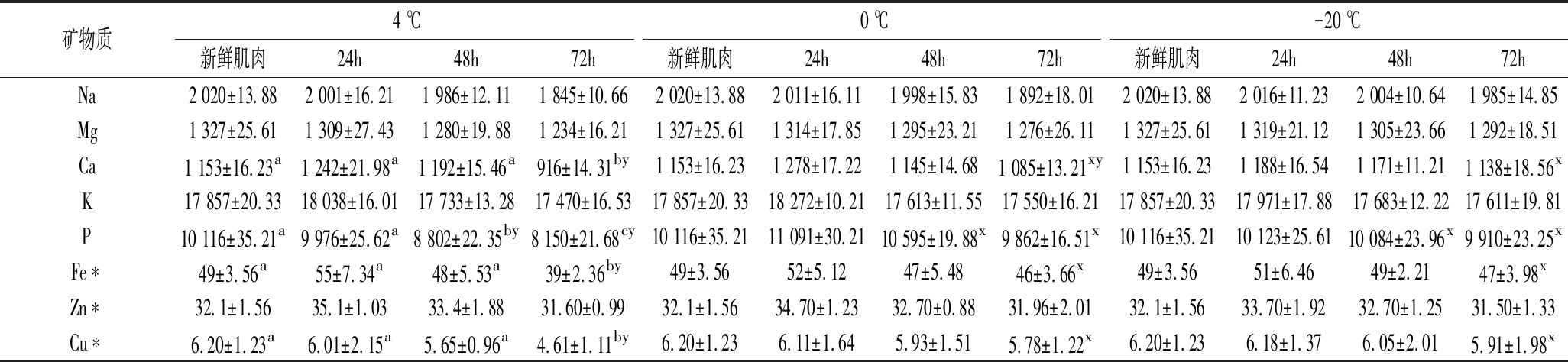
矿物质4 ℃0 ℃-20 ℃新鲜肌肉24h48h72h新鲜肌肉24h48h72h新鲜肌肉24h48h72hNa2 020±13.882 001±16.211 986±12.111 845±10.662 020±13.882 011±16.111 998±15.831 892±18.012 020±13.882 016±11.232 004±10.641 985±14.85Mg1 327±25.611 309±27.431 280±19.881 234±16.211 327±25.611 314±17.851 295±23.211 276±26.111 327±25.611 319±21.121 305±23.661 292±18.51Ca1 153±16.23a1 242±21.98a1 192±15.46a916±14.31by1 153±16.231 278±17.221 145±14.681 085±13.21xy1 153±16.231 188±16.541 171±11.211 138±18.56xK17 857±20.3318 038±16.0117 733±13.2817 470±16.5317 857±20.3318 272±10.2117 613±11.5517 550±16.2117 857±20.3317 971±17.8817 683±12.2217 611±19.81P10 116±35.21a9 976±25.62a8 802±22.35by8 150±21.68cy10 116±35.2111 091±30.2110 595±19.88x9 862±16.51x10 116±35.2110 123±25.6110 084±23.96x9 910±23.25xFe∗49±3.56a55±7.34a48±5.53a39±2.36by49±3.5652±5.1247±5.4846±3.66x49±3.5651±6.4649±2.2147±3.98xZn∗32.1±1.5635.1±1.0333.4±1.8831.60±0.9932.1±1.5634.70±1.2332.70±0.8831.96±2.0132.1±1.5633.70±1.9232.70±1.2531.50±1.33Cu∗6.20±1.23a6.01±2.15a5.65±0.96a4.61±1.11by6.20±1.236.11±1.645.93±1.515.78±1.22x6.20±1.236.18±1.376.05±2.015.91±1.98x
注:*表示微量元素。
3 结论
通过对0、4和-20 ℃贮藏24、48和72 h后白乌鳢肌肉的pH、红度、明度、黄度、持水力、剪切力和TVB-N等肌肉品质指标及水分、粗脂肪、粗灰分、粗蛋白、氨基酸、脂肪酸和矿物质等营养成分进行综合分析,研究结果表明,白乌鳢肌肉的品质和营养价值变化与贮藏时间及温度密切相关。不同贮藏温度条件下的白乌鳢肌肉TVB-N值、亮度、黄度和蒸煮损失率随着贮藏时间的延长而逐渐上升,pH、红度和剪切力呈现下降的趋势,且温度越高,变化的速率越快,其中4 ℃贮藏条件下,pH在贮藏72 h后略有上升。在0和-20 ℃条件下贮藏72 h均能较好地保持肌肉的品质,减缓TVB-N值的上升。同样,白乌鳢肌肉的常规营养成分和氨基酸、脂肪酸、矿物质在-20 ℃条件下贮藏72 h后基本保持不变,0 ℃贮藏条件下的肌肉各营养成分略有下降,均显著高于4 ℃条件下的肌肉(P<0.05)。因此,贮藏过程中,低温可以较好地保持白乌鳢肌肉的品质和营养成分,短期贮藏选择-20和0 ℃均可。但本次试验测定时间较短,其货架期的预测还有待进一步的研究。
[1] 姜杨,李婷婷,晋高伟,等.草鱼冷藏过程中新鲜度的综合评价[J].食品科学,2014,35(20):281-285.
[2] 黄晓春,侯温甫,杨文鸽,等.冰藏过程中美国红鱼生化特性的变化[J].食品科学,2007,28(1):337-340.
[3] 陈剑岚,施文正,陈舜胜,等.不同贮藏温度对草鱼肉滋味和鲜度的影响[J].食品工业科技,2017,38(5):329-333.
[4] 郑锐,包建强.不同冻藏温度下草鱼肉营养成分的变化研究[J].湖南农业科学,2010(11):102-104.
[5] 田光娟,李喜宏,韩聪聪,等.不同贮藏温度下鲫鱼鱼片品质变化研究[J].食品研究与开发,2017,38(10):177-181.
[6] 王文娟,汪水平.在不同贮藏温度下齐口裂腹鱼肌肉品质的变化[J].食品科学, 2014,35(14):229-233.
[7] 王文娟,汪水平,刘云,等.在不同贮藏温度下鲢肌肉鲜度的变化[J].淡水渔业,2012,42(2):80-83.
[8] 宋永令,罗永康,张丽娜,等.不同温度贮藏期间团头鲂品质的变化规律[J].中国农业大学学报,2010,15(4):104-110.
[9] 尹磊,谢晶,张宁,等.不同温度贮藏条件下小黄鱼的品质变化[J].食品科学,2015,36(22):227-231.
[10] 王晓君,沈秋霞,卢朝婷,等.不同贮藏温度下南方大口鲇品质的变化[J].食品与发酵工业,2018,44(11):245-250.
[11] 施白南,邓其祥.嘉陵江鱼类名录及其调查史略[J].西南师范学院学报:自然科学版,1980(2):38-48.
[12] 邹远超,文正勇,覃川杰,等.不同年龄白乌鳢肌肉营养成分分析[J].营养学报,2017,39(6):616-618.
[13] 周朝伟,雷骆,邓星星,等.乌鳢与白乌鳢肌肉营养成分分析与评价[J].淡水渔业,2018,48(3):83-89.
[14] 王桢璐,王超,姜文钊,等.白甲乌鳢和乌鳢肌肉营养成分及血液生理生化指标的比较研究[J].黑龙江畜牧兽医,2018(9):208-210.
[15] 王宇希,张伟忠,马恒甲,等.乌鳢×白乌鳢F1及其亲本肌肉成分与必需氨基酸组成的比较[J].浙江农业科学,2013,1(12):1 673-1 676.
[16] 陈佳荣,王以农,曾达.若干水产品鲜度变化规律的研究[J].渔业研究,1993(4):39-44.
[17] 陈思,李婷婷,李欢,等.白鲢鱼片在冷藏和微冻条件下的鲜度和品质变化[J].食品科学,2015,36(24):297-301.
[18] 杨宏旭.不同低温贮藏对青鱼肉品质的影响[D].无锡:江南大学,2016.
[19] ROBB D H F,KESTIN S C,WARRISS P D.Muscle activity at slaughter.I.Changes in flesh colour and gaping in rainbow trout[J].Aquaculture,2000,182(3-4):261-269.
[20] COLMENERO F J.Muscle protein gelation by combined use of high pressure/temperature[J].Trends in Food Science & Technology,2002,13(1):22-30.
[21] KAUFFMAN R G,EIKELENBOOM G,VANDERWAL P G, et al.The use of filter paper to estimate drip loss of porcine musculature[J].Meat Science,1986,18(3):191-200.
[22] HONLKEL K O.Reference methods for the assessment of physical characteristics of meat[J].Meat Science,1998,49(4):447-457.
[23] 李红民,陈韬,卢杰,等.肉及肉制品持水性测定方法的研究进展[J].肉类研究,2009(3):54-58.
[24] ALIZADEH E,CHAPLEAU N,LAMBALLERIE M D,et al.Effects of freezing and thawing processes on the quality of atlantic salmon (Salmo salar) fillets[J].Journal of Food Science,2010,72(5):E279-E284.
[25] TAYLOR R G,FJAERA S O,SKJERVOLD P O.Salmon fillet texture is determined by myofiber-myofiber and myofiber-myocommata attachment[J].Journal of Food Science,2010,67(6):2 067-2 071.
[26] ALIZADEH E,CHAPLEAU N,DE-LAMBALLERIE M,et al.Impact of freezing process on salt diffusivity of seafood: Application to salmon (Salmo salar) using conventional and pressure shift freezing[J].Food & Bioprocess Technology,2009,2(3):257-262.
[27] OLAFSDOTTIR G,MARTINSD TTIR E,OEHLENSCHL-
TTIR E,OEHLENSCHL- GER J,et al.Methods to evaluate fish freshness in research and industry[J].Trends in Food Science & Technology,1997,8(8):258-265.
GER J,et al.Methods to evaluate fish freshness in research and industry[J].Trends in Food Science & Technology,1997,8(8):258-265.
[28] 刘小羽,姚成强,梁建平,等.不同贮藏温度对酱鱼营养品质的影响[J].湖北农业科学,2015,54(1):152-153.
[29] PELLETT P L,YOUNG V R.Nutritional evaluation of protein foods[J].Food & Nutrition,1980(4):119-127.
[30] 阮征,吴谋成,胡筱波,等.多不饱和脂肪酸的研究进展[J].中国油脂,2003,28(2):52-56.
[31] SIMOPOULOS A P.The importance of the ratio of omega-6/omega-3 essential fatty acids[J].World Review of Nutrition & Dietetics,2002,56(8):365-379.
[32] KINSELLA J E,LOKESH B,STONE R A.Dietary n-3 polyunsaturated fatty acids and amelioration of cardiovascular disease: Possible mechanisms[J].American Journal of Clinical Nutrition,1990,52(1):1-28.
[33] 杨月欣,王光亚,潘兴昌.中国食物成分表2002[M].北京:北京大学医学出版社,2002.
[34] 李湛.EPADHA对体内脂质代谢影响的研究进展[J].生物技术世界,2015(1):117-118.
[35] 范莉梅. 食品灰分测定中应注意的问题[J].产品可靠性报告,2006,23(3):704-705.
[36] 李玉珍.editor 微量元素与健康(四)—钙(Ca)[C].北京:第七届全国微量元素研究和进展学术研研讨会,2007:167-168.
[37] 李海波,杨雪,白冬,等.鲣鱼(Katsuwonus pelamis)肌肉蛋白在热处理过程中的营养变化及功能性评价[J].海洋与湖沼,2017,48(1):155-160.
[38] 石娟.药物分析设计实验教学探讨[J].药学教育,2006,22(4):51-53.
[39] 李万立,罗海吉.微量元素铜与人类疾病关系的研究进展[J].微量元素与健康研究,2008,25(1):62-65.