猕猴桃(Actinidia chinensis),属于猕猴桃科(Actinidiaceae)猕猴桃属植物,具有多种营养成分和抗氧化功能,并且含有预防疾病方面功能的保健因子,因此越来越受到人们的重视[1-2]。猕猴桃果实属于呼吸跃变型,采后的果实有明显的后熟软化现象[3],采后腐烂损失直接限制猕猴桃的储存寿命[4]。目前,猕猴桃有效的保鲜方式主要是低温结合1-甲基环丙烯保鲜剂[5-6]。
1-甲基环丙烯(1-methylcyclopropene,1-MCP)是一种乙烯受体抑制剂,可以有效抑制乙烯与受体的结合及信号传导,推迟果实的软化进程,延缓果实成熟与衰老。但有研究表明1-MCP浓度使用不当会影响猕猴桃后熟口感,果实出库后难以后熟,果心和果皮硬化,口感差、果肉褐化、腐烂率高[7-8],也就是目前市场上反馈的“僵尸果”现象。关于1-MCP在猕猴桃上的使用报道的较多,但关于不同浓度1-MCP在猕猴桃保鲜方面系统的报道较少,尤其针对不同浓度1-MCP探究果实的后熟口感及影响乙烯合成途径的关键基因表达还为见过相关报道。因此,本研究以“贵长”猕猴桃为材料,研究不同浓度1-MCP对“贵长”猕猴桃贮藏期间和货架期间的理化参数和酶活性,并且研究了1-MCP影响猕猴桃成熟过程中乙烯生物合成途径的2个关键基因表达及合成,进而解释高浓度的1-MCP对猕猴桃造成“负面影响”问题,从而寻找猕猴桃适宜后熟品质的1-MCP阈值,以期为达到更好地保持猕猴桃后熟品质提供理论依据和技术支撑。
1 材料与方法
1.1 材料与仪器
“贵长”猕猴桃鲜果,于2017 年10月12日采摘于贵州省贵阳市鹏盛通农业有限公司基地;1-甲基环丙烯(1-MCP),购自美国陶氏益农公司; PE保鲜膜(厚度为20 μm),由国家农产品保鲜工程技术研究中心生产。
TA.XT.Plus质构仪,英国SMS公司;精准控温保鲜库(±0.5℃、(90±5)%),国家农产品保鲜工程技术研究中心(天津);荧光定量机(CFX96 Touch Deep well),美国Bio-Rad公司。
1.2 试验方法
1.2.1 处理方法
“贵长”猕猴桃采摘后立即运回贵州省果品加工工程技术研究中心果蔬贮藏与保鲜研究室。选择大小基本一致、无病虫害、无机械损伤的果实,分 7组,每组120 kg果实,使用大功率工业风扇对猕猴桃除去田间热,愈伤24 h后分别置于7个低密度聚乙烯(厚度:0.08 mm,体积:1 m3)帐内,以不同质量浓度1-MCP (0.25、0.5、0.75、1.0、1.25、1.5 μL/L) 分别对6组样品进行熏蒸处理24 h,温度为[(25 ±1)℃], 另一组对照处理(CK)只放相同质量的蒸馏水。熏蒸后经 20 μm的PE保鲜膜分装(10 kg/袋),每组设 3个重复,分装后的果实放置(0 ± 0.5)℃的环境中预冷24 h后扎袋贮藏,贮藏120 d后出库进行货架实验,货架果实摆放在温度为(25 ±2)℃房间内,每3 d对不同处理进行相关指标测定,测定周期为12 d。
1.2.2 感官品质评价
根据感官评价小组成员对货架末期(12 d)时的猕猴桃口感风味进行评价,采用分析型感官实验,参照宋小青等的测定方法[9],略有改动,具体评价标准见表1。
表1 感官品质评价标准
Table 1 Sensory quality evaluation standard
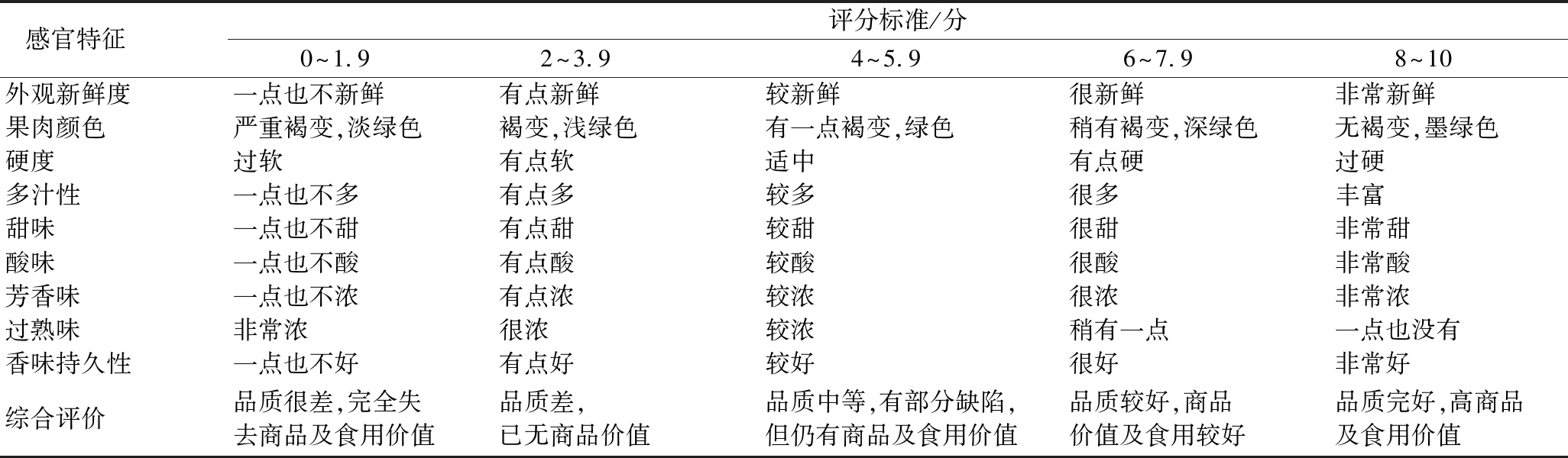
感官特征 评分标准/分0~1.9 2~3.9 4~5.9 6~7.9 8~10 外观新鲜度一点也不新鲜有点新鲜较新鲜很新鲜非常新鲜果肉颜色严重褐变,淡绿色褐变,浅绿色有一点褐变,绿色稍有褐变,深绿色无褐变,墨绿色硬度过软有点软适中有点硬过硬多汁性一点也不多有点多较多很多丰富甜味一点也不甜有点甜较甜很甜非常甜酸味一点也不酸有点酸较酸很酸非常酸芳香味一点也不浓有点浓较浓很浓非常浓过熟味非常浓很浓较浓稍有一点一点也没有香味持久性一点也不好有点好较好很好非常好综合评价品质很差,完全失去商品及食用价值品质差,已无商品价值品质中等,有部分缺陷,但仍有商品及食用价值品质较好,商品价值及食用较好品质完好,高商品及食用价值
1.2.3 硬度的测定
参照曹森等报道的方法对果实硬度进行测定[10]。采用英国TA XT Plus物性测定仪测定,利用P/2探头对其进行穿刺测试,测试参数:穿刺深度为10 mm,测前速度为2 mm/s,测试速度为 1mm/s,测后速度为2 mm/s。
1.2.4 多聚半乳糖醛酸酶(PG)活性的测定
参照LOHANI等的报道的方法进行测定[11]。
1.2.5 呼吸强度和乙烯生成速率的测定
呼吸强度和乙烯生成速率的测定均参照张鹏等报道的方法进行测定[12]。
1.2.6 ACS活性和ACO活性的测定
1-氨基环丙烷-1-羧酸合成酶(1-aminocyclopropane-1-carboxylate synthase, ACS)活性和1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxylate oxidase, ACO)活性的测定均按曹建康的方法测定[13]。
1.2.7 RNA的提取及ACS1和ACO1基因表达的测定
用生工生物工程(上海)股份有限公司Trizol Reagent(NO. B610409)的RNA提取试剂盒提取猕猴桃样品的RNA,然后用One Step RT-qPCR Kit(NO. B639277)把RNA反转录成cDNA,参照MINAS等[14-15]建立的猕猴桃荧光定量PCR的反应体系和程序进行试验。猕猴桃ACS1和ACO1基因序列以及荧光定量引物参照MINAS等[14]的研究报道,具体引物见表2。
表2 引物序列
Table 2 Primer sequence

基因引物序列PCR产物长度/bpACT1F5′-CGAACGGGAAATTGTCCGT-3′239ACT1R5′-TTCTCAACTGAGGAGCTGCTCTT-3′239ACO1F5′-AGGCTGTTCAGTCCGAAATCA-3′960ACO1R5′-GAAGGTGGCGCAAGAAGAAG -3′960ACS1F5′-CGAAGAATATCCACCTCATCAGTG-3′271ACS1R5′-CAAACTTCAGTGGAGTGGCTACTGT-3′271
1.2.8 ACC含量和MACC含量的测定
1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid, ACC)含量和丙二酰基-1-氨基环丙烷-1-羧酸(malonyl-1-aminocyclopropane-1-carboxylic acid, MACC)含量参照MINAS等的方法进行测定[14]
1.2.9 VC含量和固酸比含量的测定
VC含量和固酸比含量的测定均参照韩飞等报道的方法进行测定[15]。
1.3 数据处理与分析
采用Origin Pro 2017软件对数据进行统计处理,采用SPSS 19.0软件的Duncan氏新复极差法进行数据差异显著性分析及用主成分分析法来分析各样品间的差异(P<0.05为差异显著, P>0.05为差异不显著)。
2 结果与分析
2.1 不同质量浓度1-MCP处理对猕猴桃感官评价的影响
果实的感官品质决定其商品价值。由图1可见,不同质量浓度的1-MCP处理均影响果实的外观新鲜度、果肉颜色、硬度、多汁性、甜味、酸味、芳香味、过熟味及香味持久性,最终影响果实的综合评价。1.25 μL/L和1.5 μL/L的处理组果实在多汁性、甜味、酸味、芳香味、过熟味及香味持久性方面均不如对照处理,并且两处理组在硬度方面显著高于其他处理组(P<0.05),说明1-MCP质量浓度过高影响猕猴桃的后熟品质,造成烂而不软的“僵尸果”。0.75 μL/L处理组的果实新鲜,果肉颜色好,硬度适中,丰富的多汁性、甜味和酸味适中,果实芳香味浓、无过熟味道,香味持久性好,并且综合评价高,均好于其他处理,0.5 μL/L处理组次之,0.25 μL/L和1 μL/L的处理组好于对照处理,但均不如0.5 μL/L处理组和0.75 μL/L处理组。货架末期(12 d)时,通过对不同处理的果实感官品质综合评价分析可知, CK组、0.25 μL/L组、0.5 μL/L组、0.75 μL/L组、1 μL/L组、1.25 μL/L组和1.5 μL/L组的综合评价分别为3.48、5.48、8.44、9.12、4.85、2.25、1.86,其中0.75 μL/L组的综合评价最高,其次为0.5 μL/L组。因此,适宜的1-MCP质量浓度能够更好地保持果实的后熟感官品质,1-MCP质量浓度过高会导致猕猴桃感官品质出现负面效应。
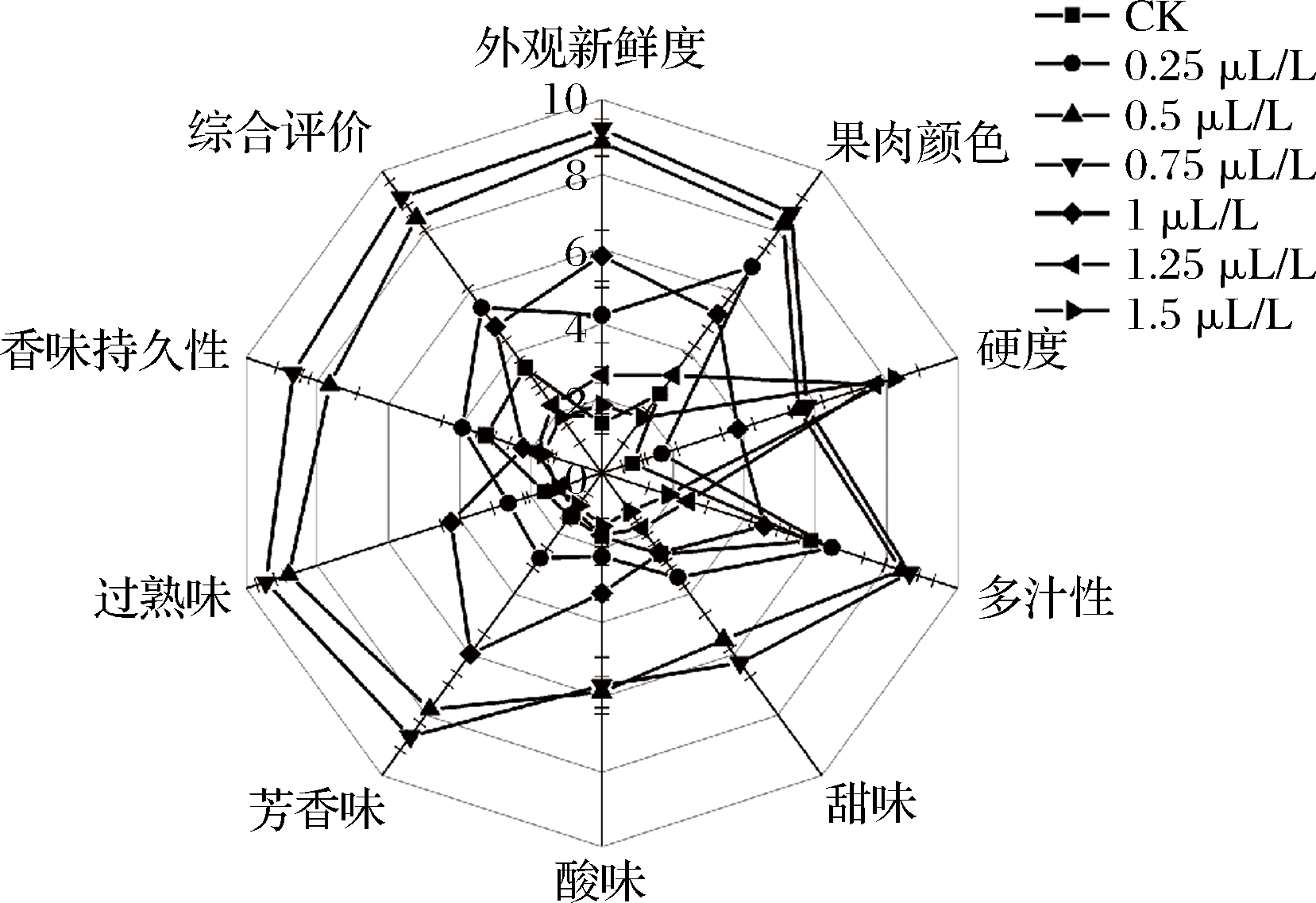
图1 1-MCP处理对猕猴桃感官品质的影响
Fig.1 Effects of 1-MCP treatment on the sensory quality of kiwifruit
2.2 不同质量浓度1-MCP处理对猕猴桃硬度和PG活性的影响
图2-A表明,不同处理的果实硬度呈现下降趋势,在冷藏结束时,1.25 μL/L和1.5 μL/L的处理组硬度均显著高于其他处理(P<0.05),但与其他处理没有显著差异(P>0.05)。CK、0.25 μL/L和1 μL/L的处理硬度在货架期6 d时分别降至1.16、1.48和1.37 kg/cm2,而此时0.5 μL/L和0.75 μL/L的处理组硬度分别为4.57、4.33 kg/cm2。STEC等[16]报道了当猕猴桃硬度为0.5 ~1.5 kg/cm2,果实食用口感良好。说明货架期6 d时,CK、0.25 μL/L和1 μL/L的处理果实均处于可食阶段。货架末期(12 d)时,1.25 μL/L和1.5 μL/L的处理组硬度均显著高于其他处理(P<0.05),这与图1货架末期感官品质结果相一致。0.5 μL/L和0.75 μL/L的硬度分别为0.98、1.26 kg/cm2, 说明此时依然处于可食阶段。而CK、0.25 μL/L和1 μL/L的处理硬度分别为0.21、0.35、0.45 kg/cm2,说明3个处理组在货架末期由于过软已处于不可食阶段。图2-B表明,PG活性呈现先上升后下降的趋势。在冷藏期间,不同处理没有显著差异(P<0.05)。 货架期开始,CK和0.25 μL/L的处理组PG活性开始快速上升,至货架期6 d时,两处理PG活性达到最大值。
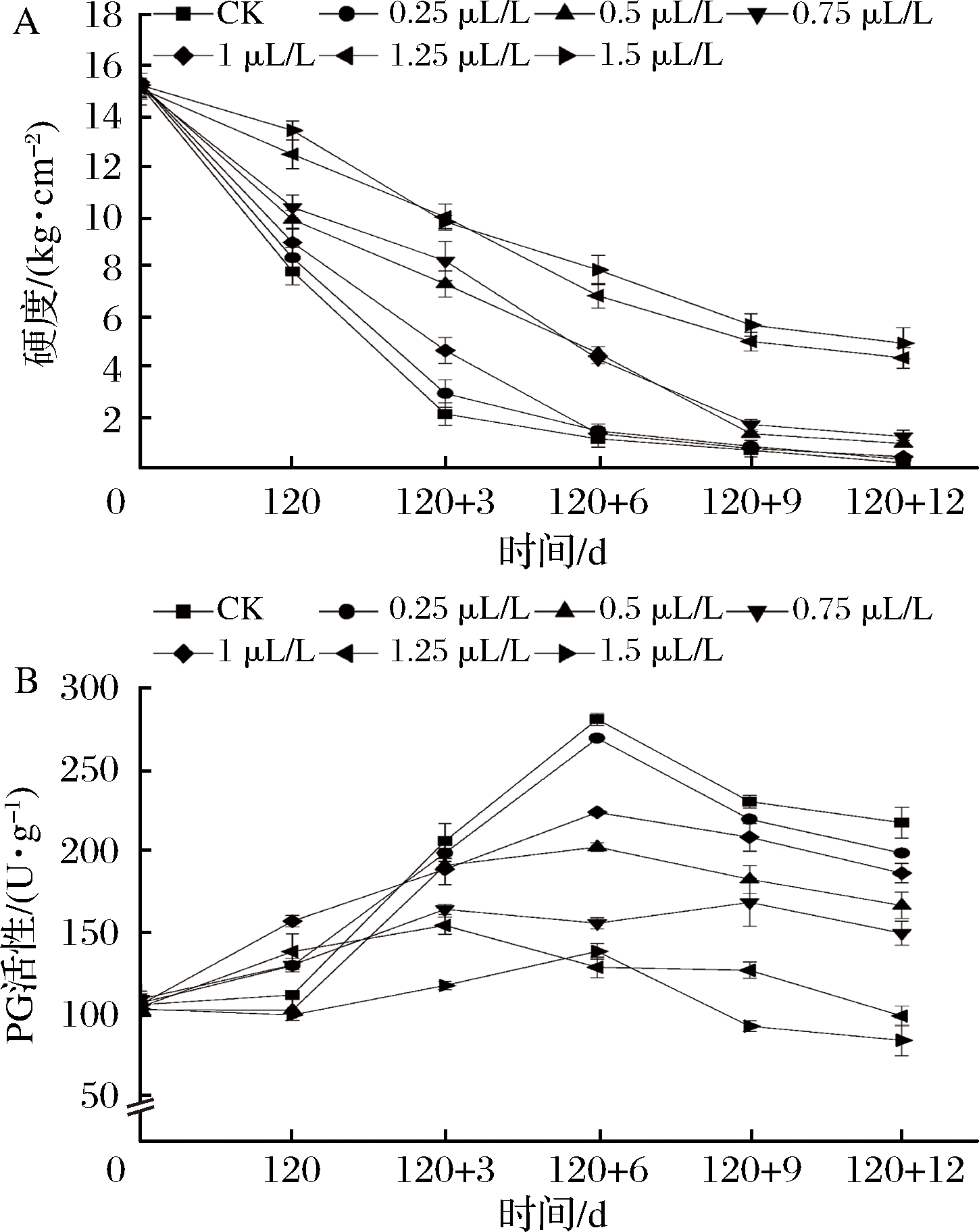
图2 1-MCP处理对猕猴桃硬度(A)和多聚半乳糖醛酸酶活性(B)的影响
Fig.2 Effects of 1-MCP treatment on the firmness and the polygalacturonase of kiwifruit
货架期12 d时,不同处理组的PG活性大小关系为CK组>0.25 μL/L组>1 μL/L组>0.5 μL/L组>0.75 μL/L组>1.25 μL/L组>1.5 μL/L组,并且在整个货架期,1.25 μL/L和1.5 μL/L的处理组PG活性均处于较低水平。PG活性影响果实的软化[17],这与图2-A研究的结果一致。因此,0.75 μL/L组能够更好地保持果实的硬度,维持适宜的PG活性,0.5 μL/L 组次之。
2.3 不同质量浓度1-MCP处理对猕猴桃呼吸强度和乙烯生成速率的影响
呼吸速率是反映储存效果的重要指标。在一般情况下,呼吸强度越高,果实呼吸越旺盛,进而营养成分消耗[17-18]。由图3-A可见,经过120 d的冷藏,1-MCP处理组果实呼吸强度没有显著差异(P>0.05),而CK组达到呼吸高峰,货架期3 d时, 0.25 μL/L、1 μL/L、1.25 μL/L 和1.5 μL/L的处理组果实呼吸强度均达到呼吸高峰, 0.5 μL/L和0.75μL/L的处理在货架期 6 d 时才达到呼吸高峰。
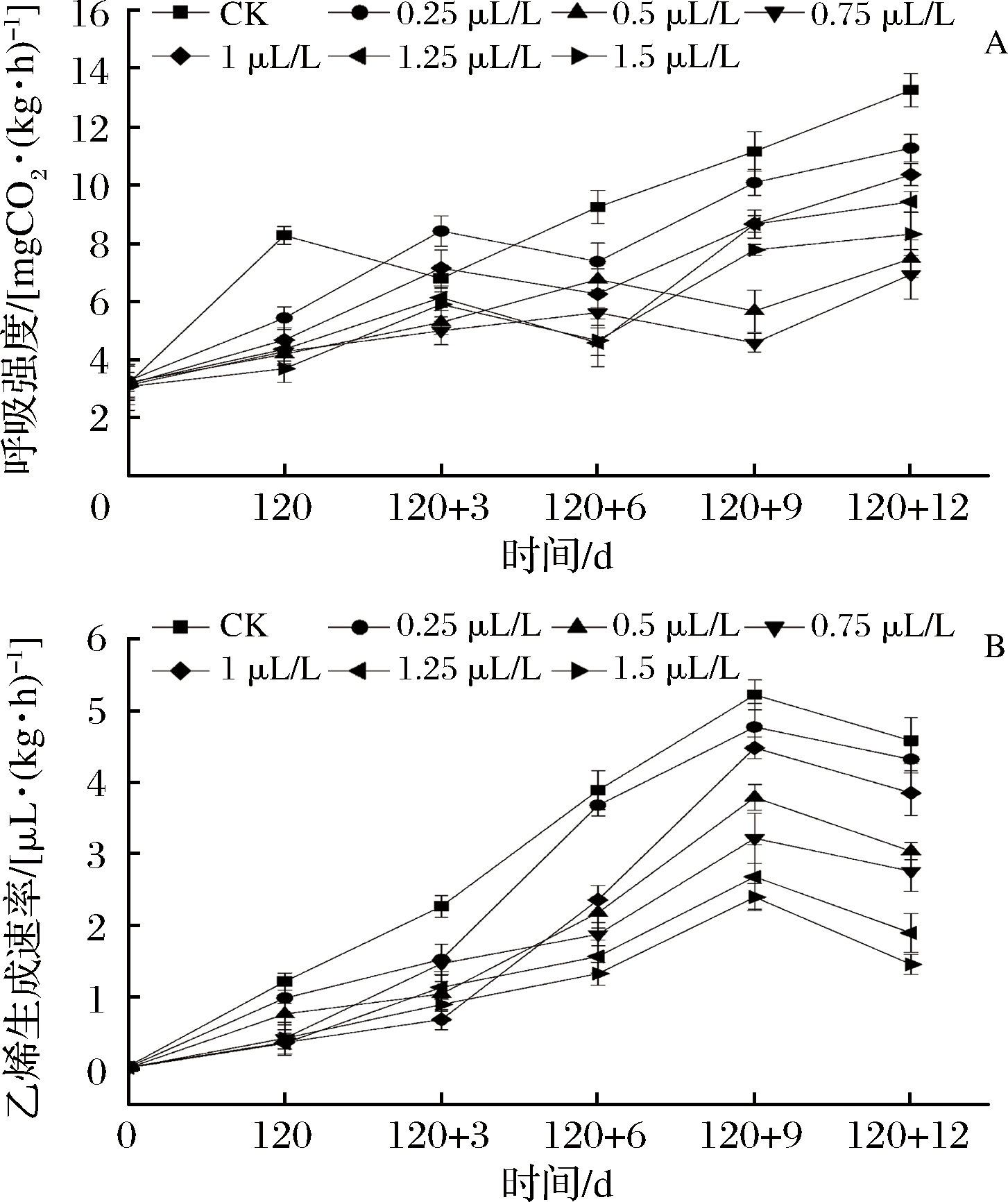
图3 1-MCP处理对猕猴桃呼吸强度(A)和乙烯生成速率(B)的影响
Fig.3 Effects of 1-MCP treatment on the respiration intensity and the ethylene production rate of kiwifruit
货架末期(12 d) 时,不同处理组的呼吸强度大小关系为CK组>0.25 μL/L组>1 μL/L组>1.25 μL/L组>1.5 μL/L组>0.5 μL/L组>0.75 μL/L组,并且不同处理组均显著低于对照组(P<0.05)。果实在冷藏120 d维持较低的乙烯生成速率(图3-B),并且相互之间没有显著差异(P>0.05)。货架期3 d,CK、0.25 μL/L和1 μL/L的处理组乙烯生成速率均快速上升,在货架末期时,不同处理组的呼吸强度大小关系为CK组>0.25 μL/L 组>1 μL/L组>0.5 μL/L组>0.75 μL/L组>1.25 μL/L组>1.5 μL/L组。说明适宜浓度的1-MCP均能够更好地保持果实的呼吸强度,降低果实的乙烯生成速率,推迟果实呼吸峰的出现,但果实乙烯生成速率过低,有可能导致烂而不软的“僵尸果”出现。
2.4 不同质量浓度1-MCP处理对猕猴桃乙烯生物合成的影响
图4-A显示随着果实的软化,ACS活性呈现上升趋势,在冷藏120 d内,不同处理的ACS活性没有显著差异(P>0.05)。从货架期开始对照处理的ACS活性快速上升,货架期9 d时不同处理的ACS活性达到峰值,并且CK组显著高于其他处理(P<0.05),1.25 μL/L组和1.5 μL/L组处理的ACS活性均一直处于较低水平。图4-B表明,从冷藏期间到货架期间CK组果实的ACO活性均高于其他处理。不同处理组果实ACO活性。货架期12 d时,不同处理的ACO活性大小关系为CK组>0.25 μL/L组>1 μL/L组>0.5 μL/L组>0.75 μL/L组>1.25 μL/L组>1.5 μL/L组。说明适宜浓度的1-MCP能在货架期9 d均开始出现下降的趋势,这有可能由于货架后期猕猴桃腐烂率快速导致的(图1),这与MA等研究结果一致[18够保持果实的ACS活性和ACO活性。
图4-C和图4-D表明在冷藏120d内,经过不同质量浓度的1-MCP处理对猕猴桃ACS1和ACO1基因表达的积累没有显著差异(P>0.05)。由图4-C可见,货架期3 d开始不同处理的猕猴桃均显示ACS1和ACO1表达的快速上调。货架期9 d时,不同处理的果实ACS1相对表达量的大小关系为CK组>0.25 μL/L组>0.5 μL/L组>0.75 μL/L组>1 μL/L组>1.25 μL/L 组>1.5 μL/L组,说明随着1-MCP浓度增加,抑制ACS1的表达越明显。货架期9 d的果实显示ACS1表达快速下调,原因可能由于果实衰老导致(图1)。货架期12 d时,不同的处理ACS1相对表达量没有显著差异(P>0.05)。由图4-D可见,从冷藏开始至货架期3 d时,CK组显著高于其他处理(P<0.05),而1-MCP处理均处于较低水平。从货架期3 d开始,不同1-MCP处理出现不同程度的ACO1表达上调。货架期9 d时,不同处理的果实ACO1相对表达量均达到峰值,其大小关系同图4-C货架期9 d ACS1的表达量一致。货架期12 d时,CK组、0.25 μL/L 组、0.5 μL/L组、0.75 μL/L组、1 μL/L组、1.25 μL/L组和1.5 μL/L组ACO1相对表达量分别为13.74、100.46、65.50、50.72、23.24、33.23、19.12。由此说明不同浓度1-MCP影响ACS1和ACO1的相对表达量,1-MCP浓度过高导致ACS1和ACO1一直处于较低水平,进而影响乙烯的合成,影响果实的软化,这与图3-B研究结果一致。
图4-E和图4-F表明,在冷藏期间猕猴桃ACC和MACC含量均非常低,而从货架期开始果实的ACC和MACC含量快速上升,经过12 d的货架期,不同处理的ACC和MACC含量的大小关系均为CK组>0.25 μL/L组>1 μL/L组>0.5 μL/L组>0.75 μL/L 组>1.25 μL/L组>1.5 μL/L组,并且CK组的果实ACC和MACC含量均显著高于1-MCP 处理(P<0.05),而1.25 μL/L组和1.5 μL/L组处理的ACC和MACC含量在整个货架期间均处于较低水平,说明高浓度的1-MCP处理能够极大地抑制ACC和MACC的积累。适宜浓度的1-MCP 能够维持果实一定的ACC和MACC含量。
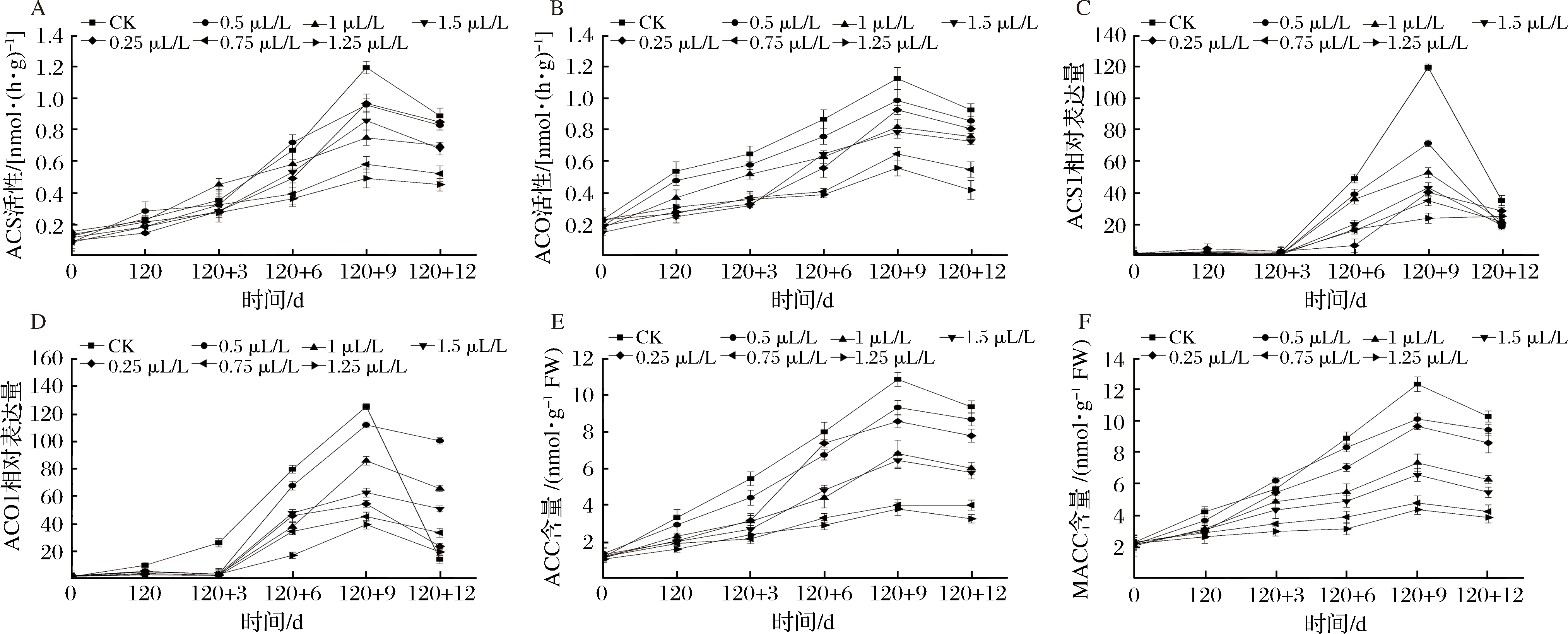
图4 1-MCP处理对猕猴桃乙烯生物合成的影响
Fig.4 Effects of 1-MCP treatment on the ethylene biosynthesis of kiwifruit
2.5 不同质量浓度1-MCP处理对猕猴桃VC含量和固酸比的影响
Vc是猕猴桃重要的营养成分,固酸比是果实完熟时口感和内在品质的重要指标。由图5-A可见,冷藏120 d后,0.75 μL/L组果实的VC含量显著高于其他处理(P<0.05)。从货架期开始,CK组开始快速下降,货架期12 d时,不同处理果实的VC含量大小关系为0.75 μL/L组>0.5 μL/L组>0.25 μL/L组>1 μL/L组>1.25 μL/L组>1.5 μL/L组>CK组。图5-B表明,固酸比呈现上升的趋势,果实的固酸比在前期上升可能由于后熟作用导致可溶固形物含量上升较快,从而使固酸比上升,而果实固酸比后期上升的原因可能由于可滴定酸含量下降较快的原因导致[9]。冷藏结束时,不同处理的固酸比没有显著差异(P>0.05)。货架期12 d时,CK组、0.25 μL/L组、0.5 μL/L组、0.75 μL/L组、1 μL/L组、1.25 μL/L组和1.5 μL/L 组处理的果实固酸比分别为13.67、13.21、10.87、10.45、12.98、12.85、12.03。
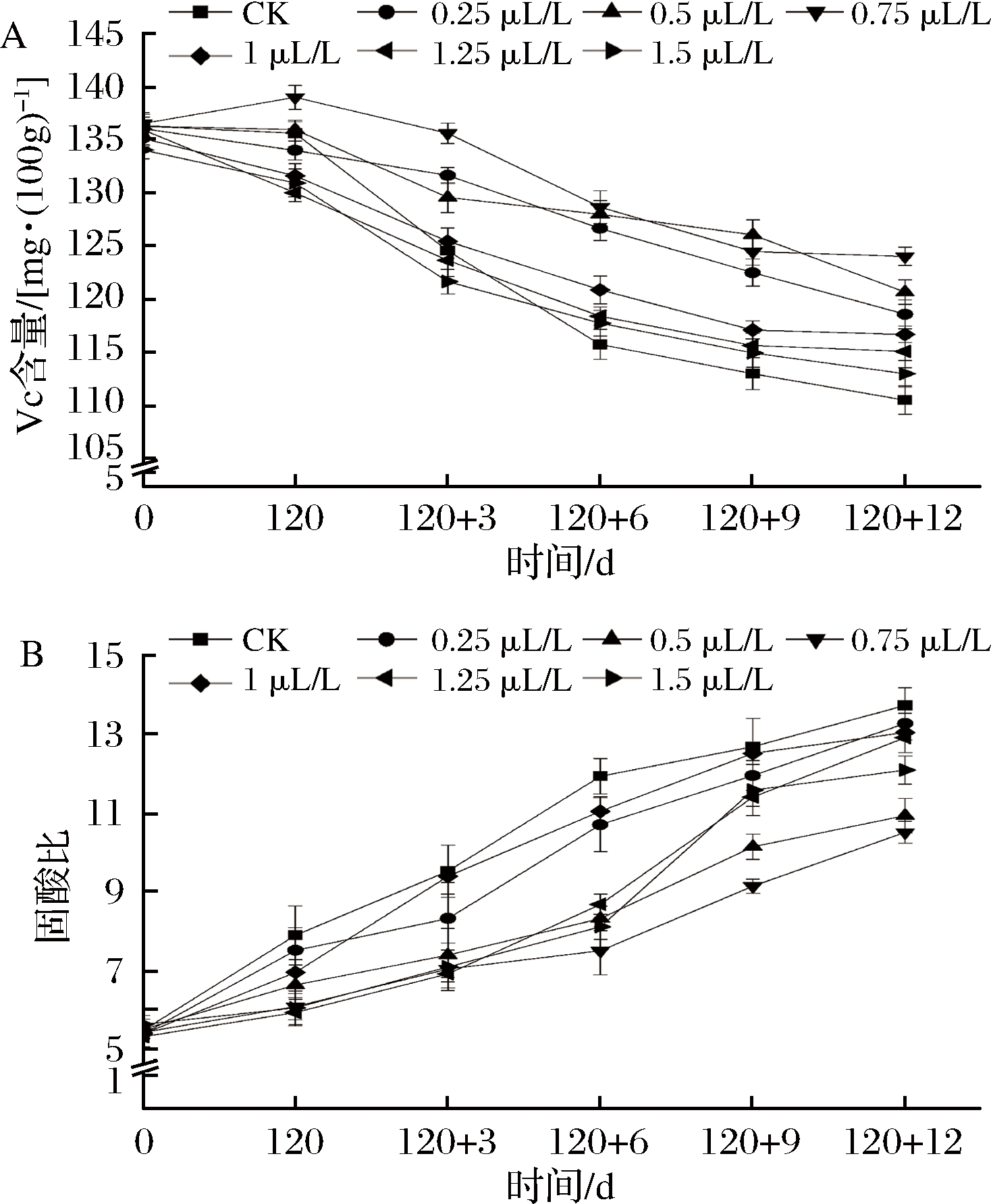
图5 1-MCP处理对猕猴桃VC含量(A)和固酸比(B)的影响
Fig.5 Effects of 1-MCP treatment on the VC content and the ratio of sugar to acid of kiwifruit
由此说明,0.75 μL/L的处理能够更好地维持果实VC的含量和口感,其次为0.5 μL/L的处理,这与图1研究结果一致。
3 讨论
在植物细胞中,乙烯是由S-腺苷蛋氨酸(SAM)合成的,由ACC合成酶(ACS)转化为1-氨基环丙烷-1-羧酸(ACC)。ACC随后被ACC氧化酶(ACC)氧化(ACO),产生乙烯、CO2和氰化物[19],因此乙烯的产生率是由其直接前体ACC水平控制的[20]。通常,植物乙烯的生产维持在较低的基础水平,但在某些发展阶段或压力刺激下会迅速而剧烈地诱导。虽然ACS通常被认为是乙烯生物合成的限速步骤,但有越来越多的证据表明,在不同植物的特定发育和胁迫条件下,ACO也作为控制点[21-22]。
ACS和ACC氧化酶(ACO)是乙烯生物合成途径中涉及的两个关键酶,都是各种植物器官的多基因家族编码[23]。它们已被证明,乙烯的生物合成受到正面和负面的反馈调节[24]。为了进一步阐明猕猴桃成熟期间乙烯的生产的机制,我们评估了乙烯生物合成的关键酶的活性,即ACS和ACO。ILINA等研究表明乙烯-烯生物合成基因ACS1和ACO1分别对ACC合成酶和ACC氧化酶进行编码[25]。尽管MACC并没有被认为是ACC的重要存储形式,但ACC丙二酰化反应仍然可以调节ACC水平[26]。
图4-A和图4-B显示,随着果实的软化,ACS和ACO活性呈现先上升后下降的趋势,并且1-MCP处理能够抑制ACS和ACO活性的上升。但1 μL/L的1-MCP处理对2个关键酶活性的抑制反而不如低浓度0.5 μL/L和0.75 μL/L的处理,并且1.25 μL/L和1.5 μL/L一直处于较低水平。通过图4-C和图4-D表明,1.25 μL/L和1.5 μL/L的处理ACS1和ACO1的表达一直处于较低水平,进而影响乙烯的合成,降低了乙烯的生成速率(图3),这与图4-E和图4-F两种处理(1.25 μL/L和1.5 μL/L)的ACC含量和MACC含量结果相一致。说明1.25 μL/L和1.5 μL/L的处理影响了果实的正常软化,从而导致果实硬化(图2),口感差(图5)等问题,也就是市场上反馈的“僵尸果”现象的原因。而1 μL/L的1-MCP在货架后期能够快速软化,但1.25 μL/L和1.5 μL/L的1-MCP处理出现“僵尸果”现象,并且高浓度的(1 μL/L、 1.25 μL/L和1.5 μL/L)1-MCP货架末期(12 d)果实的感官综合评价较低(图1),原因可能是1-MCP浓度使用过高导致果实生理代谢紊乱,至于相关机理待于进一步研究。
4 结论
综合比较,0.75 μL/L的处理能够有效抑制果实ACS和ACO的酶活性及ACS1和ACO1的基因表达量,降低了ACC和MACC含量,维持果实的硬度、PG活性、VC含量和固酸比,保持果实更好地后熟品质,并且能够使果实正常软化,猕猴桃在货架期12 d时的感官综合评价高达9.12,0.5 μL/L的处理次之,而1.25 μL/L和1.5 μL/L的处理会出现果实硬化,口感差等“僵尸果”现象。因此,采后用0.5~0.75 μL/L 1-MCP 来处理猕猴桃对保持果实后熟品质的效果最好。
[1] 薛敏, 高贵田,张思远,等. 气体ClO2对‘华优’猕猴桃采后生理及贮藏品质的影响[J]. 食品科学, 2015, 36(18):257-261.
[2] SOUFLEROS E H, PISSA I, PETRIDIS D, et al. Instrumental analysis of volatile and other compounds of Greek kiwi wine; sensory evaluation and optimisation of its composition [J]. Food Chemistry, 2001, 75(4):487-500.
[3] YIN X R, ALLAN A C, CHEN K S, et al. Kiwifruit EIL and ERF genes involved in regulating fruit ripening[J]. Plant Physiology, 2010, 153(3):1 280-1 292.
[4] MICHAILIDES T J, ELMER P A G. Botrytis gray mold of kiwifruit caused by Botrytis cinerea in the United States and New Zealand[J]. Plant Disease, 2000, 84(3):208-223.
[5] 马婷, 任亚梅,庞荣,等. 1-MCP处理对亚特猕猴桃冷藏期生理特性及品质的影响[J]. 中国食品学报, 2016, 16(11):145-153.
[5] DENG L, JIANG C Z, MU W, et al. Influence of 1-MCP treatments on eating quality and consumer preferences of ‘Qinmei’ kiwifruit during shelf life[J]. Journal of Food Science & Technology, 2015, 52(1):335-342.
[7] 孙志栋, 田雪冰,倪穗,等. 1-MCP对采后果实贮藏品质影响的研究进展[J]. 现代食品科技, 2017(7):336-341.
[8] 夏源苑, 猕猴桃不同品种1-MCP处理浓度研究[D]. 杨凌:西北农林科技大学. 2011.
[9] 宋小青, 任亚梅,张艳宜,等. CPPU、1-MCP处理对猕猴桃贮藏品质的影响[J]. 食品与发酵工业, 2017, 43(4):266-271.
[10] 曹森, 马超,吉宁,等. 乙烯吸附剂耦合1-MCP对“贵长”猕猴桃保鲜效果的影响[J]. 食品与发酵工业, 2018,44(3):186-193.
[11] LOHANI S, TRIVEDI P K, NATH P. Changes in activities of cell wall hydrolases during ethylene-induced ripening in banana: Effect of 1-MCP, ABA and IAA [J]. Postharvest Biology & Technology, 2004, 31(2):119-126.
[12] 张鹏, 李天元,李江阔,等. 微环境气体调控对精准相温贮藏期间柿果保鲜效果的影响[J]. 中国食品学报, 2018, 18(3): 180-187.
[13] 曹建康, 姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京,中国轻工业出版社, 2007.
[14] MINAS I S, VICENTE A R, DHANAPAL A P, et al. Ozone-induced kiwifruit ripening delay is mediated by ethylene biosynthesis inhibition and cell wall dismantling regulation[J]. Plant Science, 2014, 229: 76-85.
[15] 韩飞, 陈美艳,李昆同,等. 不同产地‘金圆’猕猴桃低温贮藏下的生理指标及贮藏性变化[J]. 植物科学学报, 2018, 36(3): 381-392.
[16] STEC M G H, HODGSON J A, MACRAE E A, et al. Role of fruit firmness in the sensory evaluation of kiwifruit (Actinidia deliciosa, cv Hayward)[J]. Journal of the Science of Food & Agriculture, 1989, 47(4): 417-433.
[17] 钟秋平. 1-甲基环丙烯处理延迟采后油梨果实后熟的研究[J]. 食品与发酵工业, 2005, 31(5):147-150.
[18] NAVARRO J M, FLORES P, GARRIDO C, et al. Changes in the contents of antioxidant compounds in pepper fruits at different ripening stages, as affected by salinity[J]. Food Chemistry, 2006, 96(1): 66-73.
[19] MA G, WANG R, WANG C R, et al. Effect of 1-methylcyclopropene on expression of genes for ethylene biosynthesis enzymes and ethylene receptors in post-harvest broccoli[J]. Plant Growth Regulation, 2009, 57(3): 223-232.
[20] YANG S F, HOFFMAN N E. Ethylene biosynthesis and its regulation in higher plants[J]. Annu rev plant Physiol, 2003, 35(1):155-189.
[21] BOUZAYEN M, LATCHÉ A, ALIBERT G. Intracellular sites of synthesis and storage of 1-(malonylamino) cyclopropane-1-carboxylic acid in acer pseudoplatanus cells[J]. Plant Physiology, 1988, 88(3):613-617.
[22] RAUF M, ARIF M, FISAHN J et al. NAC transcription factor speedy hyponastic growth regulates flooding-induced leaf movement in Arabidopsis[J].The Plant Cell, 2013, 25(12):4 941-4 955.
[23] QIN Y M, HU C Y, PANG Y, et al. Saturated very-long-chain fatty acids promote cotton fiber and arabidopsis cell elongation by activating ethylene biosynthesis[J]. The Plant Cell, 2007, 19(11):3 692-3 704.
[24] ZAREMBINSKI T I, THEOLOGIS A. Ethylene biosynthesis and action: A case of conservation[J]. Plant Molecular Biology, 1994, 26(5):1 579-1 597.
[25] KENDE H. Ethylene biosynthesis[J]. Annual review of plant biology, 1993, 44(44):283-307.
[26] ILINA N, ALEM H J, PAGANO E A, et al. Suppression of ethylene perception after exposure to cooling conditions delays the progress of softening in 'Hayward' kiwifruit[J]. Postharvest Biology and Technology, 2010, 55(3):160-168.