饮酒不适感通常指人在饮酒后,呈现醉酒状,出现头晕、头痛[1]。造成饮后不适感的原因相当复杂,除了饮酒人的身体状况、饮用量、饮酒习惯、思维情绪及环境因素等以外[2],还有酒体本身设计和质量的因素。目前研究结果表明,造成白酒饮后产生不适感原因,一是由于乙醇自身的麻醉作用和其所代谢产生的乙醛引起的脑缺氧[3],二是由于酒体自身的复杂成分在人体内的作用以及代谢,这些物质包括高级醇,生物胺等物质[4-5]。其中高级醇是3个C以上一元醇类物质的总称[6],在白酒中常见的有异戊醇、正丙醇、异丁醇、正己醇等[7]。高级醇是浓香型白酒中的重要成分和呈味物质。适量的高级醇能够使酒体醇甜,还能与酸酯化生成酯类物质,使酒体丰满[8]。但由于高级醇化学结构较乙醇更为复杂,代谢也更加缓慢,过量累积会导致肝损伤[9-10],同时其对人体神经系统所产生的毒害和麻醉作用比乙醇更强,其能使神经系统充血,对脑神经细胞的损害作用,使人产生头疼、头晕的感觉,引起大醉现象[11-14]。
旷场实验(open field test, OFT)作为一个经典的动物行为学实验,可以检测小鼠的自发活动行为(locomotor activity)和探索行为(exploratory behavior)[15]。由于小鼠有畏惧空旷场地的天性,其活动具有趋避性(thigmotaxis),而另一方面,又会对新环境产生好奇心进而进行探索[16]。常用的旷场系统是一个方形的箱子(亦有圆形),小鼠在旷场中可以自由活动,箱子顶部有摄像机以记录小鼠活动[17]。旷场实验可通过1次实验对小鼠的自发活动、探索行为及焦虑/抑郁状态进行定量评价[18]。现阶段,旷场实验常应用于药物副作用的检测,如药物对行动、睡眠的影响等[19],是一个简单实用的动物实验手段。
因此,本研究通过小鼠的浓香型白酒灌胃模型,利用旷场实验饮后行为分析结合白酒常规风味物质分析,建立对浓香型白酒中引起饮后不适感的关键高级醇的判定方法,确定在浓香型白酒中引起饮后不适的主要高级醇类物质。以进一步提高酒类品质,降低饮后不适感奠定基础。
1 材料与方法
1.1 实验酒样和动物
酒样:酒样A、B、C、D、E、F分别为市售的6款不同品牌浓香型白酒,均为52%vol。
实验动物:C57小鼠,雄性,清洁Ⅱ级,4~6周龄,由北京维通利华公司实验动物有限公司提供。随机选取小鼠80只,平均体重为(23±2) g,于室温(23±2) ℃,光照(150 xl)12 h和黑暗12 h环境,自由饮水进食饲喂,1周后进行实验。实验前提前1 d将小鼠置于旷场实验室以适应环境;实验时,将小鼠随机分为实验组(酒样A、B、C、D、E、F组)、对照组1(Control 1,52%vol食用酒精)和对照组2(Control 2,生理盐水),每组10只。
1.2 仪器与设备
Clarus 590/690气相色谱火焰离子化检测器(gas chromatography-flame ionization detection,GC-FID),美国PerkinElmer公司。
旷场实验动物行为学跟踪系统ANY-Maze系统(v.4.72),美国Stoelting公司。该仪器主要由一个半径为20cm的白底箱壁透明半封闭有机玻璃圆筒组成,其顶部中央悬挂有摄像机,并与记录系统相连,以此来跟踪小鼠在旷场中的行为,其数据由ANY-Maze软件进行记录并分析。
1.3 实验方法
1.3.1 小鼠灌胃
按照实验分组对实验动物分别进行灌胃,实验各组和对照组1灌胃剂量均为15 mL/kg,对照组2采用等量生理盐水进行灌胃。
1.3.2 旷场实验
在灌胃完成后,计录时间。在30 min后,依次按照分组将每只小鼠放置于旷场底面中央。利用高频摄像机及软件跟踪记录动物在旷场内自由运动60 s内的行为变化。采集的数据包括活动总路程、移动平均速度、停滞时间及停滞次数[20]。实验过程中保持安静,动作轻柔;每只动物实验结束后及时清除粪便,使用72%(体积分数)乙醇溶液清洁底面并擦干,减少之前动物的气味,防止行为干扰。
1.3.3 醇类物质测定
色谱条件:自动进样器;进样口温度:240 ℃;载气:N2;流速:1 mL/min;FID检测器温度:FID(280 ℃);H2:45 mL/min;空气:450 mL/min;色谱柱:CP-Wax57CB (50 m×0.25 mm×0.20 μm)。升温程序,起始温度:35 ℃,保持4.00 min;以4.0 ℃/min升温到60 ℃,再以10.0 ℃/min升温到130 ℃,再以15.0 ℃/min升温到205 ℃,保持15.00 min。采用30∶1分流比进样。采用内标法。内标浓度为:叔戊醇1%,乙酸正丁酯1%,2-乙基丁酸1%(体积分数)。
1.4 实验数据统计分析
本实验结果采用SPSS Statistics 24软件,使用单因素ANOVA方法进行统计,并使用Tableau作图,数据使用均数±标准误表示;同时,利用SPSS Statistics 24.0软件,使用其中的降维功能,分别使用数值变量对应分析方法和因子分析方法对实验数据进行分析。
2 结果与分析
2.1 旷场实验结果
本研究前期研究成果表明,灌胃30 min~1 h小鼠血液乙醇积累程度达到最高,对行为影响最大。所以本实验对灌胃后30 min小鼠行为数据进行统计,结果(表1,图1)发现,对照组1小鼠在旷场中的活动总路程为(6.607±0.723) m,平均速度为(0.110±0.030) m/s,相较于对照组2的(7.479±0.085) m和(0.125±0.001) m/s略有所下降,但在统计学上均无显著性差异(P>0.05);而两者在旷场中的停滞时间分别为(1.850±0.238) s和(1.660±0.245) s,食用酒精组时间略长于生理盐水组,但差异不显著(P>0.05);在停滞频数上,食用酒精组和生理盐水组并无显著差异(P>0.05)。本研究旨在判定浓香型白酒中可能引起饮后不适的关键高级醇类物质,需消除乙醇的干扰,所以在其后的实验中选择食用酒精组与实验组进行比较。
表1 各组小鼠旷场中运动的行为学指标![]()
Table 1 Behaviors of different groups’ mice in open field

组别活动总路程/m平均速度/(m·s-1)停滞时间/s停滞次数/次A7.212±0.7210.120±0.0290.550±0.1320.500±0.024B9.437±1.0360.158±0.0171.850±0.4332.670±0.585C7.862±0.6400.131±0.0222.667±0.4921.830±0.249D11.157±1.2920.186±0.0222.100±0.4212.670±0.430E9.168±1.0310.166±0.0260.367±0.0790.670±0.094F8.759±0.9430.153±0.0231.850±0.3903.000±0.915对照组16.607±0.7230.110±0.0301.850±0.2381.330±0.055对照组27.479±0.0850.125±0.0011.600±0.2451.600±0.045
而在各实验组与食用酒精组的比较中发现,酒样B、D、E、F组灌胃30 min后的小鼠,在旷场运动1 min内,活动总路程和平均速度均显著增加(P<0.05);灌胃A、E两组酒样的小鼠停滞时间和停滞次数均显著低于食用酒精组(P<0.05),而C组小鼠的停滞时间则显著高于食用酒精组(P<0.01),B、D、F组的停滞次数相较于食用酒精组明显增加(P<0.05)。将A、B、C、D、E、F各行为学指标进行对应分析,对应分析图结果见图2,酒样E灌胃后的小鼠活动总路程较长,同时停滞时间和停滞次数减少;酒样F灌胃后的小鼠停滞次数更多,酒样C灌胃后小鼠停滞时间变长;酒样D灌胃后小鼠平均速度更快,同时小鼠的停滞次数也会相应增加。

A-活动总路程;B-平均速度;C-停滞时间;D-停滞次数
图1 各组小鼠灌胃30 min后在旷场中运动1 min的行为学指标
Fig.1 Behavioral indices of mice in different group who who exercised in open field for 1 minute after 30 minutes of gavage
注:*代表差异显著,P<0.05。
结合图1和图2分析可知,在酒样E的作用下,小鼠的运动能力提高,呈现出酒后兴奋,同时其受抑制出现间断性麻木的情况最轻,说明该酒样所引起的小鼠兴奋并非异常兴奋;小鼠在酒样A的作用下,受抑制出现间断性麻木的情况较轻,但其运动能力提高并不明显,说明其兴奋受到抑制,呈现醉酒状;酒样F作用下的小鼠受抑制出现间断性麻木的次数增加,酒样C则造成小鼠间断性麻木的时间最长,同时两组小鼠运动能力都有所提高,说明在这两种酒样的作用下,小鼠的运动能力应属于在异常状态下产生的兴奋,即饮后不适感所引起的刺激;同理,酒样D虽然引起小鼠运动能力提高在所有酒样中程度最高,但其对小鼠所造成的间断性麻木时间和次数也处在较高水平,由此可认为酒样D造成饮后不适所引起的兴奋程度最强。

图2 酒样-行为指标对应分析图
Fig.2 The correspondent analysis chart between Baijiu samples and mice’s behaviors
综上所述,可以发现,酒样D为引起小鼠饮后不适感最强的酒样,而酒样E为引起小鼠饮后不适感程度最弱的酒样。
2.2 六款浓香型白酒醇类物质成分的定量检测结果
将A、B、C、D、E、F六款白酒按照给定条件进行GC-FID检测,检测共计13种醇类物质,其中包含12种高级醇,分别为仲丁醇、正丙醇、异丁醇、2-戊醇、正丁醇、活性戊醇、异戊醇、正戊醇、正己醇,1,2-丙二醇、糠醇以及2-苯乙醇,各酒样醇类物质含量测定结果见表2。
表2 六款酒样醇类物质含量 单位:mg/L
Table 2 Contents of alcohols in 6 different Baijiu of strong aroma

风味物质ABCDEF甲醇88.89126.97139.25128.9792.44127.84仲丁醇78.6339.3649.3338.0829.7754.04正丙醇852.1160.45206.69307.0798.84197.98异丁醇82.6132.6390.20238.448.2591.052-戊醇15.4255.440.00120.7117.6837.55正丁醇67.8545.76171.8353.572.64153.71活性戊醇55.4654.9354.6242.9223.1746.84异戊醇188.11308.66236.07414.8778.46205.48正戊醇3.664.158.163.992.706.550正己醇36.8338.7666.7344.8341.875.401,2-丙二醇34.039.562.271.642.847.72糠醇4.394.753.624.723.452.002-苯乙醇4.093.443.933.842.022.35
2.3 PCA主成分分析结果
通过PCA将所检测出的除乙醇外的其他醇类物质(共计13种)作为指标进行分析,共计得到13个主成分,其中主要的主成分各自的特征值、贡献率(方差百分比)及累积贡献率(累积)见表3,因子负荷矩阵见表4。
表3 主成分提取总方差解释
Table 3 Total variance explained by PCA

成分初始特征值提取载荷平方和总计方差百分比累积/%总计方差百分比累积/%14.47734.44134.4414.47734.44134.44124.20132.31566.7564.20132.31566.75633.39426.10992.8653.39426.10992.86540.6344.87497.73950.2942.261100
表4 因子负荷矩阵分析
Table 4 Component matrixan alysis
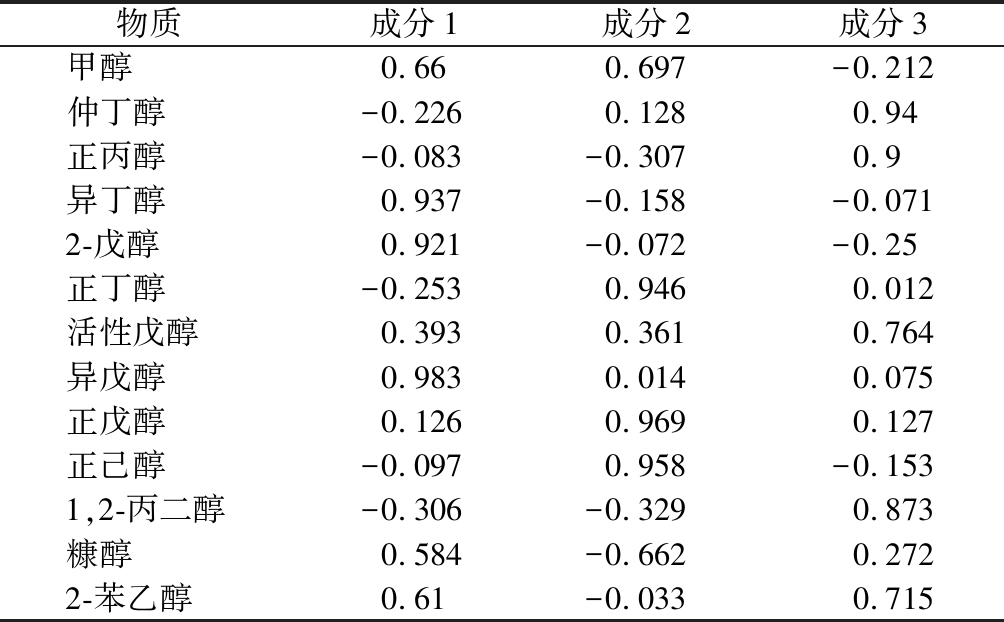
物质成分1成分2成分3甲醇0.660.697-0.212仲丁醇-0.2260.1280.94正丙醇-0.083-0.3070.9异丁醇0.937-0.158-0.0712-戊醇0.921-0.072-0.25正丁醇-0.2530.9460.012活性戊醇0.3930.3610.764异戊醇0.9830.0140.075正戊醇0.1260.9690.127正己醇-0.0970.958-0.1531,2-丙二醇-0.306-0.3290.873糠醇0.584-0.6620.2722-苯乙醇0.61-0.0330.715
由表3可知,前3个主成分特征根大于1,且累计贡献率达到92%,故选择前3个因子。从表4中可以得知,异戊醇、异丁醇和2-戊醇在主成分1(FAC 1)上有较大载荷;正戊醇,正己醇及正丁醇在主成分2(FAC 2)上有较大载荷;仲丁醇、正丙醇则在主成分3(FAC 3)中拥有较大载荷。将上述PCA所得结果进行投影后,3个因素间可得PCA投影图,如图3所示。

图3 醇类物质PCA投影图
Fig.3 Projection plot of principal component analysis for alcohols
由图3可以发现,各酒样中3个主成分的权重各不相同,较为直观地表明不同酒样中不同主成分所代表的物质贡献不同。由图3可知,酒样A中FAC 3所占权重最大,说明FAC 3所代表的正丙醇和仲丁醇在其所含醇类物质中起到主要作用;酒样B中则为FAC 1所代表的异戊醇、异丁醇和2-戊醇在其所含醇类物质中起到主要作用;酒样C受3个主成分影响,但其中以FAC 2所代表的正戊醇,正己醇及正丁醇起主要作用;酒样D中,FAC 1所代表的异戊醇、异丁醇和2-戊醇起到了主要作用,其程度较之于酒样B更为突出;酒样E中则3个主成分均不起主要作用;酒样F中是以FAC 2所代表的正戊醇,正己醇及正丁醇起主要作用。
3 结论
旷场实验作为评价啮齿类动物运动功能和焦虑行为的经典方法,被广泛运用于药理学的基础研究中[21]。动物对新奇环境的探究习性和对空旷场地恐惧的矛盾冲突是旷场实验的主要原理,动物水平运动情况代表其运动活性[22]。本研究基于小鼠行为学实验和酒样常规风味物质测定,通过将两者结合分析对能引起浓香型白酒饮后不适的关键物质进行初步判定。行为学实验结果表明,酒样D能引起小鼠较为强烈的饮后不适感,而酒样E为引起小鼠饮后不适感程度最弱的酒样;从酒样中风味物质分析结果来看,酒样D中起主要作用的高级醇是异戊醇、异丁醇和2-戊醇,且观察异戊醇含量发现,酒样D在所有酒样中为最高,而引起小鼠饮后不适感程度最弱的酒样E中异戊醇含量在所有酒样中最低。将上述行为实验结果与物质含量测定结果相对应,可初步判定异戊醇为引起浓香型白酒饮后不适的关键高级醇之一,推测其含量愈高的浓香型白酒,饮后不适感愈强。
同时,通过实验发现,酒样A作用的小鼠虽受抑制出现间断性麻木的情况较轻,但其运动能力提高并不明显,说明其兴奋受到抑制,呈现出醉酒状;而在酒样风味物质的分析中,发现酒样A起主要作用的高级醇为正丙醇和仲丁醇,正丙醇含量为所有酒样中最高的,所以将其行为实验结果与物质含量测定结果相对应,怀疑浓香型白酒中正丙醇含量越高,其越易造成饮后易醉的现象。但浓香型白酒作为一个复杂的体系,要进一步确定异戊醇和正丙醇是否是引起浓香型白酒饮后不适的关键高级醇,以及本研究所使用方法可否应用于其他香型白酒,还需更加深入的研究。本文旨在以进一步提高酒类品质,为降低饮后不适感奠定基础。
[1] 邱修柄. 米香型白酒上头成分的形成机理及控制措施研究[D]. 广州:仲恺农业工程学院, 2014.
[2] 曾祖训. 白酒醉酒度低的产品是消费者的新追求[J]. 酿酒科技, 2008(10): 115-116.
[3] 童国强, 杨强,乐细选. 白酒饮用舒适度的影响因素及应对措施[J]. 酿酒科技, 2011(8): 91-92;95.
[4] ZAEEM Z, ZHOU L, DILLI E. Headaches: a review of the role of dietary factors[J]. Curr Neurol Neurosci Rep, 2016, 16(11):101.
[5] 郑含笑, 张亮. 啤酒中酯类与高级醇对小鼠行为学影响的研究[J]. 吉林农业, 2011(5): 85.
[6] 曾朝珍, 张永茂,康三江,等. 发酵酒中高级醇的研究进展[J]. 中国酿造, 2015, 34(5): 11-15.
[7] 苟静瑜, 贾智勇,闫宗科,等. 降低白酒中高级醇含量的研究进展[J]. 酿酒, 2016, 43(4): 25-29.
[8] 罗杰, 敖宗华,王松涛,等. 浓香型白酒不同类别基酒中杂醇油相关性研究[J]. 酿酒科技, 2015(1): 43-44;47.
[9] COMER J, SCHULTEN K, CHIPOT C. Permeability of a fluid lipid bilayer to short-chain alcohols from first principles[J]. J Chem Theory Comput, 2017, 13(6):2 523-2 532.
[10] P L L,
L L, RNYAS E M, BUJDOS
RNYAS E M, BUJDOS O, et al. Aliphatic alcohols in spirits inhibit phagocytosis by human monocytes[J]. Immunopharmacol Immunotoxicol, 2015, 37(2):193-201.
O, et al. Aliphatic alcohols in spirits inhibit phagocytosis by human monocytes[J]. Immunopharmacol Immunotoxicol, 2015, 37(2):193-201.
[11] 汤二将. 高级醇毒性效应及其定量构效关系研究[D]. 福州:福建师范大学, 2013.
[12] 胡帮超, 汤有宏,唐林,等. 影响浓香型酒中高级醇生成因素的研究[J]. 酿酒, 2016, 43(6): 33-36.
[13] 孔小勇, 冷云伟,孙然,等. 影响黄酒中高级醇含量的工艺因素探讨[J]. 中国酿造, 2011, 30(10): 163-166.
[14] KIM H M, YANG G, KIM J Y, et al. Simultaneous determination of volatile organic compounds in commercial alcoholic beverages by gas chromatography with flame ionization detection[J]. J AOAC Int, 2017,100(5):1 492-1 499.
[15] 王维刚. 旷场实验在小鼠行为分析中的应用[J]. 中国细胞生物学学报, 2011,33(11):1 191-1 196.
[16] JUAREZ B, MOREL C, KU S M, et al. Midbrain circuit regulation of individual alcohol drinking behaviors in mice[J]. Nature Communications, 2017(8): 2 220.
[17] GOULD T D. Mood and Anxiety Related Phenotypes in Mice[M]. New York City:Humana Press, 2011.
[18] SCHLOESSER R J, LEHMANN M, MARTINOWICH K, et al. Environmental enrichment requires adult neurogenesis to facilitate the recovery from psychosocial stress[J]. Molecular Psychiatry, 2010, 15(12): 1 152-1 163.
[19] HE M, ZHANG Q, DENG C, et al. Time-dependent effects of olanzapine treatment on the expression of histidine decarboxylase, H1 and H3 receptor in the rat brain: The roles in olanzapine-induced obesity[J]. Psychoneuroendocrinology, 2017, 85:190-199.
[20] 皇甫洁, 王德良,刘蓉,等. 一种评价酒类饮后兴奋程度的方法: 中国, CN107908924A[P]. 2018-04-13.
[21] 孙世光, 李自发,孙鹏,等. 昆明小鼠旷场实验评价方法的三维结构[J]. 中华行为医学与脑科学杂志, 2011, 20(10): 875-877.
[22] SARAH C, CRAIG B, MIHALY K, et al. Agrp neuron activity is required for alcohol-induced overeating [J]. Nature Communications, 2017, 8:14 014.