氨基甲酸乙酯(ethylcarbamate,EC,也可称作Urethane)[1],常伴随发酵过程产生,在发酵酒中含量较高。EC是一种已被证实的致癌物[2-3],且乙醇可以促进其致癌性。2007年,世界卫生组织(World Trade Organization, WTO)将EC归类为可能会造成人类患癌症的2A组之中[4]。
黄酒作为我国传统发酵食品和民族特产,是世界上最古老的酒种之一,与葡萄酒、啤酒并称为世界三大古酒[5]。因生产过程涉及特殊的发酵工艺,EC存在于黄酒、葡萄酒、啤酒等酿造酒[6-7]和食用酒精中,而食用酒精又被广泛用于配制酒、白酒等产品中,是目前我国酒类生产中使用最为广泛的原料。因此,研究黄酒和食用酒精中EC含量测定,掌握其中EC的含量水平,促进酒类行业的健康发展,一直是科研机构的研究重点[8]。
已报道的黄酒及食用酒精中氨基甲酸乙酯的测定方法有分光光度法、高效液相色谱法(high performance liquid chromatography, HPLC)[9]、薄层色谱法和气相色谱-质谱联用法(gas chromatography-mass spectrometry, GC-MS)[10]。分光光度计操作简单,检测迅速,但易受其他杂质干扰,而高效液相色谱法的前处理操作复杂繁琐,成本昂贵。气相色谱-质谱联用法不但拥有气本色谱法(gas chromatography,GC)的高效能分离,而且还拥有了质谱法(mass spertrometry, MS)的高效能鉴别。它可以从复杂的基质中灵敏地测定某一特定的组分,因此气相色谱-串联质谱法是目前使用较多的测定酒精饮料中氨基甲酸乙酯的方法[11-13]。
本实验在参考大量相关文献及反复实验的基础上,采用GC-MS法测定黄酒和食用酒精中的氨基甲酸乙酯[14-17]。本方法使用碱性硅藻土固相萃取柱净化、浓缩后,同位素内标法定量。本方法的建立,有效提高了黄酒和食用酒精中氨基甲酸乙酯的检测效率和技术水平,为其他酒类中EC的测定提供技术参考,有效促进不同酒类中氨基甲酸乙酯限定标准的制定。
1 材料与方法
1.1 仪器与设备
GCMS-TQ8040气相色谱-质谱联用仪,日本岛津公司;QT-1涡旋混匀器,上海琪特分析仪器有限公司;Turbo VapO LV全自动氮吹浓缩仪,美国Biotage公司;WAT200609固相萃取装置(配真空泵),美国Waters公司;KH-500DV数控超声波清洗机,昆山禾创超声仪器有限公司;P330马弗炉,德国纳博热公司;XPE205天平(可读性0.01 mg),梅特勒-托利多仪器(上海)有限公司。
1.2 材料与试剂
1.2.1 试剂
实验所用样品:黄酒样品为上海老酒,产自浙江省绍兴市;食用酒精,产自西安食用酒精厂。
Na2SO4(分析纯),450 ℃烘烤4 h,冷却后贮存于干燥器中备用;NaCl(分析纯);正己烷、乙醚、甲醇(色谱纯);以上试剂均购自国药集团化学试剂公司。
氨基甲酸乙酯标准品(C3H7O2N,CAS51-79-6):购自上海源叶生物技术有限公司(纯度大于99.0%);D5-氨基甲酸乙酯标准品(C3H2D5NO2,CAS73962-07-9):购自甄淮生物科技有限公司(纯度>98.0%)。
1.2.2 标准溶液配制
准确称取10 mg(精确至0.000 01 g)氨基甲酸乙酯对照品,用甲醇溶解并定容至10 mL,配制成质量浓度为1 000.0 mg/L的标准溶液储备液,4 ℃避光保存;使用时用甲醇稀释为1.0和0.1 mg/L标准工作液。
准确称取10 mg(精确至0.000 01 g)D5-氨基甲酸乙酯对照品,用甲醇溶解并定容至10 mL,配制成质量浓度为1 000.0 mg/L的同位素内标储备液,4 ℃避光保存;使用时用甲醇稀释为1.0 mg/L同位素内标工作液。
分别精密移取20、40、80、120、240、600、1 200 μL标准工作液(1.0 mg/L)置2.0 mL容量瓶中,再分别精密加入200 μL同位素内标工作液(1.0 mg/L),用甲醇定容,得到10、20、40、60、120、300、600 μg/L系列标准溶液。
1.3 方法
1.3.1 色谱条件
色谱柱:HP-INNOWAX毛细管色谱柱(30 m×250 μm, 0.25 μm);载气:He,流速1 mL/min;进口样柱温:220 ℃;进样方式:不分流进样;进样量:1 μL; 溶剂延迟:11 min,传输线温度:250 ℃;升温程序:初温50 ℃,保持1 min,以8 ℃/min升至180 ℃,程序运行完后,240 ℃后运行5 min。
1.3.2 质谱条件
电离模式:电子轰击源(EI);能量为70 eV;四级杆温度:150 ℃;离子源温度:230 ℃;检测方式:选择离子监测(SIM);氨基甲酸乙酯选择监测离子(m/z):44、62、74、89[15],定量离子62;D5-氨基甲酸乙酯选择监测离子(m/z):64、76,定量离子64。
1.4 前处理操作
酒类样品摇匀,称取2 g(精确至0.000 1 g),加入100 μL D5-氨基甲酸乙酯工作液(1.0 mg/L),混匀后再加入0.3 g NaCl,超声溶解,在抽真空条件下,将样品溶液缓慢加入碱性硅藻土固相萃取柱中,静置10 min,经10 mL正己烷淋洗后,用10 mL乙酸乙酯-乙醚(95∶5)以约1 mL/min流速进行洗脱,收集洗脱液,并经2 g Na2SO4脱水后,35 ℃下用N2缓缓吹至近干,用甲醇定容至1.0 mL,经0.45 μm有机滤膜过滤后,供GC-MS分析。
2 结果与分析
2.1 色谱和质谱条件的选择
GC-MS法用于酒类中氨基甲酸乙酯检测的研究已有文献[18-22]报道,本文参考已发表文献,并进一步优化。由于EC含有的氨基具有较高的极性,故选择极性色谱柱HP-INNOWAX(30 m×250 μm,0.25 μm),并且在优化后的色谱条件下EC可获得较好的峰形、较高的灵敏度和分离度,杂质干扰少,结果如对照品色谱图1和样品色谱图5所示。在电子电离源条件下(70 eV),通过对D5-EC和EC标准品的分析,获得EC灵敏度和选择性较好的选择特征碎片离子(m/z) 62、44、74,如图2。

图1 EC及D5-EC的总离子流图
Fig.1 Total ion chromatography of EC and D5-EC
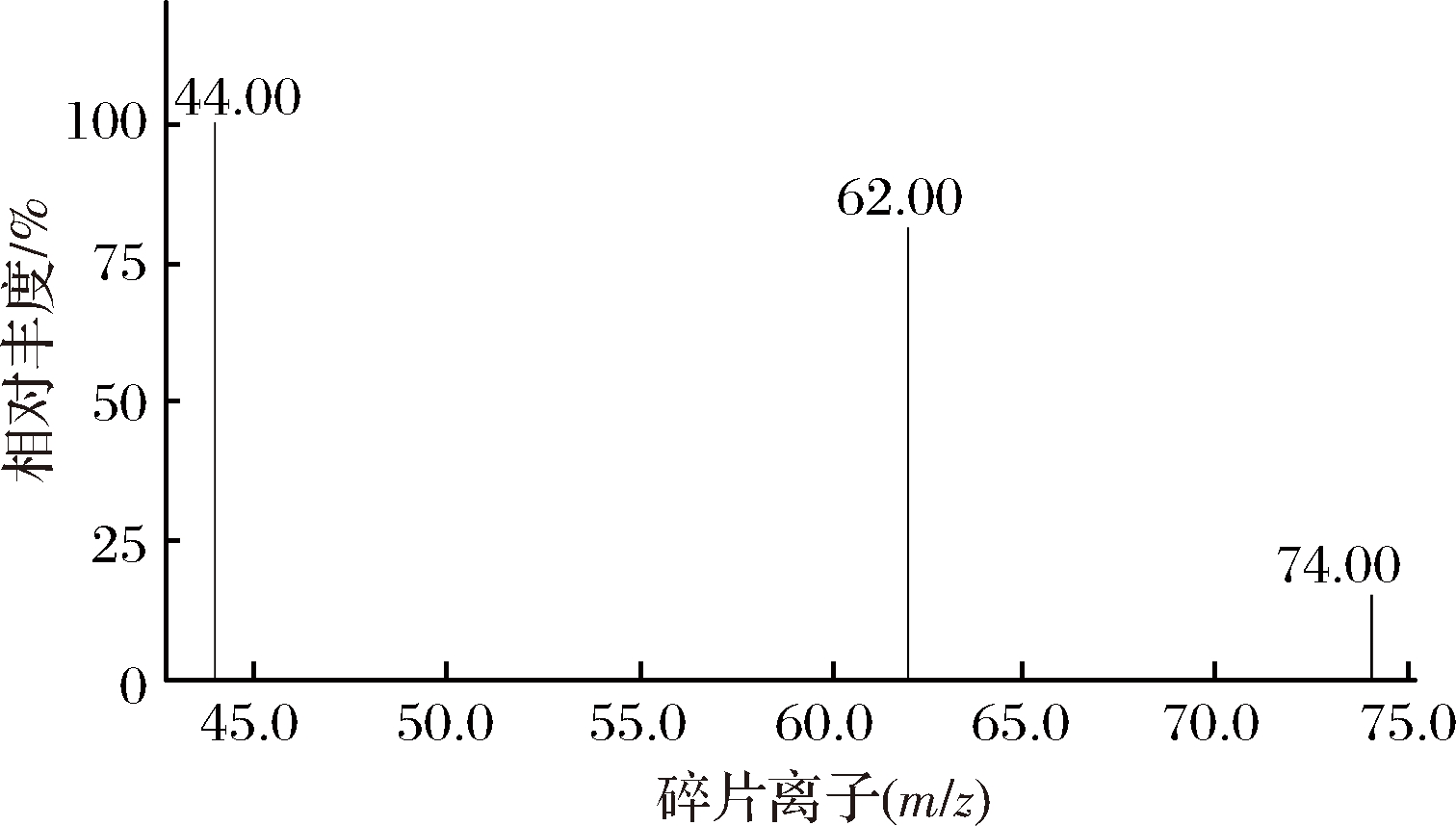
图2 氨基甲酸乙酯质谱图
Fig.2 Mass spectra of EC
通过对EC可能的裂解途径分析,氮带正电荷的自由基离子会发生α断裂生成m/z 44碎片离子,或经过氢自由基迁移、逆锹尔斯-阿尔德反应(Diels-Alder reaction)重排后生成m/z 62碎片离子,可以通过N-C-O的共轭系统稳定正离子,所以理论上m/z 62碎片离子具有最高的强度和稳定性,与实际实验结果相符,所以选择m/z 62作为定量离子。获得D5-EC灵敏度和选择性较好的选择特征碎片离子m/z 64、76,选择对应的m/z 64作为定量离子。
2.2 前处理的优化
本文主要研究对象是中国特色酒类—黄酒,而已报到文献的研究对象主要为白酒[18-21]或果酒、饮料[16-17, 22]。黄酒主要用糯米发酵,含有糊精、麦芽糖、葡萄糖、脂类,甘油、高级醇、维生素及有机酸等,基质非常复杂,直接进行质谱分析时基质效应明显,定性、定量准确性差,所以需要采用相应的前处理技术进行净化。
在前处理方面,为了所研制方法的普适性,本研究采用的是较为通用型碱性硅藻土固相萃取柱[23],进一步考察淋洗液、洗脱液和静置时间对回收率的影响。而王健等[18]和徐跃成等[22]都采用的固定品牌的专用固相萃取柱(cleanert EC-SPE,购于Agela,4 g/25 mL), 因为白酒属于蒸馏酒,酒精含量高,基质成分简单,上样后可以直接用二氯甲烷洗脱,白酒甚至不用前处理就可以直接进行质谱分析;但对于黄酒来说,该方法很难达到比较好的净化效果,况且二氯甲烷的毒性较强。出于以上原因本文研究了便于所有实验室使用的通用型碱性硅藻土固相萃取柱在黄酒中氨基甲酸乙酯检测中的应用,与苏占元等[19]的研究相比,简化了“洗脱液再经过填有2 mL N-丙基乙二胺固相吸附剂(primany secondary amine,PSA)填料柱净化”的前处理步骤。
2.2.1 淋洗液对EC回收率和基质效应的影响
正己烷和环己烷在性质上虽然没有太大差异,但两种物质的极性差异明显,因此作为淋洗液时,对黄酒中部分物质的去除能力不同,因此考察环己烷、正己烷2种淋洗液对回收率和基质效应的影响,研究发现环己烷和正己烷均不会将EC从固相萃取柱上洗脱下来。进一步研究环己烷和正己烷的淋洗除杂效果,结果发现正己烷和环己烷作为淋洗液时都有一定程度的除杂效果,如图4和图5所示,与未经过固相萃取净化处理的黄酒样品的检测结果(图3)相比,虽然环己烷和正己烷均有一定的除杂效果,但以正己烷作为淋洗液时基质干扰较少。因此本研究选择10 mL正己烷作为淋洗液。

图3 未经过固相萃取净化处理的黄酒样品色谱图
Fig.3 Chromatographic charts of yellow rice wine samples without solid phase extraction and purification

图4 经过环己烷淋洗固相萃取净化处理的黄酒样品色谱图
Fig.4 Chromatographic charts of yellow rice wine samples purified by solid phase extraction aftercyclohexane elution
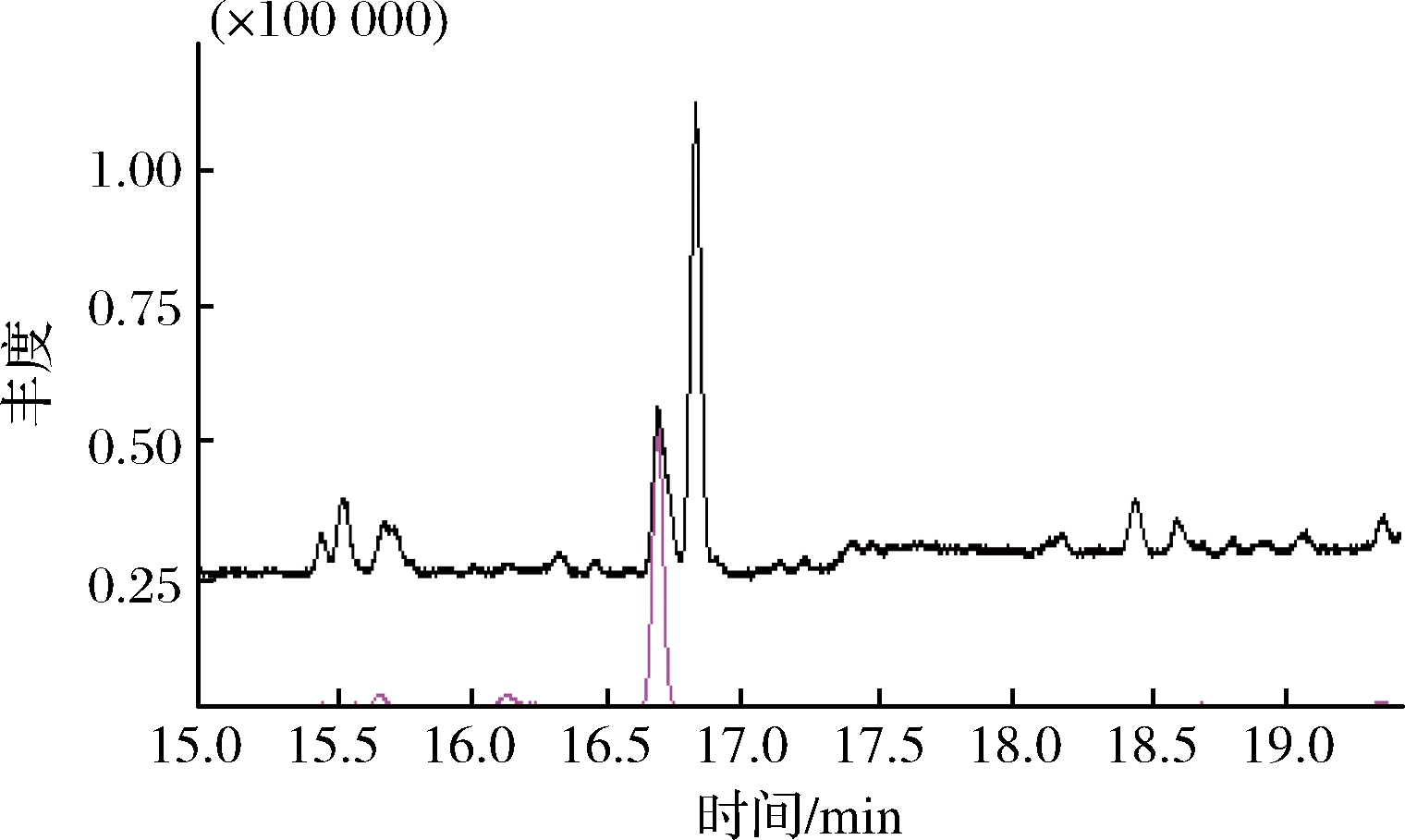
图5 经过正己烷淋洗固相萃取净化处理的黄酒样品色谱图
Fig.5 Chromatographic charts of yellow rice wine samples purified by solid phase extraction after n-hexane elution
2.2.2 洗脱液对EC回收率的影响
分别选择乙酸乙酯和含有5%、10%、30%、50%(质量分数)乙醚的乙酸乙酯溶液10 mL,以约1 mL/min流速进行洗脱。其余条件不变,按照样1.4前处理操作进行实验,回收率结果如表1所示。
采用双总体t检验确定不同样本平均数与其各自所代表的总体的差异是否显著,从而确定洗脱液中乙醚的最佳含量。将表1平均回收率![]() 和方差S代入t检验计算公式(1)计算其中含5%乙醚(质量分数)的数据组作为参考组,即
和方差S代入t检验计算公式(1)计算其中含5%乙醚(质量分数)的数据组作为参考组,即![]() 和n1始终是第一组的数据,利用上述公式计算含乙醚0%、10%、30%和50%(质量分数)的回收率与含5%乙醚的回收率计算结果是否存在显著性差异。通过公式(1)计算出0%乙醚的t=0.492,10%乙醚的t=1.826,30%乙醚的t=3.954,50%乙醚的t=11.477。自由度ν=n1+n2-2=10,P取0.10,查t检验表t0.1/10=1.812,所以当洗脱液中乙醚含量为0%的t=0.492<t0.1/10,说明洗脱液中不含乙醚时的回收率与5%的乙醚的回收率没有明显差异,当洗脱液中含10%、30%和50%乙醚的t均大于t0.1/10,与5%乙醚的回收率差异显著,并且随着洗脱液中乙醚含量的增加,黄酒中EC的回收率不断减少,所以可以选择在乙酸乙酯的洗脱液中不加乙醚或加入质量分数5%乙醚溶液进行洗脱。
和n1始终是第一组的数据,利用上述公式计算含乙醚0%、10%、30%和50%(质量分数)的回收率与含5%乙醚的回收率计算结果是否存在显著性差异。通过公式(1)计算出0%乙醚的t=0.492,10%乙醚的t=1.826,30%乙醚的t=3.954,50%乙醚的t=11.477。自由度ν=n1+n2-2=10,P取0.10,查t检验表t0.1/10=1.812,所以当洗脱液中乙醚含量为0%的t=0.492<t0.1/10,说明洗脱液中不含乙醚时的回收率与5%的乙醚的回收率没有明显差异,当洗脱液中含10%、30%和50%乙醚的t均大于t0.1/10,与5%乙醚的回收率差异显著,并且随着洗脱液中乙醚含量的增加,黄酒中EC的回收率不断减少,所以可以选择在乙酸乙酯的洗脱液中不加乙醚或加入质量分数5%乙醚溶液进行洗脱。
表1 不同洗脱液条件下的回收率
Table 1 Recovery of differenteluents
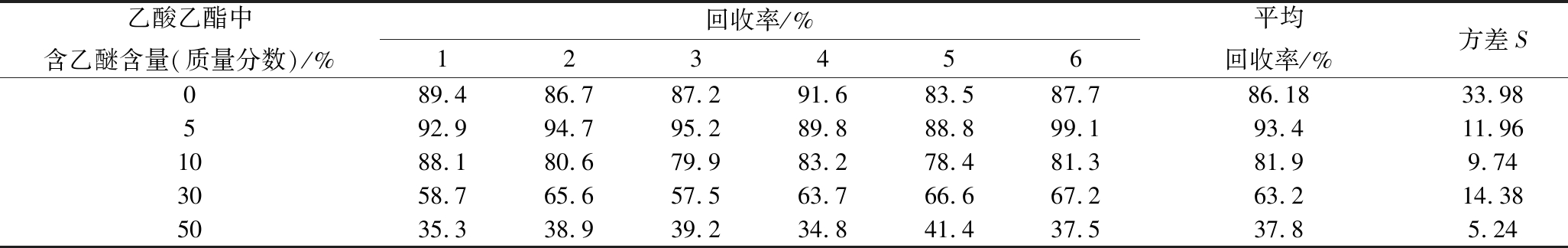
乙酸乙酯中含乙醚含量(质量分数)/%回收率/%123456平均回收率/%方差S089.486.787.291.683.587.786.1833.98592.994.795.289.888.899.193.411.961088.180.679.983.278.481.381.99.743058.765.657.563.766.667.263.214.385035.338.939.234.841.437.537.85.24
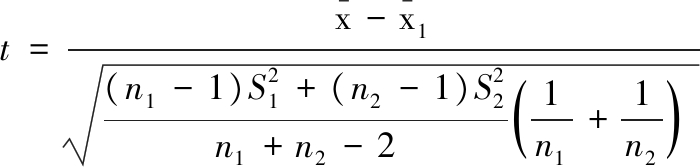
(1)
式中:t为两组结果间双总体检验的统计量,![]() 为含5%乙醚的平均回收率;n1和n2为相比较的两组样本的测量次数,即n1=n2=6;S1为含5%乙醚的回收率的方差;
为含5%乙醚的平均回收率;n1和n2为相比较的两组样本的测量次数,即n1=n2=6;S1为含5%乙醚的回收率的方差;![]() 为不同乙醚含量的平均回收率;S2为含不同乙醚含量的回收率的方差。
为不同乙醚含量的平均回收率;S2为含不同乙醚含量的回收率的方差。
2.2.3 不同静置时间对EC回收率的影响
按照1.4前处理操作所述,酒类样品摇匀,称取2 g(精确至0.000 1 g),加入100 μL D5-EC工作液(1.0 mg/L),混匀后再加入0.3 g NaCl,超声溶解,在抽真空条件下,将样品溶液缓慢加入碱性硅藻土固相萃取柱中,进行静置处理。
将样品分别静置1、5、10、15、20、30 min,用5%(质量分数)乙酸乙酯-乙醚溶液洗脱,其余条件不变,按照样品前处理进行实验。实验结果如图6所示,随着静置时间的推移,中EC的回收率逐渐增高,当静置时间大于10 min,回收率几乎没有变化。
2.3 方法学考察
2.3.1 线性范围、检出限和定量限
按照本研究建立的方法对“1.2.2”所述的系列标准溶进行检测,以D5-EC作为同位素内标,以待测物质的峰面积和相应同位素内标的峰面积的比值(Y)为纵坐标,质量浓度(X)为横坐标绘制标准曲线,结果如表2所示,得到线性回归方程Y=0.004 41X+0.002 834,r2=0.999 3。结果表明EC在10~600 μg/L线性关系良好。
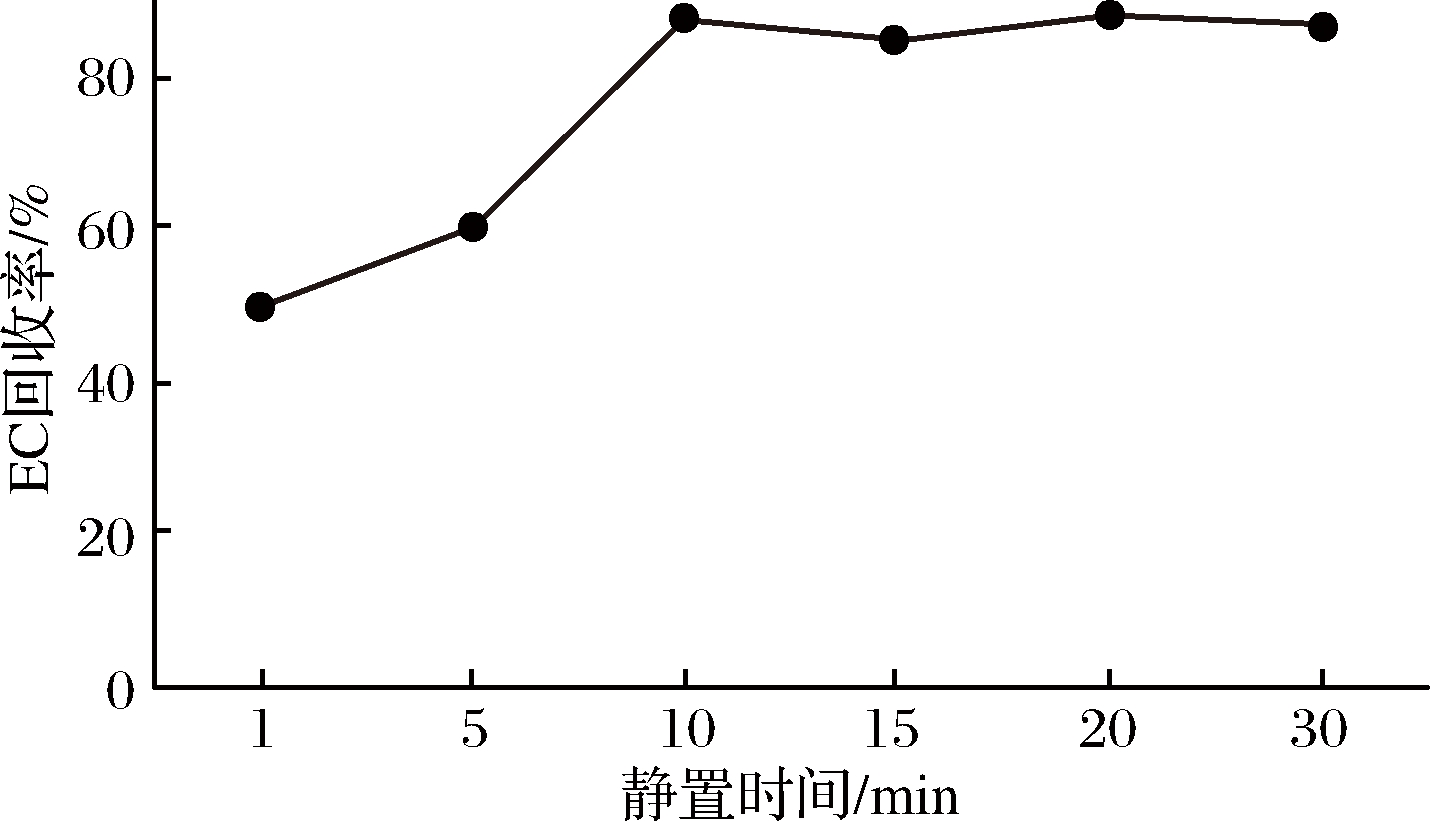
图6 不同静置时间对EC回收率的影响
Fig.6 Effect on EC recovery of different standing time
分别在2 g黄酒和2 g食用酒精样品中(每种样品各2份),分别加入40 μL氨基甲酸乙酯标准工作液(0.1 μg/mL),理论加标浓度为2.0 μg/kg,再加入100 μL D5-EC标准工作液,按照1.4前处理操作后,分别用甲醇定容至1.00 mL,过0.45 μm有机滤膜,供GC-MS分析,S/N的检测结果见表2。每个检出限加标都采用3倍的信噪比计算方法的检出限,结果表明,3倍S/N的检测浓度在0.10~0.15 μg/kg,由于受到前处理方式、仪器设备条件和基质效应的影响,本方法取1.0 μg/kg作为方法检出限,3.0 μg/kg作为本方法的定量限,结果表明,本方法的检出限与相关报道基本一致[23-25],可满足检测需求。
表2 方法的线性范围、检出限和定量限
Table 2 The linear range, detection limit and quantitative limit of the method

样品理论加标浓度/(μg·kg-1)S/N方法检出限/(μg·kg-1)方法定量限/(μg·kg-1)黄酒2.0392.0481.03.0食用酒精2.0642.0611.03.0
2.3.2 方法的回收率和精密度
为了验证方法的准确性和可靠性,在阴性样品黄酒和食用酒精中分别加入EC标准工作液(1.0 mg/L),加标水平为5、100和250 μg/kg,每个浓度水平按照优化后的方法平行测试6次,回收率和RSD的计算结果见表3。结果表明,EC在黄酒中的回收率为81.2%~89.5%,相对标准偏差为3.7%~5.0%,在食用酒精中的回收率为91.2%~99.4%,相对标准偏差为3.1%~4.1%,本方法的准确度和精密度良好,可以满足黄酒和食用酒精中EC检测的要求。
2.3.3 实际样品检测
随机抽取市场在售的20个品牌的不同规格、不同等级的黄酒和20个不同企业生产的食用酒精,按照本实验建立的方法进行检测,检测结果保留3位有效数字,结果见表4。
表3 方法的精密度和回收率(n=6)
Table 3 Recovery and precision of the method

加标浓度/(μg·kg-1)黄酒食用酒精检测结果/(μg·kg-1)回收率/%平均回收率/%RSD/%检测结果/(μg·kg-1)回收率/%平均回收率/%RSD/%54.1182.203.9879.603.8276.404.3587.003.8977.804.2184.2081.25.04.5190.204.6893.604.7294.404.3587.004.6993.804.4188.2091.23.510088.588.5084.384.3083.183.1086.786.7082.282.2090.290.2085.83.794.594.50105.3105.3097.497.40100.7100.7096.296.20102.2102.2099.44.1250225.790.28222.388.92214.285.68235.194.04214.585.80231.292.4889.53.8235.394.12243.597.40232.793.08235.194.04251.5100.60234.193.6495.53.1
表4 实际样品的检测结果
Table 4 Results of EC determined insumple food

黄酒样品食用酒精样品样品名称包装分类样品规格质量等级检验结果/(μg·kg-1)样品名称包装分类样品规格质量等级检验结果/(μg·kg-1)1号黄酒预包装2.1 L/桶二级29.41号食用酒精---75.82号黄酒预包装2.5 L/瓶二级43.32号食用酒精---60.63号黄酒预包装4 L/桶一级1123号食用酒精---19.04号黄酒预包装500 mL/壶-1274号食用酒精---未检出5号黄酒预包装450 mL/坛-1275号食用酒精---13.46号黄酒预包装1 L/壶一级62.56号食用酒精---14.67号黄酒预包装1 L/坛优等品19.27号食用酒精---未检出8号黄酒预包装500 mL/瓶-1118号食用酒精---85.19号黄酒预包装375 mL/瓶-1129号食用酒精---67.410号黄酒预包装3 L/瓶-96.710号食用酒精---10.811号黄酒预包装1 L/坛-11211号食用酒精---未检出12号黄酒预包装2.5 L/瓶-未检出12号食用酒精---17.913号黄酒预包装3 L/瓶-99.713号食用酒精---12714号黄酒预包装2.5 L/瓶-未检出14号食用酒精---未检出15号黄酒预包装2 500 mL/瓶-21.115号食用酒精---未检出16号黄酒散装--21516号食用酒精---15717号黄酒预包装350 mL/瓶一级26717号食用酒精---11218号黄酒预包装1.5 L/瓶优级20318号食用酒精---未检出19号黄酒预包装2 L/瓶优级15419号食用酒精---28.220号黄酒散装-优等品10820号食用酒精---124
注:“-”表示无。
通过检测发现,黄酒中基本都含有不同浓度的EC,EC检测出率为90%,其中含量超过100 μg/kg的有10批,占总抽样量的50%,含量最高的第17号黄酒样品的检测结果为267 μg/kg。说明本实验建立的黄酒中EC的检测方法符合实际检测的需要,检出限和定量限能满足实际检测要求,本方法制定的线性范围符合实际检测的需要,也说明黄酒中普遍含有一定浓度的EC,所以建议黄酒生产企业应该改进和规范生产工艺,进一步控制黄酒中EC浓度,同时也为监管部门制定黄酒中EC含量的相关标准提供参考依据。通过表4中食用酒精样品的检测结果发现,由于食用酒精的生产原料和工艺不同于黄酒,所以食用酒精中EC的检出率为70%,较黄酒低,另外含量超过100 μg/kg的食用酒精只有4批,占总抽样批次的20%,含量最高的16号食用酒精样品的检测结果为157 μg/kg,说明本研究建立的方法同样适用于食用酒精中EC的检测,也说明部分食用酒精中含有一定浓度的EC,为监管部门制定食用酒精中EC含量的相关标准提供参考依据。
3 结论
本实验选用黄酒和食用酒精为研究对象,建立了气相色谱-质谱联用法(GC-MS)快速测定黄酒和食用酒精中氨基甲酸乙酯含量。样品经过碱性硅藻土固相萃取柱净化、浓缩后,用GC-MS进行测定,同位素内标法定量。在优化的条件下,对EC的线性范围、相关系数、回收率、精密度和检出限进行考察。结果表明氨基甲酸乙酯在10~600 μg/L线性关系良好,r2=0.999 3。 当加标水平为5、100和250 μg/kg时,黄酒的加标回收率为81.2%~89.5%,相对标准偏差(RSD)为3.7%~5.0%。食用酒精的加标回收率为91.2%~99.4%,相对标准偏差(RSD)为3.1%~4.1%,方法检出限为1.0 μg/kg,定量限为3.0 μg/kg。利用本实验建立的方法对市场在售的20批黄酒和20批食用酒精样品进行检测,结果表明本实验建立的方法符合黄酒和食用酒精样品中EC的检测需要,检出限和定量限能满足实际检测要求,本方法制定的线性范围符合实际检测的需要,该方法定量准确、灵敏度高,适用于黄酒和食用酒精中氨基甲酸乙酯的测定。
[1] MADRERA R R, VALLES B S. Determination of ethyl carbamate in cider spirits by HPLC-FLD[J]. Food Control, 2009, 20(2): 139-143.
[2] PFLAUM T, HAUSLER T, BAUMUNG C, et al. Carcinogenic compounds in alcoholic beverages:An update[J]. Archives of Toxicology, 2016, 90(10): 2 349-2 367.
[3] XIA Qiang, YANG Caijiao, WU Chongde, et al. Quantitative strategies for detecting different levels of ethyl carbamate (EC) in various fermented food matrices: An overview[J]. Food Control, 2018, 84: 499-512.
[4] International Agency for Cancer Research (IARC). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Alcoholic Beverage Consumption and Ethyl Carbamate (urethane)[M]. Lyon France: IARC, 2010.
[5] 肖泳, 邓放明. 发酵食品中氨基甲酸乙酯的研究进展[J]. 食品安全质量检测学报, 2012(3): 216-221.
[6] GOWD V, SU H, KARLOVSKY P, et al. Ethyl carbamate: An emerging food and environmental toxicant[J]. Food Chemistry, 2018, 248: 312-321.
[7] CHEN Dawei, REN Yiping, ZHONG Qiding, et al. Ethyl carbamate in alcoholic beverages from China: Levels, dietary intake, and risk assessment[J]. Food Control, 2017, 72: 283-288.
[8] 黄振波. 气相色谱法测定酒中EC[J]. 现代食品, 2016, 3(6): 74-76.
[9] 陈达炜, 苗虹, 赵云峰,等. 酒精度对高效液相色谱-荧光法分析白酒中氨基甲酸乙酯含量的影响[J]. 色谱, 2013, 31(12):1 206-1 210.
[10] 徐小民, 何华丽, 阮瑜迪,等. 气相色谱-串联质谱法测定黄酒和酱油中的EC[J]. 食品安全质量检测学报, 2013, 4(3): 705-709.
[11] 周勇, 李晓明, 梁德沛,等. 气相色谱-串联质谱法测定酒中氨基甲酸乙酯的含量[J]. 酿酒科技, 2013(5):97-99.
[12] RYU D, CHOI B, KIM E, et al. Determination of ethyl carbamate in alcoholic beverages and fermented foods sold in Korea[J]. Toxicological Research, 2015, 31(3): 289-297.
[13] 柯润辉,王丽娟, 安红梅, 等. 超高效液相色谱-串联质谱法同时测定白酒中氨基甲酸乙酯和8种甜味剂[J]. 食品与发酵工业, 2016, 42(4): 174-178.
[14] 李凤华, 曹艳平, 王锡宁. GC-MS法测定酒中的氨基甲酸乙酯[J]. 中国卫生检验杂志, 2009, 19(6): 1 240-1 241.
[15] 宋利军, 杨竹,周银古,等. 江西省产黄酒中氨基甲酸乙酯残留量的GC-MS分析[J]. 中国酿造, 2014, 33(3): 147-150.
[16] 张雪娜, 叶长文, 邹更,等. 基于基质修饰的多次顶空固相微萃取-气相色谱法检测酒精饮料中的氨基甲酸乙酯[J]. 色谱,2011, 29(8): 701-705.
[17] 王丽娟, 柯润辉, 王冰,等. 超高效液相色谱-电喷雾串联质谱法直接测定黄酒和葡萄酒中氨基甲酸乙酯[J]. 色谱, 2012, 30(9): 903-907.
[18] 王健, 艾涛波, 岳清洪. 固相萃取和同位素内标法检测白酒中氨基甲酸乙酯[J]. 中国酿造, 2015, 34(1): 115-117.
[19] 苏占元, 郑若欣, 杨晓军, 等. 白酒中氨基甲酸乙酯含量检测与分析[J]. 酿酒, 2019 (1): 55-57.
[20] 张顺荣, 范文来, 徐岩. 不同香型白酒中氨基甲酸乙酯的研究与风险评估[J]. 食品与发酵工业, 2016, 42(5): 198-202.
[21] DU Hai, SONG Zhewei, XU Yan. Ethyl carbamate formation regulated by Lactic Acid Bacteria and Nonconventional Yeasts in solid-state fermentation of Chinese moutai-flavor liquor[J]. Journal of Agricultural and Food Chemistry, 2018, 66(1):387-392.
[22] 徐跃成, 王健, 艾涛波,等. 气质联用内标法测定饮料酒中氨基甲酸甲酯和氨基甲酸乙酯[J]. 中国酿造, 2018, 37(4): 179-182.
[23] 马亚萍, 孙守成, 邓富全. 用多维色谱-稳定同位素稀释质谱联用技术测定酒中氨基甲酸乙酯[J]. 分析化学, 1996(1): 190-192.
[24] 耿予欢, 吕芬, 黄伟雄,等. 黄酒中氨基甲酸乙酯的分析与控制[J]. 现代食品科技, 2013, 29(9): 2 271-2 275.
[25] 王利平, 刘杨岷, 袁身淑. 固相微萃取气质联用分析黄酒中的氨基甲酸乙酯[J]. 江苏食品与发酵, 2003(4): 3-6.