氯丙醇酯(bound monochloropropanediol,MCPDE)是氯丙醇(monochloropropanediol,MCPD)连接不同高级脂肪酸后产生的酯类化合物[1]。2004年SVEJKOVSKA等[2]发现食品中含有高含量的氯丙醇酯。随后氯丙醇酯在多种食用油[3-4],油脂[5]和高油脂食品[6],甚至在婴儿奶粉中被检测到[7]。氯丙醇酯本身具有一定毒性[8],同时体外实验显示,氯丙醇酯可通过肠道内的脂肪酶水解成氯丙醇[9-10]产生毒性。热反应的过程会产生低剂量的氯丙醇酯等毒性物质[11],所以对氯丙醇酯在食品中的含量进行调查,并进行风险评估,对人们的身体健康十分重要。
目前,氯丙醇酯的研究多集中于油脂精炼加工[4,12]过程中,国内外对于食品中氯丙醇酯的研究相对少[13-14]。SVEJKOVSKA等[2]发现在一些奶酪、黑麦芽、烤花生、腊肠、和烤鸡中3-MCPDE含量较高(0.14~6.10 mg/kg);KÜSTERS等[14]采用GC-MS检测了高油脂食品(如烘焙食品,甜食,肉汁,汤粉,食用油)中MCPDE含量,其中含量最高为人造黄油样品,为1 417 μg/kg;里南[15]对我国的食用油、方便面和油炸食品进行了检测,结果表明,油炸食品中氯丙醇酯的污染较为严重,3-MCPDE和2-MCPDE的含量为0.064~7.67 mg/kg脂肪和0.072~5.02 mg/kg脂肪。
油炸作为高温下油脂直接接触食品的一种加工方式,很可能导致最终食品中含有较高含量的氯丙醇酯,对人体健康造成一定的风险。国内虽对油炸食品中3-MCPDE和2-MCPDE含量多有分析,但是对脂肪提取部分的优化不足。国外研究者[16-17]使用加速溶剂萃取的方式提取食品中的氯丙醇酯。超声波仪器属于实验室的常用仪器,对很多物质提取有重要作用[18],通过优化超声波提取的条件,经过前处理及GC-MS/MS分析进而确定3-MCPDE和2-MCPDE的含量。
1 材料与方法
1.1 材料与试剂
实验样品:油饼(编号1),菜丸子(编号2),麻花(编号3),虾片(编号4),炸花生(编号5),馓子(编号6),锅巴(编号7),咯吱盒(编号8),炸鱼(编号9),炸羊肉丸(编号10),炸鸡肉(编号11),麻花(编号12),超市。
试剂:叔丁基甲基醚(t-butyl methyl ether, TBME),乙醚,乙酸乙酯,正己烷,NaOH,石油醚,甲醇,四氢呋喃(均为分析纯),国药集团化学试剂有限公司;H3PO4,苯硼酸,异辛烷(均为分析纯),百灵威科技有限公司。
3-氯-1,2-丙二棕榈酸酯(1,2-distearoyl-3-chloropropanediol, pp-3-MCPD),d5-3-氯-1,2-丙二棕榈酸酯(d5-1,2-distearoyl-3-chloropropanediol, d5-pp-3-MCPD),2-氯-1,3-丙二硬脂酸酯(1,3-distearoyl-2-chloropropanediol, pp-2-MCPD),均为标准品,纯度>97%,Toronto Research Chemicals公司。
溶液配制:pp-3-MCPD溶液,用四氢呋喃稀释至10.0 μg/mL;pp-2-MCPD溶液,用四氢呋喃稀释至10.0 μg/mL;d5-pp-3-MCPD溶液,用四氢呋喃稀释至5.0 μg/mL;甲醇钠溶液,0.25 gNaOH溶解于100 mL甲醇中,摇匀至全部溶解,放置于-22 ℃冰箱中;NaBr溶液,600 g NaBr加入3.0 mL H3PO4定容于1.0 L水中,移取600 μL,加入350 μL甲醇钠溶液,放置于-22 ℃冰箱中;乙醚/乙酸乙酯溶液,将30 mL乙醚与20 mL乙酸乙酯混合放置于存储瓶中;苯硼酸溶液,称取200 mg苯硼酸溶解于10 mL丙酮中。
1.2 仪器与设备
T-403电子天平,北京赛多利斯仪器系统有限公司;Pipetman M EF9697精密移液器,法国Gilson公司;TSQ8000三重串联四级杆气相质谱仪,美国Thermo Fisher公司;BF-2000氮气吹干仪,北京八方世纪科技有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;JYL-C012食物打碎机,九阳股份有限公司。
1.3 方法
1.3.1 总脂肪含量测定
总脂肪含量的检测参照GB/T 5009.6—2016[19]并进行适当修改。称取5.00 g样品,移入滤纸筒内。将滤纸筒放入脂肪提取器的抽提筒中,连接已干燥的250 mL抽提瓶,由冷凝管上端加入190 mL石油醚,于油浴锅内100 ℃加热,不断回流提取6 h。反应结束后取下接收瓶,用旋转蒸发仪将有机溶剂蒸发,再于(100±5) ℃干燥2 h,放干燥器中冷却0.5 h后称重,重复操作直至恒重。
1.3.2 样品前处理
MCPDE提取(油脂提取物):将试样均匀打碎,称取试样5.00 g,加入20 mL TBME,充分振摇混匀,40 ℃超声提取20 min,以3 000 r/min离心5 min,转移出上层溶剂。下层样品重复提取(1次),合并有机相,以氮气浓缩至质量不再减少。
MCPDE的酯化及衍生[20]:称取100 mg油脂提取物,加入80 μL内标物d5-pp-3-MCPD,600 μL乙醚,摇晃至溶解。油脂提取物在-22~-25 ℃保持15 min,加入350 μL甲醇钠溶液,于-22 ℃反应16 h。取出反应液,加入600 μL NaBr溶液于-22 ℃停止反应,氮吹。加入正己烷600 μL,剧烈摇,在室温下静置5 min。 用吸管移去有机相,再用600 μL正己烷清洗1次,移去有机相。用600 μL乙醚/乙酸乙酯溶液提取3次,转移有机相并用无水Na2SO4除水,加入80 μL衍生溶液,常温超声5 min,氮吹至干,用500 μL的异辛烷复溶。
1.3.3 仪器分析条件
(1)气相色谱条件
HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm);初温60 ℃,以6 ℃/min升至150 ℃,保持2 min;再以10 ℃/min升至280 ℃,保持5 min;载气He,纯度99.999%,流速1.0 mL/min;进样口温度250℃;不分流进样,进样量1.0 μL。
(2)质谱条件:EI源,电子能量70 eV,离子源温度280 ℃,传输线温度280 ℃,选择反应扫描模式(selective reaction monitoring,SRM)参数如表1所示。
表1 MCPDEs的保留时间和二级质谱参数
Table 1 retention times and m/z of native and stable isotopelabelled MCPDEs for GC-MS/ MS SRM analysis

化合物保留时/min母离子子离子碰撞能d5-pp-3-MCPD15.7715093122011508pp-3-MCPD15.8414791121961478pp-2-MCPD16.57104771419610414
1.4 总脂肪及氯丙醇酯含量计算
(1) 总脂肪含量计算,见公式(1)。
(1)
式中:x,试样中粗脂肪含量,g/100g; m1,接收瓶和粗脂肪的总质量, g; m0,接收瓶的质量, g;m2,试样的质量, g。
(2)氯丙醇酯的含量
内标标准曲线建立:3-MCPDE和2-MCPDE的定量结果均以游离态3-MCPD、2-MCPD,换算系数如表2所示。以pp-3-MCPD(或pp-2-MCPD)与d5-pp-3-MCPD的峰面积比与相对应的pp-3-MCPD(或pp-2-MCPD)浓度做标准曲线,拟合回归方程(见公式(2))。
y=a×x+b
(2)
式中:y,标准物与内标物峰面积比; a,拟合曲线的斜率; b,拟合曲线的截距; x,pp-3-MCPD(或pp-2-MCPD)的质量(以MCPD计),μg。
样品中pp-3-MCPD(或pp-2-MCPD)的含量计算(以MCPD计,μg),见公式(3)。
(3)
式中:w,样品中pp-3-MCPD(或pp-2-MCPD)的含量,μg/g;x/100,pp-3-MCPD(或pp-2-MCPD)在油脂提取物中的含量,μg/mg,100是提取的质量,mg;m油,油脂提取物含量,mg;w样,称取的样品质量,g。
表2 MCPDE及其同位素折算系数
Table 2 Conversion coefficient of MCPDE and d5-MCPDE
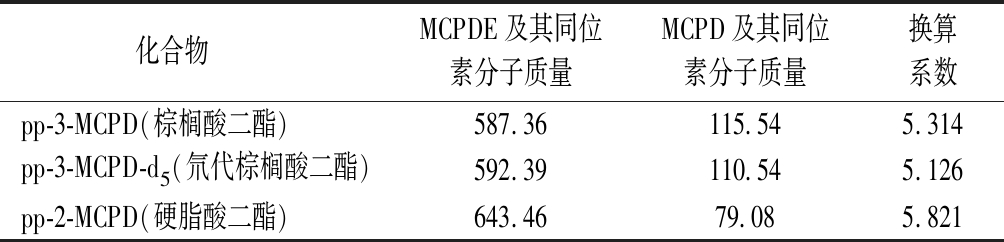
化合物 MCPDE及其同位素分子质量MCPD及其同位素分子质量换算系数pp-3-MCPD(棕榈酸二酯)587.36115.545.314pp-3-MCPD-d5(氘代棕榈酸二酯)592.39110.545.126pp-2-MCPD(硬脂酸二酯)643.4679.085.821
2 结果与分析
2.1 MCPDE提取优化
为保证MCPDE在分析时不受到食品复杂基质干扰,先要进行脂肪提取。为使提取过程更加完全,需要对提取参数进行优化。提取过程的主要优化参数包含有机溶剂的种类和提取的温度。溶剂的选择是重要因素之一,因为不同溶剂对目标物的萃取效率不一样;同时,需要避免引入氯离子,氯离子的存在可能会造成副反应。有研究者认为叔丁基甲基醚(TBME)被认为是最适合的溶剂[21],然而MA等[22]认为TBME与乙酸乙酯在体积比为1∶5混合时提取效果更好,因为混合溶剂的极性不同,可以增加提取效率。提取温度也是影响提取效率的重要因素,过高的温度会使有机溶剂挥发,导致提取率偏差较大;同时,高温可能引起一些副反应。过低的温度会导致提取不完全,提取率低。所以,选择40 ℃和60 ℃两个提取温度进行优化。最优条件根据脂肪提取率和MCPDE含量结果确定,结果如图1、图2所示。

1-40 ℃ TBME; 2-60 ℃ TBME;3-40 ℃正己烷:TBME(体积比1∶2);4-60 ℃正己烷:TBME(体积比1∶2)
图1 不同超声提取条件下脂肪提取率的比较
Fig.1 Comparison of different extraction protocols based on ultrasonic extraction technique for fat recovery from the fried dough twist

1-40 ℃ TBME;2-60 ℃ TBME;3-40 ℃正己烷:TBME(体积比1∶2);4-60 ℃正己烷:TBME(体积比1∶2)
图2 不同超声提取条件下MCPDEs含量的比较
Fig.2 MCPDEs content measured in fried dough twist with different extraction protocols
以麻花(编号12)作为优化样品,根据国标方法测定其脂肪含量为31.5%。在4种提取条件中,在40 ℃条件下,正己烷∶TBME=1∶2(体积比)的提取效率最高,40 ℃ TBME提取效率次之,而在60 ℃条件下,提取效率较低。可见,40 ℃提取效率高于60 ℃的提取效率,这可能是由于在提取过程中,高温使有机溶剂挥发过多,提取效率下降。在溶剂的选择上,正庚烷与TBME因其极性不同,溶剂混合后提取效果更好。
另外,MANIRAKIZA等[23]认为正己烷与丙酮(体积比4∶1)混合时对样品中总脂肪的提取最好,但是SAMARAS等[24]指出这种溶剂组合的方式提取会将含水量高食品中的水分一同提取出来,不利于后面氯丙醇酯的分析。为进一步验证结果的有效性,对比不同超声提取条件下MCPDE检测的含量结果,如图2所示。
由图2可知,40 ℃提取溶剂为MTBE时提取效率最高,3-MCPDE含量为12.695 mg/kg,2-MCPDE含量为9.183 mg/kg。所以,选择40 ℃,MTBE为溶剂对油炸食品进行提取。
2.2 MCPDE检测方法验证
选取9个不同质量浓度分别建立3-MCPDE和2-MCPDE 的标准曲线,由表3可知,2条标准曲线的相关系数分别为0.998和0.992,线性良好;以信噪比(S/N)=3确定3-MCPDE和2-MCPDE的检出限(LOD)为0.006 8 μg/g和0.0062 μg/g,以信噪比(S/N)=10确定定量限(LOQ)为0.026 μg/g和0.012 μg/g。
检测方法的准确度可以通过添加已知含量的标准物来确定。在咯吱盒(编号8)中加入2种不同质量浓度的pp-3MCPD和pp-2-MCPD,质量浓度分别为0.11 mg/L 和0.086 mg/L,0.22 mg/L和0.17 mg/L,每个样品重复进样6次确定方法的重复性,分析结果如表4所示。由表4可知,两种氯丙醇酯的回收率为93.8%~111.7%,相对标准偏差(RSD)为1.1%~4.8%。
表3 MCPD的标准曲线、定量限及检出限结果
Table 3 Standard curves, limits of detection (LOD) and limits of quantification (LOQ) of MCPDs

化合物斜率截距R2检出限/(μg·g-1)定量限/(μg·g-1)pp-3-MCPD7.325 9-0.051 70.9980.006 80.026pp-2-MCPD3.510 3-0.302 00.9920.006 20.012
表4 MCPD的回收率和相对标准偏差
Table 4 The accuracy and relative standard deviation of MCPDs
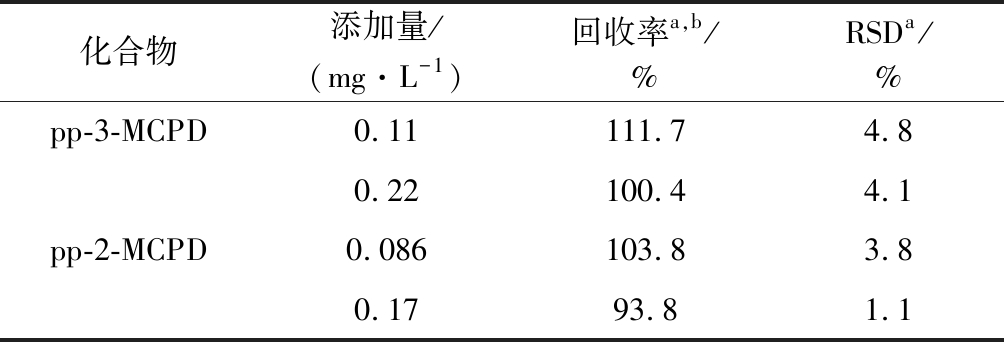
化合物添加量/(mg·L-1)回收率a,b /%RSDa/%pp-3-MCPD0.11111.74.80.22100.44.1pp-2-MCPD0.086103.83.80.1793.81.1
注:an=6;b d5-pp-3-MCPD作为内标物。
2.3 油炸食品中MCPDEs含量分析
根据上述的检测方法,分析中国油炸食品中3-MCPDE 和2-MCPDE的含量,每个分析样品平行进行3次,检测结果如表5所示。
由表5可知,在检测的12个样品中,油脂的含量为8.1%~38.9%,3-MCPDE的含量为0.056~0.672 μg/g, 2-MCPDE的含量为ND~0.424 μg/g,其中3-MCPDE含量最高的样品为虾片(样品4),最低的为炸花生(样品5),2-MCPDE的含量最高的为麻花(样品12),最低的为炸花生(样品5)。
表5 油炸食品中3-MCPDE和2-MCPDE的含量
Table 5 Levels of 3-MCPD esters and 2-MCPD esters in fried foods in China

样品油脂提取物/%a含量/ (μg·g-1)RSD/%3-MCPDE2-MCPDE3-MCPDE2-MCPDE(2-MCPDE∶3-MCPDE)/%111.80.149±0.012b0.061±0.0048.26.241213.80.111±0.0020.058±0.000 81.71.552317.90.169±0.0080.069±0.0034.74.540438.90.672±0.0280.222±0.0024.21.033531.80.056±0.003NDc5.0--636.10.339±0.0190.149±0.0045.72.843711.70.073±0.0010.055±0.0032.15.575823.50.153±0.0060.110±0.0063.75.072921.60.306±0.0210.119±0.0136.95.3391020.30.303±0.0210.109±0.0147.06.636118.10.117±0.0020.040±0.000 62.11.4341226.90.643±0.0040.424±0.0040.60.966
注:40 ℃TBME提取;b平均值±标准偏差;cND表示未检出。
样品中MCPDE的含量与油脂提取量基本呈现正相关,有微小差异可能是因为食品基质较为复杂。炸花生(样品5)最为特殊,其油脂提取量很高,但3-MCPDE 含量很低,而2-MCPDE未检出,这说明虽然花生本身含脂量高,在油炸过程中花生中的脂很少甚至不与氯结合产生MCPDE。样品9~11为肉制品,其他为非肉制品,在油脂提取量上及MCPDE含量上这2种制品并没有明显区别,但是样品9~11的2-MCPDE∶ 3-MCPDE差异不大,含量百分比为34%~39%。在所有样品中2-MCPDE的含量均低于3-MCPDE的含量,这与KUHLMANN[3]分析精炼食用油中的结果相同,由此油炸食品中产生的MCPDE可能部分来源于煎炸油,如ILKO等[25]通过检测油炸薯条前后氯丙醇酯的含量变化,也认为油炸食品中氯丙醇酯的主要来源为煎炸油。同时,所有样品中2-MCPDE含量占3-MCPDE的33%~75%,这与J![]() DRKIEWICZ等[5]对使用油和人造黄油中40%~80%是近似的。另外,有研究表明提高棕榈油的脱臭温度会使2-MCPDE 含量和比例增高[26],所以油炸食品中的不同的煎炸温度也可能是造成比例不同的原因之一。
DRKIEWICZ等[5]对使用油和人造黄油中40%~80%是近似的。另外,有研究表明提高棕榈油的脱臭温度会使2-MCPDE 含量和比例增高[26],所以油炸食品中的不同的煎炸温度也可能是造成比例不同的原因之一。
3 结论
以TBME为溶剂,选择40℃超声提取食品中的油脂部分,采用低温下碱水解的方式检测提取物中3-MCPDE及2-MCPDE的含量。该方法的内标定量曲线的线性,方法的回收率和重复性良好。在所有样品检测中,除了油炸花生中检测到2-MCPDE,其他样品均检测到3-MCPDE及2-MCPDE;3-MCPDE含量最高的样品为虾片(样品4),2-MCPDE的含量最高的为麻花(样品12);在所有样品中2-MCPDE的含量均低于3-MCPDE的含量,2-MCPDE∶3-MCPDE的含量百分比为33%~75%,但二者的比例关系的形成原因有待进一步研究。
[1] 胡小松, 谢明勇.食品加工过程安全优化与控制[M]. 北京: 化学工业出版社, 2017: 164.
[2] SVEJKOVSKA B, NOVOTNY O, DIVINOVA V, et al. Esters of 3-chloropropane-1,2-diol in foodstuffs[J]. Czech Journal of Food Sciences, 2004, 22(5):190-196.
[3] KUHLMANN J. Determination of bound 2,3-epoxy-1-propanol (glycidol) and bound monochloropropanediol (MCPD) in refined oils[J]. European Journal of Lipid Science & Technology, 2015, 113(3):335-344.
[4] MACMAHON S, BEGLEY T H, DIACHENKO G W. Occurrence of 3-MCPD and glycidyl esters in edible oils in the United States[J]. Food Additives & Contaminants, 2013, 30(12):2 081-2 092.
[5] J![]() DRKIEWICZ R, G
DRKIEWICZ R, G OWACZ A, GROMADZKA J, et al. Determination of 3-MCPD and 2-MCPD esters in edible oils, fish oils and lipid fractions of margarines available on Polish market[J]. Food Control, 2016, 59:487-492.
OWACZ A, GROMADZKA J, et al. Determination of 3-MCPD and 2-MCPD esters in edible oils, fish oils and lipid fractions of margarines available on Polish market[J]. Food Control, 2016, 59:487-492.
[6] BECALSKI A, FENG S, LAU P Y, et al. A pilot survey of 2- and 3-monochloropropanediol and glycidol fatty acid esters in foods on the Canadian market 2011-2013 [J]. Journal of Food Composition & Analysis, 2015, 44(6):111-114.
[7] SPUNGEN J H, MACMAHON S, LEIGH J, et al. Estimated US infant exposures to 3-MCPD esters and glycidyl esters from consumption of infant formula[J], Food Additives & Contaminants: Part A,35(6): 1 085-1 092.
[8] LIU M, GAO B Y, QIN F, et al. Acute oral toxicity of 3-MCPD mono- and di-palmitic esters in Swiss mice and their cytotoxicity in NRK-52E rat kidney cells [J]. Food Chem Toxicol, 2012, 50 (10): 3 785-3 791.
[9] SEEFELDER W, VARGA N, STUDER A, et al. Esters of 3-chloro-1, 2-propanediol (3-MCPD) in vegetable oils: Significance in the formation of 3-MCPD [J]. Food Additives & Contaminants, 2008, 25(4): 391-400.
[10] 黄明泉,刘廷竹,范方辉,等. 食品中氯丙醇酯的研究进展[J]. 食品安全质量检测学报, 2014(12):3 962-3 970.
[11] 孙秀兰,李耘, 李晓薇.食品加工过程安全性评价及风险评估[M]. 北京: 化学工业出版社, 2017: 92.
[12] 刘海兰.油脂煎炸过程3-氯丙醇酯和缩水甘油酯的研究[D].郑州:河南工业大学,2018.
[13] DIVINOV V, DOLEZAL M, VELISEK J. Free and bound 3-chloropropane-1,2-diol in coffee surrogates and malts[J]. Czech Journal of Food Sciences, 2007, 25(1):39-47.
V, DOLEZAL M, VELISEK J. Free and bound 3-chloropropane-1,2-diol in coffee surrogates and malts[J]. Czech Journal of Food Sciences, 2007, 25(1):39-47.
[14] KUSTERS M, BIMBER U, REESER S, et al. Simultaneous determination and differentiation of glycidyl esters and 3-monochloropropane-1,2-diol (MCPD) esters in different foodstuffs by GC-MS[J]. J Agric Food Chem, 2011, 59(11):6 263-6 270.
[15] 里南. 食品中脂肪酸氯丙醇酯的污染调查与暴露评估[D]. 福州:福建农林大学, 2012.
[16] BRATINOVA S, BUTTINGER B, KARASEK L, Determination of the MCPD fatty acid esters and glycidyl fatty acid esters in food [R] Luxembourg: the EURL-PAH and Process Contaminants(EUR 29109 EN), 2018.
[17] SAMARAS V G, GIRI A, ZELINKOVA Z, et al. Analytical method for the trace determination of esterified 3- and 2-monochloropropanediol and glycidyl fatty acid esters in various food matrices[J]. Journal of Chromatography A, 2016,1466(30):136-147.
[18] 徐君飞,谢慧,刘兰,等. 超声波辅助酶法提取茶叶籽油及其脂肪酸组成分析[J].中国油脂, 2018,43(1):20-23.
[19] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局. GB/T5009.6—2016, 食品中脂肪的测定[S].北京:中国标准出版社,2016.
[20] AOCS Official. Cd 29b-13. 2013 determination of bound monochloropropanediol- (MCPD-) and bound 2,3-epoxy-1-propanol (glycidol-) by gas chromatography/mass spectrometry (GC/MS) [S]. 2013.
[21] Deutsche Gesellschaft fur Fettwissenschaft (DGF). Standard method C-VI 18 (10) fatty-acid-bound 3-chloropropane-1,2-diol (3-MCPD) and 2,3-epoxipropane-1-ol (glycidol). determination in oils and fats by GC/MS (Differential measurement)[S]. Deutsche Einheitsmethoden zur Untersuchung von Fetten, Fettprodukten, Tensiden und verwandten Stoffen, 2011.
[22] MA F, LI P, MATTH US B, et al. Optimization of ultrasonic-assisted extraction of 3-monochloropropane-1,2-diol (MCPD) and analysis of its esters from edible oils by gas chromatography-mass spectrometry[J]. Journal of Separation Science, 2015, 35(17):2 241-2 248.
US B, et al. Optimization of ultrasonic-assisted extraction of 3-monochloropropane-1,2-diol (MCPD) and analysis of its esters from edible oils by gas chromatography-mass spectrometry[J]. Journal of Separation Science, 2015, 35(17):2 241-2 248.
[23] MANIRAKIZA P, COVACI A, SCHEPENS P. Comparative study on total lipid determination using soxhlet, roese-gottlieb, bligh & dyer, and modified bligh & dyer extraction methods[J]. Journal of Food Composition & Analysis, 2001, 14(1):93-100.
[24] SAMARAS V G, GIRI A, ZELINKOVA Z, et al. Analytical method for the trace determination of esterified 3- and 2-monochloropropanediol and glycidyl fatty acid esters in various food matrices.[J]. Journal of Chromatography A, 2016, 1 466:136-147.
[25] ZELINKOV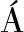
![]() M, VELI
M, VELI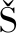 EK J,et al. 3-chloropropane-1,2-diol fatty acid esters in potato products[J]. Czech Journal of Food Sciences, 2011, 27(6):S421-S424.
EK J,et al. 3-chloropropane-1,2-diol fatty acid esters in potato products[J]. Czech Journal of Food Sciences, 2011, 27(6):S421-S424.
[26] LI C, LI L, JIA H, et al. Formation and reduction of 3-monochloropropane-1,2-diol esters in peanut oil during physical refining[J]. Food Chemistry, 2016, 199:605-611.