食用菌含有独特的风味,主要源于其含有的八碳挥发性化合物、含硫化合物及醛、酸、酮和酯类等挥发性的成分,而且食用菌的品种、生长部位及发育阶段、培养方式、储藏方式、加工方式的差异都会导致食用菌风味的变化[1-6]。HUMFELD[7]首次报道液体深层发酵技术不仅可以高产蘑菇菌丝体,同时也不失蘑菇特有的风味,认为液体深层发酵技术可在风味物质的生产应用上发挥重大作用。KAWABE等[8]在117种蕈菌的液体培养液中鉴定出47种化合物,其中有14种挥发性化合物首次在蕈菌的液体培养中发现,其中最多的组分是苯甲醛,占整个风味物质的61%,其他还含有一些芳香化合物和醇类,其中3-甲基-1-丁醇的含量最高;在培养基中添加L-苯丙氨酸,发现苯甲醛和苯甲醇的含量会显著增加,说明蕈菌独特风味不仅和培养基的成分等有关外,还说明蕈菌独特的风味是许多风味物质共同作用的结果。
桑黄(Phellinus linteus)作为一种重要的药用真菌,目前对桑黄的研究主要集中在药理和药用成分的研究中[9-11],对桑黄特殊风味物质的研究国内外鲜有报道。尽管目前桑黄已经能够人工栽培,但桑黄子实体栽培时间长,而液态发酵是使桑黄规模化生产的最佳方式。所以研究菌丝体和发酵液的化学成分对工业化生产更具现实意义,而且许多研究表明菌丝体和子实体具有同样价值和药理功效[9,12-15]。本实验室利用液体发酵和固态发酵,获得菌丝体和发酵液,应用顶空固相微萃取-气质联用法初步对桑黄液体发酵菌丝体和发酵液及固态发酵菌丝中的风味物质进行分析研究,旨在了解桑黄菌丝体和发酵液中挥发性风味物质的组成的特性,为利用桑黄液体深层发酵技术来生产天然风味化合物及食品添加剂原料提供一定的理论依据。
1 材料与方法
1.1 菌种
桑黄(Phellinus linteus,P. linteus)菌种为本实验室保存。
1.2 材料
麸皮等,购于农贸市场;葡萄糖等化学试剂,购于国药集团。
1.3 仪器
SPME手动进样手柄,美国Supelco公司;75 μm CAR/PDMS萃取头,美国Supelco公司;Trace MS气相色谱-质谱联用仪,美国安捷伦公司。
1.4 方法
1.4.1 桑黄培养
(1)培养基
斜面培养基:马铃薯葡萄糖琼脂培养基(PDA培养基)。
麸曲培养基(g∶mL):麸皮∶水=1∶1.2。
液体种子培养基(g/L):葡萄糖10,玉米粉30,麸皮10,豆饼粉5,KH2PO4 3,MgSO4 1.5。
液体发酵培养基(g/L):葡萄糖55,玉米粉20,麸皮10,豆饼粉5,KH2PO4 3,MgSO4 1.5。
(2)种子培养
将斜面菌种接种在PDA培养基中,26 ℃下培养,长满斜面后待用。
液体种子培养:将斜面种子分割成约0.5 cm2的小块转接到液体种子培养基中。培养条件:250 mL 三角瓶,装量70 mL,摇瓶转速150 r/min,在26 ℃条件下培养10 d。
(3)液体发酵
在500 mL三角瓶中加入基础培养基140 mL,接种量10%,转速150 r/min,26 ℃下培养,待原料完全被菌丝分解吸收结束发酵。将发酵液4 000 r/min离心30 min得菌丝及发酵清液。菌丝体用流水冲洗净,除掉杂质,离心收集菌丝体。
(4)固态培养
将斜面菌种0.5 cm2接种于麸曲培养基中,在26 ℃ 下进行培养,待菌丝长满,原料被完全分解吸收时结束发酵。
1.4.2 样品的制备及分析参照[16-17]
将固相微萃取头于气相色谱仪进样口250 ℃老化5~10 min。分别取发酵液10 mL,研碎的鲜菌丝10 g,剪碎的鲜固态发酵菌丝10 g,装入250 mL三角瓶中,封严密闭。将固相微萃取器的萃取头通过聚四氟乙烯隔垫插入到样品瓶顶空萃取45 min,萃取温度为60 ℃,然后将萃取头抽出,插入GC-MS进样口,于250 ℃解吸1 min,进行GC-MS检测。气相色谱条件:HP25(30 m×25 mm, 25 μm)毛细管柱;载气为He;流量1.0 mL/min,进样口采用不分流模式;程序升温:进样口温度250 ℃,起始温度35 ℃,停留5 min,以3 ℃/min升至150 ℃,然后以10 ℃/min升至240 ℃, 最后停留2 min。质谱条件:质谱接口温度为280 ℃,电离方式EI,离子源温度200 ℃,电子能量70 eV,扫描质量范围为40~500 u,检索谱库为Nist05a。
1.4.3 数据处理
利用NIST11谱库的标准质谱图对得到的谱图数据进行检索和解析,选择匹配度>800的作为物质鉴定依据。比对相关质谱资料,对基峰、m/z和相对丰度等方面进行分析,结合保留时间和MS对样品中各挥发性成分进行定性分析。釆用峰面积归一化法定量,得到各组分的相对含量。
2 结果与分析
2.1 萃取条件的选择
2.1.1 萃取时间
选取30、45、60 min考察萃取时间对桑黄挥发性成分的影响,萃取温度固定在50 ℃,气-质联用分析仪所检出的挥发性物质数量和总含量(质量分数)如图1。图1表明,萃取时间由30 min增加到45 min,检出的挥发性物质的数量和总质量分数增加;但在45 min后,呈现下降趋势,所以样品萃取时间以45 min为宜。
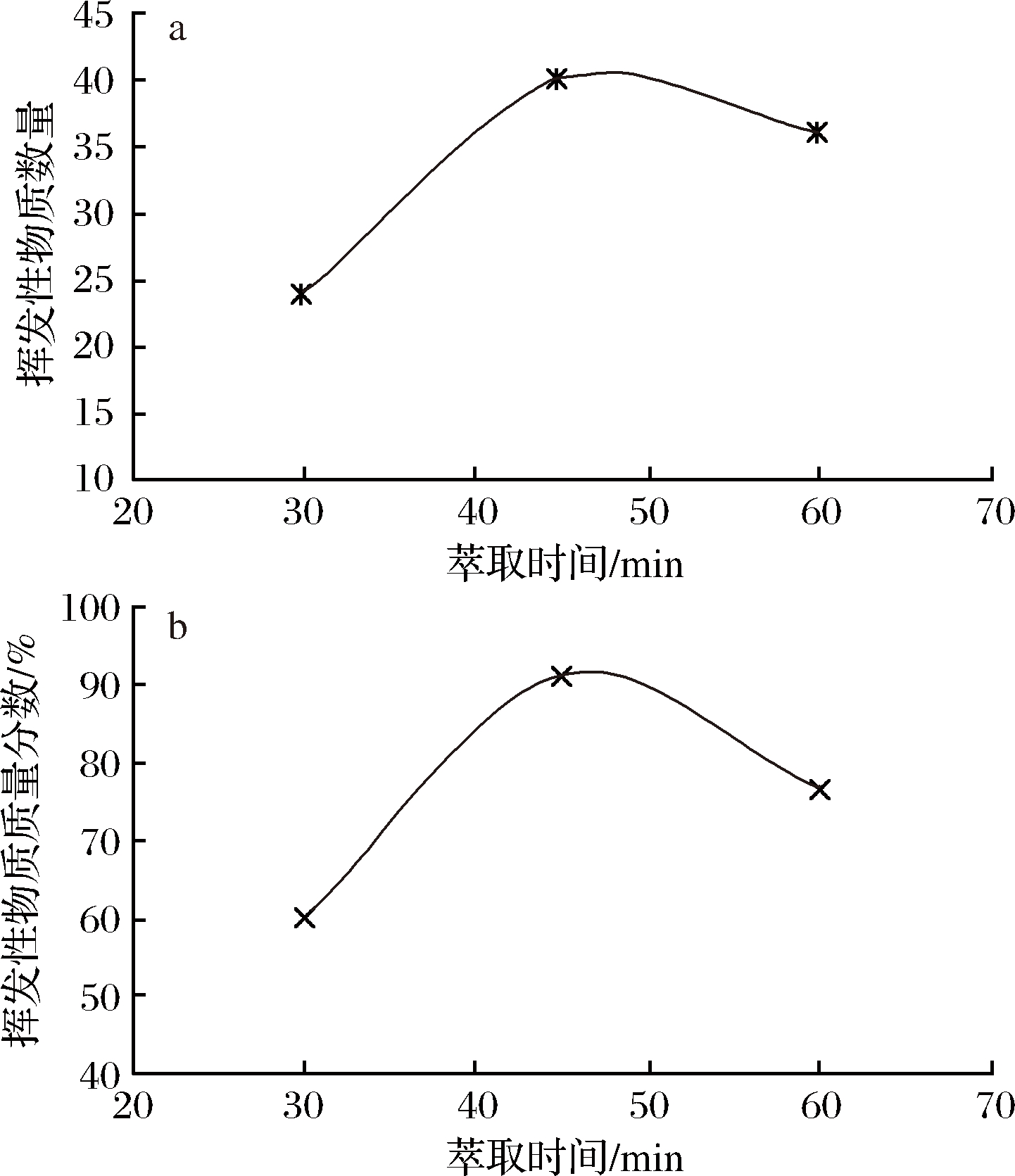
a-挥发性物质数量;b-挥发性物质质量分数
图1 萃取时间对检出的挥发性物质数量和总质量分数的影响
Fig.1 Effect of extraction time on the quantity and total mass fraction of volatile substances detected
2.1.2 萃取温度
样品萃取时间固定于45 min,考察40、50、60 ℃对检出的挥发性物质数量和总含量(质量分数)的影响。图2表明,随着温度升高,检出的挥发性物质数量和总含量(质量分数)都呈现增加趋势,考虑到温度高于60 ℃后,对桑黄风味贡献较大的化合物容易分解而损失,因此,萃取温度选择60 ℃。
2.2 不同样品的挥发性组分的GC-MS分析结果
图3~图5是在萃取时间45 min、萃取温度60 ℃时气-质联用分析桑黄发酵液、桑黄液态发酵菌丝、桑黄固态发酵菌丝的挥发性成分的总离子流色谱图,表1~表3是化合物鉴定结果。

a-挥发性物质数量;b-挥发性物质质量分数
图2 萃取温度对检出的挥发性物质数量和总质量分数的影响
Fig.2 Effect of extraction temperature on the quantity and total mass fraction of volatile compounds detected
2.2.1 桑黄发酵液的挥发性组分GC-MS分析
通过谱库检索在发酵液中鉴定出20种挥发性风味化合物(图3),占整个挥发性化合物的92.29%。其中醇类5种、酯类5种、芳香烃类3种、烷烃类2种、生物碱类2种、酮类1种、酸类1种、醌类1种,挥发性风味化合物及相对百分含量见表1。各类化合物比例为酯类化合物41.43%、醇类34.06%;芳香烃类6.95%、生物碱类4.02%、醌类1.51%、烷烃类1.03%、 酮类1.31%、酸类0.51%。
图3 桑黄发酵液挥发性成分的总离子流色谱图
Fig.3 Total ion flow chromatography of volatile components in fermentation broth of P. linteus
表1 固相微萃取/气-质联用仪检出的桑黄发酵液的挥发性成分
Table 1 Volatile components in P. linteus fermentation broth detected by solid phase microextraction/GC-MS

化合物名称 保留时间/min峰面积峰面积占比/%3-甲基-1丁醇5.02101 087 372.87417.55乙酸正戊酯5.221 278 375.490.25乙二胺6.9221 202 111.2173.681-丁胺7.101 378 375.490.34苯乙烷9.261 862 652.7360.371-十一醇10.655 286 281.281.051,3,3-三甲基-2-氧杂二环[2.2.2]辛烷桉叶醇14.076 922 674.5111.371,3,5-三甲基苯17.942 071 586.5010.412-乙基已醇18.7620 812 780.0144.13萘22.233 520.6016.03正壬酸24.623 580 585.5090.711-甲氧基-4-(2-丙烯基)苯25.622 557 167.1310.51丙酸睾丸酮28.196 619 950.5241.312,6-二叔丁基苯醌28.6972 374 450.3151.159(顺)十八烯酸甲酯29.7957 380 689.25912.564-甲基-1-(1-甲基乙基)-3-环己烯-1-醇30.6293 348 329.1599.96角鲨烷31.9117 747 341.57216.21邻苯二甲酸二丁酯34.0471 478 173.14812.41十七烷39.495 172 276.0351.03
2.2.2 桑黄液态发酵菌丝的挥发性组分的GC-MS分析
通过谱库检索在液态发酵的菌丝中鉴定出25种挥发性风味化合物,占整个挥发性化合物的91.51%。其中烷烃类6种、醇类5种、酯类3种、烯烃类3种、酸类2种、生物碱类2种、芳香烃类1种、酚类1种,酮类1种,醛类1种,挥发性风味化合物及相对含量(%)见表2。对各类化合物分析表明,烷烃类占整个挥发性化合物的36.95%、醇类22.24%、烯烃类16.5%、酯类6.3%、生物碱类5.84%、酸类3.05%、醛类1.2%、酚类1.29%、芳香烃类0.63%、酮类0.52%(图4)。

图4 桑黄液态发酵菌丝的挥发性成分的总离子流色谱图
Fig.4 Total ion flow chromatography of volatile components in mycelium of P. Linteus by liquid fermentation
2.2.3 桑黄固态发酵菌丝的挥发性组分GC-MS分析
通过谱库检索在固态发酵菌丝体重鉴定出29种挥发性风味化合物,占整个挥发性化合物的91.06%。其中烷烃类8种、醇类7种、酯类5种、醛类2种、芳香烃类2种、酸类2种、酮类2种,挥发性风味化合物及相对含量(%)见表3。对各类化合物分析说明:烷烃类51.19%、醛类9.33%、酯类8.96%、醇类8.91%、芳香烃类2.44%、酮类3.55%、酸类2.12%(图5)。
表2 固相微萃取/气-质联用仪检出桑黄液态发酵菌丝的挥发性成分
Table 2 Volatile components in mycelium of P. linteus by liquid fermentation detected by solid phase microextraction/GC-MS

化合物名称 保留时间/min峰面积峰面积占比/%戊二醛6.799 254 079.6821.2环己烯7.7326 252 288.4233.41,3 二氧五环12.9913 919 806.3311.8十五烷13.99253 576 754.02932.861-十三烯17.2432 108 918.7394.16十一碳烯酸18.8214 796 584.6561.921,2,3,5四甲基苯19.334 842 578.6130.63桉叶醇21.262 301 566.1010.31-丁胺24.643 711 266.30.481-十四醇26.373 953 436.7920.51十一醇27.9527 779 794.5093.64-甲基-1-(1-甲乙基)-3-环己烯-1-醇28.46113464926.38214.72,6 二(1,1二甲乙基)2,5-环己二烯-1,4-二酮28.894 027 808.7730.521甲基-4-(1-甲亚乙基)环己烯29.1468 996 479.528.942,4-二叔丁基苯酚29.989 931 823.2941.29油醇30.4724 163 736.3473.132,6,10,14-四甲基十五烷31.9314 758 083.3691.919-十八烯酸甲酯31.615 433 952.0730.7十二烷33.17 840 037.7431.02叶酸33.358 742 033.0681.13肉豆蔻酸异丙酯33.47 758 537.5112.01邻苯二甲酸二异丁酯34.0517 331 681.3392.25秋水仙碱35.197 758 537.5111.01角鲨烷38.5110 324 871.6081.34十七烷41.795 956 296.5630.7

图5 桑黄固态发酵菌丝的挥发性成分的总离子流色谱图
Fig.5 Total ion flow chromatography of volatile components in mycelium of P. linteus by solid fermentation
2.3 桑黄菌发酵液、桑黄液态发酵菌丝及固态发酵菌丝挥发性组分的比较
2.3.1 烃类物质
由表4可以看出,发酵液中烃类占7.98%,主要是芳香烃类,烷烃比例较少;而菌丝中烃类种类较多,含量高达54.08%,其中烷烃、烯烃分别为36.95%,16.5%,芳香烃含量和种类较少;固态菌丝中烃类占53.63%,主要是烷烃类,芳香烃类种类较少,占2.44%, 这与液态发酵菌丝体在烷烃和芳香烃含量上基本相似。
表3 固相微萃取/气-质联用仪检出桑黄固态发酵菌丝的挥发性成分
Table 3 Volatile components in mycelium of P. linteus by solid fermentation detected by solid phase microextraction/GC-MS
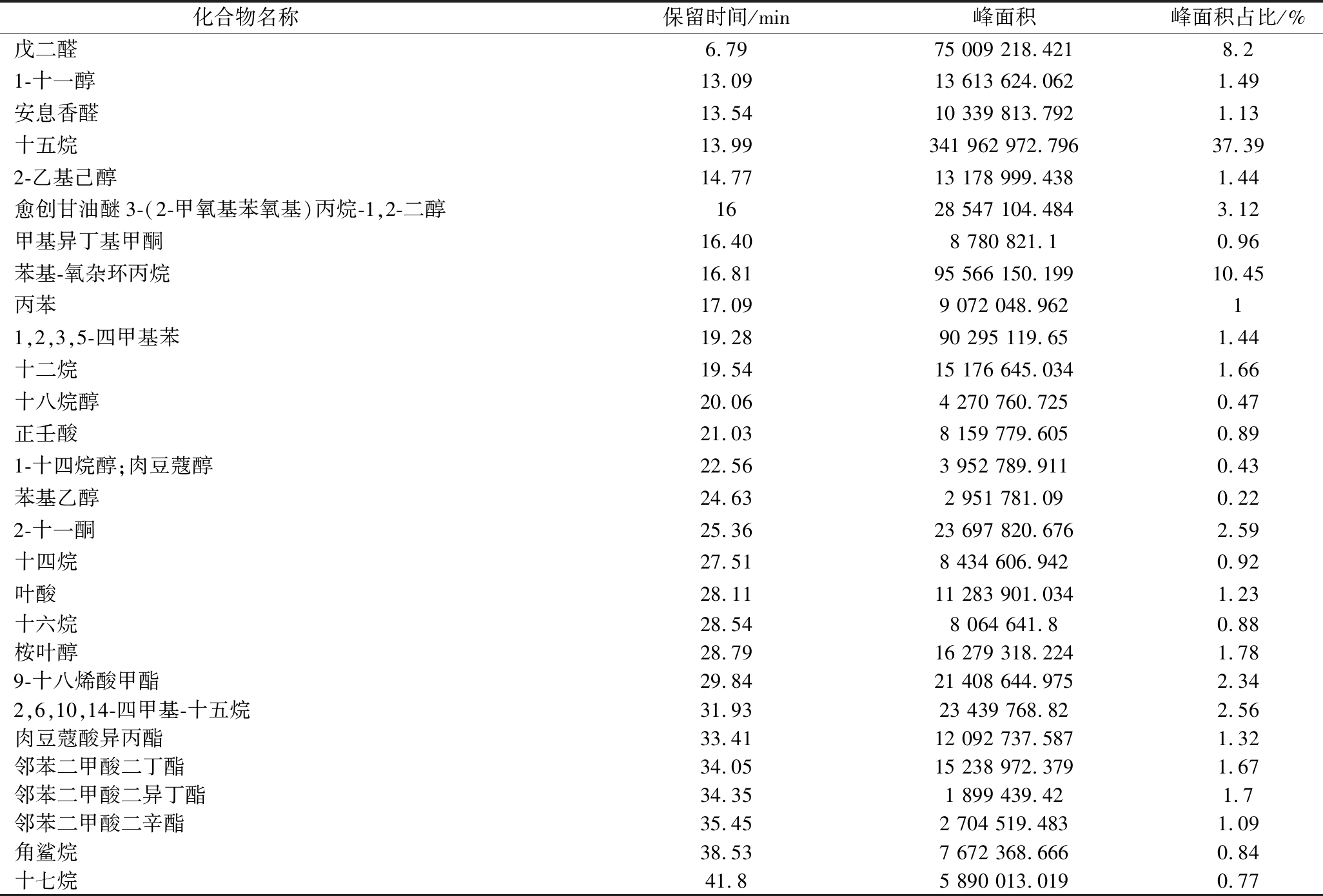
化合物名称 保留时间/min峰面积峰面积占比/%戊二醛6.7975 009 218.4218.21-十一醇13.0913 613 624.0621.49安息香醛13.5410 339 813.7921.13十五烷13.99341 962 972.79637.392-乙基己醇14.7713 178 999.4381.44愈创甘油醚3-(2-甲氧基苯氧基)丙烷-1,2-二醇1628 547 104.4843.12甲基异丁基甲酮16.408 780 821.10.96苯基-氧杂环丙烷16.8195 566 150.19910.45丙苯17.099 072 048.96211,2,3,5-四甲基苯19.2890 295 119.651.44十二烷19.5415 176 645.0341.66十八烷醇20.064 270 760.7250.47正壬酸21.038 159 779.6050.891-十四烷醇;肉豆蔻醇22.563 952 789.9110.43苯基乙醇24.632 951 781.090.222-十一酮25.3623 697 820.6762.59十四烷27.518 434 606.9420.92叶酸28.1111 283 901.0341.23十六烷28.548 064 641.80.88桉叶醇28.7916 279 318.2241.789-十八烯酸甲酯29.8421 408 644.9752.342,6,10,14-四甲基-十五烷31.9323 439 768.822.56肉豆蔻酸异丙酯33.4112 092 737.5871.32邻苯二甲酸二丁酯34.0515 238 972.3791.67邻苯二甲酸二异丁酯34.351 899 439.421.7邻苯二甲酸二辛酯35.452 704 519.4831.09角鲨烷38.537 672 368.6660.84十七烷41.85 890 013.0190.77
表4 桑黄菌发酵液、桑黄液态发酵菌丝及固态发酵菌丝中含醇类情况
Table 4 Hydrocarbon in fermentation broth, mycelium of P. linteus by liquid and solid fermentation

烃发酵液(5种,7.98%)菌丝(9种,54.08%)固态发酵菌丝(9种,53.63%)十二烷++十四烷+十五烷++2,6,10,14-四甲基-十五烷++十六烷+十七烷+++1,2,3,5-四甲基苯++苯基-氧杂环丙烷+丙苯+1-十三烯+环己烯+1-甲基-4-(1-甲亚乙基)环己烯+1,3 二氧五环+1,3,5-三甲基苯+苯乙烷+1-甲氧基-4-(2-丙烯基)苯+萘+
注:+代表含有该物质。下同。
2.3.2 醇类化合物
由表5可知,3种样品中醇类化合物的相对含量及种类不同。
发酵液中醇类相对含量最大,主要为萜烯醇、十一醇、桉叶醇、2-乙基己醇和3-甲基丁醇;液体发酵菌丝体中所含有的5种醇类相对含含量为28.01%,主要为油醇、萜烯醇、十四烷醇、十一醇、桉叶醇,菌体细胞能合成这5种醇类,而固态发酵菌丝中醇类种类较多,相对含量只占8.91%,含有十八烷醇、2-乙基己醇、苯基乙醇、桉叶醇、十一醇、1-十四烷醇、愈创甘油醚。
表5 桑黄菌发酵液、桑黄液态发酵菌丝及固态发酵菌丝中含醇类情况
Table 5 Alcohols in fermentation broth, mycelium of P. linteus by liquid and solid fermentation
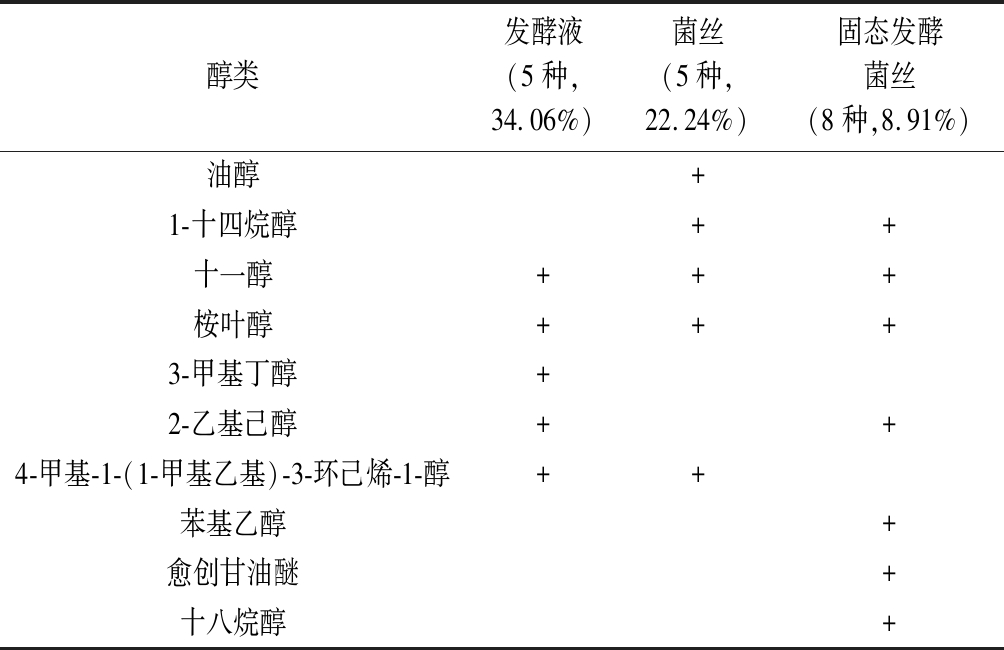
醇类发酵液(5种,34.06%)菌丝(5种,22.24%)固态发酵菌丝(8种,8.91%)油醇+1-十四烷醇++十一醇+++桉叶醇+++3-甲基丁醇+2-乙基己醇++4-甲基-1-(1-甲基乙基)-3-环己烯-1-醇++苯基乙醇+愈创甘油醚+十八烷醇+
2.3.3 酯类
酯类化合物是一类馥郁芳香味的物质。从表6可知,桑黄发酵液、液态发酵菌丝、固态发酵菌丝体中酯类相对含量分别为41.43%、6.3%、8.96%,在桑黄的风味物质中起到重要作用。桑黄发酵液中主要含有乙酸正戊酯、邻苯二甲酸二丁酯、9(顺)十八烯酸甲酯及角鲨烷,其中角鲨烷含量较多。菌丝体中主要酯类物质是9-十八烯酸甲酯、肉豆蔻酸异丙酯和邻苯二甲酸二丁酯;固态发酵菌丝中含有的酯类种类较多,除不含乙酸正戊酯外,其余几种酯类均含有。
表6 桑黄菌发酵液、桑黄液态发酵菌丝及固态发酵菌丝中含酯类情况
Table 6 Esters in fermentation broth, mycelium of P. linteus by liquid and solid fermentation

酯类发酵液(3种,41.43%)菌丝(3种,6.3%)固态发酵菌丝(5种,8.96%)乙酸正戊酯+9(顺)十八烯酸甲酯+++邻苯二甲酸二丁酯+++角鲨烷+++肉豆蔻酸异丙酯++邻苯二甲酸二异丁酯+邻苯二甲酸二辛酯+
2.3.4 酮类、酸类、醛类、生物碱类
分析表明,发酵液中含有丙酸睾丸酮占1.31%,发酵菌丝中的2,6 二(1,1二甲乙基)2,5-环己二烯-1,4-二酮相对含量为0.52%,而固态发酵的菌丝中含有甲基异丁基甲酮,2-十一酮为3.55%。比较而言,酮类化合物在桑黄固态发酵菌丝体挥发性风味物质的相对含量比其他两种样品都高。
桑黄固态菌丝体中检测到2种酸类化合物:壬酸,叶酸相对含量分别为0.89%、1.23%;而液态发酵菌丝中十一碳烯酸、叶酸类物质相对含量为1.92%、1.13%;发酵液中壬酸为0.71%,液态发酵中酸为2.83%,而固态发酵总酸为3.05%。
固态发酵菌丝中检测到戊二醛及安息香醛,相对含量占整个风味物质的9.33%,液态发酵中醛类占1.2%,仅存于菌丝体中,而发酵液中则未检出。
桑黄液态发酵过程中产生生物碱类物质,其中发酵液中含2种乙二胺和1-丁胺,菌丝中含2种,1-丁胺和秋水仙碱,而固态发酵中不含生物碱类。生物碱本身是苦味物质,发酵液的清苦味和固态菌丝的芳香味不同,是否与含有生物碱类有关需要进一步的探讨。
液态发酵的发酵液中含有醌类2,6-二叔丁基苯醌1.51%,而发酵菌丝均不含有醌类物质;液态发酵菌丝中含有酚类2,4-二叔丁基苯酚1.29%,而固态菌丝不含酚类物质。酚类是否对桑黄的呈味起到贡献,需要进一步的研究。
3 讨论
作为食用菌品质的重要指标,对挥发性风味成分的组成和含量的研究有助于我们深入了解食用菌的风味特征,对菌种的改良、定向培育及储藏加工等方面的应用具有指导作用和实践意义[18-20]。
液态发酵和固态发酵中形成烃的含量和种类说明烷烃类在菌丝体中挥发性物质中发挥重要作用。发酵液中仅检测到芳香烃类及少量烷烃类物质,说明烷烃为胞内物质,由菌丝体细胞合成的。芳香烃烃类是否是基质中的挥发性成分或是发酵过程中释放的挥发性物质,有待进一步的研究。
3种样品中醇类相对含量比较高,说明醇类化合物是主要的挥发性物质,但研究表明八碳化合物(C8H16O)是食用菌最重要的风味物质,其中1-辛烯-3-醇具有浓烈的蘑菇味道[21-22],但在本研究中发现,桑黄的固体发酵菌丝和液体发酵菌丝及发酵液中八碳化合物种类极少,仅含3,3-三甲基-2-氧杂二环[2.2.2]辛烷桉叶醇、 2-乙基己醇两种八碳醇类,而酯类化合物并无八碳酯类,这与1-辛烯-3-醇是食用菌中最具特征的风味化合物的结论不同[23-24]。而且分析发现醇类化合物在发酵液中的含量远高于菌丝,说明醇类物质容易分泌于胞外。2-乙基己醇在固态发酵菌丝和发酵液中均含有,是菌丝细胞合成还是培养基本身带来的挥发性物质需进一步的研究。
酯类物质具有浓郁的芳香气味。本实验发现液态发酵菌丝体含有9(顺)十八烯酸甲酯,邻苯二甲酸二丁酯、角鲨烷、肉豆蔻酸异丙酯,说明菌丝体细胞本身能够合成这类物质。而液态发酵菌丝体及发酵液无邻苯二甲酸二异丁酯、邻苯二甲酸二辛酯,说明培养基无此挥发性物质,主要由菌丝体细胞产生,这与发酵形式、发酵时间有关。陈志杰等[23]分析发现主要灵芝菌丝体中酯类物质是3,7,11-三甲基-2,6,10-十二碳三烯酸甲酯(3.26%)、邻苯二甲酸二丁酯(1.23%)和苯甲酸甲酯(0.92%),而邢增涛等[25]发现姬松茸子实体中酯类物质含量较少,而我们的实验发现发酵液中酯类物质相对含量更多,说明发酵方式对酯类的影响较大,但桑黄子实体中酯类含量和种类是否与姬松茸相同,需要进一步的实验证明。角鲨烷主要存在于鲨鱼肝油中,少量存在于橄榄油、米糠油、麦胚油、酵母及人体脂肪中,对皮肤具有保护作用[26]。本实验发现角鲨烷在发酵液中含量较大,通过液态发酵工业化生产角鲨烷具有一定的经济意义。
醛类在固态发酵中产生量较大,而发酵液中无醛类,说明菌丝细胞能够合成醛类。褚东阳等[6]研究发现醛类是蛹虫草挥发性风味物质的主要来源,可见醛类也是风味物质中起到一定呈味作用的物质。
本实验对桑黄液体发酵和固态发酵的挥发性代谢产物进行了初步分析,未比对桑黄子实体中挥发性成分,这些挥发性物质是否都是由细胞合成的及代谢过程未进行深入的研究和探讨,随着分离技术及仪器的发展,风味物质的形成过程、分离纯化及鉴定将在风味物质鉴定的准确性和风味物质形成机理等方面打开新的局面,并在将来真菌的风味物质替代人工合成的香料物质方面有着极为重要的意义。
[1] 李文,陈万超,杨焱.香菇生长过程中挥发性风味成分组成及其风味评价[J].核农学报,2018,32(2): 325-334.
[2] 李翔,邓杰,徐宏,等.椴木木耳和袋栽木耳挥发性成分及特性风味物质比较分析[J].食品工业科技,2019, 40(5): 249-269.
[3] 李小林,陈诚,黄羽佳.顶空固相微萃取-气质联用分析4种野生食用菌干品的挥发性香气成分[J].食品与发酵工业,2015,41 (9):174-180.
[4] 唐秋实,刘学铭,池建伟,等.不同干燥工艺对杏鲍菇品质和挥发性风味成分的影响[J].食品科学,2016, 37(4): 25-30.
[5] 武模戈.同时蒸馏萃取与气质联用分析杏鲍菇挥发性成分[J].濮阳职业技术学院学报,2016, 29(6):150-153.
[6] 褚东阳,张震遐,云少君,等.蛹虫草菌丝体粉营养成分及挥发性气体成分分析[J]. 中国食用菌, 2016,35(6):38-41.
[7] HUMFELD H. The production of mushroom mycelium(Agaricus campestris)in submerged culture[J]. Science, 1948, 107(2 780): 373.
[8] KAWABE T, MORITA H. Volatile components in culture fluid of polyporus tuberaster [J]. Agriculture Food Chemistry, 1993, 41(4): 637-640.
[9] LIN C J, LIEN H M, CHANG H Y, et al. Biological evaluation of Phellinus linteus fermented broths as anti-inflammatory agents[J]. Journal of Bioscience and Bioengineering,2014,118(1):88-93.
[10] LI Tingting,YANG Yan, LIU Yanfang, et al. Physicochemical characteristics and biological activities of polysaccharide fractions from Phellinus baumii cultured with differrent methods[J]. International Journal of Biological Macromolecules, 2015, 81:1 082-1 088.
[11] QIN Hao, XU Junwei, XIAO Jianhui, et al.Cell factories of higher fungi for useful metabolite production[J]. Advances in Biochemical Engineering /Biotechnology, 2015,155:199-235.
[12] LIN C J, LIEN H M, LIN H J,et al. Modulation of T cell response by Phellinus linteus[J]. Journal of Bioscience and Bioengineering, 2015, 121(1):84-88.
[13] YAN Jingkun,WANG Yaoyao, MA Haile,et al.Ultrasonic effects on the degradation kinetics, preliminary characterization and antioxidant activities of polysaccharides from Phellinus linteus mycelia[J]. Ultrasonics Sonochemistry, 2016, 29(3):251-257.
[14] PEI Juanjuan,WANG ZhenBin, MA Haile,et al.Structural features and antitumor activity of a novel polysaccharide from alkaline extract of Phellinus linteus mycelia[J].Carbohydrate Polymers, 2015, 115(1):472-477.
[15] REIS F S, BARREIRA C M, CALHELHA R C, et al. Chemical characterization of the medicinal mushroom Phellinus linteus (Berkeley & Curtis) Teng and contribution of different fractions to its bioactivity [J]. LWT-Food Science and Technology, 2014, 58(2):478-485.
[16] 王丹, 丹彤,孙天松,等. SPME-GC-MS结合ROAV分析单菌及复配发酵牛乳中关键性风味物质[J]. 食品科学, 2017,38(8):145-152.
[17] 殷朝敏,范秀芝,史德芳,等. HS-SPME-GC-MS结合HPLC分析5种食用菌鲜品中的风味成分[J].食品工业科技,2019,40(3):254-260.
[18] HIRAIDE M, MIYAZAKI Y, SHIBATA Y. The smell and odorous components of dried shiitake mushroom, Lentinula edodes I: Relationship between sensory evaluations and amounts of odorous components [J]. Journal of Wood Science, 2004, 50(4): 358-364.
[19] 罗晓莉,张沙沙,曹晶晶,等.美味牛肝菌风味沙拉酱的研制[J].食品工业科技,2017, 38(3):206-211.
[20] 王丽君.香菇制取天然调味基料及系列食品开发[D].洛阳:河南科技大学,2013.
[21] COMBET E, HENDERSON J, EASTWOOD D C, et al. Eight carbon volatiles in mushrooms and fungi: Properties, analysis, and biosynthesis [J]. Mycoscience, 2006, 47(6): 317-326.
[22] LI Wen, GU Zhen,YANG Yan, et al. Non-volatile taste components of several cultivated mushrooms [J]. Food Chemistry, 2014, 143: 427-431.
[23] 陈志杰,杨振东,顾振新.顶空固相微萃取气质联用检测灵芝菌丝体挥发性风味物质[J].食品研究与开发, 2010,31(2):132-135.
[24] MAU JENBL,BEELMAN R O B,ZIEGLER G R R. 1-octen-3-ol in the cultivated mushroom Agaricus bisporus[J]. Journal of Food Science,1992,57(3):704-706.
[25] 邢增涛,郭倩,冯志勇,等.姬松茸中挥发性风味物质的GC-MS分析[J].中药材,2003,26(1):789-791.
[26] 王俊华,蔡再生.角鲨烷微胶囊在织物护肤整理中的应用[J].纺织学报,2010,31(1):76-81.