麦角硫因(ergothioneine, ERG),学名为2-巯基-L-组氨酸三甲基内盐,具有显著的抗氧化[1]、抗炎[2]、保护细胞[3]、护色[4]和抗紫外辐射[5]等多种功能,是一种天然的抗氧化剂。区别于其他常见抗氧化剂(如谷胱甘肽、抗坏血酸等),麦角硫因被人体或其他动物从饮食中迅速吸收后,不会被快速代谢或排泄到尿液中,而是以硫酮形式存在于人体组织和体液中,因而不易发生自动氧化并能在某些组织和体液中累积至较高水平[6]。强大的体外抗氧化性、独特的抗自动氧化性和天然安全性使麦角硫因在食品添加、保健制药、化妆护肤等各个领域极具开发和利用价值,市场潜力巨大[7-8]。
除一些细菌(如放线菌、蓝细菌)和部分真菌(如链霉菌、分枝杆菌)等微生物外,人体或动物机体自身均无合成麦角硫因的能力,只能从食物中摄取[9]。早期研究表明,在合成麦角硫因的微生物中,杏鲍菇、香菇等食用菌中麦角硫因含量较高,又具有天然安全、易获取等优势,成为其制备资源的首选[10]。其中,CHEN等研究发现侧耳属食用菌中麦角硫因含量相当高[11]。DUBOST等也发现杏鲍菇(king oyster mushroom)中麦角硫因含量较高,可达2 590 mg/kg干重,远大于香菇、灰树花等其他人工栽培蘑菇(210~198 mg/kg干重)[12],表明杏鲍菇是制备麦角硫因的理想资源之一。除来源外,提取方式、纯化方法、物化环境等因素均会对麦角硫因体外抗氧化性及其稳定性产生影响[13-15]。因此,研究杏鲍菇麦角硫因的体外抗氧化力及环境因素对其稳定性的影响有利于实现麦角硫因的快速开发和高效应用。目前,国内外对麦角硫因的研究多集中于功能特性[6,16],关于杏鲍菇麦角硫因的报道较少,而对其体外抗氧化活性及稳定性的研究尚未见报道。
本文考察杏鲍菇中麦角硫因的常见体外自由基(如羟自由基、DPPH自由基、ABTS自由基等)清除能力及其对贮藏鱼肉的保鲜效果,分析其体外抗氧化活性,并研究不同环境因素对其抗氧化能力稳定性的影响,将为其在各领域的开发应用提供理论依据。
1 材料与方法
1.1 材料与试剂
采用广东蓝田食用菌公司提供的杏鲍菇,真空冷冻干燥后低温保藏备用。
KOH、FeCl3、乙二胺四乙酸二钠、HCl、乙醇、KH2PO4、H3PO4等,广州成硕公司;2’-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、谷胱甘肽、脱氧核糖,天津凯通试剂公司;硫代巴比妥酸(TBA)、抗坏血酸、H2O2、三吡啶基三嗪(TPTZ),天津科密欧试剂公司;叔丁基对苯二酚(TBH),上海抚生试剂公司;三氯乙酸(TCA)、2,4-二硝基苯肼(DNPH),北京索莱宝有限公司。未注明试剂均为国产分析纯。
1.2 主要仪器和设备
LC2130高效液相色谱仪,上海天美仪器公司;TG16K-Ⅱ冷冻高速离心机,长沙东旺公司;FD-1-50冷冻真空干燥机,天津比朗仪器公司;UV1102分光光度计,上海天美仪器公司;UV2300Ⅱ系列双光束紫外分光光度计,上海天美公司;PB-10 pH计,德国赛多利斯。
1.3 方法
1.3.1 杏鲍菇麦角硫因的提取纯化和检测
取一定量冷冻干燥的杏鲍菇干粉,按照料液比1∶48 加入体积体积分数为54%的乙醇,混匀,于微波功率500 W,微波温度70 ℃,微波处理5 min后再在超声功率440 W、超声时间5 min条件下提取。将提取液8 000 r/min离心10 min,取上清以70%乙醇定容后,加入4倍体积的95%乙醇,静置24 h后,以沉淀多糖、蛋白质等。之后浓缩过滤,使用葡聚糖凝胶G-10 进行分离纯化,纯化条件为:洗脱液为去离子水,上样量为2 mL,洗脱速度为1.5 mL/min。即得麦角硫因提取液(部分提取液冷冻干燥后低温保藏备用)。
将麦角硫因提取液过0.22 μm微孔滤膜后采用高效液相色谱法测定麦角硫因提取量。色谱柱为Phenomenex公司生产,型号Luna® 5 μm C18(2) 100A,大小250 mm×4.6 mm,货号为00G-4252-E0;流动相为V(水)∶V(甲醇)=98∶2,流速1 mL/min,检测波长254 nm,进样量20 μL。上述条件下检测出麦角硫因提取纯度约为22.7%。
1.3.2 麦角硫因的体外抗氧化活性检测
1.3.2.1 羟自由基清除能力的测定
参考FRANZONI等[17]的方法并略作改动。取2.056 5 mL麦角硫因提取液,依次加入0.6 mL 4 mmol/L KH2PO4-KOH缓冲液、43.5 μL 3%(体积分数)H2O2和各75 μL的4 mmol/L EDTA、0.8 mmol/L FeCl3、4 mmol/L L-抗坏血酸、112 mmol/L脱氧核糖。37 ℃水浴1 h后,添加等体积的0.6%硫代巴比妥酸溶液,沸水浴反应20 min,立即冰浴降温,6 000 r/min离心分离得上清。测定波长为600 nm,532 nm,450 nm波长。用式(1)表示反应中产生的MDA浓度,用式(2)计算羟自由基清除能力(%):
Q/(μmol·L-1) = 6.45×(OD532-OD600)-0.56×OD450
(1)
羟自由基清除能力![]()
(2)
式中:Q为MDA浓度,μmol/L;Q1为对照管测定的MDA浓度,μmol/L;Q2为待测样品管测定的MDA浓度,μmol/L;Q3为误差管测定的MDA浓度,μmol/L。
1.3.2.2 DPPH自由基清除能力的测定
参考ZHANG等[18-19]的方法并略作修改。向1 mL麦角硫因提取液中添加3倍体积的100 μmol/L的DPPH-甲醇溶液,黑暗条件静置35 min,检测波长为517 nm。 使用蒸馏水代替提取液作对照,以纯甲醇代替DPPH自由基溶液为误差。DPPH自由基清除能力用式(3)计算。
DPPH自由基清除能力![]()
(3)
式中:OD0表示对照管OD值;ODi表示测定管OD值;ODj表示误差管OD值。
1.3.2.3 ABTS自由基清除能力的测定
参考THAIPONG等[20]的方法并略加修改。取ABTS储备液(4.9 mmol/L过硫酸钾水溶液和14 mmol/L ABTS水溶液等体积混匀,25 ℃黑暗反应12~16 h即可)加入等体积48%乙醇稀释至OD734 = 0.650±0.02。向3.9 mL稀释液添加0.1mL麦角硫因提取液,涡旋45 s,25 ℃反应7 min。测定波长为734 nm。以等量70%乙醇代替提取液为对照,以等体积蒸馏水代替ABTS工作液为误差。按照式(4)计算ABTS自由基清除能力。
ABTS自由基清除能力![]()
(4)
式中:A1表示对照管吸光值;A2表示待测样品管吸光值;A3表示误差管吸光值。
1.3.2.4 FRAP法
参考THAIPONG等[20]的方法并略加修改。FRAP工作液(0.3 mol/L pH 3.2醋酸钠缓冲液,20 mmol/L FeCl3溶液和12 mmol/L三吡啶基三嗪溶液以体积比10∶1∶1混匀即得)。取3 mL工作液于37 ℃下避光水浴至恒温后,加入100 μL杏鲍菇麦角硫因提取液,测定波长为593 nm。标准曲线以FeSO4溶液(200~1 000 μmol/L)代替提取液测定吸光度值,结果表示为每毫升样品液达到同样吸光度所需的Fe2+的浓度(μmol/L)表示。
1.3.3 杏鲍菇麦角硫因对贮藏鱼肉的保鲜作用
1.3.3.1 新鲜鱼肉前处理
采购新鲜活鳙鱼,宰杀后洗净绞碎后将肉糜随机分成6组。设置第1组为对照(保鲜剂以同体积蒸馏水代替),第2~5组为麦角硫因处理组(具体为ERG×0、ERG×1、ERG×2和ERG×3,数字代表稀释倍数),其中ERG×0组使用的麦角硫因浓缩液是2%(质量分数)的提取冻干粉溶液,第6组为TBH组(保鲜剂为叔丁基对苯二酚,添加量同ERG×0组)。每组均按照1 mL/100 g的保鲜剂添加量和2%添加量的食盐添加量添加相应保鲜剂和食盐,混匀后将各组肉糜均分为约30 g的小份,制成厚度为1.0 cm、直径约7.0 cm的肉饼,密封袋封装后于4 ℃冰箱贮藏3 d。每天随机取样并分别检测以下指标以分析杏鲍菇麦角硫因对贮藏鱼肉的保鲜效果。
1.3.3.2 色差值检测
根据操作说明使用色差计进行色差值测定,使用黑白板校正。
1.3.3.3 pH值检测
参照国标GB/T 9695.5—2008《肉与肉制品pH测定》测定贮藏肉饼的pH值。
1.3.3.4 羰基含量检测
取肉饼1.0 g于pH 7.4的磷酸缓冲液(15 mL)中均质过滤。滤液(0.5 mL)用等体积的10%TCA处理后离心分离沉淀,再经等体积盐酸-丙酮(盐酸体积分数为3%)溶液洗涤3次后,以1 mL蒸馏水溶解即得待测样品液。以2 mol/L盐酸作空白。待测样品液先与等体积10 mmol/L DNPH-HCL溶液于25 ℃避光反应1 h,再经20% TCA处理后12 000 r/min离心分离沉淀。以乙醇-乙酸乙酯(体积分数为50%)溶液洗涤3次后,再将沉淀重新于37 ℃在3 mL盐酸胍溶液(现配现用) 中溶解 15 min,室温12 000 r/min离心3 min取上清。测定波长为370 nm。根据测得的吸光度计算鱼肉中的羰基含量。
1.3.3.5 硫代巴比妥酸反应值检测
先以5 mL TCA溶液(质量分数为20%)处理均质后的1 g肉饼20 min,再与等体积的TBA溶液(质量分数为 0.5%)于沸水浴中反应30 min。立即冰浴降温终止反应。用等体积正丁醇洗涤1次,于5 000 r/min离心分离得上清。测定波长为600 nm和532 nm。计算硫代巴比妥酸反应值。
1.3.3.6 贮藏鱼肉感官评定
邀请具备评定能力和专业知识的8名感官评定员,参照鱼肉感官评定标准表4,对处理后的贮藏鱼肉进行感官评定,如表1。
表1 鱼肉感官评定标准表
Table 1 Sensory evaluation standard of Pleurotus eryngii on fresh fish during storage

指标1~2 3~4 5~6 色泽呈灰褐色,且有浑浊液体流出浅褐色,光泽稍逊或无光泽粉红色,色泽明亮均匀气味无鲜味,有强烈的腥臭味、酸败味和劣变味鲜味降低,能察觉到鱼腥味、酸败味和劣变味无异味,具有鱼肉特有的鲜味和香味弹性无弹性,压后不能复平弹性差,压后复平缓慢有弹性,指腹压出凹印能很快复平品质总体可接受度低中等高
1.3.4 杏鲍菇麦角硫因体外抗氧化能力稳定性分析
1.3.4.1 pH对杏鲍菇麦角硫因DPPH自由基清除能力稳定性的影响
取杏鲍菇麦角硫因提取液(pH=7.8±0.2)0.5 mL,分管添加等体积pH为2.0、4.0、6.0、8.0、10.0和12.0的磷酸钾缓冲溶液(配制时以磷酸和氢氧化钾水溶液调节pH),混匀后在37 ℃水浴孵育2 h。按照1.3.2.2方法测定各管DPPH自由基清除能力。
1.3.4.2 不同温度对杏鲍菇麦角硫因DPPH自由基清除能力的影响
取1 mL杏鲍菇麦角硫因提取液(pH=7.8±0.2),分管于4、37、50、70、90 ℃孵育1 h,降温后按照1.3.2.2方法测定各管DPPH自由基清除能力。
1.3.4.3 不同金属离子对杏鲍菇麦角硫因DPPH自由基清除能力的影响
取杏鲍菇麦角硫因提取液(pH=7.8±0.2)0.5 mL,分管添加等体积50 μg/mL的K+、Ca2+、Na+、Mg2+、Fe3+、Al3+溶液,混匀后37 ℃孵育处理1h。各管DPPH自由基清除能力测定方法同1.3.2.2。
1.3.4.4 不同还原剂对杏鲍菇麦角硫因DPPH自由基清除能力的影响
取杏鲍菇麦角硫因提取液(pH=7.8±0.2)0.5 mL,分管添加等体积质量分数为0%、0.1%、0.2%、0.3%、0.4% 和0.5%的亚硫酸钠水溶液,37 ℃孵育处理15 min。 按照1.3.2.2方法测定各管DPPH自由基清除能力。
1.3.4.5 不同氧化剂对杏鲍菇麦角硫因DPPH自由基清除能力的影响
取杏鲍菇麦角硫因提取液(pH=7.8±0.2)0.5 mL,分管分别添加体积分数为0.00%、0.05%、0.10%、0.15%和0.20%的20% H2O2,混匀后黑暗静置30 min。按照1.3.2.2方法测定各管DPPH自由基清除能力。
1.4 数据处理方法
本文使用Excel 2016和SPSS 22 进行显著性分析,Origin 8.5等图表制作软件进行数据处理。
2 结果与分析
2.1 杏鲍菇麦角硫因的体外抗氧化活性分析
2.1.1 羟自由基清除能力
金属依赖型羟自由基可降解脱氧核糖。作为其降解反应的产物之一,丙二醛(MDA)的浓度可间接说明抗氧化剂的羟自由基清除能力的强弱[17]。本研究据此来检测麦角硫因的抗氧化性,并使用谷胱甘肽(传统抗氧化剂)作为对照分析。
如图1所示,添加量对2种抗氧化剂的抗氧化活性影响显著,且在本实验设置浓度梯度区间内,相较于谷胱甘肽,杏鲍菇麦角硫因(ERG)的羟自由基清除能力显著更强(P<0.05);0.262 mmol/L的谷胱甘肽羟自由基清除率最高仅为22.2%,而麦角硫因(ERG)最高可至64.26%。这表明杏鲍菇麦角硫因的羟自由基清除能力较谷胱甘肽显著更强、且与杏鲍菇麦角硫因浓度(添加量)呈正相关。FRANZONI等也发现,和抗坏血酸、生育酚、谷胱甘肽等常见抗氧化剂相比,L-麦角硫因(Mw=229.3) 清除过氧自由基和羟自由基等效果更好[17]。
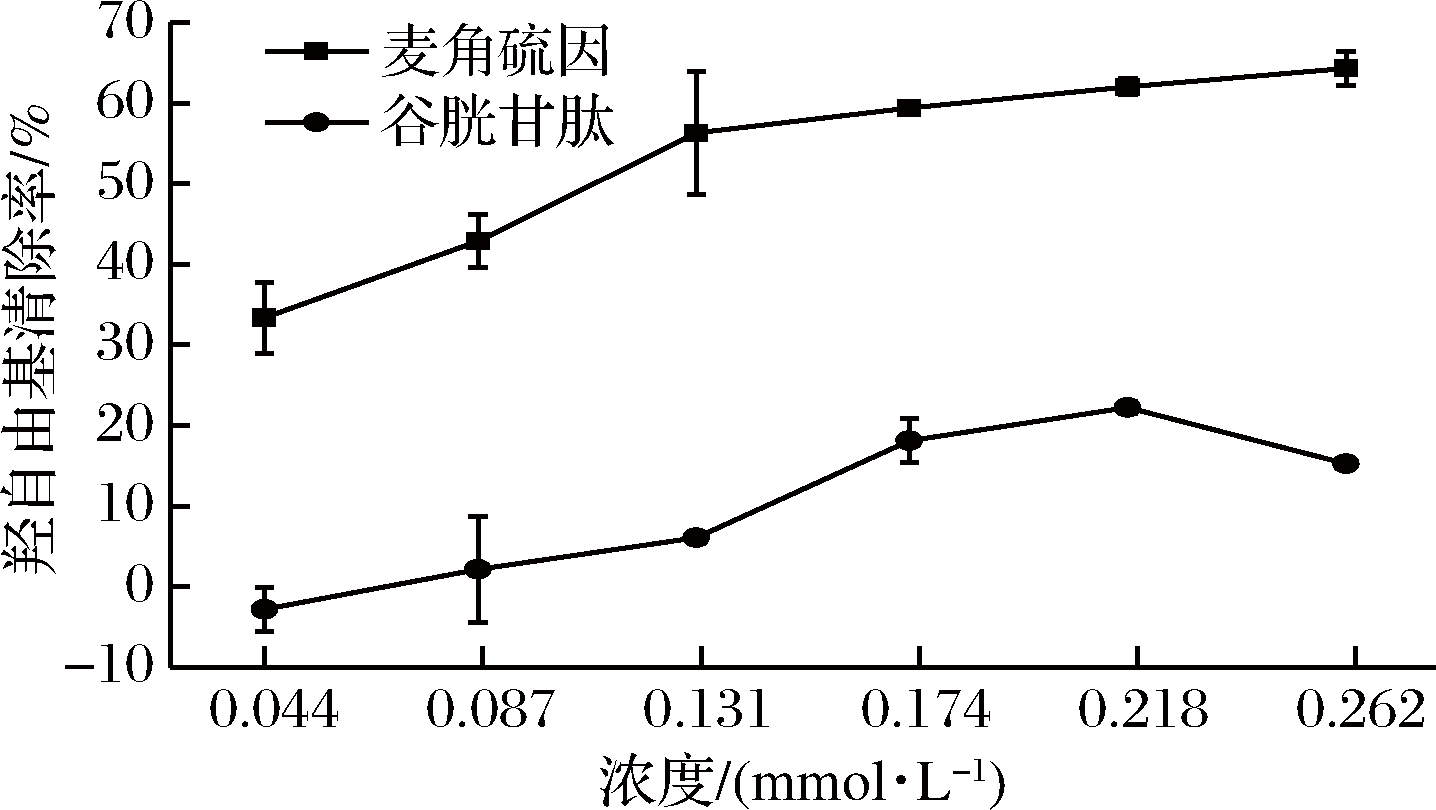
图1 麦角硫因的羟自由基清除能力
Fig.1 Hydroxyl free radical scavenging ability of ergothioneine
2.1.2 DPPH自由基清除能力
作为一种比较稳定的自由基,DPPH自由基可与抗氧化剂的单电子结合导致褪色。其褪色强弱与抗氧化剂的抗氧化能力直接相关[19]。如图2所示,在0.087~0.436 mmol/L,杏鲍菇麦角硫因浓度和其DPPH清除能力显著正相关(r2=0.981,P<0.05),BHATTACHARYA等的研究也发现平菇(Pleurotus ostreatus)麦角硫因含量与其DPPH自由基清除能力存在正相关关系(r2=0.94)[21];在0.349~0.872 mmol/L的麦角硫因的DPPH自由基清除能力始终位于抗坏血酸和谷胱甘肽之间,且当浓度增加至0.523~1.047 mmol/L时,杏鲍菇麦角硫因的DPPH自由基清除能力稳定在96%左右。这表明杏鲍菇麦角硫因是很好的DPPH自由基清除剂,且整体DPPH自由基清除能力强于谷胱甘肽。这与ZHANG等的研究也表明1-麦角硫因含量较高的黄色金针菇(Flammulina velutipes)的提取物在DPPH自由基,羟自由基清除力中表现出更好的抗氧化活性[22]。
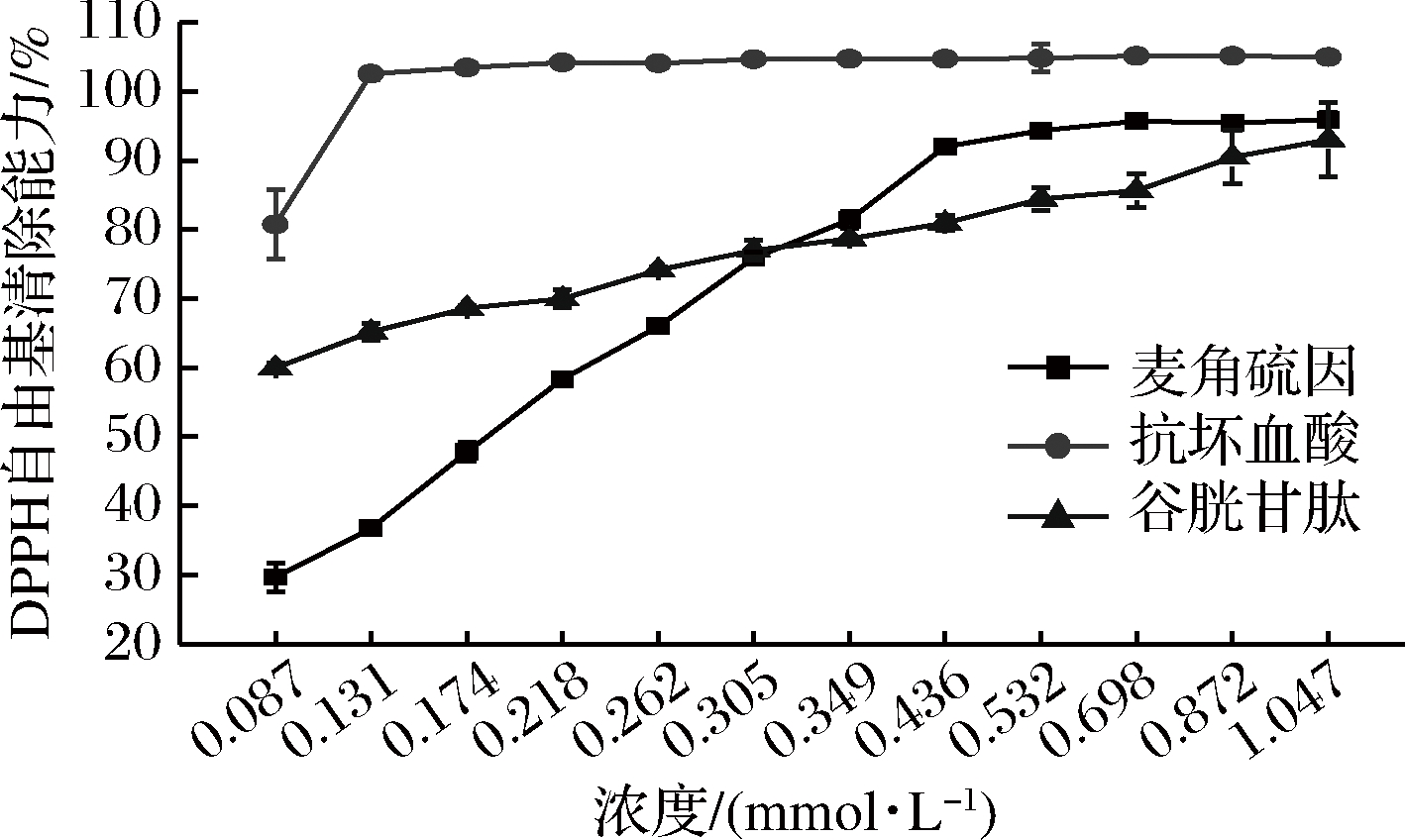
图2 麦角硫因的DPPH自由基清除能力
Fig.2 DPPH free radical scavenging ability of ergothioneine
2.1.3 ABTS自由基清除能力
ABTS自由基在抗氧化剂存在下的减少程度可用于评估可被抗氧化剂清除的自由基总量,反映了抗氧化剂的抗氧化能力强弱[20]。如图3所示,在浓度0.087~0.349 mmol/L,杏鲍菇麦角硫因的ABTS清除能力始终位于抗坏血酸和谷胱甘肽之间(P<0.05)。
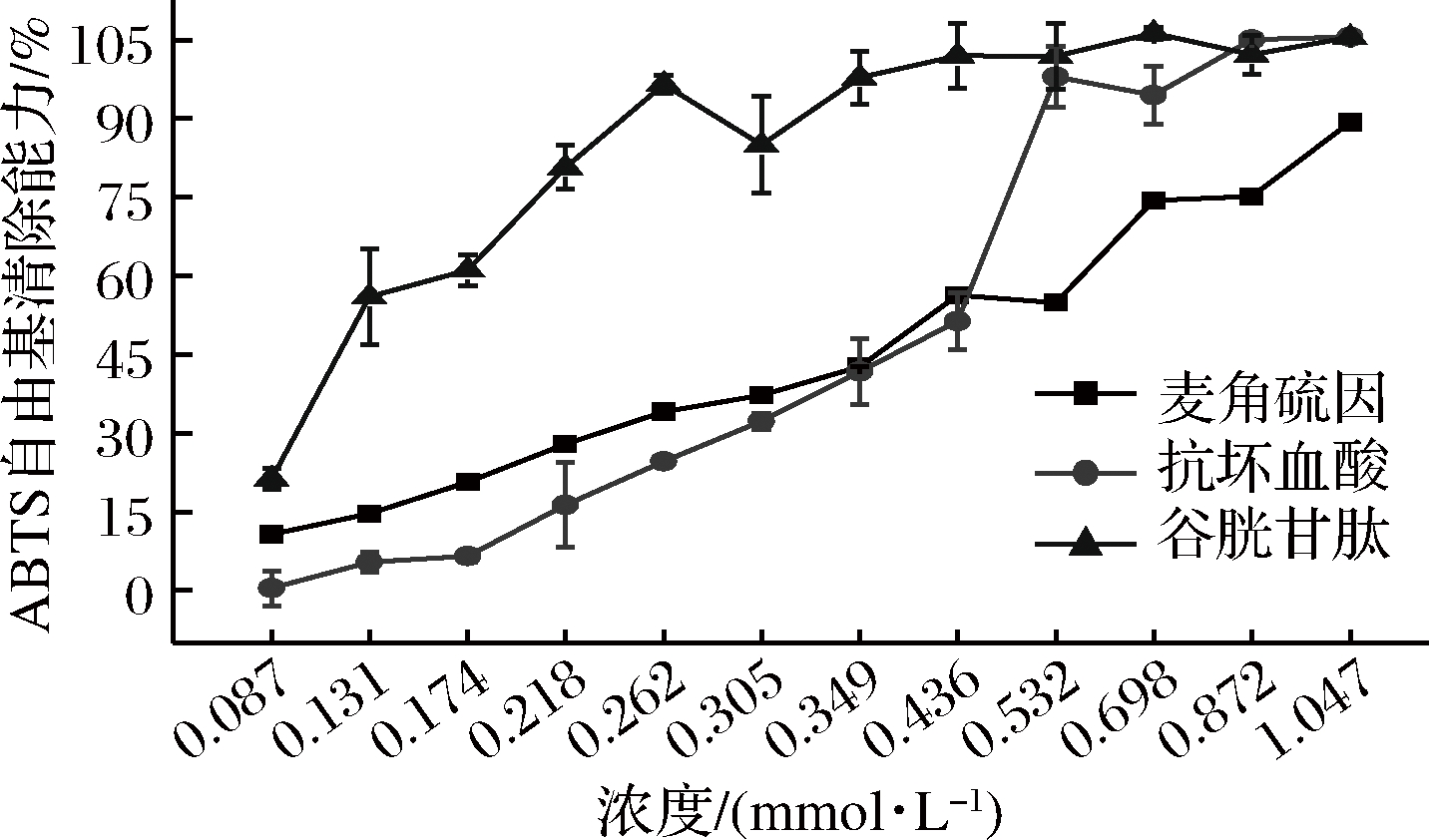
图3 麦角硫因的ABTS自由基清除能力
Fig.3 ABTS free radical scavenging ability of ergothioneine
有趣的是,抗坏血酸和谷胱甘肽的ABTS自由基清除能力增加到一定程度后出现稳定平缓的趋势,而杏鲍菇麦角硫因的ABTS自由基清除能力始终增强至最大,没有出现最高稳定范围。在浓度为1.047 mmol/L时,尽管较其他2种传统抗氧化剂,杏鲍菇麦角硫因的ABTS自由基清除力显著最弱(P<0.05),但仍能达到89.28%,且有继续上升的趋势。GHAHREMANI-MAJD等比较了双孢蘑菇子实体和其不同生长期的菌丝提取物中的麦角硫因含量和ABTS自由基清除能力,发现在麦角硫因含量最高的S1菌株子实体提取物的ABTS自由基清除能力最高,而麦角硫因含量最低的S4初期菌丝提取物的ABTS自由基清除能力最低[23]。结合本实验结果,我们推测随着浓度的继续上升,杏鲍菇麦角硫因的ABTS自由基清除力仍会继续增强,且可能增强至抗坏血酸和谷胱甘ABTS自由基清除力的最高值。
2.1.4 FRAP抗氧化能力检测
在抗氧化物质的作用下, Fe3+被还原成Fe2+,因此通过检测Fe2+-TPTZ的生成量(FRAP值)可以反映抗氧化物质的还原能力[20]。如图4所示,在0.087~1.047 mmol/L,抗坏血酸和谷胱甘肽的FRAP抗氧化能力均随着其浓度的增加而显著增强,但杏鲍菇麦角硫因的FRAP抗氧化能力的增强并不显著(P>0.05)。图4还表明,杏鲍菇麦角硫因的FRAP值在图示浓度区间内始终显著低于抗坏血酸和谷胱甘肽(P<0.05),且维持在0.056 3~0.072 3 μmol/L,接近于0,显示出极弱的FRAP抗氧化能力。这可能是因为此测定环境(酸性)严重影响了麦角硫因的稳定性,导致其FRAP抗氧化能力的丢失。KIM等也发现平菇麦角硫因最高FRAP抗氧化力(8.86±0.33 FeSO4 eq)远低于其最高DPPH自由基和ABTS自由基清除活性,分别为(80.41±0.56)%和(91.47±0.11)%[24]。

图4 麦角硫因的FRAP值
Fig.4 FRAP of ergothioneine
2.2 杏鲍菇麦角硫因对贮藏鱼肉的保鲜作用
2.2.1 杏鲍菇麦角硫因对贮藏鱼肉的护色作用
色差值(a*)越低,鱼肉颜色越暗,细胞受损和脂肪氧化就越严重。如图5所示,在0~3 d的贮藏期内,对照组的色差值都较低,第3天时,在所有组中显著最低(P<0.05);在3 d的贮藏期,ERG×0组的色差值较高且保持稳定,且其第1天色差值在所有处理组中最高(P<0.05);而在第0、2、3天,ERG×2组的色差值显著最高(P<0.05)。ENCARNACION等研究发现金针菇提取物中的麦角硫因可与黑变关键酶之一的酚氧化酶上的金属铜离子螯合,导致此黑变关键酶活性降低,从而有效抑制成年黑虎虾和太平洋白对虾的黑变病[25]。本实验结果也表明杏鲍菇麦角硫因对贮藏鱼肉的护色作用明显,且效果优于传统保鲜剂TBH。本实验还表明杏鲍菇麦角硫因的护色效果受浓度和贮藏时间影响,贮藏前期高浓度的麦角硫因护色效果最好,贮藏后期中等浓度的麦角硫因效果最佳。
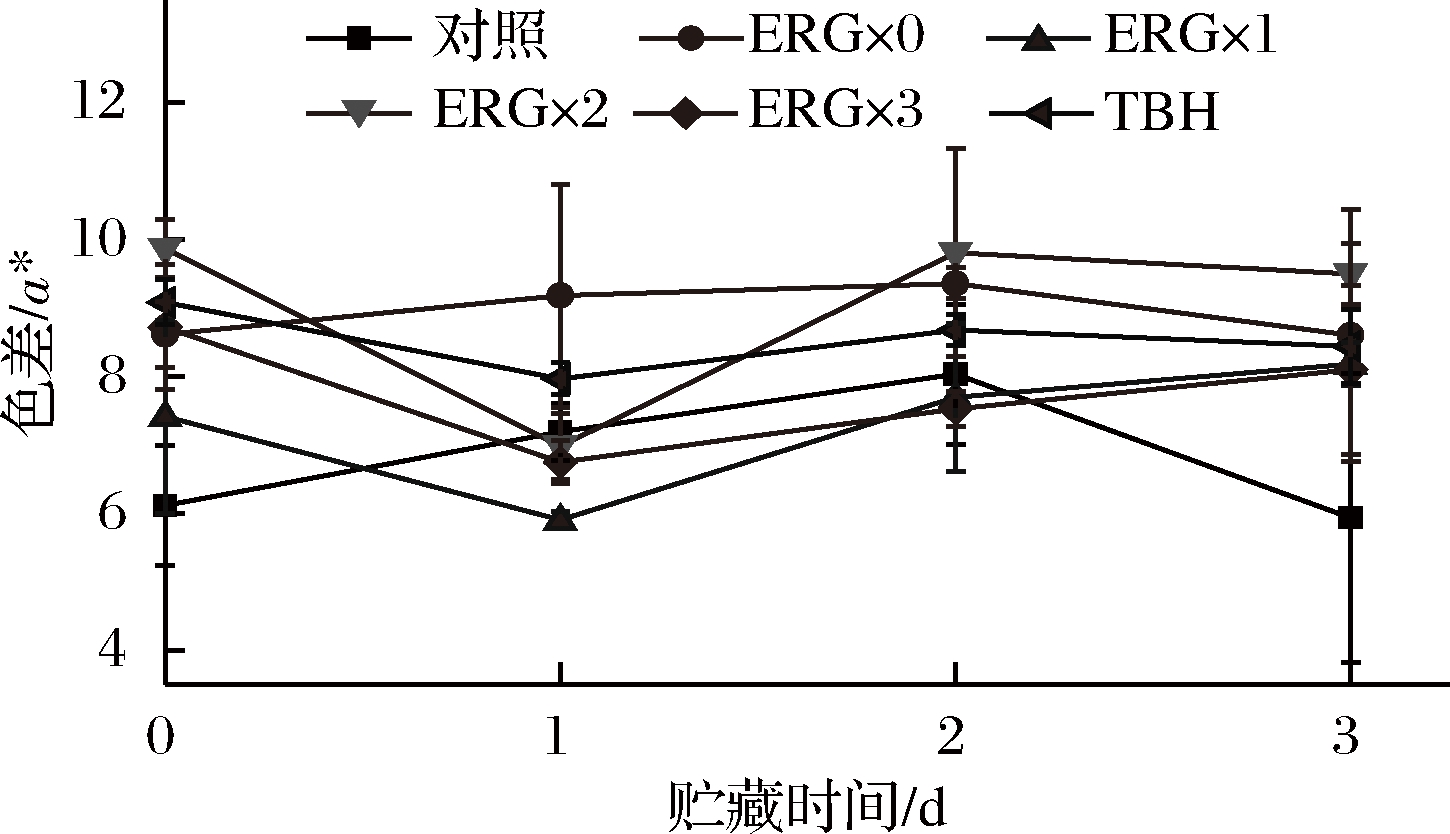
图5 杏鲍菇麦角硫因对贮藏鱼肉的护色作用
Fig.5 Color protection effect of ergothioneine on the fresh fish during storage
2.2.2 杏鲍菇麦角硫因对贮藏鱼肉pH值的维持作用
如图6所示,第0~1天所有组的pH值显著下降(P<0.05),这是鱼肉在贮藏初期三磷酸腺苷和糖原分解产生磷酸、乳酸等酸性物质所致;第1~3天所有组的pH值呈上升趋势,这是因为在贮藏后期,鱼肉发生酶促等自身溶解反应,如蛋白质分解,TMAO分解和AMP脱氨等,产生氨基酸、TMA和DMA等含氮碱性化合物,导致鱼肉pH值上升,品质下降。
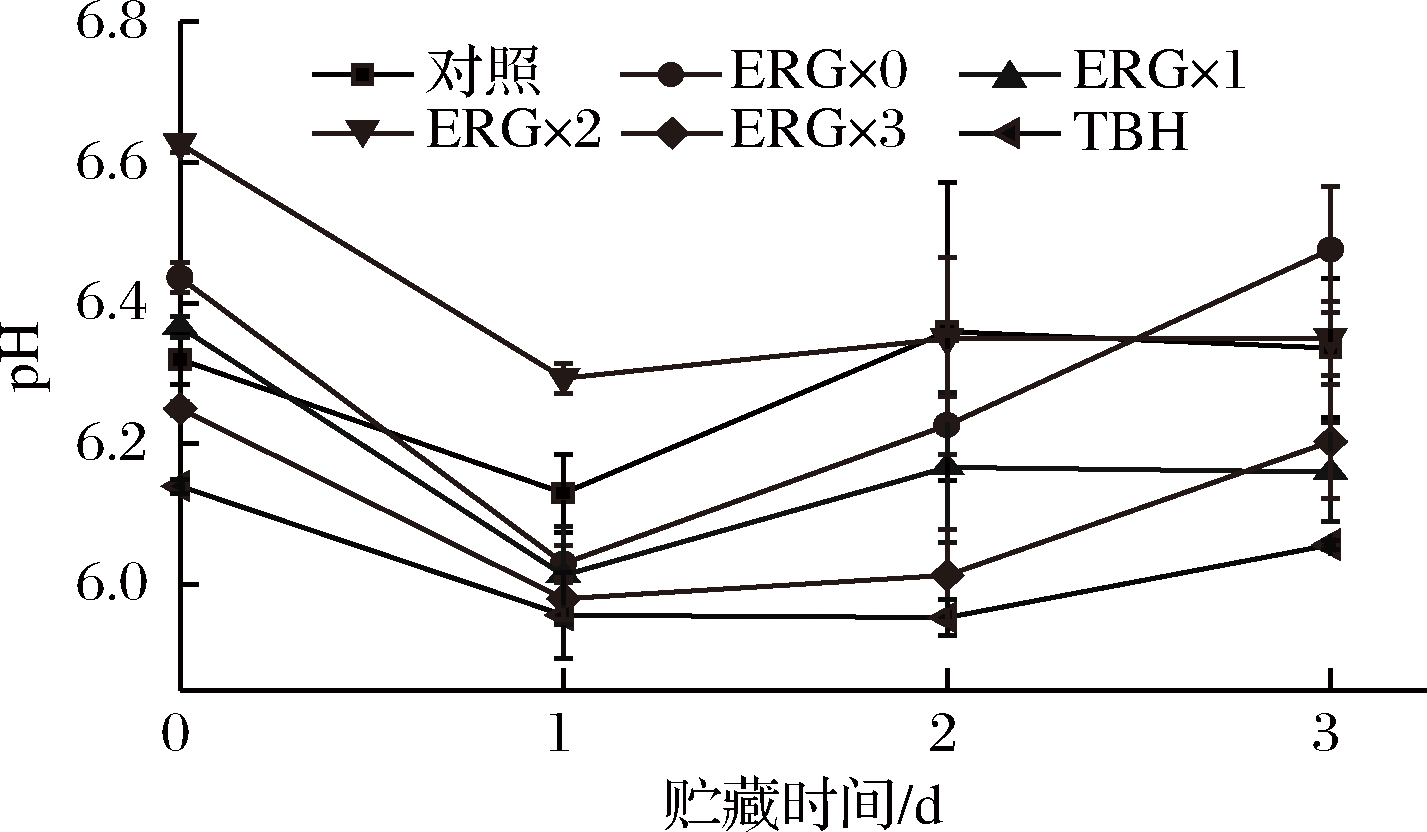
图6 杏鲍菇麦角硫因对贮藏鱼肉pH变化的作用
Fig.6 Effect of ergothioneine on the pH change of fresh fish during storage
第0~1天,ERG×3组pH值减幅最低,这说明贮藏前期低浓度的麦角硫因更有利于鱼肉pH值的维持;在第1~3天,ERG×0组pH值增幅最高。3 d后ERG×0组的pH值最高(P<0.05),ERG×2组次之,对照组pH值水平居中,TBH组pH最低(P<0.05)。这些结果表明贮藏后期较高浓度的杏鲍菇麦角硫因更能有效维持新鲜鱼肉的pH,且总体的pH维持效果显著优于传统保鲜剂TBH。
2.2.3 杏鲍菇麦角硫因对贮藏鱼肉蛋白质氧化的减缓作用
自由基被氧化的一个重要特征是羰基的形成,据此蛋白质的氧化程度可由羰基含量的变化来评判[26-27]。如图7所示,在整个贮藏期内,对照组的羰基含量始终较麦角硫因组和TBH组高,且所有组的羰基含量均显著上升(P<0.05),表明随着贮藏时间的延长,鱼肉中的蛋白质被迅速氧化。第2天和第3天时,麦角硫因处理组和TBH组的羰基含量均低于对照组,这说明杏鲍菇麦角硫因和TBH均能在一定程度上抑制鱼肉的蛋白质氧化。第3天时,贮藏鱼肉羰基含量高低顺序为ERG×1组
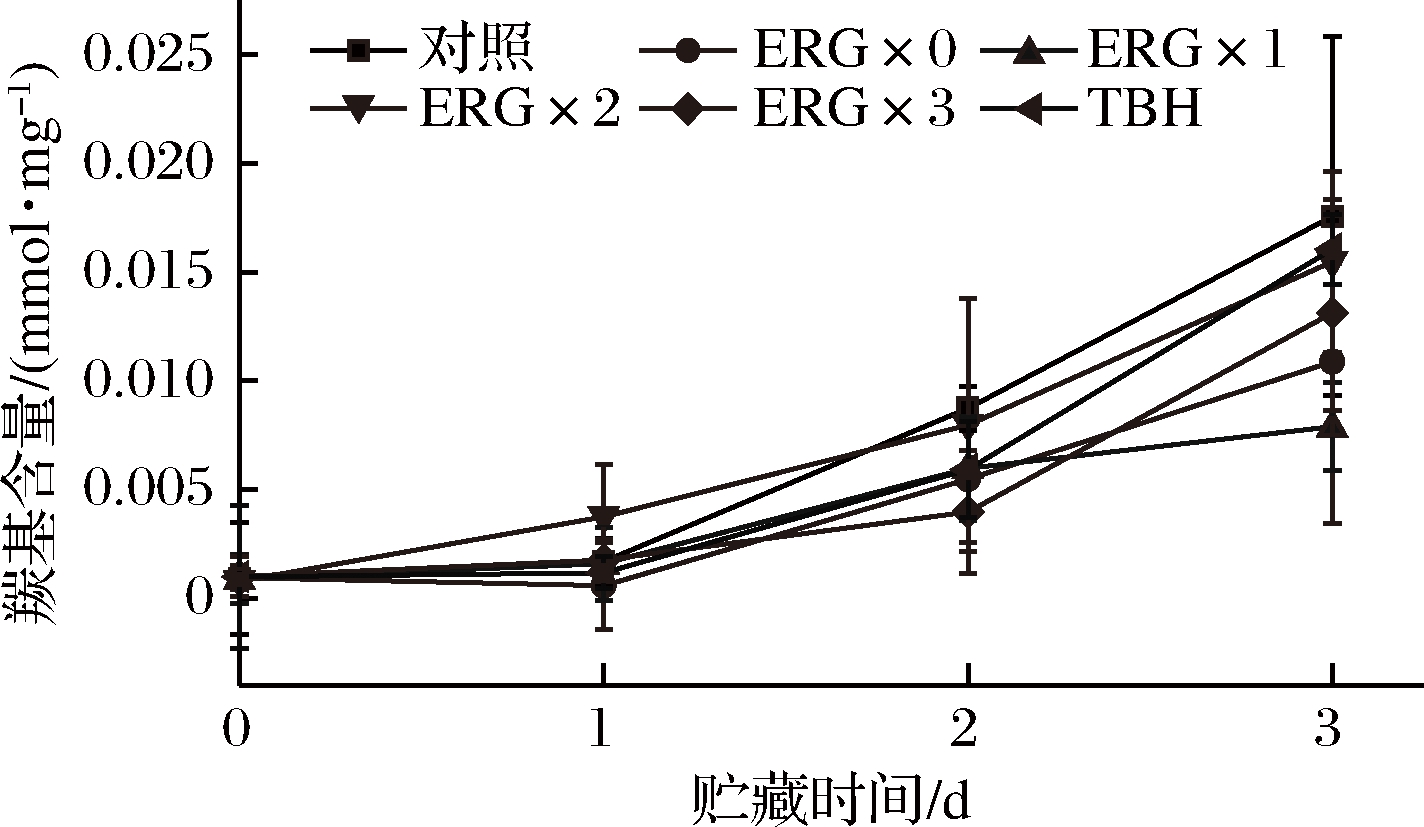
图7 杏鲍菇麦角硫因对新鲜鱼肉贮藏过程羰基含量变化的作用
Fig.7 Effect of ergothioneine on changes of carbonyl content of fresh fish during storage
2.2.4 杏鲍菇麦角硫因对贮藏鱼肉脂肪氧化的减缓作用
在贮藏后期,酶解和自动氧化可导致细胞脂肪氧化,而脂肪氧化产生醛类物质可与硫代巴比妥酸生成有色化合物,因此硫代巴比妥酸反应值越高,脂肪氧化就越严重[3]。如图8所示,整个贮藏期内,对照组的硫代巴比妥酸反应值显著最高,脂肪氧化最严重;TBH组的硫代巴比妥酸反应值显著最低(P<0.05),脂肪氧化程度最轻,这说明传统保鲜剂TBH具有最强的抑制脂肪氧化效果。4个麦角硫因处理组的硫代巴比妥酸反应值较TBH组较高,但较对照组低,脂肪氧化程度显著较轻(P<0.05)。PAHILA等研究发现补充富含麦角硫因的金针菇提取物能有效降低低温贮藏的鲑鱼中脂质过氧化氢(HPO)的积累,进而减缓其脂质氧化程度[29]。本实验结果也表明杏鲍菇麦角硫因具有一定的减缓脂肪氧化能力,但同等浓度下抗脂肪氧化效果较TBH更弱。

图8 杏鲍菇麦角硫因对贮藏鱼肉硫代巴比妥酸值变化的作用
Fig.8 Effect of ergothioneine on changes of TBA of fresh fish during storage
2.2.5 杏鲍菇麦角硫因对贮藏鱼肉感官品质的维持作用
感官评定是对食品品质评判的一个基础的手段,其结果是消费者选购食品的主要依据。如表2所示,第0天的鱼肉为粉红色,色泽明亮均匀,有鲜味,无异味和酸败味,总体品质可接受程度高;第1天时,所有处理组肉样颜色都较第0天加深,鱼腥味加重,但4个麦角硫因处理组鱼腥味最淡;至冷藏第2天,肉样颜色较前1天无明显差异(P>0.05),但对照组和TBH组均出现强烈酸腐味,且ERG×0组酸腐味最淡。第3天时,所有组变味显著,酸腐味明显,肉质变软,且伴随着浅褐色组织液的溶出,但麦角硫因处理组的酸腐味和浅褐色组织液溶出的程度较另外2组显著较轻。这些结果说明,杏鲍菇麦角硫因对贮藏鱼肉的酸腐变味有显著的减缓作用,可有效延长新鲜鱼肉的冷藏期,且效果较传统保鲜添加剂TBH更强。CAI等的研究也表明麦角硫因-壳聚糖涂膜比只有壳聚糖涂膜处理能更好地抑制日本鲈鱼总挥发性碱性氮的增加、保持鱼肉组织硬度和减少生物胺含量(尤其是腐胺,尸胺和组胺)等刺激性气体的产生,延长其保质期[30]。
添加抗氧化剂是贮存食品的有效手段之一。而过量摄入人工合成抗氧化剂引起的潜在毒性、致癌作用及可能的健康损害已被越来越多的研究证实[31]。例如,动物实验表明,食用过量的传统保鲜添加剂TBH会对健康产生负面影响,存在患胃肿瘤和损伤脱氧核糖核酸(deoxyribonucleic acid,DNA) 的风险[32]。消费者对这些人工合成抗氧化剂剂安全性的担忧促使食品工业寻找天然抗氧化剂,以代替其在食品保鲜领域的应用[31]。研究发现麦角硫因或富含麦角硫因的蘑菇提取物可有效减缓鲑鱼[29]、日本鲈鱼[30]和红鲷(Pagrosomus major)[33]等贮藏鱼肉的变色、酸败、蛋白质和脂质氧化等品质劣变,延长其货架期。但受其来源和产量的制约,麦角硫因在鱼肉保鲜的应用目前仍停留于研究阶段。本保鲜实验结果则表明相较于人工合成保鲜剂TBH,杏鲍菇麦角硫因对贮藏鱼肉总体保鲜效果较好,表现出更好的护色、维持pH、减缓蛋白质氧化及酸败腐变等作用,实际应用价值较高。
表2 贮藏鱼肉感官评定结果
Table 2 Sensory evaluation results of fresh fish during storage
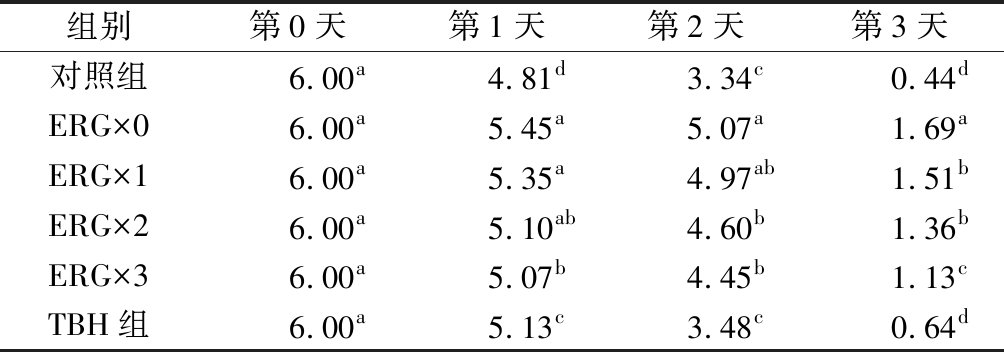
组别第0天第1天第2天第3天对照组6.00a4.81d3.34c0.44dERG×06.00a5.45a5.07a1.69aERG×16.00a5.35a4.97ab1.51bERG×26.00a5.10ab4.60b1.36bERG×36.00a5.07b4.45b1.13cTBH组6.00a5.13c3.48c0.64d
注:不同小写字母代表差异显著(P<0.05)。
2.3 杏鲍菇麦角硫因的体外抗氧化能力稳定性分析
2.3.1 pH对杏鲍菇麦角硫因DPPH自由基清除能力的影响
如图9所示,环境pH对杏鲍菇麦角硫因的DPPH自由基清除能力的影响差异显著(P<0.05)。在强酸性条件下(pH为2或4)时,杏鲍菇麦角硫因的DPPH自由基清除能力接近0;在弱碱性条件下(pH为6~8)时,麦角硫因DPPH自由基清除能力显著增强;当pH高于8时,麦角硫因DPPH自由基清除能力维持在80%左右不变。
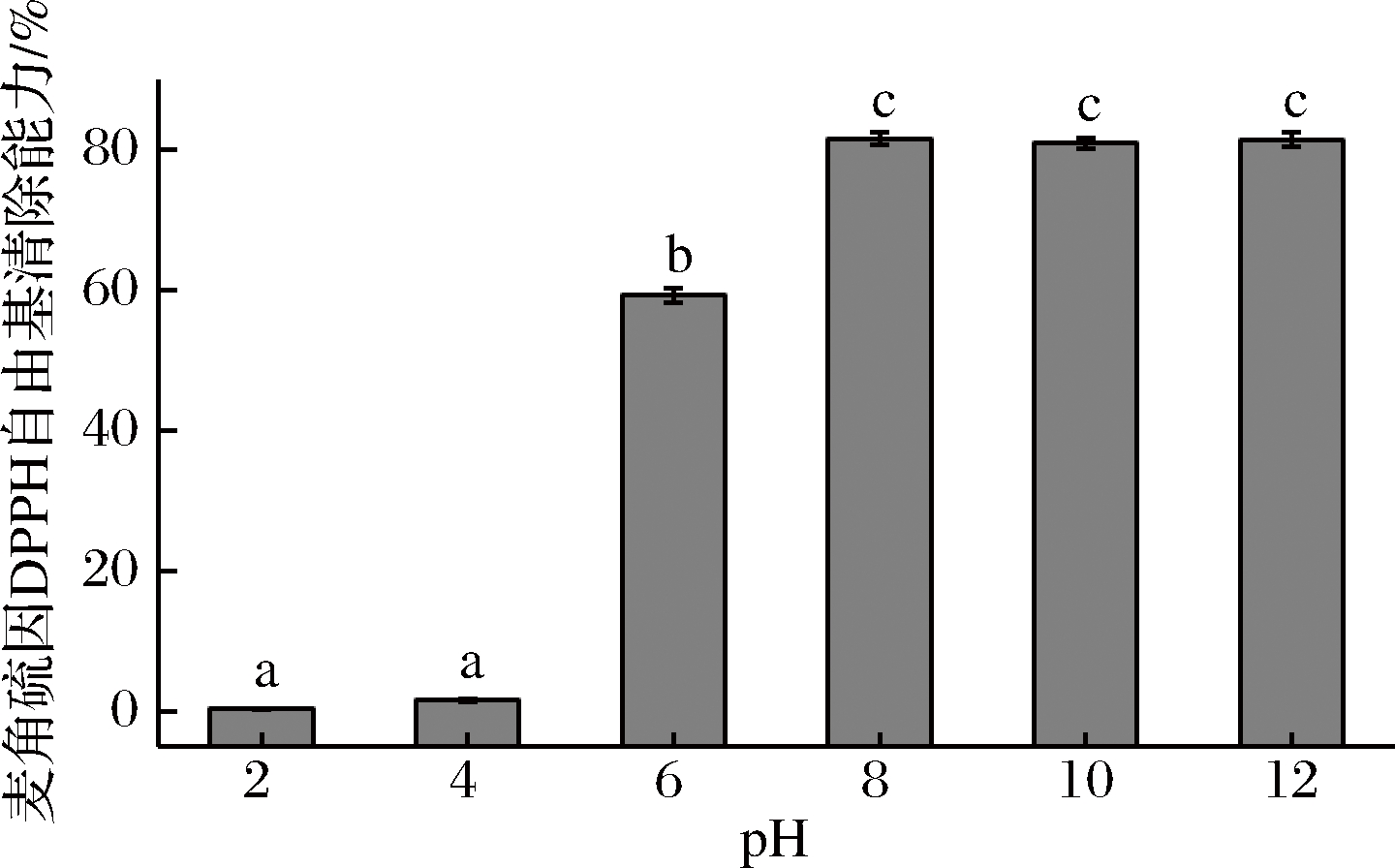
图9 pH对麦角硫因DPPH自由基清除能力的影响
Fig.9 Effect of pH on DPPH free radical scavenging capacity of ergothioneine
注:不同小写字母代表差异显著(P<0.05)。下同。
这些结果表明中性和碱性环境更有利于维持麦角硫因DPPH自由基清除能力稳定性,而酸性环境则会显著降低其体外抗氧化力的稳定性(P<0.05)。这一结果与本研究在上述抗氧化活性FRAP试验结果相一致。CUMMING等也发现与谷胱甘肽和抗坏血酸不同,麦角硫因在生理pH下以硫酮形式存在,不存在自氧化作用,因而具有更高效的抗氧化性和稳定性[6]。
2.3.2 不同温度影响杏鲍菇麦角硫因DPPH自由基清除能力
图10表明不同温度培育对杏鲍菇麦角硫因的DPPH自由基清除能力的影响差异不显著(P>0.05)。4 ℃恒温培育的麦角硫因DPPH自由基清除能力最弱,为 78.64%;其次为37℃培育的麦角硫因,为80.82%;90 ℃ 培育的麦角硫因DPPH自由基清除能力最强,为 82.34%。这些结果表明杏鲍菇麦角硫因在37℃人体温度和90 ℃高温下均具有良好的稳定性,其提取和应用等都可在这些温度下进行。这也和ITO等的实验也表明在高温下提取的麦角硫因仍有较好的抗氧化活性[34]。麦角硫因在人体温度和生理pH具有较强稳定性特征使其在保健品等功能性产品等领域且有极高的应用价值。

图10 温度对麦角硫因DPPH自由基清除能力的影响
Fig.10 Effect of temperature on DPPH free radical scavenging capacity of ergothioneine
2.3.3 金属离子对杏鲍菇麦角硫因DPPH自由基清除能力的影响
图11表明金属离子的存在会显著降低杏鲍菇麦角硫因DPPH自由基清除能力(P<0.05)。和对照组相比,添加金属离子使杏鲍菇麦角硫因的DPPH自由基清除能力整体直接减少24.76%~32.06%。图11还表明,各金属离子对杏鲍菇麦角硫因DPPH自由基清除能力的影响存在差异但不显著(P>0.05)。金属离子存在时麦角硫因DPPH自由基清除能力稳定性从小到大依次为K+< Mg2+< Na+< Al3+< Ca2+< Fe3+。其中K+和Mg2+对麦角硫因稳定性的影响最大,分别使其DPPH自由基清除能力降低了39.75%和35.81%;Ca2+和Fe3+的存在对其稳定性的影响较小,分别使其DPPH自由基清除能力降低了32.48%和30.73%。 ZHU等研究发现麦角硫因(Sigma)能与Cu(I)形成一种稳定的无氧化还原性的复合物[28],因此推测这些金属离子可能也会与杏鲍菇麦角硫因结合导致其DPPH自由基清除能力的显著降低。这表示在麦角硫因的制备、保存和应用中应该尽量避免其与金属离子共存,特别是K+和Mg2+。

图11 金属离子对麦角硫因DPPH自由基清除能力的影响
Fig.11 Effect of metal ions on DPPH free radical scavenging capacity of ergothioneine
注:不同小写字母代表差异显著(P<0.05)。
2.3.4 还原剂对杏鲍菇麦角硫因DPPH自由基清除能力的影响
图12表明亚硫酸钠的添加使麦角硫因的DPPH自由基清除能力急剧下降。这说明,亚硫酸钠(还原剂)的存在能显著降低杏鲍菇麦角硫因的稳定性,其微量添加即会使麦角硫因的DPPH自由基清除能力急剧减弱,在麦角硫因的提取、保存和使用过程中应严格避免其与亚硫酸钠等还原剂接触。

图12 还原剂对麦角硫因DPPH自由基清除能力的影响
Fig.12 Effect of reducing agent on DPPH free radical scavenging capacity of ergothioneine
2.3.5 氧化剂对杏鲍菇麦角硫因DPPH自由基清除力的影响
如图13所示,随着H2O2(氧化剂)添加量(质量分数)的增大,杏鲍菇麦角硫因DPPH自由基清除能力持续下降,这说明杏鲍菇麦角硫因的稳定性受到环境中H2O2(氧化剂)存在的显著影响。因此,在麦角硫因的提取、保存和使用过程中应有意识地减少其与H2O2等氧化剂接触。值得注意的是,当H2O2添加量为0.1%时,杏鲍菇麦角硫因DPPH自由基清除率为36.07%,远大于等量添加亚硫酸钠(还原剂)时其DPPH自由基清除率(1.57%),这表明H2O2对杏鲍菇麦角硫因的稳定性的影响较亚硫酸钠(还原剂)弱。
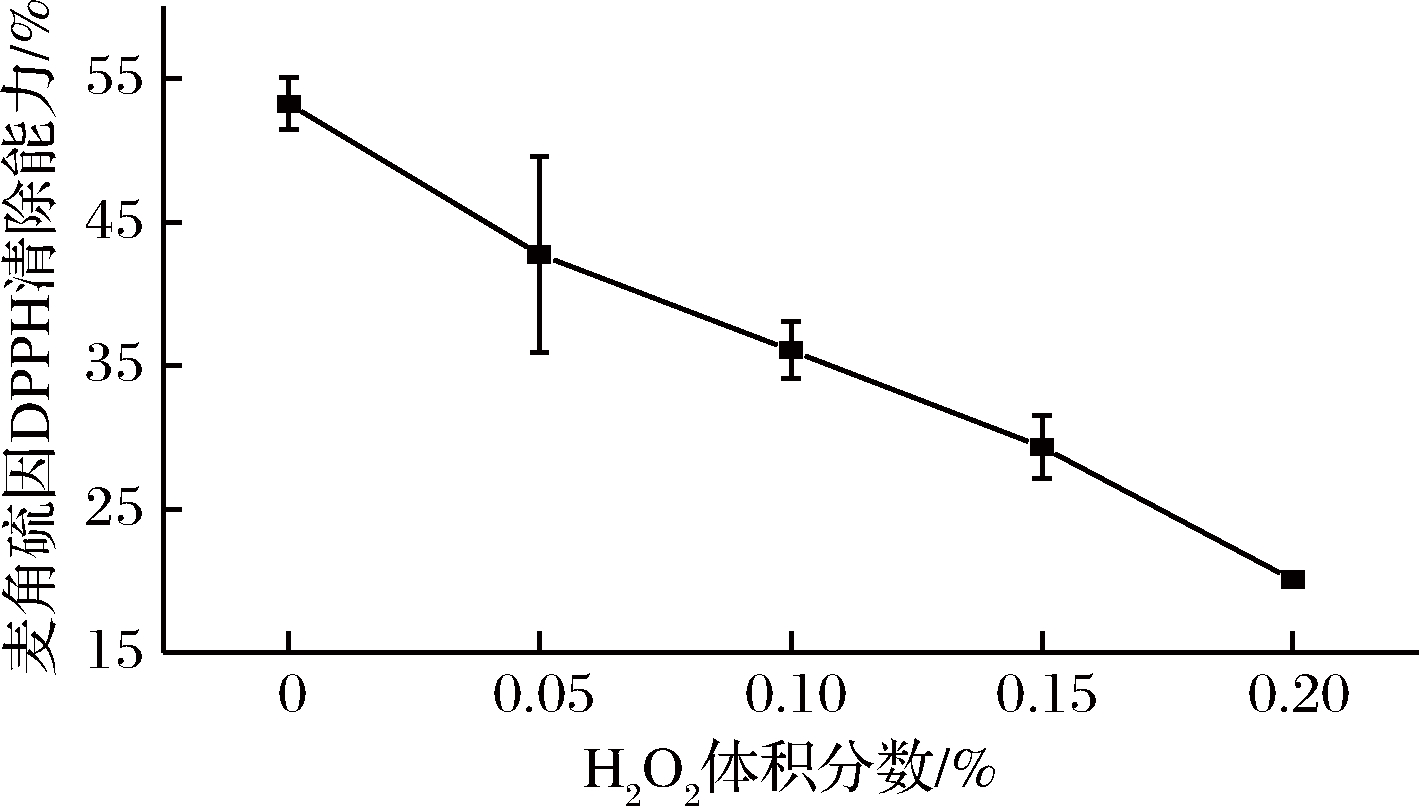
图13 氧化剂对麦角硫因DPPH自由基清除能力的影响
Fig.13 Effect of oxidants on DPPH free radical scavenging capacity of ergothioneine
3 结论
添加量对麦角硫因的抗氧化活性影响显著,在一定区间内表现出正相关的趋势。同等添加量下,相比于抗坏血酸和谷胱甘肽,杏鲍菇麦角硫因的抗氧化活性表现出显著最强的羟自由基的清除能力(P<0.05), 位于二者之间的DPPH自由基清除能力,较弱的ABTS自由基清除能力和显著最低的FRAP抗氧化能力(P<0.05)。相较于人工合成保鲜剂TBH,杏鲍菇麦角硫因不仅具有更高的天然安全性,且对贮藏鱼肉总体保鲜效果较好,表现出更好的护色、维持pH、减缓蛋白质氧化及酸败腐变等作用,实际应用价值较高。稳定性分析发现,酸性、K+/Mg2+类金属离子、部分氧化剂和还原剂等环境因子可显著降低杏鲍菇麦角硫因的体外抗氧化活性,而人体温度37 ℃/较高温度(如90 ℃)、生理pH/强碱等条件则有利于其稳定性的维持。本文证实杏鲍菇麦角硫因具有较强体外抗氧化性和保鲜效果,并对影响麦角硫因抗氧化能力稳定性的环境条件进行初探,可为其在各领域的开发应用提供理论依据。
[1] WEIGAND-HELLER A B J, KRIS-ETHERTON P M, BEELMAN R B. The bioavailability of ergothioneine from mushrooms (Agaricus bisporus) and the acute effects on antioxidant capacity and biomarkers of inflammation[J]. Preventive Medicine, 2012,54:S75-S78.
[2] CHEAH I K, TANG R M Y, YEW T S Z, et al. Administration of pure ergothioneine to healthy human subjects: Uptake, metabolism, and effects on biomarkers of oxidative damage and inflammation[J]. Antioxidants & Redox Signaling, 2017,26(5):193-206.
[3] ENCARNACION A B,FAGUTAO F, HIRONO I, et al. Effects of ergothioneine from mushrooms (Flammulina velutipes) on melanosis and lipid oxidation of kuruma shrimp (Marsupenaeus japonicus)[J]. Journal of Agricultural and Food Chemistry, 2010,58(4):2 577-2 585.
[4] BAO H N D, OSAKO K, OHSHIMA T. Value-added use of mushroom ergothioneine as a colour stabilizer in processed fish meats[J]. Journal of the Science of Food and Agriculture, 2010,90(10):1 634-1 641.
[5] BAZELA K, SOLYGA-ZUREK A, DEBOWSKA R, et al. L-ergothioneine protects skin cells against UV-induced damage—A preliminary study[J]. Cosmetics, 2014,1(1):51-60.
[6] CUMMING B M, CHINTA K C, REDDY V P, et al. Role of ergothioneine in microbial physiology and pathogenesis[J]. Antioxidants & Redox Signaling, 2018,28(6):431-444.
[7] CHEAH I K, HALLIWELL B. Ergothioneine,antioxidant potential, physiological function and role in disease[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2012,1822(5):784-793.
[8] HALLIWELL B, CHEAH I K, TANG R M Y. Ergothioneine - a diet-derived antioxidant with therapeutic potential[J]. FEBS Letters, 2018,592(20):3 357-3 366.
[9] EYF J, SCHÖMIG E, TAUBERT D. Dietary sources and antioxidant effects of ergothioneine[J]. Journal of Agricultural and Food Chemistry, 2007,55(16):6 466-6 474.
[10] KALARAS M D, RICHIE J P, CALCAGNOTTO A, et al. Mushrooms: A rich source of the antioxidants ergothioneine and glutathione[J]. Food Chemistry, 2017,233:429-433.
[11] CHEN S Y,HO K J, HSIEH Y, et al. Contents of lovastatin, γ-aminobutyric acid and ergothioneine in mushroom fruiting bodies and mycelia[J]. LWT-Food Science and Technology, 2012,47(2):274-278.
[12] DUBOST N J, OU B, BEELMAN R B. Quantification of polyphenols and ergothioneine in cultivated mushrooms and correlation to total antioxidant capacity[J]. Food Chemistry, 2007,105(2):727-735.
[13] NGUYEN T H, NAGASAKA R, OHSHIMA T. Effects of extraction solvents, cooking procedures and storage conditions on the contents of ergothioneine and phenolic compounds and antioxidative capacity of the cultivated mushroom Flammulina velutipes[J]. International Journal of Food Science and Technology, 2012,47(6):1 193-1 205.
[14] LIANG C H, HUANG L Y, HO K J, et al. Submerged cultivation of mycelium with high ergothioneine content from the culinary-medicinal king oyster mushroom Pleurotus eryngii (higher Basidiomycetes) and its composition[J]. International Journal of Medicinal Mushrooms, 2013,15(2):153-164.
[15] BAO H N D, USHIO H, OHSHIMA T. Antioxidative activities of mushroom (Flammulina velutipes) extract added to bigeye tuna meat: Dose-dependent efficacy and comparison with other biological antioxidants[J]. Journal of Food Science, 2009,74(2):C162-C169.
[16] SONG T Y, YANG N C, CHEN C L, et al. Protective effects and possible mechanisms of ergothioneine and hispidin against methylglyoxal-induced injuries in rat pheochromocytoma cells[J]. Oxidative Medicine and Cellular Longevity, 2017,2017:1-10.
[17] FRANZONI F,COLOGNATO R, GALETTA F, et al. An in vitro study on the free radical scavenging capacity of ergothioneine: Comparison with reduced glutathione, uric acid and trolox[J]. Biomedicine & Pharmacotherapy, 2006,60(8):453-457.
[18] DICAGNO R, MINERVINI G, RIZZELLO C G, et al. Effect of lactic acid fermentation on antioxidant, texture, color and sensory properties of red and green smoothies[J]. Food Microbiology, 2011,28(5):1 062-1 071.
[19] ZHANG J, HOU X, AHMAD H, et al. Assessment of free radicals scavenging activity of seven natural pigments and protective effects in AAPH-challenged chicken erythrocytes[J]. Food Chemistry, 2014,145:57-65.
[20] THAIPONG K,BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006,19(6):669-675.
[21] BHATTACHARYA M,SRIVASTAV P P, MISHRA H N. Optimization of process variables for supercritical fluid extraction of ergothioneine and polyphenols from Pleurotus ostreatus and correlation to free-radical scavenging activity[J]. The Journal of Supercritical Fluids, 2014,95:51-59.
[22] ZHANG Z, JIN Q, LYU G, et al. Comparative study on antioxidant activity of four varieties of Flammulina velutipes with different colour[J]. International Journal of Food Science & Technology, 2013,48(5):1 057-1 064.
[23] GHAHREMANI-MAJD H, DASHTI F. Chemical composition and antioxidant properties of cultivated button mushrooms (Agaricus bisporus)[J]. Horticulture, Environment, and Biotechnology, 2015,56(3):376-382.
[24] KIM M H, JEONG E J, KIM Y S. Studies on the antioxidative activities and active components of the extracts from Pleurotus ostreatus[J]. Journal of Food Hygiene and Safety, 2016,31(2):119-125.
[25] ENCARNACION A B,FAGUTAO F, HIRAYAMA J, et al. Edible mushroom (Flammulina velutipes) extract inhibits melanosis in Kuruma shrimp (Marsupenaeus japonicus)[J]. Journal of Food Science, 2011,76(1):C52-C58.
[26] HUANG D, OU B, HAMPSCH-WOODILL M, et al. High-throughput assay of oxygen radical absorbance capacity (ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format[J]. Journal of Agricultural and Food Chemistry, 2002,50(16):4 437-4 444.
[27] GOKCE G, ARUN M Z. Ergothioneine produces relaxation in isolated rat aorta by inactivating superoxide anion[J]. European Review for Medical and Pharmacological Sciences, 2014,18(21):3 339-3 345.
[28] ZHU B Z, MAO L, FAN R M, et al. Ergothioneine prevents copper-induced oxidative damage to DNA and protein by forming a redox-inactive ergothioneine-copper complex[J]. Chemical Research in Toxicology, 2011,24(1):30-34.
[29] PAHILA J, KANEDA H, NAGASAKA R, et al. Effects of ergothioneine-rich mushroom extracts on lipid oxidation and discoloration in salmon muscle stored at low temperatures[J]. Food Chemistry, 2017,233:273-281.
[30] CAI L, LI X, WU X, et al. Effect of chitosan coating enriched with ergothioneine on quality changes of Japanese sea bass (Lateolabrax japonicas)[J]. Food and Bioprocess Technology, 2014,7(8):2 281-2 290.
[31] DE-OLIVEIRA V S,FERREIRA F S, COPLE M C R, et al. Use of natural antioxidants in the inhibition of cholesterol oxidation: A review[J]. Comprehensive Reviews in Food Science and Food Safety, 2018,17(6):1 465-1 483.
[32] WANG L, YANG R, LI J, et al. A selective and sensitive tert-butylhydroquinone sensor based on synergy of CTAB and AuNPs-PVP-graphene nanohybrids[J]. Ionics, 2016,22(3):415-423.
[33] CAI L, WU X, DONG Z, et al. Physicochemical responses and quality changes of red sea bream (Pagrosomus major) to gum arabic coating enriched with ergothioneine treatment during refrigerated storage[J]. Food Chemistry, 2014,160:82-89.
[34] ITO T,KATO M, TSUCHIDA H, et al. Ergothioneine as an Anti-oxidative/anti-inflammatory component in several edible mushrooms[J]. Food Science and Technology Research, 2011,17(2):103-110.