色素作为食品的重要组分,能够弥补食品加工过程中色素损失,减少产品批次间质量差异,改进食品视觉特性[1-2]。来源于动植物、昆虫及微生物等的天然色素具有绿色、环保和可再生等特点,已经应用于食品添加剂、纺织品染色、化妆品及药剂生产等领域[3]。然而,结构不饱和导致天然色素不稳定性,成为其广泛应用的主要瓶颈之一[4]。天然色素稳定性不仅受加工过程中的温度影响,还与色素体系的内在特性如色素化学结构、pH、蛋白(酶)和金属离子,及储运过程中外界光和氧等有关[5]。因此,有必要了解天然色素的降解过程,以采取有效措施,确保其稳定,更好地将其用于有色食品生产。热处理是食品加工过程中一个常用手段,它可以诱导生物大分子失去稳定性,减少生物活性成分的含量,是一个复杂的化学和物理变化过程[1,6]。基于大量数据的数学模型,能够运用数学语言描述化学和物理变化过程,预测天然色素的降解特征[7]。研究表明,第一动力学模型能够很好地描述天然色素,如叶绿素、花青素、胭脂红色素、聚酮类色素及甜菜红色素等的降解行为,量化其热降解动力学参数,这为它们在食品加工中的应用提供了理论依据[2,5-9]。
蓝状菌(Talaromyces spp.)在生物医药、食品加工、环境治理及作物病害控制等领域具有重要的应用价值[10]。某些蓝状菌能够分泌大量的聚酮类色素,且不产生真菌毒素,是潜在的工业生产菌种[11-12]。VENKATACHALAM等[13-14]对分离自印度洋中的留尼汪岛珊瑚礁上的白二轮蓝状菌色素生产能力进行评价,其中最有潜力的1株胞外橙黄色素色价为22.39 UA(470 nm),红色素色价为18.67 UA(500 nm);并利用HPLC-DAD-ESI-MS和NMR鉴定出橙色的红斑红曲素和红曲红素、黄色的红曲素及红色的单红曲胺等12种聚酮类化合物;AGUILAR等[15]研究了臭氧消毒技术对蓝状菌色素稳定的影响,发现臭氧浓度和作用时间对色素具有显著性影响。本课题组前期从大王岭原始森林腐殖质土壤中分离得到1株产可溶性红色素的白二轮蓝状菌DWL-C010(以下简称蓝状菌),且其色素具有较好的热稳定性,具有一定的应用前景[16]。本实验建立了不同pH下的蓝状菌红色素热降解和光降解的动力学模型,并考查了抗氧化剂Vc、氧化剂H2O2、还原剂Na2SO3、甜味剂和防腐剂等食品添加剂对其的影响,以期为其今后应用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
菌株白二轮蓝状菌(Talaromyces abobiverticillius)DWL-C010, 保存于百色学院农业与食品工程学院-80 ℃ 超低温冰箱。
1.1.2 主要试剂
柠檬酸、Na2HPO4、NaH2PO4、麦芽糖、葡萄糖、蔗糖、无水亚硫酸钠、山梨酸钾、苯甲酸钠、VC及H2O2等,均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂培养基(PDA),用于孢子培养,马铃薯葡萄糖液体培养基(PDB),用于发酵产红色素,二者pH自然,115 ℃灭菌20 min。
1.2 仪器与设备
UV-2700紫外可见分光光度计,日本岛津公司;MDF-U73V-80 ℃超低温冰箱,日本三洋公司;AL204电子分析天平,德国梅特勒公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;DL-3000循环水冷器,郑州长城科工贸公司。
1.3 实验方法
1.3.1 色素制备
蓝状菌于PDA平板上划线培养6 d,用0.1%(体积分数)的Tween-80无菌水洗下孢子、计数,并接种于盛有100 mL PDB的500 mL锥形瓶中(孢子终浓度约为106/mL);28 ℃、150 r/min发酵培养8 d。按照马博等[16]的方法进行色素样品前处理,得红色素样品浓缩液。确定其最佳吸收波长(493 nm),适当稀释,使其吸光度在1.8~2.0。
1.3.2 降解热力学和动力学参数测定
不同pH色素溶液用不同缓冲溶液进行稀释配制。pH 4.0~6.0时,用0.2 mol/L柠檬酸-Na2HPO4缓冲液进行配制;色素溶液pH 7.0时,用0.2 mol/L NaH2PO4-Na2HPO4缓冲液进行配制。色素保留率按照公式(1)计算:
(1)
式中: R为色素保留率;An为某一个处理条件下的吸光度;A0为对照0 h/d时的吸光度。
由于聚酮类色素降解符合一级动力学规律,故可以参考文献[16]求出Dc、t1/2、D及Ea等动力学参数[1, 16];Z值可以由公式(2)计算,即以Τ对lg(t1/2)作线性回归,由直线的斜率可得到Z值:
T=-Ζlg(t1/2)+b
(2)
式中:Τ为温度,℃;t1/2为半衰期;b为线性方程截距。
此外,基于Dc和Ea,可由公式(3)、(4)和(5)分别推出活化焓(ΔH#)、活化自由能(ΔG#)和活化熵(ΔS#)等热力学参数。
ΔH#=Ea-RT
(3)
ΔG#=-RTln(Dch/KΒT)
(4)
(5)
式中,Ea为活化能,kJ/mol;R为气体常数[8.314 J/(mol·K)],T为绝对温度,K;Dc为降解速率常数;h为普朗克常数(6.626 2×10-34 J/s);ΚΒ为玻尔兹曼常数(1.380 6×10-23 J/K)。
1.3.3 光照对红色素稳定的影响
将不同pH红色素溶液分别进行室温避光、紫外和可见光(15 W,20 cm)处理,连续7 d,每隔1 d进行400~800 nm的光谱扫描,读取其最大吸收峰处OD值。按照1.3.2计算色素保留率和降解动力学参数。
1.3.4 抗氧化剂对红色素稳定的影响
配制终质量浓度Vc分别为0、0.01、0.045及0.09 g/L的红色素溶液,室温避光连续振荡处理 6 d, 并每隔2 d取出,进行光谱扫描和OD值读取。按照公式(1)计算色素保留率。
1.3.5 氧化剂对红色素稳定的影响
配制H2O2终体积分数为0、0.03%、0.3%和3%红色素溶液,室温避光连续振荡处理6 h,并每隔1.0 h取出,测定和色素保留率计算同1.3.2。
1.3.6 甜味剂对红色素稳定的影响
配制甜味剂终质量浓度分别为0、2.5、5.0 和10.0 g/L的红色素溶液,室温下避光振荡处理1.0 h后,测定和色素保留率计算同1.3.2。
1.3.7 防腐剂对红色素稳定的影响
配制苯甲酸钠和山梨酸钾终浓度分别为0.05、0.15及0.3 g/L和0.1、0.2及0.3 g/L的红色素溶液。室温下避光振荡处理6 h,每隔2.0 h取样测试。测定方法及计算色素保留率同1.3.2。
1.4 数据处理与分析
实验重复3次,利用Excel 2013数据包进行统计分析,采用Origin 8.0进行作图和曲线拟合。
2 结果与分析
2.1 pH对蓝状菌红色素热稳定性的影响
由图1可知,蓝状菌红色素保留率随时间延长和温度升高而降低,而随着pH升高而增加。在pH 4.0、40和80 ℃处理1.0 h后,二者色素保留率分别为96.02%和79.33%;处理6 h后,二者色素保留率分别为90.75%和41.34%。在pH 5.0、40和80 ℃处理1.0 h后,二者色素保留率分别97.06%和81.22%;处理6 h后,二者色素保留率分别91.88%和44.26%。在pH 6.0、40和80 ℃处理1.0 h后,二者色素保留率分别97.10%和82.42%;处理6.0 h后,二者色素保留率分别92.61%和51.35%。在pH 7.0、40和80 ℃ 处理1.0 h后,二者色素保留率分别为97.11%和82.22%;处理6 h后,二者色素保留率分别为93.01% 和51.79%。可见,在低温和/或较高pH条件下,蓝状菌红色素降解缓慢,较为稳定。
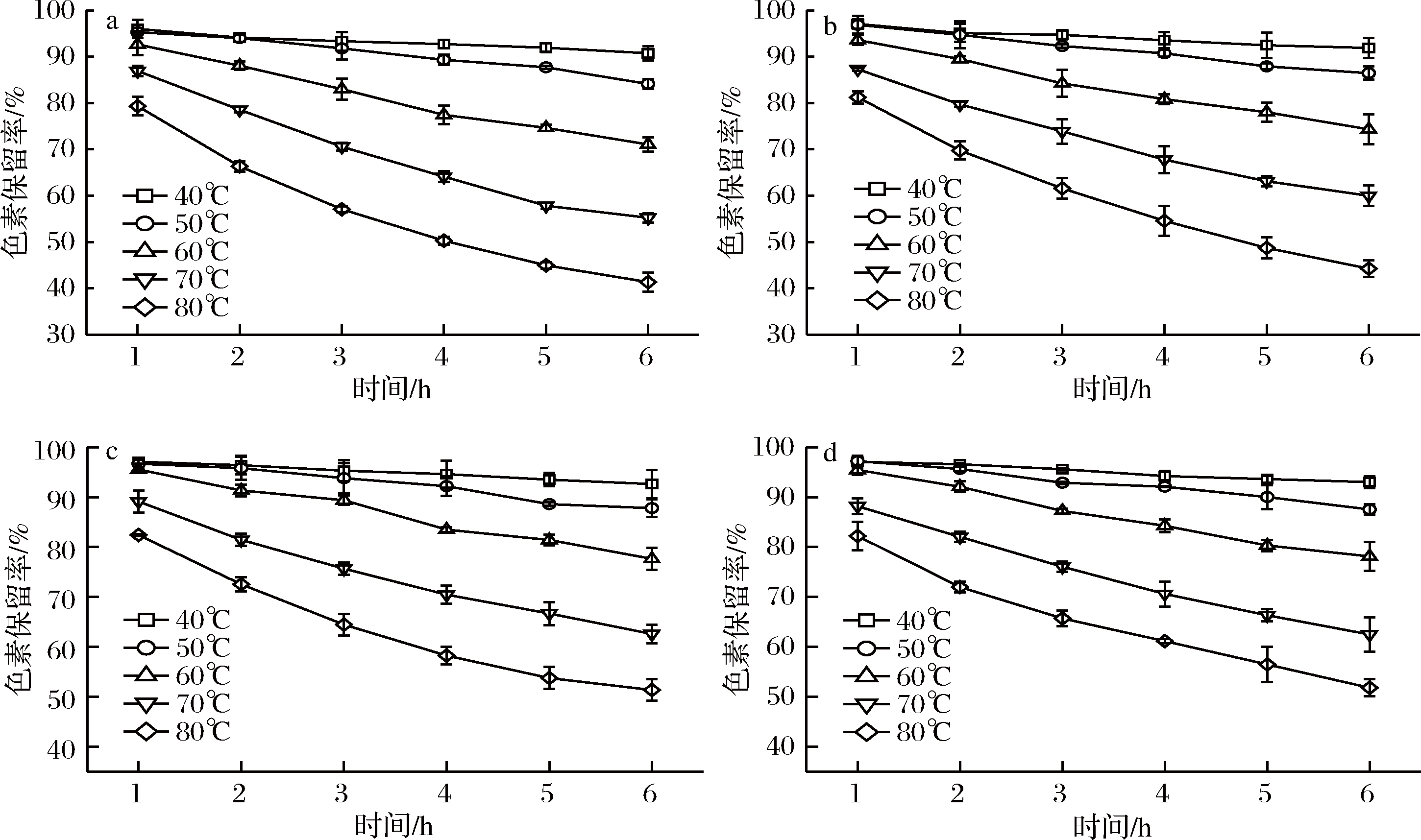
a-pH 4.0;b-pH 5.0;c-pH 6.0;d-pH 7.0
图1 不同pH和温度下的蓝状菌红色素降解情况
Fig.1 Degradation of red pigment from T. abobiverticillius at different pH and temperature
为了更好地理解pH对蓝状菌红色素热降解过程,利用第一动力学模型对热解时间和色素保留率进行了线性回归分析,确定了不同温度和pH下的Dc和决定系数R2,利用文献[16]及公式(2)计算出了不同温度和pH下的t1/2、Z值及D等动力学参数。不同pH下各温度线性拟合方程决定系数在0.957 29~0.997 31, 说明第一动力学模型能够很好地描述蓝状菌红色素热降解行为(图2)。由表1可知,在相同pH下,Dc随温度升高而增加,t1/2、D和Ζ随温度升高而降低,且它们各自都达到了显著水平(P<0.05); 在相同温度下,降解速率Dc随pH升高而降低,t1/2、D和Ζ随pH升高而增加。
表1 不同pH下蓝状菌红色素热降解动力学和热力学参数
Table 1 Kinetic and thermodynamic parameters of red pigment from T. abobiverticillius at different pH

pHT/KDc×103/ht1/2/hD/hΖ/℃Ea/(kJ·mol-1)ΔΗ#/(kJ·mol-1)ΔG#/(kJ·mol-1)ΔS#/(J·mol-1)4.031310.26±0.78e67.49±5.17a224.20±17.18a32324.54±0.64d28.25±0.74b93.83±2.45b33357.52±0.63c12.05±0.15c40.03±0.50c34393.82±1.30b7.39±0.10d24.54±0.34d353130.04±3.55a5.33±0.15e17.71±0.48e34.56±1.12c59.33±1.82a56.7288.70-102.1756.6389.28-101.0656.5589.77-99.7556.4791.15-101.1256.3992.94-103.545.031310.61±2.86e65.33±19.02a217.02±63.18a32323.19±2.36d29.89±3.10a99.29±10.30a33345.87±5.67c15.11±1.89a50.20±6.27a34376.03±5.01b9.12±0.62b30.29±2.05b353120.91±5.71a5.73±0.27c19.04±0.8c37.54±5.6bc55.80±7.67ab53.2088.61-113.1553.1189.43-112.4353.0390.39-112.2052.9591.75-113.1352.8793.15-114.126.03139.60±1.79e72.20±9.85a239.85±32.72a32320.98±1.02d33.04±1.61b109.75±5.33b33341.44±3.43c16.73±1.39c55.56±4.62c34369.70±2.62b9.94±0.37d33.04±1.24d35396.17±7.35a7.21±0.55e23.94±1.83e38.67±4.37ab53.62±5.08bc51.0288.87-120.9450.9389.70-120.0150.8590.67-119.5950.7792.00-120.2150.6993.82-122.20
续表1
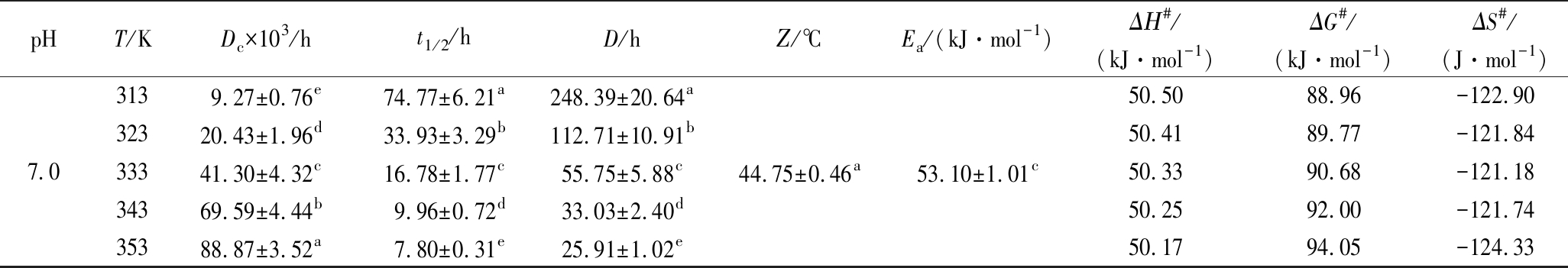
pHT/KDc×103/ht1/2/hD/hΖ/℃Ea/(kJ·mol-1)ΔΗ#/(kJ·mol-1)ΔG#/(kJ·mol-1)ΔS#/(J·mol-1)7.03139.27±0.76e74.77±6.21a248.39±20.64a32320.43±1.96d33.93±3.29b112.71±10.91b33341.30±4.32c16.78±1.77c55.75±5.88c34369.59±4.44b9.96±0.72d33.03±2.40d35388.87±3.52a7.80±0.31e25.91±1.02e44.75±0.46a53.10±1.01c50.5088.96-122.9050.4189.77-121.8450.3390.68-121.1850.2592.00-121.7450.1794.05-124.33
注:同列右上角不同小写字母表示有显著性差异(P<0.05)。
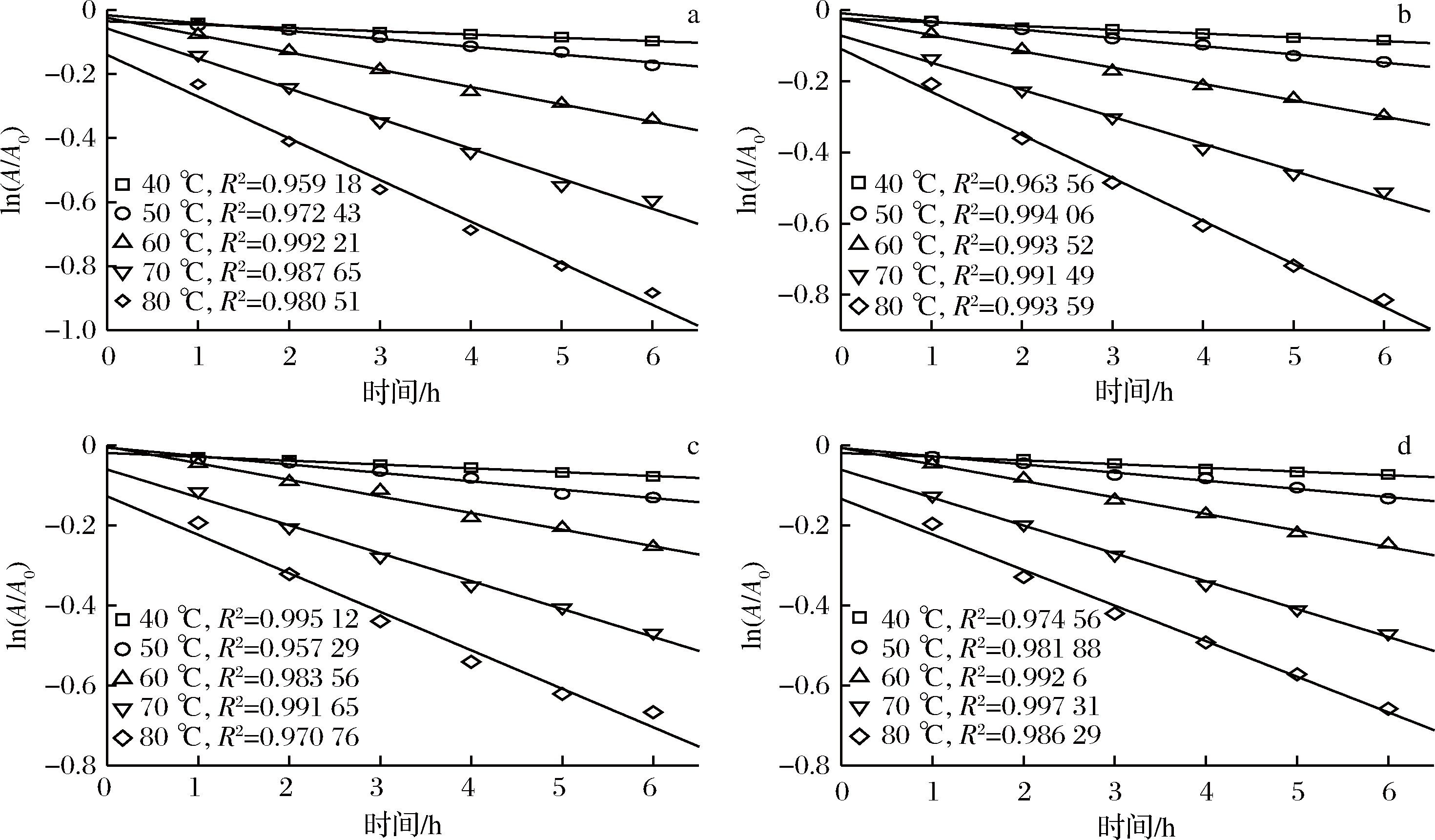
a-pH 4.0;b-pH 5.0;c-pH 6.0;d-pH 7.0
图2 不同pH和温度条件下白二轮蓝状菌DWL-C010红色素降解动力学曲线
Fig.2 Degradation kinetic curve of red pigment from T. abobiverticillius DWL-C010
在pH 4.0时,5个温度下的Dc依次为0.010 26、0.024 50、0.057 52、0.093 82和0.130 04/h,t1/2为67.49、 28.25、12.05、7.39和5.33 h,D为224.20、93.83、 40.03、24.54和17.71 h;在pH 7.0时,5个温度下的Dc依次为9.27、20.43、41.30、69.59、88.87/h,t1/2为74.77、33.39、16.78、9.96和7.80 h,D为248.39、112.71、55.75、33.03和25.91 h。Z在pH 7.0的值为44.75 ℃,与pH 6.0的38.67 ℃没有显著差异(P>0.05),但与pH 5.0的37.54 ℃和pH 4.0的34.56 ℃ 均达到了显著差异水平(P<0.05)。VENDRUSCOLO等[1]利用响应面模型描述了M. ruber CCT3802红色素降解行为,发现温度和pH对M. ruber红色素降解速率在线性水平都有极显著影响,而pH在二次方水平上也有极显著的影响,并且pH和温度交互作用也极显著;M. ruber Tieghem IOC 2225利用蔗渣水解液能够生产热稳定性较好的红色素,其热解动力学参数随温度和pH变化的趋势与本实验一致[17];M. purpureus以蔗渣为碳源进行液体发酵产红色素,其热降解也符合第一动力学模型,且在30~50 ℃、近中性pH 6.0~8.0时稳定性较好[6]。可见,聚酮类红色素具有相似的热降解行为。
活化能Ea是判断物质稳定性的重要指标,可以由lnDc对1/T线性拟合的斜率求得。由图3可知,蓝状菌红色素热降解的Arrhenius拟合曲线决定系数在0.966 92~0.991 69,说明可信度较高。由表1可知,红色素pH 7.0的Ea为53.10 kJ/mol,与其pH 6.0的Ea(53.62 kJ/mol)没有显著差异(P>0.05),但与其pH 4.0和pH 5.0的Ea有显著差异(P<0.05),表明蓝状菌DWL-C010红色素在近中性条件下其热敏性变弱,稳定性增加,这可能与酸性环境中红曲红胺和红斑胺素中酯键断裂有关[18]。植物中,胭脂萝卜红色素在pH 3.0柠檬酸缓冲液中的Ea为108.52 kJ/mol;蓝莓花色苷在pH 1.0~7.0时的Ea分别为46.38~ 83.73 kJ/mol,甜菜红色素在高压与CO2热联合处理的Ea为94.01 kJ/mol[8,19-20];丝状真菌中,产紫青霉红色素在柠檬酸-磷酸盐缓冲液(pH 6.0)中的Ea为61.878 kJ/mol[2],紫红曲霉红色素柠檬酸-磷酸盐缓冲液(pH 6.0)中Ea为40.18 kJ/mol[6],红曲霉菌在pH 4.5、5.5及6.5的Ea分别为12.66、12.04和10.53 kcal/mol[17]。可见,蓝状菌红色素不是最稳定,但今后可以通过改变发酵培养基组分来进一步提高其稳定性[21]。
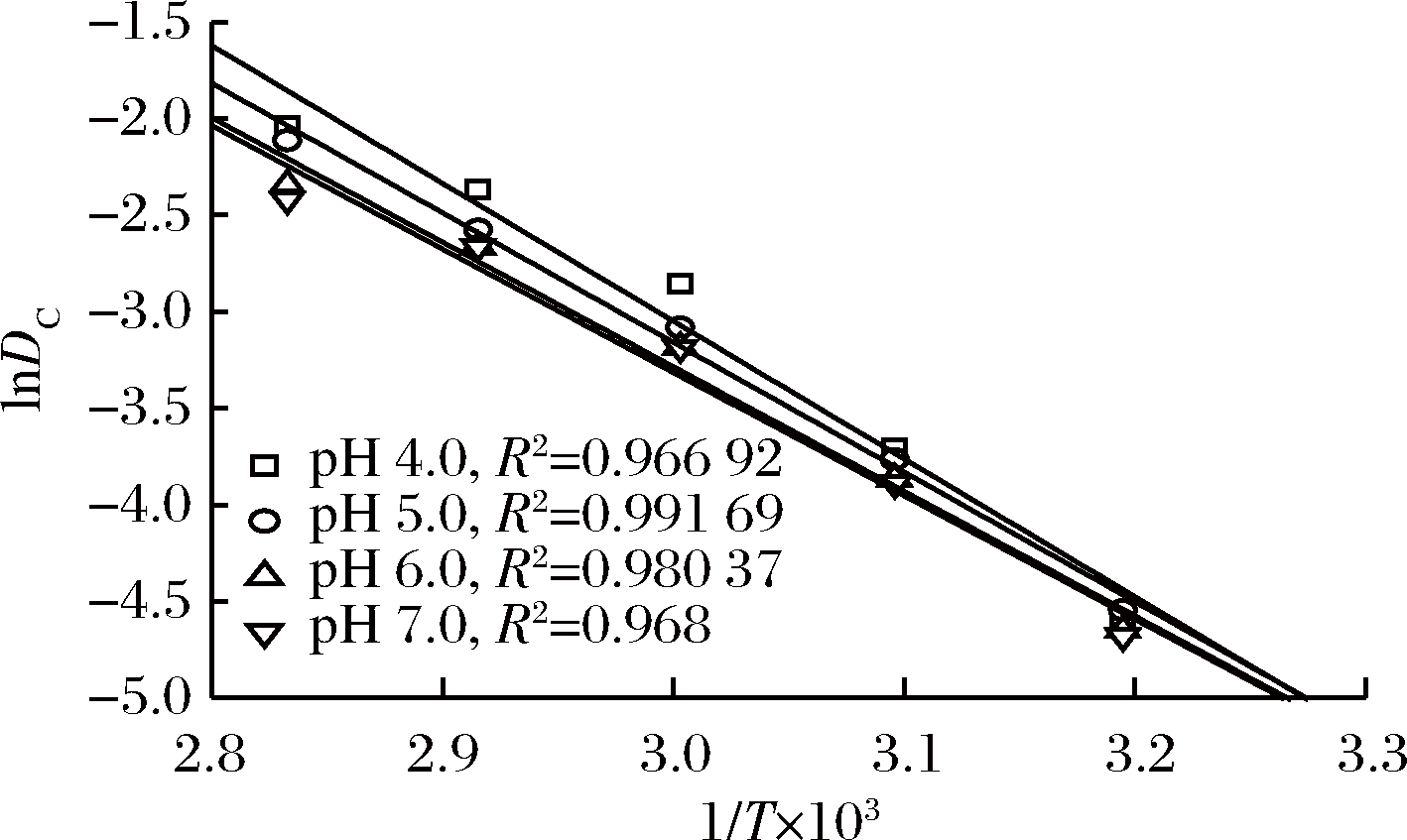
图3 蓝状菌红色素热降解的阿伦尼乌斯图
Fig.3 Thermo-degradation Arrhenius curves of red pigment from T. abobiverticillius
2.2 pH对蓝状菌红色素光稳定性的影响
由表2可知,蓝状菌红色素光解过程中,其保留率均随时间延长而降低,随pH的升高而增加。pH和处理时间相同条件下,避光、紫外光和可见光3种光处理条件下的色素保留率依次降低,表明其对可见光敏感,紫外光次之。在pH 7.0,避光、紫外光和可见光3种光处理第7天时,其色素保留率依次为79.81%、 69.40%和63.99%,显著高于相应其他pH的色素保留率(P<0.05)。通过对时间与ln(An/A0)进行拟合分析,发现蓝状菌红色素光降解符合第一动力学模型,且决定系数在0.991 8~0.998 01(图4)。由表3可知,避光、紫外光和可见光处理下,红色素各自Dc随pH升高而降低,t1/2和D随pH升高而增加;pH 7.0时,在3种光处理下的红色素Dc依次增加,分别为0.031 05、0.051 47、0.063 21/d,而t1/2和D依次减小,分别为22.32、13.47、10.97 d和74.16、44.74、 36.43 d。显著性分析显示,3种光处理各自pH为7.0时的Dc、t1/2及D均与各自pH 6.0的差异不显著,但与各自pH 5.0和pH 4.0的有显著性差异(P<0.05)。 可见,蓝状菌红色素在避光和近中性条件下的稳定性较好。ASKAR等[22]发现玫瑰花青素光降解符合第一动力学模型,且太阳光处理的降解速率较高;但与本实验不同的是,其高pH的花色苷降解速率较高,这可能和色素的化学结构有关。由青霉和红曲霉菌产的聚酮类色素光降解也符合第一动力学模型,并且也在近中性pH时的降解速率较低[4,23-24]。ZHANG等[24]通过改变培养基氮源,有效提高了红曲色素的光稳定性;而JUNG等[23]通过在培养基中添加不同氨基酸也提高了红曲色素光稳定性[23-24]。LIU等[25]认为聚酮类红色素和橙色素的褪色是由发色官能团上的共价大π键断裂诱导的,但JUNG等[23]发现聚酮类红色素降解成其他物质,溶液呈棕色,而其Phe衍生物降解后没有新的发色官能团产生,仍然呈弱红色,表明二者降解机理可能不同。另外,MAPARI等[4]发现棘孢青霉橙红色素降解成了聚酮类色素的同系物。可见,不同聚酮类色素光催化降解可能存在多种路径。
表2 不同pH和光处理下的蓝状菌红色素保留率
Table 2 Color retention of red pigment from T. abobiverticillius under different pH and light condition
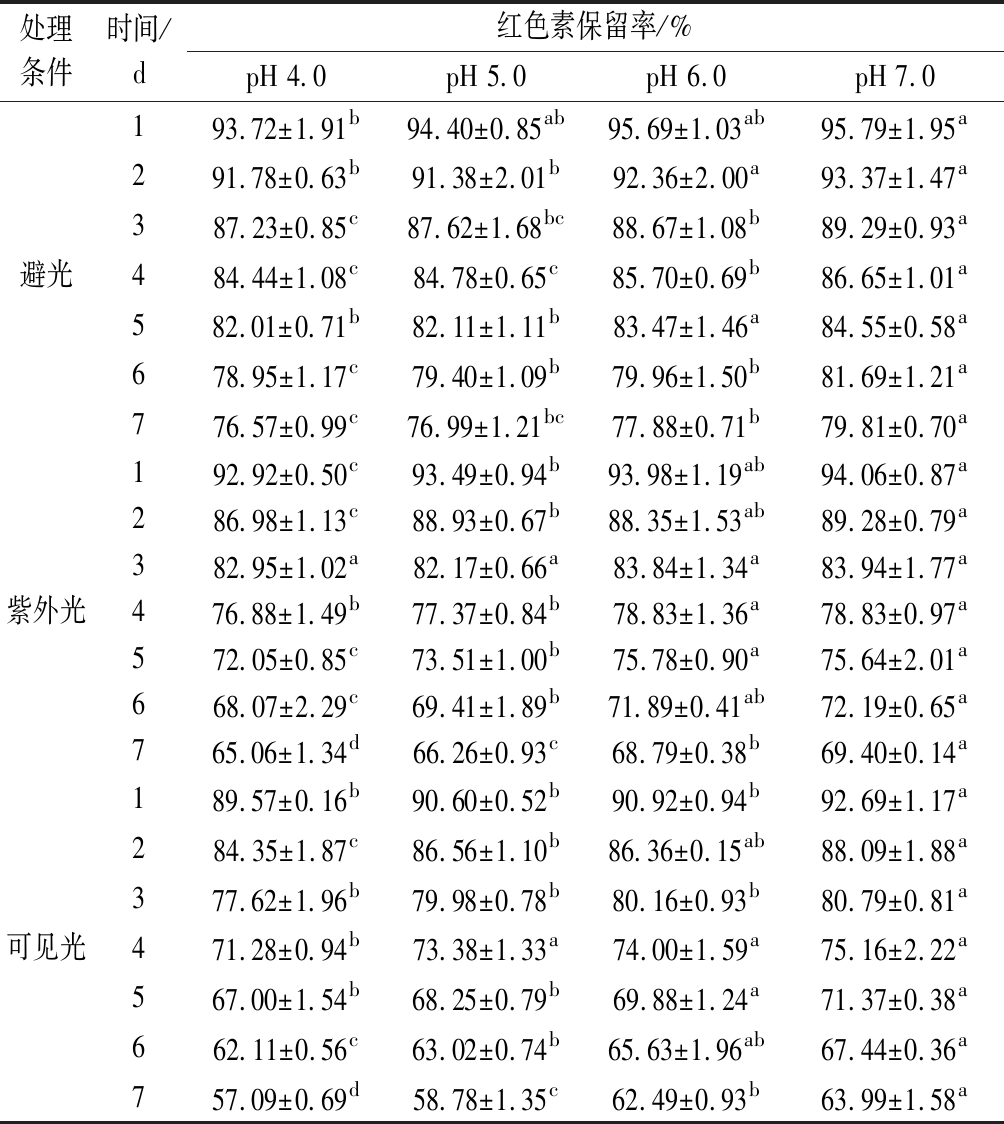
处理条件时间/d红色素保留率/%pH 4.0pH 5.0pH 6.0pH 7.0避光193.72±1.91b94.40±0.85ab95.69±1.03ab95.79±1.95a291.78±0.63b91.38±2.01b92.36±2.00a93.37±1.47a387.23±0.85c87.62±1.68bc88.67±1.08b89.29±0.93a484.44±1.08c84.78±0.65c85.70±0.69b86.65±1.01a582.01±0.71b82.11±1.11b83.47±1.46a84.55±0.58a678.95±1.17c79.40±1.09b79.96±1.50b81.69±1.21a776.57±0.99c76.99±1.21bc77.88±0.71b79.81±0.70a紫外光192.92±0.50c93.49±0.94b93.98±1.19ab94.06±0.87a286.98±1.13c88.93±0.67b88.35±1.53ab89.28±0.79a382.95±1.02a82.17±0.66a83.84±1.34a83.94±1.77a476.88±1.49b77.37±0.84b78.83±1.36a78.83±0.97a572.05±0.85c73.51±1.00b75.78±0.90a75.64±2.01a668.07±2.29c69.41±1.89b71.89±0.41ab72.19±0.65a765.06±1.34d66.26±0.93c68.79±0.38b69.40±0.14a可见光189.57±0.16b90.60±0.52b90.92±0.94b92.69±1.17a284.35±1.87c86.56±1.10b86.36±0.15ab88.09±1.88a377.62±1.96b79.98±0.78b80.16±0.93b80.79±0.81a471.28±0.94b73.38±1.33a74.00±1.59a75.16±2.22a567.00±1.54b68.25±0.79b69.88±1.24a71.37±0.38a662.11±0.56c63.02±0.74b65.63±1.96ab67.44±0.36a757.09±0.69d58.78±1.35c62.49±0.93b63.99±1.58a
注:同行右上角不同小写字母表示有显著性差异(P<0.05)。
2.3 抗氧化剂Vc对蓝状菌红色素稳定性的影响
Vc作为一种抗氧化剂,对蓝状菌DWL-C010红色素的影响如图5所示。
由图5可知,添加不同量Vc的红色素溶液在第0天时,其色素保留率均高于对照ddH2O,且在Vc质量浓度0.015和0.09 g/L时达到了显著水平(P<0.05),说明Vc具有增色效应。第2天的3个质量浓度Vc处理的红色素保留率依次为93.68%、94.94%和95.92%,高于对照的92.46%;第4天的不同质量浓度Vc处理的红色素保留率分别为89.79%、89.97%和92.50%;均显著高于对照的86.32%(P<0.05);第6天Vc处理的红色素保留分别为84.31%、84.81%和87.43%,也均高于对照的81.39%。可见,Vc对蓝状菌红色素具有一定的护色作用。

a-避光;b-紫外光;c-可见光
图4 不同光处理和pH条件下白二轮蓝状菌DW-C010红色素降解动力学曲线
Fig.4 Degradation kinetic curve of red pigment from T. abobiverticillius DWL-C010 under different light treatment and pH
表3 不同pH下的蓝状菌红色素光解动力学参数
Table 3 Photo-degradation kinetic parameters of red pigment fromT. abobiverticillius under different pH
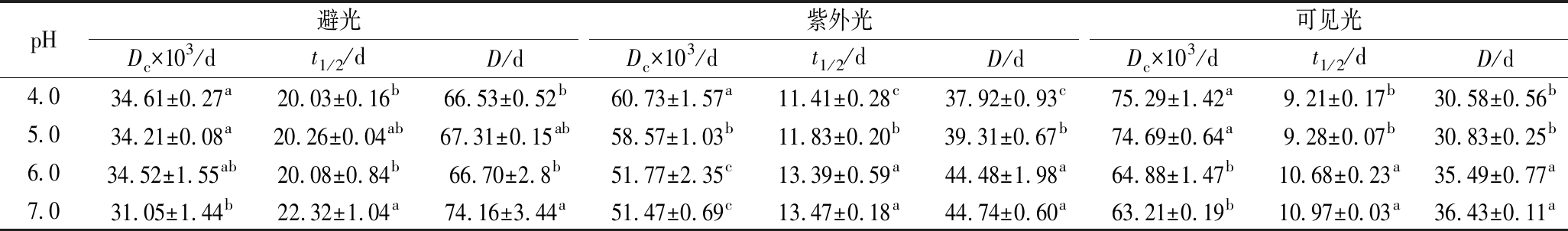
pH避光紫外光可见光Dc×103/dt1/2/dD/dDc×103/dt1/2/dD/dDc×103/dt1/2/dD/d4.034.61±0.27a20.03±0.16b66.53±0.52b60.73±1.57a11.41±0.28c37.92±0.93c75.29±1.42a9.21±0.17b30.58±0.56b5.034.21±0.08a20.26±0.04ab67.31±0.15ab58.57±1.03b11.83±0.20b39.31±0.67b74.69±0.64a9.28±0.07b30.83±0.25b6.034.52±1.55ab20.08±0.84b66.70±2.8b51.77±2.35c13.39±0.59a44.48±1.98a64.88±1.47b10.68±0.23a35.49±0.77a7.031.05±1.44b22.32±1.04a74.16±3.44a51.47±0.69c13.47±0.18a44.74±0.60a63.21±0.19b10.97±0.03a36.43±0.11a
注:同列右上角不同小写字母表示有显著性差异(P<0.05)。
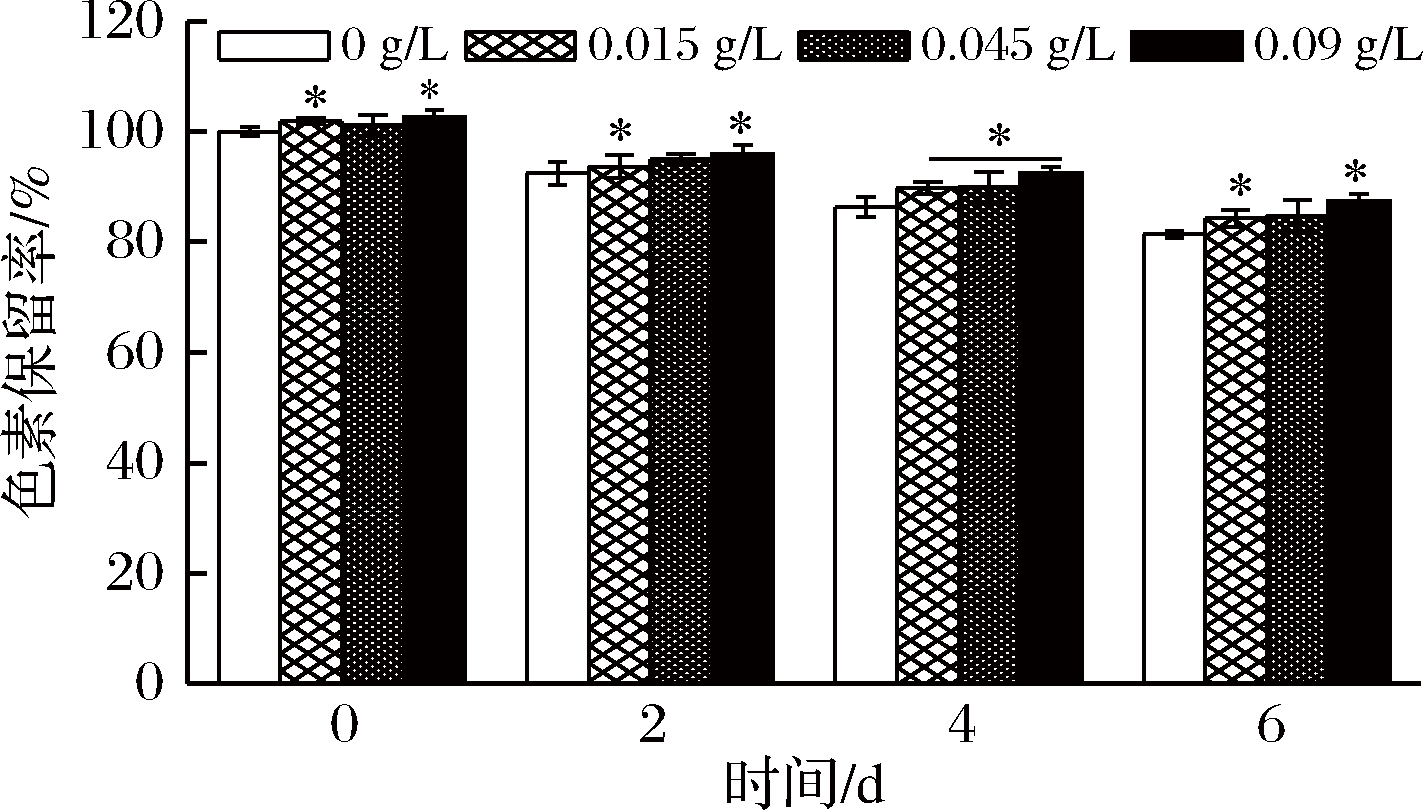
图5 Vc对蓝状菌红色素稳定性的影响
Fig.5 Effect of Vc on the stability of red pigment from from T. abobiverticillius
注:*表示在P<0.05差异显著。
2.4 氧化剂H2O2对蓝状菌红色素稳定性的影响
氧化反应是食品加工和贮藏过程伴随的副反应之一。实验以H2O2为例,考察了氧化剂对蓝状菌红色素的影响。由图6-a可知,随着氧化剂H2O2浓度的增加和处理时间的延长,其消色作用逐渐增强。0.03%、0.3% 和3.0%(体积分数)的H2O2处理1 h时,红色素的保留率分别为97.89%、85.70%和69.39%; 处理6 h时,其红色素保留率分别为90.18%,71.85%和39.93%; 而对照ddH2O处理1 h和6 h时,其红色素保留率分别为99.77%和99.30%,均显著高于不同体积分数H2O2的处理组(P<0.05)。可见,H2O2对蓝状菌红色素具有消色作用。此外,由图6-b可知,不同体积分数H2O2处理红色素1 h后,其色谱特征峰发生了蓝移,表明H2O2分解过程中产生的羟自由基破坏红色素的发色官能团,进而导致了色素保留率降低。
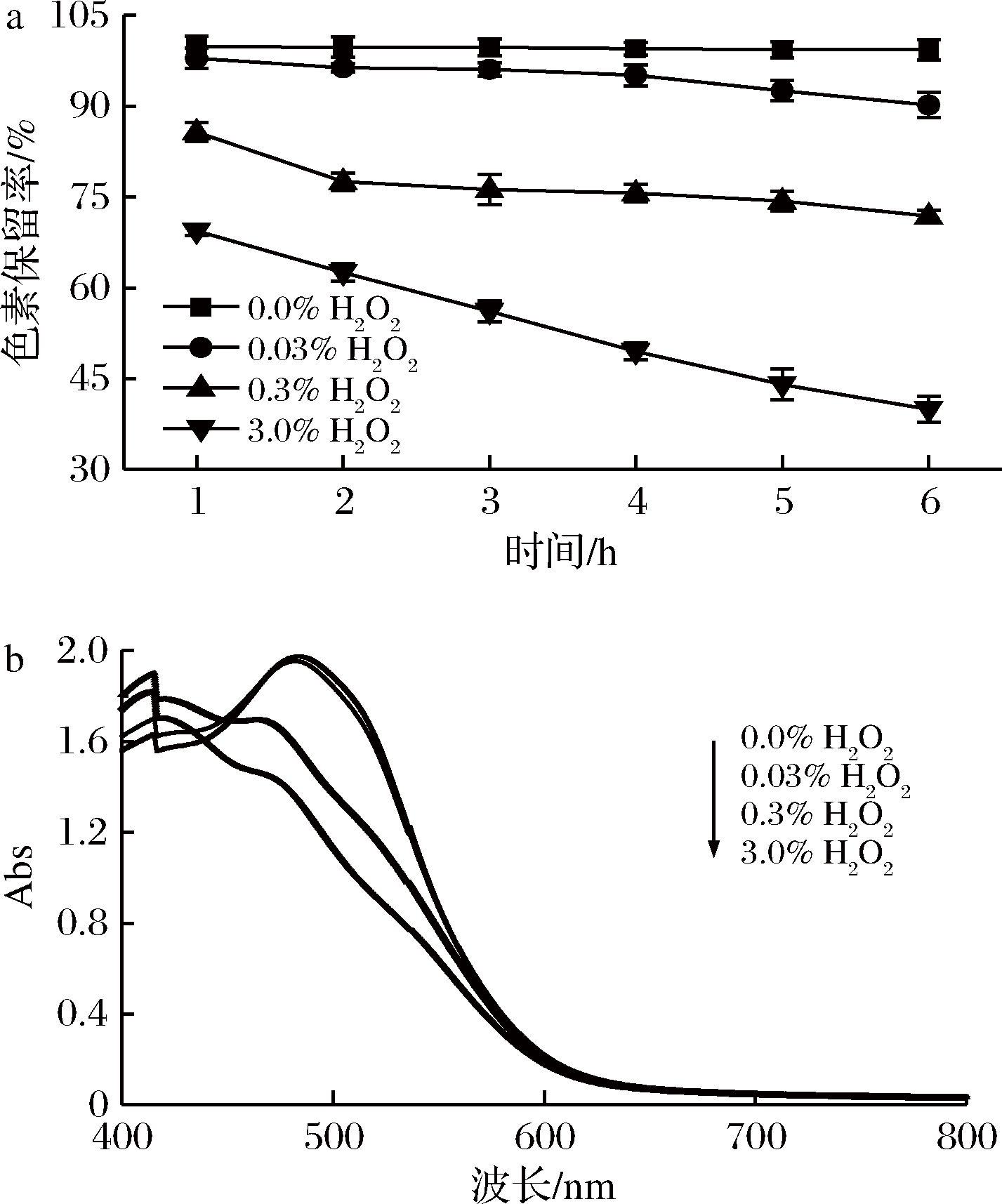
a-色素保留率; b-为不同体积分数H2O2处理1h的色素光谱图
图6 H2O2对蓝状菌红色素稳定性的影响
Fig.6 Effect of H2O2 on the stability of red pigment from from T. abobiverticillius
2.5 还原剂Na2SO3对蓝状菌红色素稳定性的影响
亚硫酸盐是食品工业广泛使用的食品添加剂,具有漂白、防腐和抗氧化等功能。由图7可知,不同质量浓度Na2SO3处理蓝状菌DWL-C010红色素具有显著影响(P<0.05)。在第0 h,不同质量浓度Na2SO3处理的色素保留率分别为97.44%、91.91%和71.43%,均显著低于对照(0 g/L)的99.85%(P<0.05),说明Na2SO3具有消色作用。随着处理时间的延长,0.09和0.15 g/L的Na2SO3处理的色素保留率逐渐降低。前者在第2、 4和6 h的色素保留率依次为96.23%、95.77%和94.55%,后者依次为88.34%、88.07%和87.04%。然而,Na2SO3质量浓度为0.45 g/L时,处理2 h时的色素保留率为73.82%,却略高于处理0 h时的色素保留率;但在第4和第6 h又逐渐下降,分别为73.40%和72.94%。这可能是由于Na2SO3与红色素形成的化合物不稳定,亚硫酸根的氧化分解使其失去作用,进而色素保留率略有回升。
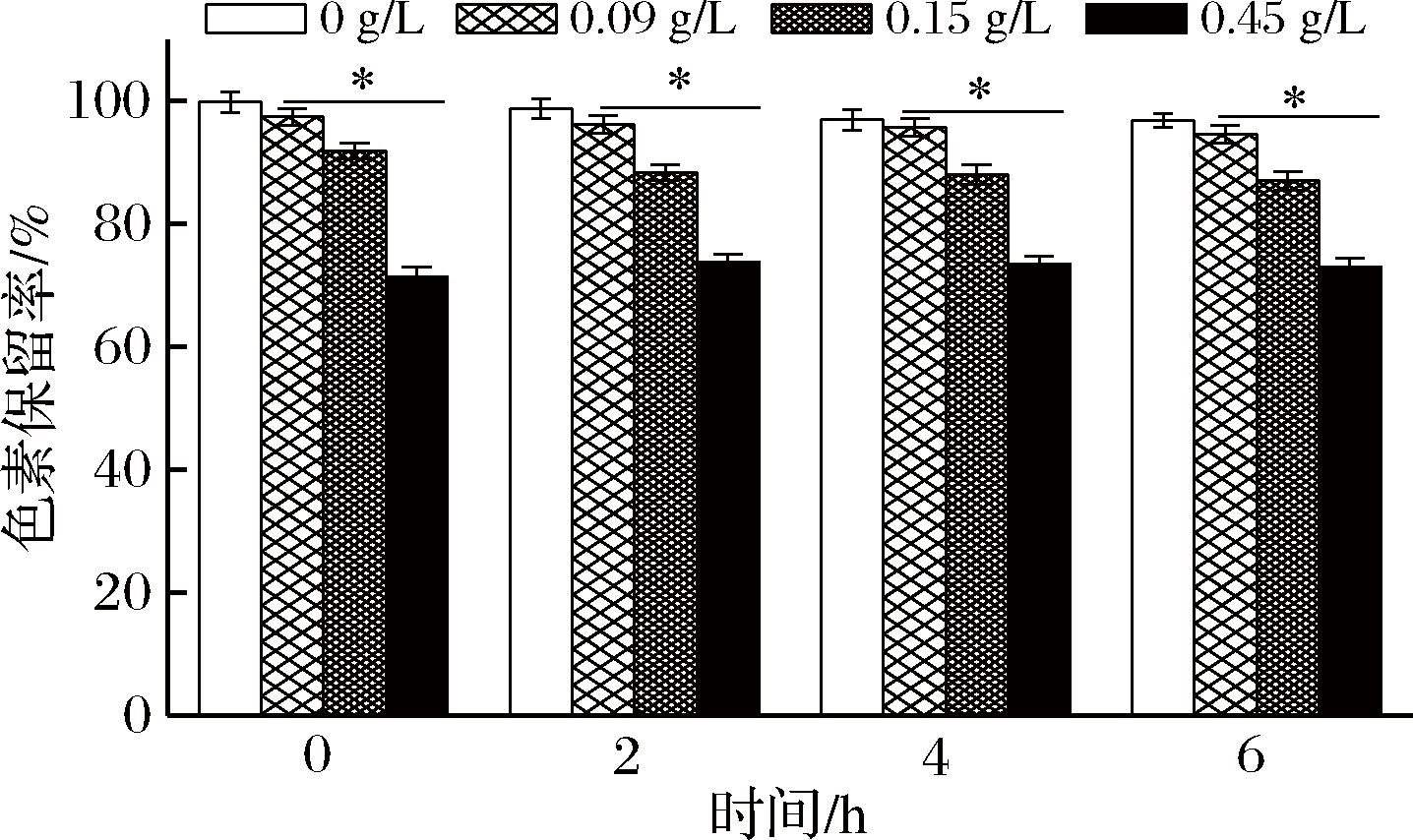
图7 Na2SO3对蓝状菌DWL-C010红色素红色素稳定性的影响
Fig.7 Effect of Na2SO3 on the stability of red pigment from from T. abobiverticillius
2.6 甜味剂对蓝状菌红色素稳定性的影响
以葡萄糖、麦芽糖和蔗糖3种糖为代表,考察了甜味剂对蓝状菌DWL-C010红色素的影响。由图8可知,低质量浓度葡萄糖(2.5和5.0 g/L)处理的红色素保留率略高于对照(0 g/L),而高质量浓度葡萄糖(10 g/L) 处理的色素保留率却略有下降,为98.36%。蔗糖和麦芽糖3个浓度下的红色素保留率均低于对照。然而,高质量浓度蔗糖(10 g/L)处理时色素保留率虽高达98.17%,但较对照有显著差异(P<0.05),而3个浓度麦芽糖处理的色素保留率较对照均有显著差异(P<0.05),可见,甜味剂葡萄糖和蔗糖对蓝状菌红色素保留率影响较小,而麦芽糖有一定的影响。

图8 甜味剂对蓝状菌红色素稳定性的影响
Fig.8 Effect of sweeteners on the stability of red pigment from T. abobiverticillius
2.7 防腐剂对蓝状菌红色素稳定的影响
防腐剂能够抑制食品霉变,延长食品货架期。当前,食品加工中主要使用的防腐剂是苯甲酸和山梨酸及其盐,故本实验选取苯甲酸钠和山梨酸钾作为研究对象,考察二者对蓝状菌红色素的影响。由图7可知,红色素保留率随防腐剂处理时间延长而降低。其中,0.3 g/L苯甲酸钠(图9-a)处理第4和第6 h的色素保留率显著低于对照组(P<0.05),但都在96%以上;而不同质量浓度山梨酸钾处理不同时间的色素保留率均与对照没有显著差异(图9-b)。可见,防腐剂苯甲酸钠和山梨酸钾对蓝状菌红色素的色素保留率影响不明显。
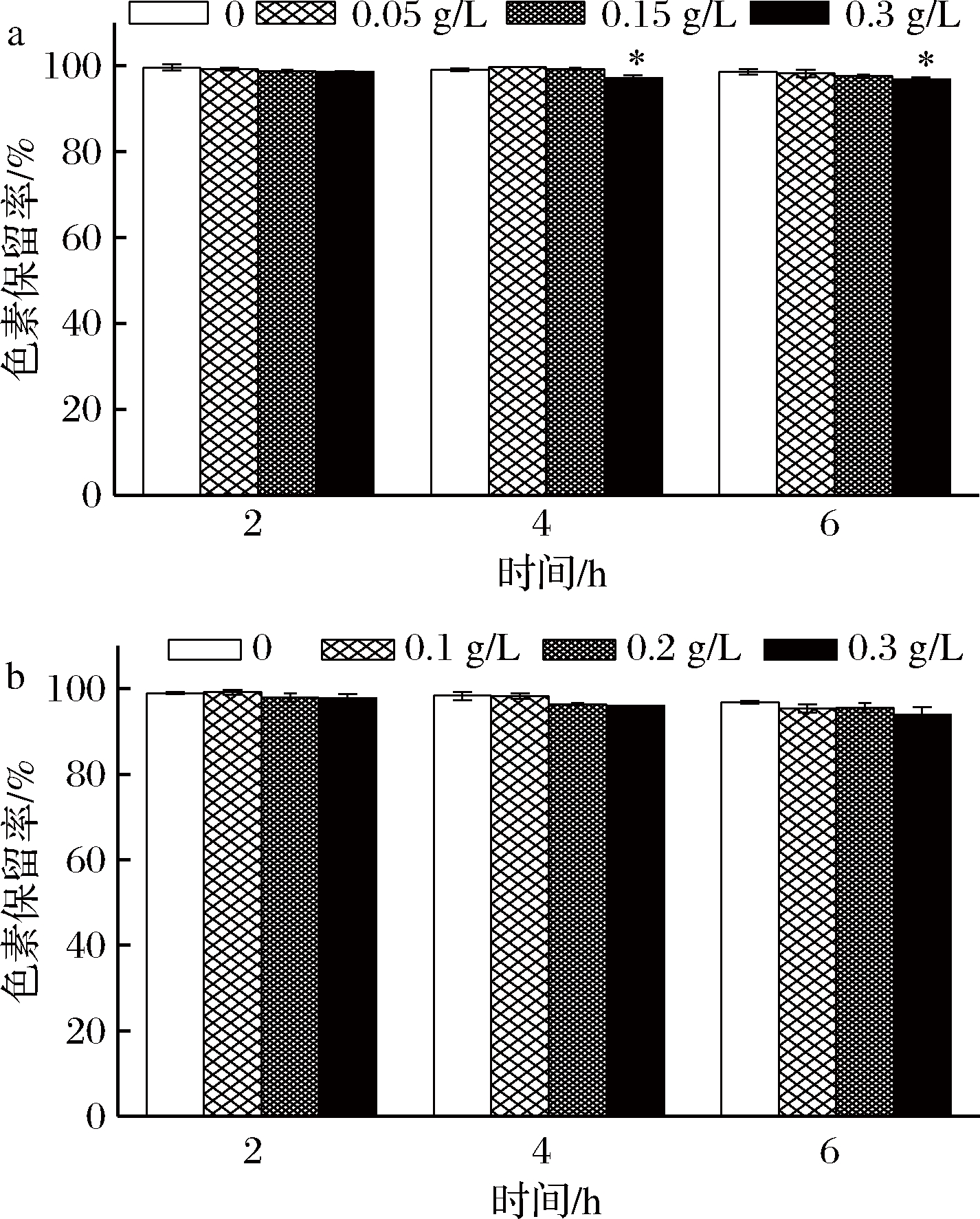
a-苯甲酸钠;b-山梨酸钾
图9 防腐剂对蓝状菌红色素稳定性的影响
Fig.9 Effect of preservatives on the stability of red pigment from T. abobiverticillius
3 结论
本实验考查了不同pH、光照和食品添加剂对白二轮蓝状菌DWL-C010红色素的影响,建立了不同pH下光、热降解动力学模型,并分析了其降解规律,为其今后在食品加工中的应用提供了理论依据。其结论有:
白二轮蓝状菌DWL-C010红色素在近中性(pH 7.0)和低温(40 ℃)条件下较为稳定,其热降解过程符合第一动力学模型。相同温度下,Dc随pH升高而降低,t1/2、D和Ζ随pH升高而增大;Ea也随pH升高而降低,pH 7.0的Ea为53.10 kJ/mol,与pH 6.0的(53.62 kJ/mol)没有显著差异,但较pH 4.0和pH 5.0的活化能差异显著(P<0.05)。
白二轮蓝状菌DWL-C010红色素对紫外光和可见光敏感,但在近中性条件下也较为稳定。在pH 7.0,避光、紫外光和可见光3种光处理第7天时,其色素保留率依次为79.81%、69.40%和63.99%,显著高于相应其他pH的色素保留率(P<0.05)。红色素保留率与处理时间线性关系良好,决定系数R2>0.99,表明其光降解也符合第一动力学模型。相同pH下,避光、紫外光和可见光的Dc依次升高,t1/2和D依次减小;相同光处理条件下,Dc也随pH升高而降低,t1/2和D随pH升高而增大。在pH 7.0时,避光、紫外光和可见光的Dc、t1/2和D较pH 4.0和pH 5.0的差异显著(P<0.05)。
不同食品添加剂对白二轮蓝状菌DWL-C010红色素的影响不同。抗氧化剂Vc具有一定的增色和护色效应,不同浓度Vc处理时,其色素保留率均高于对照;氧化剂H2O2和还原剂Na2SO3具有消色作用,二者不同终质量浓度处理的色素保留率均低于对照,且达到了差异显著水平(P<0.05);甜味剂葡萄糖和蔗糖对红色素的影响较小,而添加不同量麦芽糖对色素均有显著影响。另外,防腐剂山梨酸钾和苯甲酸钠对白二轮蓝状菌DWL-C010红色素的影响不明显。
今后有必要进一步分析白二轮蓝状菌DWL-C010红色素在食品体系中的稳定性,并通过优化其发酵培养基和发酵条件,改进其色素的稳定性,提高其色素产量,降低其色素生产成本,提高市场竞争力。
[1] VENDRUSCOLO F, MÜLLER B L, MORITZ D E, et al. Thermal stability of natural pigments produced by Monascus ruber in submerged fermentation[J]. Biocatalysis and Agricultural Biotechnology, 2013, 2(3): 278-284.
[2] AGUILAR-MACHADO D, MORALES-OYERVIDES L, CONTRERAS-ESQUIVEL J C, et al. Effect of ohmic heating processing conditions on color stability of fungal pigments[J]. Food Science and Technology International, 2017, 23(4): 338-348.
[3] ARULDASS C A, DUFOSSÉ L, AHMAD W A. Current perspective of yellowish-orange pigments from microorganisms- a review [J]. Journal of Cleaner Production, 2018, 180: 168-182.
[4] MAPARI S A S, MEYER A S, THRANE U. Photostability of natural orange-red and yellow fungal pigments in liquid food model systems[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6 253-6 261.
[5] MORALES-OYERVIDES L, OLIVEIRA J C, SOUSA-GALLAGHER M J, et al. Effect of heat exposure on the colour intensity of red pigments produced by Penicillium purpurogenum GH2[J]. Journal of Food Engineering, 2015, 164: 21-29.
[6] SILVEIRA S T, DAROIT D J, SANT’ANNA V, et al. Stability modeling of red pigments produced by Monascus purpureus in submerged cultivations with sugarcane bagasse[J]. Food and Bioprocess Technology, 2013, 6(4): 1 007-1 014.
[7] FERN NDEZ-L
NDEZ-L PEZ J A, ANGOSTO J M, GIMÉNEZ P J, et al. Thermal stability of selected natural red extracts used as food colorants[J]. Plant Foods for Human Nutrition, 2013, 68(1): 11-17.
PEZ J A, ANGOSTO J M, GIMÉNEZ P J, et al. Thermal stability of selected natural red extracts used as food colorants[J]. Plant Foods for Human Nutrition, 2013, 68(1): 11-17.
[8] 李恩惠, 矫馨瑶,王晨歌,等. 蓝莓花色苷降解动力学及稳定性[J]. 食品科学, 2018, 39(5): 1-7.
[9] MERCALI G D, JAESCHKE D P, TESSARO I C, et al. Degradation kinetics of anthocyanins in acerola pulp: Comparison between ohmic and conventional heat treatment[J]. Food Chemistry, 2013, 136(2): 853-857.
[10] YILMAZ N, VISAGIE C M, HOUBRAKEN J, et al. Polyphasic taxonomy of the genus Talaromyces[J]. Studies in Mycology, 2014, 78: 175-341.
[11] FRISVAD J C, YILMAZ N, THRANE U, et al. Talaromyces atroroseus, a new species efficiently producing industrially relevant red pigments[J]. Plos One, 2013, 8(12): e84102.
[12] DUFOSSÉ L. Red colourants from filamentous fungi: Are they ready for the food industry?[J]. Journal of Food Composition and Analysis, 2018, 69: 156-161.
[13] VENKATACHALAM M, MAGALON H, DUFOSSÉ L, et al. Production of pigments from the tropical marine-derived fungi Talaromyces albobiverticillius: New resources for natural red-colored metabolites[J]. Journal of Food Composition and Analysis, 2018, 70: 35-48.
[14] VENKATACHALAM M, ZELENA M, CACCIOLA F, et al. Partial characterization of the pigments produced by the marine-derived fungus Talaromyces albobiverticillius 30548. Towards a new fungal red colorant for the food industry[J]. Journal of Food Composition and Analysis, 2018, 67: 38-47.
[15] AGUILAR D, MORALES-OYERVIDES L, CONTRERAS-ESQUIVEL J C, et al. Effect of ozone processing conditions on stability of fungal pigments[J]. Innovative Food Science & Emerging Technologies, 2018, 45: 255-263.
[16] 马博, 张婷婷,吴宝祥. 真菌DWL-C010的鉴定及其可溶性红色素热稳定性分析[J]. 生物技术通报, 2018, 34(4): 186-193.
[17] HILARES R T, DE SOUZA R A, MARCELINO P F, et al. Sugarcane bagasse hydrolysate as a potential feedstock for red pigment production by Monascus ruber[J]. Food Chemistry, 2018, 245: 786-791.
[18] CARVALHO J C D, OISHI B O, PANDEY A, et al. Biopigments from Monascus: Strains selection, citrinin production and color stability[J]. Brazilian Archives of Biology and Technology, 2005, 48(6): 885-894.
[19] 董楠,王强,雷丹丹,等. 胭脂萝卜红色素热处理及贮藏过程中降解动力学[J]. 食品科学, 2013, 34(5): 67-71.
[20] LIU X, GAO Y, XU H, et al. Impact of high-pressure carbon dioxide combined with thermal treatment on degradation of red beet (Beta vulgaris L.) pigments[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6 480-6 487.
[21] JUNG H, CHOE D, NAM K Y, et al. Degradation patterns and stability predictions of the original reds and amino acid derivatives of monascus pigments[J]. European Food Research and Technology, 2011, 232(4): 621-629.
[22] ASKAR K A, ALSAWAD Z H, KHALAF M N. Evaluation of the pH and thermal stabilities of rosella anthocyanin extracts under solar light[J]. Beni-Suef University Journal of Basic and Applied Sciences, 2015, 4(3): 262-268.
[23] JUNG H, KIM C, SHIN C S. Enhanced photostability of monascus pigments derived with various amino acids via fermentation[J]. Journal of Agricultural and Food Chemistry, 2005, 53(18): 7 108-7 114.
[24] ZHANG X W, WANG J H, CHEN M H, et al. Effect of nitrogen sources on production and photostability of monascus pigments in liquid fermentation[J]. IERI Procedia, 2013, 5: 344-350.
[25] LIU Y, WU L, LYU Q. DFT/TDDFT study on the photodissociation mechanism of the original monascus red and orange pigments[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 145: 181-187.