玉米黄粉(corn gluten meal,CGM)是玉米湿法生产淀粉的主要副产物[1],其蛋白含量高达60%,是一种具有极大开发价值的蛋白资源[2-5]。但由于玉米蛋白不溶于水且氨基酸组成不均衡,目前玉米黄粉在我国主要用于低值粗饲料生产或自然排放,造成蛋白质资源的极大浪费和环境污染[6-8]。若将玉米黄粉开发成玉米肽等高附加值产品,将能大幅度提升玉米深加工企业的经济效益[9]。玉米肽是玉米蛋白经过水解得到的分子质量小且可溶于水的肽混合物,其组成包含分子质量大小不一的玉米多肽、低聚肽以及少量氨基酸。现代营养学研究表明与蛋白质和氨基酸相比,肽类物质特别是低聚肽(分子质量≤1 000 Da)更容易被机体吸收利用[10-11]。
目前制备玉米肽的方法主要有酶解法和微生物发酵法,其中酶解法是制备玉米肽最常用的方法。陈芳[12]利用碱性蛋白酶和木瓜蛋白酶双酶水解底物质量浓度为50 g/L的玉米黄粉,得到可溶性肽含量为21 g/L,其中低聚肽含量占比67.1%;杨弈[13]利用微波协同碱性蛋白酶酶解底物质量浓度为90 g/L的玉米蛋白,得到可溶性肽含量为1.71 g/L;张学忠[14]利用碱性蛋白酶酶解底物质量浓度为100 g/L的玉米蛋白,得到可溶性肽含量为26.19 g/L,低聚肽含量占比高达75%。虽然酶解法已经得到广泛的应用,但酶解法制备玉米肽对原料要求较高,酶制剂价格高昂,且酶解结束后玉米肽常出现严重苦味,而去除玉米肽苦味的程序繁琐且成本较高,这些都限制了酶解法制备玉米肽在发展中国家的工业化扩大生产。
与酶解法相比,微生物发酵法是通过微生物发酵过程中分泌的蛋白酶将原料蛋白水解为小分子肽,是一个微生物产酶和蛋白水解同步进行的过程。在发酵过程中微生物通过自身的代谢将小肽之间的肽键重排转接,对某些苦味基团进行修饰、转移和重组,小肽氨基酸又经过同化代谢作用,最终转化为具有生物活性的玉米肽[15]。但是,目前国内外对微生物发酵法制备玉米肽的报道还很少。基于此,本文利用产蛋白酶丰富的枯草芽孢杆菌发酵玉米黄粉制备玉米可溶性肽,建立较优发酵工艺参数并对发酵所得可溶性肽的理化性质进行分析。
1 材料与方法
1.1 实验材料
枯草芽孢杆菌(Bacillus subtilus CICC 20030),中国工业微生物菌种保藏管理中心;玉米黄粉(蛋白含量60%),购于山东百盛生物科技有限公司;市售玉米肽和市售大豆肽,购于湖北瑞邦生物有限公司;邻菲罗啉、邻苯三酚、1,1-二苯基-2-三硝基苯肼均为分析纯,购自美国Sigma公司。
1.2 培养基
菌种活化固体培养基(g/L):蛋白胨5.0,牛肉浸取物3.0,NaCl 5.0,琼脂15.0,蒸馏水1.0 L,pH 7.0;
液体种子培养基(g/L):蛋白胨10.0,酵母膏5.0, NaCl 10.0,蒸馏水1.0 L,pH 7.0。
1.3 仪器与设备
UV-3200型分光光度计,上海美谱达仪器有限公司;MICROMAX RF230型离心机,美国Thermo Fisher公司;HPX-9052MBE型数显电热培养箱,上海博讯实业有限公司;HYL-C3型三层摇床,太仓市强乐实验设备有限公司;chromaster CM5110型日立高效液相色谱仪,日本日立公司。
1.4 实验方法
1.4.1 种子液的制备
用接种环挑取菌种接于装有50 mL种子培养基的250 mL锥形瓶中,在37 ℃、220 r/min的条件下振荡培养18 h,待用。
1.4.2 发酵培养基优化
玉米黄粉发酵前进行脱淀粉处理[16],脱淀粉玉米黄粉(destarch comgluten meal,DCGM)蛋白含量为80.09%。枯草芽孢杆菌发酵DCGM条件为:以发酵培养基初始pH 7.0和接种量6%,在温度37 ℃和转速220 r/min条件下发酵48 h。
(1)单因素实验
选择DCGM添加量分别为10、30、50、70、90 g/L,以筛选最适DCGM添加量。考察碳源时,发酵培养基中DCGM添加量70 g/L,碳源包括葡萄糖、蔗糖、麦芽糖,添加量分别为2、4、6、8、10 g/L。选择无机盐时,发酵培养基中添加DCGM 70 g/L和蔗糖8 g/L,分别检测NaCl、CaCl2、KCl、MgSO4、 MnSO4等无机盐添加量为2、4、6、8、10 g/L时发酵48 h的玉米可溶性肽含量。
(2)发酵培养基的响应面优化
在上述单因素实验基础上,实验根据Box-Behnken中心组合试验选择玉米黄粉添加量(A)、蔗糖添加量(B)、NaCl添加量(C)3个因子作为自变量,进行发酵培养基组分优化。
1.4.3 培养条件优化
本实验以上述最佳发酵培养基在接种量6%、发酵初始pH 7.0、培养温度37 ℃、转速220 r/min等基础培养条件下考察发酵时间、接种量、发酵温度和转速等对玉米可溶性肽发酵产量的影响。
(1)单因素实验
选择发酵时间,在上述发酵过程中于24、36、48、60、72、84 h取样检测。在选择发酵初始pH时,维持其他条件不变,仅改变发酵初始pH值分别为6.0、7.0、 8.0、9.0、10.0、11.0。在选择接种量时调节发酵培养基pH值为8.0,仅改变上述基础发酵条件接种量分别为2%、4%、6%、8%、10%、12%、14%。在选择发酵温度时培养基初始pH 8.0和4%接种量,设置发酵温度分别为29、33、37、41、45 ℃时研究发酵温度对产玉米可溶性肽含量的影响。选择发酵转速时培养基初始pH 8.0、4%接种量和发酵温度37 ℃,分别考察140、180、220、240、260 r/min时产玉米可溶性肽含量。
(2) 发酵培养条件的响应面优化
实验接着在上述单因素实验基础上,按照Box-Behnken中心组合试验对玉米可溶性肽产量影响较大的3个因素(发酵时间(A)、发酵pH(B)、发酵温度(C)为自变量)进行发酵培养条件优化。
1.4.4 可溶性肽含量的测定
可溶性肽溶液:将发酵液进行离心分离(8 000 r/min,10 min),去除玉米黄粉残渣和菌体,得到发酵上清液。将发酵上清液进行适当稀释用于可溶性肽含量的检测。采用考马斯亮蓝显色法进行可溶性肽含量的测定[17]。
1.4.5 肽分子质量分布的测定
采用高效液相色谱法进行分子质量分布的测定。色谱条件:TSK gel 2000 SWXL(7.8 mm×300 mm)色谱柱;检测波长:220 nm;流动相∶V(乙腈)∶V(水)∶V(三氟乙酸)=40∶60 ∶0.1;流速:0.5 mL/min;柱温:30 ℃; 进样体积:20 μL。
1.4.6 肽抗氧化活性的检测
将本实验所制备玉米可溶性肽配制成2 g/L的肽溶液,而后进行自由基清除能力检测以评估其抗氧化活性。玉米可溶性肽·OH清除能力测定采用涂勇刚等[18]的方法;O2-·清除能力测定采用邻苯三酚自氧化方法,具体操作步骤采用刘建华[19]的方法;DPPH·清除能力测定方法采用CHEN等[20]的方法。
1.4.7 统计方法
利用Excel进行数据统计处理,测定结果以均值±标准差表示。采用Design-Expert 8.0.6软件进行响应面分析。
2 结果与分析
2.1 发酵培养基组成对可溶性肽发酵产量的影响
2.1.1 发酵培养基组成的单因素优化
本实验对发酵培养基组成中的DCGM添加量、碳源种类及添加量、无机盐种类及添加量进行了单因素优化,实验结果见图1-a~图1-c。
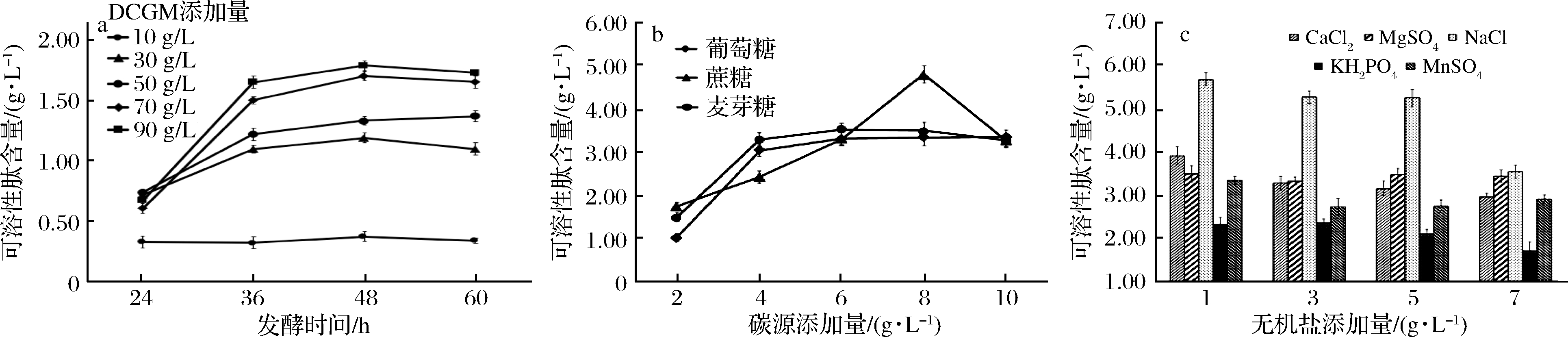
a-DCGM添加量;b-碳源添加量;c-无机盐添加量
图1 发酵培养基组成对可溶性肽含量的影响
Fig.1 Effect of fermentation medium composition on soluble peptide content
由图1-a可知,当DCGM添加量为90和70 g/L时,在发酵过程中可溶性肽含量均优于其他水平添加量。其中在发酵48 h时可溶性肽含量达到最高,DCGM添加量为90 g/L时,可溶性肽含量为1.79 g/L;DCGM添加量为70 g/L时,可溶性蛋白含量为1.71 g/L,考虑到蛋白转化率和发酵培养基黏度选择DCGM添加量为70 g/L。
由图1-b可知,当以蔗糖为碳源且蔗糖的添加量为8 g/L时,可溶性肽含量达到4.8 g/L,高于蔗糖其他添加量以及以葡萄糖、麦芽糖为碳源时可溶性肽含量。因此选择蔗糖添加量为8 g/L。
由图1-c可知,当添加无机盐为CaCl2、KCl、MgSO4、MnSO4时,发酵液中可溶性肽含量不足4.0 g/L,与未添加无机盐时可溶性肽含量4.80 g/L相比有所降低,显示CaCl2、KCl、MgSO4、MnSO4对DCGM发酵产可溶性肽均有抑制作用,表明发酵过程无需添加这些无机盐。以NaCl作为无机盐时,NaCl添加量低于5 g/L时,对可溶性肽含量的增加有促进作用,其中NaCl添加量为1 g/L时,对可溶性肽含量的提升促进作用最为明显,此时可溶性肽含量可达5.66 g/L;当NaCl添加量高于5 g/L时,可溶性肽含量随着NaCl添加量的增加而有所下降。因此,实验选择NaCl为无机盐且添加量为1 g/L。
2.1.2 发酵培养基组成的响应面优化
根据Box-Behnken设计原理,进行17组发酵培养条件优化试验,结果见表1。利用Design-Expert 8.0.6软件对所得实验数据进行回归分析,得到二次多项回归方程: Y可溶性肽=-58.84+ 4.16×A+147.35×B-248.79×C-4.02×AB+14.75×AC +210.00×BC-0.14×A2-86.729×B2-1.99×C2。
对此二次多项回归模型进行方差分析结果显示,此二次多项回归模型具有高度的显著性(P<0.000 1),失拟项在α=0.05水平上不显著(P=0.992 6>0.05),回归模型相关系数R2=0.988 5,校正决定系数![]() 变异系数CV=3.37%。这表明该回归方程的拟合度高,具有统计学意义且能准确拟合试验中各因素对产可溶性肽含量的影响,能充分反应响应值与各因素之间的关系。因此该模型可用来分析和预测最佳发酵培养基组成。
变异系数CV=3.37%。这表明该回归方程的拟合度高,具有统计学意义且能准确拟合试验中各因素对产可溶性肽含量的影响,能充分反应响应值与各因素之间的关系。因此该模型可用来分析和预测最佳发酵培养基组成。
表1 响应面分析实验及实验结果
Table 1 Experiments and experimental results of response surface methodology
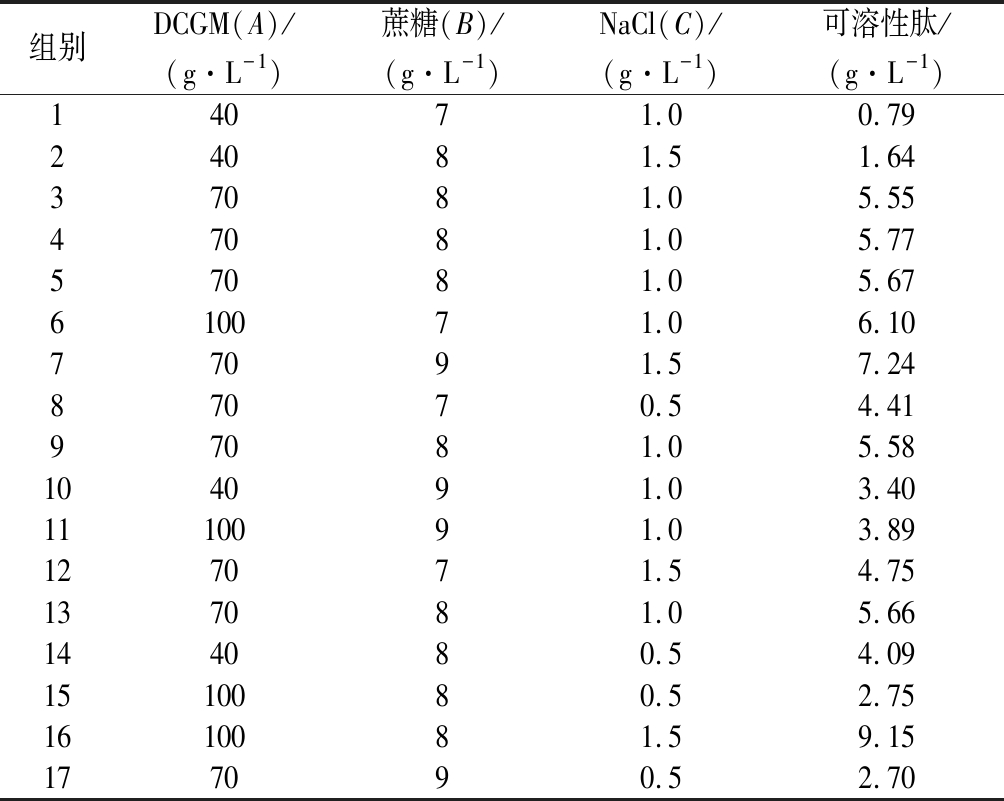
组别DCGM(A)/(g·L-1)蔗糖(B)/(g·L-1)NaCl(C)/(g·L-1)可溶性肽/(g·L-1)14071.00.7924081.51.6437081.05.5547081.05.7757081.05.67610071.06.1077091.57.2487070.54.4197081.05.58104091.03.401110091.03.89127071.54.75137081.05.66144080.54.091510080.52.751610081.59.15177090.52.70
通过单因素选择和响应面优化,实验最终得到最佳发酵培养基的重要组成:DCGM添加量100 g/L,蔗糖添加量8 g/L,NaCl添加量1.5 g/L,此时得到可溶性肽含量为9.20 g/L。与发酵培养基优化前相比,可溶性肽产量提升为优化前5.38倍。
2.2 培养条件对可溶性肽发酵含量的影响
2.2.1 发酵培养条件的单因素优化
本实验对发酵培养条件中的发酵时间、发酵初始pH、接种量、发酵温度及发酵转速进行了单因素优化,实验结果见图2-a~图2-e。
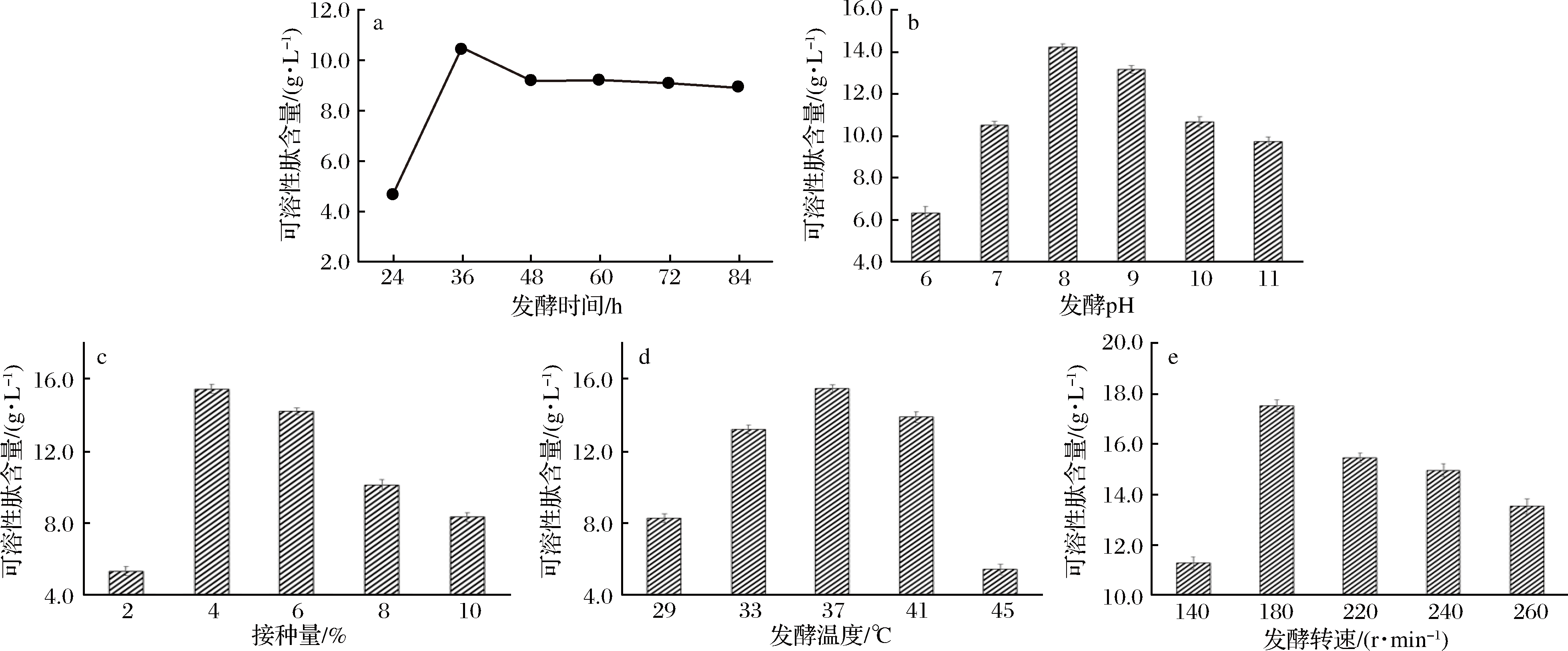
a-发酵时间;b-发酵pH;c-接种量;d-发酵温度;e-发酵转速
图2 发酵培养条件对可溶性肽含量的影响
Fig.2 Effect of fermentation conditions on soluble peptide content
由图2-a所示,在发酵初始阶段,随着发酵时间的增加可溶性肽含量随之提升;在发酵36 h可溶性肽含量达到最高值为10.51 g/L,随后可溶性肽含量随着发酵时间的增加趋于稳定。因此,选择发酵时长为36 h。
由图2-b所示,在初始pH<8时,随着初始pH的增大可溶性肽含量随之增加;在pH>8时,随着培养基初始pH的增大,可溶性肽含量随之降低;在培养基初始pH=8时,可溶性肽含量达到最高为14.23 g/L。 因此,选择培养基初始pH为8。
由图2-c所示,在接种量<4%时,随着接种量的增大可溶性肽的含量不断增加;在接种量>4%时,随着接种量的增大可溶性肽含量逐渐降低;在接菌量为4%时,可溶性肽含量达到最高为15.47 g/L。因此,选择发酵接种量为4%。
由图2-d所示,在发酵温度<37 ℃时,随着发酵温度的增加,可溶性肽的含量不断增加;在发酵温度>37 ℃ 时,随着发酵温度的增加可溶性肽含量随之降低,在发酵温度为37 ℃时,可溶性肽含量达到最高。因此,选择发酵温度为37 ℃。
由图2-e所示,在发酵转速<180 r/min时,随着转速的增加可溶性肽含量不断增加;在发酵转速>180 r/min时,随着转速的增加可溶性肽含量逐渐降低;在发酵转速为180 r/min时,可溶性肽含量达到最高,约达17.5 g/L。因此,选择发酵转速为180 r/min。
2.2.2 响应面优化发酵培养条件结果
根据Box-Behnken设计原理,进行17组发酵培养条件优化试验,结果见表2。利用Design-Expert 8.0.6软件对所得实验数据进行回归分析,得到二次多项回归方程: Y可溶性肽=-308.04+0.345 93×A+38.595 96× B+8.789 23×C+0.022×AB+0.047×AC-0.071×BC-0.032×A2-2.049×B2-0.140×C2。
表2 响应面分析实验及实验结果
Table 2 Experiments and experimental results of response surface methodology
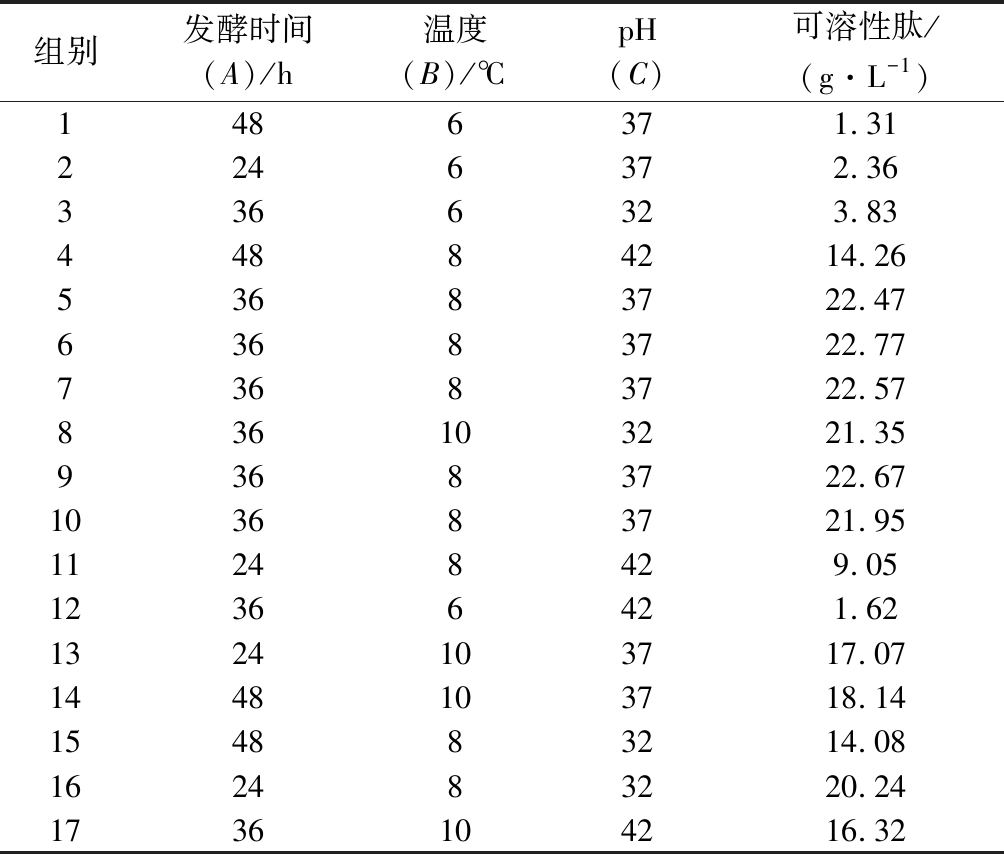
组别发酵时间(A)/h温度(B)/℃pH(C)可溶性肽/(g·L-1)1486371.312246372.363366323.8344884214.2653683722.4763683722.7773683722.57836103221.3593683722.67103683721.9511248429.0512366421.621324103717.071448103718.14154883214.08162483220.241736104216.32
对此二次多项回归模型进行方差分析结果显示,回归模型具有高度的显著性(P<0.000 1),失拟项在α=0.05水平上不显著(P=0.992 6>0.05),回归模型相关系数R2=0.988 5,校正决定系数![]() 变异系数CV=3.92%。数据表明该回归方程的拟合度高,在统计学上有意义,可用来分析预测最佳发酵培养条件。响应面优化最佳发酵培养条件为:发酵时间42 h、培养基初始pH 8.99、发酵温度37.7 ℃、接种量4%、发酵转速 180 r/min,实验考虑到实际试验操作将工艺参数修正为发酵时间42 h、培养基初始pH 9.0、发酵温度37 ℃。此条件下预测可溶性肽产量为23.10 g/L,最后对该模型进行验证试验(n=5)得到可溶性肽含量为(22.7±0.35)g/L,与预测值非常接近,与培养条件优化前相比,可溶性肽产量提升至优化前的2.47倍。
变异系数CV=3.92%。数据表明该回归方程的拟合度高,在统计学上有意义,可用来分析预测最佳发酵培养条件。响应面优化最佳发酵培养条件为:发酵时间42 h、培养基初始pH 8.99、发酵温度37.7 ℃、接种量4%、发酵转速 180 r/min,实验考虑到实际试验操作将工艺参数修正为发酵时间42 h、培养基初始pH 9.0、发酵温度37 ℃。此条件下预测可溶性肽产量为23.10 g/L,最后对该模型进行验证试验(n=5)得到可溶性肽含量为(22.7±0.35)g/L,与预测值非常接近,与培养条件优化前相比,可溶性肽产量提升至优化前的2.47倍。
目前国内对发酵法制备玉米肽的研究还较少。祁尼娜等[21]利用纳豆芽孢杆菌发酵底物浓度10%的玉米黄粉,在34 ℃条件下发酵50 h得到可溶性肽含量为22.15 g/L;牟金秀[22]利用枯草芽孢杆菌发酵底物浓度5.89%玉米黄粉,在33 ℃条件下发酵85 h得到可溶性肽含量为22.90 g/L;宋占兰[23]利用纳豆芽孢杆菌发酵底物浓度13.5%玉米黄粉,在32 ℃条件下发酵42 h得到可溶性肽含量为12.84 g/L。与以上研究相比,本实验所制备玉米肽的方法具有发酵可溶性肽产量较高,发酵耗时较短和发酵效率高的优势。
2.3 玉米可溶性肽的理化性质分析
2.3.1 分子质量分布
表3分析检测最佳发酵条件下制备的玉米可溶性肽分子质量分布。该可溶性肽中分子质量<1 000 Da低聚肽含量较高,占总肽含量的76.36%。相似地,陈芳[12]、张学忠[14]和权文吉[24]利用酶法所制备玉米肽中低聚肽含量占比分别为67.1%、75%和63%。与这些报道相比,本实验利用发酵法制备的玉米肽在低聚肽含量上处于较高水平。
表3 可溶性肽分子质量分布
Table 3 Soluble peptide molecular weight distribution
分子质量分布/Da<1 0001 000~2 000>2 000分子质量占比/%76.3611.3512.29
2.3.2 玉米可溶性肽抗氧化活性检测
实验接着对所制备玉米肽进行抗氧化活性(·OH、O2-· 及DPPH·清除能力)检测,结果见表4。发酵法所制备的玉米肽对·OH清除率为99.31%、O2-·清除率为58.38%和DPPH·清除率为80.27%。与市售玉米肽和大豆肽相比,发酵玉米肽对3种自由基清除能力均优于市售玉米肽和大豆肽。该分析显示,发酵制备的玉米肽具有很高的抗氧化性,意味着该活性肽可能具有重要的生理功能,值得将来进一步研究。
表4 抗氧化能力的检测
Table 4 Determination of antioxidant activity of peptides
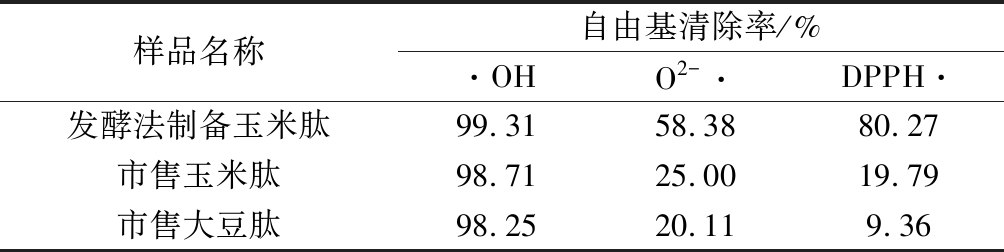
样品名称自由基清除率/%·OHO2-·DPPH·发酵法制备玉米肽99.3158.3880.27市售玉米肽98.7125.0019.79市售大豆肽98.2520.119.36
3 结论
经过对玉米黄粉添加量、碳源及无机盐种类和添加量、发酵时间、发酵pH、接种量、发酵温度、发酵转速等相关因素的单因素和响应面综合试验,确定利用枯草芽孢杆菌CICC20030发酵生产可溶性肽的最佳发酵条件为:玉米黄粉添加量100 g/L,蔗糖添加量8 g/L,NaCl添加量1.0 g/L,发酵时间42 h,培养基初始pH 9.0,发酵温度37 ℃,接种量4%,发酵转速 180 r/min。在此条件下得到的可溶性肽含量为22.7 g/L, 是优化前产量的8倍。在最佳发酵条件下所制备的玉米肽中低聚肽含量较高,占玉米肽总含量的76.36%。同时对最佳发酵条件下所制备的玉米肽清除·OH、O2-·、DPPH·的能力进行检测,检测其对3种自由基的清除能力分别为99.31%、58.38%、80.27%,对3种自由基的清除能力均优于市售玉米肽及市售大豆肽。
[1] 江成英,王松,李琰,等.多菌种固态发酵玉米黄粉饲料种曲的制备条件研究[J]. 中国饲料, 2018(7):35-37.
[2] 王晓杰,丛万锁,刘晓兰,等.玉米ACE抑制肽的制备工艺及中试生产[J]. 食品与发酵工业, 2016, 42(7):158-164.
[3] 肖潇,尹胜,侯威,等.四种植物蛋白的成分与营养学特性分析[J]. 食品科学技术学报,2016,34(3):61-66.
[4] JIN J, MA H, ZHOU C, et al. Effect of degree of hydrolysis on the bioavailability of corn gluten meal hydrolysates[J]. Journal of the Science of Food and Agriculture, 2015, 95(12):2 501-2 509.
[5] TANIMOTO S Y, TANABE S, WATANABE M, et al. Enzymatic modification of zein to produce a non-bitter peptide fraction with a very high fischer ratio for patients with hepatic encephalopathy[J]. Agricultural and Biological Chemistry, 2014, 55(4): 1 119-1 123.
[6] ZHOU C, HU J, MA H, et al. Antioxidant peptides from corn gluten meal: Orthogonal design evaluation [J]. Food Chemistry, 2015,187: 270-278.
[7] 王晓杰,丛万锁,刘晓兰,等.玉米ACE抑制肽的制备工艺及中试生产[J]. 食品与发酵工业, 2016, 42(7):158-164.
[8] WANG Y X, ZHENG M Y, YANG X H, et al. Optimization of multi-enzyme hydrolysis process for efficient corn gluten meal hydrolysis [J]. Advanced Materials Research, 2012, 608: 333-338.
[9] SHUKLA R, CHERYAN M. Zein: The industrial protein from corn [J]. Industrial Crops & Products, 2001, 13(3):171-192.
[10] CUDENNEC B, RAVALLEC-PLÉ R, COUROIS E, et al. Peptides from fish and crustacean by-products hydrolysates stimulate cholecystokinin release in STC-1 cells [J]. Food Chemistry, 2008, 111(4):970-975.
[11] 潘兴昌,曾瑜,刘文颖,等.玉米低聚肽和姜黄素对小鼠的醒酒功能研究[J]. 食品与发酵工业,2016, 42(11):25-34.
[12] 陈芳.玉米黄粉酶法制备高F值低聚肽的研究[D]. 重庆:西南农业大学, 2003.
[13] 杨羿.玉米肽F值及风味控制技术的研究[D]. 长春:吉林农业大学, 2012.
[14] 张学忠.玉米肽、制备方法及其应用:中国,200310115958.7[P].2004-12-08.
[15] 何音华,蔡丹,盛悦,等.玉米活性肽的制备分析及其功能活性研究进展[J]. 食品工业, 2018 (1): 234-237.
[16] 马伟.玉米肽低聚肽的制备、分离及其生物活性研究[D]. 无锡:江南大学,2015.
[17] 王福荣. 生物工程分析与检验[M]. 北京:中国轻工业出版社, 2006:124-125.
[18] 涂勇刚, 刘亚真,田颖刚,等,泰和乌骨鸡黑色素的体外抗氧化作用[J]. 食品与生物技术学报, 2009, 28(2): 145-149.
[19] 刘建华. 泰和乌骨鸡活性肽抗氧化与降血压及其补血作用研究[D]. 南昌:南昌大学, 2011.
[20] CHEN Y, XIE M Y, NIE S P, et al. Purification, composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J]. Food Chemistry, 2008, 107(1):231-241.
[21] 祁尼娜,黄妙燕,马洪娟.纳豆杆菌发酵玉米粉制备玉米肽生产条件研究[J]. 青岛科技大学学报(自然科学版), 2015,36(S2): 84-89.
[22] 牟金秀.微生物发酵法生产玉米肽的研究[D].济南:山东轻工业学院, 2015.
[23] 宋占兰.玉米蛋白的生物法水解及产物的性质研究[D].齐齐哈尔:齐齐哈尔大学, 2012.
[24] 权文吉.酸性蛋白酶水解玉米蛋白粉的研究[D].大连:大连理工大学, 2007.