鲢鱼(Hypophthalmichthys molitrix)又称白鲢,四大家鱼之一,肉质鲜嫩、味道鲜美、胶质蛋白含量丰富,并含多种人体所需的营养物质,具有润肌肤、和气血、补气和乌发的功效[1]。目前,我国鲢鱼市场以鲜活供应为主,供应半径短,无法满足产业化发展的需求,而鲢鱼的工厂化屠宰加工是未来发展的必然趋势。鲢鱼在贮藏期间易发生微生物腐败、脂肪和蛋白质的氧化,食用和加工品质下降,鲢鱼的贮藏保鲜是困扰和限制着产业发展的一个难题。国内外对鲢鱼的研究主要集中在养殖、病害防治等方面,保鲜方面的研究起步较晚。张进杰等[2]研究表明质量浓度为10 g/L的壳聚糖涂膜能有效改善鲢鱼块的感官品质且能延长3 d货架期。杨华等[3]研究表明,在冰温(-1.5±0.03)℃条件下,鲤鱼鱼糜制品贮藏期为3周。相关研究主要集中在贮藏过程中鱼肉食用品质的变化,对贮藏过程中蛋白质氧化变化及其造成的加工特性变化等研究却鲜有报道。
目前对于延缓蛋白质氧化的研究多通过添加抗氧化剂来实现,但化学抗氧化剂存在潜在的安全性问题。天然抗氧化剂多为植物提取物,其毒性远远低于化学抗氧化剂,应用前景广阔。鼠尾草(Salvia Officinalis)为唇形科一年生芳香性草本植物,主要分布在热带、亚热带和温带地区,共有900~1 100种,我国有84种[4]。鼠尾草的花、茎、叶均有较高的利用价值,且其资源丰富、成本低廉,故被广泛用作医药、香料和食品行业的原料。鼠尾草中的一些成分能够螯合金属离子、清除自由基和单线态氧,具有较强的抗氧化能力[5-6]。章林等[7]的研究也证明了鼠尾草提取物具有良好的抗氧化能力。目前,已经有学者开展了鼠尾草提取物在动物性食品中的抗氧化效果的研究,如李玉邯等[8]研究发现添加10 g/L的鼠尾草提取物能明显提高肉脯的抗氧化能力,并能保持肉脯良好的感官品质;MCCARTHY等[9]的研究显示添加0.05%的鼠尾草到冷藏的生或熟猪肉饼中可有效地减少脂肪氧化并有一定的护色作用。但鼠尾草提取物在水产品中的抗氧化及防腐效果等相关研究还未见报道。
本文以新鲜鲢鱼为原料,以人工合成抗氧化剂BHT和天然抗氧化剂TP为参照,从鲢鱼肌原纤维蛋白质结构和功能特性2个方面入手,考察不同浓度的鼠尾草提取物的抗氧化效果,探讨抗氧化机理,以期为鲢鱼的贮藏保鲜提供理论基础和应用参考。
1 材料与方法
1.1 材料与试剂
鲜活鲢鱼(体态完好,体型均匀),重庆市北碚区永辉超市;大豆油(食品级),金龙鱼集团股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UltraScan PRO色差仪,美国HunterLab公司;Avanti J-10高速冷冻离心机,美国贝克曼库尔特公司;PHS-4C+酸度计,成都世纪方舟科技有限公司;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司; TA.XT2质构仪,英国stablemicrosystem公司; PowerPacBasic小型垂直电泳槽,美国Bio-Rad公司;G:BOX凝胶成像系统,美国基因公司;722-P可见分光光度计,上海现科仪器有限公司;XW-80A漩涡混合器,上海青浦沪西仪器厂。
1.3 方法
1.3.1 试样处理
将鲜活白鲢宰杀,去头、去鳞、去内脏,洗净后切片,分别用蒸馏水(空白)、质量浓度10、20、30 g/L鼠尾草提取物、质量浓度0.1 g/L BHT、10 g/L TP溶液浸泡30 min,取出后沥干,托盘包装覆上保鲜膜,置于4 ℃下备用。
1.3.2 MP的提取及浓度的测定
参照ZHANG[10]和CHIN[11]的方法并做适当修改。以20 mmol/L,pH 7.5的磷酸盐缓冲溶液为提取液,0.1 mol/L NaCl为漂洗液。MP的提取和贮藏均在4 ℃的条件下完成,3 d内完成相关指标的测定。MP浓度的测定采用双缩脲法,牛血清蛋白为标准蛋白[12]。
1.3.3 MP结构指标的测定
1.3.3.1 羰基含量的测定
参照BAHAR[13]的方法并做适当改动,在10 mL离心管中加入1 mL 10 mmol/L 2,4-二硝基苯肼(DNPH),室温下反应1 h后,加1 mL 20%三氯乙酸,振荡后离心(12 000 r/min,3 min,4 ℃),弃上清液,用1 mL乙酸乙酯和乙醇(1∶1,V/V)混合物清洗3次,收集沉淀,将沉淀溶于3 mL 6mol/L盐酸胍溶液中,并于37 ℃恒温水浴下保持15 min,离心(12 000 r/min,3 min,4℃)后取上清液于370 nm处测吸光值。用22 000 L/(mol·cm)的摩尔吸光系数计算羰基含量。
1.3.3.2 巯基含量的测定
调整待测MP的质量浓度为5 mg/mL,溶于9 mL 0.05 mol/L,pH 7.2的磷酸盐缓冲液中并加入1 mL样液,充分混匀,取4 mL混合液,加0.4 mL 0.01 mol/L 5,5′-二硫代双(2-硝基苯甲酸)(5,5′-Dithiobis-(2-nitrobenzoic acid),DTNB)和0.05 mol/L醋酸钠溶液,振荡摇匀后在40 ℃下保温25 min。以不加DTNB样品为对照,在412 nm下测定吸光值[12]。
1.3.3.3 SDS- PAGE凝胶电泳
参照LAEMMLI[14]的方法,将样液(4% SDS,质量分数0.02%溴酚蓝,质量分数20%甘油,质量分数10% β-巯基乙醇,0.125 mol/L,pH 6.8的Tris-HCl缓冲液)调节成蛋白质质量浓度为1.5 mg/mL,振荡1 min,100 ℃水浴下保温3 min,高速离心10 min后备用。电泳分离胶、浓缩胶浓度分别为10%和5%,上样量为15 μL,标准蛋白上样为5 μL。
1.3.4 MP功能特性指标的测定
1.3.4.1 溶解度的测定
参照AGYARE等[15]的方法。取一定量MP溶于4 ℃磷酸缓冲液(50 mmol/L Na2HPO4,0.6 mol/L NaCl,pH 6.25)中,低速混合匀浆36 s,使蛋白质充分溶解,双缩脲法测得的蛋白质溶液的浓度记作C1。冷藏(4 ℃)1 h,于5 500 r/min条件下冷冻离心15 min,用双缩脲法测定的离心后的MP的浓度记作C2,空白用磷酸缓冲溶液替代。即MP溶解度按公式(1)计算。
溶解度![]()
(2)
1.3.4.2 乳化性的测定
采用浊度法测定MP的乳化性[16]。
1.3.4.3 表面疏水性的测定
参照CHIN[11]的方法,用0.02 mol/L pH 6.0的磷酸缓冲液调整蛋白质量浓度为5 mg/mL。向离心管中加入1 mL样液和200 μL 1 mg/mL溴酚蓝,在室温下反应10 min,离心(3 000 r/min,10 min,20 ℃)后取上清液,上清液稀释10倍后于595 nm处测定吸光值,空白以磷酸缓冲液代替样液进行测定。
1.3.5 MP凝胶性质的测定
1.3.5.1 凝胶的制备
参照李艳青[17]的方法并做修改,将MP配成质量浓度160 mg/mL的溶液,装入10 mL小烧杯中在80 ℃水浴加热30 min,待凝胶形成后取出并冷却至室温,在4 ℃下贮藏备用。
1.3.5.2 凝胶质构(texture profile analysis, TPA)的测定
取出待测MP凝胶,在室温下放置30 min后采取TPA模式进行质构测定。参数如下:探头TA10;测前速度5 mm/s;测中速度1 mm/s;测后速度1 mm/s;压缩比50%;触发力5 g;触发类型Auto。
1.3.5.3 凝胶保水性的测定
取出待测样品放置30 min后,称重记m1,离心(5 000 r/min,10 min,4 ℃),去上清液,称重记m2。每个样品测定3次,取平均值,m0为离心管质量[18]。凝胶保水性按公式(2)计算。
保水性![]()
(2)
1.3.5.4 凝胶白度的测定
取出待测样品,室温下平衡30 min后,用吸水纸吸去表面水分,切成1 cm厚圆柱体,用色差仪进行凝胶白度值分析,测定L*(亮度)、a*(红度)、b*(黄度)[19]。凝胶白度值按公式(3)计算。
白度值![]()
(3)
1.3.6 数据处理
每个试验重复3次,每次3个平行样品,结果取平均值。用Excel、Origin 8.5和SPSS Statistics 20.0软件进行统计分析。
2 结果与分析
2.1 鼠尾草提取物对冷藏鲢鱼MP结构的影响
2.1.1 羰基含量的变化
蛋白质发生氧化后最显著的变化之一就是形成羰基,常用其衡量蛋白质的氧化程度。鼠尾草提取物对冷藏鲢鱼MP羰基含量的影响如图1所示,从图1中可看出羰基含量随贮藏时间延长而显著上升(P<0.05),初期变化较为平缓,从第3天开始上升速率显著增加,这说明鲢鱼MP在贮藏过程中发生了不同程度的氧化。羰基含量的逐渐增多可能是因为肌肉组织中各项生化反应随贮藏时间延长缓慢发生,导致部分肽链骨架断裂被分解成氨基酸,侧链上带有NH和![]() 的氨基酸又非常容易被羟基自由基氧化形成NH3和相应的羰基,致使羰基含量增加[20]。
的氨基酸又非常容易被羟基自由基氧化形成NH3和相应的羰基,致使羰基含量增加[20]。

图1 冷藏条件下鲢鱼MP羰基含量的变化
Fig.1 Changes of carbonyl content in MP of chub under cold storage
新鲜鲢鱼的羰基含量为15.73 μmol/L,贮藏过程中对照组的羰基含量上升速率最快,高于其他试验组,经过9 d的贮藏后,对照组羰基含量增加了88.05%,10 g/L SE组、20 g/L SE组、30 g/L SE组、BHT组和TP组分别增加了63.25%、56.96%、60.39%、61.16%和54.67%,处理组羰基含量增加值明显小于对照组,表明SE和BHT、TP均可以不同程度地抑制MP的氧化,且20 g/L SE组和TP组对MP的抗氧化效果最好。丁景等[21]在研究5种抗氧化剂对微冻泥鳅MP的功能特性的影响时指出BHT可以有效抑制MP氧化,这与本试验结果一致。
2.1.2 巯基含量的变化
巯基基团是MP中很活跃的功能基团,其含量变化影响MP空间结构的稳定性[22]。鼠尾草提取物对冷藏鲢鱼MP巯基含量的影响如图2所示,从图2中可看出,巯基含量随着贮藏时间的延长而逐渐下降,这可能是因为在贮藏过程中暴露在蛋白质表面的巯基不断被氧化形成二硫键,导致巯基含量不断减少[17]。新鲜鲢鱼MP的巯基含量为6.31 nmol/105 g蛋白质,经过9 d贮藏后,对照组巯基含量下降了70.21%;10 g/L SE、20 g/L SE、30 g/L SE、BHT、TP处理组分别下降了67.83%、63.39%、64.66%、66.46%和67.67%。对比发现,对照组巯基含量下降最快,20 g/L SE处理组下降较为缓慢。这表明鼠尾草提取物、TP和BHT均可抑制鲢鱼MP中的巯基的氧化,且20 g/L的鼠尾草提取物对MP的抗氧化效果最好,鼠尾草提取物的抗氧化机理可能与其自身含有的酚类物质有关。本试验鲢鱼肌原纤维蛋白在贮藏过程中的总体变化趋势与荣建华等[23]研究的脆肉鱿鱼肉肌动球蛋白巯基含量在低温贮藏中的变化趋势相类似。
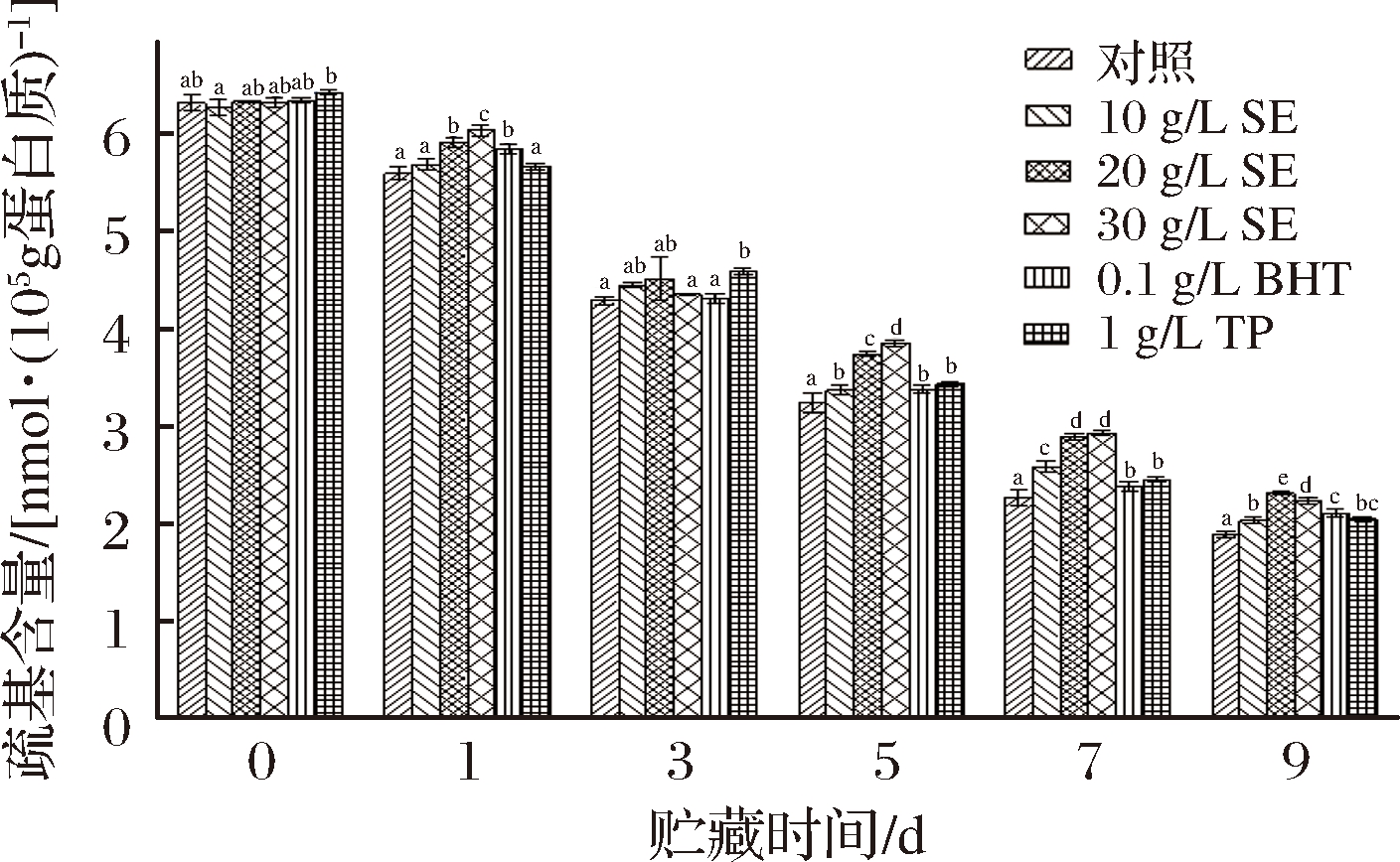
图2 冷藏条件下鲢鱼MP巯基含量的变化
Fig.2 Changes of sulfhydryl content in MP of chub under cold storage
2.1.3 SDS-PAGE分析
蛋白质的氧化主要是蛋白质通过转氨基、脱羧基、脱氨基作用形成一系列小分子物质或者一些氧化产物发生聚集形成大分子物质。因氧化导致了分子量的变化,故SDS-PAGE凝胶电泳法通过对不同分子量的蛋白质分离能反映蛋白质分子的断裂、交联聚合程度[24]。鼠尾草提取物对冷藏鲢鱼MP SDS-PAGE的影响如图3。从中可以看出,冷藏5 d时各试样间肌球蛋白重链和肌动蛋白的条带无很明显的差异,表明此时各试样的肌原纤维蛋白虽然发生了一定程度的氧化,但还没有产生严重的交联聚合。冷藏9 d后各个试样的肌球蛋白重链和肌动蛋白明显减弱,但第4、5和6泳道的条带相似且比第1、2和3泳道的条带粗,说明30 g/L SE处理能更好地抑制因氧化导致的蛋白质的交联和聚合且抑制效果与0.1 g/L BHT及1 g/L TP相当。
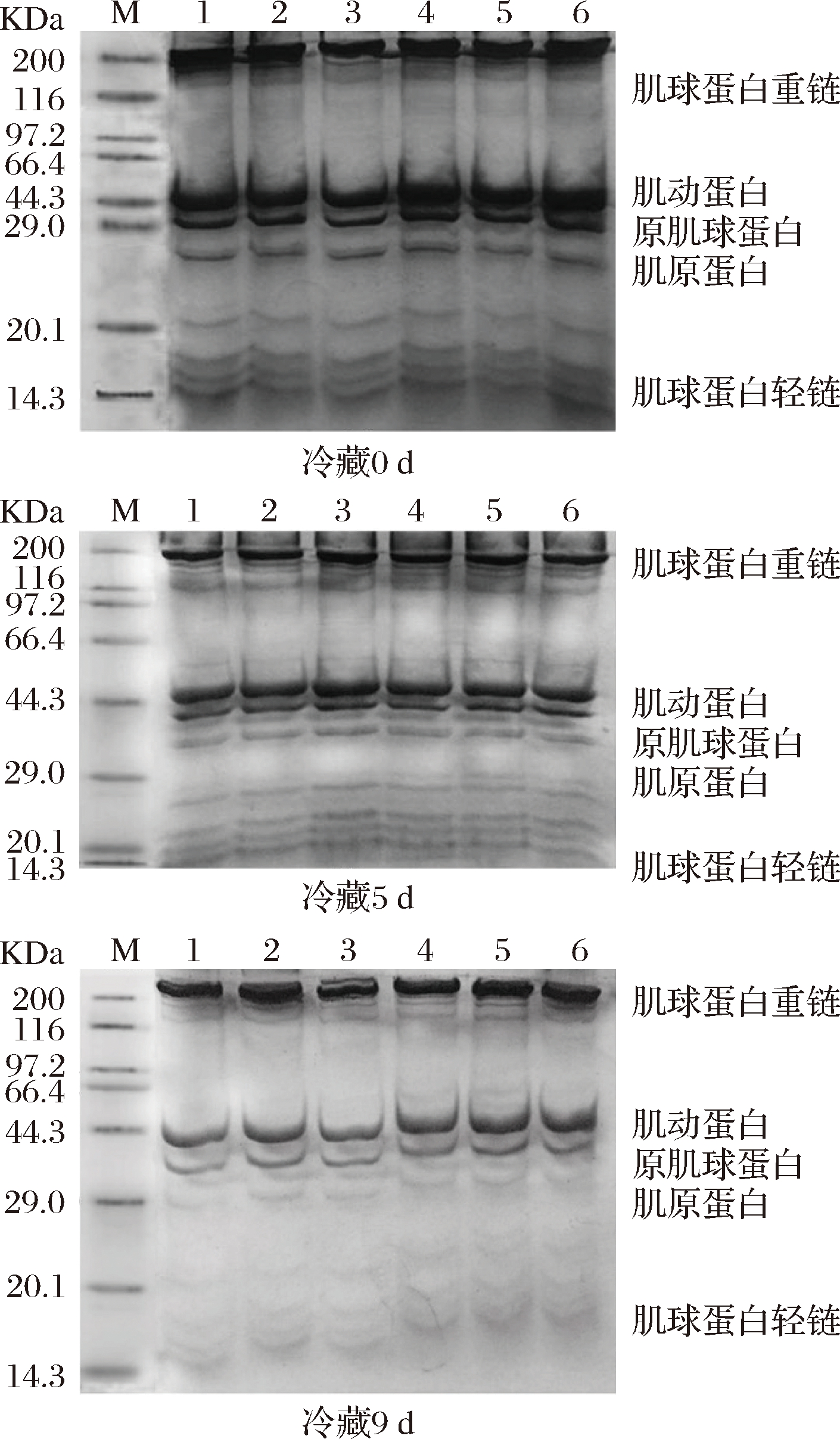
M-marker;1-6分别为对照、10 g/L SE、20 g/L SE、30 g/L SE、0.1 g/L BHT和1 g/L TP
图3 冷藏条件下鲢鱼肌原纤维蛋白的SDS-PAGE电泳分析
Fig.3 SDS - PAGE electrophoresis analysis of silver carp myofibrillar protein under cold storage
2.2 鼠尾草提取物对冷藏鲢鱼MP功能特性的影响
2.2.1 溶解度的变化
蛋白质的溶解性是其基本的物理性质,能直接反映蛋白质变性和聚集的变化程度[25]。鼠尾草提取物对冷藏鲢鱼MP溶解度的影响如图4所示,从图4中可以看出,MP的溶解度随贮藏时间的延长呈下降趋势,溶解度降低可能是由于在贮藏过程中蛋白质变性和微环境的变化导致了不溶性大分子量蛋白质聚集体的形成,使蛋白质溶解性降低[26]。蛋白质结构发生变化会暴露其疏水基团,疏水相互作用会使蛋白质发生凝聚,从而导致其溶解度下降。新鲜鲢鱼MP的溶解度为66.08%,经过9 d的贮藏,对照组鲢鱼MP的溶解度下降为45.51%,而10 g/L SE、20 g/L SE、30 g/L SE、BHT、TP处理组溶解度依次为49.57%、50.77%、50.29%、49.29%和51.45%,下降幅度显著低于对照组,这可能是由于鼠尾草提取物具有较强的抗氧化性,较好地抑制了蛋白质的氧化变性,延缓了蛋白质溶解度的下降速度。

图4 冷藏条件下鲢鱼MP溶解度的变化
Fig.4 Changes of MP solubility of chub under cold storage
2.2.2 乳化性的变化
蛋白质既有亲水基团,又有疏水基团,故而具有一定的乳化性,其乳化能力用乳化活性指数(emulsifying activity index, EAI)和乳化稳定性指数(emulsifying stability index, ESI)衡量。鼠尾草提取物对冷藏鲢鱼MP乳化性的影响如图5和图6所示。
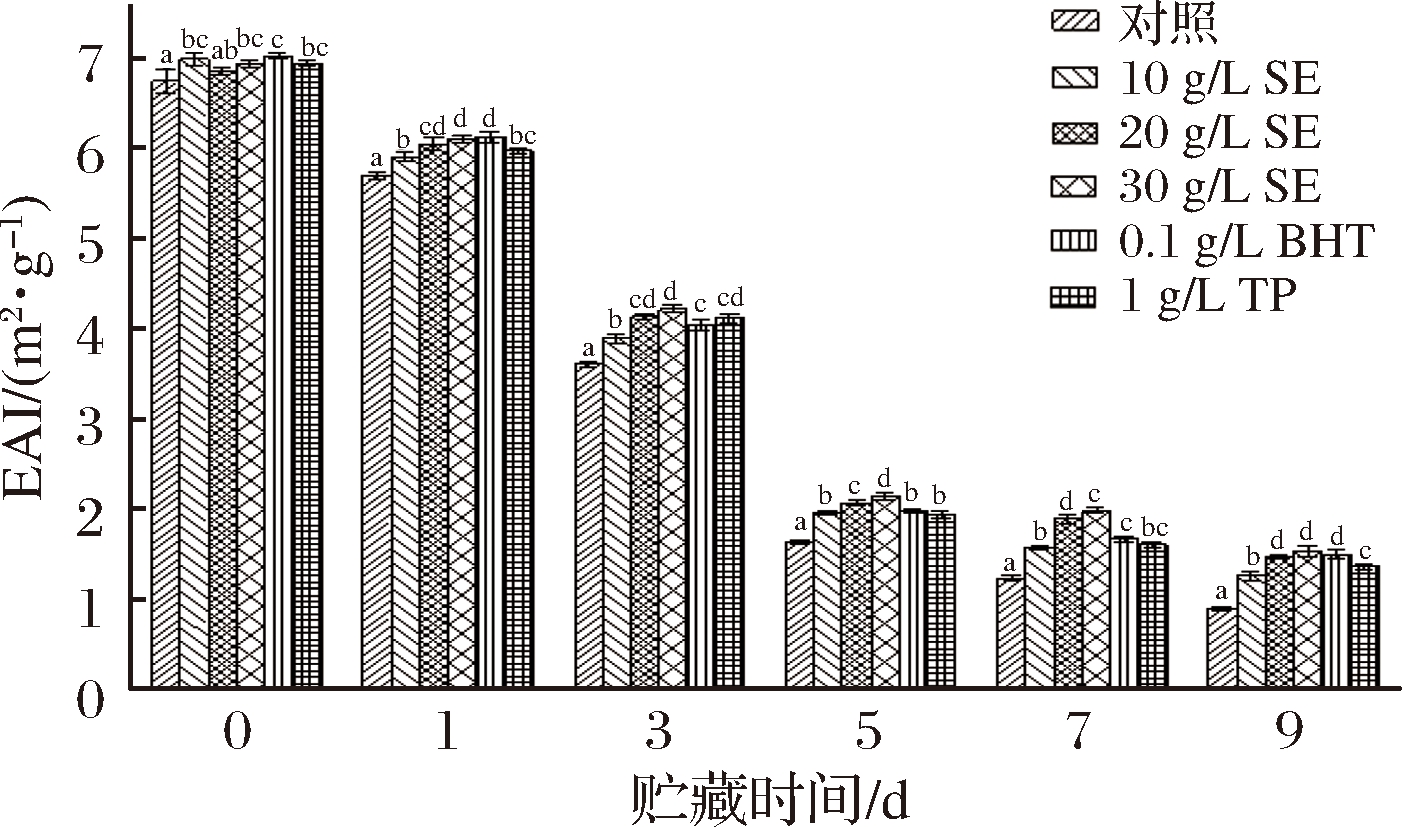
图5 冷藏条件下鲢鱼MP乳化活性的变化
Fig.5 Changes of MP emulsifying activity of chub under cold storage
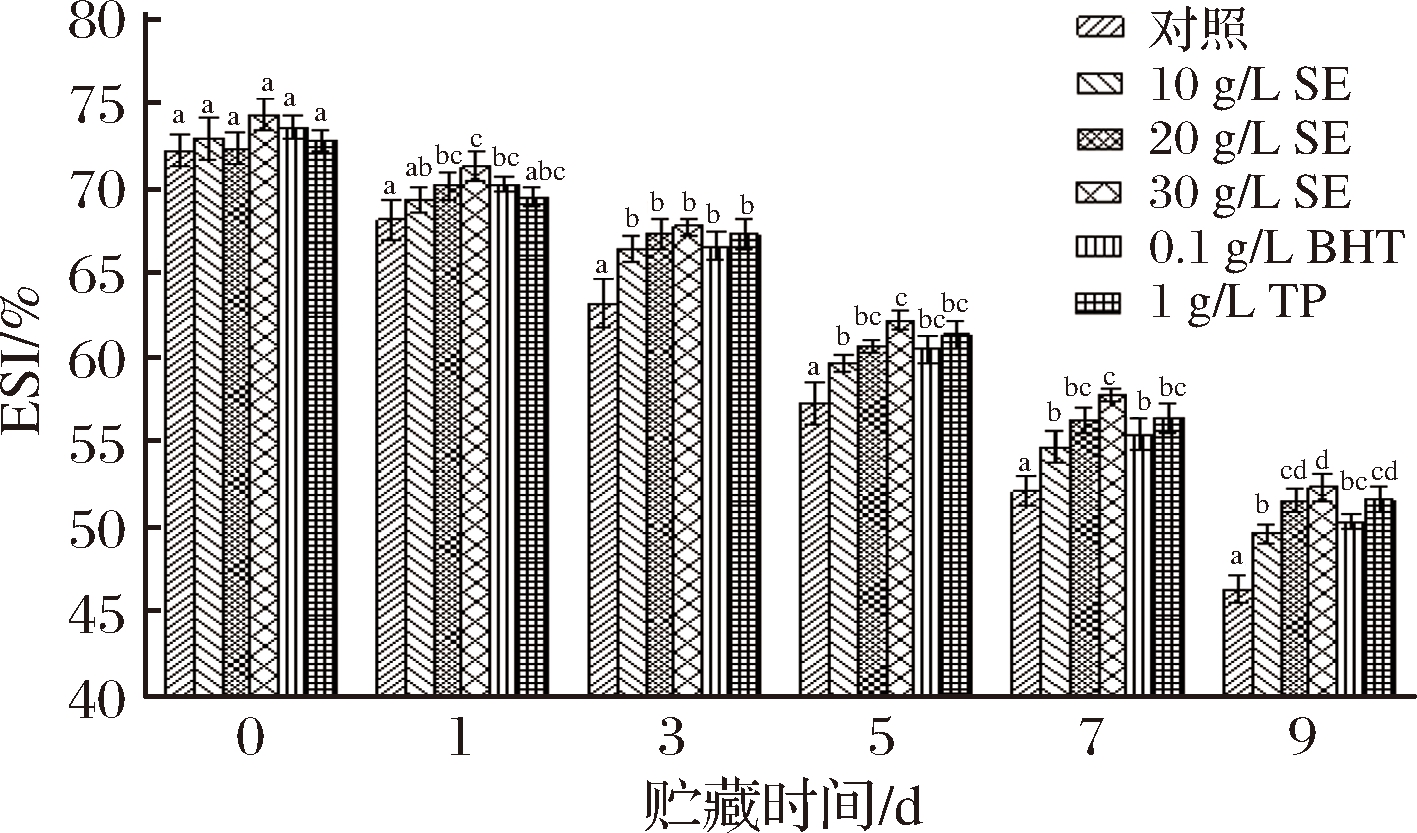
图6 冷藏条件下鲢鱼MP乳化稳定性的变化
Fig.6 Changes of MP emulsifying stability of chub under cold storage
从中可以看出,鲢鱼MP的EAI和ESI均随着贮藏时间的延长呈持续下降趋势,这可能是因为随着贮藏时间延长MP发生了氧化变性,蛋白质原有空间结构被破坏,肌球蛋白交联程度增加,其表面吸附脂肪颗粒的能力下降,从而降低了蛋白质的乳化活性[27]。李艳青[17]的研究也表明蛋白质氧化会导致其乳化性能降低。对照组、10 g/LSE、20 g/L SE、30 g/L SE、BHT、TP处理组鲢鱼MP初始EAI分别为6.73、6.97、6.83、6.93、7.01和6.93 m2/g,贮藏9 d后,分别降低至0.89、1.25、1.46、1.52、1.49和1.35 m2/g;初始ESI分别为72.27%、73.01%、72.42%、74.42%、73.67%和72.87%,9 d后分别降至46.29%、49.60%、51.54%、52.37%、50.29和51.63%。统计分析表明,鼠尾草提取物浓度越大,EAI和ESI下降越慢。
2.2.3 表面疏水性的变化
蛋白质的表面疏水性是指蛋白质分子与水分子间相互排斥的物理性质,是常用的衡量蛋白质变性程度的指标。鼠尾草提取物对冷藏鲢鱼MP表面疏水性的影响如图7所示。
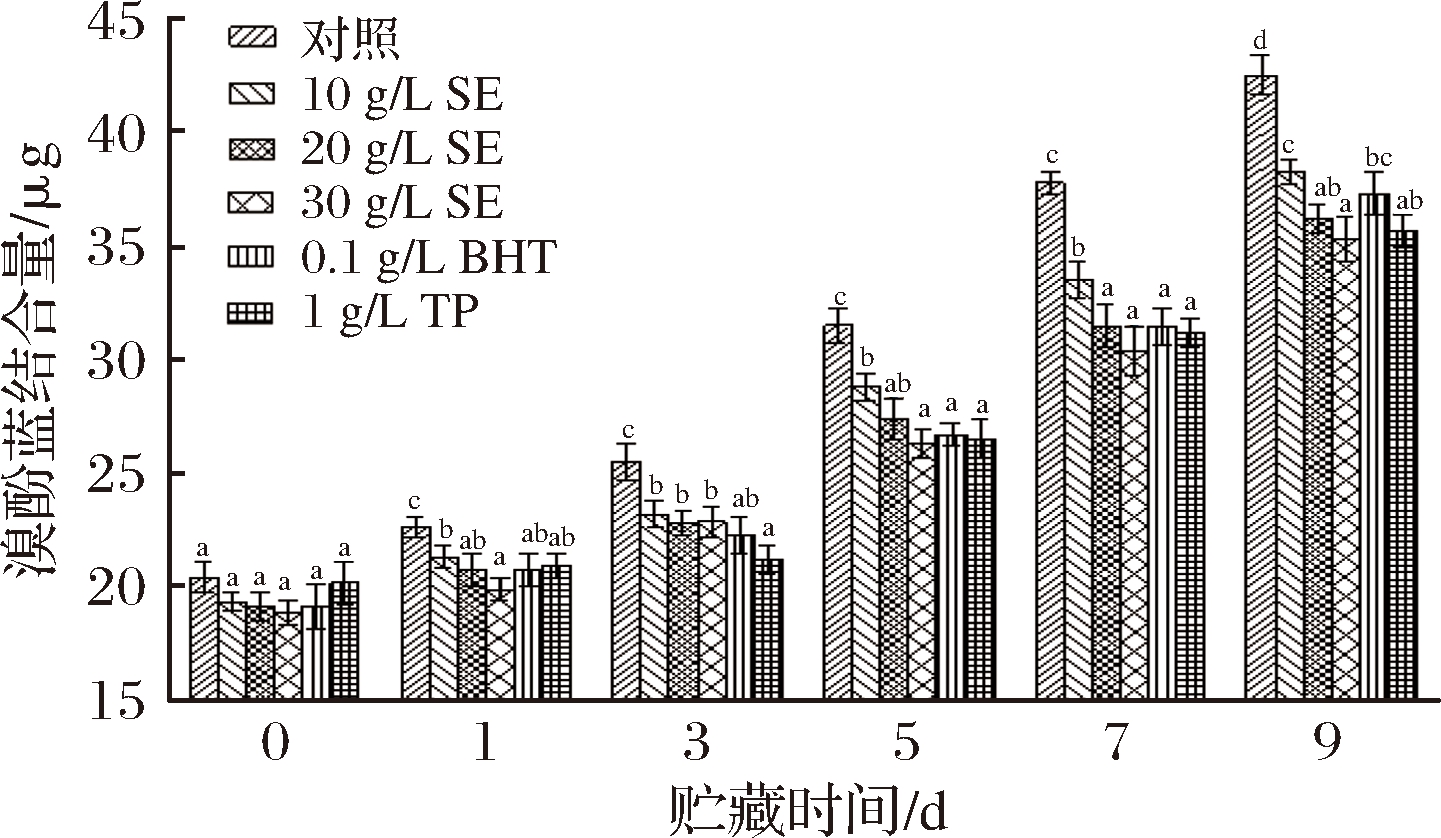
图7 冷藏条件下鲢鱼MP表面疏水性的变化
Fig.7 Changes of MP surface hydrophobicity of chub under cold storage
从图7中可以看出,鲢鱼MP的表面疏水性随着贮藏时间的延长呈现持续上升趋势,这可能是因为在贮藏过程中鲢鱼MP发生了变性,蛋白质的构象随着变性程度的加深发生变化,其表面疏水性氨基酸基团逐步暴露,表面疏水性逐渐增大。对照组和10 g/L SE、20 g/L SE、30 g/L SE、BHT、TP处理组的溴酚蓝初始结合量分别为20.44、19.35、19.12、18.87、19.17和20.19 μg,在贮藏过程中,0~3 d溴酚蓝结合量上升缓慢,3~9 d溴酚蓝结合量上升较快,MP与溴酚蓝的结合量越大,说明其疏水性越强[15]。与对照组相比,其他处理组的溴酚蓝结合量显著低于对照组(P<0.05),且鼠尾草提取物浓度越大,溴酚蓝结合量越小。本结果与吕卫金等[28]的研究结果相一致。
2.3 鼠尾草提取物对冷藏鲢鱼MP凝胶特性的影响
2.3.1 凝胶质构(TPA)的变化
凝胶具有连续网状结构,凝胶固形物浸没在液体介质中不具有稳定的流动性[29]。鼠尾草提取物对冷藏鲢鱼MP凝胶硬度的影响如图8所示。
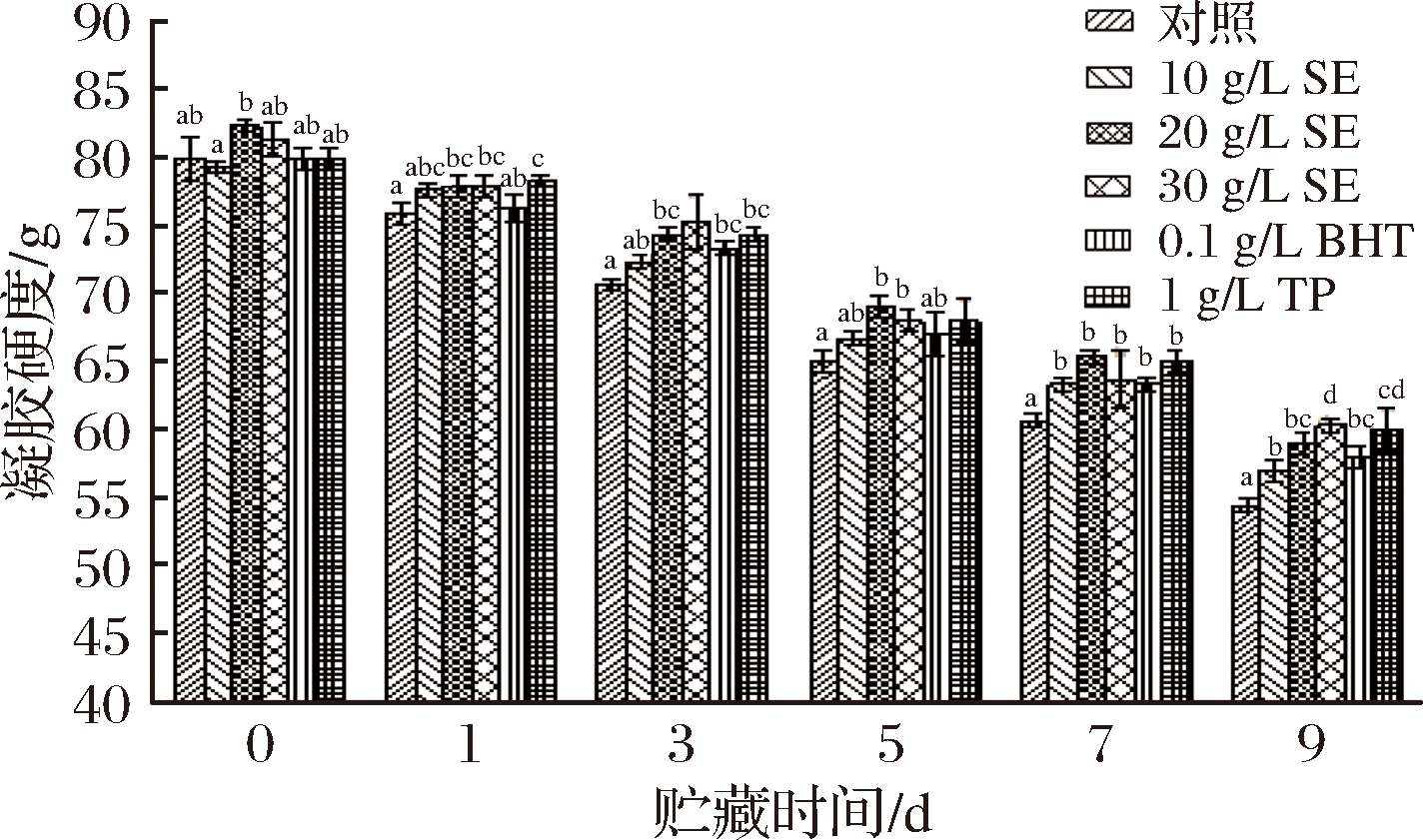
图8 冷藏条件下鲢鱼MP热诱导凝胶硬度的变化
Fig.8 Changes of MP heat-induced gel hardness of chub under cold storage
从图8可以看出,鲢鱼MP的凝胶硬度随着贮藏时间的延长均呈显著下降的趋势(P<0.05);整个贮藏期间处理组的蛋白凝胶硬度均大于对照组(P<0.05)。初期对照组和10 g/L SE、20 g/L SE、30 g/L SE、BHT、TP处理组鲢鱼MP凝胶硬度分别为80.00、79.33、82.33、81.33、80.00和80.00 g,9 d后,分别降低了32.09%、28.15%、28.34%、25.82%、27.50%和25.00%。这表明鼠尾草提取物、BHT和TP可以有效抑制贮藏过程中鲢鱼MP凝胶硬度的降低,且30 g/L SE效果最佳。鼠尾草提取物对冷藏鲢鱼MP凝胶弹性的影响如图9所示。
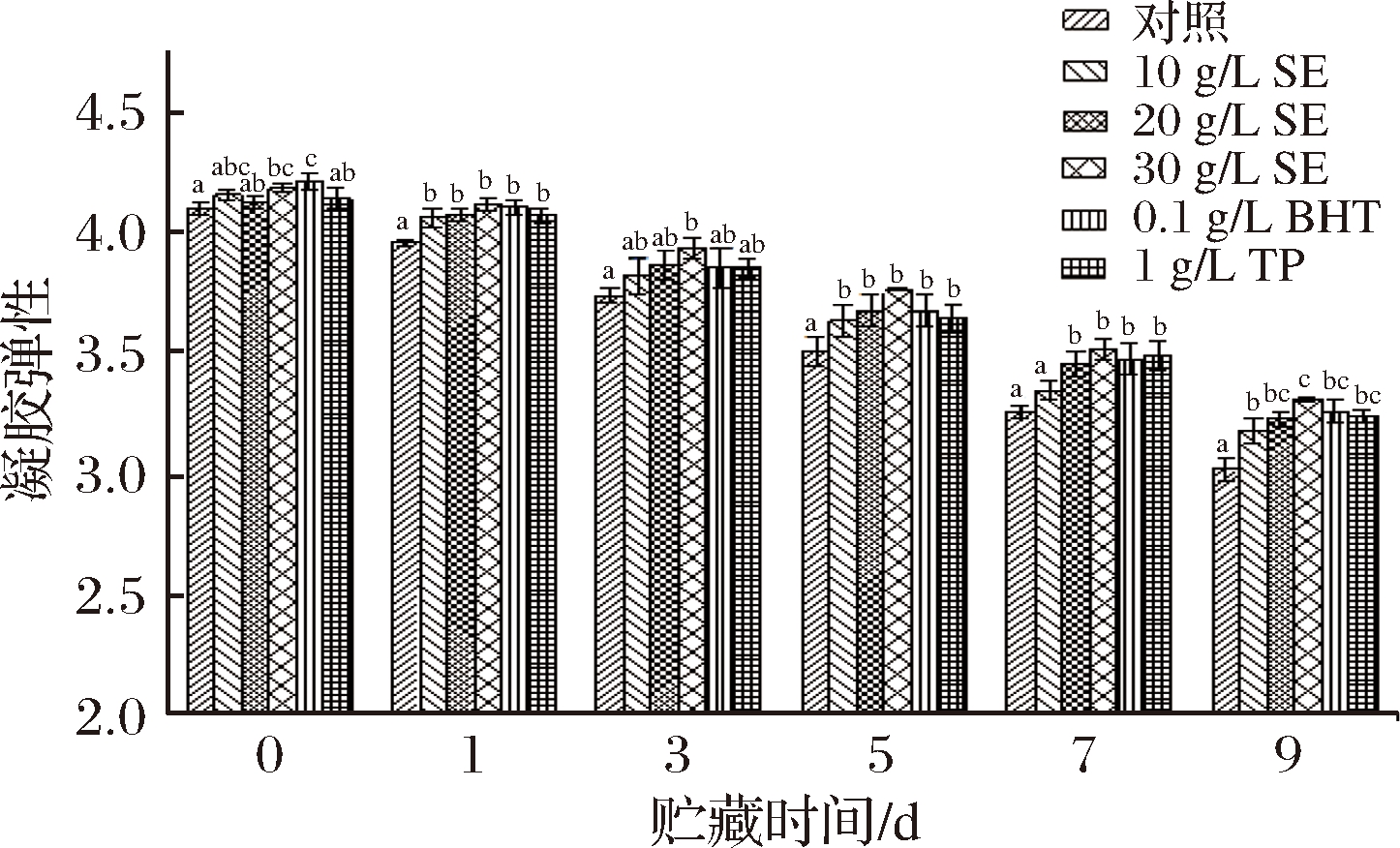
图9 冷藏条件下鲢鱼MP热诱导凝胶弹性的变化
Fig.9 Changes of MP heat-induced gel springiness of chub under cold storage
从图9中可看出,鲢鱼MP的凝胶弹性随着贮藏时间延长而显著下降大于对照组(P<0.05);整个贮藏期间处理组的蛋白凝胶弹性均(P<0.05);初期对照组和10 g/L SE、20 g/L SE、30 g/L SE、BHT、TP处理组初始凝胶弹性分别为4.10、4.16、4.13、4.19、4.22和4.15,9 d后,分别降低了26.34%、23.56%、21.79%、21.00%、22.75%和21.93%。这表明SE和BHT、TP可以显著抑制冷藏过程中鲢鱼MP凝胶弹性的减弱(P<0.05),且30 g/L SE的效果最好,但与20 g/L SE差异不显著。鲢鱼MP热诱导凝胶硬度和弹性的持续下降可能是因为在贮藏过程中肌肉组织发生了不同程度的生化反应,其内部结构(分子间作用力、官能团等)和外部条件(pH、温度等)发生了变化,蛋白质的高级结构发生改变,蛋白质间的交联程度降低,无法形成稳定的三维网状空间结构,从而蛋白质凝胶形成能力下降[30]。而处理组凝胶强度和弹性下降较缓是由于SE、BHT和TP抑制了蛋白质的氧化变性。这一结果与林静[31]研究的茶多酚对微冻泥鳅MP及鱼糜凝胶特性的影响结果一致。
2.3.2 凝胶保水性的变化
蛋白质的一些基团(主肽链基团、带电基团、Gln的酰胺基等)可与水分子结合,而其热诱导凝胶的保水性与氨基酸组成相关,水合能力与带电氨基酸数呈正相关[32]。鼠尾草提取物对冷藏鲢鱼MP凝胶保水性的影响如图10所示。
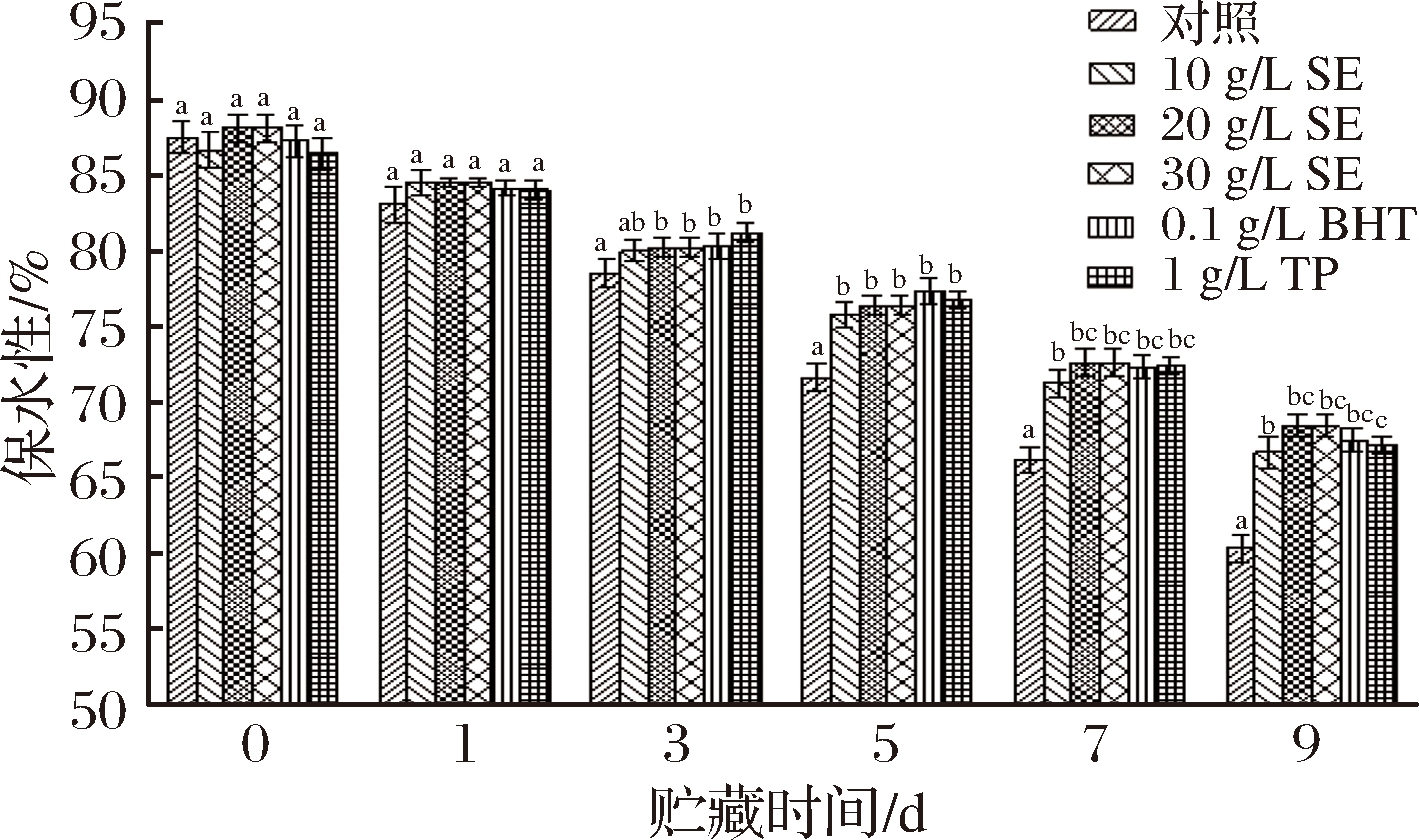
图10 冷藏条件下鲢鱼MP热诱导凝胶保水性的变化
Fig.10 Changes of MP heat-induced gel water-holding of chub under cold storage
从图10中可以看出,鲢鱼MP热诱导凝胶的保水性与贮藏时间和处理方式有关。各处理组鲢鱼MP热诱导凝胶的保水性随着贮藏时间延长均呈现下降趋势(P<0.05)。新鲜鲢鱼MP热诱导凝胶的保水性最好,为87.47%,贮藏9 d后,对照组和10 g/L SE、20 g/L SE、30 g/L SE、BHT、TP处理组的保水性分别下降了31.04%、23.84%、21.84%、21.81%、22.88%和23.28%。这可能是由于随着蛋白质的不断氧化,其空间效应和静电效应发生改变,凝胶微观结构被破坏,保水性降低[33]。于建行[34]研究表明,蛋白质随着贮藏时间的延长逐渐变性,MP中的肌动蛋白和肌球蛋白转化成肌动球蛋白,减弱了热诱导凝胶的空间三维结构,从而使得保水性下降,XIONG等[35]的研究同样表明蛋白质氧化是热诱导凝胶保水性下降的重要原因,这与本研究结果一致。
2.3.3 凝胶白度值的变化
凝胶白度值对鱼肉制品的感官评价至关重要,其变化情况与蛋白质变性程度有关[36]。鼠尾草提取物对冷藏鲢鱼MP凝胶白度值的影响如图11所示。
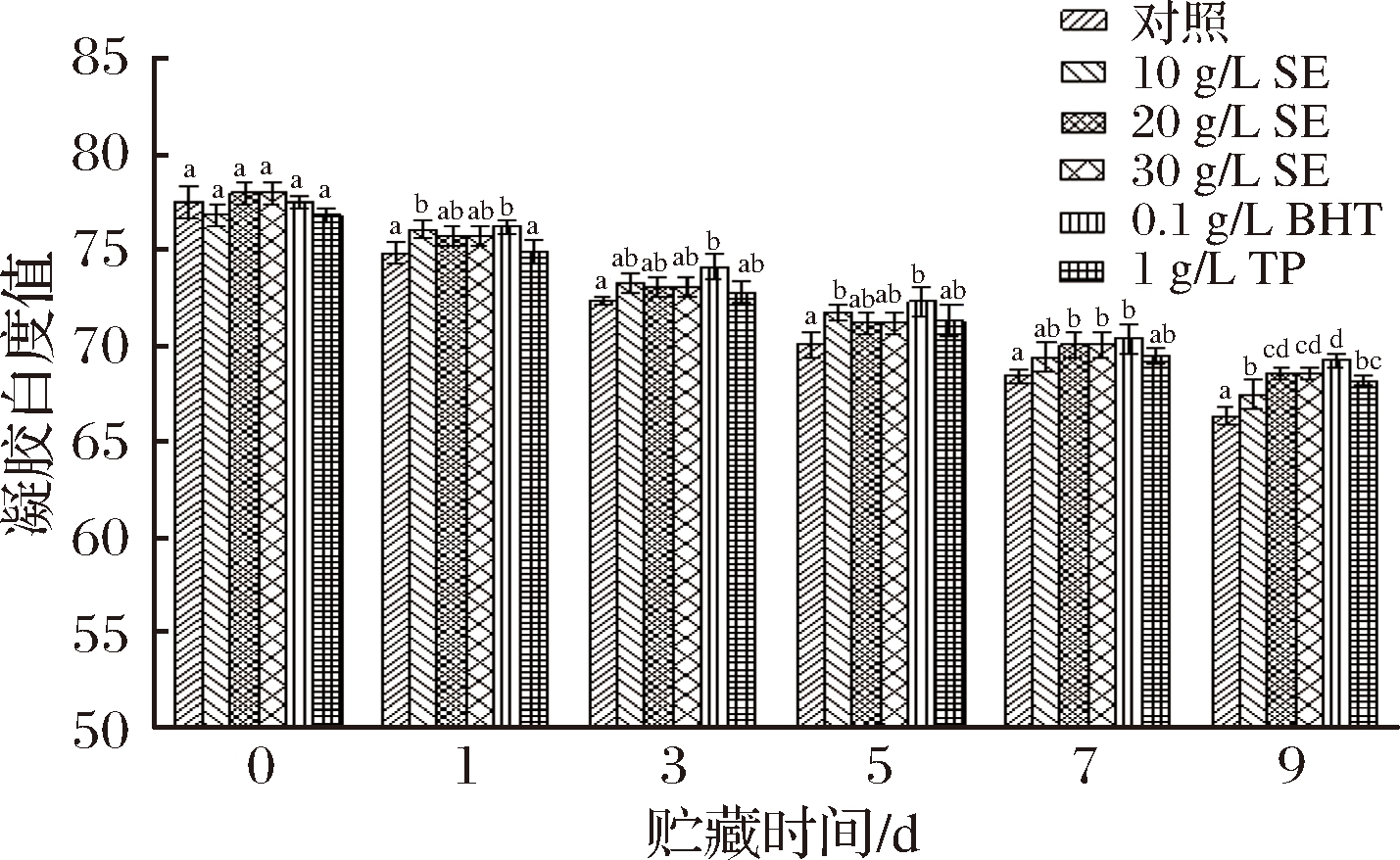
图11 冷藏条件下鲢鱼MP热诱导凝胶白度值的变化
Fig.11 Changes of MP heat-induced gel whiteness of chub under cold storage
从图11中可看出,鲢鱼MP热诱导凝胶白度值随贮藏时间延长呈持续下降趋势。新鲜鲢鱼MP热诱导凝胶白度值为77.46,贮藏9 d后,对照组和10 g/L SE、20 g/L SE、30 g/L SE、BHT、TP处理组鲢鱼MP凝胶白度值分别下降了14.43%、12.96%、11.53%、11.52%、10.64%、12.02%。处理组的凝胶白度值下降幅度要显著低于对照组,其中20 g/L SE、30 g/L SE、TP处理组凝胶白度值差异不显著(P>0.05),BHT处理组效果最佳,这可能是由于BHT能更加有效地抑制鲢鱼MP的氧化变性。另一方面,羰基含量的增加会使其与蛋白质氨基发生美拉德反应,生成有色物质从而使凝胶白度值下降[30]。还有研究表明热诱导凝胶白度值与脂肪氧化、保水性、还原酶的活性相关[37]。
3 结论
本研究通过对比发现鼠尾草提取物对冷藏鲢鱼MP的氧化具有显著的抑制作用。在整个贮藏过程中,试验组MP的溶解度、巯基含量、乳化性质、凝胶硬度和弹性、凝胶保水性和凝胶白度值下降程度均显著低于空白对照组,羰基含量和表面疏水性的上升程度显著低于空白对照组,30 g/L的鼠尾草提取物对MP氧化的抑制效果与参照组相当。综合分析表明,20 g/L的鼠尾草提取物的抗氧化效果最好,能很好地保持鲢鱼的加工品质,延长其货架期,这为鼠尾草提取物在水产品保鲜方面提供了理论支撑,同时鼠尾草作为一种安全的天然食材,来源丰富,成本低廉,其良好的抗氧化效果使得其具有较高的开发应用前景,可作为继茶多酚之后的又一天然抗氧化剂被推广。
[1] 王帮国.白鲢鱼肌肉脂肪氧合酶构象和酶学特性及其脂肪氧化调控研究[D].合肥:合肥工业大学,2017.
[2] 张进杰,阙婷婷,曹玉敏,等.壳聚糖、Nisin涂膜在鲢鱼块冷藏保鲜中的应用[J].中国食品学报,2013,13(8):132-139.
[3] 杨华,张建斌,吴晓,等.冰温贮藏对鲢、草、鲤鱼糜制品品质的影响[J].食品科学,2016,37(12):273-278.
[4] 王涛.川西鼠尾草属植物观赏资源调查与引种及果实和叶片形态学研究[D].雅安:四川农业大学,2012.
[5] SANTOS-GOMES P C, SEABRA R M, ANDRADE P B, et al. Determination of phenolic antioxidant compounds produced by calli and cell suspensions of sage (Salvia officinalis L.)[J]. Journal of Plant Physiology, 2003, 160(9): 1 025-1 032.
[6] PIZZALE L, BORTOLOMEAZZI R, VICHI S, et al. Antioxidant activity of sage (Salvia officinalis and S. fruticosa) and oregano (Origanmn onites and O. indercedens) extracts related to their phenolic compound content[J]. Journal of the Science of Food and Agriculture, 2002, 82(14): 1 645-1 651.
[7] 章林,冷雪娇,黄明.鼠尾草提取物多酚含量与抗氧化活性的研究[J].食品工业科技,2012,33(19):143-146.
[8] 李玉邯,麻莹,陈宇飞,等.鼠尾草对猪肉脯感官品质和抗氧化性能的影响[J].中国调味品,2016,41(12):55-58.
[9] MCCARTHY T L, KERRY J P, DERRY J F, et al. Assessment of the antioxidant potential of natural food and plant extracts in fresh and previously frozen pork patties[J].Meat Science, 2001, 57(2):177-184.
[10] ZHANG Z Y,YANG Y L,TANG X Z,et al. Effects of ionic strength on chemical forces heat-induced myofibrillar protein gel[J]. Food Science and Technology Research,2015,21(4):597-605.
[11] CHIN K B, GO M Y, XIONG Y L. Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel: Effect of salt level and transglutaminase incubation[J]. Meat Science, 2009, 81(3): 565-572.
[12] 刘琴.金枪鱼肌原纤维蛋白冻藏过程中生化及流变特性研究[D].上海:上海海洋大学,2013.
[13] BAHAR T, KORAY K. The effects of an iron-catalyzed oxidation system on lipids and proteins of dark muscle fish[J]. Food Chemistry,2007,104(2):754-760.
[14] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5 259) :680-685.
[15] AGYARE K K, ADDO K, XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81.
[16] AGYARE K K, XIONG Y L, ADDO K. Influence of salt and pH on the solubility and structural characteristics of transglutaminase-treated wheat gluten hydrolysate[J]. Food Chemistry, 2008, 107(3): 1 131-1 137.
[17] 李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013.
[18] SALVADOR P, TOLDRA M, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J]. Food Hydrocolloids, 2009, 23(7): 1 654-1 659.
[19] PARK J W. Functional protein additives in surimi gels[J]. Journal of Food Science, 1994, 59(3): 525-527.
[20] 牛思思,汪建明,贺雅欣,等.羟基自由基氧化对蛋清蛋白质结构的影响[J].食品工业科技,2017,38(8):113-117.
[21] 丁景,王晓君,白登荣,等.五种抗氧化剂处理对微冻贮藏泥鳅肌原纤维蛋白功能性质的影响[J].食品与发酵工业,2018,44(8):231-238.
[22] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al. The effect of antioxidants on the quality changes of cuttlefish(Sepia pharaonis) muscle during frozen storage[J]. LWT-Food Science and Technology, 2008, 41(1):161-169.
[23] 荣建华,甘承露,丁玉琴,等.低温贮藏对脆肉鲩鱼肉肌动球蛋白特性的影响[J].食品科学,2012,33(14):273-276.
[24] UTRERA M,ESTEVEZ M. Oxidation of myofibrillar proteins and impaired functionality: Underlying mechanisms of the carbonylation pathway[J]. Journal Agriculture and Food Chemistry, 2012, 60 (32): 8 002-8 011.
[25] WU S J,PAN S K,WANG H B. Effect of trehalose on Lateolabrax japonicus myofibrillar protein during frozen storage[J]. Food Chemistry,2014, 160:281-285.
[26] HERRERA J R, MACKIE I M.Cryoprotection of frozen-stored actomyosin of farmed rainbow trout (Oncorhynchus mykiss) by some sugars and polyols[J]. Food Chemistry, 2004, 84(1): 91-97.
[27] XIONG Y L, AGYARE K K, ADDO K K. Hydrolyzed wheat gluten suppresses transglutaminase-mediated gelation but improves emulsification of pork myofibrillar protein[J]. Meat Science,2008,80(2):535-544.
[28] 吕卫金,赵进,汪金林,等.茶多酚延缓冷藏大黄鱼肌原纤维蛋白变性降解机理研究[J].中国食品学报,2014,14(1):60-67.
[29] 孔保华,刘骞,陈洪生,等.肉制品品质及质量控制[M].北京:科学出版社,2015:39-41.
[30] 白登荣,董唯,齐昕宇,等.γ-聚谷氨酸对鸡肉肌原纤维蛋白功能特性的影响[J].食品与机械,2017,33(9):35-40.
[31] 林静.茶多酚处理对微冻泥鳅保鲜效果的影响[D].重庆:西南大学,2017.
[32] 雷叶斯,杨巨鹏,吕春霞,等.羟自由基氧化体系对大黄鱼肌原纤维蛋白结构的影响[J].食品工业科技,2019,40(1):29-33.
[33] 李银.蛋白氧化对肌肉保水性的影响机制研究[D]. 北京: 中国农业科学院, 2014.
[34] 于建行.泥鳅贮藏保鲜及鱼糜凝胶制备工艺研究[D].重庆:西南大学,2015.
[35] XIONG Y L, BLANCHARD S P, OOIZUMI T,et al. Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J].Journal of Food Science,2010,75(2): C215-C221.
[36] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J].Food Chemistry,2007,104(2): 746-753.
[37] 姜晴晴.冻融过程中带鱼脂肪和蛋白氧化及其对肌肉品质影响的研究[D].杭州:浙江大学,2015.