葡萄酒主要经历2个发酵过程:酒精发酵(alcohol fermentation, AF)和苹果酸-乳酸发酵(malolactic fermentation, MLF)[1],其中苹果酸-乳酸发酵是由酒酒球菌主导进行,有降低酸度、改善风味、增加生物稳定性的作用[2-3]。自然苹果酸-乳酸发酵的葡萄酒由于多种微生物共同作用,可能存在生物胺含量过高、挥发酸含量过高等问题[4-5]。为了避免这些问题,可在生产过程中使用酒酒球菌发酵剂[6-7]。冷冻干燥是制备酒酒球菌发酵剂的常用方法,但菌体容易受到损伤而导致活力下降[8-9],若在冷冻干燥过程中添加冷冻干燥保护剂则能有效降低菌体损伤,维持活力[10]。目前,我国关于酒酒球菌发酵剂及其冷冻干燥保护剂的研究较少,且过度依赖进口发酵剂,因此研究冷冻干燥保护剂对酒酒球菌发酵剂的发展有重要意义。
许多微生物在生长代谢过程中都能分泌胞外聚合物(extracellular polymeric substances, EPS),研究显示,EPS可以提高微生物在逆境中的抗性[11]。某些微生物自身产生的EPS能显著提高其对反复冷冻的抗性[12-14]。KIM等[15]从北极分离得到的细菌Pseudoalteromonas elyakovii所产的EPS能显著提高大肠杆菌的冷冻抗性。酒酒球菌产EPS可以增加葡萄酒香气种类,并能明显提高细菌的逆境抗性[16],具有成为冷冻干燥保护剂的潜力[17-18]。EPS的形成受到许多因素的影响,包括碳源、氮源、初始pH等[19-20],不同的碳氮组合显著影响细菌EPS的产量[21],且不同的乳酸菌产EPS所需条件具有菌株依赖性[22]。
本研究从实验室保藏的优良酿酒菌株中筛选得到1株高产EPS的酒酒球菌,针对该菌株产EPS的培养基条件进行优化,以提高EPS的产量。
1 材料与方法
1.1 材料
1.1.1 菌株
酒酒球菌(Oenococcus oeni)28A-1,西北农林科技大学葡萄酒学院微生物实验室保藏。
1.1.2 培养基
ATB培养基的制备参照参考文献[23]。
1.2 方法
1.2.1 酒酒球菌活化
取-80 ℃保藏的菌株接入ATB培养基,在26 ℃培养箱中培养48 h,转接2次,待用。
1.2.2 EPS提取及产量测定
参照DIMOPOULOU等[24]的方法操作,稍有改动。将培养2周的菌液离心(8 000×g,10 min)取上清,加入3倍体积95%的乙醇在4 ℃冰箱中存放过夜,离心(8 000×g,10 min)取沉淀,冷冻干燥获得酒酒球菌EPS。采用重量法测定EPS产量。
1.2.3 培养基条件对酒酒球菌EPS产量的影响
分别改变1.1.2中ATB培养基的pH值(3.8、4.3、4.8、5.3、5.8),氮源种类(胰蛋白胨、大豆蛋白胨、蛋白胨和牛肉膏)及碳源种类(木糖、乳糖、蔗糖、果糖和葡萄糖),将1.2.1活化后的酒酒球菌以4%接种量接种于不同培养条件的培养基中,按照1.2.2的方法测定酒酒球菌EPS的产量。选取最优氮源和碳源后,研究氮源含量(5、10、15、20、25 g/L)和碳源含量(5、10、15、20、25 g/L)对酒酒球菌EPS产量的影响。
培养基中的初始pH值、葡萄糖含量和蛋白胨含量对酒酒球菌生长代谢有重要影响,只有3者达到最适条件才能使酒酒球菌的活力达到最佳,EPS的产量达到最大。因此,以单因素试验中最优的初始pH、葡萄糖含量和蛋白胨含量进行对EPS产量影响的L9(33)正交试验,按照1.2.2的方法测定酒酒球菌EPS的产量,确定3个因素的最优组合。
1.2.4 冷冻干燥存活率
具体参照ZHAO等[17]的方法操作,稍有改动。取10 mL培养至稳定期的菌液离心(8 000×g,10 min)去上清,用无菌生理盐水洗涤2次。加入冷冻干燥保护剂1 mL混匀,于-80 ℃冰箱过夜后放入真空冷冻干燥机处理24 h,温度为-55 ℃,真空度<0.06 mbar。真空冷冻干燥前后活菌数采用平板计数法检测,如公式(1)。
真空冷冻干燥存活率![]()
(1)
式中:Nf,真空冷冻干燥后菌悬液活菌数,CFU/mL;N0,真空冷冻干燥前菌悬液活菌数,CFU/mL。
1.2.5 冷冻干燥保护剂对酒酒球菌抗冷冻干燥能力的影响
参考张国强[25]的方法操作,确定将质量分数为10%蔗糖、10%甘露糖、10%海藻糖、10%葡萄糖、10%乳糖、5%酵母浸粉、5%甘露醇、5%EPS、2.5%谷氨酸钠和1.1.2中的ATB培养基分别作为冷冻干燥保护剂,加入离心洗涤后的菌泥中,以水作为对照组,按照1.2.4的方法检测酒酒球菌冷冻干燥存活率。
1.2.6 场发射扫描电子显微镜和透射电子显微镜观察
通过场发射扫面电子显微镜(scanning electron microscopy, SEM)观察冷冻干燥前后酒酒球菌细胞表面的变化。冷冻干燥前的样品需离心(8 000×g,10 min)以收集稳定期前期的酒酒球菌,用无菌水洗涤3次,悬浮在体积分数为2.5%的戊二醛中,4 ℃隔夜固定后用2 mL 0.1 mol/L的PBS(pH 6.8)缓冲液浸洗4次,每次10 min。浸洗完成进行细胞脱水,用体积分数为10%、30%、50%、70%、80%和90%的乙醇溶液各浸1次,每次15~20 min,最后用100%的乙醇浸3次,每次30 min。接着干燥细胞4 h,喷金后使用扫描电子显微镜(Nova Nano SEM-450 美国)进行观察。冷冻干燥后的样品可直接喷金进行观察,无需前处理。
通过透射电子显微镜(transmission electron microscopy, TEM)观察冷冻干燥前后酒酒球菌细胞内部的变化。所有样品在脱水之前(包括脱水)的操作与TEM一致,脱水后将细菌悬浮在白胶∶乙醇(1∶1)中过夜后悬浮在白胶中处理2次,分别为3和6 h。在60 ℃条件下固定48 h,进行切片,染色,最后使用透射电子显微镜(TECNAI G2 SPIRIT BIO美国)进行观察。
1.3 数据处理
试验结果采用SPSS 20.0 分析软件(上海卡贝信息技术有限公司)进行分析。
2 结果与分析
2.1 培养基条件对酒酒球菌EPS产量的影响
培养基初始pH值、碳源、氮源对微生物生长及产物代谢均有重要的影响,对其进行优化可以显著提高目标代谢产物产量。
2.1.1 单因素试验
2.1.1.1 初始pH
酒酒球菌是一种耐受低酸环境的细菌,能够在葡萄酒酒精发酵后的低酸环境中进行MLF[15]。因此,将初始pH值控制在3.8~5.8。由图1可知,酒酒球菌EPS产量随着初始pH值的升高先升高后降低,且当初始pH值为4.3时,EPS产量最高(96.3 mg/100 mL)。说明优化初始pH值能明显提高酒酒球菌EPS的产量。在其他乳酸菌产EPS的研究中,干酪乳杆菌在初始pH值为6.5时产生的EPS量比其他试验组有明显提高[26],同样德氏乳杆菌在不同的初始pH值下所产生EPS的量也有明显差异[27]。
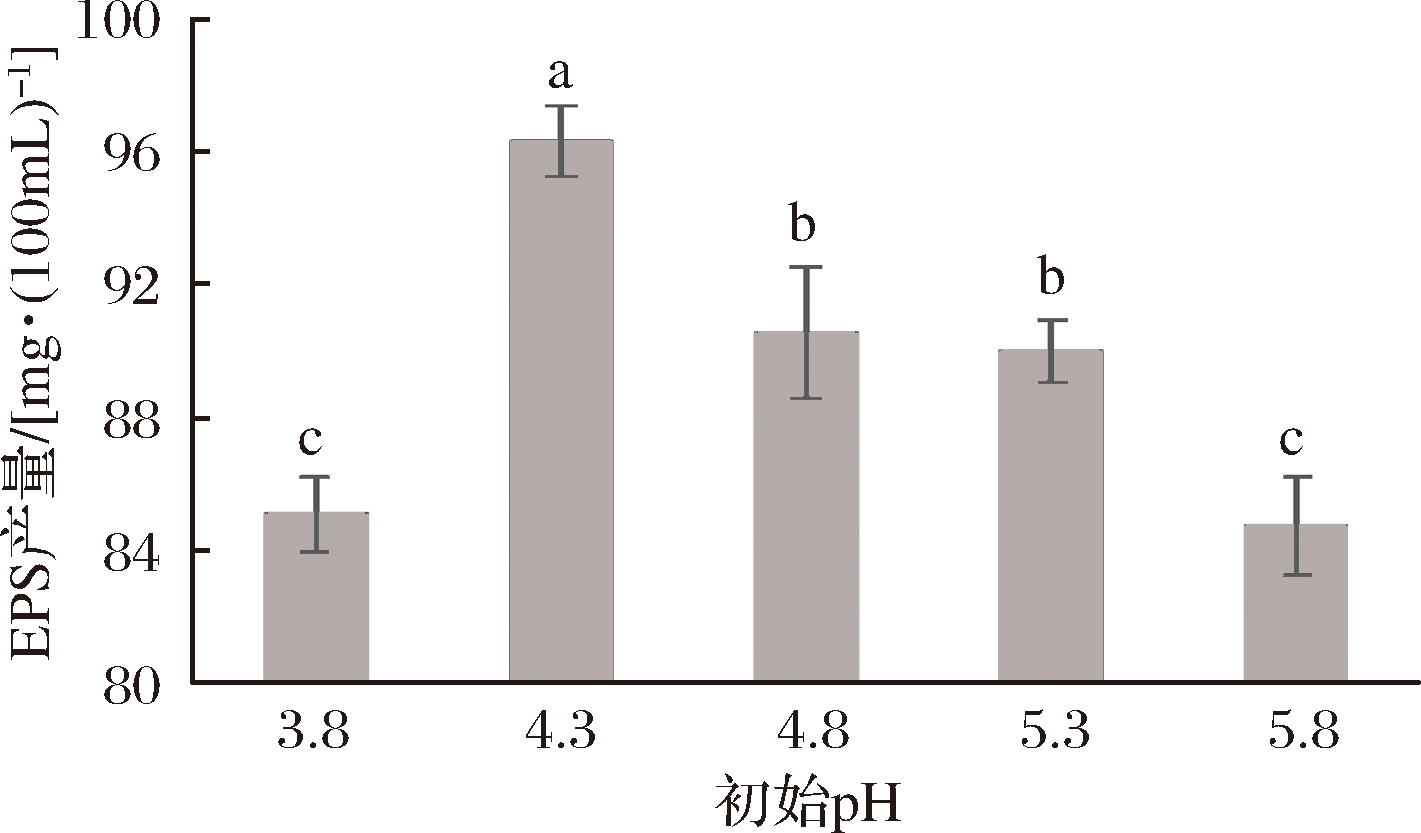
图1 初始pH值对酒酒球菌EPS产量的影响
Fig.1 Effects of initial pH value on EPS production of Oenococcus oeni
注:不同字母表示差异显著(P<0.05)。
2.1.1.2 氮源种类及氮源含量
氮元素作为构成蛋白质和核酸的主要元素之一,是微生物生长的必需因素。胰蛋白、大豆蛋白、蛋白胨和牛肉膏作为酒酒球菌生长所需氮源对EPS产量的影响见图2-a。
当ATB培养基中的氮源是蛋白胨时,酒酒球菌EPS的产量明显高于其他氮源,可以达到97 mg/100 mL。培养基的氮源种类不同,酒酒球菌EPS的产量有明显差异,可能是由于蛋白胨中的氨基酸、短肽或其他因素更适合酒酒球菌,对酒酒球菌生成EPS有明显的影响,但是蛋白胨的含量是否对酒酒球菌EPS的产量有影响还需要研究。
根据酒酒球菌常用培养基中的氮源含量,设定了5~25 g/L的梯度进行试验,由图2-b可知,酒酒球菌EPS产量随着蛋白胨含量升高先升高后降低,说明蛋白胨含量过高或过低都会减少酒酒球菌EPS的产量,且当蛋白胨含量为20 g/L时,EPS产量最高(109.7 mg/100 mL)。说明ATB培养基中选择合适的蛋白胨含量能明显提高酒酒球菌EPS的产量。该结果与KANMANI等[28]研究乳酸链球菌EPS的产量时最优氮源含量的结果一致。
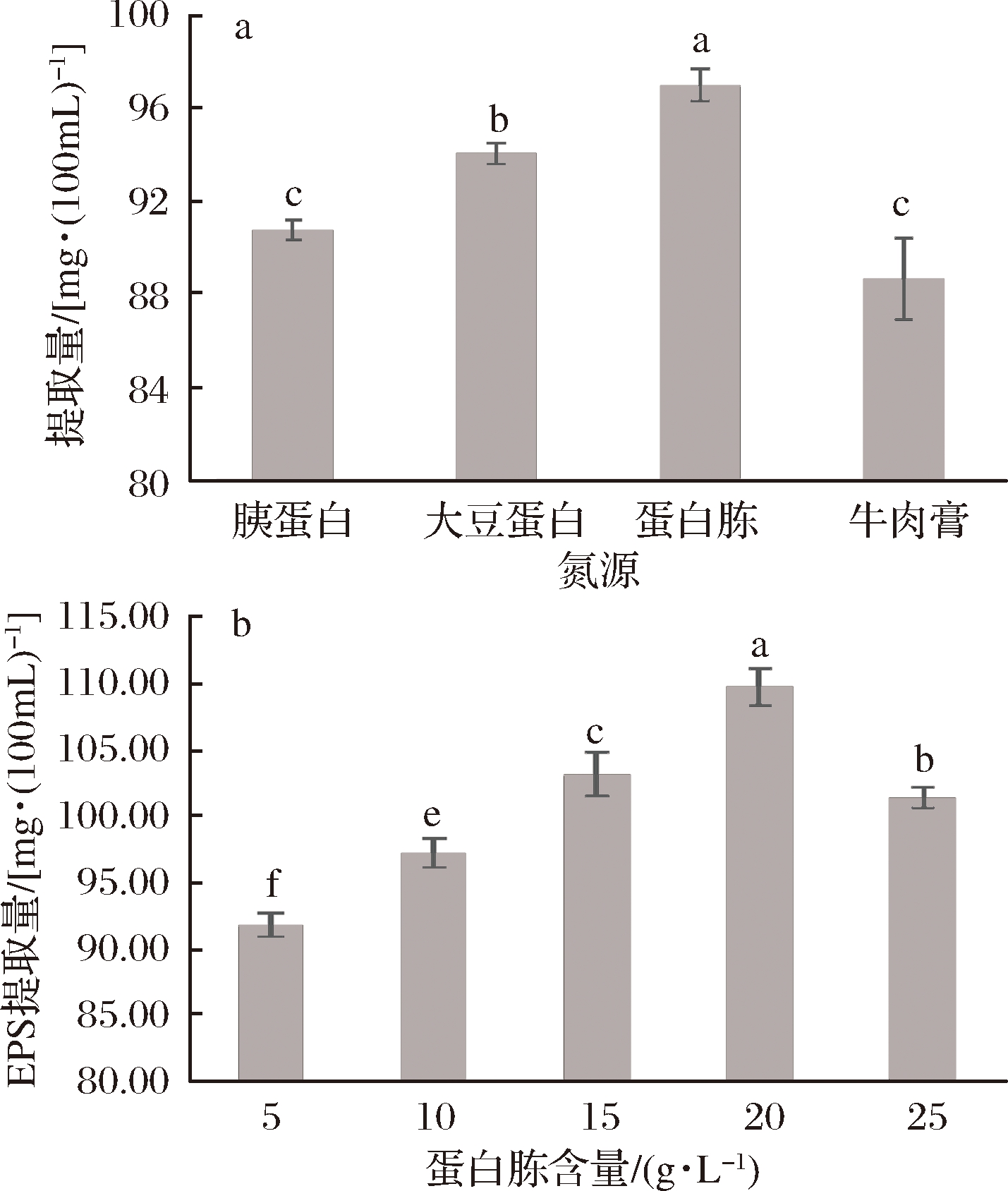
图2 氮源种类(a)及氮源含量(b)对酒酒球菌EPS产量的影响
Fig.2 Effects of nitrogen source (a) and peptone (b) on EPS production of Oenococcus oeni
注:不同字母表示差异显著(P<0.05)。
2.1.1.3 碳源种类及碳源含量
碳源作为营养成分的一种,是影响菌体EPS产量的重要因素之一[29]。本研究选取培养基中常用的碳源以相同的含量进行试验,结果由图3-a可知,当ATB培养基中的碳源是葡萄糖时,酒酒球菌EPS的产量明显高于其他碳源,达到95.6 mg/100 mL。培养基中的碳源种类不同,酒酒球菌EPS的产量有明显差异,说明碳源种类对酒酒球菌生成EPS有明显的影响,但是碳源的含量是否对酒酒球菌EPS的产量有影响还需要试验。故选取葡萄糖作为碳源,研究其含量对酒酒球菌EPS产量的影响。
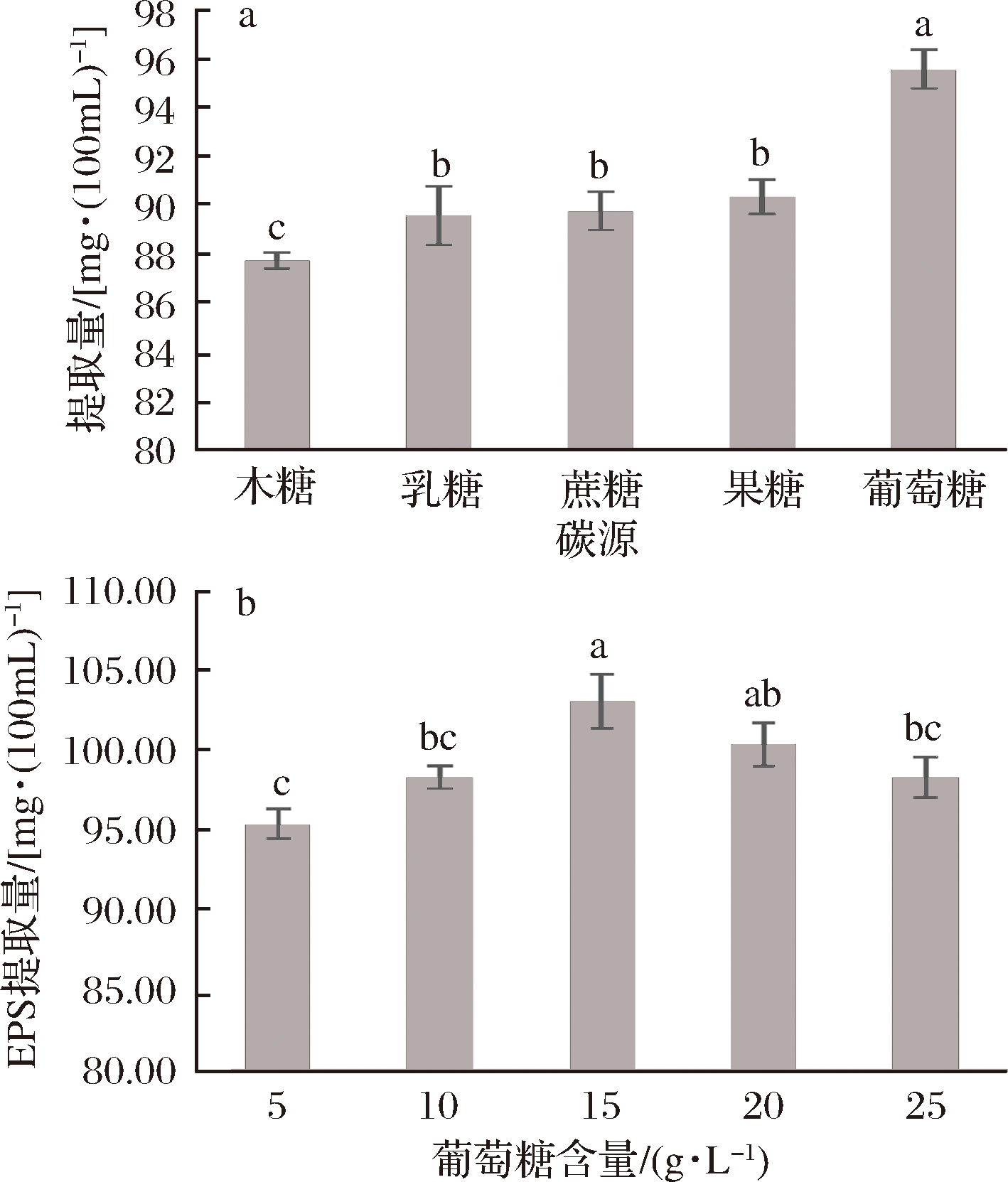
图3 碳源种类(a)及碳源含量(b)对酒酒球菌EPS产量的影响
Fig.3 Effects of carbon source (a) and glucose (b) on EPS production of Oenococcus oeni
注:不同字母表示差异显著(P<0.05)。
由图3-b可知,酒酒球菌EPS产量随着葡萄糖含量升高先升高后降低,说明葡萄糖含量过高或过低都会减少酒酒球菌EPS的产量,且当葡萄糖含量为15 g/L时EPS产量最高(103.1 mg/ 100 mL)。说明ATB培养基中合适的葡萄糖含量能明显提高酒酒球菌EPS的产量。
2.1.2 正交试验对酒酒球菌EPS产量的影响
选取单因素产量最高的初始pH、蛋白胨含量和葡萄糖含量进行L9(33)正交试验,测定各因素对结果的影响大小,并选取最优培养基条件。由表1可知,酒酒球菌EPS产量影响因素的主次顺序为B>A>C,即蛋白胨含量>初始pH>葡萄糖含量。由K值可以确定生产条件的最佳组合为A3B2C2,即初始pH值4.8、蛋白胨含量20 g/L、葡萄糖含量15 g/L,此时酒酒球菌能够生产119.7 mg/100 mL EPS,高于其他试验组。本试验结果明显高于DIMOPOULOU等[24]研究中酒酒球菌在未优化培养基中EPS的产量,对其他乳酸菌EPS产量的研究中发现正交试验能够显著提高EPS的产量[30]。说明正交试验优化对酒酒球菌EPS的产量有明显的提升作用。
用SPSS 20.0统计软件对正交试验结果进行方差分析见表2,因素A和B在P<0.05的水平上有显著性差异。
表1 正交试验对酒酒球菌EPS产量的影响
Table 1 Effect of orthogonal experiment on EPS production of Oenococcus oeni
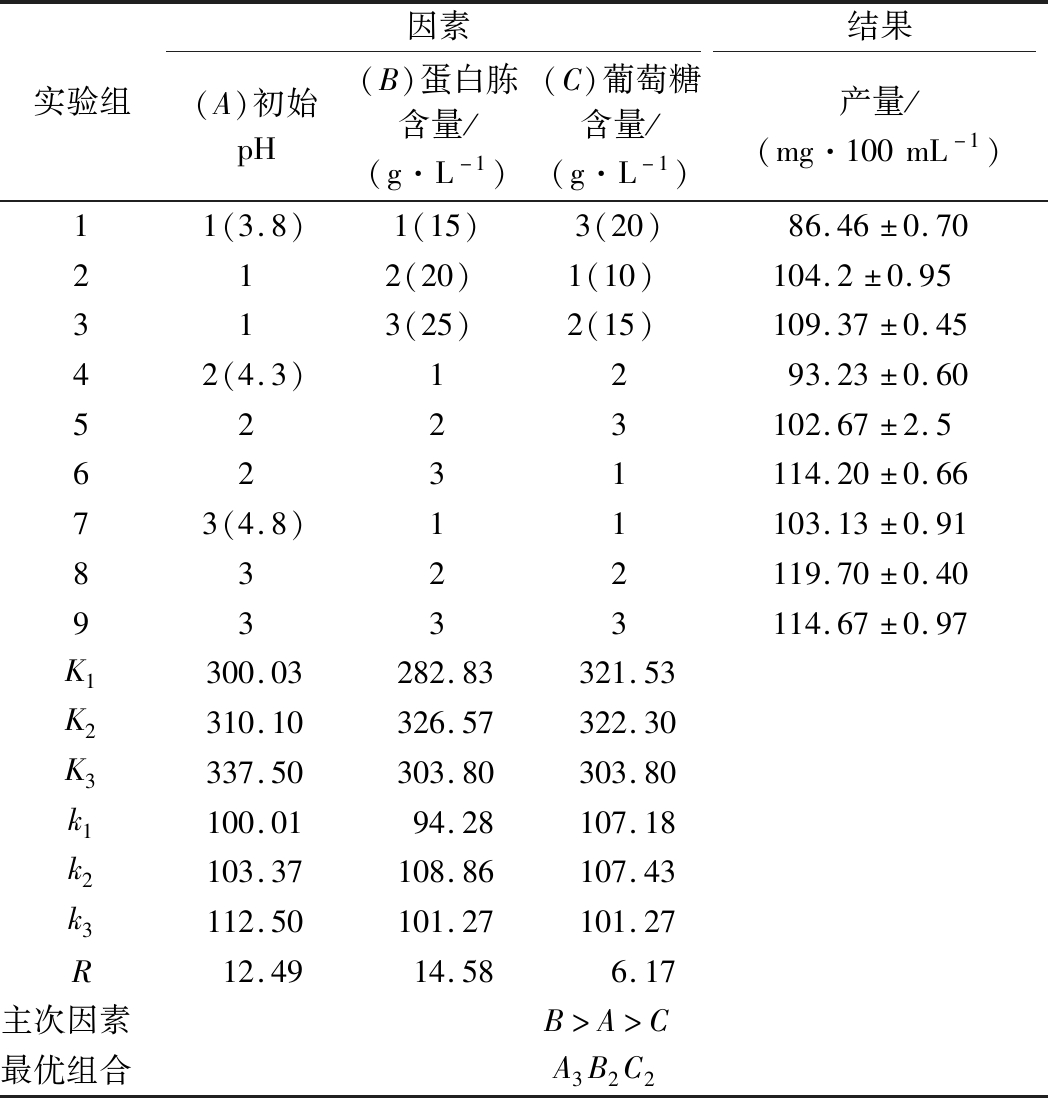
实验组因素结果(A)初始pH(B)蛋白胨含量/(g·L-1)(C)葡萄糖含量/(g·L-1)产量/(mg·100mL-1)11(3.8)1(15)3(20)86.46±0.70212(20)1(10)104.2±0.95313(25)2(15)109.37±0.4542(4.3)1293.23±0.605223102.67±2.56231114.20±0.6673(4.8)11103.13±0.918322119.70±0.409333114.67±0.97K1300.03282.83321.53K2310.10326.57322.30K3337.50303.80303.80k1100.0194.28107.18k2103.37108.86107.43k3112.50101.27101.27R12.4914.586.17主次因素B>A>C最优组合A3B2C2
表2 正交试验方差分析结果
Table 2 Analysis of variance for the orthohonal array design
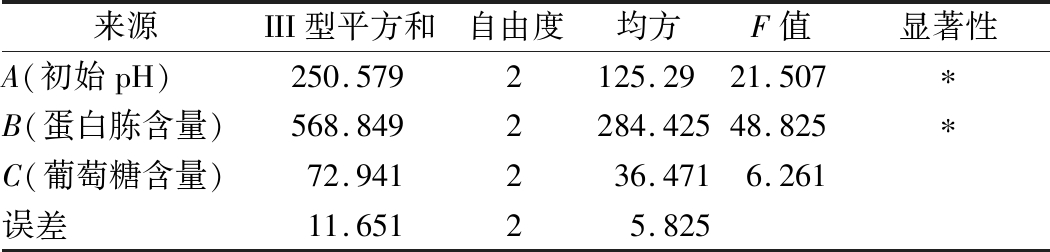
来源III型平方和自由度均方F值显著性A(初始pH)250.5792125.2921.507∗B(蛋白胨含量)568.8492284.42548.825∗C(葡萄糖含量)72.941236.4716.261误差11.65125.825
注:*差异显著(P<0.05)。
2.2 EPS抗冷冻干燥
2.2.1 冷冻干燥存活率试验
由图4可知,对照组(水)冷冻干燥酒酒球菌存活率为5.2%,添加保护剂试验组的酒酒球菌冷冻干燥存活率显著高于对照组,且不同保护剂的保护效果有明显差异。保护效果最好的4种保护剂是:10%蔗糖、10%海藻糖,、5%EPS、2.5%谷氨酸钠,存活率分别为49.62%、54.89%、70.97%和68.50%,此结果与张国强[25]的经2.5%谷氨酸钠、10%海藻糖、10%蔗糖及其他冷冻干燥保护剂冻干酒酒球菌后的存活率相近。
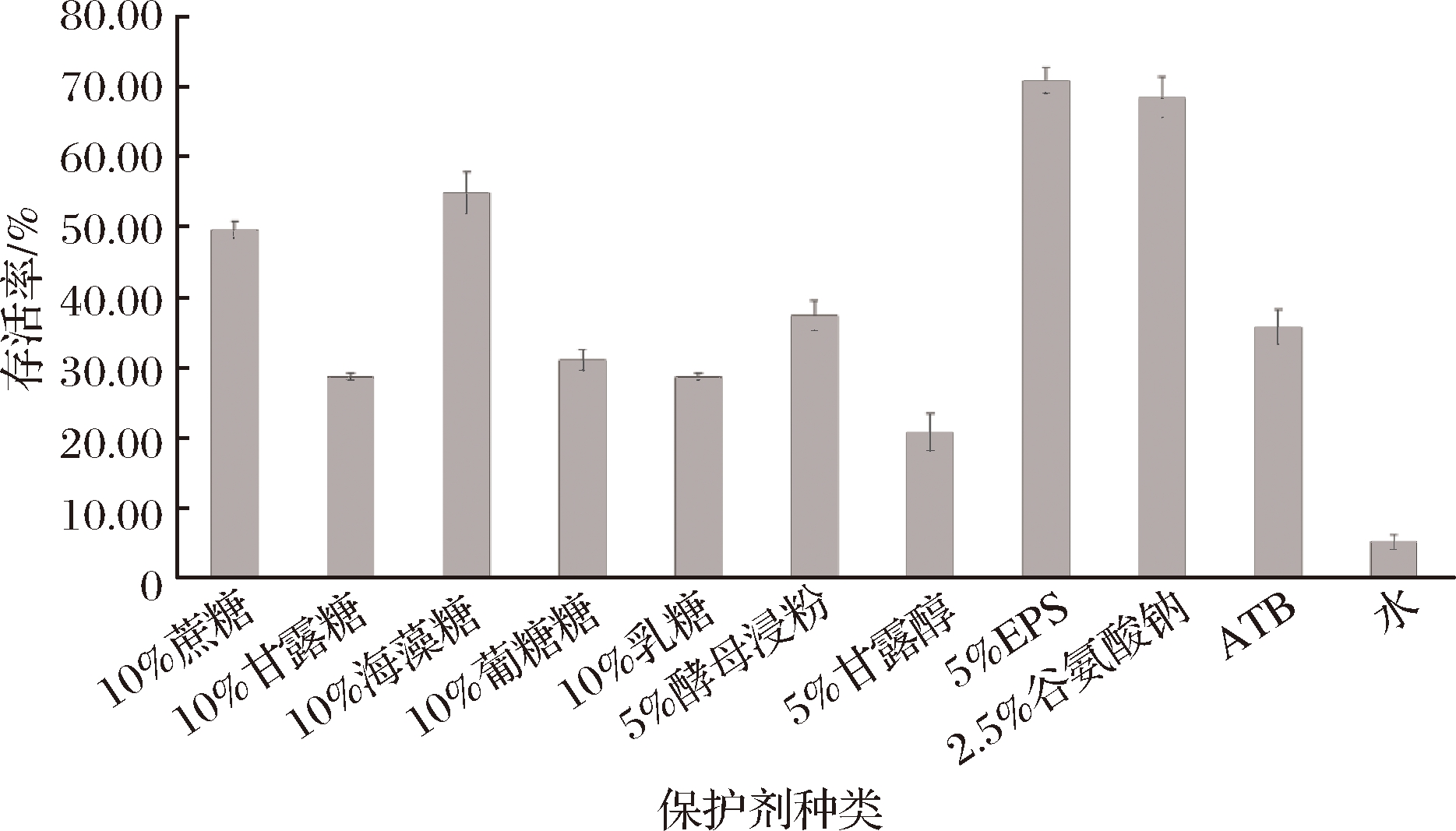
图4 不同冷冻干燥保护剂对酒酒球菌冷冻干燥存活率的影响
Fig.4 Effects of different freeze-drying protectant on survival rate of Oenococcus oeni after freeze drying
为了进一步研究4种保护效果最好的保护剂添加量对冷冻干燥存活率的影响,分别添加质量分数为5%、10%、15%、20%和25%的蔗糖和海藻糖;质量分数为0.5%、2.5%、5%、7.5%和10%的EPS和谷氨酸钠进行单一保护剂添加量的试验。
通过表3可以看出,保护剂的添加量对酒酒球菌冷冻干燥存活率影响明显,且各试验组的存活率均随着保护剂添加量的增加先升高后下降,当蔗糖、海藻糖、谷氨酸钠和EPS的质量分数分别为15%、10%、2.5%和5%时酒酒球菌存活率最高,分别达77.46%、56.72%、67.17%和73.31%。其中蔗糖在浓度优化后,其保护效果明显高于优化前,其余各保护剂的最优浓度与单因素试验结果相近。
表3 冷冻干燥保护剂添加量对酒酒球菌冷冻干燥存活率能力的影响
Table 3 Effect of the amount of freeze-dried protectant on viability of Oenococcus oeni after freeze drying
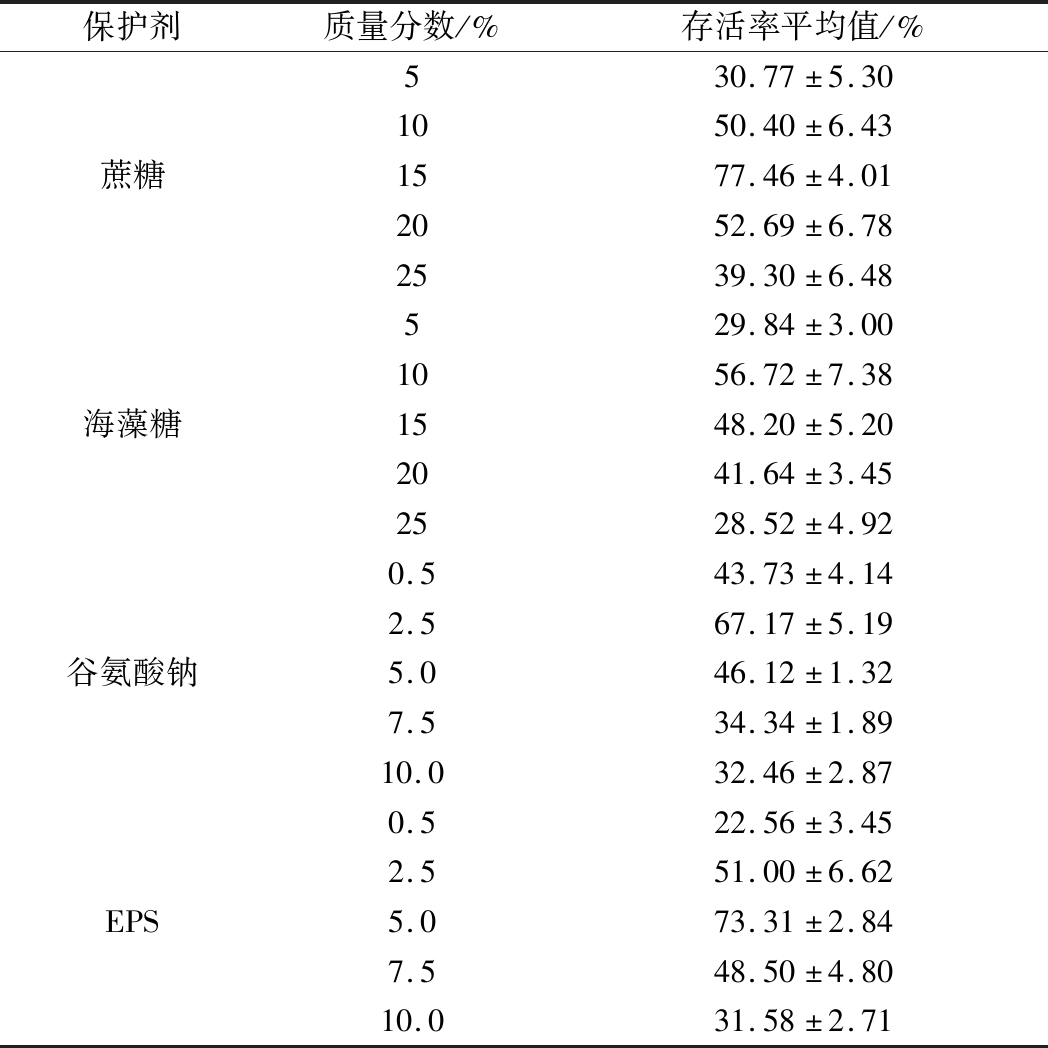
保护剂质量分数/%存活率平均值/%530.77±5.301050.40±6.43蔗糖1577.46±4.012052.69±6.782539.30±6.48529.84±3.001056.72±7.38海藻糖1548.20±5.202041.64±3.452528.52±4.920.543.73±4.142.567.17±5.19谷氨酸钠5.046.12±1.327.534.34±1.8910.032.46±2.870.522.56±3.452.551.00±6.62EPS5.073.31±2.847.548.50±4.8010.031.58±2.71
2.2.2 SEM和TEM观察结果
本试验通过SEM和TEM观察酒酒球菌不同处理下细胞内部和表面的变化,以期得到EPS冷冻干燥保护的机制。选择同为糖类且冷冻干燥存活率与EPS相当的蔗糖以及水作为对照,与EPS进行比较。
比较图5第1列发现,添加EPS试验组冷冻干燥后样品(图5-A1)呈一定厚度的片状物,表面无细胞暴露,这与蔗糖试验组(图5-B1)的结果相一致;添加水冷冻干燥后的样品(图5-C1)也呈片状但表面有大量暴露在外且被压缩成薄片的细胞,还有呈石榴状的细胞团[35],可能是这些“石榴”及“薄片”中心的细胞由于周围细胞的保护得以幸存,而位于“石榴”和“薄片”周围的细胞大量死亡,这也解释了冷冻干燥存活率试验中添加水的试验组存活率低的原因。
比较图5第2列发现添加EPS试验组(图5-A2)中拍摄到EPS的断裂层,细胞被EPS包裹如同镶嵌在EPS中,细胞表面光滑无褶皱,EPS断层表面有许多凹洞,每1个凹洞形状规则表面光滑,可能是片状物断裂后细胞掉落形成的。蔗糖实验组(图5-B2)与EPS试验组相似,但是有部分细胞有破裂现象,可能是由于蔗糖在结晶过程中会不断长大[36]导致部分细胞受到蔗糖晶体的机械损伤而破裂。在添加水的对照组(图5-C2)中可以发现“薄片”中有大量堆积在一起被压缩的细胞,图片中央的“石榴”表面的细胞有破损,且左下角有不规则的细胞,可能是破裂后的细胞。
比较图5第3、4列可以发现添加EPS试验组(图5-A3、图5-A4)中的细胞被EPS包裹,所有的细胞形态完整,未发生细胞壁破损的现象。蔗糖试验组(图5-B3、图5-B4)结果与EPS类似,但包裹细胞的保护层更薄。添加水的对照组(图5-C3、图5-C4)中的细胞有明显破裂,大量细胞内容物外泄,能看到许多细胞碎片细胞外围有少许物质包裹,推测可能是细胞产生的EPS,但产量过低,不能完全包裹细胞。

A-添加EPS的试验组;B-添加蔗糖的试验组;C-添加水的对照组;1、2列-SEM图像;3、4列-TEM图像
图5 不同处理下冷冻干燥后SEM和TEM的图像
Fig.5 The image of SEM and TEM under different processing after freeze-drying
3 结论
本试验通过酒酒球菌产EPS培养基条件的优化的研究发现,优化后的培养基能够显著提高酒酒球菌EPS的产量,并且含EPS的冷冻干燥保护剂对酒酒球菌冷冻干燥存活率有明显的提升作用,说明该保护剂能够作为高效酒酒球菌冷冻干燥保护剂。
试验结果显示,酒酒球菌EPS生产的最适碳源是葡萄糖,最适氮源是蛋白胨,且酒酒球菌EPS的产量随着初始pH、蛋白胨含量和葡萄糖含量的增加先升高后降低,在初始pH值为4.3时EPS产量最高(96.3 mg/100 mL),葡萄糖含量为15 g/L时EPS的产量最高(103.1 mg/100 mL),蛋白胨含量为20 g/L时EPS产量最高(109.7 mg/100 mL)。通过正交试验优化可得在初始pH值4.8、蛋白胨含量20 g/L、葡萄糖含量15 g/L的条件下,能够生产119.7 mg/100 mL酒酒球菌EPS。酒酒球菌冷冻干燥存活率的研究结果表明,保护效果最好的4种保护剂是15%蔗糖、10%海藻糖、5%EPS、2.5%谷氨酸钠,存活率分别为77.46%、56.72%、73.31%和67.17%。SEM和TEM的结果表明酒酒球菌EPS有冷冻干燥保护作用,能使细胞内部和外表面的形态保持完整。后续研究中,可继续深入探究EPS冷冻干燥保护的机理,以及EPS的组成和分子结构,帮助研究者了解EPS。
[1] 彭传涛, 贾春雨,文彦,等.苹果酸-乳酸发酵对干红葡萄酒感官质量的影响[J]. 中国食品学报, 2014,14(2): 261-268.
[2] 王玲, 卜潇,陈其玲,等,酒酒球菌β-葡萄糖苷酶产酶条件优化及酶学性质研究[J]. 西北农林科技大学学报(自然科学版), 2017,45(5): 130-138.
[3] 任晓宁, 张宇,陈其玲,等.不同发酵条件对模拟葡萄酒中酒酒球菌柠檬酸代谢的影响[J]. 食品工业科技, 2017,38(4): 180-185;190.
[4] LA H D V, BRAVO-FERRADA B M, DELFEDERICO L, et al. Prevalence of Lactobacillus plantarum and Oenococcus oeni during spontaneous malolactic fermentation in Patagonian red wines revealed by polymerase chain reaction-denaturing gradient gel electrophoresis with two targeted genes[J]. Australian Journal of Grape and Wine Research, 2015,21(1): 49-56.
[5] SURIANO S, SAVINO M, BASILE T, et al. Management of malolactic fermentation and influence on chemical composition of Aglianico red wines[J]. Italian Journal of Food Science, 2015, 27(3): 310-319.
[6] BERBEGAL C, BENAVENT-GIL Y, NAVASCUES E, et al. Lowering histamine formation in a red ribera del duero wine (Spain) by using an indigenous O.oeni strain as a malolactic starter[J]. International Journal of Food Microbiology, 2017, 244: 11-18.
[7] 李莹莹, 苏静,杨世玲,等.直投式酒酒球菌SD-2a发酵剂对葡萄酒品质的影响[J]. 西北农林科技大学学报(自然科学版), 2016,44(12): 192-200.
[8] CARVALHO A S, SILVA J, HO P, et al. Relevant factors for the preparation of freeze-dried lactic acid bacteria[J]. International Dairy Journal, 2004,14(10): 835-847.
[9] BRAVO-FERRADA B M, GONCALVES S, SEMORILE L, et al. Cell surface damage and morphological changes in Oenococcus oeni after freeze-drying and incubation in synthetic wine[J]. Cryobiology, 2018,82: 15-21.
[10] 陈俊亮, 张慧芸,田芬,等. 乳酸乳球菌乳脂亚种冷冻干燥保护剂优化及其贮藏稳定性[J]. 食品科学, 2014, 35(11): 109-114.
[11] MARX J G, CARPENTER S D, DEMING J W. Production of cryoprotectant extracellular polysaccharide substances (EPS) by the marine psychrophilic bacterium Colwellia psychrerythraea strain 34H under extreme conditions[J]. Can J Microbiol, 2009,55(1): 63-72.
[12] 李江, 何培青,陈靠山,等. 南极适冷菌Pseudoaltermonas sp. S-15-13胞外多糖低温保护作用的研究[J]. 海洋科学进展, 2007(2): 215-219.
[13] SELBMANN L, ONOFRI S, FENICE M, et al. Production and structural characterization of the exopolysaccharide of the Antarctic fungus Phoma herbarum CCFEE 5080[J]. Research in Microbiology, 2002, 153(9): 585-592.
[14] WU Z, KAN F W, SHE Y M, et al. Biofilm, ice recrystallization inhibition and freeze-thaw protection in an epiphyte community[J]. Applied Biochemistry and Microbiology, 2012,48(48):363-370.
[15] JIANG J, SUMBY K M, SUNDSTROM J F, et al. Directed evolution of Oenococcus oeni strains for more efficient malolactic fermentation in a multi-stressor wine environment[J]. Food Microbiol, 2018, 73: 150-159.
[16] BASTARD A, COELHO C, BRIANDET R, et al. Effect of biofilm formation by Oenococcus oeni on malolactic fermentation and the release of aromatic compounds in wine[J]. Front Microbiol, 2016,7: 613.
[17] ZHAO G Q, ZHANG G. Influence of freeze-drying conditions on survival of Oenococcus oeni for malolactic fermentation[J]. International Journal of Food Microbiology, 2009, 135(1): 64-67.
[18] DIMOPOULOU M, RAFFENNE J, CLAISSE O, et al. Oenococcus oeni exopolysaccharide biosynthesis, a tool to improve malolactic starter performance[J]. Front Microbiol, 2018,9: 1 276.
[19] 张娟, 刘丽,高侃,等. 鼠李糖乳酸杆菌Lactobacillus rhamnosus GG胞外多糖合成与提取优化研究[J]. 饲料工业, 2014,35(13): 30-34.
[20] CARUSO C, RIZZO C, MANGANO S, et al. Production and biotechnological potential of extracellular polymeric substances from sponge-associated Antarctic bacteria[J]. Appl Environ Microbiol, 2018, 84(4).
[21] 刘丽波, 李春,孟祥晨. 1株高产EPS嗜热链球菌的筛选及培养条件优化[J]. 中国食品学报, 2007,8(3): 64-68.
[22] 张立冬, 党芳芳,赵思雨,等. 影响乳酸菌生物膜形成的因素[J]. 中国乳品工业, 2016, 44(10):4-6.
[23] 杨世玲, 陈其玲,李莹莹,等. 酒酒球菌磷酸-β-葡萄糖苷酶基因的克隆及生物信息学分析[J]. 中国食品学报, 2017,17(2): 197-205.
[24] DIMOPOULOU M, BARDEAU T, RAMONET P Y, et al. Exopolysaccharides produced by Oenococcus oeni: From genomic and phenotypic analysis to technological valorization[J]. Food Microbiology, 2016, 53: 10-17.
[25] 张国强. 酒酒球菌胁迫诱导抗冷冻干燥机制研究[D]. 杨凌:西北农林科技大学, 2013.
[26] 王英, 周剑忠,黄开红,等. 益生菌干酪乳杆菌FM10-3产胞外多糖培养条件的优化[J]. 中国乳品工业, 2014. 42(2): 9-12; 17.
[27] YANG Z, LI S, ZHANG X, et al. Capsular and slime-polysaccharide production by Lactobacillus rhamnosus JAAS8 isolated from Chinese sauerkraut: Potential application in fermented milk products[J]. J Biosci Bioeng, 2010, 110(1): 53-57.
[28] KANMANI P, SATISH K R, YUVARAJ N, et al. Production and purification of a novel exopolysaccharide from lactic acid bacterium Streptococcus phocae PI80 and its functional characteristics activity in vitro[J]. Bioresour Technol, 2011, 102(7): 4 827-4 833.
[29] ZAJSEK K, GORSEK A, KOLAR M. Cultivating conditions effects on kefiran production by the mixed culture of lactic acid bacteria imbedded within kefir grains[J]. Food Chem, 2013, 139(1-4): 970-977.
[30] 于静, 曾小群,王鸿飞,等. 高产胞外多糖乳酸菌的筛选及其发酵条件优化[J]. 中国食品学报, 2015, 15(2): 93-98.
[31] ROZALI S N M, MILANI E A, DEED R C, et al. Bacteria, mould and yeast spore inactivation studies by scanning electron microscope observations[J]. Int J Food Microbiol, 2017, 263: 17-25.
[32] MOSER T H, SHOKUHFAR T, EVANS J E. Considerations for imaging thick, low contrast, and beam sensitive samples with liquid cell transmission electron microscopy[J]. Micron, 2018, 117: 8-15.
[33] WANG Y, LIU S, SU J, et al. Three novel structural phenomena in the cellular ontogeny of Oenococcus oeni from northern China[J]. Sci Rep, 2017, 7(1): 11 265.
[34] YANG K, LIU M, WANG J, et al. Surface characteristics and proteomic analysis insights on the response of Oenococcus oeni SD-2a to freeze-drying stress[J]. Food Chem, 2018, 264: 377-385.
[35] 王云. 酒酒球菌细胞个体发育过程中三种新的结构现象研究[D]. 杨凌:西北农林科技大学, 2018.
[36] 潘泽锴. 基于蔗糖结晶过程的数学建模与仿真[J]. 齐齐哈尔大学学报(自然科学版), 2018, 34(4): 65-69.