桑葚(mulberry)为桑科落叶乔木桑树的聚花果,又名桑果、桑枣[1]。桑葚很早就被当作水果和中药材使用[2],国家已将其列入药食同源物品[3]。桑葚不仅富含营养物质,如有机酸、维生素和人体必需氨基酸等[4],还含有花青素和酚类等功效成分[5]。研究表明桑葚对自由基具有明显的清除作用[6-7],还具有抗癌[8]、降血糖[9]、减少脂肪[10]等多种生理功能。传统中医认为,桑葚具有滋阴、明目、治疗失眠和神经衰弱、抗疲劳、防治便秘等功效[11]。桑葚提取物是以成熟的桑葚果实或者其加工余料为原料经提取得到的紫黑色粉末,其含有大量的花青素。
花青素属于黄酮类化合物,是自然界广泛存在的一类水溶性天然色素,广泛存在于蓝紫色果蔬中[12]。自然界中存在于植物中的花青素主要有6种:矢车菊素、飞燕草素、牵牛花素、天竺葵素、芍药素和锦葵素[13],其中桑葚中主要为矢车菊素类花青素[14-15]。目前,主要使用液质联用法对花青素中的各组分进行分离鉴定,XIANG等[16]通过液相色谱-质谱联用对桑葚中花青素进行分离与鉴定,发现桑葚中的花青素主要有矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷等。且已有研究表明,花青素具有抗氧化、缓解视觉疲劳、护肝、抗肿瘤和保护神经等作用[17-22]。
本研究使用液相色谱与质谱联用的方法对桑葚提取物中的花青素进行定性分析,并以矢车菊素-3-葡萄糖苷为标准品,测定花青素各组分的含量。同时测定桑葚提取物的DPPH、ABTS+、羟基自由基清除能力和还原力,为桑葚的开发利用提供一定理论与数据基础。
1 材料与方法
1.1 材料与仪器
桑葚提取物,尖峰天然产物有限公司;矢车菊素-3-葡萄糖苷标准品(纯度>98%),USP(美国药典);2,2’-联氨-二(3-乙基苯并噻唑- 6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothiazoline-6-sulphonate,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1- diphenyl-2-picrylhydrazyl,DPPH),美国Sigma公司;甲醇、乙腈、甲酸(色谱纯);水,超纯水;其他试剂,分析纯。
Ultimate 3000高效液相系统,美国安捷伦公司;amaZon SL离子阱质谱仪,美国Bruker公司;A20高效液相系统,日本岛津公司;EX125DZH电子天平,奥豪斯仪器(常州)有限公司;Milli-RO Plus超纯水仪,美国Millipore公司;Thermo-C18固相萃取小柱,美国Thermo公司;3020-679酶标仪,美国Thermo公司。
1.2 试验方法
1.2.1 桑葚提取物中花青素的组成及含量分析
1.2.1.1 桑葚提取物的纯化
精密称取10 mg桑葚提取物(精确至0.01 mg),置于10 mL容量瓶中,用2 %盐酸-甲醇溶解并定容,得到质量浓度为1 mg/mL的桑葚提取物溶液。
Thermo-C18固相萃取小柱先分别用5 mL甲醇溶液和5 mL水溶液清洗活化,然后加入1 mL样品溶液,抽真空至液体流尽,再用5 mL甲醇溶液洗脱,收集甲醇洗脱液。将收集的甲醇洗脱液进行氮吹至甲醇完全吹干,用2%盐酸-甲醇溶液复溶至1 mL,以备液质测定。
1.2.1.2 液相色谱及质谱条件
根据预试验结果,高效液相色谱测定条件为Ultimate 3000高效液相色谱仪,配紫外检测器;C18色谱柱(250 mm×4.6 mm,5 μm);流动相A 3%甲酸水溶液;流动相B 3%甲酸乙腈;梯度洗脱程序:0~35 min,7%~25% B;35~45 min,25%~65% B;45~46 min,65%~100% B;46~50 min,100% B;50~51 min,100%~7% B;51~60 min,7% B;柱温35 ℃;进样量20 μL;检测波长530 nm。
质谱条件:正离子模式,全自动二级质谱扫描,扫描范围m/z 0~1 000;雾化器压力30 Psi;干燥气(N2)流速8 L/min;温度230 ℃;毛细管电压3 500 V。
1.2.1.3 标准品溶液的配制及线性关系的考察
精密称取10 mg矢车菊素-3-葡萄糖苷标准品(精确至0.01 mg),置于10 mL容量瓶中,用2%盐酸-甲醇溶解并定容,得到质量浓度为1 mg/mL的矢车菊素-3-葡萄糖苷标准品溶液,避光保存。
1.2.2 桑葚提取物的体外抗氧化活性
1.2.2.1 DPPH自由基清除率的测定
称取0.198 4 g DPPH用无水甲醇溶解并定容至50 mL,配制成0.1 mmol/L DPPH储备质量浓度液。桑葚提取物用无水甲醇分别配制成质量浓度10、20、30、40、50 μg/mL的桑葚提取物溶液,准确吸取1 mL不同浓度的桑葚提取物溶液加入到3 mL 0.1 mmol/L DPPH储备液中,室温避光30 min。以去离子水为参比溶液,以Vc为对照,每组分别设置3个平行,在517 nm下测定吸光度,根据公式(1)计算DPPH自由基清除率,并计算IC50。IC50越小,清除能力越强[23]。
DPPH自由基清除率![]()
(1)
式中:A0,空白对照的吸光度;Ai,加入样品后的吸光度;Aj,样品本身的吸光度。
1.2.2.2 ABTS+自由基清除率的测定
配制ABTS+自由基储备液:将10 mL 7 mmol/L ABTS+溶液和440 μL 140 mmol/L过硫酸钾混合,在室温、避光条件下放置12~16 h,作为ABTS+储备液。用0.1 mol/L磷酸盐缓冲液(pH 7.4)稀释储备液使其在734 nm处的吸光值为(0.70±0.02)。桑葚提取物用无水甲醇分别配制成质量浓度10、20、30、40、50 μg/mL的桑葚提取物溶液。
准确吸取1 mL不同浓度的桑葚提取物溶液加入到4 mL ABTS+溶液中,在30 ℃水浴中反应6 min。以去离子水为参比溶液,以Vc为对照,每组分别设置3个平行,在734 nm处测定吸光值,根据公式(2)计算ABTS+清除率,并计算IC50[24]。
ABTS+自由基清除率![]()
(2)
式中:A0,空白对照的吸光值;Ai,加入样品后的吸光值;Aj,样品本身的吸光值。
1.2.2.3 羟基自由基清除率的测定
桑葚提取物用无水甲醇配制成质量浓度0.2、0.5、1.0、2.0及4.0 mg/mL的桑葚提取物溶液。准确吸取不同浓度的桑葚提取物溶液各1 mL,依次加入1.0 mL 9 mmol/L FeSO4溶液、1.0 mL 9 mmol/L水杨酸溶液和1.0 mL 8.8 mmol/L H2O2溶液,充分摇匀,在37 ℃水浴中反应30 min。以去离子水为参比溶液,以Vc为对照,每组分别设置3个平行,在510 nm测定吸光值,根据公式(3)计算羟基自由基清除率,并计算IC50[25]。
羟基自由基清除率![]()
(3)
式中:A0,空白对照的吸光值;Ai,加入样品后的吸光值;Aj,样品本身的吸光值。
1.2.2.4 还原力的测定
桑葚提取物用无水甲醇配制成50、100、150、200及250 μg/mL的桑葚提取物溶液。吸取不同浓度的桑葚提取物溶液各1 mL,依次加入磷酸盐缓冲液(0.2 mol/L,pH 6.6)2.5 mL和2.5 mL 1%铁氰化钾溶液,充分混匀,在50℃水浴中反应30 min后,快速冷却,加入2.5 mL 10%三氯乙酸,充分混匀,加入2.5 mL蒸馏水和0.5 mL 0.1% FeCl3溶液,充分摇匀,反应10 min。以去离子水为参比,以Vc为对照,在700 nm下测定吸光度值。还原力的大小用吸光值来表示,吸光值越大,还原力越强[26]。
2 结果与讨论
2.1 桑葚提取物中花青素的组成及含量分析
2.1.1 桑葚提取物中花青素的组成分析
桑葚提取物的液相色谱图见图1,同时结合质谱分析各物质的色谱保留时间、分子离子峰和碎片离子峰,鉴定出桑葚提取物中共有3种花青素,结果见表1。
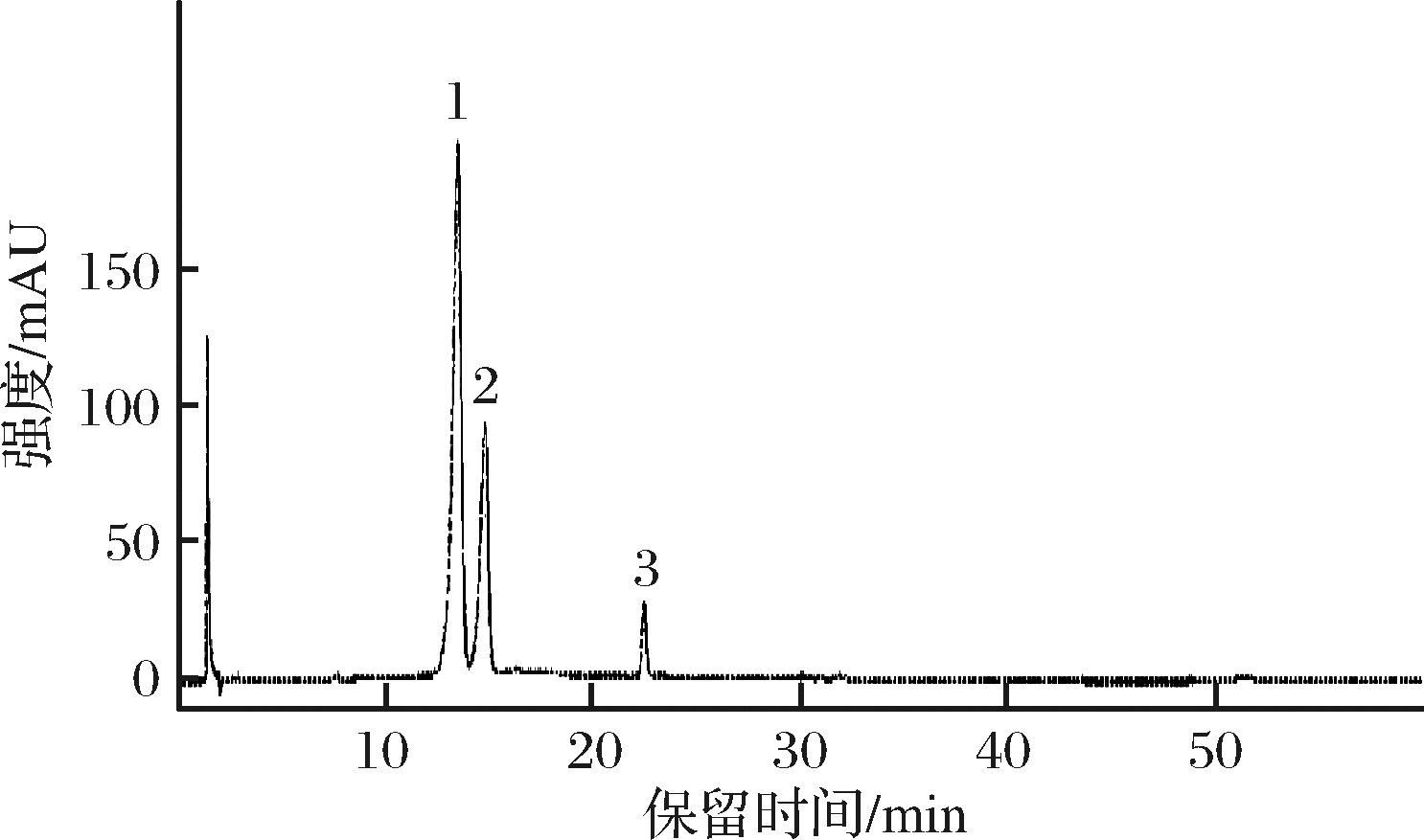
图1 桑葚提取物的液相色谱图
Fig.1 HPLC chromatogram of mulberry extract
表1 桑葚提取物花青素分析
Table 1 Anthocyanin analysis of mulberry extract

峰号保留时间/minMSMS/MS对应化合物113.5449287矢车菊素-3-O-葡萄糖苷214.8595287矢车菊素-3-O-芸香糖苷322.4287-矢车菊素
在桑葚的花青素鉴定中,据文献[27]报道,花青素大多数为矢车菊素(m/z 287)。峰1的一级质谱离子峰m/z 449,二级质谱离子峰m/z 287,据此可判断其为矢车菊类花青素。离子峰m/z 449与碎片离子峰m/z 287相差162,表明丢失1个葡萄糖苷,且峰1和矢车菊素-3-O-葡萄糖苷标准品的保留时间一致,均在13.5 min时出峰,因此可判断峰1为矢车菊素-3-O-葡萄糖苷。
由峰2的一级质谱离子峰m/z 595,二级质谱离子峰m/z 287,可判断其为矢车菊类花青素。离子峰m/z 595与碎片离子峰m/z 287相差308,表明是与芸香糖脱水缩合(缩合后质量数308)而形成,故可初步判断其为矢车菊素-3-O-芸香糖苷,与文献报道的结果一致[28-29]。
由峰3的一级质谱离子峰m/z 287,可推断其为矢车菊素单体。
2.1.2 桑葚提取物中花青素的含量分析
2.1.2.1 标准曲线的确定
分别配制质量浓度为2、5、10、25、50、100 μg/mL的矢车菊素-3-葡萄糖苷标准溶液,按照1.2.1.2中色谱条件进行测定。以矢车菊素-3-葡萄糖苷质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。峰面积与浓度具有良好的线性关系,回归方程为y=58 286x+67 727,R2=0.999 5。
2.1.2.2 精密度试验
将质量浓度为100 μg/mL的矢车菊素-3-O-葡萄糖苷标准品按照1.2.1.2中色谱条件进行测定,重复进样6次,测得色谱峰面积的相对标准偏差(RSD)为0.57%,表明在该色谱条件下精密度良好。
2.1.2.3 重复性试验
取桑葚提取物6份,按照1.2.1方法处理并进行测定,测得桑葚提取物中矢车菊素-3-O-葡萄糖苷的RSD为1.77%,表明该方法重复性较好。
2.1.2.4 加样回收率试验
在已知含量的桑葚提取物溶液中分别加入矢车菊素-3-O-葡萄糖苷标准品(5、10、25 μg/mL),连续进样3次,每次20 μL。加样回收率试验结果表明,矢车菊素-3-O-葡萄糖苷的平均回收率为99.20%,RSD为1.39%,表明该方法具有较高的加样回收率。
2.1.2.5 桑葚提取物中花青素的含量测定
通过标准品的线性回归方程计算得出3种花青素组分的含量,以平均值±SD表示,花青素各组分的含量如表2。
表2 桑葚提取物中花青素各组分的含量
Table 2 Content of anthocyanins in mulberry extract

花青素组分花青素含量/(μg·mg-1)矢车菊素-3-O-葡萄糖苷177.18±3.13矢车菊素-3-O-芸香糖苷106.59±2.06矢车菊素30.53±0.30
经计算,桑葚提取物中花青素的总含量为314.30 μg/mg。从表2中可以看出,在桑葚提取物中,矢车菊素-3-O-葡萄糖苷的质量分数是(177.18±3.13) μg/mg,占总含量的56.37%;矢车菊素-3-O-芸香糖苷的质量分数为(106.59±2.06) μg/mg,占总含量的33.91%;矢车菊素单体的质量分数最低,为(30.53±0.30) μg/mg,占总含量的9.71%。
2.2 桑葚提取物的体外抗氧化能力分析
2.2.1 DPPH自由基清除能力
桑葚提取物和Vc的DPPH自由基清除能力的测定结果如图2所示。桑葚提取物的DPPH自由基清除率随桑葚提取物浓度加大而增大,从28.72%增加到了90.07%。在同一浓度下,桑葚提取物的DPPH自由基清除能力低于Vc,当Vc浓度为20 μg/mL时,DPPH自由基清除率已达到95%以上,之后随浓度的增加趋于平稳。经计算,桑葚提取物和Vc的DPPH自由基清除率的IC50分别为22.33 μg/mL和7.35 μg/mL。根据IC50可知桑葚提取物具有良好的DPPH清除能力,但相对于Vc较弱。

图2 桑葚提取物和Vc的DPPH自由基清除能力
Fig.2 DPPH free radical scavenging ability of mulberry extract and Vc
2.2.2 ABTS+自由基清除能力
桑葚提取物和Vc的ABTS+自由基清除能力的测定结果如图3所示。在相同的质量浓度下,桑葚提取物ABTS+自由基清除能力强于Vc,且两者增长趋势类似。当两者质量浓度均为30 μg/mL时,桑葚提取物和Vc的ABTS+清除率都达到90%以上,之后随浓度的增加趋于平稳,接近100%。经计算,桑葚提取物和Vc的ABTS+自由基清除率的IC50分别为12.90和15.55 μg/mL。根据IC50可知,桑葚提取物的ABTS+自由基清除能力强于Vc。
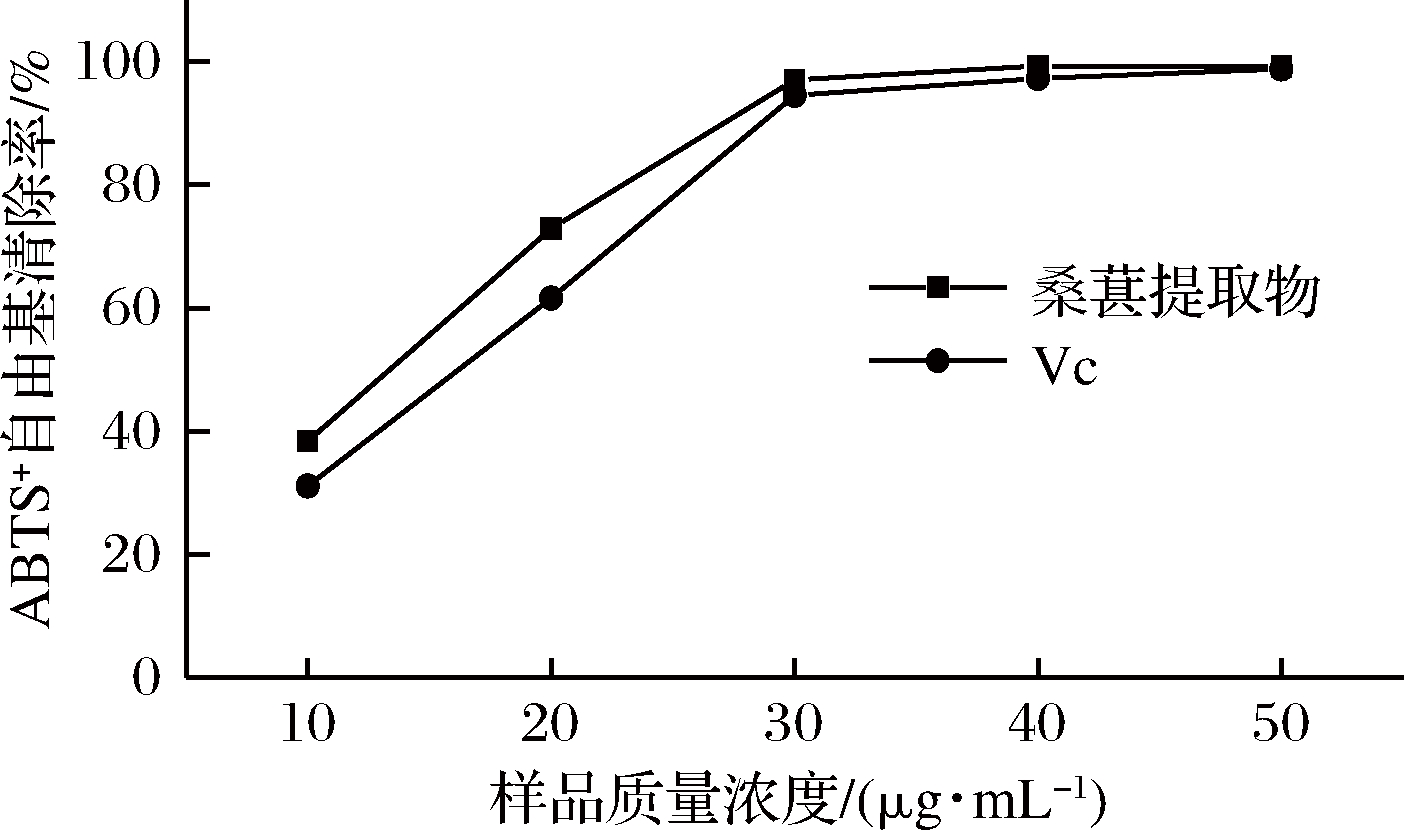
图3 桑葚提取物和Vc的ABTS+自由基清除能力
Fig.3 ABTS+ free radical scavenging ability of mulberry extract and Vc
2.2.3 羟基自由基清除能力
羟基自由基(·OH)是活性氧类物质中化学性质最活泼的一种自由基,其在自由基病理学上具有高度损伤性,几乎在每一个活细胞内都能发生,是一种危害程度最大的自由基[30]。桑葚提取物和Vc的羟基自由基清除能力的测定结果见图4。在试验浓度的测定范围内,桑葚提取物的羟基自由基清除率随浓度的增加而增加,清除率从18.46%增加到93.13%。Vc在质量浓度为1.0 mg/mL时,清除率已达到98%,后随浓度的继续增大接近100%。经计算,桑葚提取物和Vc的羟基自由基清除率的IC50分别为1.74和0.48 mg/mL。根据IC50可知,桑葚提取物有较强的羟基自由基清除能力,但是相对于Vc来说较弱。
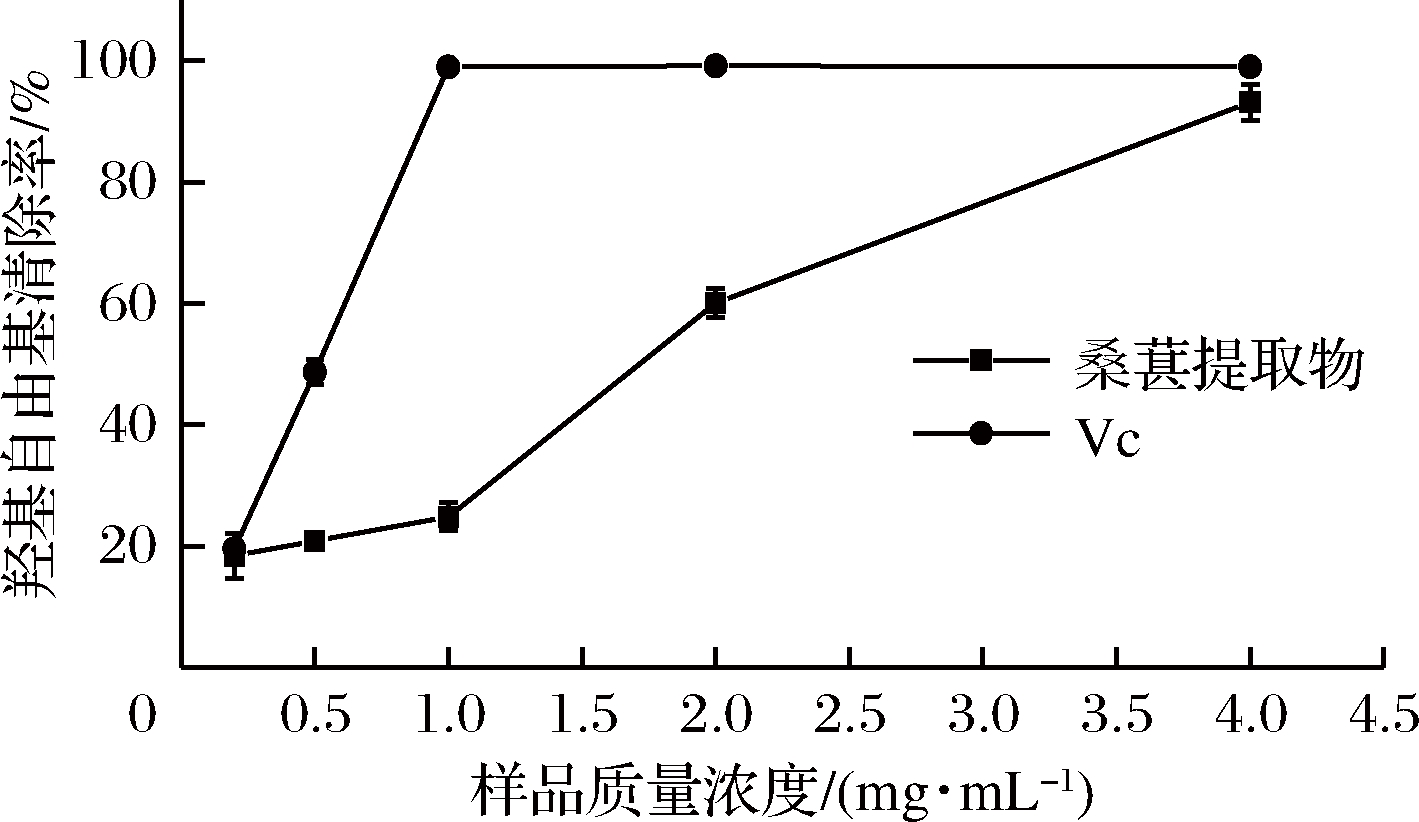
图4 桑葚提取物和Vc的羟基自由基清除率
Fig.4 Hydroxyl free radical scavenging ability of mulberry extract and Vc
2.2.4 还原力
常用还原铁氰化钾的能力来测定还原力的大小,抗氧化剂可以将Fe3+还原成Fe2+,测定700 nm处的吸光度可以反映已被还原的Fe2+数量,从而表示为还原力的大小[31]。桑葚提取物和Vc的还原力如图5所示。桑葚提取物和Vc的还原能力都随浓度增大而增大。在试验浓度范围内,经桑葚提取物还原的Fe2+的吸光度从0.043增加到0.744,而Vc对照从0.043增加到1.162,且在相同浓度下,桑葚提取物的还原力低于Vc。
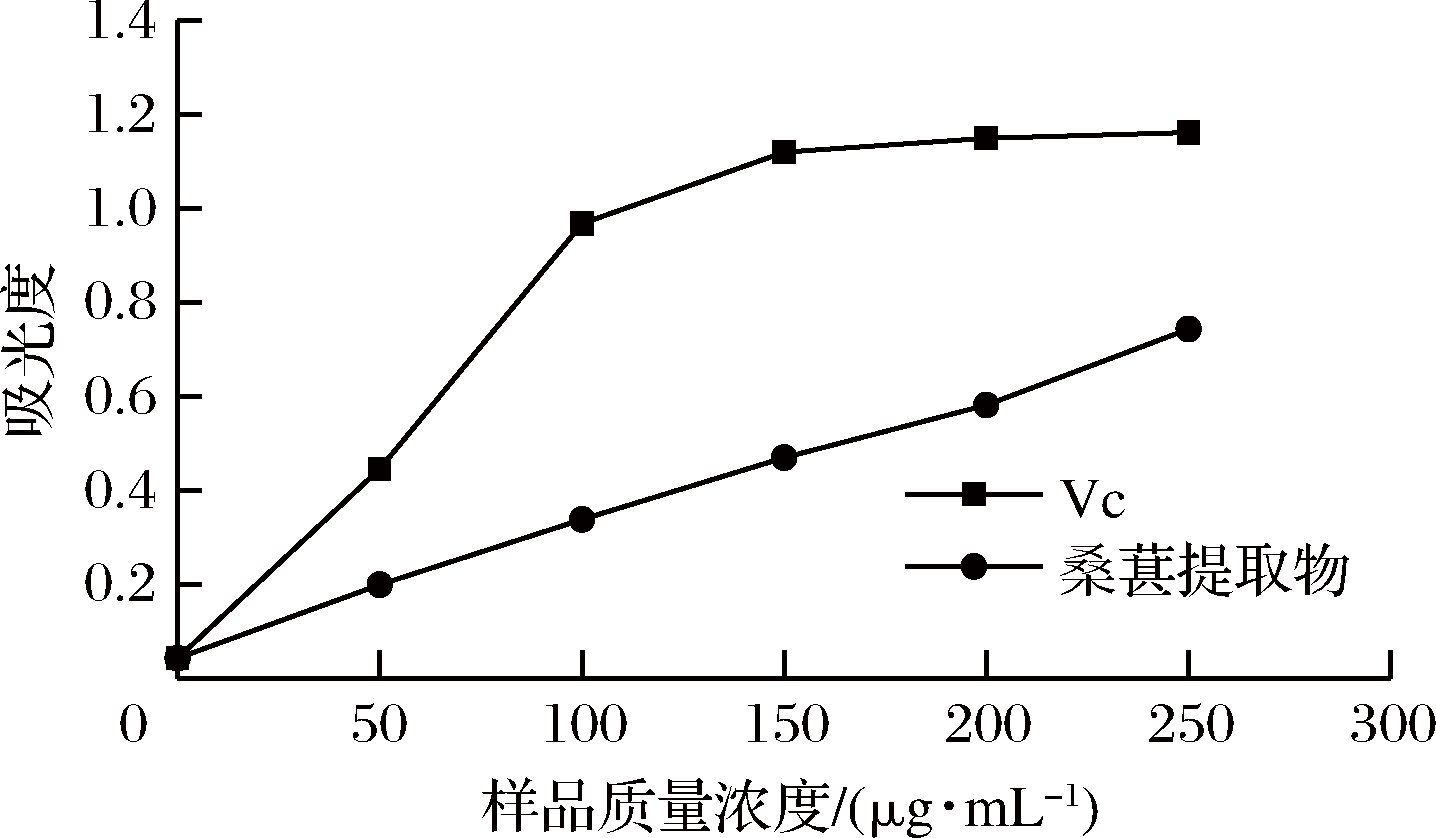
图5 桑葚提取物和Vc的还原力
Fig.5 The reducing power of mulberry extract and Vc
3 结论
本文通过液质联用法鉴定出桑葚提取物中含有3种花青素,分别为矢车菊素-3-O-葡萄糖苷、矢车菊素-3-O-芸香糖苷和矢车菊素。以矢车菊-3-O-葡萄糖苷为标品,得到桑葚提取物中总花青素含量为318.30 μg/mg,其中,矢车菊素-3-O-葡萄糖苷的含量为179.52 μg/mg,占总含量的56.40%。体外抗氧化活性试验结果表明,桑葚提取物的DPPH、ABTS+和羟基自由基清除能力的IC50分别为22.33 μg/mL、12.90 μg/mL和1.74 mg/mL,在桑葚提取物溶液浓度为250 μg/mL时还原力达到0.744。本文为桑葚提取物的开发利用提供一定理论与数据基础。
[1] 胡金奎.桑葚花色苷的分离制备、结构分析及其体外活性[D].无锡:江南大学,2013.
[2] 邱长玉,朱方容,林强.桑果的利用与开发前景[J].广西蚕业,2009,46(3):63-66.
[3] 栾琳琳,卢红梅,陈莉.桑葚花青素提取纯化研究进展[J].中国调味品,2019,44(3):156-160.
[4] 曾俊.桑葚的植物化学成分及其在食品加工中的研究进展[J].食品研究与开发,2015,7:127-130.
[5] 吴滨滨,甄丹丹,甄汉深,等.桑葚研究进展[J].亚太传统医药,2015,11(6):41-43.
[6] AJAY P K,SIVAKUMAR T R,JIN C,et al.Antioxidant and hemolysis protective effects of polyphenol-rich extract from mulberry fruits[J].Pharmacognosy Magazine,2018,14(53):103-109.
[7] RAMAN S T,GANESHAN K P G,CHEN C,et al.In vitro and In vivo antioxidant activity of flavonoid extracted from mulberry fruit (Morus alba L.)[J].Pharmacognosy Magazine,2016,12(46):128.
[8] HUANG H P,CHANG Y C,WU C H,et al.Anthocyanin-rich mulberry extract inhibit the gastric cancer cell growth in vitro and xenograft mice by inducing signals of p38/p53 and c-jun[J].Food Chemistry,2011,129(4):1 703-1 709.
[9] YAN F, DAI G, ZHENG X. Mulberry anthocyanin extract ameliorates insulin resistance by regulating PI3K/AKT pathway in HepG2 cells and db/db mice[J]. The Journal of Nutritional Biochemistry,2016,36:68-80.
[10] CHANG J J,HSU M J,HUANG H P, et al. Mulberry anthocyanins inhibit oleic acid induced lipid accumulation by reduction of lipogenesis and promotion of hepatic lipid clearance[J]. Journal of Agricultural & Food Chemistry,2013,61(25):6 069-6 076.
[11] CHEN H, GAO H, FANG X, et al. Effects of allyl isothiocyanate treatment on postharvest quality and the activities of antioxidant enzymes of mulberry fruit[J].Postharvest Biology and Technology,2015,108:61-67.
[12] 吴蔚楚.植物花青素研究进展[J].当代化工研究,2018(9):183-185.
[13] ALI H M, ALMAGRIBI W, AL-RASHIDI M N.Antiradical and reductant activities of anthocyanidins and anthocyanins, structure-activity relationship and synthesis[J].Food Chemistry,2016,194:1 275-1 282.
[14] 胡金奎.桑葚花色苷的分离制备、结构分析以及体外抗氧化活性[D].无锡:江南大学,2013.
[15] JIN Q, YANG J, MA L, et al. Comparison of polyphenol profile and inhibitory activities against oxidation and α-glucosidase in mulberry(Genus Morus) cultivars from China[J].Journal of Food Science,2015,80(11):2 440-2 451.
[16] WU Xiangyang, LIANG Linghong, ZOU Ye. Aqueous two-phase extraction, identification and antioxidant activity of anthocyanins from mulberry (Morus atropurpurea Roxb.)[J].Food Chemistry,2011,129:443-453.
[17] 姜水红,查圣华,张宏.欧洲越橘提取物制剂缓解视疲劳的功效研究[J].现代中药研究践,2014,28(6):38-40.
[18] 田野,殷中琼,唐茜. 紫嫣茶中花青素水提工艺及其提取物抗癌活性[J].安徽农业大学报, 2019,46(1):1-8.
[19] 杨洋.紫山药化学成分测定、花青素提取及抗肿瘤活性的筛选[D].西安:西南交通大学,2014.
[20] KANG T H, HUR J Y, KIM H B,et al.Neuroprotective effects of the cyanidin-3-O-[beta]-d-glucopyranoside isolated from mulberry fruit against cerebral ischemia[J].Neuroscience Letters,2006,391(3):122-126.
[21] WANG L S, STONER G D. Anthocyanins and their role in cancer prevention[J].Cancer Letters,2008,269(2):281-290.
[22] BYAMUKAMA R, KIREMIRE B T, ANDERSEN O M,et al.Anthocyanins from fruits of Rubus pinnatus and Rubus rigidus[J].Journal of Food Composition and Analysis,2005,18(6):599-605.
[23] 程勇杰,陈小伟,王珍珍,等.树莓酵素与蓝莓酵素有机酸分析及其体外抗氧化性能[J].食品工业科技,2017,20(38):142-145.
[24] 位路路,林杨,王月华,等.黑果腺肋花楸花色苷提取工艺优化及其抗氧化活性和组成鉴定[J].食品科学,2018,39(12):239-246.
[25] 章苹苹.紫薯花青素的提取、纯化及其抗氧化和益生元活性研究[D].合肥:合肥工业大学,2014.
[26] LU L Z, ZHOU Y Z, ZHANG Y Q, et al.Anthocyanin extracts from purple sweet potato by means of microwave baking and acidified electrolysed water and their antioxidation in vitro[J].International Journal of Food Science & Technology,2010,45(7):1 378-1 385.
[27] 邹堂斌,凌文华.桑葚花色苷含量测定及种类分析[J].食品研究与开发,2013(24):197-200.
[28] DU Q, ZHENG J, XU Y.Composition of anthocyanins in mulberry and their antioxidant activity[J].Journal of Food Composition and Analysis,2008,21(5):390-395.
[29] 陈亮,辛秀兰,袁其朋.野生桑葚中花色苷成分分析[J].食品工业科技,2012,15(33):307-310.
[30] 郭晓青,张晓春,陈晓靓,等.明日叶黄酮化合物清除羟基自由基活性研究[J].广州化学,2013,38(4):231-234.
[31] 周方,赵宏飞,杨洋,等.高丛蓝莓品种花青素含量与抗氧化能力比较[J].西南林业大学学报,2011,31(5):53-57.