红薯尖(sweet potato leaves)是红苕秧茎顶端及嫩叶,又称红薯叶、地瓜叶,是一种有机蔬菜,翠绿鲜嫩、味美爽口,红薯尖还具有保健功能,其富含的黄酮类化合物可抗炎防癌、抵抗氧化、延缓衰老。因此,红薯尖被誉为“蔬菜皇后”、“长寿蔬菜”及“抗癌蔬菜”。但红薯尖采摘后容易失水萎蔫、黄化褪绿、褐变、腐烂变质,常温下寿命只有2~3 d[1],这对薯尖的销售及食用品质极为不利。
乙醇熏蒸作为一种安全无毒、化学污染小的保鲜技术,可以降低果蔬生理代谢速度[2],减少果蔬营养物质消耗[3],保持高质量的果蔬品质[4]。SUZUKI等[5]用乙醇蒸汽处理西兰花,结果显示乙醇蒸汽量为7.2 g时能有效抑制乙烯的产生,维持较高的叶绿素含量,有效延长西兰花保鲜期。李勃等[6]的研究发现,用12 g酒精缓释剂处理青花菜能够最有效地控制失重率,延缓黄化速度。邢皓[7]研究了乙醇熏蒸对荷兰豆采后贮藏品质的影响,结果表明200 μL/L乙醇处理可降低腐烂发生,保持较高的好果率。RITENOUR等[8]将蜜瓜和甜瓜暴露在乙醇蒸汽中,结果表明6 mL/kg的乙醇可以保持甜瓜和蜜瓜较高的硬度,延迟软化,发挥良好的保鲜效果。目前,有关红薯尖采后贮藏及物流过程中的保鲜研究极少,更未见乙醇熏蒸处理对红薯尖的保鲜研究的报道。本试验以红薯尖为材料,对其进行乙醇熏蒸处理,研究不同浓度乙醇对红薯尖保鲜品质的影响,为解决红薯尖采后贮藏及物流过程中的保鲜问题提供科学依据。
1 材料与方法
1.1 材料与试剂
新鲜红薯尖购于重庆市北碚菜市场,该批薯尖于下午5点左右采摘,4 h内到达实验室,为防止叶片失水萎蔫,在叶片上均匀洒水,次日早7点进行乙醇熏蒸处理。薯尖的拣选标准为:色泽鲜绿饱满,叶边平整硬挺,无明显病虫害和机械损伤。
PE包装袋,35 cm×50 cm×8丝,石家庄诚胜塑业;丙酮、冰醋酸、无水醋酸钠、聚乙烯吡咯烷酮、曲拉通X—100、邻苯二酚、30%过氧化氢、二硫代苏糖醇、L-蛋氨酸、核黄素、乙二胺四乙酸二钠、氮蓝四唑、三氯乙酸、硫代巴比妥酸,成都市科龙化工试剂厂;无水乙醇(分析纯),重庆北碚化学试剂厂;聚乙二醇6 000、愈创木酚、氢氧化钠,重庆川东化工试剂公司。
1.2 仪器与设备
UV-2450PC型紫外可见分光光度计,日本岛津公司;DDS-307A型电导率仪,上海雷磁公司;Pac Check® Model 650EC型顶空分析仪,美国MOCON公司;HWS型低温恒温恒湿箱,宁波东南仪器有限公司;H1650R型台式高速冷冻离心机,湖南湘仪公司。
1.3 试验方法
选取色泽鲜绿、叶边无卷曲、大小一致、无病虫害和机械损伤的红薯尖进行处理。以泡沫箱为熏蒸单元,每箱放入挑选好的薯尖350 g(薯尖量不宜过多,以免影响箱内可利用空间体积),箱盖内部中央粘有4层叠放的纱布,分别取一定体积的95%乙醇均匀滴在纱布上,迅速封箱(动作尽量轻,防止液体滴落),于室温(25 ℃左右)下熏蒸3 h。试验中乙醇熏蒸浓度分别为20、50、100 μL/L,如式(1)所示。
乙醇浓度![]()
(1)
另设对照组,共4组。熏蒸结束后开箱通风1 h,最后将红薯尖装入PE袋,每袋(100±5)g,每组3个平行,每个平行6袋。PE袋封口放入4 ℃左右、RH 90%~95%的恒温恒湿箱中贮藏18 d,每3 d测定1次指标。
1.4 测定指标及方法
1.4.1 呼吸强度
静置法测定[9]。用顶空气体分析仪测定大气中的CO2含量,记为初始体积分数Ψ1,每个平行随机称取薯尖100 g,放入真空干燥皿,封盖,25 ℃静置1 h,测量最终CO2体积分数Ψ2。重复3次。薯尖呼吸强度根据(2)计算:
呼吸强度![]()
(2)
式中:Ψ2,薯尖在干燥皿中呼吸1 h后的CO2体积分数,%;Ψ1,大气中的初始CO2体积分数,%;V,干燥皿中密闭空间体积(排水法测定),mL;1.96,CO2摩尔质量与摩尔体积之比(=44/22.4,绝对零度);m,薯尖质量,kg;t,静置时间,h。
1.4.2 腐烂指数
红薯尖腐烂的判断依据为薯尖表面出现水渍状腐烂斑点。参照蔡佳昂等[10]的方法,根据薯尖表面出现腐烂斑点的数量可划分为4个级别标准:0级,无腐烂斑点;1级,有1~5个小面积腐烂斑点;2级,有5~10个小面积腐烂斑点;3级,腐烂斑点个数>10。红薯尖的腐烂指数采用(3)式进行计算:
腐烂指数![]()
(3)
1.4.3 电导率
参照程曦[11]的方法。
1.4.4 丙二醛(malondiadehyde, MDA)含量
参照MOSTAGHIMI等[12]的方法且稍作修改。称取1.0 g样品,置于研钵中,加入5 mL 100 g/L TCA溶液,室温(25 ℃)研磨匀浆后,于4 ℃、10 000 r/min离心20 min,收集上清液,低温保存备用。取2 mL上清液(对照空白管以100 g/L TCA溶液2 mL代替提取液),加入2 mL 0.67% TBA,混合后在沸水浴中煮沸20 min,取出冷却再离心20 min。分别测定上清液在450、532、600 nm处的吸光度。重复3次。
1.4.5 多酚氧化酶(polyphenol oxidase, PPO)活性
参照曹建康等[13]方法测定,稍加改动。称取1.0 g薯尖叶片(避开粗脉取样),置于研钵中,加入5 mL提取缓冲液(1 mmol PEG、4% PVPP和1% Triton X-100),在冰浴条件下研磨成浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液,于4 ℃低温保存备用。往试管中加入4.0 mL 0.05 mol/L磷酸缓冲液(pH 6.8)、1.0 mL 50 mmol/L邻苯二酚溶液、100 μL酶提取液。以蒸馏水为参比,记反应体系在波长420 nm处吸光度,测定120 s,制作OD420值随时间变化曲线。重复3次。
1.4.6 超氧化物歧化酶(superoxide dismutase, SOD)活性
酶液提取时提取缓冲液含5 mmol/L DTT、5% PVP和pH 7.5磷酸钠缓冲液,其他步骤同PPO。测定方法:取5支试管,分别加入1.7 mL 50 mmol/L pH 7.8磷酸缓冲液、0.3 mL 130 mmol/L L-蛋氨酸、0.3 mL 750 μmol/L氮蓝四唑溶液、0.3 mL 100 μmol/L EDTA-Na2溶液,最后加入0.3 mL 20 μmol/L核黄素溶液和0.1 mL酶提取液(2支对照管中以50 mmol/L pH 7.8磷酸缓冲液代替)。混匀后将1支对照管置于暗处,其他各管置于30 W日光灯下反应30 min后立即取出,并放于暗处终止反应。以暗处光管为参比调零,于560 nm波长处测其他各管吸光度。重复3次。
1.4.7 过氧化氢酶(catalase, CAT)活性
酶液提取时提取缓冲液含5 mmol/L DTT、5% PVP和pH 7.8磷酸钠缓冲液,其他步骤同PPO。测定方法:向试管中加入20 mmol/L H2O2溶液2.9 mL和酶提取液50 μL。以蒸馏水为参比,在波长240 nm处测吸光度,测定180 s,制作OD240值随时间变化曲线。重复3次。
1.4.8 过氧化物酶(peroxidase, POD)活性
酶液提取方法同PPO。测定方法:往试管中加入3 ml 25 mmol/L愈创木酚溶液、25 μL酶提取液和200 μL 0.5 mol/L H2O2。以蒸馏水为参比,记反应体系在波长470 nm处吸光度,测定80 s,制作OD470值随时间变化曲线。重复3次。
1.4.9 叶绿素含量
参照YANG等[14]测定叶片的方法,用分光光度计测定。用打浆机将薯尖叶片(避开粗脉)打成细小均匀的碎片,称取1.0 g置于100 mL三角瓶中。加入20 mL乙醇与丙酮混合液(比例1:1,现配现用),保鲜膜封口并用橡皮筋固定,放置于暗处反应24 h后过滤。以乙醇与丙酮混合液为空白参比调零,用1 cm光径比色皿测定645、663 nm处吸光度,并计算叶绿素含量。重复3次。
1.4.10 感官评分
参照张学杰等[15]方法,稍作改动。感官评定小组由经过专门训练的5人组成,分别从薯尖的颜色、质地、形态、气味和水渍5个方面进行评分,加权平均,每项的加权系数均为0.2,满分为5分。表1为评分标准。
表1 红薯尖感官评分标准
Table 1 Sensory evaluation standard of sweet potato leaves

指标5分4分3分2分1分颜色鲜绿浅绿黄化<10%黄化<30%黄化>30%质地新鲜、脆较新鲜、较脆软、韧<10%软、韧<30%软、韧>30%形态饱满、硬挺较饱满、较硬挺萎蔫、疲软<10%萎蔫、疲软<30%萎蔫、疲软>30%气味蔬菜清香味清香味变淡轻微异味异味加重明显腐臭味水渍无轻微水渍水渍程度<10%水渍程度<30%水渍程度>30%
1.5 数据处理
采用Microsoft Excel 2010进行数据处理,用SPSS 22进行统计分析,使用最低显著性差异法(LSD)进行显著性差异检验,显著性水平为0.05,制图使用Origin 8.6软件。
2 结果与分析
2.1 乙醇熏蒸对红薯尖呼吸强度的影响
如图1所示,薯尖经乙醇处理后呼吸强度呈先上升后下降的趋势。前3 d,乙醇处理组的呼吸强度较低。从第 6天起100 μL/L组均高于CK组,可能原因是乙醇浓度太高,熏蒸时大量渗入细胞,使乙醇在薯尖体内过量积累,贮藏期间逐渐削弱薯尖抵抗力[16],加快腐烂进程,导致呼吸强度升高,这与张洪翠等[17]发现600 μL/L乙醇熏蒸会使双孢蘑菇呼吸强度升高的结果一致。前9 d,20、50 μL/L处理组与CK组具有极显著差异(P<0.01)。CK组和100 μL/L处理组均在第9天达到峰值;20 μL/L和50 μL/L处理组均在第9天后出现呼吸高峰,峰值也低于前2组,说明适宜浓度的乙醇可以延缓薯尖呼吸高峰出现的时间并降低峰值。生物体呼吸作用会产生活性氧,活性氧随着呼吸代谢的加强蓄积在细胞中,可攻击细胞生物膜,与生物体内的核酸、蛋白质和脂质等发生反应损害生物体机能[18-19]。乙醇熏蒸通过降低呼吸作用,减少活性氧自由基的产生,减小了生物体损伤。另有研究表明乙醇处理可以抑制双孢蘑菇[17]、茎瘤芥[20]和西兰花[21]的呼吸强度。
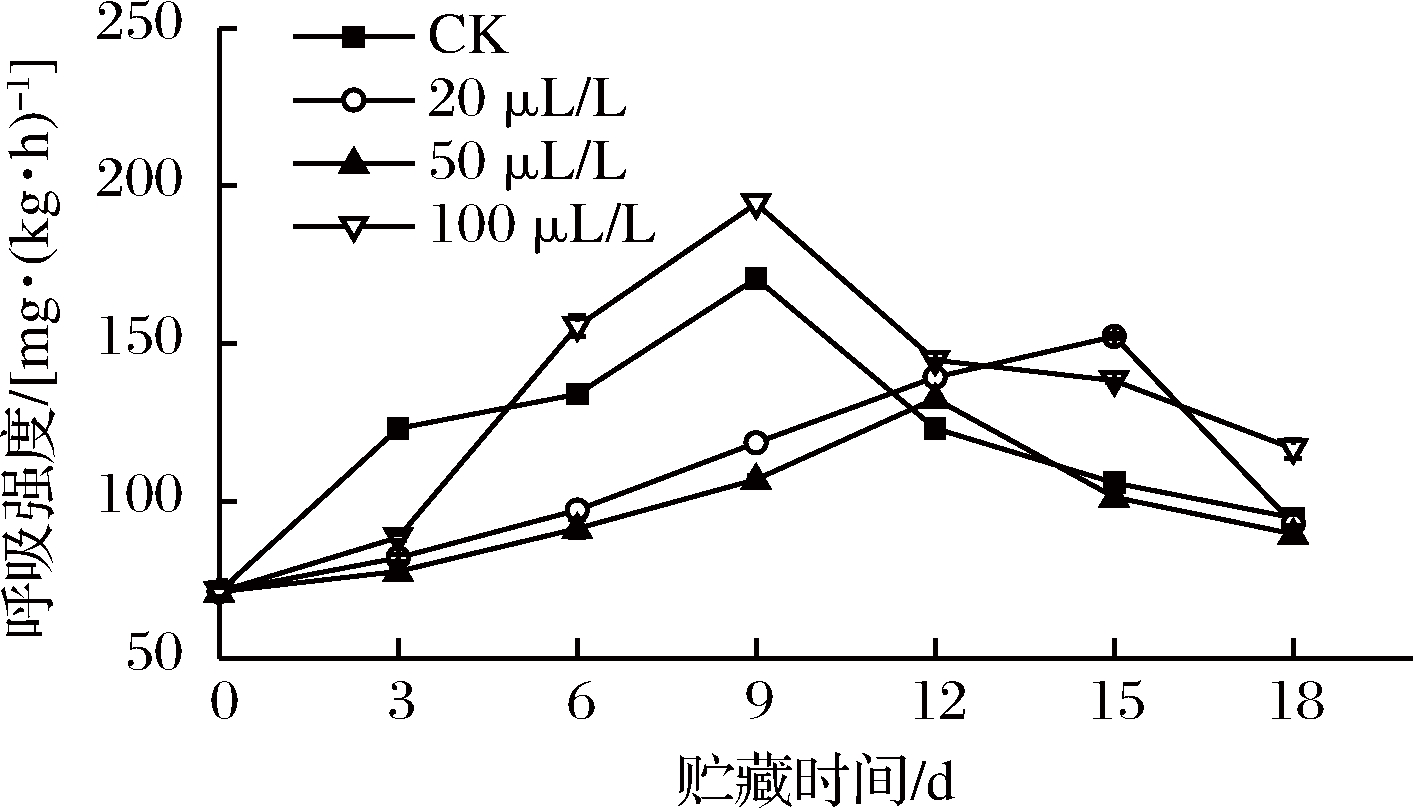
图1 乙醇熏蒸对红薯尖呼吸强度的影响
Fig.1 Effects of ethanol fumigation on respiratory intensity of sweet potato leaves
2.2 乙醇熏蒸对红薯尖腐烂指数的影响
薯尖水分多、组织脆嫩,招致微生物侵害引起叶片腐烂,薯尖的生理机能易被破坏[22]。由图2可知,在整个贮藏期间,薯尖的腐烂指数呈上升趋势。第3天,CK组已出现小面积腐烂斑点,乙醇处理组均无明显腐烂现象,3个处理组腐烂指数分别为0.53%、0.31%、0.62%,三组间差异尚不显著(P>0.05)。6 d后薯尖腐烂速率加快,50 μL/L组显著(P<0.05)低于20 μL/L组,极显著(P<0.01)低于CK组和100 μL/L组。18 d时,4组的腐烂指数依次为35.1%、21.3%、10.4%、39.5%。由此可见,50 μL/L乙醇熏蒸在延缓薯尖腐烂上效果最佳。程曦等[11]研究发现无氧呼吸会加速腐烂,因此适宜浓度的乙醇熏蒸可以通过减弱呼吸作用,延迟无氧呼吸,从而减慢腐烂速率。
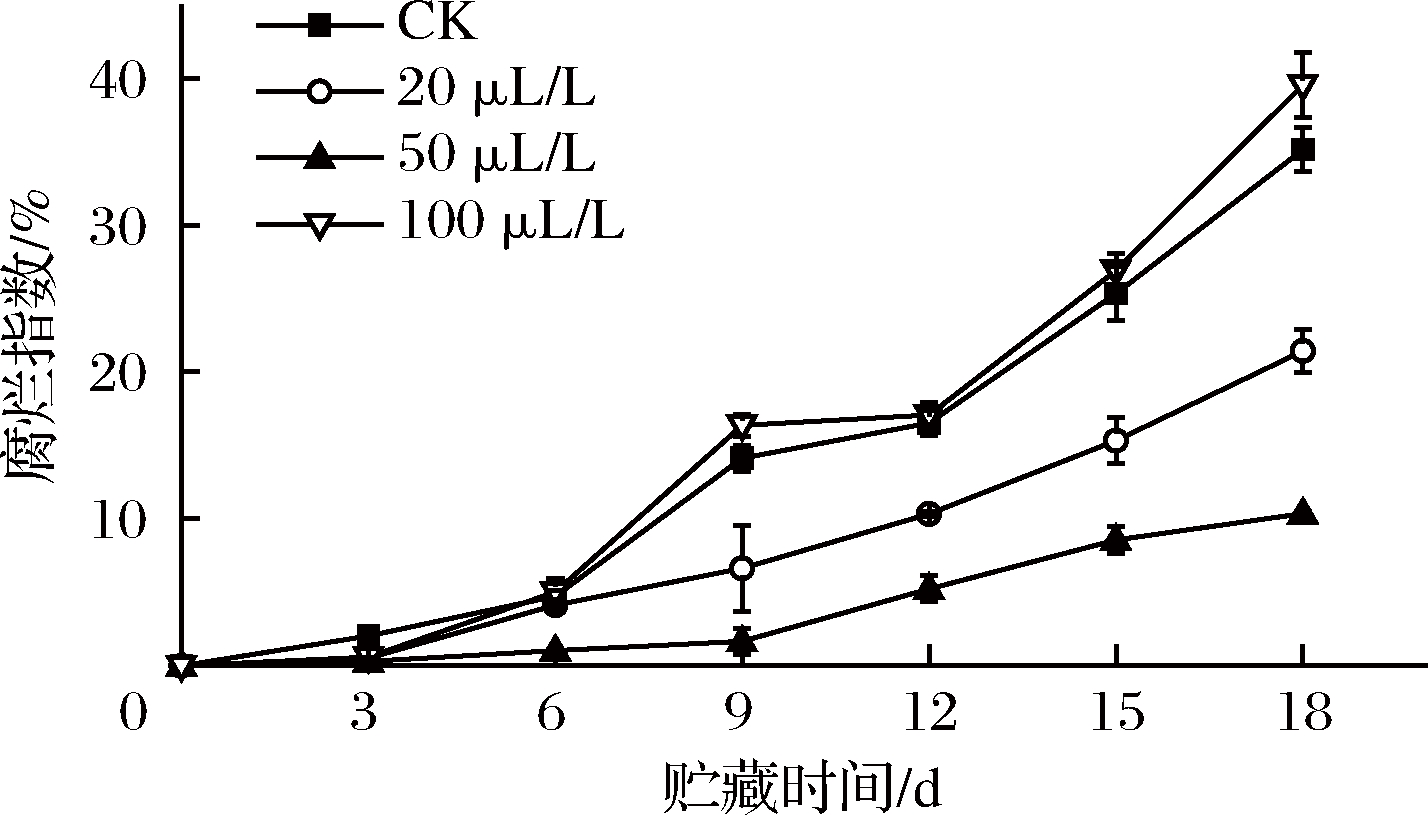
图2 乙醇熏蒸对红薯尖腐烂指数的影响
Fig.2 Effects of ethanol fumigation on decay index of sweet potato leaves
2.3 乙醇熏蒸对红薯尖相对电导率的影响
贮藏期间,各处理组电导率呈上升趋势。前9 d,50 μL/L组与CK组之间差异并不显著(P>0.05);12~18 d,50 μL/L组电导率显著(P<0.05)低于CK组。第15天,100 μL/L组电导率显著(P<0.05)高于其他3组。贮藏结束时,100 μL/L组的电导率最大,表明此时100 μL/L组薯尖细胞受损伤最大,难以维持细胞的完整性,这可能与乙醇浓度过高加快细胞原生质膜破裂,使离子泄露增加相关[23]。如图3所示,50 μL/L组的电导率始终低于其他3组,20 μL/L组在贮藏后期仍然能减缓电解质渗出,因此20和50 μL/L组均能够有效维持薯尖细胞完整性。李江阔等[24]研究发现,处于厌氧状态时间过长的果实,细胞膜透性上升迅速,而乙醇熏蒸能够推延薯尖的无氧呼吸,减缓膜透性上升,从而更好地维持细胞膜的完整程度。
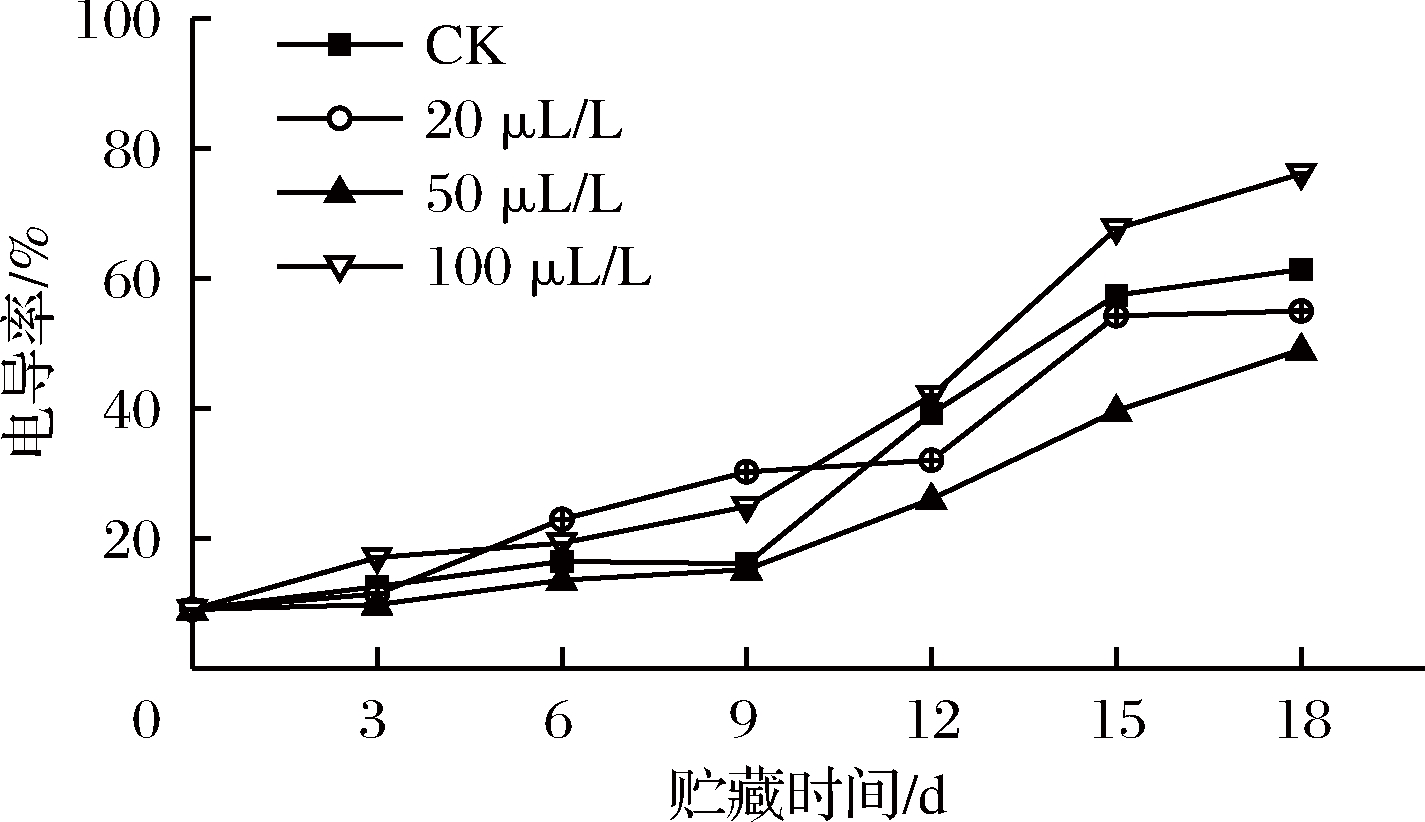
图3 乙醇熏蒸对红薯尖相对电导率的影响
Fig.3 Effects of ethanol fumigation on relative conductivity of sweet potato leaves
2.4 乙醇熏蒸对红薯尖MDA含量的影响
MDA含量可作为膜损伤的直接指标[13]。由图4知,50 μL/L处理组在贮藏期间始终能够维持较低的MDA含量,20 μL/L组能够在贮藏前期和后期抑制MDA含量的上升,然而100 μL/L组在整个贮藏期间MDA含量始终高于其他3组,其中15~18 d显著(P<0.05)高于CK组和20 μL/L处理组,极显著(P<0.01)高于50 μL/L组,这可能是由于薯尖遭受了高浓度乙醇胁迫,细胞产生的自由基逐渐诱导不饱和脂肪酸过氧化,最终诱发了膜脂过氧化,使细胞膜受损伤程度严重[25]。有研究表明,膜脂过氧化产物会随SOD、CAT活性的下降而增加[26],因此乙醇可通过提高这2种酶的活性(见图6、图7)来抑制MDA含量的上升。
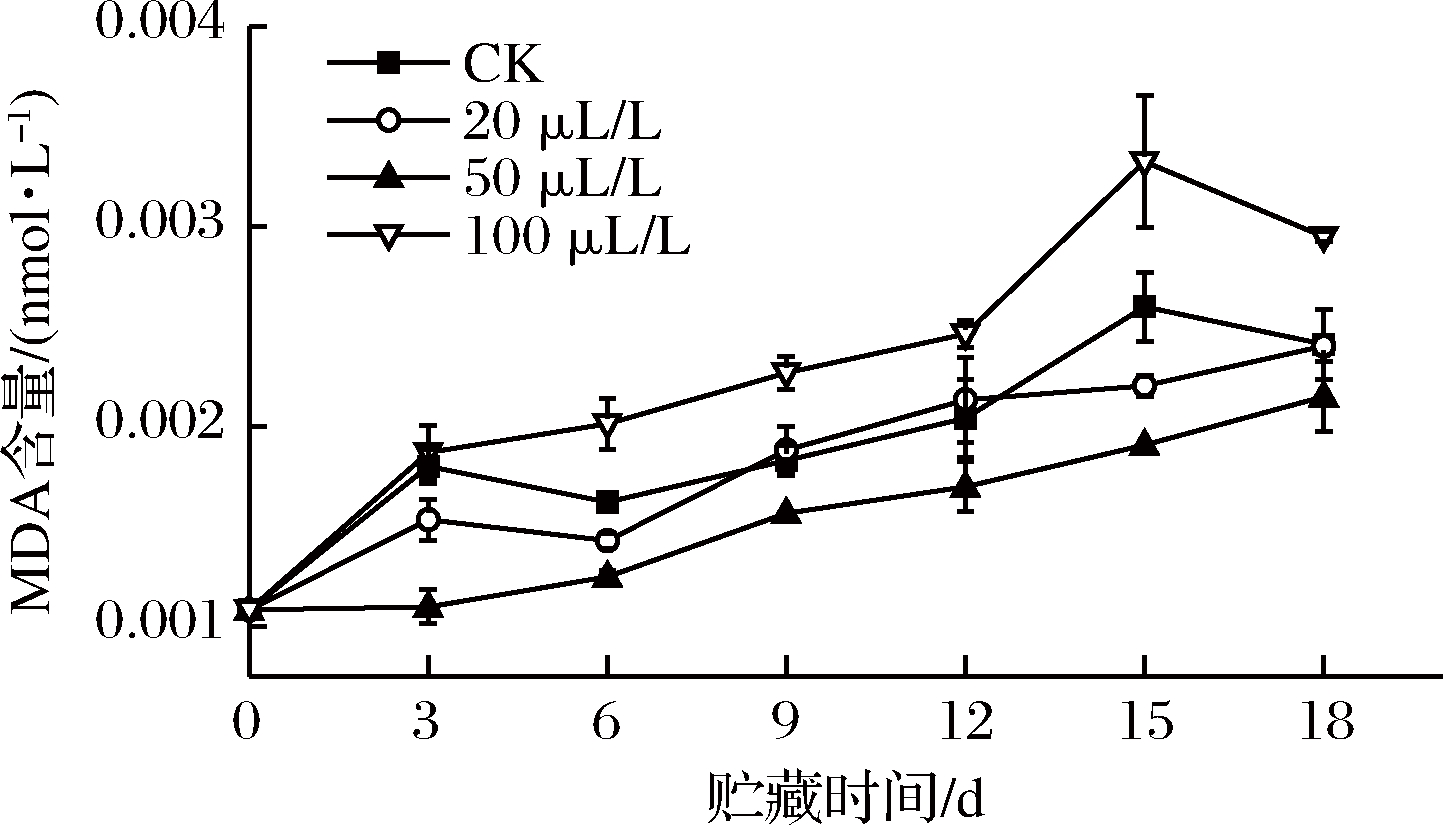
图4 乙醇熏蒸对红薯尖丙二醛含量的影响
Fig.4 Effects of ethanol fumigation on malondialdehyde content of sweet potato leaves
2.5 乙醇熏蒸对红薯尖PPO活性的影响
PPO是一种以铜为辅基的酶,能催化多种简单酚类物质氧化形成醌类,醌类化合物进一步聚合形成呈褐色、棕色或黑色的聚合物[13]。如图5,贮藏期间薯尖PPO活性整体呈上升趋势。

图5 乙醇熏蒸对红薯尖PPO活性的影响
Fig.5 Effects of ethanol fumigation on polyphenol oxidase of sweet potato leaves
0~3 d,薯尖PPO活性上升迅速,可能与薯尖应对机械损伤的生化过程相关,薯尖在损伤部位产生较多的酚类物质来抑制伤口病原菌侵染[27]。第6天,100 μL/L组PPO活性极显著(P<0.01)高于其他3组。第15天,CK组达PPO活性最大值0.45 U/g,显著(P<0.05)高于20、50和100 μL/L组,分别为0.22、0.24和0.29 U/g。贮藏结束时,50 μL/L组PPO活性最低,表明50 μL/L乙醇能较好地延缓PPO活性上升,抑制薯尖褐变。乙醇熏蒸通过诱导SOD、CAT的活性(见图6和图7),很好地防御了活性氧及其他过氧化物对细胞膜系统的毒害,降低了细胞膜的破坏程度,由此阻碍酚类和PPO的相互作用,减缓薯尖褐变。
2.6 乙醇熏蒸对红薯尖SOD活性的影响
SOD是含金属辅基的酶,是活性氧清除系统中首先发挥作用的抗氧化酶,通过防御活性氧或其他过氧化物自由基对细胞膜系统的伤害,以减轻自由基对有机体的毒害[13,28]。如图6所示,贮藏期间薯尖各处理组SOD活性达到高峰值后下降,BARTOLI等[29]推测这是一种复杂的、特异的抗氧化防御机制。贮藏前期和后期,100 μL/L组SOD活性不如CK组,且在第6天显著(P<0.05)低于其他3组。20、50 μL/L组在整个贮藏期间都能有效诱导SOD活性提高,其中50 μL/L组效果最佳。YA-RU等[30]研究表明0.1%乙醇熏蒸处理可诱导蓝莓果实SOD基因的表达,抑止亚细胞结构中活性氧积累。王中元等[31]用乙醇处理木薯,结果也发现处理组能维持较高SOD活性,更好清除细胞中的有害物质。
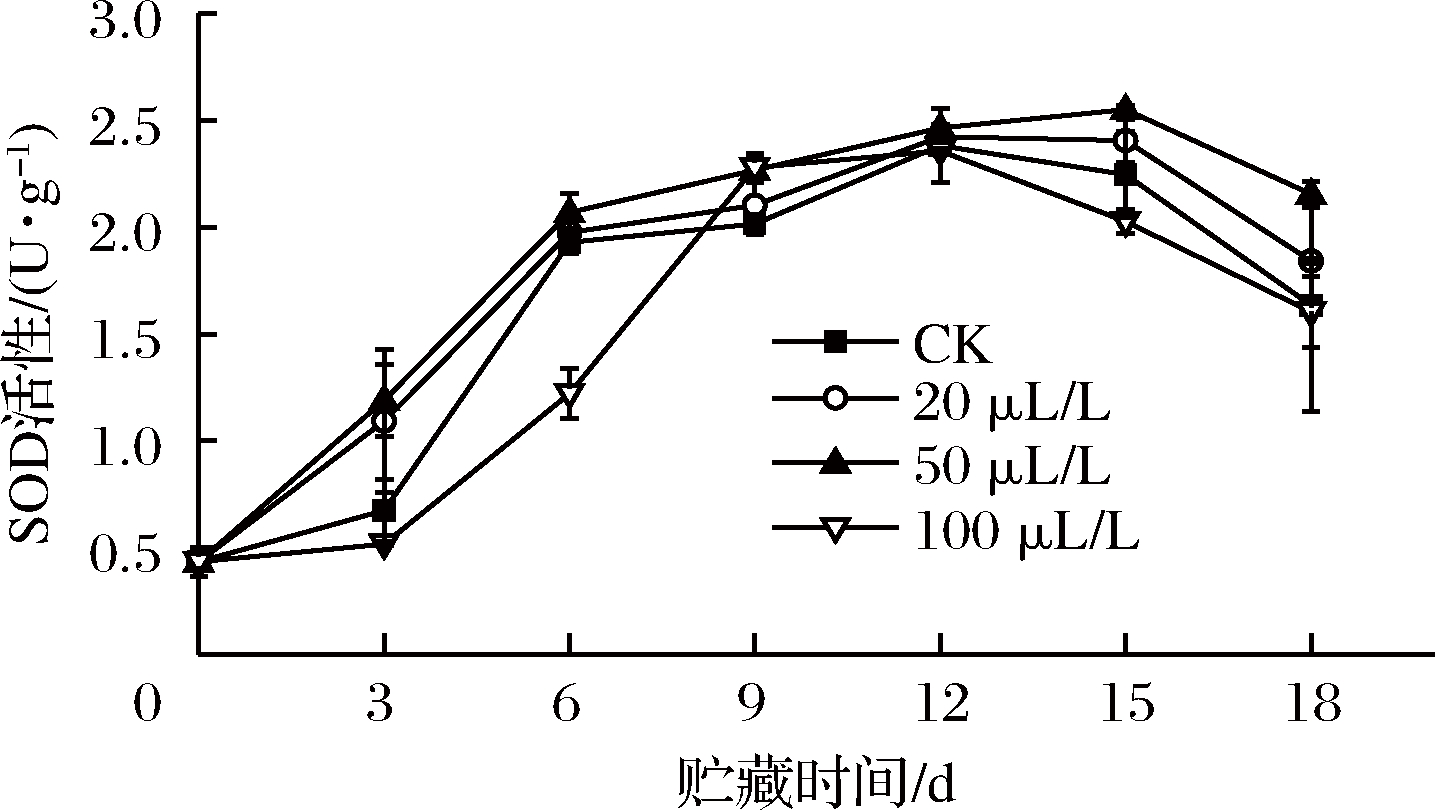
图6 乙醇熏蒸对红薯尖SOD活性的影响
Fig.6 Effects of ethanol fumigation on superoxide dismutase of sweet potato leaves
2.7 乙醇熏蒸对红薯尖CAT活性的影响
CAT是含铁的血红蛋白酶,它通过催化分解积累的H2O2,减少H2O2对果蔬组织可能造成的氧化伤害[13]。由图7知,各处理组CAT活性在贮藏前期呈下降趋势,可能是与薯尖采摘时受到机械损伤有关[32]。CAT是清除因伤胁迫产生的活性氧的主要酶,对伤胁迫有较强的调节作用[33],因此随着贮藏时间的延长,各处理组CAT活性回升。贮藏至12 d时,50 μL/L组CAT活性达17.67 U/g,显著(P<0.05)高于CK组(13.33 U/g)、20 μL/L组(13.51 U/g)、100 μL/L组(13.06 U/g)。贮藏后期,薯尖衰老导致CAT活性下降[34],100 μL/L组CAT活性低于CK组,20 μL/L组略高于CK组,50 μL/L组显著(P<0.05)高于CK组。可见,50 μL/L处理组能够在贮藏期间一直保持较高CAT活性,降低活性氧毒害。乙醇熏蒸通过诱导抗氧化酶CAT的活性来清除活性氧自由基,延缓采后薯尖衰老速度,这与韩俊华[35]用6 mL/kg乙醇处理西兰花得出的结论相似。

图7 乙醇熏蒸对红薯尖CAT活性的影响
Fig.7 Effects of ethanol fumigation on catalase of sweet potato leaves
2.8 乙醇熏蒸对红薯尖POD活性的影响
POD能催化H2O2氧化酚类物质产生醌类物质,这些化合物进一步缩合,或与其他分子缩合形成颜色较深的化合物,致使组织褐变[13]。贮藏前期,POD活性急速上升,有研究表明,POD活性与CAT活性具有一定联系[36],贮藏初期CAT活性下降,导致其催化的底物H2O2积累,因此薯尖细胞通过诱导POD活性来清除H2O2。100 μL/L组在贮藏前期POD活性值始终高于CK组,表明乙醇浓度过大诱导了POD活性增强[37],加速薯尖褐变。第12天,50 μL/L组POD活性为10.63 U/g,分别为其他3组的70.54%、75.44%、73.97%,差异显著(P<0.05)。贮藏后期,乙醇熏蒸组POD活性均大于CK组,李秋菊等[38]研究表明POD是一种活性氧清除酶,可减少氧化力更强的·OH的生成,在抗氧化胁迫中起重要作用,因此3个处理组在贮藏后期能够较好地维持POD活性高水平,防止![]() 的积累[10,13],降低薯尖细胞损伤。综上,20、50 μL/L组在贮藏期间效果较好。
的积累[10,13],降低薯尖细胞损伤。综上,20、50 μL/L组在贮藏期间效果较好。
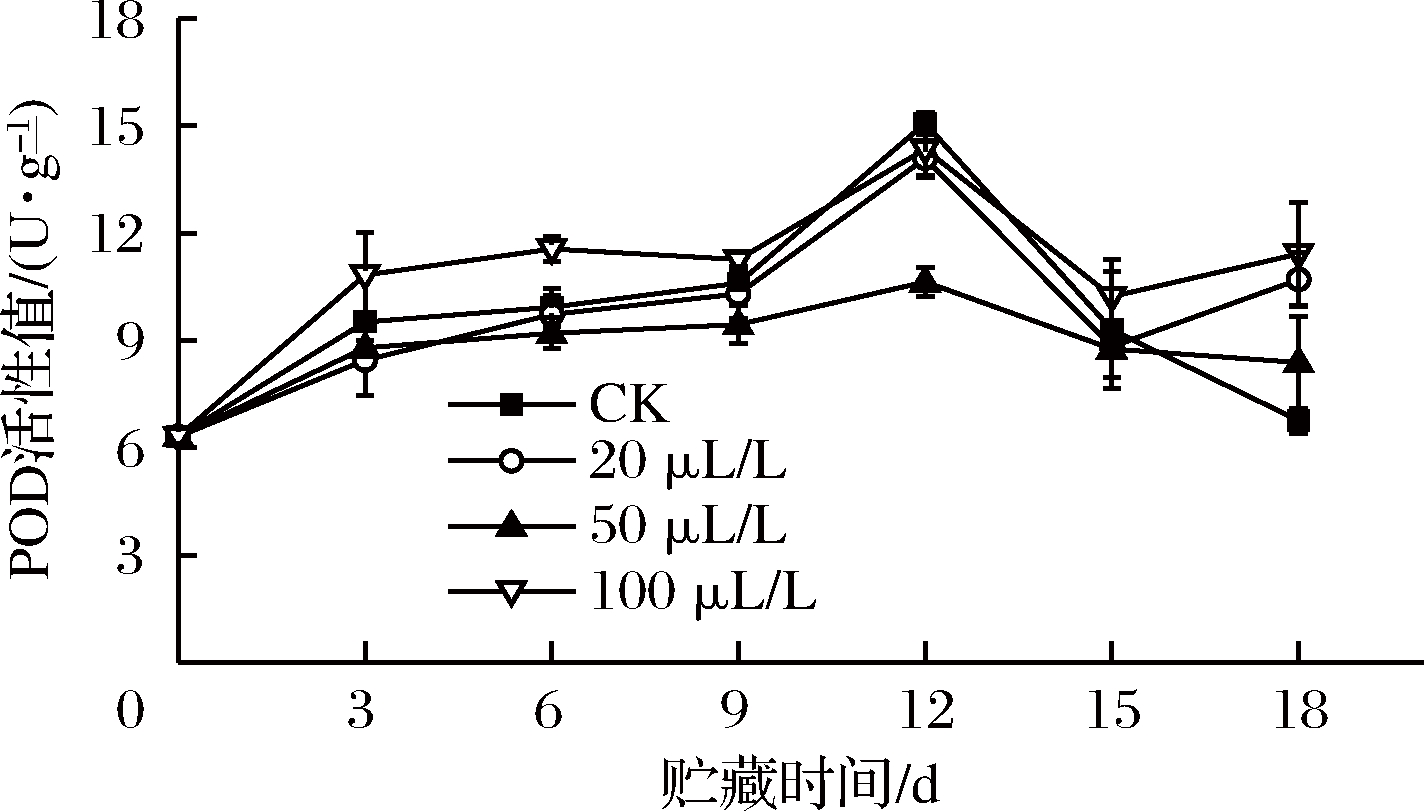
图8 乙醇熏蒸对红薯尖POD活性的影响
Fig.8 Effects of ethanol fumigation on peroxidase of sweet potato leaves
2.9 乙醇熏蒸对红薯尖叶绿素含量的影响
叶绿素含量是判断红薯尖是否保持鲜绿状态的重要指标。图9显示,薯尖叶绿素含量随着贮藏时间的延长呈下降趋势,20、50 μL/L组的叶绿素含量始终高于其余2组,且50 μL/L组延缓叶绿素降解效果最佳。第3天时,50 μL/L组的叶绿素含量为88.03 mg/100 g,极显著(P<0.01)高于CK组、20 和100 μL/L组,叶绿素含量分别为84.78、84.86 和79.65 mg/100 g。整个贮藏期间,20、50 μL/L组在第3天、第6天与100 μL/L组差异极显著(P<0.01),其他时间差异显著(P<0.05),可见乙醇浓度过高,加强呼吸代谢(见图1),加快叶绿素从绿色被降解成无色化合物[39]。王慧倩等[40]也得出高浓度乙醇处理鲜切西兰花会促进花蕾黄化的结论。
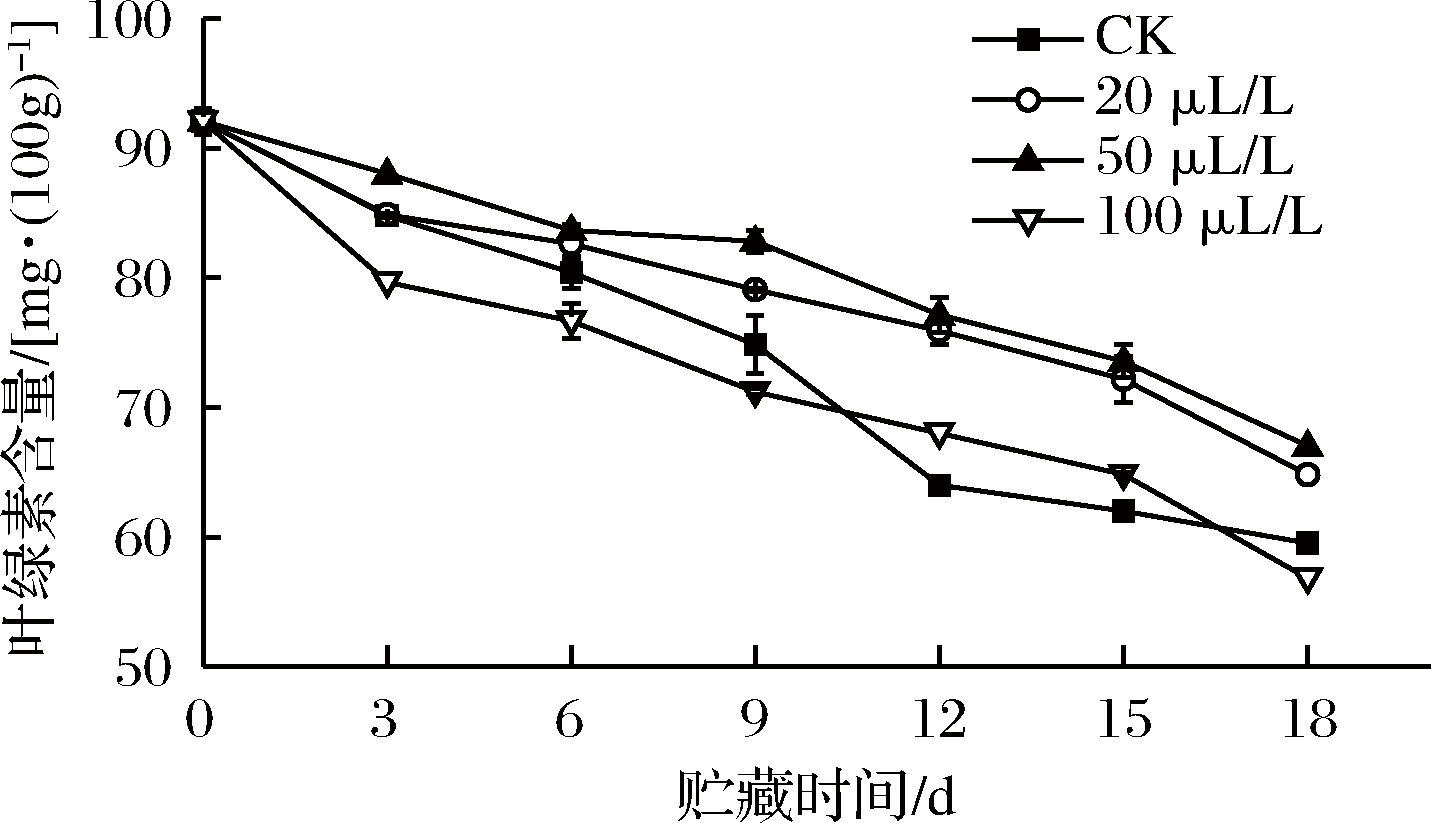
图9 乙醇熏蒸对红薯尖叶绿素含量的影响
Fig.9 Effects of ethanol fumigation on chlorophyll content of sweet potato leaves
2.10 乙醇熏蒸对红薯尖感官评分的影响
薯尖的感官品质从颜色、质地、形态、气味和水渍5个方面来进行评定。由图10可知,随着贮藏时间的延长,薯尖的感官品质逐渐下降。前6 d,薯尖品质下降平缓,各组之间未形成显著差异(P>0.05),20与50 μL/L组品质略好于其他2组。第9天,CK组表现为清香味明显变淡、软韧和萎蔫,100 μL/L组品质最差,另外2组均能维持4.5 分以上的感官评分。第9天后,CK组与100 μL/L组品质剧烈下降。12~18 d,CK、100 μL/L组与其他2组形成极显著(P<0.01)差异。在整个贮藏期间,100 μL/L组最快出现异味、软烂等不良现象。20、50 μL/L组均能保持较好的感官评分,50 μL/L组保鲜效果最佳。
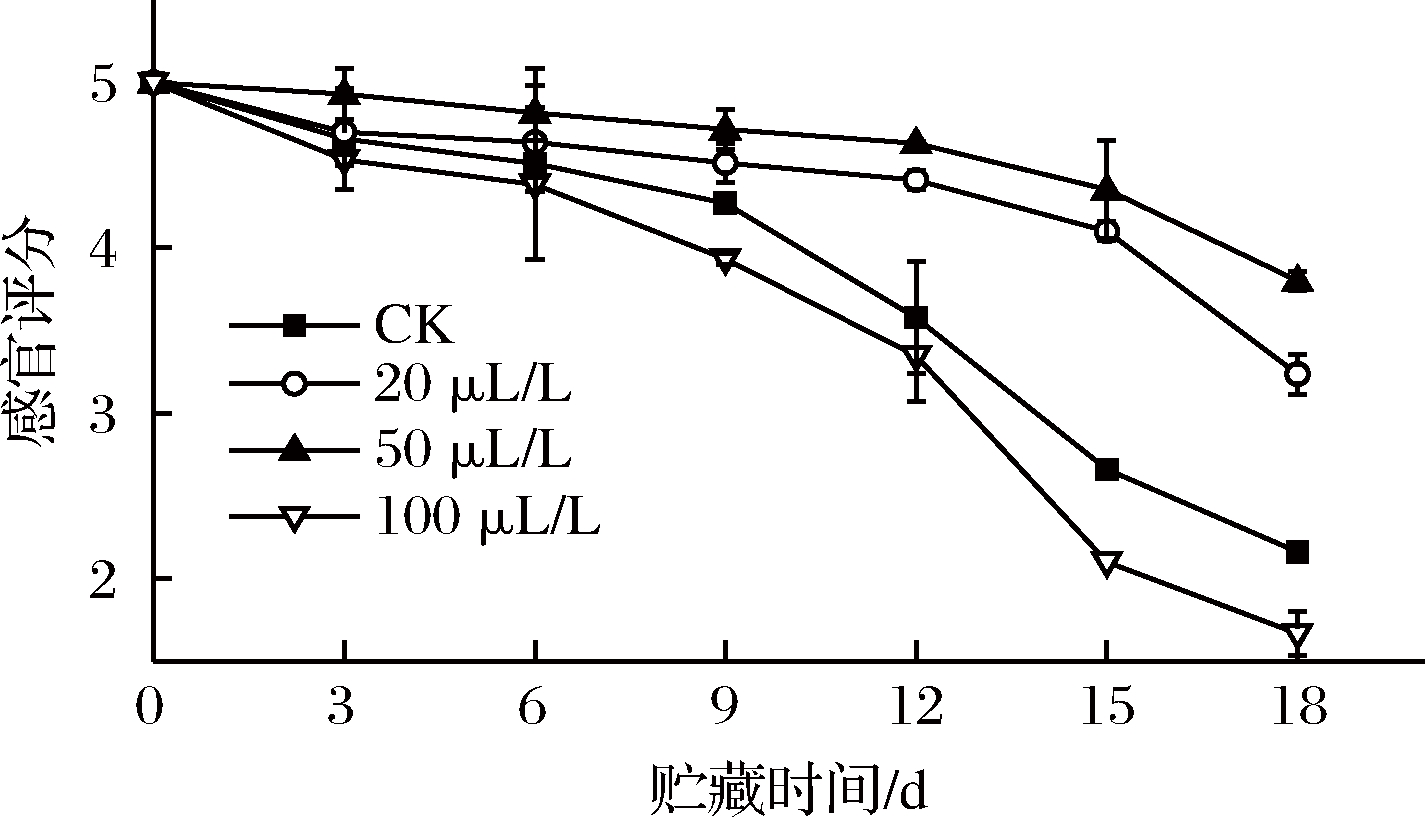
图10 乙醇熏蒸对红薯尖感官评分的影响
Fig.10 Effects of ethanol fumigation on sensory evaluation of sweet potato leaves
3 结论与讨论
本试验探究了不同浓度(20、50、100 μL/L)的乙醇熏蒸对红薯尖在冷藏期间品质的影响,结果表明,乙醇熏蒸从控制采后生理变化、维持活性氧代谢平衡及降低细胞膜损伤等方面抑制薯尖的品质劣变。
果蔬采后的生理生化变化有衰老、失绿黄化、褐变、病菌感染、腐烂等。乙醇可抑制乙烯合成相关酶的活性,减少乙烯生成,从而削弱乙烯导致的呼吸强度的变化[41]。本研究中,20和50 μL/L的乙醇熏蒸分别将薯尖的呼吸高峰降低了10.76%和22.32%,说明乙醇可以抑制呼吸作用,从而延缓衰老。果蔬的衰老过程往往伴随着颜色的变化,乙醇通过维持叶绿体内部基粒片层结构及外膜的完整性[35],降低贮藏期间叶绿体的破坏程度,有效延缓叶绿体结构的解体,从而保持薯尖的鲜绿状态;PPO是褐变主要酶,乙醇与PPO作用底物邻苯二酚具有相似化学特性的羟基[42],因此乙醇可通过与底物竞争酶活性中心基团,抑制PPO活性,延缓薯尖褐变。此外,乙醇具有强烈的消毒杀菌作用,可杀死组织表面大部分真菌和细菌,抑制病菌感染。果蔬受微生物侵害后会引发腐烂,外源乙醇通过影响生物体代谢来抑制果蔬成熟衰老,从而维持自身抗性[43],减少腐烂发生,适当的乙醇处理可保持相对较低的腐烂率,这在乙醇处理新鲜生菜[44]、新鲜白芦笋[45]、枇杷[46]中均有体现。
活性氧是一种化学反应性的含氧分子,它可以与蛋白质、DNA和膜脂发生反应,从而增加电解质泄漏,加速衰老和细胞死亡[47]。如果细胞中缺乏清除活性氧自由基的酶或物质时,活性氧的代谢失调从而使机体受到各种自由基的伤害。SOD、CAT、POD都是防御活性氧毒害的酶系统,它们相互协调使活性氧维持在较低水平,防止其对细胞的毒害。韩俊华等[35]的研究指出,经6 mL/kg的乙醇处理后的西兰花,SOD和CAT的活性受到了促进作用,增强了对活性氧毒害的抵抗。本研究中,20和50 μL/L的乙醇处理使得薯尖的SOD、CAT、POD活性增强,有效地防止了细胞活性氧的蓄积,减轻机体受到的自由基伤害。这与乙醇熏蒸有利于油豆角[48]、柿果实[49]的活性氧正常代谢,降低自由基毒害的结果一致。
果蔬细胞膜对维持细胞的微环境和正常的代谢起着重要的作用。MDA是膜脂过氧化作用的主要产物之一,可作为膜损伤的直接指标,相对电导率表示细胞膜渗透率以及膜受到伤害的程度,可反映细胞膜通透性的变化。因此,MDA和相对电导率可作为判断细胞膜损伤的指标。果蔬组织在衰老过程中,细胞内的活性氧自由基代谢平衡往往被破坏,自由基大量积累并引发或加剧脂质过氧化作用,造成细胞质膜系统的损伤。本研究中,适当的乙醇处理可以抑制活性氧的产生[50],提高薯尖的抗氧化能力[51],从而抑制细胞膜的脂质过氧化,较好地维持膜稳定性。由图3、图4可知,到贮藏结束时,50 μL/L组的相对电导率和MDA含量分别为CK组的79.1%和89.21%,说明乙醇熏蒸能够有效降低膜损伤。HOMAIDA等[52]也发现300 mL/L乙醇处理可有效抑制鲜切甘蔗电导率的上升,减轻细胞质膜系统的损伤。FAN等[4]的研究也表明200 mL/L乙醇熏蒸是抑制鲜切山药MDA含量上升的有效方法。
在乙醇熏蒸处理过程中,过高的浓度对果蔬的破坏超出果蔬的修复能力从而引起损伤。王慧倩等[40]用2%、5%、10%和20%乙醇熏蒸处理西兰花6 h,结果表明在2%~10%,乙醇体积分数越高,对西兰花黄化的抑制越明显,货架期越长,以10%乙醇处理效果最佳;而高体积分数(20%)乙醇处理反而促进西兰花黄化,货架期随之缩短。张洪翠等[17]在双孢蘑菇上采用200、400、600 μL/L乙醇熏蒸3 h,发现600 μL/L乙醇过量渗入细胞,促进胞内蛋白变性,对细胞产生毒害。本研究中,50 μL/L乙醇熏蒸组保鲜效果最佳,20 μL/L组次之,而100 μL/L组则会加速红薯尖的腐烂衰老。因此,乙醇熏蒸对红薯尖的品质保护作用受乙醇浓度的影响很大,在一定范围内,乙醇的保鲜效果随着浓度的增加而显著。但乙醇浓度过高,会在薯尖细胞中过量积累,逐渐削弱薯尖抵抗力,加速腐败,其次,高浓度乙醇加快细胞原生质膜破裂,离子泄露增加,此外,高浓度乙醇胁迫下,活性氧清除酶的活性下降,活性氧代谢平衡被打破,细胞产生的自由基最终诱发膜脂过氧化,加剧了细胞膜系统的损伤。
综上所述,适宜浓度的乙醇熏蒸处理可明显抑制薯尖呼吸强度,有效维持活性氧代谢平衡(SOD、CAT、POD),同时能够很好地保持薯尖颜色(PPO、叶绿素含量),降低细胞膜损伤(MDA含量、相对电导率),减少腐烂的发生,且能维持较高的感官品质。整体而言,50 μL/L组综合保鲜效果最佳。然而,高浓度(100 μL/L)乙醇熏蒸处理降低了细胞自身防御力,加快原生质膜破裂,胁迫降低了活性氧清除酶活性,不利于薯尖保鲜。试验结果表明,乙醇熏蒸对抑制薯尖品质劣变、延长物流及运输保鲜期具有应用价值。
[1] 司金金, 辛丹丹,王晓芬,等. 温度和保鲜膜对红薯叶贮藏品质的影响[J]. 食品工业科技, 2017, 38(17):268-274.
[2] CHERVIN C, WESTERCAMP P, MONTEILS G. Ethanol vapours limit Botrytis development over the postharvest life of table grapes[J]. Postharvest Biology & Technology, 2005, 36(3):319-322.
[3] 吴娟, 毕生雷,张成明,等. 乙醇及其提取物在食品保鲜中的应用进展[J]. 食品研究与开发, 2016, 37(18):221-224.
[4] FAN W, CAO Y, REN H, et al. Effects of ethanol fumigation on inhibiting fresh-cut yam enzymatic browning and microbial growth[J]. Journal of Food Processing & Preservation, 2017, 42(2):e13434.
[5] SUZUKI Y, UJI T, TERAI H. Inhibition of senescence in broccoli florets with ethanol vapor from alcohol powder[J]. Postharvest Biology & Technology, 2004, 31(2):177-182.
[6] 李勃, 党永,马瑜,等. 乙醇蒸汽对青花菜贮藏保鲜效果的影响[J]. 保鲜与加工, 2008, 8(3):17-21.
[7] 邢皓. 荷兰豆采后品质劣变规律及调控技术研究[D]. 海口:海南大学, 2015.
[8] RITENOUR M A, MANGRICH M E, BEAULIEU J C, et al. Ethanol effects on the ripening of climacteric fruit[J]. Postharvest Biology & Technology, 1997, 12(1):35-42.
[9] SCHARFENBERGER G. [Determination of odour intensity by static gas dilution]. [German][J]. Chemie in Labor Und Biotechnik, 1991.
[10] 蔡佳昂, 赵霞,周静,等. 1-甲基环丙烯与微孔气调包装复合技术对红苕尖保鲜品质的影响[J]. 食品与发酵工业,2018,44(7):203-210.
[11] 程曦. 控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学,2017.
[12] MOSTAGHIMI T. The effect of isolated soy and collagen on potato chips malondialdehyde (MDA) content reduction under vacuum conditions[J]. Agricultural Communications, 2015.
[13] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007.
[14] YANG M W. Study on rapid determination of chlorophyll content of leaves[J]. Chinese Journal of Spectroscopy Laboratory, 2002, 19(4):478-481.
[15] 张学杰, 叶志华. 高压对鲜切生菜感官品质的影响[J]. 食品科学, 2013, 34(7):140-143.
[16] 八藤真. 乙醇防止食品腐败机理[J]. 酿酒科技, 1995(1):95.
[17] 张洪翠, 李云云,靳苗苗,等. 乙醇熏蒸对双孢蘑菇保鲜品质的影响[J]. 食品与发酵工业, 2018,44(6):187-194.
[18] 刘虹彬, 温进坤,韩梅. 氧化应激与动脉粥样硬化[J]. 中国动脉硬化杂志, 2001, 9(4):360-362.
[19] 王灵敏, 尚忠林. 活性氧在气孔运动中的作用[J]. 生命科学, 2010, 22(5):482-486.
[20] 吴日章, 曾凯芳. 乙醇熏蒸对新鲜茎瘤芥贮藏品质的影响[J]. 保鲜与加工, 2011, 11(3):6-9.
[21] 陶炜煜. 乙醇及抗菌膜在最小加工西兰花保鲜上的应用[D]. 北京:北京林业大学, 2006.
[22] 郭霞, 段凯. 红薯贮藏期间的腐烂原因及对策[J]. 南阳农业科技, 2003(6):5-5.
[23] SALTVEIT, M E. Effect of alcohols and their interaction with ethylene on the ripening of epidermal pericarp discs of tomato Fruit[J]. Plant Physiology, 1989, 90(1):167-174.
[24] 李江阔, 张鹏,寇文丽,等. 1-MCP和真空包装对冰温贮藏磨盘柿品质的影响[J]. 食品与发酵工业, 2012, 38(7):201-205.
[25] SWINNEN S, GOOVAERTS A, SCHAERLAEKENS K, et al. Auxotrophic mutations reduce tolerance of Saccharomyces cerevisiae to very high levels of ethanol stress.[J]. Eukaryotic Cell, 2015, 14(9):368-375.
[26] 崔喜艳, 陈展宇,张美善,等. 土壤pH值对烤烟叶片生理生化特性的影响[J]. 植物生理学报, 2005, 41(6):737-740.
[27] 邱永祥, 柯玉琴,代红军,等. 甘薯抗蔓割病的酚类物质代谢的研究[J]. 中国生态农业学报, 2007, 15(5):167-170.
[28] 马旭俊, 朱大海. 植物超氧化物歧化酶(SOD)的研究进展[J]. 遗传, 2003, 25(2):225-231.
[29] BARTOLI C G, SIMONTACCHI M, GUI MET, et al. Antioxidant enzymes and lipid peroxidation during aging of Chrysanthemum morifolium, RAM petals[J]. Plant Science, 1995, 104(2):161-168.
MET, et al. Antioxidant enzymes and lipid peroxidation during aging of Chrysanthemum morifolium, RAM petals[J]. Plant Science, 1995, 104(2):161-168.
[30] YA-RU J I, ZHOU F H, JIANG A L, et al. Effects of ethanol fumigation treatments on the quality of postharvest blueberry fruits[J]. Packaging Engineering, 2018.
[31] 王中元, 王展,邵远志.乙醇熏蒸在木薯保鲜上的应用效果[J].食品科技,2015(4):43-47.
[32] 王艳颖, 胡文忠,庞坤. 机械损伤伤对富士苹果抗氧化酶活性的影响[D]. 食品与机械, 2007,23(5):31-35.
[33] 脱落酸在番茄果实采后损伤愈合过程中的作用[D]. 杭州:浙江大学, 2016.
[34] 谷建田, 欧阳新星. 番茄种子衰老过程中过氧化氢酶(CAT)活性变化[J]. 华北农学报, 1998, 13(2):112-116.
[35] 韩俊华, 周君一,牛天贵,等. 乙醇对鲜切西兰花抗氧化酶及叶绿体超微结构的影响[J]. 食品科学, 2008, 29(3):283-287.
[36] VENKATACHALAM K, MEENUNE M. Changes in physiochemical quality and browning related enzyme activity of longkong fruit during four different weeks of on-tree maturation[J]. Food Chemistry, 2012, 131(4):1 437-1 442.
[37] O’BRIEN J A, DAUDI A, BUTT V S, et al. Reactive oxygen species and their role in plant defence and cell wall metabolism[J]. Planta, 2012, 236(3):765-779.
[38] 李秋菊, 韩红艳. 乙醇处理对桃果实贮藏期间POD、PPO活性的影响[J]. 食品研究与开发, 2006, 27(7):185-187.
[39] 丁跃, 吴刚,郭长奎. 植物叶绿素降解机制研究进展[J]. 生物技术通报, 2016, 32(11):1-9.
[40] 王慧倩, 郑聪,王华东,等. 乙醇熏蒸处理对鲜切西兰花活性成分和抗氧化活性的影响[J]. 食品科学, 2014, 35(16):250-254.
[41] 范文广, 韩双,姚春艳,等. 1-MCPC1O2和乙醇在果蔬保鲜的应用研究进展[J]. 农产品加工:学刊, 2013(13):52-54.
[42] 彭益强, 邓峰,刘宇,等. 富士苹果中多酚氧化酶活性的中心必需基团与抑制动力学[J]. 华侨大学学报(自然科学版), 2012, 33(1):51-54.
[43] 胡文瑾, 毕阳,李颖超,等. 采后热水和乙醇处理对枸杞鲜果腐烂的控制及品质的影响[J]. 食品工业科技, 2013, 34(12):308-311.
[44] YAN S, YANG T, LUO Y. The mechanism of ethanol treatment on inhibiting lettuce enzymatic browning and microbial growth[J]. LWT - Food Science and Technology, 2015, 63(1):383-390.
[45] HERPPICH W B, HUYSKENS-KEIL S, HASSENBERG K. Impact of ethanol treatment on physiological and microbiological properties of fresh white asparagus (Asparagus officinalis L.) spears[J]. LWT - Food Science and Technology, 2014, 57(1):156-164.
[46] 郎雅琼. 乙醇对枇杷常温保鲜效果的影响及其机理研究[D]. 南京:南京农业大学, 2014.
[47] LICHTER A, ZUTKHY Y, SONEGO L, et al. Ethanol controls postharvest decay of table grapes[J]. Postharvest Biology & Technology, 2002, 24(3):301-308.
[48] 郭禹, 姜宇芙,钟佳, 等. 乙醇熏蒸对采后油豆角衰老相关生理指标的影响[J]. 食品与机械, 2016,32(5):144-147.
[49] 廖汝玉, 金光,郭瑞, 等. 乙醇对‘早红’柿果实脱涩过程中若干活性氧代谢指标的影响[J]. 福建农业学报, 2014,29(2):148-152.
[50] NOVACKY P A. Use of dimethyl sulfoxide to detect hydroxyl radical during bacteria-induced hypersensitive reaction[J]. Plant Physiology, 1991, 96(4):1 157-1 160.
[51] 王斌利, 张莉霞,石晓峰,等. 紫斑牡丹花粉不同浓度乙醇提取物抗氧化能力研究[J]. 中国中医药信息杂志, 2018,25(2):65-68.
[52] HOMAIDA M A, YANG H, YAN S. Effects of ethanol treatment on inhibiting fresh-cut sugarcane enzymatic browning and microbial growth[J]. LWT-Food Science and Technology, 2017, 77:8-14.