黄酒是我国最古老的酒种,拥有数千年的发展历史;近年来,由于黄酒的发展,瓶装黄酒的浑浊问题受到了行业内的重视[1]。瓶装黄酒浑浊现象严重影响销售,在一定程度上制约着黄酒的发展。黄酒中的蛋白不仅影响黄酒的营养价值[2-3],而且对浑浊的产生更有显著的影响[4]。研究发现[5-6],蛋白质是引起黄酒浑浊的主要原因,但浑浊的形成与黄酒中蛋白质总量没有直接关系,而是与某些特定蛋白质有关,找出这些特定蛋白并将其除去,可以大大提高黄酒的非生物稳定性,但是特定蛋白质尚不明确。
目前黄酒酿造过程中蛋白质的研究主要集中在对麦曲、发酵液以及浑浊中的蛋白[7-11],瓶装黄酒中蛋白质种类与来源的研究目前未涉及。一些研究者推测[12],成品黄酒中的蛋白质来源丰富,除了小麦和大米蛋白质外,可能还含有少量的微生物蛋白和酶蛋白,但这一结果并没有得到试验验证。通过对比瓶装黄酒中蛋白与其他酿造阶段的蛋白种类与数量的差异,可以找到引起浑浊的关键蛋白。
黄酒的成分较为复杂,除了蛋白质以外,还有多酚、糊精、还原糖、铁离子等多种成分[5],这些成分的存在增加了黄酒蛋白分离和鉴定的难度,因此找到合适的瓶装黄酒蛋白分离方法尤为重要。本文采用0.1 mol/L的乙酸铵-甲醇沉淀黄酒中的蛋白,结合双向电泳(two-dimensional electrophoresis,2-DE)和基质辅助激光解析电离飞行时间串联质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF-MS)对瓶装黄酒中的蛋白进行分析,并纯化其中主要的蛋白——α-淀粉酶抑制剂0.19,以期对控制瓶装黄酒的蛋白质浑浊程度提供理论指导。
1 材料与方法
1.1 材料与试剂
500 mL瓶装黄酒(古越龙山陈5年),购于无锡当地超市;丙烯酰胺/双丙烯酰胺(29∶1、30%(W/V))、过硫酸铵(APS)、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、巯基乙醇、透析膜(3.5 k)、四甲基乙二胺(TEMED)和(NH4)2SO4,购于上海生工生物工程公司;尿素、二硫苏糖醇(DTT)和3-[(3-胆固醇氨丙基)二甲氨基]-1-丙磺酸(CHAPS),购于美国Bio-Rad公司;IPG缓冲液和碘乙酰胺(IAA),购于美国GE公司;α-氰基-4-羟基肉桂酸(HCCA)、碳酸氢铵、三氟乙酸(TFA)、胰蛋白酶和乙腈,购于Sigma公司;乙醇、丙酮、甲醇、乙酸铵、乙酸、CaCl2、NaCl、溴酚蓝、考马斯亮蓝G-250、甘氨酸和聚乙二醇20000,购于国药化学试剂有限公司;DEAE-Sepharose Fast Flow、Sephacryl S-100,购于美国GE公司。
1.2 仪器与设备
高速离心机,德国Eppendorf股份公司;Science-10N冷冻干燥机,宁波新艺超声设备有限公司;UV-2100紫外-可见分光光度计,北京普析通用仪器有限责任公司;磁力搅拌器,上海司乐仪器有限公司;PE20精密pH计,梅特勒-托利多仪器有限公司;Mini-Protein 3 Cell蛋白电泳系统,美国Bio-Rad公司;Ultraflextreme串联飞行时间质谱仪,德国Bruker公司;蛋白纯化系统,美国GE公司。
1.3 实验方法
1.3.1 瓶装黄酒蛋白组成分析
(1)双向电泳
用5倍体积的0.1 mol/L的乙酸铵-甲醇溶液沉淀黄酒中蛋白,将沉淀物用-20 ℃预冷的甲醇洗1次,-20 ℃预冷的丙酮洗2次,并于室温下干燥15 min左右,使丙酮完全挥发,最后溶于上样缓冲液(8 mol/L尿素、0.5% (W/V) CHAPS、0.00 2%溴酚蓝、0.2%(W/V)DTT和0.5% IPG buffer)中。
双向电泳按照文献[13]的方法修改后进行。采用分离胶浓度为12.5%的变性聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide electrophoresis, SDS-PAGE)进行第二向电泳,蛋白胶经固定、染色并脱色至背景清晰备用。
(2)MALDI-TOF-MS分析
质谱鉴定参照文献[14]的方法进行。
1.3.2 α-淀粉酶抑制剂的纯化
(1)不同饱和度(NH4)2SO4沉淀α-淀粉酶抑制剂
向瓶装黄酒样品中添加CaCl2至质量浓度为2 g/L,并用40%的NaOH溶液调节pH至8.0,4 ℃静置过夜,8 000 r/min离心15 min,上清液置于截留分子质量为3.5 kDa的透析袋中透析72 h,然后用聚乙二醇20 000包埋浓缩[15]。向浓缩后的蛋白溶液中缓慢添加粉末(NH4)2SO4至饱和度为20%,缓慢搅拌至溶液出现浑浊时,静置1 h以上,8 000 r/min离心15 min,得到的蛋白沉淀记为S1(~20%)(Sediment,沉淀物);向上清中继续添加(NH4)2SO4至30%饱和度,得到的蛋白沉淀记为S2(20%~30%);重复上述操作,分别得到S3(30%~40%)、S4(40%~50%)、S5(50%~60%)、S6(60%~70%)、S7(70%~80%)和S8(80%~90%)。将这些蛋白组分用去离子水溶解,透析72 h并冻干[16]。
(2)DEAE-Sepharose Fast Flow弱阴离子交换柱
流动相为pH 8.0的0.02 mol/L Tris-HCl缓冲液,流速为2 mL/min,以含0~1.0 mol/L NaCl的Tris-HCl缓冲液进行梯度洗脱,收集蛋白流出液(3 min/管),逐管检测蛋白浓度,分别收集各蛋白峰,透析、冻干后用SDS-PAGE进行检测。
(3)Sephacryl S-100凝胶柱层析
流动相为pH 8.0的0.02 mol/L Tris-HCl缓冲液,流速为0.5 mL/min,收集蛋白流出液(3 min/管),逐管检测蛋白浓度,分别收集各蛋白峰,透析、冻干后用SDS-PAGE检测。
(4)SDS-PAGE
采用分离胶为12.5%,浓缩胶为4%的SDS-PAGE进行蛋白电泳,上样量为20 μL(含20 μg蛋白),开始电压为60 V,待蛋白条带跑出浓缩胶后改为80 V,电泳结束后,蛋白胶经固定、染色并脱色至背景清晰备用。
2 结果与分析
2.1 瓶装黄酒蛋白质组成的2-DE分析
本文采用0.1 mol/L的乙酸铵-甲醇溶液沉淀黄酒中蛋白,乙酸铵-甲醇常用于植物蛋白的分离提取,并且该方法在含有大量干扰物质的样品中能很好地沉淀出蛋白质[17]。

图1 瓶装黄酒蛋白双向电泳
Fig.1 Two-dimensional electrophoresis protein profile of bottled Chinese rice wine
对图1中的25个肉眼可见的蛋白点进行鉴定,其中有19个蛋白点鉴定成功,结果列于表1中。从表1的结果可知,瓶装绍兴黄酒中的蛋白包括,来源于小麦的α-淀粉酶抑制剂、类燕麦蛋白、病程相关蛋白,以及来源于大米种子的过敏蛋白RAG2和α-淀粉酶/胰蛋白酶抑制剂RA16。从鉴定结果可知,绍兴瓶装黄酒中蛋白质的种类较少且不含微生物蛋白,该结果与瓶装葡萄酒中蛋白的研究结果类似[18]:葡萄酒中蛋白质均来源于原料葡萄,包括3种不同蛋白。从表1还可以看出,瓶装黄酒中来源于小麦的蛋白点有16个,其中10个被鉴定为α-淀粉酶抑制剂,在图中用粗箭头( )标出。其他学者研究发现,α-淀粉酶抑制剂同时也是导致黄酒浑浊的主要原因[10-11],由此可知α-淀粉酶抑制剂对黄酒浑浊形成具有较大的影响。
)标出。其他学者研究发现,α-淀粉酶抑制剂同时也是导致黄酒浑浊的主要原因[10-11],由此可知α-淀粉酶抑制剂对黄酒浑浊形成具有较大的影响。
小麦中含有较多的蛋白,在制曲过程中会发生不同程度的降解[19]。张波[9]认为制曲结束后麦曲中的蛋白主要是微生物分泌的酶蛋白,原料蛋白基本被降解;而孔玲琼[7]的研究结果表明,麦曲中只有11个蛋白点来源于微生物,113个蛋白点来源于植物蛋白(主要来源于小麦,其中包括43种蛋白)。瓶装黄酒中蛋白质的研究结果表明,麦曲中的微生物蛋白和大部分的原料蛋白并没有保留到成品酒中,只有α-淀粉酶抑制剂、类燕麦蛋白和病程相关蛋白被保留下来。王文蒙[20]研究表明,小麦中的α-淀粉酶抑制剂具有很高热稳定性和酸碱耐受性,在80 ℃、pH 3~10的条件下,活性基本不受影响。另外对α-淀粉酶抑制剂的二级结构研究发现,其每个单体中含有10个半胱氨酸残基,构成5个二硫键,二硫键的形成使得α-淀粉酶抑制剂结构较稳定[21],这可能是小麦α-淀粉酶抑制剂经过制曲和发酵过程后仍能大量残留于瓶装黄酒中的原因。
表1 瓶装黄酒蛋白质谱鉴定结果(7 cm,pH 3~10,NL)
Table 1 Identified proteins in bottled Chinese rice wine by MALDI-TOF/TOF MS
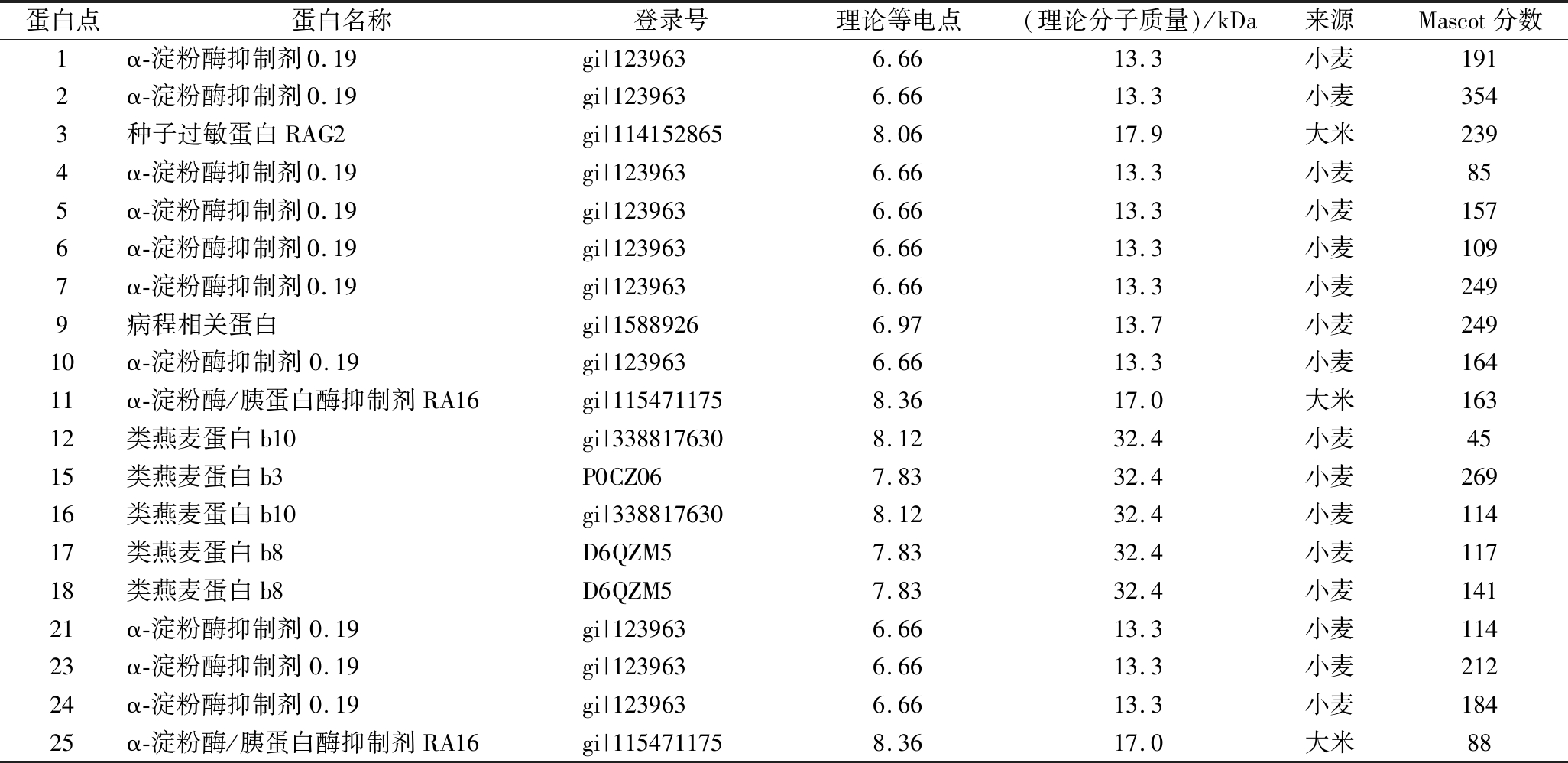
蛋白点蛋白名称登录号理论等电点(理论分子质量)/kDa来源Mascot分数1α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦1912α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦3543种子过敏蛋白RAG2gi|1141528658.0617.9大米2394α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦855α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦1576α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦1097α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦2499病程相关蛋白gi|15889266.9713.7小麦24910α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦16411α-淀粉酶/胰蛋白酶抑制剂RA16gi|1154711758.3617.0大米16312类燕麦蛋白b10gi|3388176308.1232.4小麦4515类燕麦蛋白b3P0CZ067.8332.4小麦26916类燕麦蛋白b10gi|3388176308.1232.4小麦11417类燕麦蛋白b8D6QZM57.8332.4小麦11718类燕麦蛋白b8D6QZM57.8332.4小麦14121α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦11423α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦21224α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦18425α-淀粉酶/胰蛋白酶抑制剂RA16gi|1154711758.3617.0大米88
由于α-淀粉酶抑制剂也大量存在于黄酒浑浊物中[10-11],说明该蛋白在瓶装黄酒包装后逐渐变得不稳定从而酒液中析出。有研究表明,浑浊产生受多种因素的影响[22],例如溶液的pH值和离子强度等[23],这些因素共同作用导致α-淀粉酶抑制剂的三级结构发生改变,进而使疏水基团暴露导致沉淀析出[23]。
2.2 α-淀粉酶抑制剂的分离纯化
瓶装酒中α-淀粉酶抑制剂的分离纯化,对于后续对其结构进行研究,找到特异性水解该蛋白的蛋白酶,提高黄酒的稳定性等,拓宽黄酒浑浊相关的研究均有重要意义。
2.2.1 不同饱和度(NH4)2SO4沉淀效果分析
为了保留α-淀粉酶抑制剂的活性,对其纯化时采用(NH4)2SO4进行蛋白的初步提取。由于黄酒成分较为复杂,使用(NH4)2SO4沉淀蛋白时,当添加至60%饱和度,浑浊物质逐渐析出,且酒液逐渐澄清,至70%左右饱和度时(NH4)2SO4不再溶解。因此,在用(NH4)2SO4沉淀蛋白之前,用1.3.2中添加CaCl2的方法处理黄酒样品,以除去其中的多糖物质。
用不同饱和度的(NH4)2SO4(20%~90%)沉淀处理后的黄酒样品,得到的沉淀经透析除盐后用于SDS-PAGE分析,结果如图2所示。对图2中的9条蛋白带进行质谱鉴定,结果见表2。除了条带1和5,其余6个蛋白条带均鉴定为α-淀粉酶抑制剂。因此,选用30%~90%饱和度的(NH4)2SO4进行蛋白的粗提取。
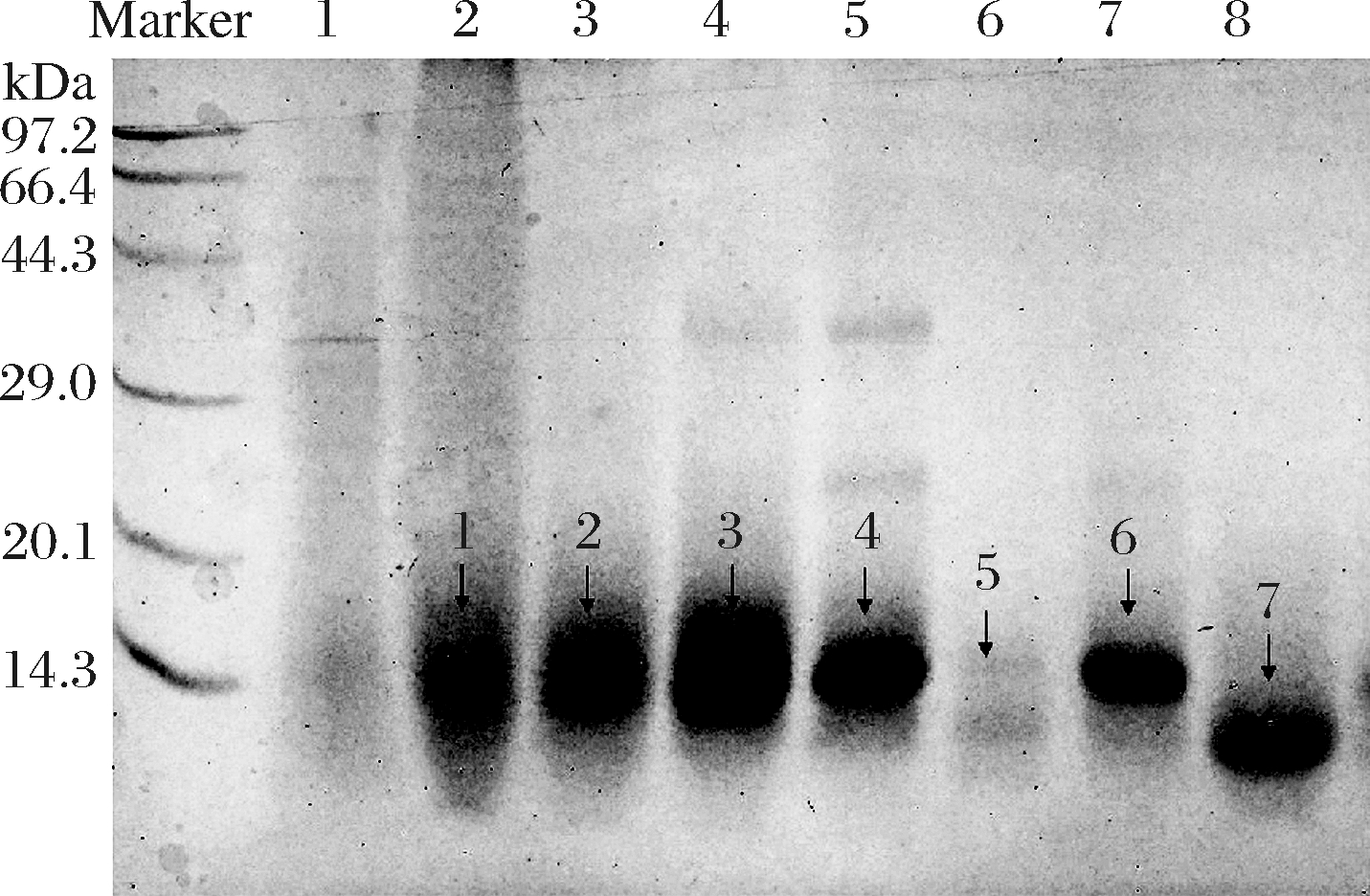
图2 不同饱和度硫酸铵沉淀蛋白的SDS-PAGE
Fig.2 SDS-PAGE of proteins precipitated by ammonium sulfate with different saturation
注:泳道1代表S1(~20%);泳道2代表S2(20%~30%);泳道3代表S3(30%~40%);泳道4代表S4(40%~50%); 泳道5代表S5(50%~60%);泳道6代表S6(60%~70%);泳道7代表S7(70%~80%);泳道8代表S8(80%~90%)。
表2 不同饱和度硫酸铵沉淀蛋白的质谱鉴定 (7 cm,pH 3~10,NL)
Table 2 Identified proteins precipitated by ammonium sulfate with different saturation by MALDI-TOF/TOF MS
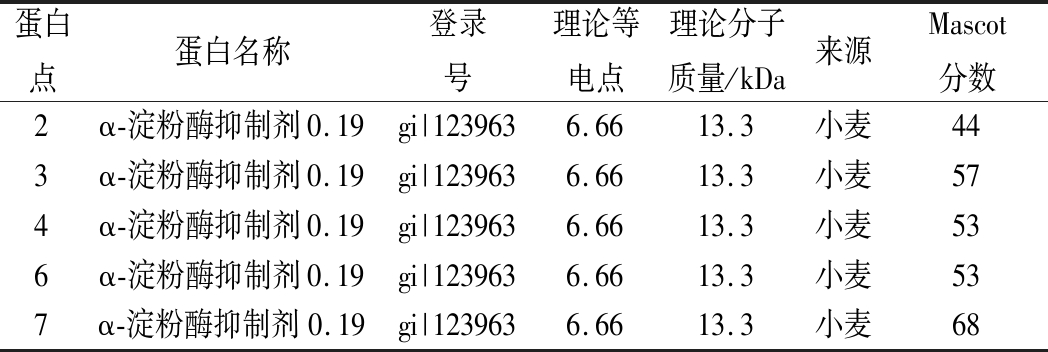
蛋白点蛋白名称登录号理论等电点理论分子质量/kDa来源Mascot分数2α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦443α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦574α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦536α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦537α-淀粉酶抑制剂0.19gi|1239636.6613.3小麦68
2.2.2 α-淀粉酶抑制剂的纯化
由于α-淀粉酶抑制剂0.19理论等电点为6.66,因此选用pH为8.0的Tris-HCl缓冲液为流动相,在该体系中,α-淀粉酶抑制剂0.19带负电荷,能与带正电荷的填料相结合。黄酒α-淀粉酶抑制剂经DEAE-Sepharose Fast Flow弱阴离子交换柱纯化结果见图3。
从图3可知道,经DEAE-sepharose fast flow弱阴离子交换柱纯化之后,得到3个蛋白峰,1个穿透峰(峰1),2个洗脱峰(峰2、峰3)。其中峰1所含蛋白为不带电或者带正电的蛋白,这2种蛋白没有与带正电荷的填料结合直接被洗脱下,因此不含有α-淀粉酶抑制剂0.19。将峰2和峰3分别收集,脱盐后对2个洗脱峰进行SDS-PAGE检测,结果如图4所示。

图3 α-淀粉酶抑制剂DEAE-Sepharose Fast Flow离子柱
Fig.3 DEAE-Sepharose Fast Flow of alpha-amylase inhibitor
从图4可以看出,峰2、峰3中均含有α-淀粉酶抑制剂0.19,将峰2与峰3冻干后称重,分别为0.5和7.8 g,由此可知目的蛋白α-淀粉酶抑制剂0.19主要存在于第3个蛋白峰中。由于经DEAE-sepharose fast flow弱阴离子交换柱纯化之后仍含有杂蛋白,因此需要进一步纯化。
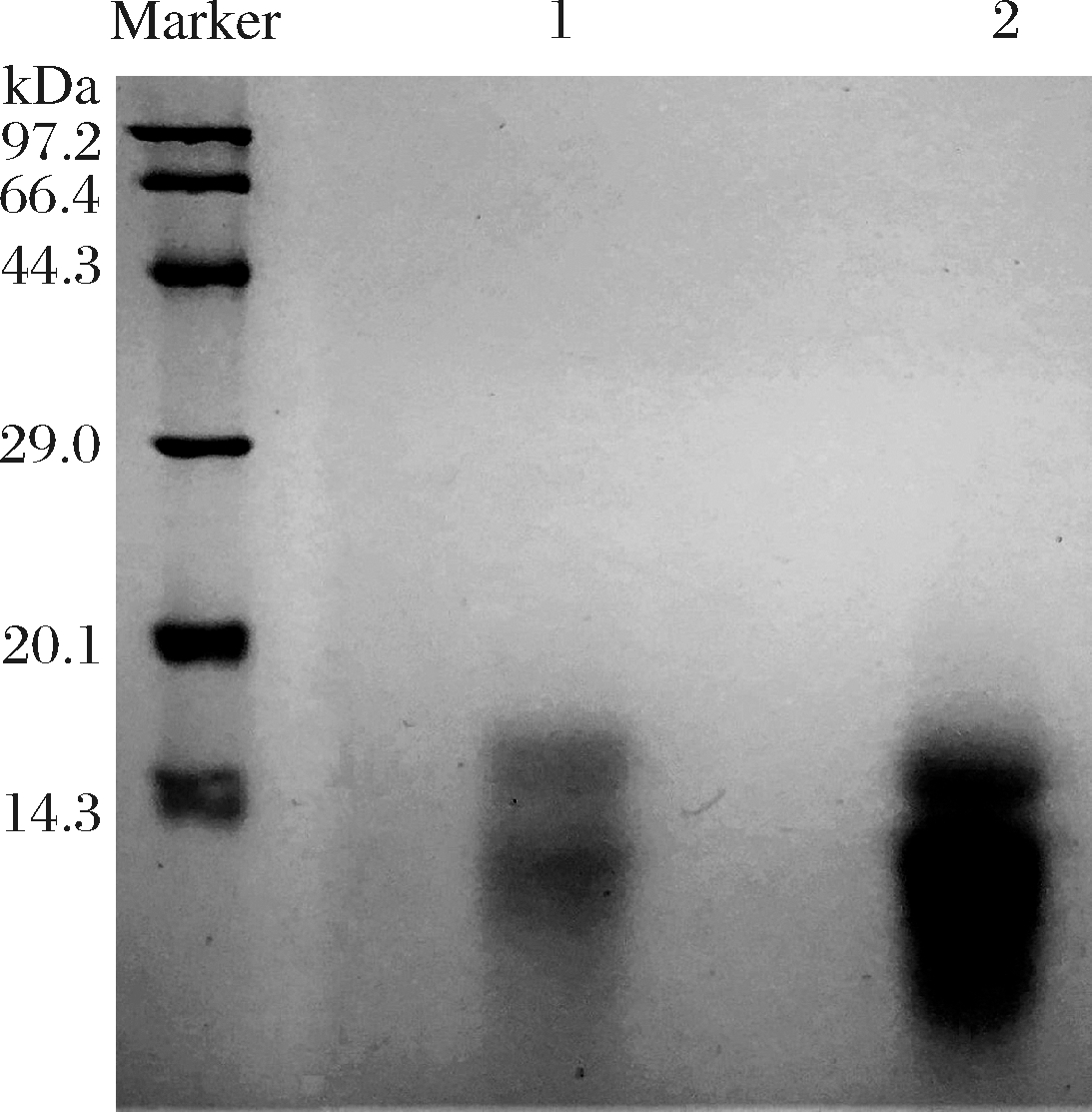
图4 DEAE-Sepharose Fast Flow离子柱纯化后蛋白的SDS-PAGE检测
Fig.4 SDS-PAGE of protein after separated by DEAE-Sepharose Fast Flow
注:泳道1代表峰2;泳道2代表峰3。
经DEAE-Sepharose Fast Flow弱阴离子交换柱纯化后得到的洗脱峰3,再用Sephacryl S-100凝胶柱进一步纯化。图5-a所示为该峰蛋白的Sephacryl S-100葡聚糖凝胶层析,峰3中的蛋白经Sephacryl S-100葡聚糖凝胶层析之后,得到1个蛋白峰,但有明显的拖尾现象,说明该峰的蛋白中含有一些杂蛋白。收集该峰1~21管蛋白样品,冷冻干燥后再次用Sephacryl S-100凝胶柱纯化,结果如图5-b所示;再次纯化得到1个对称的蛋白峰,说明该峰含有一个蛋白组分。对纯化后的蛋白进行SDS-PAGE检测,结果如图6所示。
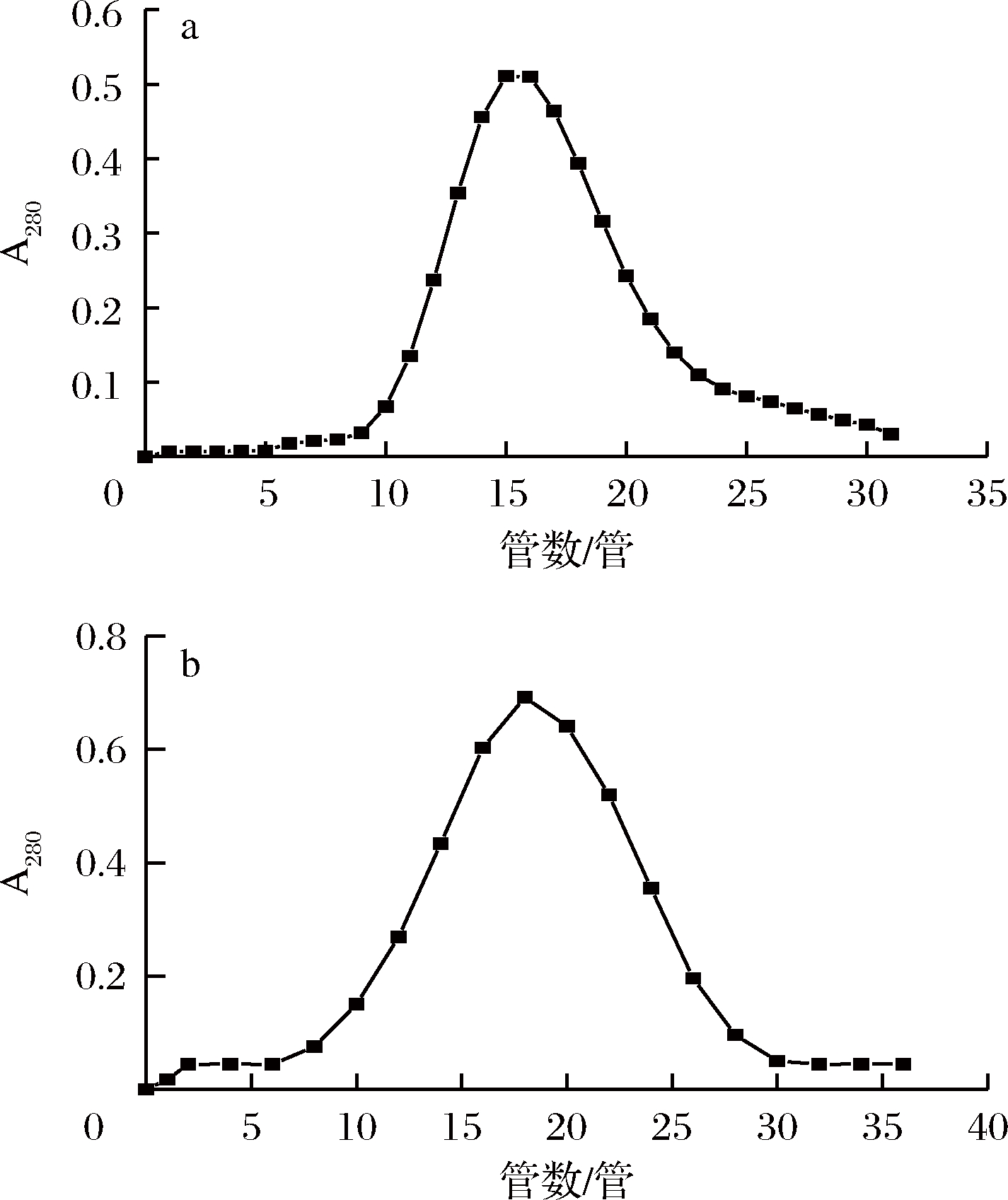
a-第一次Sephacryl S-100凝胶柱纯化;b-第二次SephacrylS-100凝胶柱纯化
图5 α-淀粉酶抑制剂的Sephacryl S-100葡聚糖凝胶层析
Fig.5 Seperation of α-amylase inhibitor on Sephacryl S-100

图6 Sephacryl S-100葡聚糖凝胶柱纯化后蛋白的SDS-PAGE检测
Fig.6 SDS-PAGE of protein purified by Sephacryl S-100
从图6可以看出,瓶装绍兴黄酒中的蛋白经(NH4)2SO4沉淀、DEAE-Sepharose Fast Flow弱阴离子交换柱及2次Sephacryl S-100凝胶柱层析纯化,得到电泳纯的α-淀粉酶抑制剂,经软件(Image Lab)计算分子质量为13.7 kDa。
小麦中的α-淀粉酶抑制剂有3种存在形式[25],分别是分子质量为12 kDa的单体、24 kDa的二聚体和64 kDa的四聚体,α-淀粉酶抑制剂的二聚体和四聚体均可裂解为分子质量约为13.3 kDa的单体,这与本试验中纯化得到的蛋白分子质量基本一致。分子质量为24 kDa的二聚体根据不同的电泳迁移率又可分为0.19、0.36、0.38和0.35等不同型号[24],因此,本研究中的α-淀粉酶抑制剂0.19属于二聚体的一种。研究发现小麦中不同分子质量的α-淀粉酶抑制剂的抑制活性与热稳定性不同,分子质量为12 kDa的单体仅能抑制昆虫淀粉酶的活性,而二聚体和四聚体形式的α-淀粉酶抑制剂对大多数哺乳动物中的淀粉酶都有很好的抑制作用[20];二聚-α-淀粉酶抑制剂在温度低于80 ℃时活性几乎不受影响,而四聚体α-淀粉酶抑制剂在温度低于60 ℃时活性保持稳定[20,25]。
3 结论
瓶装绍兴黄酒中的蛋白组成包括来源于小麦的α-淀粉酶抑制剂0.19、类燕麦蛋白(类燕麦蛋白b3、类燕麦蛋白b8、类燕麦蛋白b10)和病程相关蛋白,以及来源于大米种子的过敏蛋白RAG2和α-淀粉酶/胰蛋白酶抑制剂RA16,未鉴定到微生物来源的蛋白,其中,α-淀粉酶抑制剂0.19为瓶装绍兴黄酒的主要成分。瓶装绍兴黄酒中的蛋白经(NH4)2SO4盐析、DEAE-Sepharose Fast Flow离子交换柱纯化α-淀粉酶抑制剂0.19,得到3个蛋白峰,其中1个穿透峰(峰1),该峰所含蛋白的等电点≥8.0,2个洗脱峰(峰2、峰3),等电点<8.0,目的蛋白α-淀粉酶抑制剂0.19主要存在于第3个蛋白峰中;第3个峰的蛋白经2次Sephacryl S-100葡聚糖凝胶层析纯化后得到纯的α-淀粉酶抑制剂0.19,经SDS-PAGE检测,其分子质量为13.7 kDa。本试验纯化得到的α-淀粉酶抑制剂0.19属于二聚体蛋白,在酒中可裂解为分子质量约为13.3 kDa的单体。
[1] 冯芃菲, 冯庆义,栗竞帆,等. 黄酒发展现状及营销策略[J]. 中国市场, 2019(7):125-126.
[2] SHEN F, NIUX Y, YANG D T, et al. Determination of amino acids in Chinese rice wine by fourier transform near-infrared spectroscopy[J]. Agricultural and Food Chemistry, 2010, 58(17):9 809-9 816.
[3] QUE F, MAO L C, PAN X. Antioxidant activities of five Chinese rice wines and the involvement of phenolic compounds[J]. Food Research International, 2006, 39(5):581-587.
[4] 李敏, 韩惠敏,耿敬章,等. 黄酒的混浊沉淀及其控制研究进展[J]. 酿酒, 2019, 46(2):31-35.
[5] 齐小慧, 孙军勇,谢广发,等. 蛋白质对黄酒品质影响的研究进展[J]. 食品与发酵工业, 2018, 44(3):273-279.
[6] 杨国军, 俞关松,尉冬青. 黄酒中蛋白质分布及含量与酒质稳定性关系的研究[J]. 中国酿造, 2005 (10):47-49.
[7] 孔令琼. 黄酒麦曲浸提液的宏蛋白质组学研究[D]. 无锡:江南大学, 2011.
[8] 张波, 陆健. 绍兴黄酒熟麦曲的宏蛋白质组的样品制备方法研究[J]. 现代食品, 2018 (14):121-124.
[9] 张波, 余培斌,陆健. 绍兴黄酒熟麦曲制曲过程的宏蛋白质组学研究[J]. 中国酿造, 2014, 33(2):101-104.
[10] 樊世英. 黄酒蛋白稳定性的初步研究[D]. 无锡:江南大学, 2016.
[11] 谭新勇. 黄酒非生物混浊的初步研究[D]. 无锡:江南大学, 2013.
[12] 谢广发. 黄酒酿造技术[M]. 北京:中国轻工业出版社, 2016.
[13] CARPENTIER C S, WITTERS E, LAUKENS K, et al. Preparation of protein extracts from recalcitrant plant tissues: an evaluation of different methods for two-dimensional gel electrophoresis analysis[J]. Proteomics, 2005, 5(10):2 497-2 507.
[14] 孙军勇, 樊世英,谢广发,等. 绍兴黄酒混浊蛋白的分离鉴定及其氨基酸组成、二级结构分析[J]. 食品与发酵工业, 2016, 42(2):1-6.
[15] GOESAERT H, DEBYSER W, GEBRUERS K, et al. Purification and partial characterization of an endoxylanase inhibitor from barley[J]. American Association of Cereal Chemists, 2001, 78(4):453-457.
[16] 陆健. 蛋白质纯化技术及应用[M]. 北京:化学工业出版社, 2005.
[17] WANG W, VIGNANI R, SCALI M, et al. A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J]. Electronic Journals Service, 2006, 27(13):2 782-2 786.
[18] MAINENTE F, ZOCCATELLI G, LORENZINI M, et al. Red wine proteins: Two dimensional (2-D) electrophoresis and mass spectrometry analysis[J]. Food Chemistry, 2014, 164:413-417.
[19] ODA K, KAKIZONO D, YAMADA O, et al. Proteomic analysis of extracellular proteins from aspergillus oryzae grown under submerged and solid-state culture conditions[J]. Applied and Environmental Microbiology, 2006, 72(5):3 448-3 457.
[20] 王文蒙. α-淀粉酶抑制剂的提取、分离及性质研究[D]. 天津:天津商业大学, 2010.
[21] MIYAZAKI T, MORIMOTO T, MURAYAMA R, et al. Amylase inhibitors[J]. Biotechnology Advances, 1996, 14(1):518-518.
[22] FALCONER R, MARANGON M, VAN SLUYTER S C, et al. Thermal stability of thaumatin-like protein, chitinase, and invertase isolated from sauvignon blanc and semillon juice and their role in haze formation in wine[J]. Agricultural and Food Chemistry, 2010, 58(2):975-980.
[23] MATTEO M, VAN S S C, WATERS E, et al. Structure of haze forming proteins in white wines: Vitis vinifera thaumatin-like proteins[J]. Plos One, 2014, 9(12):e113757.
[24] 陈宁. 小麦α-淀粉酶抑制剂的药理药性研究[D]. 南京:南京工业大学, 2006.
[25] 张万山, 谢金平. α-淀粉酶抑制剂的特性及亚基组成分析[J]. 中国生化药物杂志, 2000, 21(3):121-123.