乳铁蛋白是一种由哺乳动物黏膜上皮细胞分泌产生的分子质量为80 kDa的糖基化蛋白,在不同物种间具有高度的同源性[1]。乳铁蛋白也是转铁蛋白家族的一员,对铁离子具有高度的亲和性,被认为是人类和哺乳动物防御系统的基本组成之一[2]。乳铁蛋白肽是乳铁蛋白在酸性条件下经胃蛋白酶消化得到的一种短肽,具有良好的耐热性、非抗原性、免疫调节活性和广谱抗菌、抗病毒等生物活性[3-5],目前,已在鼠、山羊、牛、骆驼等动物和人体内发现。研究表明,牛乳铁蛋白肽的抗菌活性更高[6]。
牛乳铁蛋白肽是从牛乳铁蛋白N端获得的长度为25个氨基酸残基的短肽(N17-41: FKCRR WQWRM KKLGA PSITC VRRAF),分子质量为3 126.4 Da,相对疏水性为48%,电荷数为+8,在牛乳铁蛋白分子中呈α-螺旋结构,当从牛乳铁蛋白分子上释放出来后,在水分子及盐离子的作用下,α-螺旋消失,转换为两亲性反向β-折叠结构[7],即亲水性基团和疏水性基团,分别排列在β-折叠两侧,这种结构上的变化使牛乳铁蛋白肽具有比牛乳铁蛋白更高的抗菌活性[8]。有研究表明,在发挥抑菌作用时,两亲性结构有利于促进牛乳铁蛋白肽与细菌细胞膜脂多糖的结合,带正电荷的氨基酸残基与带负电的磷脂发生静电相互作用,导致细胞膜穿孔,细胞内容物泄漏[9]。不同于传统抗生素的抑菌机制,牛乳铁蛋白新型抑菌机制有利于其作为抗生素替代药物的研发和应用。由于天然来源有限且制备工艺复杂,因此利用基因工程技术生产牛乳铁蛋白肽已成为一个趋势。
近年来,研究人员致力于抗菌肽结构-功能关系的研究,期望通过对抗菌肽两亲性参数,净电荷数,疏水性参数的改变获得具有更高生物活性的衍生肽[10]。EDWARDS等[11]通过对6种β-发卡型抗菌肽的研究发现,随着两亲性的增加,其抗菌活性也逐渐增加。作为一种两亲性阳离子活性肽,牛乳铁蛋白肽的活性与其两亲性密切相关。在形成β-折叠时,Phe1,Cys3,Trp6,Trp8,Leu13,Ala15,Pro16,Ile18和Cys20构成疏水表面,这对于其发挥抗菌功能是十分重要的[12]。STRØM等[13]对15个残基的牛乳铁蛋白肽进行了丙氨酸扫描实验,结果表明Trp6和Trp8是保持其活性的关键氨基酸,当将人乳铁蛋白肽(LfcinH)第8位Arg替换为Trp后,其抗菌活性明显提高。LEJON等[14]对牛乳铁蛋白肽进行了色氨酸替换研究,W3,14和W14都显示出比母肽更强的抗菌活性,可以看出3、4、10、14等为潜在的替换位点。牛乳铁蛋白肽作用机制和结构功能关系的研究有利于设计得到高活性的衍生肽。
在本研究中,基于抗菌肽的结构和功能之间的关系,利用抗菌肽数据库和生物信息学分析工具设计了LfcinB-W4,10 [15-16]。经过一系列的比较分析,牛乳铁蛋白肽第4位Arg和第10位Met被Trp替换后能够保持与母肽相似的空间结构,其正电荷数为+7,相较母肽有所降低,疏水残基比例提高到52%。通过抗菌肽数据库预测其抗菌活性优于母肽。将优化的LfcinB-W4,10基因插入分泌型表达载体pPIC9K中,线性化后电转入巴斯德毕赤酵母GS115中,诱导表达后发现发酵上清液具有较强的抗菌活性。实验研究为分析和优化牛乳铁蛋白肽的抗菌活性提供了理论基础。
1 仪器与试剂
Gene-Pluser XcellTM电转仪,美国伯乐公司; 1645050型DNA电泳仪,美国伯乐公司;Eppendorf 5418R型高速离心机,德国Eppendorf股份公司;SW-CJ系列超净工作台,苏州安泰空气技术有限公司;QY200型恒温摇床,上海福马实验设备有限公司;LSHZ-300系列恒温水与培养箱,太仓市强乐实验设备有限公司;BPMJ-250F系列霉菌培养箱,上海一恒科学仪器有限公司。大肠杆菌(Eschenchia coli)DH5α和金黄色葡萄球菌(Staphylococcus aureus)ATCC25923,为本实验室保藏;巴斯德毕赤酵母(Pichia pastoris)GS115及表达质粒pPIC9K,Invitrogen公司;遗传霉素G418,赛默飞世尔科技有限公司;限制性核酸内切酶EcoR I,Not I,Sac I和T4 DNA连接酶,Invitrogen公司;PCR引物和LfcinB-W4,10基因序列,由上海生工生物工程有限公司合成;基因组提取试剂盒,Qiagen公司。其他试剂均为分析纯。
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,固体培养基加入琼脂粉20;YPD培养基(g/L):蛋白胨20,酵母提取物10,葡萄糖20,固体培养基加入琼脂粉20;MD培养基(g/L):葡萄糖20,无氨基酵母氮源13.4,生物素10-4,琼脂粉20;MM培养基:甲醇50 mL/L,无氨基酵母氮源13.4 g/L,生物素10-4 g/L,琼脂粉20 g/L;BMGY培养基:蛋白胨20 g/L,酵母提取物10 g/L,无氨基酵母氮源13.4 g/L,生物素10-4 g/L,甘油100 mL/L;BMMY培养基:蛋白胨20 g/L,酵母提取物10 g/L,无氨基酵母氮源13.4 g/L,生物素10-4 g/L,甲醇25 mL/L。
2 方法与结果
2.1 LfcinB-W4,10的基因设计与合成
使用抗菌肽数据库APD(http://ap s.unmc.edu/AP/)[17]和ExPASy(http://we b.expasy.org/protparam)的预测工具对比分析牛乳铁蛋白肽和LfcinB-W4,10的物理和化学参数,包括净电荷、疏水残基的比例、分子质量、理论等电点、脂肪族指数和GRAVY(亲水性的平均值,亲水指数),结果如表1所示。相较于牛乳铁蛋白肽,LfcinB-W4,10的疏水残基由48%提升至52%,由于Arg的替换,其净电荷数由+8降低至+7,这可能有利于在表达过程中降低宿主蛋白酶对目的蛋白的降解。利用同源建模工具SWISS-MODEL(https://www.swissmodel.expasy.org/)[18]模拟牛乳铁蛋白肽和LfcinB-W4,10的空间结构,结果如图1所示,LfcinB-W4,10具有和牛乳铁蛋白肽相似的二级折叠结构,这使得LfcinB-W4,10依然具备和牛乳铁蛋白肽类似的生物学功能;通过抗菌肽数据库APD和CAMP(http://www.cam p.bicni rrh.res.in/index.php#)[19]的预测工具预测LfcinB-W4,10的抗菌活性,如表2所示,结果显示,LfcinB-W4,10的各项预测数据都高于牛乳铁蛋白肽,表明LfcinB-W4,10的设计在理论上具有可行性,为实验研究奠定了基础。根据毕赤酵母密码子偏好性优化得到基因序列,在序列两端添加EcoR Ⅰ和Not Ⅰ酶切位点(图2),交由生工生物工程有限公司合成。
表1 牛乳铁蛋白肽及LfcinB-W4,10理化参数分析
Table 1 Physical and chemical properties analysis of LfcinB and LfcinB-W4,10
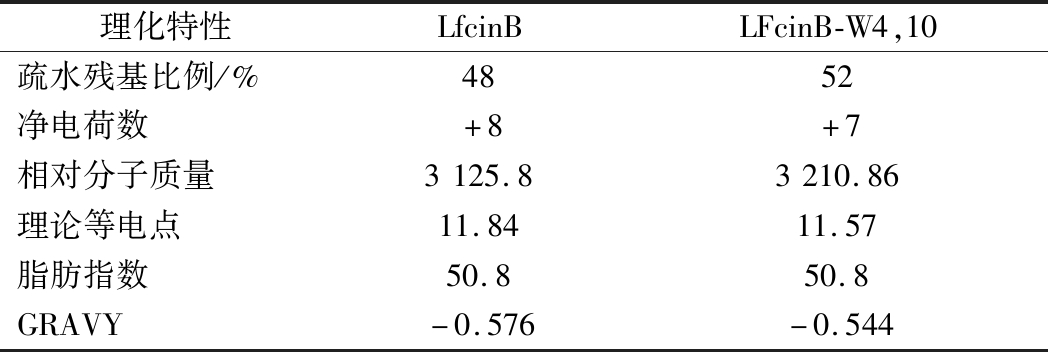
理化特性LfcinBLFcinB-W4,10疏水残基比例/%4852净电荷数+8+7相对分子质量3125.83210.86理论等电点11.8411.57脂肪指数50.850.8GRAVY-0.576-0.544
注: GRAVY,Grand average of hydropathicity,亲水性指数。

图1 牛乳铁蛋白肽和LfcinB-W4,10空间结构对比
Fig.1 Spatial structure comparison of LfcinB and LfcinB-W4,10
表2 LfcinB及LfcinB-W4,10抗菌活性预测
Table 2 The antimicrobial activity prediction of LfcinB and LfcinB-W4,10
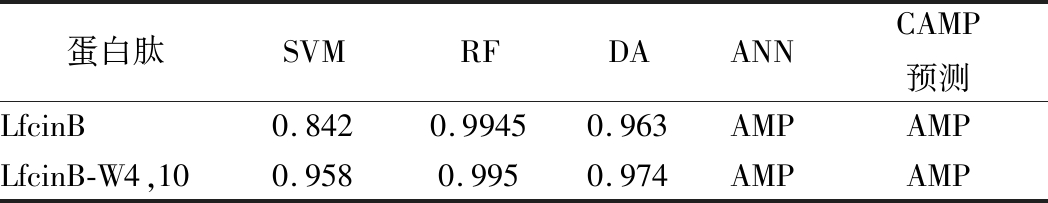
蛋白肽SVMRFDAANNCAMP预测LfcinB0.8420.99450.963AMPAMPLfcinB-W4,100.9580.9950.974AMPAMP
2.2 重组表达载体构建
使用限制性核酸内切酶EcoR Ⅰ和NotⅠ双酶切含有目的基因的扩增质粒pUC-SP-LFcinB-W4,10,经2.2%琼脂糖凝胶电泳检测(图3),检测到82 bp的条带,与目的基因大小一致,目的基因回收后与同样经EcoR Ⅰ 和Not Ⅰ 双酶切的外泌型表达质粒pPIC9K使用

图2 LfcinB-W4,10的基因序列
Fig.2 The gene sequence of LfcinB-W4,10
注:TGG、Trp表示酶切位点
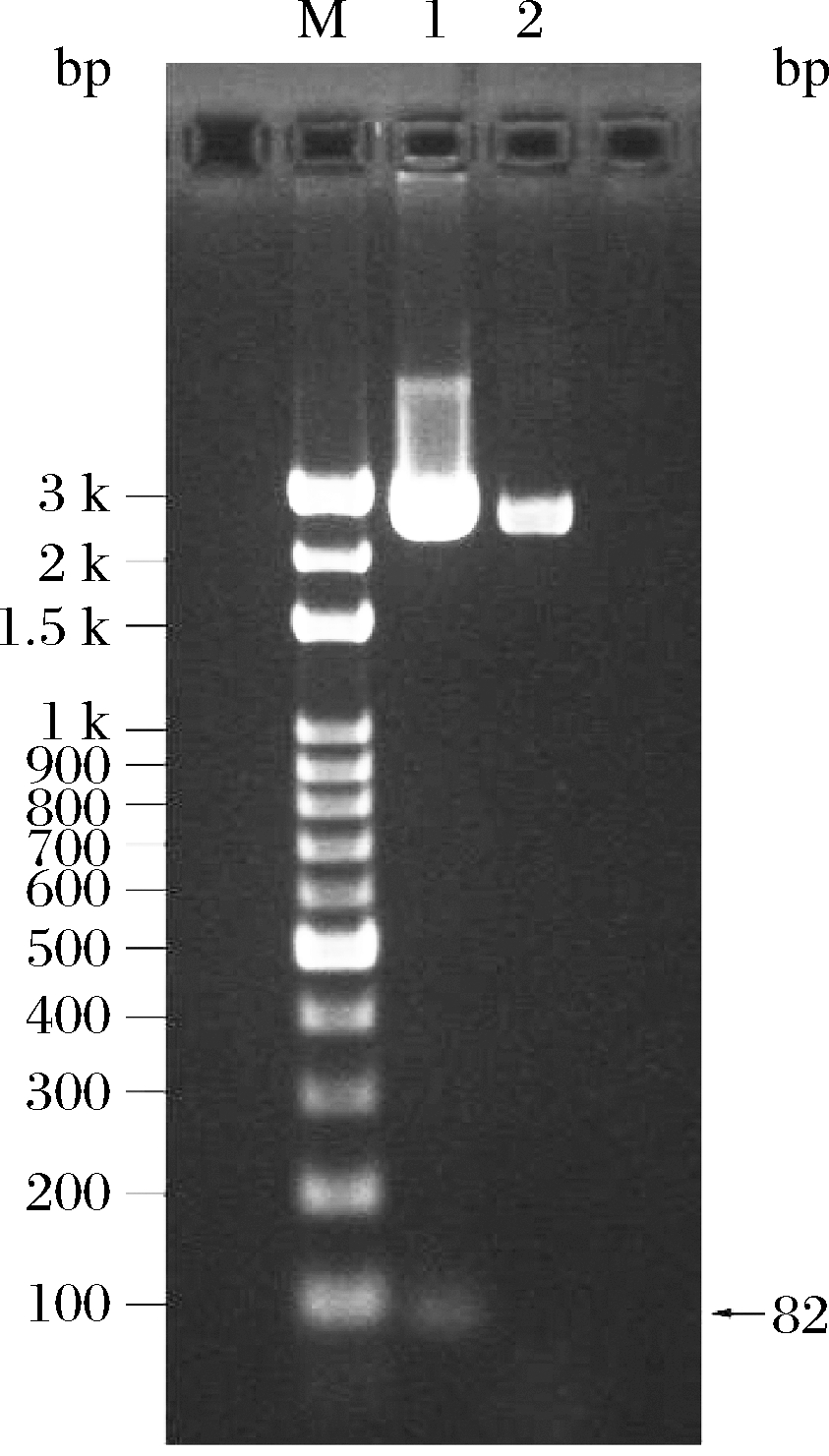
M-DNAmarker;1-目的基因LfcinB-W4,10;2-pUC-SP-LfcinB-W4,10
图3 pUC-SP-LfcinB-W4,10双酶切电泳
Fig.3 Agarose gel electrophoresis of pUC-SP-LfcinB-W4,10
T4 DNA连接酶进行连接,构建得到表达载体pPIC9K-LFcinB-W4,10(图4)。图4将构建好的表达载体转化感受态大肠杆菌DH5α进行扩增,扩增后的表达载体进行双酶切鉴定,根据重组质粒和空载质粒的序列分析,当使用Avr Ⅱ和Nde I进行双酶切鉴定时,空载质粒被切成5 881 bp和3 395 bp的2条DNA电泳条带,而重组质粒由于缺失了Avr Ⅱ酶切位点只能够被线性化,电泳时表现为1条条带(图5),结果与预期相符,说明重组质粒构建成功。

图4 重组表达载体pPIC9K-LFcinB-W4,10构建
Fig.4 Construction of recombinant expression vector pPIC9K-LFcinB-W4,10
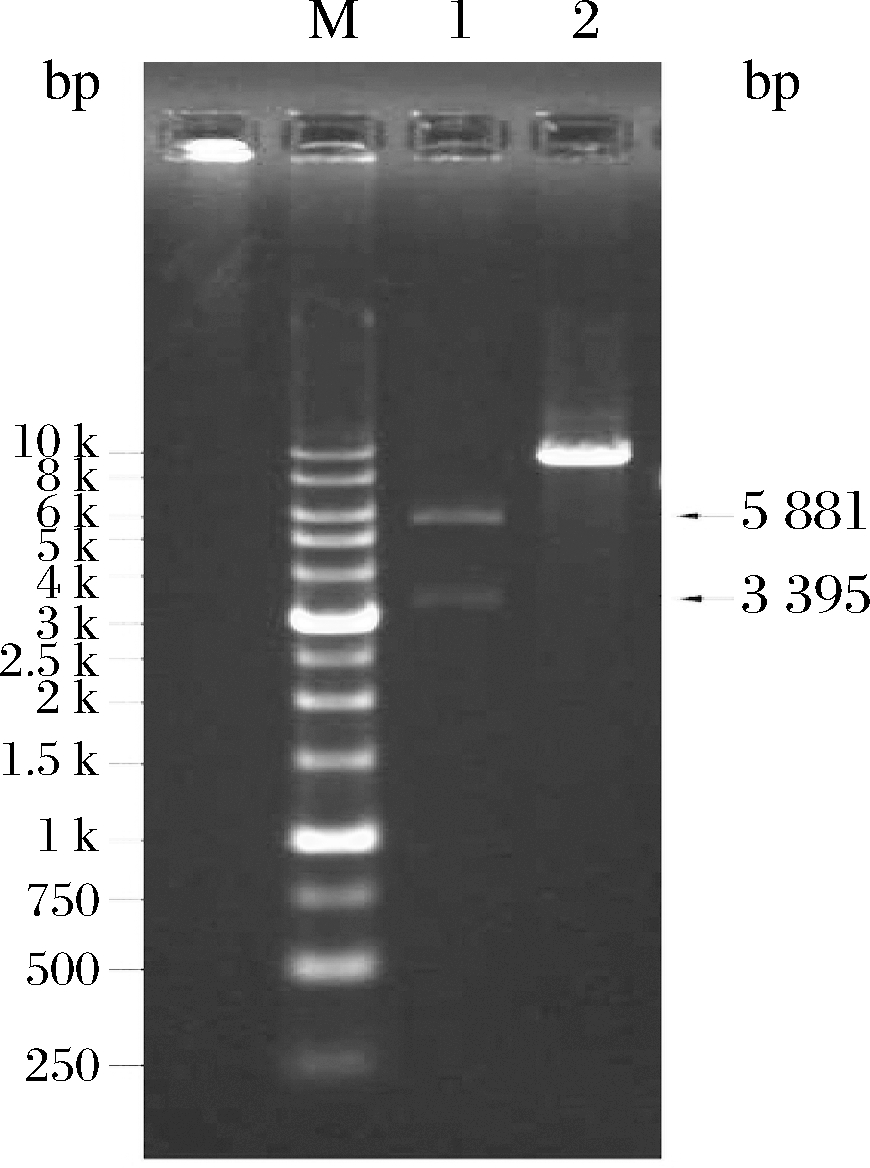
M-DNAmarker 1-pPIC9K-LfcinB-W4,10;2-pPIC9K
图5 pPIC9K-LFcinB-W4,10双酶切鉴定
Fig.5 Dual-Enzyme Digestion of pPIC9K-LFcinB-W4,10
2.3 重组表达载体转化毕赤酵母
根据毕赤酵母表达手册所述方法制备感受态毕赤酵母GS115,将已鉴定的阳性重组表达载体pPIC9K-LFcinB-W4,10经Sac I酶切线性化后电转化毕赤酵母[20],将菌液涂布于MD培养基,30 ℃培养2~3 d直至转化子长出。
2.4 高拷贝转化子的筛选及甲醇利用型鉴定
将上一步获得的pPIC9K-LfcinB-W4,10-GS115转化子涂布于含有渐增浓度(0.5~4.0 mg/mL)G418的YPD琼脂平板,30 ℃培养2~3 d筛选得到高拷贝转化子。根据拷贝数和G418质量浓度的关系[21],在G418质量浓度为2 mg/mL的YPD平板上得到拷贝数约为8的转化子。
使用无菌牙签挑取拷贝数为8的转化子,分别点接种至MM和MD平板,30 ℃培养2~3 d待转化子长出。MM培养基中,甲醇为唯一碳源,MD平板中葡萄糖为唯一碳源。甲醇利用型为Mut+的转化子在2种平板上能够正常生长,甲醇利用型为Muts的转化子在MD平板上正常生长,在MM平板上生长缓慢。根据生长速度的快慢,可确定转化子的甲醇利用型。
2.5 高拷贝转化子PCR鉴定
挑取10个转化子提取酵母基因组DNA并且进行PCR扩增,扩增引物为5′AOX Ⅰ:5′-GACTGGTTCCAATTGACAAGC-3′与3′AOXⅠ:GCAAATG GCACTG ACATCC-3′。实验设置双蒸水作为空白对照,未转化质粒的酵母基因组为阴性对照。PCR产物使用琼脂糖凝胶电泳进行检测,结果如图6所示, 3号为假阳性转化子,4~12号为阳性转化子,在562 bp处出现含有目的基因的扩增条带,其中,4~9,11,12号转化子在2.2 k出现甲醇脱氢酶AOX I基因的条带,其甲醇利用型为Mut+,10号在2.2 k处未出现条带,其甲醇利用型为Muts。结果证明,9个转化子成功整合目的基因。

1-空白对照;2-阴性对照;3~12-转化子基因组PCR
图6 转化子PCR鉴定
Fig.6 Identification by PCR of transformants genome
2.6 LfcinB-W4,10的诱导表达
挑取经PCR鉴定为阳性克隆的重组酵母转化子单克隆接入5 mL BMGY培养基,30 ℃,200 r/min培养24 h,随后接入100 mL BMGY培养基培养20 h至OD600为2~6。然后4 100 r/min离心5 min收集菌体,于250 mL三角瓶中用100 mL BMMY培养基重悬菌体,30 ℃,200 r/min振荡诱导培养,每隔24 h取样1 mL用于检测其抑菌活性并补充甲醇,使甲醇终浓度占体积分数2.5%。
2.7 抑菌活性检测
采用抑菌圈法检测LfcinB-W4,10的抑菌活性,将100 μL过夜培养的金黄色葡萄球菌菌液加入20 mL LB培养基中混匀,倒入已灭菌的培养皿中。待凝固后用已灭菌的打孔器打孔,每孔加入80 μL发酵上清液,以40 μL氨苄青霉素溶液(100 mg/mL)作为阳性对照,以未转化的酵母发酵上清液为阴性对照,于37 ℃培养16 h,检测其抑菌活性。结果如图7所示,图中7-A为40 μL 100 mg/mL的氨苄青霉素作为阳性对照,孔6为 80 μL未转化重组表达载体的毕赤酵母GS115在相同诱导条件下的发酵上清液作为阴性对照。随着发酵时间的增加,发酵上清液产生的抑菌圈逐渐增大(图8),但是当发酵时间超过96 h后,抑菌效果有所降低,这可能是因为宿主蛋白酶使目的蛋白发生了降解。
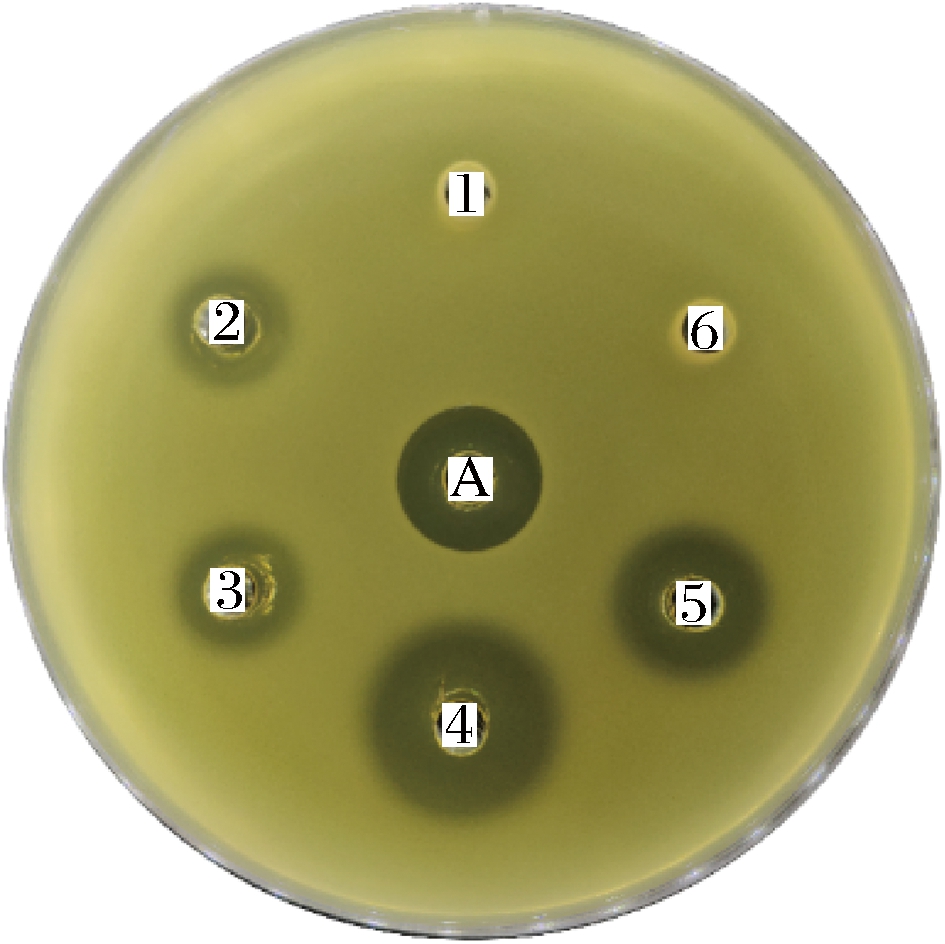
1-24 h发酵上清液; 2-48 h发酵上清液; 3-72 h发酵上清液;4-96 h发酵上清液; 5-120 h发酵上清液;6-未转化目的基因的毕赤酵母GS115发酵上清液;A-阳性对照
图7 发酵液对金黄色葡萄球菌的抑菌活性
Fig.7 Antibacterial activity of fermentation broth against Staphylococcus aureus
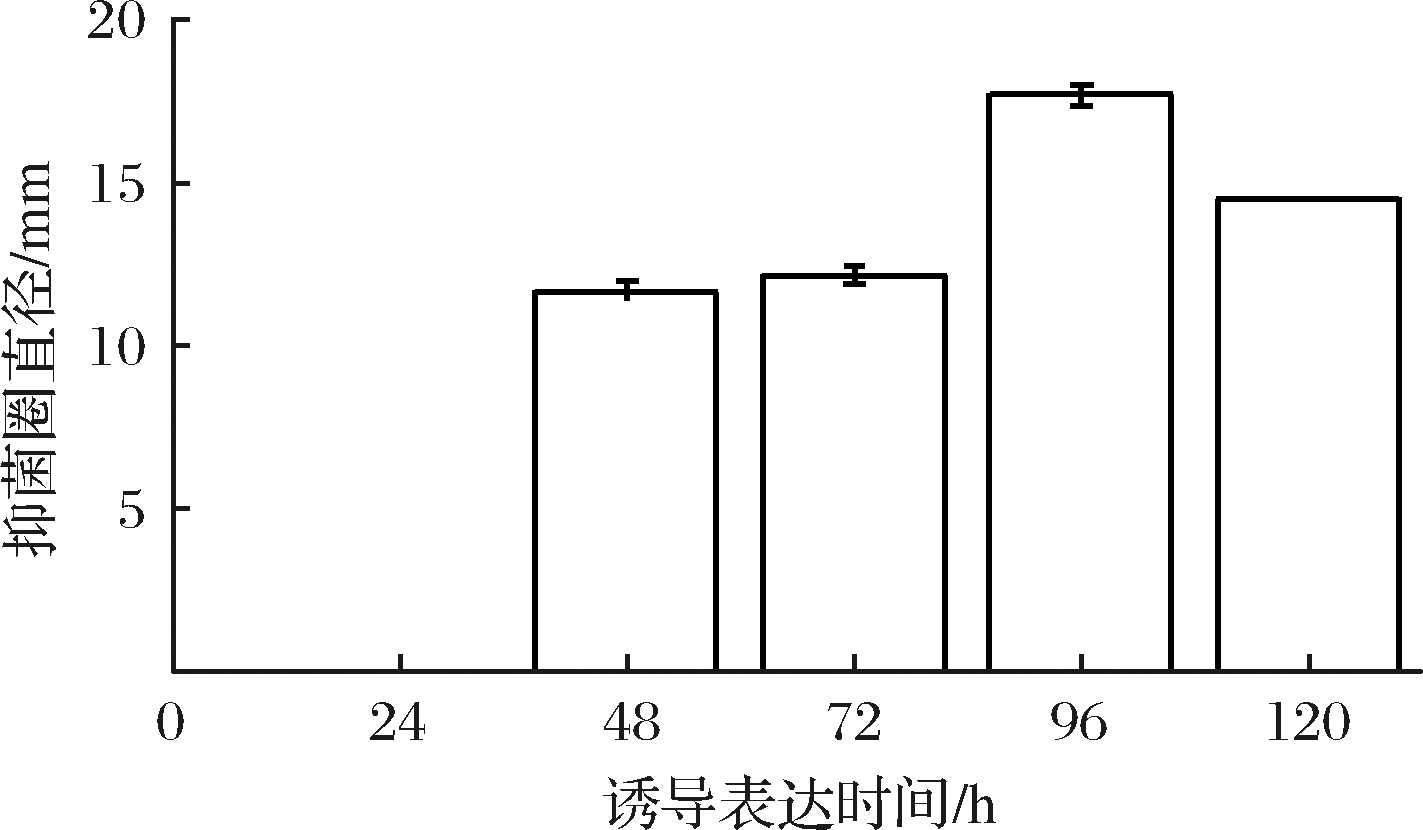
图8 不同诱导时间抑菌圈直径
Fig.8 The diameter of the inhibition zone in different time
把对照的原生肽LFcinB与衍生肽LFcinB-W4,10采用抑菌圈法检测,如图9所示,孔1和孔3为原生肽LfcinB,分别加入40 μL和80μL发酵上清液。孔2和孔4为衍生肽LfcinB-W4,10,也分别加入40 μL和80 μL发酵上清液。以40 μL氨苄青霉素溶液(100 mg/mL)作为阳性对照,于37 ℃培养16 h,检测其抑菌活性。结果显示,衍生肽的抗菌活性要优于原生肽抗菌活性。

孔1~4的抑菌圈直径分别为15、18、23和25 cm
图9 LFcinB与LFcinB-W4,10的抑菌活性比较
Fig.9 Compared antibacterial activity between LFcinB and LFcinB-W4,10
2.8 Tricine-SDS-PAGE鉴定
根据抑菌活性检测结果,在诱导培养第96小时,收集发酵上清液,使用18%含6 mol/L尿素的分离胶Tricine-SDS-PAGE分析,结果如图10所示,转化子组在3.2 kDa处有1条明显的条带,与实验设计的LfcinB-W4,10氨基酸残基的短肽相对分子质量一致。而空菌在相同条件下的发酵上清液没有条带,表明LfcinB-W4,10在毕赤酵母中有效分泌表达。

M-蛋白marker;1-空菌;2-转化子
图10 Tricine-SDS-PAGE检测
Fig.10 The detection of LfcinB-W4,10 by Tricine-SDS-PAGE
3 讨论
实验在综合分析其他实验研究的基础上,对LfcinB基因进行了多位点突变,旨在探究氨基酸残基的改变对其抗菌活性的影响,对衍生肽和原肽进行理化性质、空间结构、抑菌活性的分析,为获得更高活性的衍生肽奠定了基础。根据毕赤酵母分泌型穿梭表达质粒pPIC9K的多克隆位点,在目的基因两侧添加了EcoR I和Not I的限制性酶切位点,将合成的LfcinB-W4,10基因克隆至表达载体,经Sac I线性化后电转至毕赤酵母宿主菌GS115中,经筛选得到G418高抗性阳性转化子,提取酵母基因组进行PCR鉴定,获得9株整合成功的阳性转化子且甲醇利用型8株为Mut+,1株为Muts。经甲醇诱导后对其抗菌活性进行分析发现,有1株菌蛋白表达较快,抑菌效果较好,另外8株在诱导72 h后也表现出较强的抑菌活性。诱导表达96 h后,其抑菌活性有所下降,这可能是因为宿主蛋白酶降解异源蛋白造成的[22-23]。在进一步的实验中,将对培养温度,甲醇诱导浓度等条件进行优化以期获得大量LfcinB-W4,10。
抗菌肽由于其抗菌原理不同于传统抗生素,不具有传统抗生素所具有的抗药性,这有利于其作为抗生素替代药物的研发和应用。天然存在的乳铁蛋白,来源有限且制备工艺复杂,抗菌活性低,因此利用基因工程技术生乳铁蛋白肽已成为一个趋势。本文从生物信息学分析工具开始,基于抗菌肽结构和功能的关系设计了LfcinB衍生肽LfcinB-W4,10,实验结果表明,抗菌肽LfcinB-W4,10基因已正确整合到酵母基因组,并且获得表达,衍生肽具有良好的抑菌活性,而酵母发酵可以大规模生产目的蛋白,两者结合,为大规模工厂化生产抗菌肽奠定了良好的基础。
[1] GONZ LEZ-CH
LEZ-CH VEZ S A, ARÉVALO-GALLEGOS S, RASC
VEZ S A, ARÉVALO-GALLEGOS S, RASC N-CRUZ Q. Lactoferrin: Structure, function and applications [J]. Int J Antimicrob Ag, 2009, 33(4): 1-8.
N-CRUZ Q. Lactoferrin: Structure, function and applications [J]. Int J Antimicrob Ag, 2009, 33(4): 1-8.
[2] PANTELEEV P V, BOLOSOV I A, BALANDIN S V, et al. Structure and biological functions of β-hairpin antimicrobial peptides [J]. Acta Naturae, 2015, 7(1): 37-47.
[3] SHESTAKOV A, JENSSEN H, NORDSTRÖM I, et al. Lactoferricin but not lactoferrin inhibit herpes simplex virus type 2 infection in mice [J]. Antiviral Res, 2012, 93(3): 340-345.
[4] BO L Y, LI T J, ZHAO X H. Effect of Cu/Mn-fortification on in vitro activities of the peptic hydrolysate of bovine lactoferrinagainst human gastric cancer BGC-823 cells[J]. Molecules, 2019, 24(7):1 195.
[5] AHMADINIA K, YAN D, ELLMAN M, et al. The anti-catabolic role of bovine lactoferricin in cartilage [J]. Biomolecular Concepts, 2013, 4(5): 495-500.
[6] STRØM M B, REKDAL O, SVENDSEN J S. Antibacterial activity of 15-residue lactoferricin derivatives [J]. Chem Biol Drug Des, 2000, 56(5): 265-274.
[7] VEGA S C, MART NEZ D A, CHAL
NEZ D A, CHAL M D S, et al. Design, synthesis and evaluation of branched RRWQWR-based peptides as antibacterial agents against clinically relevant gram-positive and gram-negative pathogens[J]. Front Microbiol, 2018, 2(9):329.
M D S, et al. Design, synthesis and evaluation of branched RRWQWR-based peptides as antibacterial agents against clinically relevant gram-positive and gram-negative pathogens[J]. Front Microbiol, 2018, 2(9):329.
[8] SINHA M, KAUSHIK S, KAUR P, et al. Antimicrobial lactoferrin peptides: The hidden players in the protective function of a multifunctional protein [J]. Int J Pept, 2013:1-12.
[9] PRITCHARD S R, KAILASAPATHY K. Dairy Ingredients for Food Processing [M]. Oxford, U K: Wiley-Blackwell, 2011:3-33.
[10] CHOU H T, KUO T Y, CHIANG J C, et al. Design and synthesis of cationic antimicrobial peptides with improved activity and selectivity against Vibrio spp. [J]. Int J Antimicrob Agents, 2008, 32(2): 130-138.
[11] EDWARDS I A, ELLIOTT A G, KAVANAGH A M, et al. Contribution of amphipathicity and hydrophobicity to the antimicrobial activity and cytotoxicity of β-hairpin peptides [J]. Acs Infectious Diseases, 2016, 2(6): 442-450.
[12] HOLLMANN A, MART -NEZ M, NOGUERA M E, et al. Role of amphipathicity and hydrophobicity in the balance between hemolysis and peptide-membrane interactions of three related antimicrobial peptides [J]. Colloid Surf. B:Biointerfaces, 2016, 141: 528-536.
-NEZ M, NOGUERA M E, et al. Role of amphipathicity and hydrophobicity in the balance between hemolysis and peptide-membrane interactions of three related antimicrobial peptides [J]. Colloid Surf. B:Biointerfaces, 2016, 141: 528-536.
[13] SUN C, LI Y, CAO S, et al. Antibacterial activity and mechanism of action of bovine lactoferricin derivatives with symmetrical amino acid sequences[J]. Int J Mol Sci, 2018, 19(10):76.
[14] DRAGO-SERRANO M E, CAMPOS-RODRIGUEZ R, CARRERO J C, et al. Lactoferrin and peptide-derivatives: Antimicrobial agents with potential use in nonspecific immunity modulation[J]. Curr Pharm Des, 2018,24(10):1 067-1 078.
[15] BRANDENBURG L O, MERRES J, ALBRECHT L J, et al. Antimicrobial peptides: Multifunctional drugs for different applications [J]. Polymers, 2012, 4(1): 539-560.
[16] HAMMAMI R, FLISS I. Current trends in antimicrobial agent research: Chemo- and bioinformatics approaches [J]. Drug Discov Today, 2010, 15(13-14): 540-546.
[17] WANG G, XIA L, ZHE W. APD3: The antimicrobial peptide database as a tool for research and education [J]. Nucleic Acids Res, 2016, 44(Database issue): D1 087-D1 093.
[18] BERTONI M, KIEFER F, BIASINI M, et al. Modeling protein quaternary structure of homo- and hetero-oligomers beyond binary interactions by homology [J]. Sci Rep, 2017, 7(1): 10 480.
[19] HANIF W F, SHANKAR B R, PRATIMA G, et al. CAMPR3: A database on sequences, structures and signatures of antimicrobial peptides [J]. Nucleic Acids Res, 2016, 44(Database issue):D1 094-D1 097.
[20] CREGG J M. DNA-mediated transformation [J]. Methods Mol Biol, 2007, 389: 27-42.
[21] SEMPLE J I, LEHNER B. Single and dual drug selection for transgenes following bombardment of Caenorhabditis species[J]. Methods, 2014, 68(3):409-416.
[22] JAYANTA S, PLANTZ B A, MEHMET I, et al. Causes of proteolytic degradation of secreted recombinant proteins produced in methylotrophic yeast Pichia pastoris: Case study with recombinant ovine interferon-tau [J]. Biotechnol. Bioeng, 2010, 89(1): 102-112.
[23] NI Z, ZHOU X, SUN X, et al. Decrease of hirudin degradation by deleting the KEX1 gene in recombinant Pichia pastoris [J]. Yeast, 2008, 25(1): 1-8.