γ-氨基丁酸(γ-aminobutyric acid, GABA)是一种天然非蛋白质类氨基酸,具有降血糖、降血压及抗抑郁等重要的生理功能,作为功能性食品在市场上具有较广的前景[1-4]。其主要是由谷氨酸脱羧酶(glutamic acid decarboxylase, GAD)催化L-谷氨酸形成。GABA的测定方法有很多种,比如柱前衍生化高效液相色谱法[5-7]、核磁共振波谱技术[8]、气质联用法[9]、毛细管电泳法[10-11]、分光光度法[12-14]、氨基酸分析仪测定法[15]等。但以上方法大部分仪器昂贵、耗时较长、过程繁琐,不适合实验室大批量定性定量检测GABA。
纸层析能够快速定性检出各种氨基酸物质,其中GABA常用的定性方法就是通过纸层析法直观检测出来,采用洗脱手段将薄层色谱上的目标氨基酸斑点洗脱下来,结合分光光度计在一定波长下检测出对应浓度的吸光度[16-17]。纸层析-分光光度法既能定性又能定量检测出氨基酸,且检测出的GABA是纯物质,消除了发酵液中其他物质的干扰,大大提高了试验的准确性与高效性,为后续提纯GABA试验过程奠定了基础[18]。但分光光度计检测过程相对繁琐,耗时较长,1次能检测的样品数有限,降低了试验速度与效率。酶标仪检测原理与分光光度计一样,但酶标仪能够同时检测多个样品,检测时间少,所需样液少,节约了大量试剂,并在一定程度上保护了环境。
目前关于纸层析-酶标仪法测定微孔板发酵液中GABA产量的方法还未见文献报道,因此本研究建立纸层析-酶标仪法,并对影响此方法的重要因素进行优化,为后续高通量选育GABA高产菌株奠定了基础。
1 材料与方法
1.1 材料与仪器
GABA为标准品;CuSO4·5H2O、无水乙醇、正丁醇、冰醋酸,均为分析纯;茚三酮为BP级;以上试剂均购于生工生物;水为超纯水。
层析液:V(正丁醇)∶V(冰醋酸)∶V(水)=5∶3∶2,加入12 g/L的茚三酮[19]。
洗脱液:质量分数为75%乙醇∶6 g/L CuSO4·5H2O(体积比)为38∶2[19]。
全波长酶标仪,Thermo;TU-1810紫外可见分光光度计,北京普析;振荡水浴锅,天瑞仪器。
1.2 菌株
粪肠乳酸球菌(L-120-1)由本实验室保藏。
1.3 培养基
种子培养基(g/L):胰蛋白胨10,酵母浸出粉10,葡萄糖5,吐温-80 0.1 mL,K2HPO4 0.2,柠檬酸二铵0.2,MgSO4 0.2,MnSO4 0.05,CH3COONa·3H2O 5;115 ℃灭菌30 min,1 mL/96孔板,100 mL/250 mL摇瓶,100 r/min培养16 h。
发酵培养基(g/L):胰蛋白胨5,酵母浸出粉5,葡萄糖10,丁二酸钠5,L-谷氨酸 10;115 ℃灭菌30 min,1 mL/96孔板,75 mL/250 mL摇瓶,静置培养3 d。
1.4 试验方法
1.4.1 检测波长的选择
将新华一号滤纸裁剪成所需大小,滤纸下端2 cm处轻轻画1条直线,在线上每隔2 cm画1个小圆圈,圈直径不超过3 mm,用微量取样器吸取质量浓度为5.5 g/L标准样液1 μL点在小圆圈内,点样点干后,将层析纸卷成桶状固定住并垂直放进已被层析液饱和12 h的层析缸内,密闭层析一定时间,后取出滤纸,并用烘干枪吹干,待出现紫色斑点且斑点大小及形状不变时,将斑点剪下并放入5 mL洗脱液中,洗脱条件:40 ℃,80 r/min,水浴洗脱30 min。使用酶标仪在200~900 nm进行全波长扫描,确定GABA的最大吸收峰。
1.4.2 GABA测定原理及方法
测定原理:GABA在纸层析过程中会与茚三酮反应且经过高温显色生成紫红色斑点,乙醇能够洗脱下斑点并与铜离子结合,生成红色离子缔合物,在一定的波长下有最大吸收峰,可以测定发酵液中的GABA产量[19]。
纸层析-分光光度法:按照参考文献[13]测定发酵液中GABA产量。
纸层析-酶标仪法:取1 mL的发酵液于6 000 r/min离心5 min,后取上清液在沸水中煮5 min,用微量取样器吸取1 μL按1.4.1同样方式处理,使用酶标仪测定吸光度。
1.4.3 测定方法中主要影响因素的优化
分别配制质量浓度为1、5、10 g/L的GABA标准溶液,按照1.4.2的测定方法对主要影响因素即层析液中显色剂-茚三酮的浓度、展开剂-正丁醇与冰醋酸与水三者体积比、洗脱液中乙醇的体积分数,乙醇与6 g/L CuSO4·5H2O体积比进行优化。其中对显色剂-茚三酮浓度进行优化时,茚三酮浓度值分别为4、8、12、16 g/L;展开剂-正丁醇∶冰醋酸∶水配比优化时设为(体积比)5∶3∶2、5∶2∶3、5∶1∶4、2∶1∶1、3∶2∶1、3∶1∶2、2∶3∶1;对洗脱液中乙醇的体积分数进行优化时,乙醇的体积分数值设为0、25%、50%、75%、100%;洗脱液中乙醇与6 g/L CuSO4·5H2O配比优化时设为(体积比)39∶1、38∶2、37∶3、36∶4。
1.4.4 标准曲线的建立
精确配制10 g/L的GABA标准液,分别稀释成1、2、3、4、5、6、7 g/L,按优化后的方法分别使用酶标仪与分光光度计测定吸光度,建立标准曲线1、2。
1.4.5 稳定性试验
用微量取样器吸取5 g/L GABA标准样液1 μL按优化后的方法进行处理后放入5 mL洗脱液中,分别洗脱10、20、30、60、90 min,使用酶标仪测定吸光度。
1.4.6 精密度试验
将质量浓度分别为1.5 g/L和6.5 g/L的GABA标准品分别加入到已知质量浓度的发酵液中,按照优化后的方法测定吸光度,计算标准品浓度,每组样品设置3个重复。
1.4.7 加标回收率试验
将质量浓度分别为2、3、4、5、6 g/L的GABA标准品分别加入到已知质量浓度的发酵液中,按照优化后的方法测定吸光度,计算标准品浓度及回收率,每组样品设置3个重复。
1.4.8 两种方法拟合验证
将经过ARTP诱变后所获得的30株突变株进行96孔板发酵,分别使用优化后的纸层析-酶标仪法和纸层析-分光光度法同时测定发酵液中GABA产量,并利用origin 9.1软件进行曲线拟合。
2 结果与分析
2.1 检测波长的选择
如图1所示,GABA经过一系列反应生成的红色离子缔合物在512 nm处有最大吸收峰,故接下来的试验采用512 nm为检测波长。

图1 γ-氨基丁酸紫外可见吸收光谱
Fig.1 UV absorption spectra of GABA
2.2 测定方法中主要影响因素的优化
分别对纸层析-酶标仪法的主要影响因素即层析液中显色剂-茚三酮的浓度、展开剂-正丁醇与冰醋酸与水3者体积比、洗脱液中乙醇的体积分数,乙醇与6 g/L CuSO4·5H2O体积比进行优化,结果如下:
2.2.1 层析液中茚三酮浓度对吸光度的影响
按1.4.2测定方法所测得的结果如图2。如图2所示,利用3种质量浓度(1、5、10 g/L)的GABA进行试验,均出现随着层析液中茚三酮浓度的逐渐增加,GABA反应生成的红色离子缔合物吸光度先增加后减少,且在茚三酮质量浓度达到8 g/L时,反应体系的吸光度达到最大的现象。此种现象出现的原因可能是当茚三酮质量浓度为8 g/L时,GABA与茚三酮能够更好地结合且反应灵敏,经过高温显色后生成紫红色斑点效果最好,因此后续试验以8 g/L的茚三酮为显色剂。

图2 层析液中茚三酮质量浓度对吸光度的影响
Fig.2 Effect of concentration of ninhydrin in chromatography solution on absorbance
2.2.2 层析液中展开剂配比对吸光度的影响
不同展开剂配比层析效果如表1。L-谷氨酸为生成GABA所需的底物,因此在发酵培养基中添加一定质量浓度的L-谷氨酸,有利于GABA的生物合成[20]。但是发酵液中L-谷氨酸并未消耗完,且L-谷氨酸与GABA的极性相近,在纸层析时2者不易分开,为发酵液中产物GABA的分离带来困扰,本试验在GABA标准品溶液中添加了5 g/L的L-谷氨酸,以获得能够排除这种干扰因素的展开剂配比。层析的效果如表1所示,GABA及L-谷氨酸在不同层析液中,上行速度不同,若层析液中流动相冰醋酸占比越大,GABA与L-谷氨酸上行速度越快,2者分不开或者L-谷氨酸严重拖尾,导致与GABA重叠部分较多,影响最终测定结果,使发酵液中GABA理论值偏高。若层析液中固定相水占比越大,GABA与L-谷氨酸层析速度则越慢,可能会导致样品丢失。因此选用合适配比的展开剂对试验至关重要,如表1所示,层析效果最好的是展开剂配比为2∶1∶1与3∶1∶2。但迁移率差值有时也可为层析效果提供参考,通常迁移率差值越大,层析效果越好[21]。由于配比为2∶1∶1展开剂中GABA与L-谷氨酸迁移率差值大于3∶1∶2,因此后续试验选择展开剂配比为V(正丁醇)∶V(冰醋酸)∶V(水)=2∶1∶1。
表1 不同配比的展开剂层析效果
Table 1 Effect of developing agent chromatography with different ratio

展开剂配比展开剂前沿距离/cm谷氨酸GABA距离/cm迁移率(Rf1)距离/cm迁移率(Rf2)迁移率差值(Rf2-Rf1)层析时间/min层析效果5∶3∶26.83.50.5144.90.7210.20770有拖尾与重叠3∶2∶16.83.50.51450.7350.22170有重叠与拖尾3∶1∶26.73.40.5074.40.6560.14970分离较好但间距太小2∶1∶16.73.60.5374.80.7160.17970分离较好但间距太小2∶3∶16.84.50.6615.50.8080.14770重叠,未分离5∶2∶36.73.50.5224.50.6710.14970有重叠与拖尾5∶1∶46.81.60.2352.50.3670.13270能分离,有少许重叠,但上行速度太慢2∶1∶113.27.70.5839.90.7500.167120分离较好,没有重叠3∶1∶212.97.20.5589.20.7130.155120分离较好,没有重叠
注:展开剂配比为V(正丁醇)∶V(冰醋酸)∶V(水)。
2.2.3 洗脱液中乙醇的体积分数对吸光度的影响
按1.4.2测定方法所测得的结果如图3。
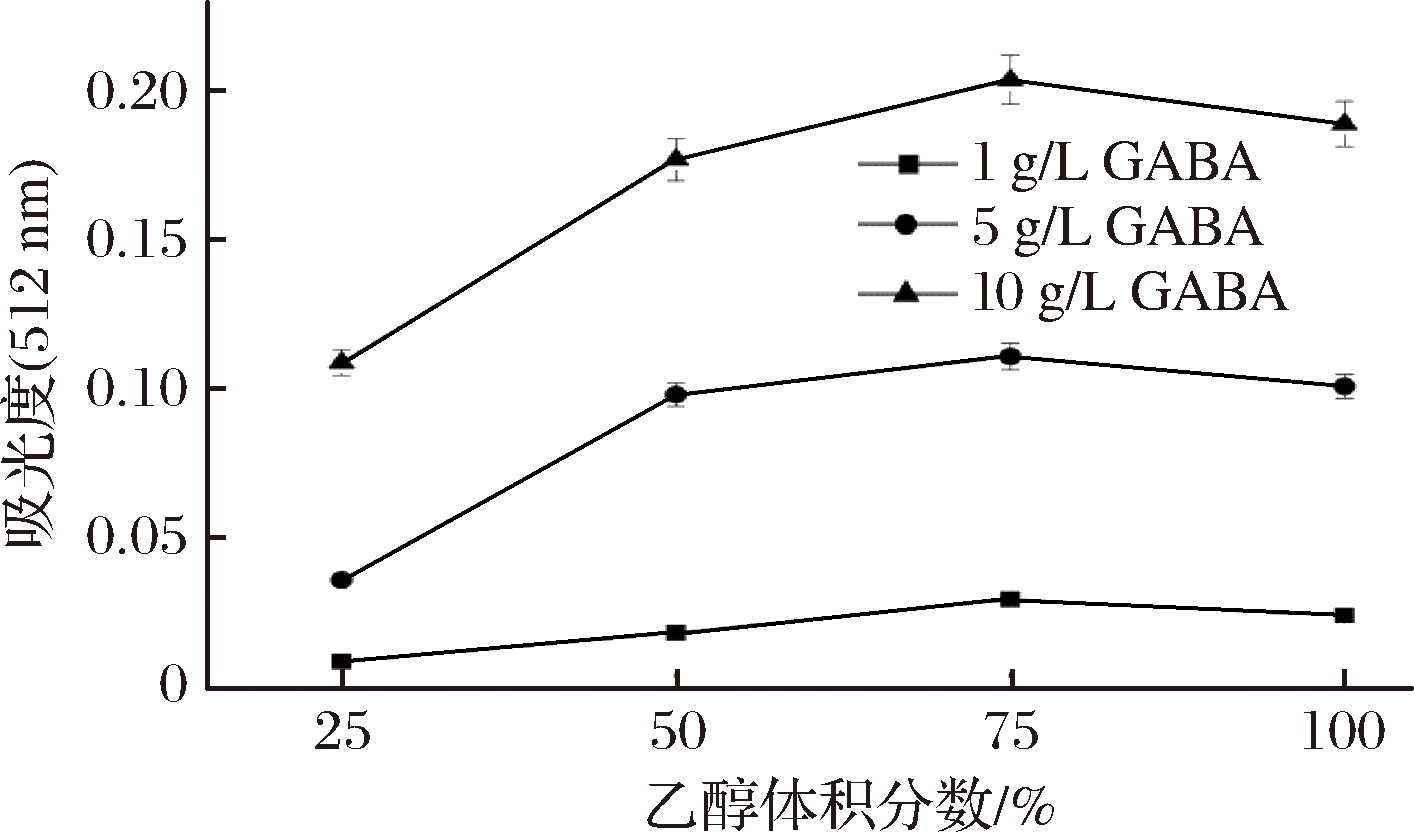
图3 洗脱液中乙醇体积分数对吸光度的影响
Fig.3 Effect of the volume fraction of ethanol of eluent on absorbance
如图3所示,利用3种质量浓度(1、5、10 g/L)的GABA进行试验,均出现随着洗脱液中乙醇体积分数的逐渐增加,GABA反应生成的红色离子缔合物吸光度先增加后减少,且在乙醇体积分数达到75%时,反应体系的吸光度达到最大值。这可能是由于当乙醇体积分数分别为25%与50%时,洗脱液不能彻底洗脱下滤纸上的斑点,导致所测得的吸光值偏低且没有可靠性;而当乙醇体积分数为100%时,吸光度也偏小的原因可能是GABA与茚三酮高温显色反应生成的物质进一步与Cu2+结合需要在一定含量的水存在下进行。因此,后续研究洗脱液中乙醇的体积分数采用75%。
2.2.4 洗脱液配比对吸光度的影响
按1.4.2测定方法所测得的结果如图4。
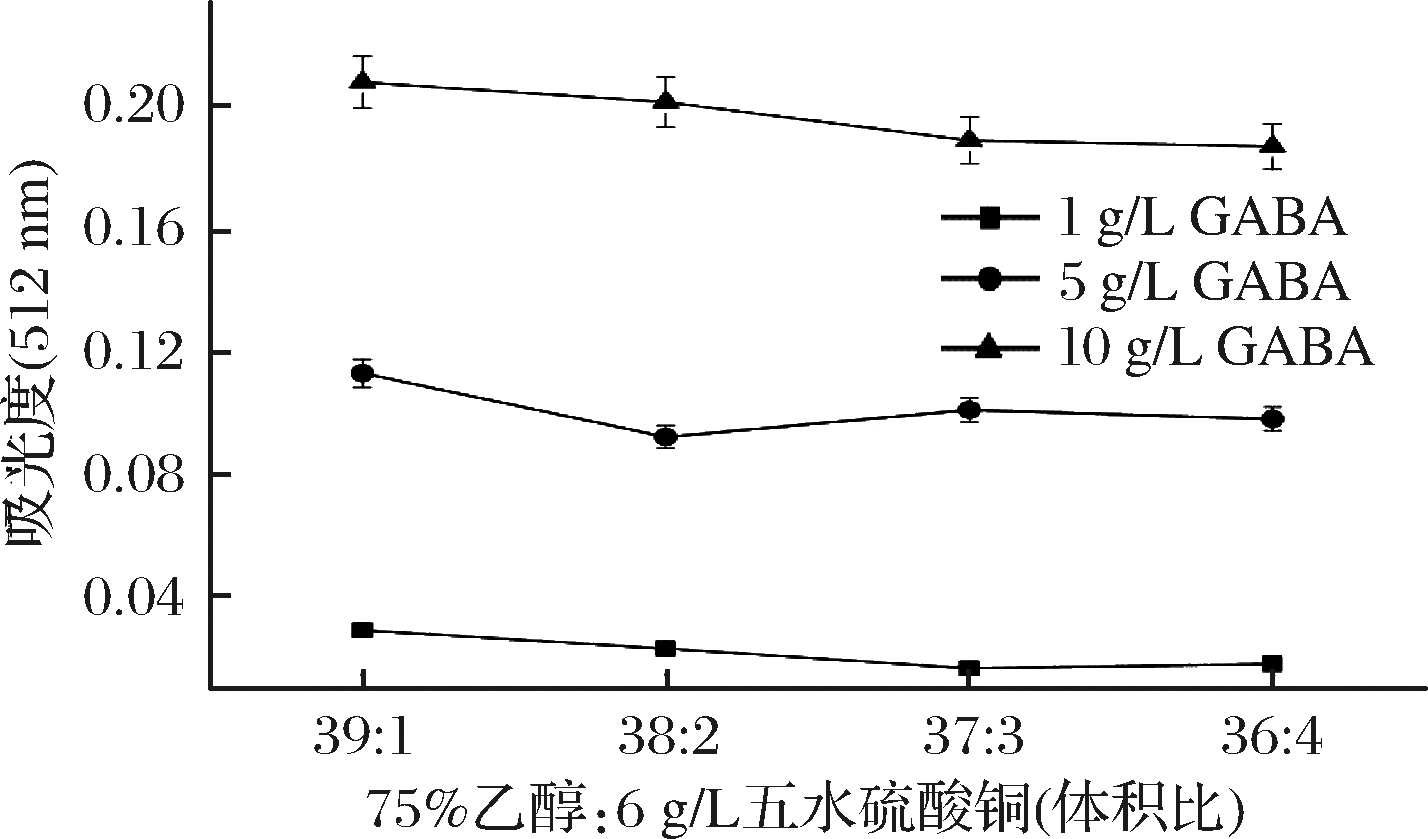
图4 洗脱液配比对吸光度的影响
Fig.4 Effect of eluent ratio on absorbance
如图4所示,利用3种质量浓度(1、5、10 g/L)的GABA进行试验,当洗脱液中75%乙醇与6 g/L CuSO4·5H2O的体积比为39∶1时,GABA反应生成的红色离子缔合物吸光度达到最大,后继续提高Cu2+浓度,吸光度却逐渐减小。这种现象出现的原因可能与CuSO4的Cu2+与茚三酮-GABA结合物的缔合程度有关,Cu2+浓度越大,最终反应体系的吸光值越小,因此后续试验选择75%乙醇与6 g/L CuSO4·5H2O配比为39∶1的洗脱液作为最适洗脱溶液。
2.3 标准曲线的建立
如图5所示,酶标仪与分光光度计测定的GABA标准品浓度在1~7 g/L之间均有较好的线性关系。其中酶标仪所建线性方程为:y1=0.018 9x+0.009 1(R2=0.999 0),可以利用酶标仪-纸层析法快速检测发酵液中GABA的含量。
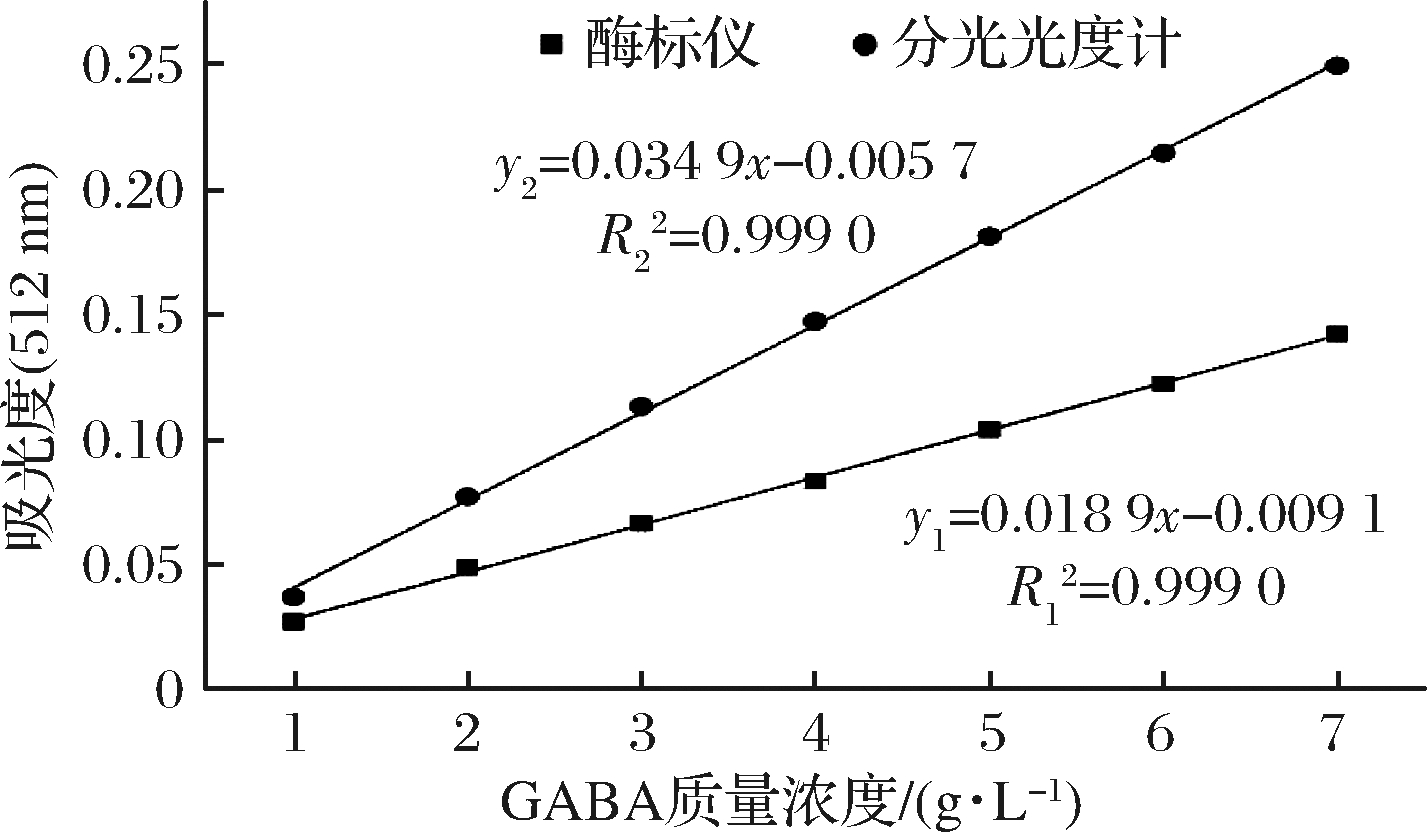
图5 酶标仪与分光光度计建立标准曲线
Fig.5 The standard curve was established by microplate reader and spectrophotometer
2.4 稳定性试验
从表2可知,洗脱液对GABA高温显色形成的紫红色斑点进行洗脱,反应10~30 min,红色离子缔合物的形成并未达到饱和,吸光度偏小;反应30 min后,红色离子缔合物几乎达到饱和,吸光度达到最大值。在实际过程中,检测诱变后大量突变株经孔板发酵后效价需要一定的操作时间,而从表2可知,GABA反应液在30~90 min内吸光度基本保持不变,稳定性良好,满足实际需求。
表2 GABA反应液的稳定性试验结果
Table 2 Stability test of GABA reaction solution
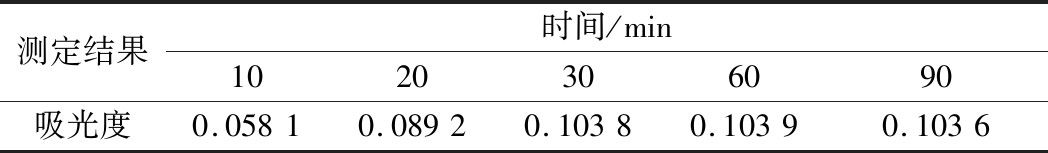
测定结果时间/min1020306090吸光度0.05810.08920.10380.10390.1036
2.5 精密度试验
为了尽可能减少试验误差,使得试验更准确,必须在工业检测中提高试验精密度[22]。由表3可知,各组在低浓度和高浓度的RSD均小于0.5%,表明该方法测定发酵液中GABA含量精密度高。
表3 精密度试验
Table 3 Accuracy examinations

加入浓度/(g·L-1)测得浓度/(g·L-1)123平均值变异系数/%1.51.46031.47621.47091.46910.44926.56.43926.45506.46036.45150.1394
2.6 加标回收率试验
为了验证样品的前处理过程是否对样品的测定产生影响以及测量过程中是否有基体干扰,必须进行加标回收试验[23]。从表4可知,平均回收率为98.248 5%,RSD为2.625 5%。结果表明,采用酶标仪-纸层析法测定发酵液中GABA加样回收率较高,前处理过程及水溶液基体对样品的测定影响几乎可以忽略不计。
表4 加标回收率
Table 4 Recoveries of spiked sample
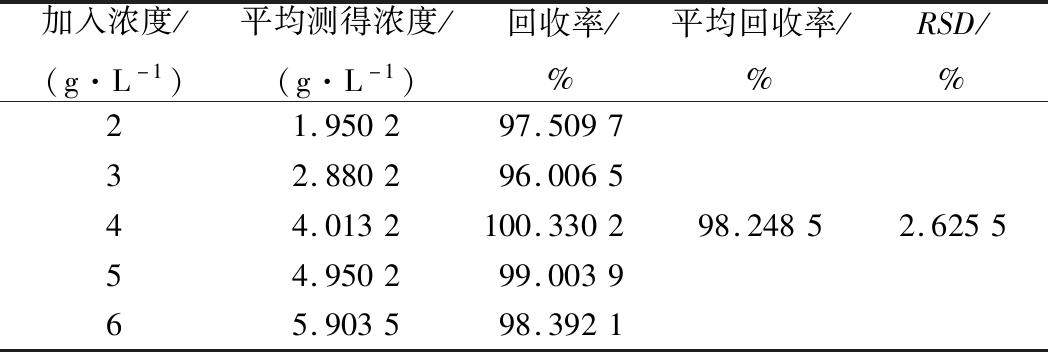
加入浓度/(g·L-1)平均测得浓度/(g·L-1)回收率/%平均回收率/%RSD/%21.950297.509732.880296.006544.0132100.330298.24852.625554.950299.003965.903598.3921
2.7 两种方法拟合结果
相关强度由相关系数的绝对值决定,相关系数的正负是相关方向,根据经验,统计学家提出了相关性强度的判断标准,将R2=0.7作为一个较高的相关关系[24]。由图7可知,拟合曲线的R2=0.939 8,表明纸层析-酶标仪法与纸层析-分光光度法同时测定诱变后大量突变株发酵液中的GABA含量具有很好的正相关性,可以利用纸层析-酶标仪法快速、高效地测定较多发酵样品中GABA的含量。
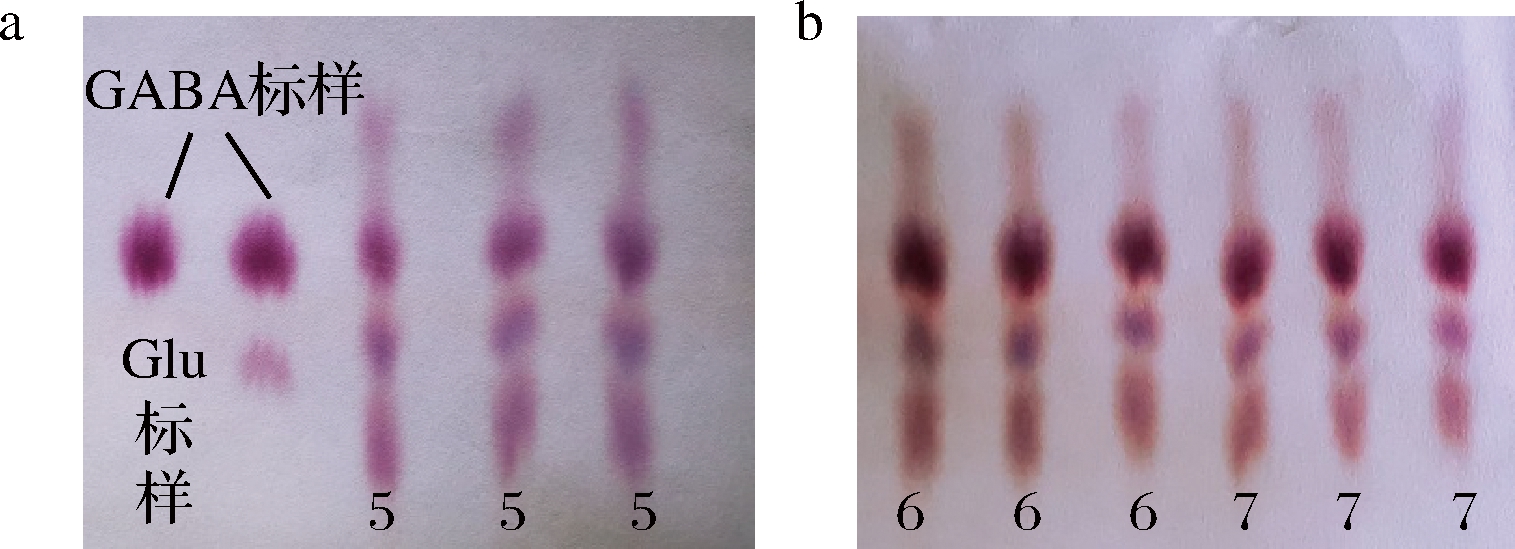
a-标峰纸层析;b-发酵液纸层析
图6 标样与发酵液纸层析图
Fig.6 Result of GABA paper chromatogram
注:图6为部分突变株(编号为5、6、7,每组发酵液样品设置3个重复)发酵液中GABA的纸层析图,可以直观地看出GABA斑点的分布以及浓度相对大小。

图7 纸层析-酶标仪法与纸层析-分光光度法测定发酵液中GABA的相关性
Fig.7 The relationship between paper chromatography-microplate reader and paper chromatography-spectrophotometer for determination of GABA in fermentation broth
3 讨论
目前文献报道中关于GABA的测定方法主要包括:(1)高效液相色谱法:广泛用于植物如桑叶、糙米、豆豉等中GABA含量的测定,该方法灵敏度高、稳定性好、测定结果准确、使用范围广,但耗时较长,比较昂贵,适合科研中有高准确度要求的测定使用;(2)氨基酸分析仪测定法:在灵敏度及多样品处理时表现较好,可用于GABA产生菌菌种选育,但是使用这种测定方法成本昂贵,测定耗时长,故在工业生产中使用较少;(3)分光光度法:在GABA产量的测定中,简单、准确,但效率较低。酶标仪满足吸光物质浓度在一定波长下与吸光度成线性相关的规律,是实验室常用的设备[25-26],适用于物质的检测定量分析,且能够一次性快速检测大量的样品,在GABA高产菌株的选育中具有高效性。
本研究对影响纸层析-酶标仪法的主要因素进行优化,并利用此方法与纸层析-分光光度法同时测定诱变后多批突变株发酵液中GABA产量且进行了曲线拟合,结果表明2种方法测定GABA含量线性关系良好,纸层析-酶标仪法能快速、准确地测定微孔板发酵液中GABA产量,为后续高通量选育GABA高产菌株奠定了基础。
[1] LIANG F, HATANAKA Y, SAITO H, et al. Differential expression of gamma-aminobutyric acid type B receptor-1a and -1b mRNA variants in GABA and non-GABAergic neurons of the rat brain [J]. Journal of Comparative Neurology, 2015, 416(4):475-495.
[2] MEKONNEN D W, FLÜGGE U I, LUDEWIG F. Gamma-aminobutyric acid depletion affects stomata closure and drought tolerance of Arabidopsis thaliana[J]. Plant Science, 2016, 245:25-34.
[3] CONTI F, MELONE M, DE B S, et al. Neuronal and glial localization of GAT-1, a high-affinity gamma-aminobutyric acid plasma membrane transporter, in human cerebral cortex: with a note on its distribution in monkey cortex [J]. Journal of Comparative Neurology, 2015, 396(1):51-63.
[4] BOONBURAPONG B, LALOKNAM S, INCHAROENSAKDI A. Accumulation of gamma-aminobutyric acid in the halotolerant cyanobacterium Aphanothece halophytica under salt and acid stress [J]. Journal of Applied Phycology, 2016, 28(1):141-148.
[5] KEHR J, UNGERSTEDT U. Fast HPLC estimation of gamma-aminobutyric acid in microdialysis perfusates: effect of nipecotic and 3-mercaptopropionic acids [J]. Journal of Neurochemistry, 1988, 51(4):1 308-1 310.
[6] WU Q, SHAH N. Gas release-based pre-screening combined with reversed-phase HPLC quantitation for efficient selection of high-γ-aminobutyric acid (GABA)-producing lactic acid bacteria [J]. Journal of Dairy Science, 2015, 98(2):790-797.
[7] MEEPLOY M, DEEWATTHANAWONG R. Determination of γ-aminobutyric acid (GABA) in Rambutan fruit cv. Rongrian by HPLC-ELSD and separation of GABA from rambutan fruit using dowex 50W-X8 column [J]. Journal of Chromatographic Science, 2016, 54(3):445-452.
[8] ROY U, STUTE L, C HÖFLING, et al. Sex- and age-specific modulation of brain GABA levels in a mouse model of Alzheimer's disease [J]. Neurobiology of Aging, 2017, 62:168-179.
[9] ALBERT B, MENNY K, NICOLE G, et al. The transporter GAT1 plays an important role in GABA-mediated carbon-nitrogen interactions in Arabidopsis[J]. Frontiers in Plant Science, 2015, 6.
[10] TAKEDA, SAHORI, YAMANO, et al. Rapid determination of 4-aminobutyric acid and L-glutamic acid in biological decarboxylation process by capillary electrophoresis-mass spectrometry [J]. Journal of Separation Science, 2015, 35(2):286-291.
[11] HAGI T, KOBAYASHI M, NOMURA M. Metabolome analysis of milk fermented by γ-aminobutyric acid-producing Lactococcus lactis[J]. Journal of Dairy Science, 2016, 99(2):994-1 001.
[12] CALDERON G D, BRATOEFF E, RAM REZ L E, et al. Effect of flutamide and two novel synthetic steroids on GABA, glutamine and some oxidative stress markers in rat brain and prostate [J]. Andrologia, 2011, 43(4):225-232.
REZ L E, et al. Effect of flutamide and two novel synthetic steroids on GABA, glutamine and some oxidative stress markers in rat brain and prostate [J]. Andrologia, 2011, 43(4):225-232.
[13] 杨晶晶,曲媛,崔秀明.γ-氨基丁酸的制备方法与含量测定研究进展[J].食品工业科技,2014,35(3):351-356.
[14] WEIWEI D, XIAONING N, MENGLOU L. Efectos de tutin y sus derivados en el GAD y GABA-T en Pseudelatia separata (Lepidoptera: Noctuidae)[J]. Revista Colombiana De Entomologia, 2012, 38:81-86.
[15] 苗雨田,杨悠悠,李颂,等.全自动氨基酸分析仪法快速测定乌龙茶中γ-氨基丁酸[J].分析测试技术与仪器,2015,21(4):231-235.
[16] KUMAR S, PUNEKAR N S, SATYANARAYAN V, et al. Metabolic fate of glutamate and evaluation of flux through the 4-aminobutyrate (GABA) shunt in Aspergillus niger[J]. Biotechnology & Bioengineering, 2015, 67(5):575-584.
[17] LIGNY C L D, REMIJNSE A G. Efficiency of chromatographic procedures. Part IV: The efficiency of paper chromatography on various kinds of Whatman paper and of thin-layer chromatography on various kinds of cellulose powder for the separation of amino-acids [J]. Recueil des Travaux Chimiques des Pays-Bas, 1967, 86(4):421-435.
[18] PAULETTA G, DEFRANCESCHI A. Studies on the amino-acid metabolism of Mycobacterium tuberculosis. I. Preliminary investigation by paper chromatography [J]. Biochimica et Biophysica Acta, 1952, 9(3):271-282.
[19] LI H, QIU T, CAO Y, et al. Pre-staining paper chromatography method for quantification of γ-aminobutyric acid [J]. Journal of Chromatography A, 2009, 1 216(25):5 057-5 060.
[20] CHONG Z, JING L, LIN C, et al. Biosynthesis of γ-aminobutyric acid by a recombinant Bacillus subtilis strain expressing the glutamate decarboxylase gene derived from Streptococcus salivarius ssp. thermophilus Y2 [J]. Process Biochemistry, 2014, 49(11):1 851-1 857.
[21] LIGNY C L D, NIEBOER H, VIJLDER J J M D, et al. Separation of some DL-amino acids into their optical isomers by paper adsorption chromatography [J]. Recueil des Travaux Chimiques des Pays-Bas, 2015, 82(2):213-224.
[22] FRANCISCO F L, SAVIANO A M, PINTO T D J A, et al. Development, optimization and validation of a rapid colorimetric microplate bioassay for neomycin sulfate in pharmaceutical drug products [J]. Journal of Microbiological Methods, 2014, 103:104-111.
[23] 余飞,孙俊峰,刘鹏飞,等.弗氏链霉菌产硫酸新霉素高通量选育模型的建立及优化[J].食品与发酵工业,2019,45(8):162-167.
[24] 叶子弘, 陈春. 生物统计学[M]. 北京:化学工业出版社, 2012: 100-109.
[25] RICHTER F, SCHEIB U S, MEHLHORN J, et al. Upgrading a microplate reader for photobiology and all-optical experiments [J]. Photochem Photobiol Sci, 2015, 14(2): 270-279.
[26] DUELLMAN T, BURNETT J, YANG J. Quantitation of secreted proteins using mCherry fusion constructs and a fluorescent microplate reader [J]. Analytical Biochemistry, 2015, 473:34-40.