肉类食品富含大量的营养成分,是人们日常饮食构架中的重要组成部分。近年来,随着市场经济的迅猛发展和人们生活水平的提高,消费者对各种肉类的需求在不断上涨[1]。目前市面上可食用肉类品种繁多,但由于供需量不同,不同品种间价格差异大,进而诱使不法商贩在肉类及其制品中掺杂使假、以次充好而牟取暴利,这样的事件屡屡出现。肉类掺假涉及到食品安全及其营养价值等问题,同时也扰乱了市场经济秩序,更直接影响了消费者的健康,尤其是那些对部分食物过敏的消费者[2]。此外,由于伊斯兰教禁食猪肉,在清真食品中掺杂猪肉更涉及宗教信仰方面的问题[3]。而肉类制品通常经过加工处理后,以依靠感官与经验的传统的肉类形态学为主的鉴别手段已无法准确鉴别其品质。因此,建立快速准确的肉类鉴别检测方法是十分必要的。
近年来,肉类鉴别检测主要是在蛋白质与核酸水平进行,常用检测技术包括物理技术、化学技术、电泳技术、DNA鉴定技术以及免疫学技术等[4]。基于蛋白质的检测方法对仪器、试剂和样品处理要求高,存在复杂、昂贵、费时且缺乏特异性等问题。而经热处理后蛋白质会发生变性,其特定表位改变,故基于蛋白质的检测方法往往不适用于经热加工处理的肉制品,而适用于对新鲜肉类的检测[5]。而因肉制品中蛋白质含量多样化及其干扰因素多变性,导致该鉴定方法的应用存在局限性,而基于DNA的检测方法更具优势,DNA测序能鉴定出物种所具有的独特DNA序列,即使是未知样品也能通过比对数据库内已知的物种信息得到样品的种类[4]。在DNA水平进行的检测方法包括:DNA探针杂交和以聚合酶链反应(PCR)为基础的基因检测技术[6]。PCR检测技术相比于其他检测手段更为准确,且灵敏度更高。
但常规的PCR技术虽能定性检测不同品种的混合肉类,但却不能实现对目标物的定量分析。实时荧光PCR(Real-Time PCR)定量检测是指向反应体系中加入荧光基团,在PCR指数扩增期间通过连续监测荧光信号的强弱变化,实时监测特异性产物的量,最后通过标准曲线目的基因进行定量分析的过程[7]。而Real-Time PCR作为一种以PCR为基础的检测技术,在实现定性定量分析的同时,与常规PCR相比自动化程度更高、动态范围更高、特异性更强,并能有效解决PCR污染问题。目前,此项技术已应用于医学、农学等多个领域,在肉类掺假检测方面的研究及应用也较为成熟。因此,本文梳理了近几年Real-Time PCR技术检测肉类掺杂的研究,旨在为完善食品掺假检测体系提供有益参考。
1 Real-Time PCR检测肉类掺假
1.1 Real-Time PCR检测流程
PCR技术是指在体外酶促合成特异性DNA片段的一种方法,Real-Time PCR技术是在常规PCR技术基础上加入荧光染料或标记探针,根据荧光信号的累积对反应过程进行实时监控,以实现对起始模板的精确定量[7]。图1反映了Real-Time PCR技术基本操作流程,根据反应中荧光信号的变化可绘制如图1-A所示的扩增曲线,利用阈值循环数(Ct)值和起始拷贝数可建立如图1-B所示的标准曲线[8],通过两者的对应关系可推断待测模板起始含量。
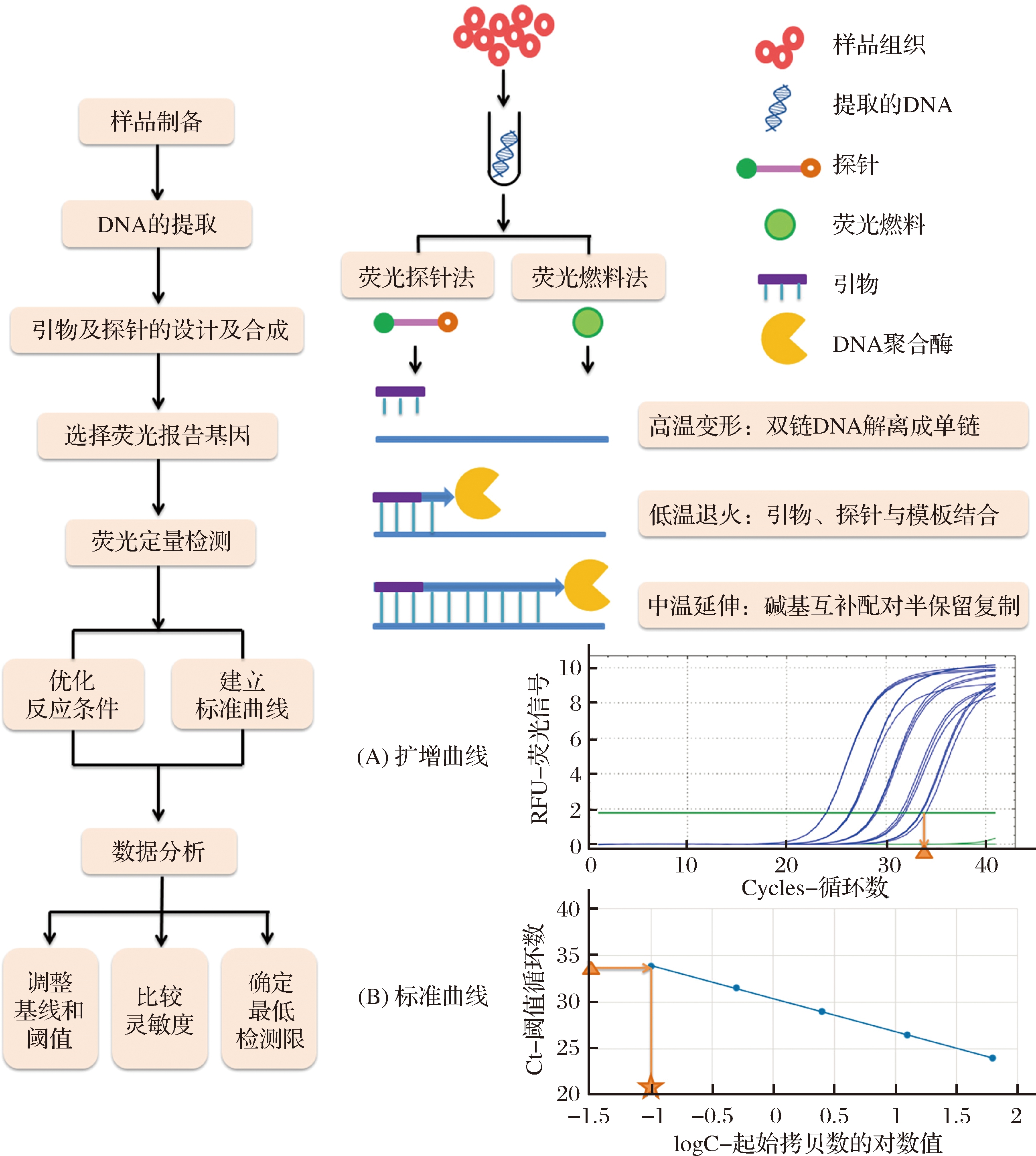
图1 Real-Time PCR技术基本操作流程[4,9]
Fig.1 Real-Time PCR technology basic operation flow
1.2 鉴定肉类品种基因的选择
Real-Time PCR技术应用于肉类掺假检测领域的关键步骤是根据检测目标选择合适的荧光报告基因并设计特异性引物,基于荧光探针法的Real-Time PCR技术,还需要设计并优化探针序列。表1整合了部分常见肉类品种的引物和探针序列,肉类鉴别中的荧光报告基因往往需要有较强的特异性,主要包括线粒体基因组DNA、细胞基因组中重复序列和单拷贝序列。线粒体基因组DNA经母体遗传,其种属特异性较强,是常用的靶基因,通常不会出现由多个等位基因所致的序列歧义情况[10]。线粒体基因组DNA包括:线粒体12S rRNA[11]、16S rRNA[12]、细胞色素b (Cyt b)[13]以及细胞色素C氧化酶I(COI)[14]等基因。但由于不同组织部位的线粒体DNA含量不一致,定量结果易出现偏差。为使得检测结果更可靠,含量更稳定的细胞基因组也开始作为肉类鉴别的靶基因,包括卫星DNA、白细胞介素2前体基因以及生长激素基因等[15]。由表1可知,研究人员往往针对不同检测体系设计不同的引物和探针,并将其优化以得到最佳的反应过程。
表1 Real-Time PCR技术鉴定常见肉类物种的引物及探针序列设计
Table 1 Identification of primers and probe sequences for common meat species by Real-Time PCR
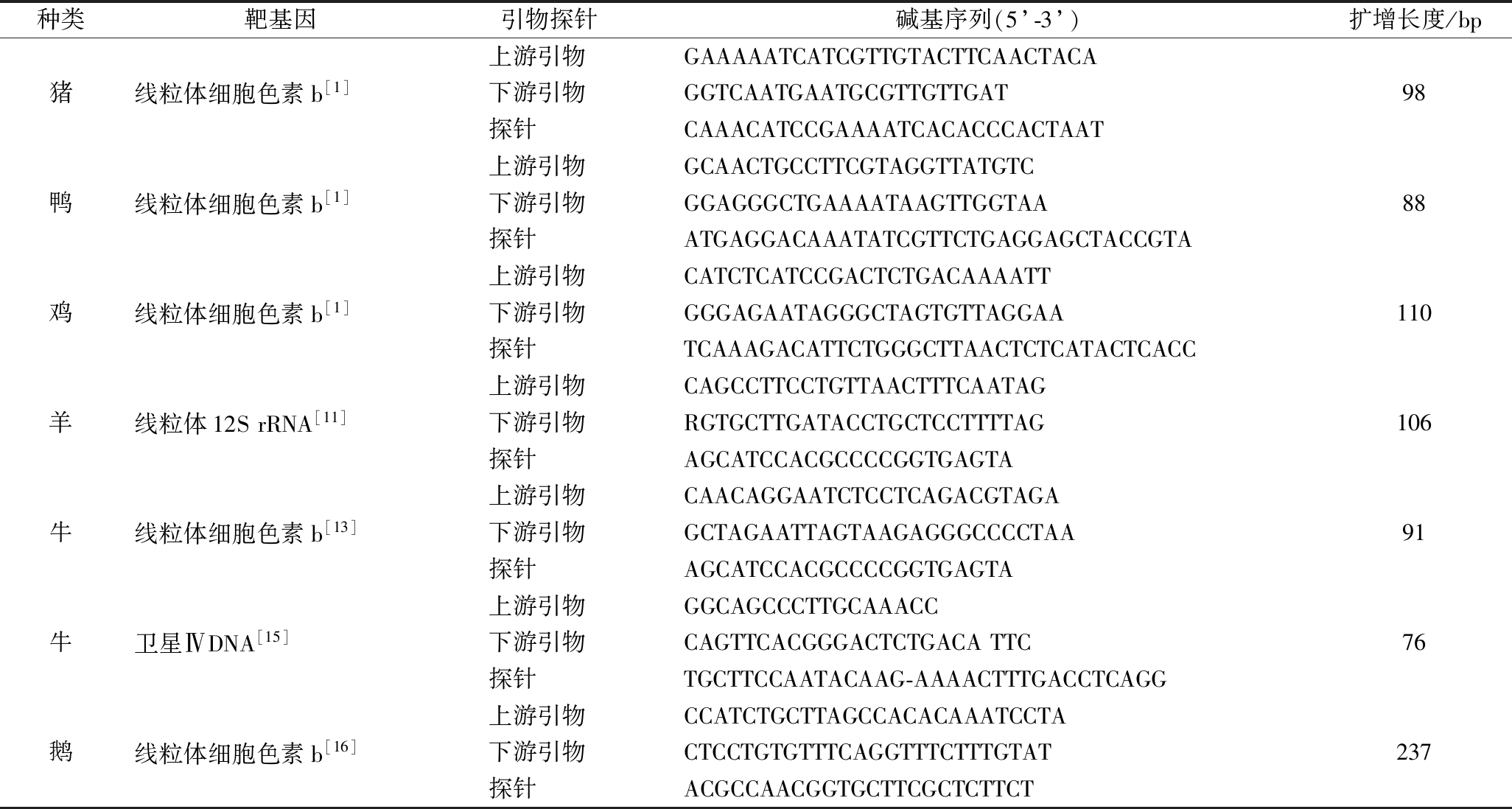
种类靶基因引物探针碱基序列(5’-3’)扩增长度/bp上游引物GAAAAATCATCGTTGTACTTCAACTACA猪线粒体细胞色素b[1]下游引物GGTCAATGAATGCGTTGTTGAT98探针CAAACATCCGAAAATCACACCCACTAAT上游引物GCAACTGCCTTCGTAGGTTATGTC鸭线粒体细胞色素b[1]下游引物GGAGGGCTGAAAATAAGTTGGTAA88探针ATGAGGACAAATATCGTTCTGAGGAGCTACCGTA上游引物CATCTCATCCGACTCTGACAAAATT鸡线粒体细胞色素b[1]下游引物GGGAGAATAGGGCTAGTGTTAGGAA110探针TCAAAGACATTCTGGGCTTAACTCTCATACTCACC上游引物CAGCCTTCCTGTTAACTTTCAATAG羊线粒体12SrRNA[11]下游引物RGTGCTTGATACCTGCTCCTTTTAG106探针AGCATCCACGCCCCGGTGAGTA上游引物CAACAGGAATCTCCTCAGACGTAGA牛线粒体细胞色素b[13]下游引物GCTAGAATTAGTAAGAGGGCCCCTAA91探针AGCATCCACGCCCCGGTGAGTA上游引物GGCAGCCCTTGCAAACC牛卫星ⅣDNA[15]下游引物CAGTTCACGGGACTCTGACATTC76探针TGCTTCCAATACAAG-AAAACTTTGACCTCAGG上游引物CCATCTGCTTAGCCACACAAATCCTA鹅线粒体细胞色素b[16]下游引物CTCCTGTGTTTCAGGTTTCTTTGTAT237探针ACGCCAACGGTGCTTCGCTCTTCT
2 Real-Time PCR在肉类掺假检测的应用
2.1 荧光探针法
2.1.1 荧光探针法的建立
2.1.1.1 Taqman荧光探针
Taqman荧光探针法又称杂交探针标记法,利用了引物及探针与靶基因序列的匹配机制,具有高特异性、高适应性和可靠性的特点。如图2所示,同时加入一对引物和一个水解核苷酸探针于PCR扩增体系,在激光激发下,可通过体系内的荧光信号变化来准确定量模板[17]。
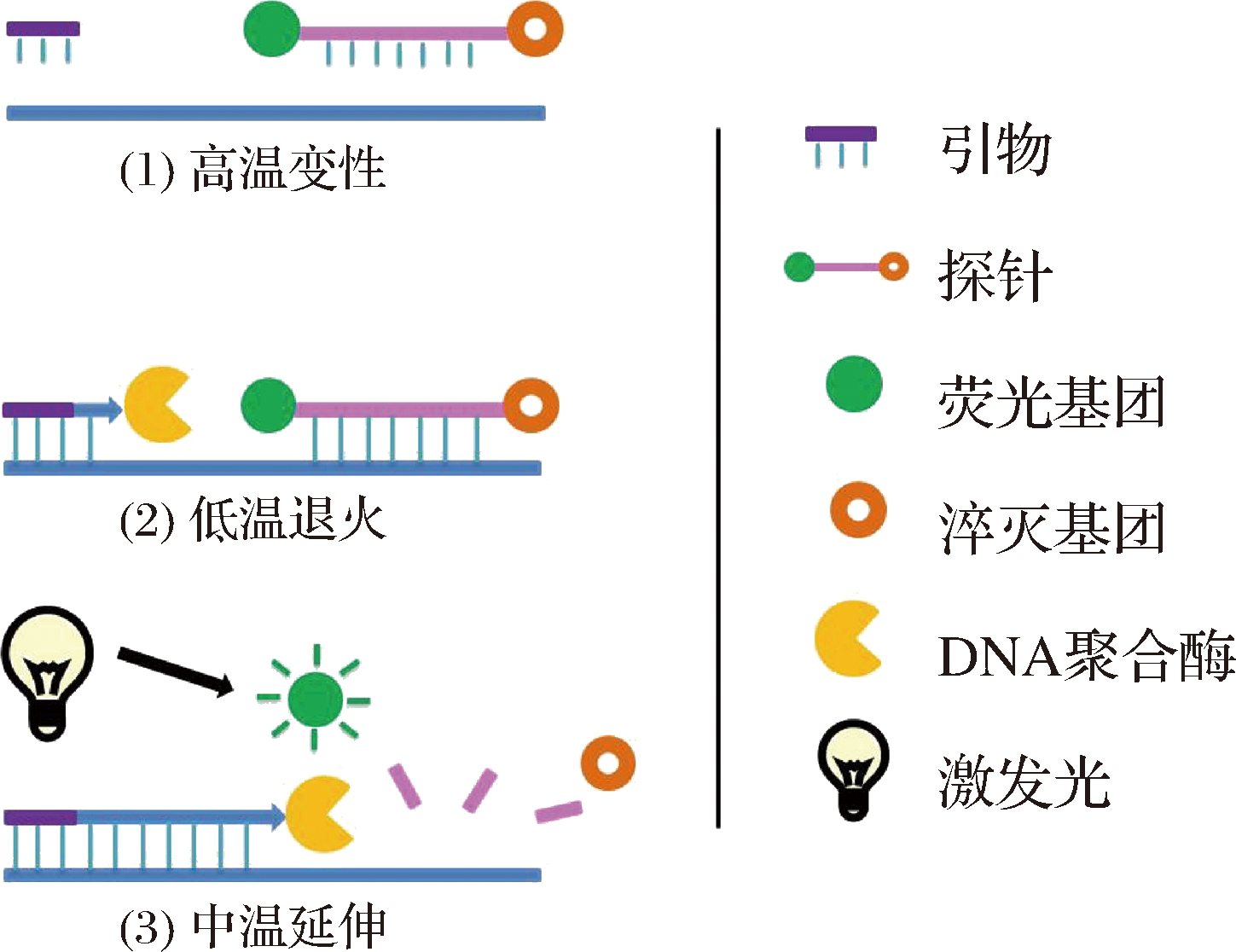
图2 Taqman实时荧光定量PCR过程示意图[1]
Fig.2 The diagrammatic drawing of the process of Taqman real-time PCR[1]
2.1.1.2 分子信标
分子信标(molecular beacon)是一种呈环形发夹结构的双标记寡核苷酸探针[7]。如图3所示,探针最初呈环状关闭状态,PCR扩增时,探针环状区序列与目标分子模板特异性结合,在激光作用下释放荧光[17]。
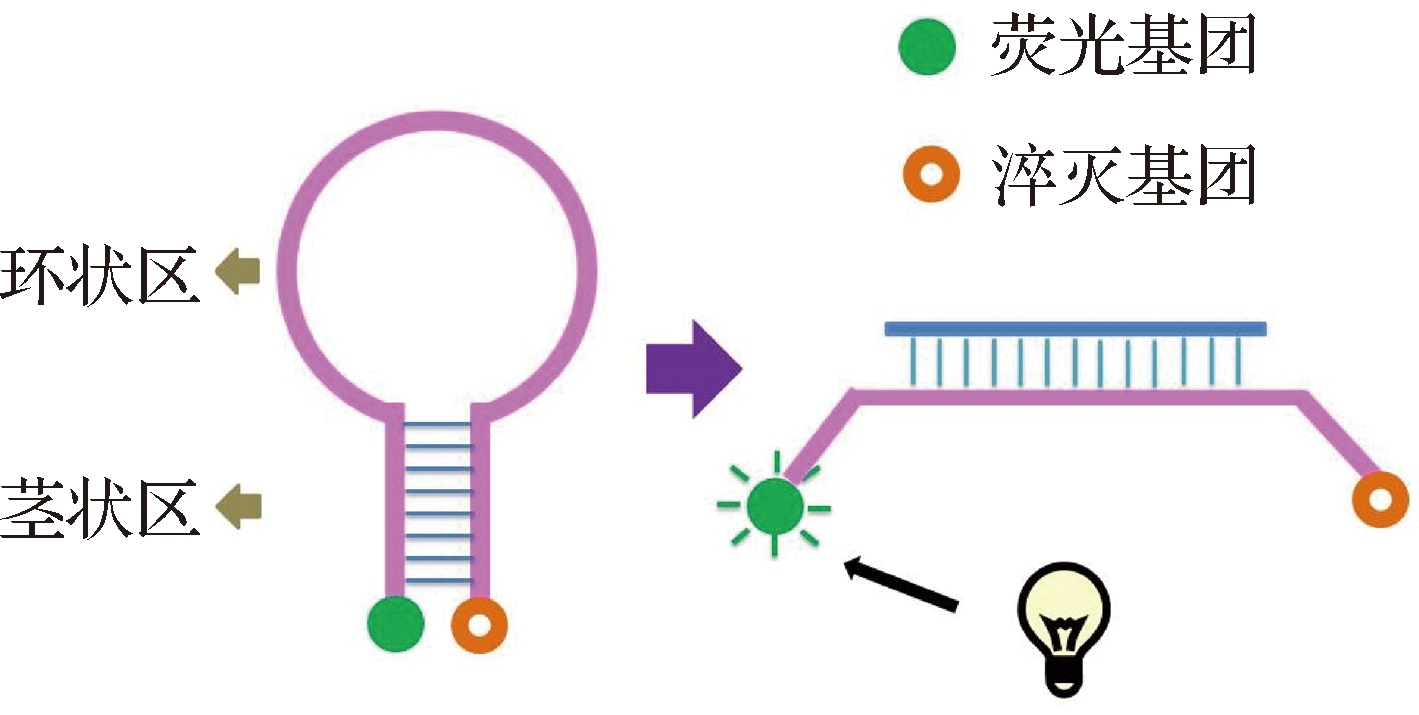
图3 分子信标结构及释放荧光过程示意图[7]
Fig.3 The diagrammatic drawing of molecular beacon structure and the process of releasing fluorescence[7]
2.1.2 荧光探针法的应用
荧光探针法在肉类掺假检测方面应用较为广泛,以前基于荧光探针的Real-Time PCR技术多用于检测单一的目标,随着科学技术的发展,Real-Time PCR检测体系日益改善:逐渐优化引物及探针的设计,利用探针与配体结合将配体的特性引入检测过程中;逐渐提高检测效率,该技术也逐渐由单重荧光定量检测发展为多重Real-Time PCR以及液滴PCR的方法。
2.1.2.1 荧光探针法在单重Real-Time PCR中的应用
Taqman荧光探针法适用于检测扩增序列专一的体系,以及样品中靶基因含量较低的PCR检测。ALI等[18]将猪线粒体Cyt b基因作为分析对象建立Taqman荧光探针,检测混合肉中是否含有猪肉,该法检出限低至0.01%,可用于测定商业汉堡中的猪肉掺假。MARTIN等[19]以猪线粒体12S rRNA基因为分析对象建立猪肉特异性引物,扩增来自猪肉DNA的411 bp片段,同时扩增来自哺乳动物物种DNA的425~428 bp片段用作内源对照,未显示其他动物DNA的交叉反应,该检测方法对猪肉定量检测的灵敏度在0.5%~5%。ZHANG等[20]则以牛线粒体Cyt b基因分析对象建立特异性引物和Taqman探针检测热处理纯肉中牛源性成分的含量,该法可最低定量检测到35 pg的牛DNA,且未显示与绵羊、山羊或猪DNA的交叉反应。但Taqman荧光探针也存在局限性,需要在保守区域内扩增荧光探针的引物,并对保守序列的3个区域分别设计上下游引物,而找到合适的保守区域并不相容[21]。且无论怎么优化引物设计条件都不能解决靶基因的特异序列较短的状况,而且如果体系中存在与靶基因同源的序列,则容易出现非特异性扩增使得定量不准确。
分子信标优于Taqman探针之处是能检测单个核苷酸的突变,近年来,在肉类掺假检测方面,YUSOP等[22]将猪的Cyt b基因作为分析对象设计引物及分子信标探针,建立Real-Time PCR体系用于检测生肉混合样品中猪肉的含量,其他样品显示阴性结果,这证实了引物的特异性,猪肉的检出限为0.000 1 ng。MOHAMAD等[23]以猪的染色体DNA和Cyt b基因设计引物以及分子信标探针,用于定量检测由明胶制品中含有的猪源性成分,结果表明基于染色体DNA和Cyt b基因的检测方法可分别检测体系中低至1 pg和10 pg的猪DNA。但分子信标存在设计困难、价格昂贵的局限性,且既要避免产生强的背景信号,又要避免其茎部与模板杂交过强,而致使退火过程受到影响[24]。可能正是引物分子信标具有的特性,致使其在检测肉制品中有害微生物方面研究较多,相比之下在肉类掺假检测方面的应用较少。
2.1.2.2 荧光探针在多重Real-Time PCR的应用
在Real-Time PCR技术的基础上利用多对引物测定,可以在单次PCR反应中快速、准确地同时识别多个肉类品种[4],基于Taqman探针的多重Real-Time PCR技术在肉类鉴定方面的应用较为广泛。IWOBI等[25]以β-肌动蛋白基因和肌肉生长抑制素基因为分析对象建立引物和Taqman探针,建立三重Real-Time PCR技术用于特异性识别并量化混合肉中牛和猪成分,未显示其他动物DNA的交叉反应,定量为0.5%~99.5%,该方法的检测限为20个基因组当量。章晶晶等[26]以貉子线粒体D-loop基因和狐狸的线粒体基因为分析对象建立引物和探针,并根据各反应体系的Ct值验证引物与探针对于狐狸和貉子源性成分的特异性,检测肉制品中狐狸、貉子源性成分,最低检测限分别为0.5 pg/μL和5 pg/μL。相比之下基于分子信标的多重Real-Time PCR技术应用于肉类掺假领域的研究较少,刘艳艳等[12]以线粒体基因组和16S rRNA基因设计引物和分子信标探针,建立多重Real-Time PCR体系能同时区分阿胶原料中的驴、马、驴骡和马骡源性成分,其他样品显示阴性结果,该法特异性强灵敏度高,检测限达到0.01 ng/μL。
近年来,为使得基于荧光探针的检测技术在肉类成分定量分析中的效率更高,出现了在Taqman探针的基础上结合配体形成的新型探针,如Taqman-MGB和Taqman-LNA探针。这些与Taqman探针结合的配体往往具有某些特性,比如Minor Groove Binding (MGB)配体具有能选择性结合富含AT碱基的序列特性[27]。近年来Taqman-MGB探针在多重Real-Time PCR的应用较多:ANDREO等[28]将t-Glu和Cyt b基因作为分析对象设计探针,在1%~20%特异性检测混合肉中猪、牛以及鸡肉的含量,原样和热处理样的最低检测限分别为1%和0.32 pg/μL。CHENG等[29]则利用β-肌动蛋白基因和生长因子基因设计引物以及Taqman-MGB探针,将鹅、马、兔、牛、驴、鲫鱼、绵羊和山羊源性物质作为对照显示为阴性,表明结果具有特异性,在1%~20%检测鸡、鸭和猪的成分在混合DNA中所含的量,检测限达到0.15 ng。DRUML等[30]利用伪表皮生长因子基因建立Taqman-MGB探针,以鉴别混合肉DNA中小鹿、马鹿以及梅花鹿的含量,该法未显示肉类产品中可能含有的20种动物物种和43种植物物种的交叉反应,在0.1%~100%,检测限达到0.1%。而新型探针Taqman-LNA在肉类掺假方面的应用也较为广泛:XU等[31]将鸭、猪、牛和鸡的线粒体DNA序列作为分析对象,设计特异性引物和TaqMan-LNA探针,开发并优化了多重Real-Time PCR检测体系,通过鉴定不相关的(绵羊、马、鹿、驴、兔、鹅、山羊、虾、鲑鱼和玉米)线粒体DNA作为物种特异性靶标来验证特异性,检测限达到每个物种的0.01%。许如苏等[32]利用线粒体基因组设计引物及探针,建立多重Taqman-LNA荧光PCR技术,同时检测肉制品中猪鸡鸭源性成分,与牛、羊、驴、兔、鹅等动物源性成分无交叉反应,其检测限均达到肉含量的0.001%。许如苏等[33]还基于马的种属保守序列设计特异性引物和Taqman-LNA探针,建立快速检测肉制品中马源性成分的检测方法,与猪、牛、羊、鹿、驴、兔、鸡、鸭、鹅和虾源性成分无交叉反应,可检测到马肉DNA最低限为1.4 pg。
2.1.2.3 荧光探针液滴PCR
微滴数字PCR(dd PCR) 是先将待测样品微滴化处理,再经PCR扩增后逐个检测每个液滴的荧光信号,根据泊松分布以及阳性微滴的个数与比例进行结果分析,实现对肉及肉制品的精确定量[17]。是传统检测技术的革新,在满足目标物的绝对定量的同时具备更加快速、准确和灵敏的特点,在肉类掺假检测方面应用较为广泛。苗丽等[34-35]将羊、牛和猪的β-肌动蛋白基因作为分析对象设计引物和荧光探针,建立dd PCR法对肉制品中羊、牛和猪的含量进行定量分析,结果表明测量值和真实值基本一致,且不受外源物种的干扰,当核酸的含量在100~1 000 ng时,生鲜肉质量与DNA含量、DNA含量与DNA拷贝数之间均呈现明显的线性关系。而CAI等[36]也利用猪和鸡的β-肌动蛋白基因设计引物和荧光探针,建立了相似的dd PCR法精确定量检测肉制品中的猪和鸡源性成分,且不受外源物种的干扰。陈晨[17]根据牛羊猪鸡鸭的基因组设计引物及探针,建立了dd PCR技术以实现牛肉和羊肉中掺入的猪鸭鸡等动物源成分的定量分析,并构建牛羊猪鸡鸭的生肉质量和DNA浓度曲线以及DNA浓度和DNA拷贝数曲线,得到5个物种的拷贝数和生肉质量的公式,实现了不同物种单一的定量检测。EUN等[37]利用dd PCR技术高精度定量海产品中阿拉斯加鳕鱼的含量:先将混合物分离成15 000~20 000个液滴,经PCR扩增后通过液滴读数器检测TaqMan荧光,基于DNA拷贝数建立公式来计算原始样品质量,且检测体系中原始样品质量,DNA浓度与DNA拷贝数之间同样呈线性关系。
2.2 荧光染料法
2.2.1 荧光染料法的建立
如图4所示,荧光染料能非特异嵌合于ds DNA双螺旋小沟区域[38]。在激发光的作用下结合状态的荧光强度远远高于游离态的荧光强度,随着扩增的进行,荧光信号随PCR产物的同步增加[39]。该法可以监测任何ds DNA序列的扩增,设计引物容易且不需要探针,成本较低。
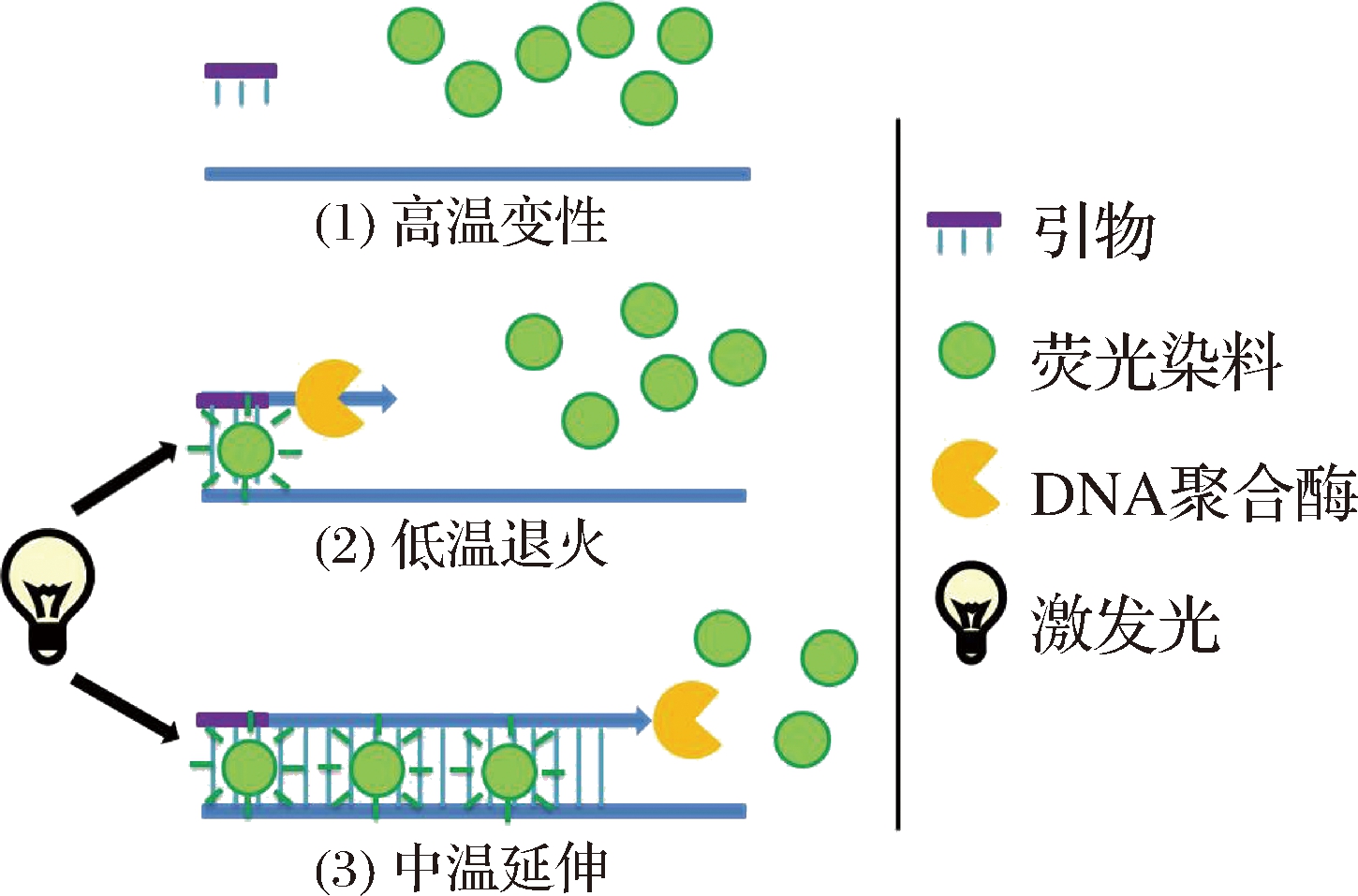
图4 SYBR Green I实时荧光定量PCR反应过程示意图[1]
Fig.4 The diagrammatic drawing of the process of SYBR Green I real-time PCR[1]
2.2.2 荧光染料法的应用
2.2.2.1 荧光染料法在单重Real-Time PCR中的应用
常见的荧光染料有:SYBR Green I和EvaGreen。SYBR Green I荧光染料是一种具有绿色激发波长的不对称菁类荧光素,最大吸收波长和发射波长分别约为497 nm、520 nm。近年来,基于SYBR Green I的Real-Time PCR技术,在肉类掺假检验方面应用较为广泛。SOARES等[40]以猪的Cyt b和18S rRNA基因为分析对象设计引物,并在体系中加入SYBR Green I荧光染料,该方法通过熔解曲线分析显示出高度特异性,在0.1%~25%检测混合肉中猪肉的含量,在原样和热处理样中最低能检测到5 pg和20 ng的猪DNA。郭云霞[41]等利用真核生物18S rRNA设计引物,对9种鲨鱼及48种常见非鲨鱼类动植物样品进行检测,非鲨鱼样品中均未出现扩增曲线,熔解曲线在(84±1.5)℃也未出现峰值,建立了基于SYBR Green I荧光染料的Real-Time PCR方法,用于特异性检测食品中鲨鱼源性成分,该法的检测限为0.000 1 ng/μL。KANG等[42]则利用基于SYBR Green的Real-Time PCR技术,在100%~0.01%,对猪肉和牛肉混合物中猪肉的含量进行分析,并对建立的定量方法进行验证和比较,以用于检测牛肉加工制品中的猪肉掺假。
EvaGreen荧光染料是一种同时适用于Real-Time PCR反应和高分辨率熔解曲线分析的新一代荧光染料, EvaGreen与SYBR Green I荧光染料的光谱相似,且应用于现有定量PCR仪的兼容性良好,这种新型饱和染料能均匀地插入ds DNA,同时能在扩增过程中及时释放DNA,减少对PCR过程的抑制,故基于EvaGreen荧光定量PCR反应的灵敏度相对较高,再加上该技术稳定性良好,且具有相对较高的荧光强度和反应效率的特点[43],近年来其应用也较为广泛。LUBIS等[44]以猪的Cyt b基因设计引物,建立使用EvaGreen荧光染料的Real-Time PCR技术,以此检测肉制品中猪的DNA含量,且通过9种非猪类动物和6种蔬菜种类(阴性),证实了该法可测定猪DNA特异性。在生猪肉和鸡肉的混合体系中检测限低至0.001%。MEIRA等[45]同样针对Cyt b基因设计新引物,建立定性定量检测,来检测加工食品中马肉掺假的特性,该测定显示出高灵敏度和特异性,在检测牛和马的混合体系中,最低可检到0.1 pg的马DNA。JOANA等[46]利用EvaGreen荧光定量PCR建立检测体系,通过分析标准曲线以及熔解曲线达到对肉制品中猪肉含量定量检测的目的,该方法利用盲肉混合物进行有效验证,具有较强的精确性和可重复性,最低可检到0.01 pg的猪DNA。
2.2.2.2 荧光染料在多重Real-Time PCR的应用
随着Real-Time PCR技术的发展,往往需要建立多重荧光检测技术,以达到同时检测多个目标物种的目的,提高检测效率。TAE等[14]利用瓦鱼的COI和18S rRNA基因作为分析对象,建立Real-Time PCR反应体系,基于SYBR Green I荧光染料检测混合肉中瓦鱼种类,且未显示20种其他物种DNA的交叉反应,证实了该法的特异性,其检测限为0.1~0.001 ng/μL,同时开发了直接三重PCR和超快速Real-Time PCR技术用于现场食品分析。
ASING等[47]建立了基于SYBR Green荧光染料的双重Real-Time PCR技术,以检测肉丸和香肠等肉制品中马来亚龟的含量,检测过程中熔解曲线在74.63 ℃和78.40 ℃附近呈现了2个分别代表这种龟和真核生物的峰,该法的检测限为0.001%。SAFDAR等[48]也建立了双重实时PCR技术用于检测饲料中的牛和家禽肉的含量,在79.5 ℃和87.5 ℃的温度下,牛和家禽的基因产物分别产生2个不同的熔解峰,且体系也达到了0.001%的检测限。WU等[9]以线粒体DNA和细胞基因组序列作为分析对象,建立基于SYBR Green荧光染料的多重Real-Time PCR体系,用于同时检测混合体系中狐狸、狗、貂和兔的DNA含量,含量在5%~40%,相对偏差为1.98%~12.23%,相对标准偏差为3.06%~11.51%。而近年来基于EvaGreen荧光染料建立的多重Real-Time PCR技术,在肉类掺假检测方面的应用也同样较为广泛: SAKALAR等[49]以猪和马的12S rRNA和16S rRNA基因为研究对象设计引物,建立基于EvaGreen的多重Real-Time PCR技术,在0.1%~10%能同时检测混合肉中马和猪肉的含量,检测限达0.000 01 ng/μL。SAKALAR等[50]还开发了基于EvaGreen的双重Real-Time PCR检测方法,该法特异性强,用于检测肉类及肉制品中的牛肉和猪肉掺假,灵敏度达到0.001%。
3 展望
肉制品的巨大市场需求促使肉类掺杂使假现象趋于严重,为此建立完善肉类鉴别检测方法成为热点。以核酸为基础的检测技术种类丰富,包括:DNA探针杂交、普通PCR技术及其衍生技术。应用于快速定量检测的Real-Time PCR技术以其特异性强、灵敏度高及操作简单的特点,自问世以来倍受青睐,在食品检测领域更是具有较高的应用价值。近年来,大量研究利用Real-Time PCR技术为基础,建立了鉴别禽、畜和鱼类的检测方法,应用于肉类掺假检测领域。
同时,Real-Time PCR技术仍存在一些挑战:基于荧光染料的技术检测简便、价格便宜,但染料与DNA双链的非特异性结合往往会影响结果的准确性,需要通过扩增曲线来判断多个终产物的特异性[38]。相比之下,基于荧光探针的技术具有更强的特异性,但至关重要的目标基因选择以及引物探针设计还较为困难,若体系中存在与靶基因同源的序列,则易出现非特异性扩增,使得定量不准确。单一的Real-Time PCR技术虽能解决定量检测问题,但需要建立已知拷贝数的标准曲线才能得到目标序列的拷贝数,而检测结果可能受到扩增效率的影响,所以该法并不能很好地达到绝对定量的要求[17]。
近年来,为使得检测体系的定性定量结果更加准确,大量研究对此项技术进行了完善,使其应用空间更为广阔。该技术的新兴发展方向无疑是使检测效率更高和检测结果更可靠。在提升检测效率方面:(1)缩短提取DNA的时间,目前,肉制品中DNA的提取是Real-Time PCR检测技术的限速步骤;(2)缩短PCR反应时间,可利用高效设备如微量荧光定量PCR仪来实现;(3)增大单次检测物种数目,结合多重PCR技术的思想,准确、高效地同时识别多个肉类品种;(4)让检测结果可视化,传统Real-Time PCR技术是通过标准曲线计算目标物种的含量,此技术较为抽象,可结合等温PCR技术的思想,通过产物或试纸条颜色变化呈现更直观的结果。在提升检测结果可靠性方面:(1)严格控制变量,由于不同组织肉样的DNA丰度不同,基因拷贝数存在差异,选取不同的质量梯度,准确建立生肉质量和DNA拷贝数的关系曲线至关重要;(2)多角度分析结果,结合其他学科知识构建新型检测体系,以当下新兴的数字PCR技术为例,将检测体系同统计概率学和“化一为万”的技巧相结合,通过直接计数或泊松分布公式来计算检测结果,不必对照标准样品和标准曲线来实现绝对定量,不受扩增效率的影响[36]。
较为繁琐的操作(公式的建立、掺假模型的设计)往往不利于检测方法的推广。通过标准化检验流程,整合DNA提取、扩增与检测过程,将PCR技术与各项新技术(基因芯片、蛋白质芯片等)有机结合[1,17]是未来的发展趋势。随着生物技术的飞速发展、新型荧光标记物的设计和新型检测模式的深入研究,在肉类掺假检测领域,建立以Real-Time PCR技术为基础的新型简单快速准确、高通量、低成本的检测体系指日可待。
[1] 刘帅帅,李宏,罗世芝,等.PCR技术在肉类掺假检验中的应用进展[J].食品安全质量检测学报,2011,2(6):280-284.
[2] 郭凤柳,熊蕊,刘晓慧,等. 应用PCR技术检测掺假肉类[J].食品安全质量检测学报,2014,5(2): 541-545.
[3] 陈涓涓,赵晨,宋帆,等. 牛肉及其制品中肉类掺假的荧光PCR鉴别体系优化[J].福州大学学报(自然科学版),2015,43(5): 688-695.
[4] 朱雨薇.肉类掺假检测鉴定技术的研究进展[J].食品工业,2014,35(11): 242-248.
[5] 马永征,马冬,白娣斯,等. 免疫学检测肉类制品掺假研究进展[J].肉类研究,2012,26(9): 26-29.
[6] 刘建兰. 牛羊乳区别检验的PCR检测技术研究[D].西安:陕西科技大学,2018.
[7] 曲勤凤. 重要食品掺假检测技术研究鱼糜制品中主料含量的测定(荧光PCR法)[D].上海:复旦大学,2011.
[8] 王玉倩,薛秀花.实时荧光定量PCR技术研究进展及其应用[J].生物学通报,2016,51(2):1-6.
[9] WU Q Q,XIANG S N,WANG W J,et al.Species identification of fox-, mink-, dog-, and rabbit-derived ingredients by multiplex PCR and Real-Time PCR assay[J].Applied Biochemistry and Biotechnology,2018,185(1):1-12.
[10] REN Y F,LI X,LIU Y M,et al.A novel quantitative real-time PCR method for identification and quantification of mammalian and poultry species in foods[J]. Food Control,2017,76:42-51.
[11] 郑文文.饲料中牛羊源成分荧光定量PCR检测方法的建立[D].长春:吉林大学,2009.
[12] 刘艳艳,张全芳,卞如如,等.利用多重荧光定量PCR检测阿胶原料驴、马、驴骡和马骡皮张的源性[J].药学研究,2016, 35(10):569-574;578.
[13] 范丽丽,李培,丁洪流,等.实时荧光PCR技术快速检测食品中的牛源成分[J].食品工业科技,2013,34(12):65-67;85.
[14] TAE S K. Development of four PCR-based methods to differentiate tilefish species(Branchiostegus japonicus and B. albus)[J].Food Chemistry,2019,271:1-8.
[15] JONKER K M,TILBURG J J,HAGELE G H,et al.Species identification in meat products using real-time PCR[J].Food Additives and Contaminants,2008,25(5):527-533.
[16] MICHAEL D,NORA F,RENE K,et al.Multiplex real-time PCR for the detection and quantification of DNA from duck, goose, chicken, turkey and pork[J].European Food Research and Technology,2013,236(6):1 093-1 098.
[17] 陈晨.微滴式数字PCR技术用于牛羊肉掺假定量检测方法的研究[D].保定:河北农业大学,2018.
[18] ALI M E,HASHIM U,MUSTAFA S,et al.Analysis of pork adulteration in commercial burgers targeting porcine-specific mitochondrial cytochrome B gene by TaqMan probe Real-Time polymerase chain reaction[J].Meat Science,2012,91(4): 454-459.
[19] MARTIN R,RODRIGUEZ M A,GARCIA T,et al.Taq Man real-time PCR for the detection and quantitation of pork in meat mixtures[J].Meat Science,2005,70(1):113-120.
[20] ZHANG C L,FOWLER M R,SCOTT N W,et al.A Taq Man real-time PCR system for the identification and quantification of bovine DNA in meats,milks and cheeses[J].Food Control,2007,18(9):1 149-1 158.
[21] 邵晓青,吕申,冯璐,等.三种荧光染料SYBR GreenⅠ、LCGreen PLUS、EvaGreen在实时定量PCR应用中的比较[J].大连医科大学学报,2016,38(5):428-431.
[22] YUSOP M H M,MUSTAFA S,MAN Y B C,et al.Detection of raw pork targeting porcine-specific mitochondrial cytochrome B gene by molecular beacon probe Real-Time polymerase chain reaction[J].Food Analytical Methods, 2012, 5(3):422-429.
[23] MOHAMAD N A,MUSTAFA S,MOKHTAR N F K.Molecular beacon-based real-time PCR method for detection of porcine DNA in gelatin and gelatin capsules[J].Journal of the Science of Food and Agriculture,2018,98(12):4 570-4 577.
[24] 曹省艳,王强,周小艺.荧光定量PCR技术的研究进展与应用[J].农家顾问,2015(4):177-179.
[25] IWOBI A,SEBAH D,KRAEMER I,et al. A multiplex real-time PCR method for the quantification of beef and pork fractions inminced meat[J].Food Chemistry,2015,169(1):305-313.
[26] 章晶晶,杜利强,李永艳,等.实时荧光PCR法快速鉴别狐狸貉子肉源性成分研究[J].现代食品科技,2017,33(8):269-275.
[27] 杨艳,王桂姬,周广运,等.PCR技术在肉类成分定量分析中的应用研究进展[J].食品工业科技,2016,37(17):360-365.
[28] MAR A L A,ALDEGUER M,ISABEL G,et al.Detection andquantification of meat species by qPCR in heat-processed foodcontaining highly fragmented DNA[J].Food Chemistry,2012,134(1):518-523.
A L A,ALDEGUER M,ISABEL G,et al.Detection andquantification of meat species by qPCR in heat-processed foodcontaining highly fragmented DNA[J].Food Chemistry,2012,134(1):518-523.
[29] CHENG X,HE W,HUANG F,et al.Multiplex real-time PCR forthe identification and quantification of DNA from duck,pig and chicken in Chinese blood curds[J].Food Research International,2014,60(6):30-37.
[30] DRUML B,GRANDITS S,MAYER W,et al.Authenticity control of game meat products A single method to detect and quantifyadulteration of fallow deer(Dama dama),red deer (Cervuselaphus) and sika deer (Cervus nippon) by real-time PCR[J].Food Chemistry,2015,170:508-517.
[31] XU R S,WEI S,ZHOU G B,et al.Multiplex TaqMan locked nucleic acid real-time PCR for the differential identification of various meat and meat products[J].Meat Science,2018,137:41-46.
[32] 许如苏,纪玲珍,黄帅,等.应用多重Taqman-LNA荧光PCR同时检测肉制品中猪鸡鸭源性成分[J].中国兽医杂志,2017, 53(12):81-84.
[33] 许如苏,周广彪,段建发,等.Taqman-LNA荧光PCR快速检测肉制品中马源性成分的研究[J].中国动物检疫,2015, 32(7):62-66.
[34] 苗丽,张秀平,陈静,等.微滴数字PCR法对肉制品中牛源和猪源成分的定量分析[J].食品科学,2016,37(8):187-191.
[35] 苗丽,张秀平,陈静,等.肉制品中羊源性成分微滴数字PCR法定量检测方法的研究[J].食品工业科技,2016,37(4):73-76.
[36] CAI Y C,LI X,LV R,et al.Quantitative analysis of pork and chicken products by droplet digital PCR[J].BioMed Research International,2014,8:1-6.
[37] EUN S N,YEON J P,EUN M K,et al.Quantitative analysis of Alaska pollock in seafood products by dropletdigital PCR[J].Food Chemistry,2019, 275:638-643.
[38] 袁继红.实时荧光定量PCR技术的实验研究[J].现代农业科技,2010(13):20-22.
[39] EISCHEID A C.SYTO dyes and EvaGreen outperform SYBR Green in real-time PCR[J].BMC Research Notes,2011, 4(1):263.
[40] SOARES S,AMARAL J S,MBPP O,et al.A SYBR Green real-time PCR assay to detect and quantify pork meat in processed poultry meat products[J]. Meat Science,2013,94(1):115-120.
[41] 郭云霞,张舒亚,谌鸿超,等.SYBR Green实时荧光PCR检测食品中鲨鱼源性成分真实性方法的建立[J].食品与生物技术学报,2012,31(12):1 300-1 306.
[42] KANG T S,TANAKA T.Comparison of quantitative methods based on SYBR Green real-time qPCR to estimate pork meat adulteration in processed beef products[J].Food Chemistry,2018,269:549-558.
[43] 王贝贝,吴艳阳,高冬生,等.禽偏肺病毒通用型EvaGreen荧光定量RT-PCR检测方法的建立[J].中国预防兽医学报,2018, 40(10):908-912.
[44] LUBIS H,SALIHAH N T,NORIZAN N A.Fast and sensitive Real-time PCR based detection of porcine DNA in food samples by using EvaGreen Dye[J].Food Science and Technology Research,2018,24(5):803-810.
[45] MEIRA L,COSTA J,VILLA C,et al.EvaGreen real-time PCR to determine horse meat adulteration in processed foods[J]. LWT-Food Science and Technology,2017,75:408-416.
[46] JOANA S A,GRACIETE S,ISABEL M,et al.Quantitative detection of pork meat by Eva Green real-time PCR to assess the authenticity of processed meat products[J].Food Control,2017,72:53-61.
[47] ASING A M E,ABD H S B,et al.Duplex real-time PCR assay using SYBR Green to detect and quantify Malayan box turtle (Cuora amboinensis) materials in meatballs,burgers,frankfurters and traditional Chinese herbal jelly powder[J].Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment,2016,33(11):1 643-1 659.
[48] SAFDAR M,JUNEJO Y.Development and validation of fast duplex real-time PCR assays based on SYBER Green florescence for detection of bovine and poultry origins in feedstuffs[J]. Food Chemistry,2015,173:660-994.
[49] SAKALAR E,ERGUN S,AKAR E.A Simultaneous analytical method for duplex identification of porcine and horse in the meat products by Eva Green based Real-time PCR[J].Korean Journalof Food Science Analysis,2015,35(3):382-388.
[50] SAKALAR E,KAYNAK A.Practical molecular detection method of beef and pork in meat and meat products by intercalating dye based duplex Real-Time polimerase chain reaction[J].International Journal of Food Properties,2016, 19(1):31-40.