地衣芽胞杆菌是革兰氏阳性的产芽胞兼性厌氧微生物,能分泌淀粉酶、蛋白酶等水解酶[1-3],以及肽类抗生素,其中包括杆菌肽。通过非核糖体合成酶系合成的十二环肽分子[4]-杆菌肽具有广谱抗菌、药物残留量少、无抗药性等优良特性,是目前国际社会允许使用的为数不多的绿色饲料添加剂之一[5]。
地衣芽孢杆菌发酵生产杆菌肽的过程中,细胞优先使用速效碳、氮源已获得最大的生长速率[6],并伴随着培养环境、营养成分改变做出快速响应,如呼吸代谢抑制[7]、溢流代谢[8]等碳分解代谢阻遏的具体表现形式[9-10]。通过提高溶氧(dissolved oxygen, DO)促进氨基酸代谢[11]、中期流加H2O2降低溢流代谢程度[12],以及提高乙偶姻还原酶活性,降低胞内NADH/NAD+比率[13]等方法,均可以提高杆菌肽合成效率。而在杆菌肽补料发酵方面,刘道奇等发现葡萄糖补料能促进细胞溢流代谢,但杆菌肽的合成被抑制[14]。另外,杆菌肽发酵过程中培养基黏度大,易起泡,细胞数可高达百亿CFU/mL等因素,均使氧的供应及利用效率逐渐降低[11],使得发酵前期DO跌至零[12]、中期菌体自溶[13]。就增加发酵液DO而言,工业上常增加通风量和提高转速,但会增加能耗,也不利于泡沫的控制[15],而适量升高罐压可以有效避免上述不利因素,如陈伟波等[16]将罐压由0.02 MPa升至0.06 MPa,L-精氨酸产量提高了34%。另外,杆菌肽合成也与其前体氨基酸的供应效率呈正相关,如ORN[21]、Asp、Glu、Asn、His、Ile、Lys等[11]。因此,杆菌肽合成涉及到了碳-氮-氧等综合因素,而相关的综合研究还未见报道。
以工业地衣芽孢杆菌LC为发酵菌株,本文探索了pH耦合、间歇补料-罐压控制和间歇-溶氧耦合流加等方式对细胞生长、代谢和杆菌肽合成的影响,建立了基于细胞需求的综合补料策略,有效提高了杆菌肽发酵效率,为杆菌肽工业化生产的补料工艺优化提供了重要参考。
1 材料与方法
1.1 菌株
地衣芽孢杆菌(Bacillus licheniformis LC,LC菌株),湖北大学绿康生物工程研究所提供。
1.2 培养基
茄子瓶斜面培养基(g/L):酵母浸膏20, NaCl 5,琼脂20,调pH 7.5。
种子培养基(g/L):豆粕90,玉米淀粉40,玉米浆2.5,轻质CaCO3 4,蛋白胨 5,(NH4)2SO4 1。
发酵培养基(g/L):豆粕79,玉米淀粉37.5,玉米浆7.5,轻质CaCO3 4.5,蛋白胨 15,(NH4)2SO4 0.75,MgSO4·7H2O 1.1。
1.3 培养方法
1.3.1 种子活化
无菌竹签转接-80 ℃保藏甘油管菌液至茄子瓶斜面,在恒温培养箱中37 ℃培养24 h。
1.3.2 种子培养
茄子瓶斜面加50 mL无菌水制备菌悬液,取4 mL菌悬液接种于摇瓶中(装液量50 mL)。37 ℃、250 r/min培养24 h,合瓶得到种子液。
1.3.3 50 L发酵罐培养
种子液接种后发酵液体积27 L,接种量5%,在通风量1.6 m3/h、温度37 ℃、转速350 r/min条件下发酵培养。
1.3.4 50 L罐发酵策略控制
发酵1:按发酵培养基配方进行发酵培养,罐压0.03 MPa。
发酵2:pH耦合补料策略,基于发酵1实施。于18~20 h补氮源1.5 L(含豆粕250 g、玉米浆125 g),22~28 h采用pH耦合补糖。pH值设定方式为:22~24 h为7.5,22~28 h每2 h的pH设定值上升0.1,28 h后pH自然。发酵过程中共补入质量分数为75%的葡萄糖溶液400 mL,罐压0.03 MPa。
发酵3:18~20 h补氮源3.0 L(含豆粕500 g、玉米浆250 g),其他同发酵2,补入葡萄糖340 g。
发酵4:间歇补料策略,从18 h开始,以200 mL/3 h的速率补入1 L质量分数为75%的葡萄糖溶液(750 g),第30小时补完。于18~20 h补氮源1.5 L(含豆粕250 g、玉米浆125 g),罐压0.03 MPa。
发酵5:间歇补料-罐压控制策略,基于发酵4,并且24 h至发酵结束罐压维持在0.05 MPa。
发酵6:间歇-溶氧耦合补料策略。基于发酵5,18~21 h间歇补料,24 h开始将补料方式改为DO耦合(溶氧>35%时,耦合补入质量分数为75%的葡萄糖溶液),24 h至发酵结束罐压维持在0.05 MPa。共补入葡萄糖500 g。
发酵7:间歇-溶氧耦合-二次氮源补料策略,基于发酵6。另外,在24~25 h第2次补入氮源1.5 L(含豆粕250 g、玉米浆125 g),发酵过程中共补入葡萄糖436 g。
1.4 分析方法
1.4.1 葡萄糖的测定
DNS法[12]。
1.4.2 杆菌肽效价测定
采用Ultimate 3000高效液相色谱进行杆菌肽效价测定[14],杆菌肽标准品(效价为65.8 U/mg)。
1.4.3 生物量的测定
采用稀释平板涂布法获得CFU/mL数据。
1.4.4 数据处理
所有试验数据为至少3个平行试验的平均值,用平均值±标准差(SD)表示,采用Origin 9.0进行数据分析。
2 结果与分析
2.1 发酵策略1对LC菌株生长和杆菌肽合成的影响
发酵1中杆菌肽效价、生物量、pH值和还原糖的变化如图1所示。

图1 发酵1对细胞生长和杆菌肽合成的影响
Fig.1 Influences of fermentation 1 on cell growth and bacitracin synthesis
杆菌肽效价在24 h达到峰值793 U/mL,平均杆菌肽合成速率为33 U/(mL·h)。菌体快速生长至18 h,之后趋于稳定,并在21 h达到峰值35×109 CFU/mL。21~24 h,还原糖基本耗完,菌体于24 h自溶。因此,应在21 h之前开始补料,以维持细胞代谢和杆菌肽的合成。
2.2 发酵策略2(pH耦合补料)对LC菌株生长和杆菌肽合成的影响
在发酵策略1中,21 h后还原糖基本耗完(图1),碳源不足使氨基酸脱氨基作用加强,导致pH上升过快,菌体自溶,影响杆菌肽合成[17]。因此采用阶梯控制pH的方式来耦合流加葡萄糖,延缓pH上升速度的同时补充碳源。另外,有机氮源对于细菌的生长和代谢也是必不可少的,并且富含杆菌肽合成的前体氨基酸。WANG等[18]研究了豆粕、菜籽饼、芝麻饼粉、花生饼粉等氮源对杆菌肽合成的影响,发现豆粕中氨基酸种类丰富,是杆菌肽发酵过程中的最佳单一氮源。但是豆粕在发酵过程中分解较为缓慢,所以考虑与发酵培养基中已有的速效氮源-玉米浆混合使用。在18~20 h补入玉米浆和豆粕,形成发酵策略2。发酵过程中杆菌肽效价、生物量、pH、还原糖变化如图2所示。
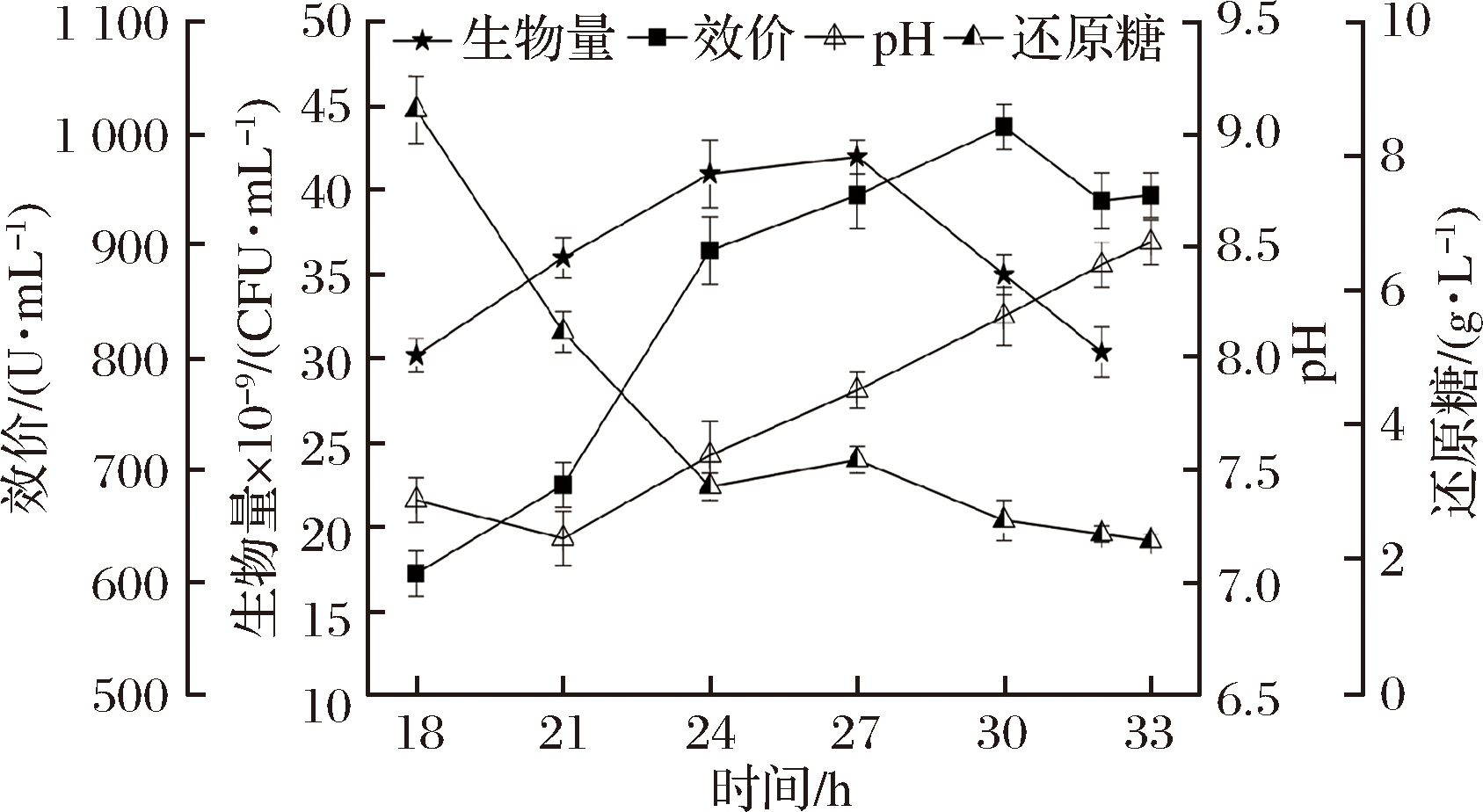
图2 发酵2对细胞生长和杆菌肽合成的影响
Fig.2 Influences of fermentation 2 on cell growth and bacitracin synthesis
杆菌肽效价持续合成至30 h达到峰值(1 006 U/mL),平均合成速率为33.5 U/(mL·h)。菌体生物量在27 h达到峰值(42×109 CFU/mL)后发生了自溶。糖质量浓度在18~24 h快速下降(8.7~3.1 g/L),但由于18~22 h的pH值<设定值,期间未补入葡萄糖。pH耦合补糖期间(22~28 h)的葡萄糖质量浓度维持在3 g/L左右,效价最高点(30 h)还原糖质量浓度为2.6 g/L。与发酵1相比,保持杆菌肽平均合成速率不变,合成时间延长了6 h,效价提高了26.9%。
2.3 发酵策略3对LC菌株生长和杆菌肽合成的影响
作为十二环肽分子,发酵过程中氮源的充分供给是杆菌肽有效合成的基础,由于发酵2在18 h补充氮源后效价得到明显提升,于是在发酵2的基础上,继续加大氮源的补入量,形成了补料策略3。发酵过程中杆菌肽效价、生物量、pH、还原糖的变化如图3所示。

图3 发酵3对细胞生长和杆菌肽合成的影响
Fig.3 Influences of fermentation 3 on cell growth and bacitracin synthesis
杆菌肽效价持续合成至32 h达到峰值958 U/mL,比发酵2减少了4.8%。菌体生物量24 h达到峰值40×109 CFU/mL,与发酵2峰值生物量相当。葡萄糖质量浓度在18~24 h快速下降(8.5~3.6 g/L),之后一直维持低位。通过增加氮源补入量,并没有进一步提高杆菌肽效价,可能是因为加大氮源的补入,增加了菌体分解和转运大分子蛋白质的负担,加速了能量的消耗[19,22]。另外,氮源补入量增加而碳源的补加量并未相应调整,导致碳氮源比例失衡,也影响了氮源的利用效率[20],此时杆菌肽转运蛋白bcrABC也可能被抑制[23-24]。最终杆菌肽效价只有发酵2的95%。
2.4 发酵策略4(间歇补料)对LC菌株生长和杆菌肽合成的影响
发酵3效价低于发酵2,说明一味提高氮源浓度会导致碳氮比失衡,从而影响杆菌肽的合成[25-26]。而采用pH耦合流加葡萄糖的方式,无法在pH较低时补加葡萄糖。于是以发酵2为基础,基于18~24 h葡萄糖质量浓度降低5.6 g/L,以及发酵3在18 h后葡萄糖供给不足的现象,采用间歇补料的方式,在18~30 h每3 h补入5.6 g/L的葡萄糖(200 mL的75%葡萄糖溶液/3 h),形成发酵策略4(间歇式补料),见图4。

图4 发酵4对细胞生长和杆菌肽合成的影响
Fig.4 Influences of fermentation 4 on cell growth and bacitracin synthesis
如图4所示,菌体生物量持续合成至27 h并达到峰值56.8×109 CFU/mL,比发酵2提高了35.2%,和发酵2相比,以200 mL/3 h补入葡萄糖的方式更能促进菌体的生长,但生物量过高后,菌体维持代谢所需要的葡萄糖、氮源以及溶氧等无法得到保障,营养和能量供应受限,开始大量自溶[12]。杆菌肽效价在30 h达到峰值(1 070 U/mL),比发酵2和发酵3分别提高了6.4%和11.7%,杆菌肽平均合成速率为35.7 U/(mL·h),略高于发酵2。与发酵2相比,虽然发酵过程中多补入了450 g葡萄糖(其中18~21 h补入300 g),但葡萄糖并没有在胞外积累。18~24 h葡萄糖质量浓度从8.8 g/L降到3 g/L,之后维持低位。
2.5 发酵策略5(间歇补料-罐压控制)对LC菌株生长和杆菌肽合成的影响
根据图1~4试验结果,实验条件下杆菌肽发酵峰值细胞数可达百亿级CFU/mL,对溶氧的需求极大。而由图5可知,18 h补料后溶氧降为0,因此推测DO不足使得氧化磷酸化供能效率低,可能是杆菌肽效价无法继续有效合成的原因。于是基于发酵4,在24 h将罐压从0.03 MPa提高到0.05 MPa,研究其对24 h前后生长和杆菌肽合成的影响(图5)。
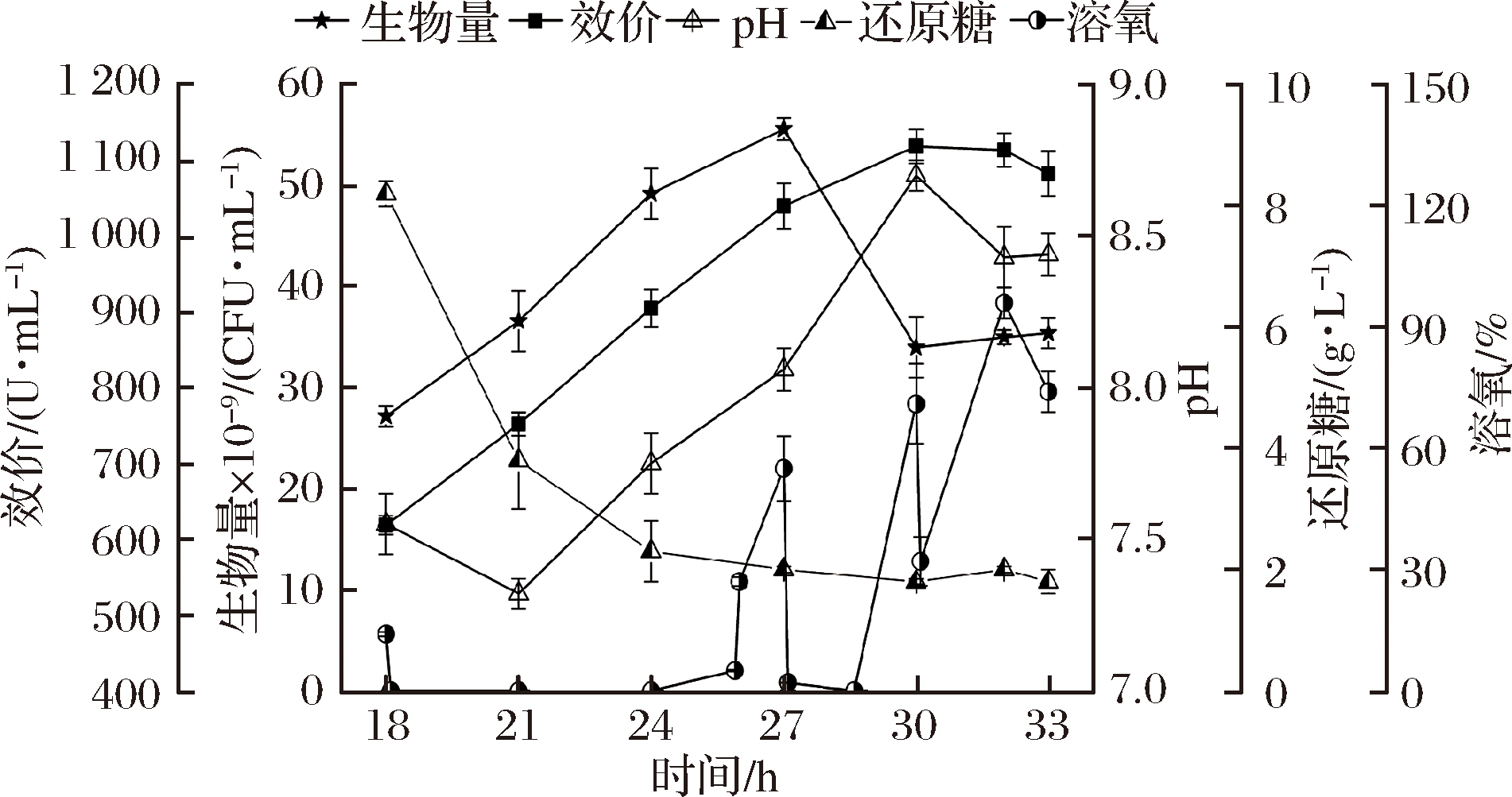
图5 发酵5对细胞生长和杆菌肽合成的影响
Fig.5 Influences of fermentation 5 on cell growth and bacitracin synthesis
如图5所示,24 h罐压提高到0.05 MPa,杆菌肽效价持续合成至30 h达到峰值(1 118 U/mL),比发酵4提高了4.5%,说明提高溶氧对杆菌肽合成有积极的影响。但提高溶氧对生物量的影响不明显,菌体生物量在27 h达到峰值(55.6×109 CFU/mL)后的变化趋势和峰值浓度都和发酵4基本一致,说明细胞数在峰值条件下,能量供应及碳源不足可能与菌体自溶有关。
18~24 h葡萄质量糖浓度从8.2 g/L降到2.3 g/L,变化趋势与发酵4一致。另外,18 h补入氮源和葡萄糖后,DO即从14%降为0并一直维持至26 h左右,并没有因24 h升罐压而立即升高。期间大量碳源和氮源被消耗,菌体代谢活跃。随着细胞生长和碳氮源的消耗,碳源不足可能引起了细胞氧化磷酸化的耗氧降低,使DO于26 h开始回升,并于27 h达到55%。此时杆菌肽效价(1 040 U/mL)比发酵4(975 U/mL)提高了7%。随着27 h间歇补料(200 mL的质量分数为75%葡萄糖),DO再次被大量消耗而跌为0,说明26 h时碳源供应确实处于不足状态,使氧化磷酸化对溶氧的消耗减少。
30 h间歇补料后,由于此时细胞数只有27 h的61%,对碳源的需求减少。仍按200 mL/3 h的葡萄糖补入量对于此时(30 h)的细胞而言,可能已经过量,CcpA被激活[10],氧化磷酸化作用被抑制[9],菌体对氧的利用速率反而减小,因而DO没有像27 h那样出现跌0的情况;
另外,溢流代谢被激活,大量的小分子有机酸如乙酸被合成[8],引起pH在发酵后期由8.7下降至8.4,补入的葡萄糖通过溢流代谢仅仅维持了细胞活性,但并没有促进杆菌肽效价的合成。
2.6 发酵策略6(间歇-DO耦合补料)对LC菌株生长和杆菌肽合成的影响
发酵4和5中菌体生物量在27 h分别达到了56.8×109 CFU/mL和55.6×109 CFU/mL,比发酵1(未补料)提高了60%左右,但高菌体量也激化了能量供应的矛盾。至30 h时,细胞又自溶了40%左右,这也造成了碳氮源的浪费。而且,这种间歇补料的方式在25~26 h溶氧开始回升时并不能及时补入葡萄糖;而在30 h菌体自溶后对碳源需求量减小时,又补入了过量的碳源,所以在24 h后应采用溶氧耦合的方式根据细胞对碳源的需求补入葡萄糖,形成发酵策略6(图6)。
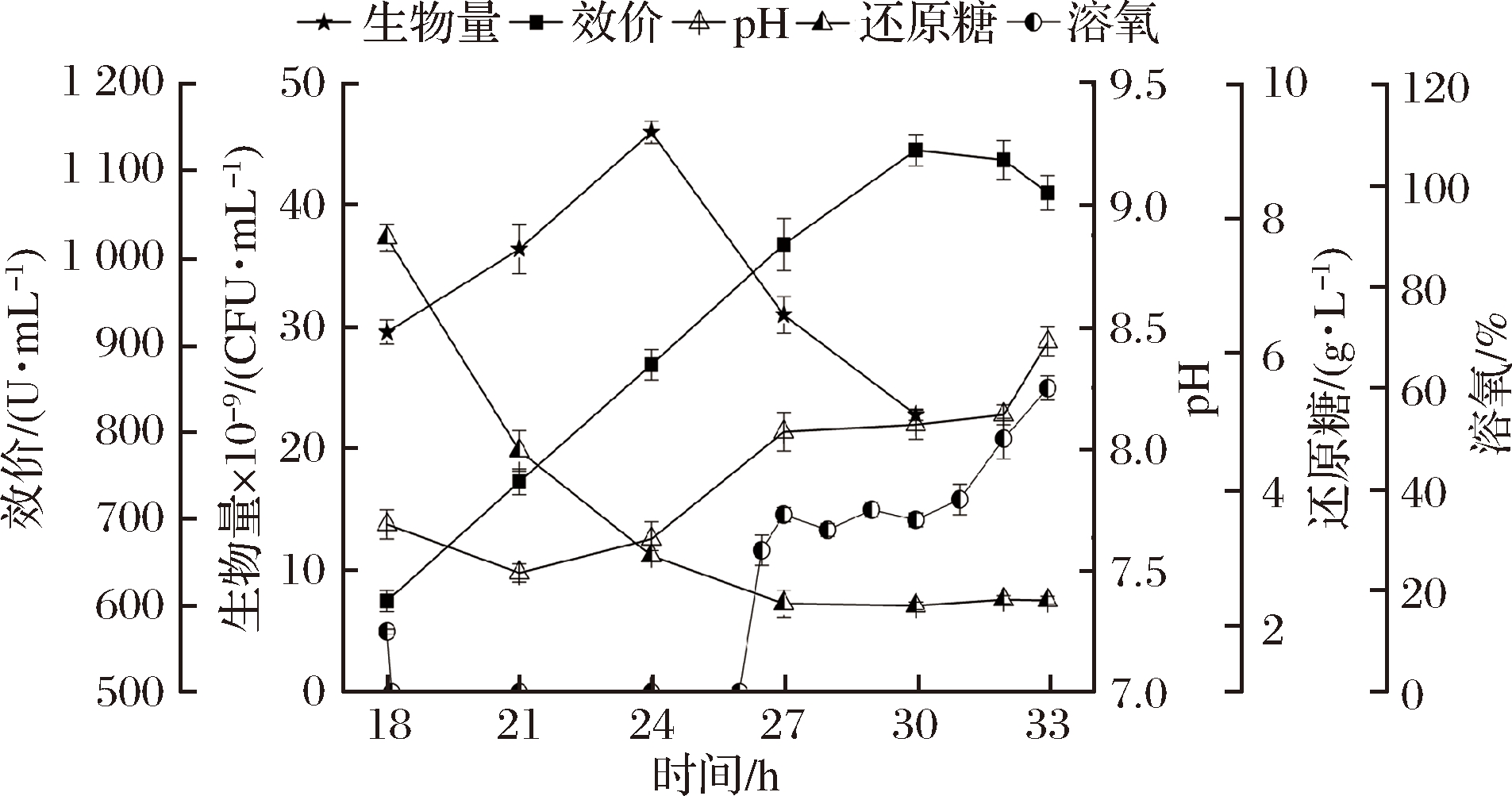
图6 发酵6对细胞生长和杆菌肽合成的影响
Fig.6 Influences of fermentation 6 on cell growth and bacitracin synthesis
如图6所示,菌体生物量在24 h即达到峰值46×109 CFU/mL,和发酵5在24 h的菌体生物量相当(47.6×109 CFU/mL),但比其峰值生物量减少了17%。虽然菌体在24 h后就逐渐自溶,但杆菌肽的合成速率没有受到影响,进一步说明杆菌肽的合成不需要维持菌体的高生物量。
24 h开始葡萄糖耦合DO(35%)补料策略,由于24~27 h的DO一直低于35%,因而期间未补入葡萄糖。葡萄糖质量浓度从18~24 h快速下降(7.7~3 g/L),然后一直维持在2.3 g/L左右。
杆菌肽效价近线性上升至30 h的峰值浓度1 123 U/mL,与发酵5基本一样,但是补糖量总计500 g,比发酵5补糖量(750 g)减少了33.3%,节约了成本。而且这种基于DO耦合的补料方式满足了细胞对DO-糖代谢匹配的需求,杆菌肽对糖的得率系数(YP/S)提高了22.7%(表1)。
2.7 发酵策略7(间歇-DO耦合-二次氮源补料)对LC菌株生长和杆菌肽合成的影响
鉴于发酵6和发酵5的试验结果,考虑到杆菌肽合成不仅与糖和DO有关,更是涉及到碳-氮-氧的综合因素,因此,在发酵6的基础上,于24 h二次补入氮源(豆粕250 g、玉米浆125 g)形成发酵策略7,考察其对杆菌肽合成的影响。
如图7所示,杆菌肽效价持续合成至30 h,达到峰值1 220 U/mL,比发酵6提高了9.1%,说明24 h后,氮源不足是影响杆菌肽合成的另一个重要因素。另外,虽然生物量于24 h达到峰值(45×109 CFU/mL)后自溶,但是27 h时细胞仅自溶了11%,相比于发酵6(自溶率33%)降低了66%。说明综合匹配碳-氮-氧3个关键因素的补料方式能有效地维持细胞在发酵中后期的代谢活性,形成了基于细胞生理需求的发酵策略,突破了有关葡萄糖不适宜作为杆菌肽补料碳源的认知,并提高了杆菌肽的合成效率[40.67 U/(mL·h)],比相关报道[14]的杆菌肽合成效率[29 U/(mL·h)]提高了40.3%。
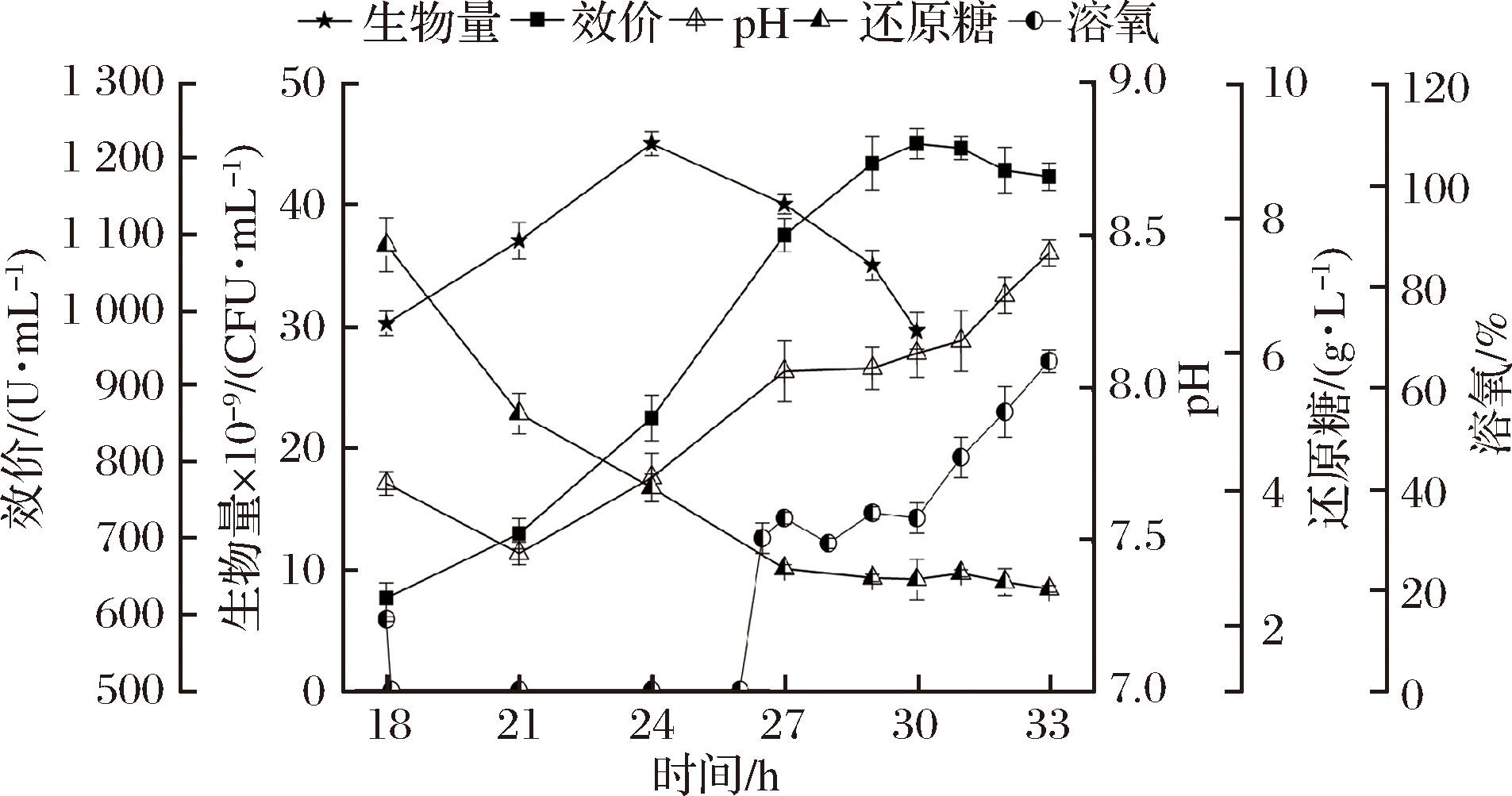
图7 发酵7对细胞生长和杆菌肽合成的影响
Fig.7 Influences of fermentation 7 on cell growth and bacitracin synthesis
为了进一步分析补料策略对杆菌肽合成的影响,对发酵1~7进行了总结,相关参数如表1所示。
表1 所有试验批次相关参数情况
Table 1 The related parameters of all test batch
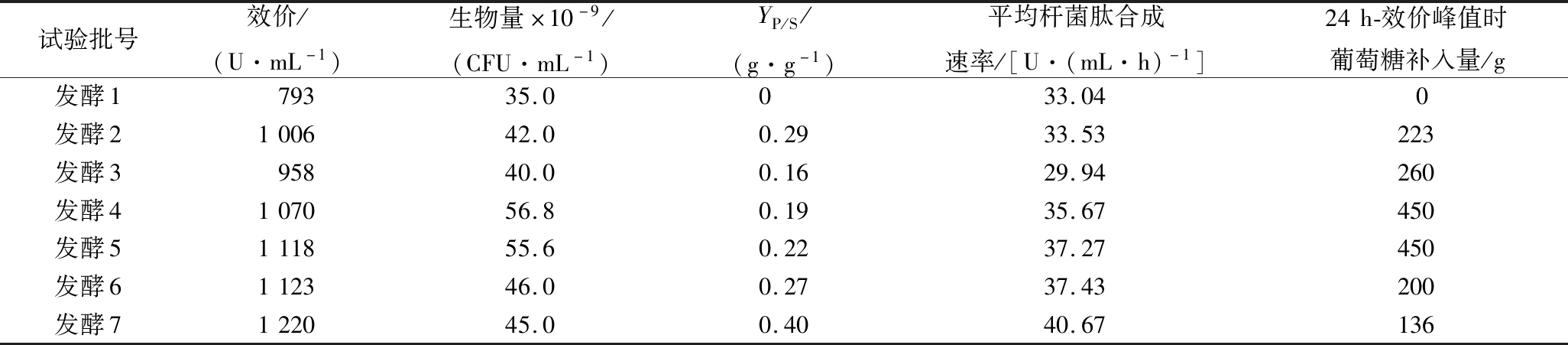
试验批号效价/(U·mL-1)生物量×10-9/(CFU·mL-1)YP/S/(g·g-1)平均杆菌肽合成速率/[U·(mL·h)-1]24h-效价峰值时葡萄糖补入量/g发酵179335.00 33.040发酵2100642.00.2933.53223发酵395840.00.1629.94260发酵4107056.80.1935.67450发酵5111855.60.2237.27450发酵6112346.00.2737.43200发酵7122045.00.4040.67136
注:效价为发酵过程中杆菌肽的最高效价;生物量为发酵过程中菌体的最高生物量;YP/S是糖对新增杆菌肽的得率系数,糖质量=效价达到峰值时补入的糖质量,新增效价=峰值效价-793,体积按27 L计,杆菌肽效价的质量系数为65.8 U/mg;平均杆菌肽合成速率为从发酵开始到杆菌肽达到最大值的平均杆菌肽合成速率。
如表1所示,发酵7杆菌肽效价最高,分别比发酵2、4提高了21%和14%。通过提高罐压(增强氧的供应强度)、补入碳源、氮源,杆菌肽效价比未补料(发酵1)提高了54%,平均杆菌肽合成速率提高了23.1%,节省了发酵时间。同时发酵7形成了基于细胞碳氮源和能量需求的补料模式,其YP/S(葡萄糖杆菌肽得率)达到了0.4 g/g,远高于其他补料试验批次。
3 结论
本研究探索了碳、氮源的间歇补加、pH耦合流加、氧的供应强度以及DO耦合流加对细胞生长、代谢和杆菌肽合成的影响。结论如下:
(1)pH耦合补料策略(18 h补入氮源、pH耦合补糖)的杆菌肽效价(1 006 U/mL)比对照提高了27%,但当18~22 h需要增加葡萄糖供应量时,却存在因pH低于耦合设定值而无法补入的缺陷。
(2)间歇补料-罐压控制策略(18 h补入氮源、间歇补糖、罐压控制)的效价(1 118 U/mL)比对照提高了41%,也比pH耦合策略提高了11%,但存在发酵后期碳源不足时(溶氧迅速回升至55%),葡萄糖无法及时补入、而细胞自溶后对糖需求量减少时仍按设定值补入的缺陷,即存在发酵后期补糖量与DO不匹配的问题。
(3)采用间歇-DO耦合补料策略(18 h补入氮源、18~21 h间歇补糖,24 h以后耦合DO补料、罐压控制),可以避免18~24 h葡萄糖补入量不足和发酵后期葡萄糖补入过量的问题,虽然杆菌肽效价为1 123 U/mL,但是由于补糖量比间歇补料-罐压控制模式减少了33.3%,因此杆菌肽对糖的得率系数(YP/S)提高了22.7%。
(4)基于间歇-DO耦合补料策略于24 h二次补入氮源后,杆菌肽效价峰值达到了1 220 U/mL,比pH耦合、间歇补料-罐压控制分别提高了21%和9.1%,平均杆菌肽合成速率为40.67 U/(mL·h),突破了有关葡萄糖不适宜作为杆菌肽补料碳源的认知,形成了基于细胞需求的综合碳-氮-氧因素的补料策略,为工业化补料发酵生产杆菌肽提供了重要参考。
[1] SHRUTI B, KUMAR D, PATRICIA R, et al. High level extracellular production of recombinant γ-glutamyl transpeptidase from Bacillus licheniformis in Escherichia coli fed-batch culture[J]. Enzyme and Microbial Technology, 2018, 116:23-32.
[2] 祝亚娇, 宋嘉宾,陈杨阳,等. 地衣芽胞杆菌工程菌高产纳豆激酶的发酵罐工艺优化及中试放大[J]. 食品与发酵工业, 2016, 42(1):37-41.
[3] ZHAO Y L, WEN L Y, CHEN S W, et al. Increased flux through the TCA cycle enhances bacitracin production by Bacillus licheniformis DW2 [J]. Applied Microbiology and Biotechnology, 2018, 102(16):6 935-6 946.
[4] HANSEN F T, GARDINER D M, LYSØE E, et al. An update to polyketide synthase and non-ribosomal synthetase genes and nomenclature in Fusarium [J]. Fungal Genetics and Biology, 2015, 75:20-29.
[5] 李冠楠, 夏雪娟,隆耀航,等. 抗菌肽的研究进展及其应用[J]. 动物营养学报, 2014, 26 (1):17-25.
[6] 罗娟, 马海乐,刘雪姣,等. 枯草芽孢杆菌液态发酵豆粕的种子培养基和发酵培养基优化研究[J]. 食品工业科技, 2016,37(8):229-233;251.
[7] PURI-TANEJA A, SCHAU M, CHEN Y. Regulators of the Bacillus subtilis cydABCD operon: identification of a negative regulator, CcpA, and a positive regulator, ResD[J]. Journal of Bacteriology, 2007, 189(9):3 348-3 358.
[8] KABISCH J, PRATZKA I, MEYER H, et al. Metabolic engineering of Bacillus subtilis for growth on overflow metabolites[J]. Microbial Cell Factories, 2013, 12(1):72.
[9] PACZIA N, NILGEN A, LEHMANN T, et al. Extensive exometabolome analysis reveals extended overflow metabolism in various microorganisms[J]. Microbial Cell Factories, 2012, 11(1):1-14.
[10] MITSUNAGA H, MEISSNER L, PALMEN T, et al. Metabolome analysis reveals the effect of carbon catabolite control on the poly (γ-glutamic acid) biosynthesis of Bacillus licheniformis ATCC 9945[J]. Journal of Bioscience & Bioengineering, 2015, 121(4):413-419.
[11] 邓坤,冀志霞,陈守文,等. 溶氧对地衣芽孢杆菌DW2合成杆菌肽的影响[J]. 中国抗生素杂志,2009, 34(11):664-668.
[12] 曾新年, 鲍帅帅,李洪杰,等. 双氧水对地衣芽胞杆菌合成杆菌肽的影响[J]. 中国酿造, 2013, 32(3):94-97.
[13] WANG Z, WANG Y, XIE F L, et al. Improvement of acetoin reductase activity enhances bacitracin production by Bacillus licheniformis[J]. Process Biochemistry, 2014, 49(12):2 039-2 043.
[14] 刘道奇, 陈守文,李俊辉,等. 混合碳源对地衣芽孢杆菌发酵合成杆菌肽的影响[J]. 食品与发酵工业, 2017,43(9):56-61.
[15] 辛星. 工程菌株发酵FK520的过程优化和抑制泡沫促进剂研究[D]. 天津:天津大学, 2014.
[16] 陈伟波, 周旭波,陈悦群,等. L-精氨酸发酵过程中的溶氧与泡沫研究[J]. 中外食品工业, 2015, 8(4):18-20.
[17] REFFATTI P F, ROY I, ODELL M, et al. Proteomics analysis of Bacillus licheniformis in response to oligosaccharides elicitors[J]. Enzyme and Microbial Technology, 2014, 61(1): 61-66.
[18] WANG Q, ZHENG H, WAN X, et al. Optimization of inexpensive agricultural by-products as raw materials for Bacitracin production in Bacillus licheniformis DW2 [J]. Applied Biochemistry and Biotechnology, 2017, 183(4):1 146-1 157.
[19] AHARONOWITZ Y. Nitrogen metabolite regulation of antibiotic biosynthesis[J]. Annual Review of Microbiology, 1980,34:209-233.
[20] 顾晓峰,颜盼.一种基于枯草芽孢杆菌的豆粕发酵方法:湖北,CN106490300A[P].2017-03-15.
[21] CHEN X, XIE F, ZENG X, et al. Supplementations of ornithine and KNO3 enhanced bacitracin production by Bacillus licheniformis LC-11[J]. Annals of Microbiology, 2014, 64(2): 509-514.
[22] BARBIERI G, ALBERTINI A M, FERRARI E, et al. Interplay of CodY and ScoC in the regulation of major extracellular protease genes of Bacillus subtilis[J]. Journal of Bacteriology, 2016,198(6):907-920.
[23] RANDAZZO P, AUCOUTURIER A, DELUMEAU O, et al. Revisiting the in vivo GlnR-binding sites at the genome scale in Bacillus subtilis[J]. BMC Research Notes, 2017,10(1):422-431.
[24] SHU C C, WANG D, GUO J, et al. Analyzing AbrB-knockout effects through genome and transcriptome sequencing of Bacillus licheniformis DW2[J]. Frontiers in Microbiology, 2018,9:1-11.
[25] WANG J, LIU S, LI Y, et al. Central carbon metabolism influences cellulase production in Bacillus licheniformis[J]. Letters in Applied Microbiology, 2017,66(1):49-54.
[26] LIU Z Y, YU W L, NOMURA T C, et al. Increased flux through the TCA cycle enhances bacitracin production by Bacillus licheniformis DW2 [J]. Applied Microbiology and Biotechnology, 2018,102(16):6 935-6 946.