益生菌是一种能够黏附在宿主体内来增强宿主免疫能力,或通过促进宿主肠道的营养组成与控制体内多种菌的动态平衡,来提高宿主健康程度的活性微生物[1]。常见的益生菌有枯草杆菌、乳酸杆菌、地衣芽孢杆菌、酵母菌等。用于发酵的益生菌多以乳酸菌为主,其作为食品发酵剂已有很长使用历史,被普遍认为安全性较高[2-3],具有多种生理功能,如控制肠道内稳态、免疫调节、抑制病原菌、抗过敏、抗肿瘤、延缓衰老等[4-7]。乳酸菌若想顺利到达体内并发挥作用,一方面,要具备对胃肠道内酸和胆盐的耐受能力[8];另一方面,要能够黏附于宿主的肠壁细胞,以保证其能抵抗住肠道的蠕动作用[9];此外,还必须具备对常见致病菌的抑制能力以及对胆固醇和甘油三酯的降解能力等[10]。目前对于乳酸菌益生特性的研究,多集中于植物乳杆菌、发酵乳杆菌、戊糖乳杆菌等[11-13],鲜有魏斯氏菌益生特性的报道,而不同益生菌株在益生特性方面存在着高度的特异性[14]。
魏斯氏菌属于乳酸菌,广泛分布于发酵食物如腊肠、泡菜、酱油、豆豉等, 多数菌种在食品发酵过程中起重要作用,对食品中酯类、有机酸及短链脂肪酸等风味物质的合成具有重要作用。此外,其还具有合成细菌素、胞外多糖等特性,具有潜在的益生菌特性[15]。因此,本研究以分离自泡菜的2株魏斯氏菌——希腊魏斯菌(Weissella Hellenica)WS-419和绿色魏斯菌(Weissella viridescens)ZY-6为对象,对其益生特性如耐酸性、耐胆盐、肠液耐受性、抑菌特性、降解胆固醇和甘油三酯、表面特性进行比较研究,为进一步应用此2株菌进行功能性食品的开发奠定基础。
1 材料与方法
1.1 原料
1.1.1 材料与试剂
希腊魏斯菌(Weissella Hellenica)WS-419、绿色魏斯菌(Weissella viridescens)ZY-6、沙门氏菌(Salmonella)SM-5、大肠杆菌(Escherichia coli)EC-19、金黄色葡萄球菌(Staphylococcus aureus)SA-405,徐州工程学院微生物遗传育种实验室保存。
甘油三酯、胆固醇测定试剂盒,长春汇力生物技术有限公司。
胆固醇、猪胆盐、柠檬酸铵、MnSO4·H2O、MgSO4·7H2O、K2HPO4·3H2O、葡萄糖、无水乙酸钠、吐温-80、正己烷、蔗糖酯等均为国产分析纯。
1.1.2 培养基
1.1.2.1 LB液体培养基(g/L)
酵母浸膏5,胰蛋白胨10, NaCl 10,pH 7.2,121 ℃灭菌20 min。
1.1.2.2 LB固体培养基
LB液体培养基中加入15 g/L的琼脂粉。
1.1.2.3 LB半固体培养基
LB液体培养基中加入7.5 g/L的琼脂粉。
1.1.2.4 MRS液体培养基(g/L)
葡萄糖20、蛋白胨10、酵母膏5、牛肉膏15、柠檬酸铵2、无水乙酸钠5、MnSO4·H2O 0.198 g/L、K2HPO4·3H2O 2.62、MgSO4·7H2O 0.58、吐温-80体积分数0.1%,pH 6.0~6.5,121 ℃灭菌20 min。
1.1.2.5 MRS固体培养基
MRS液体培养基中加入15 g/L的琼脂粉。
1.1.2.6 甘油三酯(TG)培养基
MRS培养基中加入体积分数1%的猪油和体积分数5%的吐温-80、质量浓度2 g/L巯基乙酸钠, pH值6.0,121 ℃灭菌15 min。
1.1.2.7 胆固醇(TC)培养基
MRS培养基中加入质量浓度0.1 g/L胆固醇、体积分数0.5%冰乙酸、体积分数0.1%吐温-80、质量浓度2 g/L巯基乙酸钠、质量浓度0.1 g/L蔗糖酯, pH 6.0,121 ℃灭菌15 min。
1.1.3 主要仪器设备
HYG-Ⅱ回旋式恒温调速摇瓶柜,上海欣蕊自动化设备有限公司;HH.B11.600-S-Ⅱ型电热恒温培养箱,上海跃进医疗器械厂;SW-CJ-IF超净工作台,苏州安泰空气技术有限公司;FA2104N电子天平,上海精密科学仪器有限公司;64RL高速冷冻离心机,美国Beckman公司;DHG-9140型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;酶标仪SynergyHI ,美国Biotek 公司;722型分光光度计,上海菁华科技仪器有限公司。
1.2 试验方法
1.2.1 种子液的制备
将保藏于甘油管的希腊魏斯菌WS-419和绿色魏斯菌ZY-6接种于MRS液体培养基,37 ℃静置培养24 h,再以4%的接种量接种至新鲜MRS液体培养基,37 ℃静置培养16~18 h至对数生长期,得种子液。
1.2.2 耐酸性测定
将2株魏斯菌种子液按4%的接种量接入pH值分别为2、3、4的MRS液体培养基中,37 ℃静置培养,分别于0、1、2和3 h从中吸取菌悬液,进行梯度稀释,涂布至MRS固体培养基上,于37 ℃恒温培养箱倒置培养48 h,选取菌落数30~300之间的平板进行计数。按照公式(1)计算存活率[16]:
存活率![]()
(1)
式中:Nt,各时间段的活菌数,CFU/mL;N0,0 h的活菌数,CFU/mL。
1.2.3 胆盐耐受性
将2株魏斯菌种子液按4%的接种量接入胆盐浓度分别为0.3、1.5、3 g/L的MRS液体培养基中,37 ℃静置培养,分别于0、1、2、3 h从中吸取菌悬液,进行梯度稀释,涂布至MRS固体培养基上,于37 ℃恒温培养箱倒置培养48 h,选取菌落数30~300之间的平板进行计数。按照1.2.2中的公式计算存活率。
1.2.4 肠液耐受性
1.2.4.1 人工肠液的制备
0.18 g胆盐、0.1 g胰蛋白酶、溶于无菌溶剂(1.1 g NaHCO3、0.2 g NaCl及100 mL蒸馏水),用0.5 mol/L的NaOH调整pH值到7.0[17]。溶液过0.22 μm微孔滤膜除菌。
1.2.4.2 肠液耐受性的测定
将2株魏斯菌种子液按4%的接种量接入人工肠液中,放37 ℃恒温培养箱中,分别于0、1、2、3 h从中吸取菌悬液,进行梯度稀释,涂布至MRS固体培养基上,于37 ℃恒温培养箱倒置培养48 h,选取菌落数30~300之间的平板进行计数。按照1.2.2中的公式计算存活率。
1.2.5 抑菌特性
1.2.5.1 指示菌种子液的制备
将沙门氏菌、大肠杆菌、金黄色葡萄球菌分别接种于LB液体培养基中,置37 ℃,120 r/min的摇床振荡培养12~16 h至对数生长期,备用。
1.2.5.2 样品的制备
将2株魏斯菌的发酵液于8 000 r/min离心15 min,得到发酵上清液,按如下方式制备样品:(a)用6 mol/L NaOH将发酵上清液调至pH值6.5;(b)发酵上清液;(c)空白培养基,用乳酸调至pH值与发酵上清液相同;(d)空白培养基。上述4种样品均通过无菌过滤膜(0.22 μm)除菌,备用。
1.2.5.3 抑菌活性的测定
用LB半固体培养基将3种指示菌种子液稀释至菌数为106~107 CFU/mL,倒平板。待培养基凝固后,用无菌镊子将灭菌的牛津杯置于琼脂表面,在牛津杯中注入200 μL上述4种样品,放于37 ℃的恒温培养箱中,正置培养过夜后,取出观察,用游标卡尺测量抑菌圈直径的大小[16]。
1.2.6 菌株对胆固醇和甘油三酯的降解特性
1.2.6.1 对胆固醇的降解特性
将2株魏斯菌接种至胆固醇培养基,于37 ℃下静置培养48 h,将发酵液于8 000 r/min离心15 min,取上清,分别测定0 h和48 h发酵上清中的胆固醇浓度,按公式(2)计算胆固醇降解率[18]。
降解率![]()
(2)
式中:C0,0 h发酵上清中的胆固醇浓度,mmoL/L;C48,48 h发酵上清中的胆固醇浓度,mmoL/L。
1.2.6.2 对甘油三酯的降解特性
将2株魏斯菌接种至甘油三酯培养基,于37 ℃下静置培养48 h,将发酵液于8 000 r/min离心15 min,取上清,分别测定0 h和48 h发酵上清中的甘油三酯浓度,按公式(3)计算甘油三酯的降解率[19]。
降解率![]()
(3)
式中:A0,0 h发酵上清中的甘油三酯浓度,mmoL/L;A48,48 h发酵上清中的甘油三酯浓度,mmoL/L。
1.2.7 菌株表面特性
1.2.7.1 表面疏水性的测定
采用碳烃化合物法(MATH)[20]。分别取2株菌的菌悬液离心(8 000 r/min,10 min),弃上清,用磷酸缓冲溶液(0.2 mol/L,pH 7.0)洗涤菌体2次后使菌重悬,调整菌悬液的OD600为0.8。在试管内加入4 mL菌液、1 mL正己烷,对照组不加正己烷,封口,用旋涡振荡仪剧烈振荡60 s,静置15 min分层。吸取下相水溶液3.0 mL,以Na2HPO4-NaH2PO4缓冲液为空白对照,在600 nm波长下测定吸光度,细菌细胞表面疏水性(cell-surface hydrophobicity, CSH)按公式(3)计算:
(3)
式中:A0,对照组光密度值;AS,实验组光密度值。
1.2.7.2 表面凝集性
取5 mL按1.2.7.1所述方法调整好菌浓的菌悬液,于37 ℃恒温箱静置培养2 h后,轻轻吸取200 μL上层悬浮液,不摇动,测定其在600 nm波长处的光密度值,菌体凝集性按公式(4)计算[21]:
(4)
式中:OD0,菌悬液初始光密度值;ODt,菌悬液静置后光密度值。
1.3 统计分析
实验数据为3次重复的平均值,以平均值±标准方差(x±s)表示,采用Spss 16.0进行统计分析,采用Duncan’s ANOVA进行多重比较,不同处理组之间P<0.05表示差异性显著。
2 结果与讨论
2.1 耐酸性能
测定酸性条件下对2株菌存活的影响,结果见图1。

图1 pH值对WS-419(A)和ZY-6(B)存活率的影响
Fig.1 Effect of pH value on survival rate of WS-419(A) and ZY-6(B)
注:不同小写字母表示差异显著(P<0.05),下同。
可以看出,当pH为2时,随时间的延长,2株菌的存活率皆出现了一定程度的下降(P<0.05),3 h后WS-419和ZY-6的存活率分别为24.65%和45.18%;当pH升高时,随时间的延长,2株菌的存活率都出现了增大的情况(P<0.05),当pH为3时,WS-419和ZY-6在3h后的存活率分别为115.73%和118.58%;pH为4时,3 h后的存活率分别123.31%和133.18%,这可能是由于菌株的耐受性较好,当pH值较低时,并不能抑制其生长,而是出现了在培养基中随培养时间的延长,菌体生长的现象。刘秀侠等在研究枯草芽孢杆菌的益生特性时,也有类
似发现[22]。总体看来,2株菌对酸性条件皆有一定的耐性,ZY-6的耐酸性稍强于WS-419,体现在同一pH条件下,ZY-6的存活率都高于WS-419(P<0.05)。
2.2 胆盐耐受性
胆盐会对微生物的生长产生一定的抑制作用[23]。正常情况下小肠内胆盐质量浓度在 0.3~3.0 g/L [24],因此,选择0.3、1.5和3.0 g/L 3个浓度来考察菌株的胆盐耐受性,结果见图2。从图2可以看出,2株菌在低、中、高浓度的胆盐中,随时间的延长,存活率皆有所下降(P<0.05),但呈现出了一定的耐胆盐特性。当胆盐质量浓度为0.3 g/L时,3 h后,2株菌的存活率皆保持在90%左右;随胆盐浓度的升高,存活率出现了下降的情况,但在高胆盐质量浓度下,WS-419和ZY-6在3 h后的存活率也较高,分别为72.05%和75.89%。总体说来,ZY-6和WS-419的胆盐耐受性无明显差异(P>0.05)。
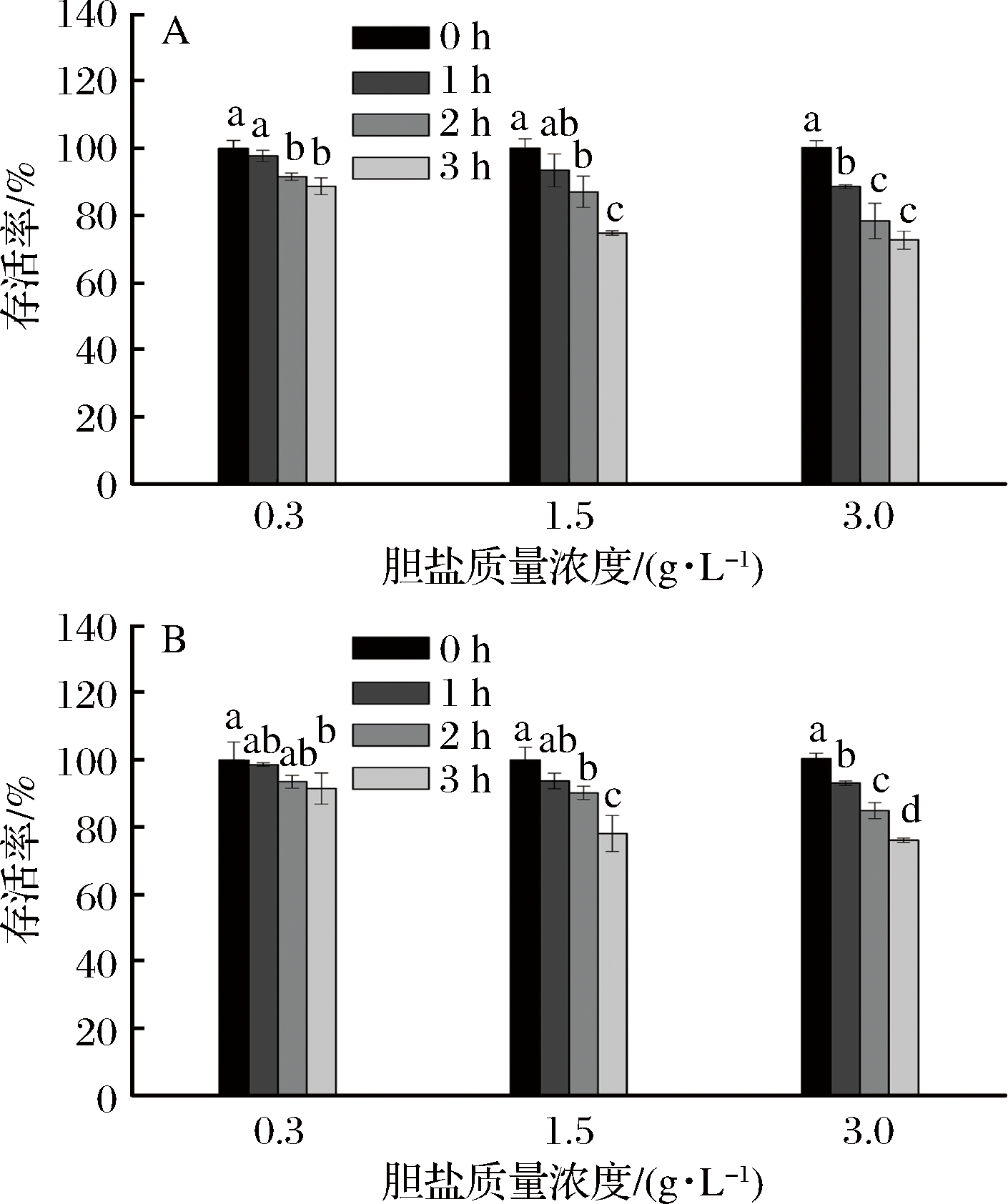
图2 胆盐浓度对WS-419(A)和ZY-6(B)存活率的影响
Fig.2 Effect of concentrations of bile salt on survival rate of WS-419 (A) and ZY-6 (B)
2.3 耐人工肠液性能
考察2株菌在人工肠液中的存活情况,结果见图3。从图3可以看出,随时间的延长,2株菌在人工肠液中的存活率出现了下降(P<0.05),WS-419在2 h之前的存活率都保持在90%以上,3 h后的存活率降为85.47%;ZY-6的存活率在1 h后降为86.72%,随着时间的继续延长,存活率变化不显著(P>0.05)。因此,2株菌均表现出了对人工肠液的较好抗性。
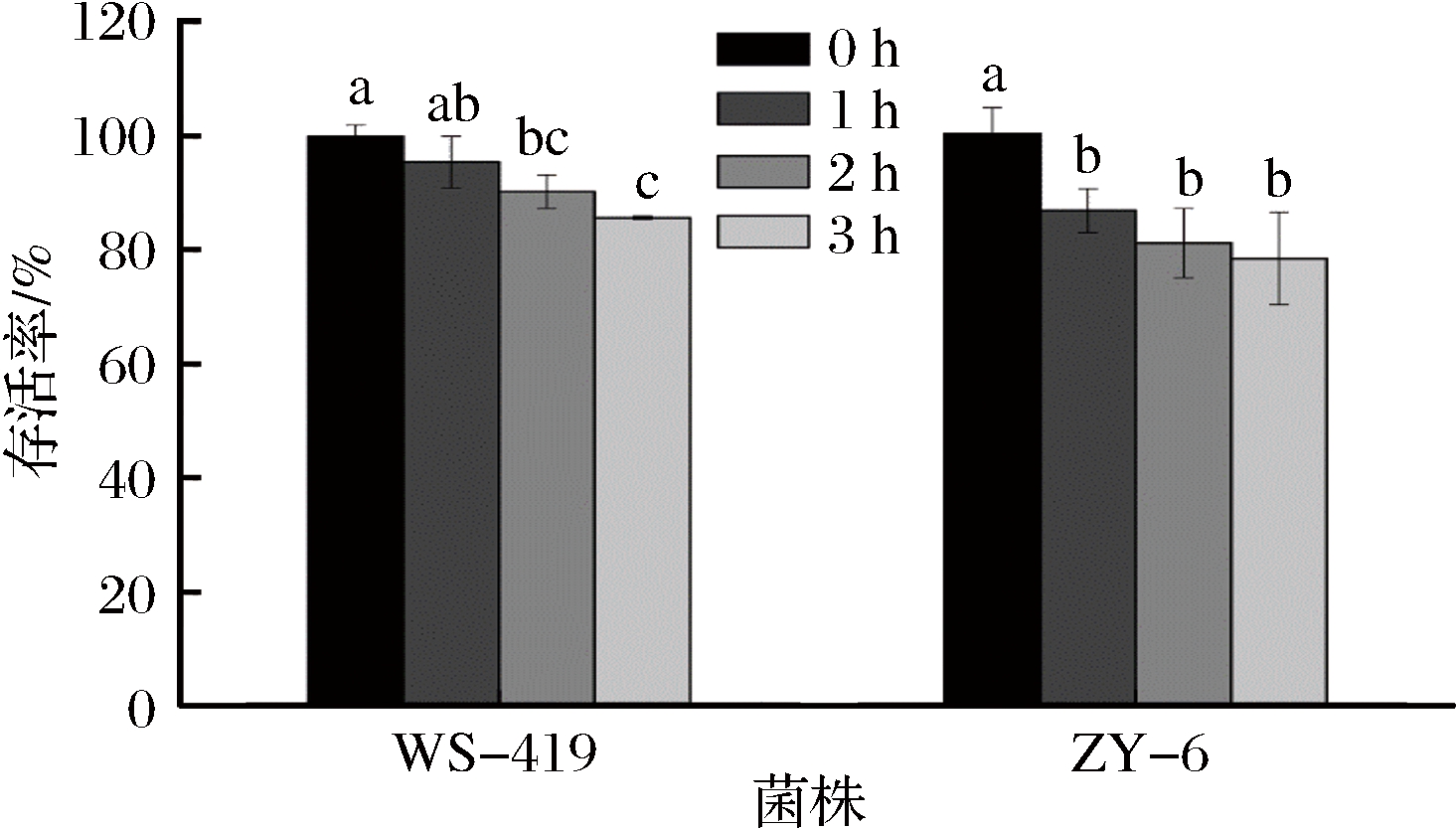
图3 人工肠液测定
Fig.3 Determination of tolerance to simulated intestinal fluid
2.4 抑菌特性
益生菌可以作为肠道的保护屏障,抑制肠道病原菌,保持肠道微生态平衡[25]。选取3种常见的肠道致病菌:沙门氏菌、大肠杆菌和金黄色葡萄球菌,考察2株魏斯菌对3种致病菌在平板上生长的抑制作用,并测定其抑菌圈直径大小,结果见图4和图5。
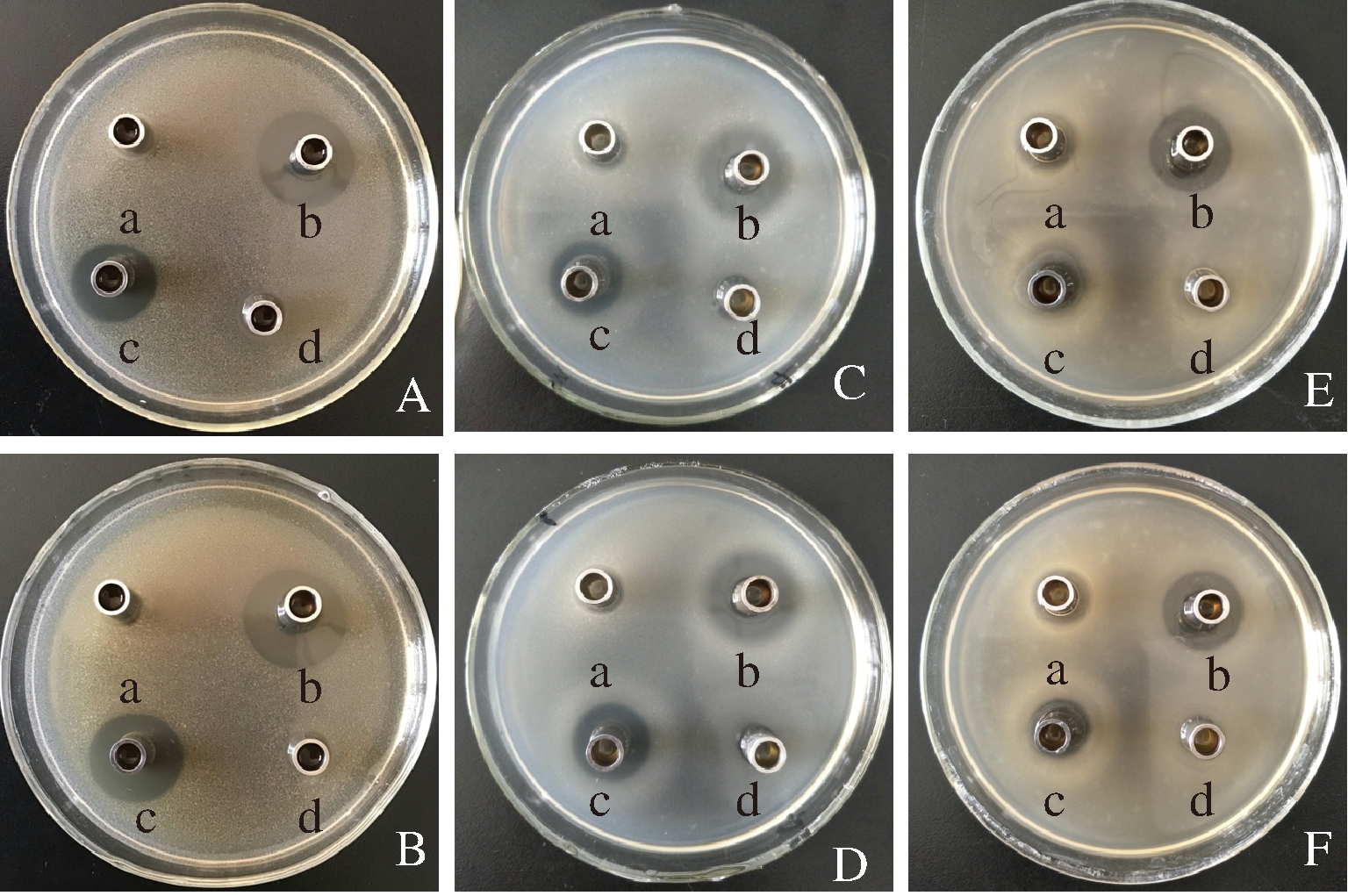
A、C、E分别为WS-419对沙门氏菌、大肠杆菌、金黄色葡萄球菌的抑制作用;B、D、F分别为ZY-6对沙门氏菌、大肠杆菌、金黄色葡萄球菌的抑制作用;a-调中性的发酵上清;b-发酵上清液;c-调酸的空白培养基;d-空白培养基
图4 两株菌对指示菌的抑制作用
Fig.4 Inhibitory activities of the two strains against various pathogens
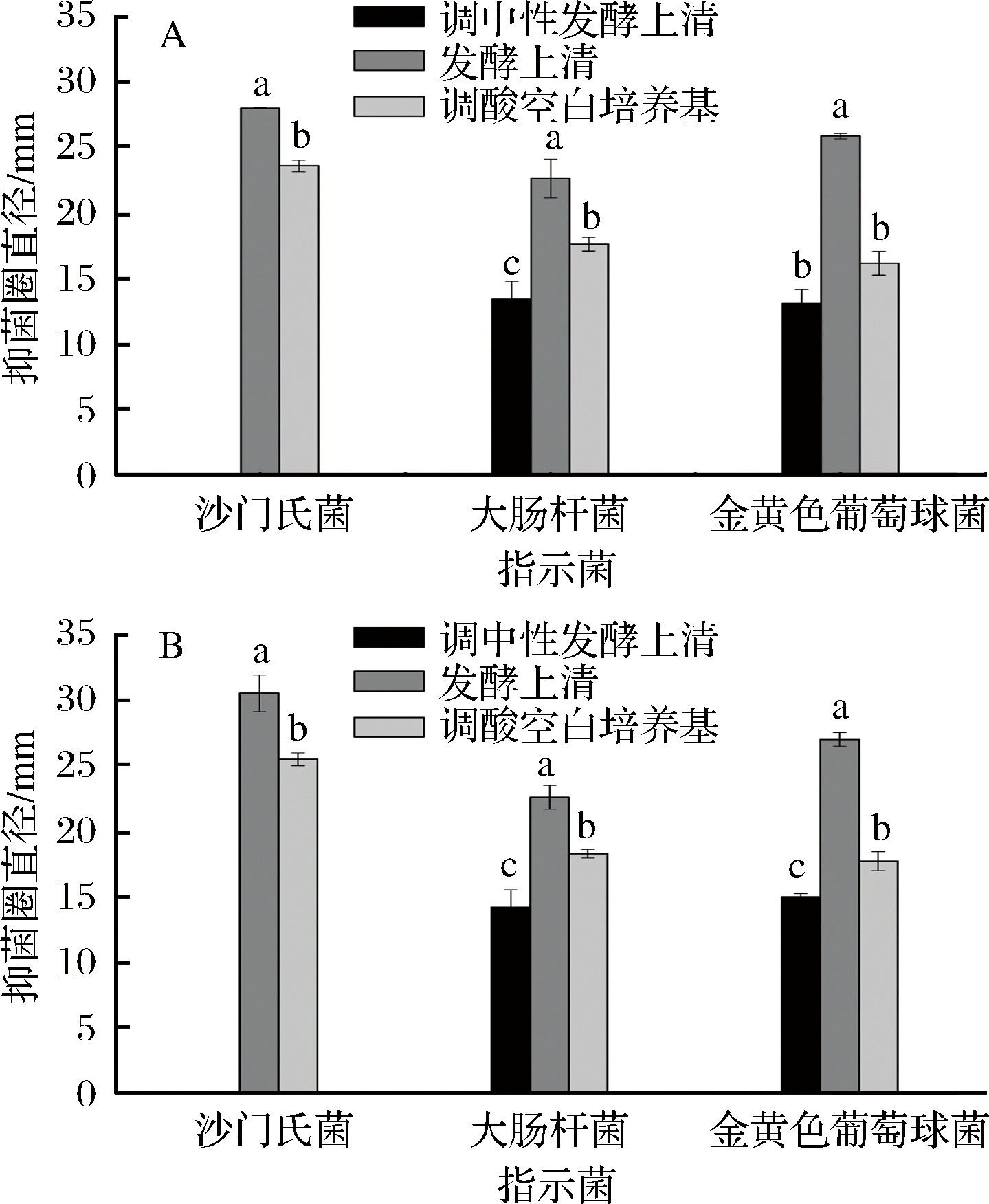
图5 WS-419 (A)和ZY-6 (B)对指示菌产生的抑菌圈直径
Fig.5 Diameter of inhibition zone of WS-419 (A)and ZY-6 (B) against various pathogens
可以看出,2株菌的发酵上清液对3种指示菌的生长皆呈现出了较好的抑制作用,且对大肠杆菌、金黄色葡萄球菌和沙门氏菌的抑制作用表现出逐渐增强的趋势。WS-419发酵上清液对3种指示菌的抑菌圈直径分别为(22.59±1.49)、 (25.82±0.20)、(27.96±0.04)mm;ZY-6分别为(22.61±0.90)、(27.02±0.53)、(30.53±1.40)mm。ZY-6对金黄色葡萄球菌和沙门氏菌的抑制效果好于WS-419(P<0.05);对于每种指示菌而言,发酵上清液的抑菌效果好于调酸的空白培养基(P<0.05),可见,发酵过程中,除了产生有机酸如乳酸等使发酵液呈现酸性,对菌的生长产生酸抑制外,也会产生一些抑菌活性物质如细菌素等,与酸共同作用,从而呈现出更强的抑菌作用;调成中性的发酵上清液对大肠杆菌和金黄色葡萄球菌呈现出了较弱的抑菌效果,而空白培养基对3种指示菌皆无抑菌作用,这进一步验证了发酵上清中存在抑菌活性物质,但具有一定的菌种选择性。
2.5 降解甘油三酯和胆固醇特性
血清中胆固醇、甘油三酯含量过高,会诱发冠心病、脑中风、高血压等心脑血管疾病,严重影响健康。因此,菌株对胆固醇、甘油三酯的降解能力是衡量益生菌益生特性的指标之一。由图6可以看出,在分别含胆固醇和甘油三酯的培养基中培养48 h后,WS-419和ZY-6对胆固醇的降解率相似(P>0.05),分别为32.79%和32.13%;对甘油三酯的降解率分别为42.80%和26.70%,WS-419对甘油三酯的降解能力强于ZY-6(P<0.05)。
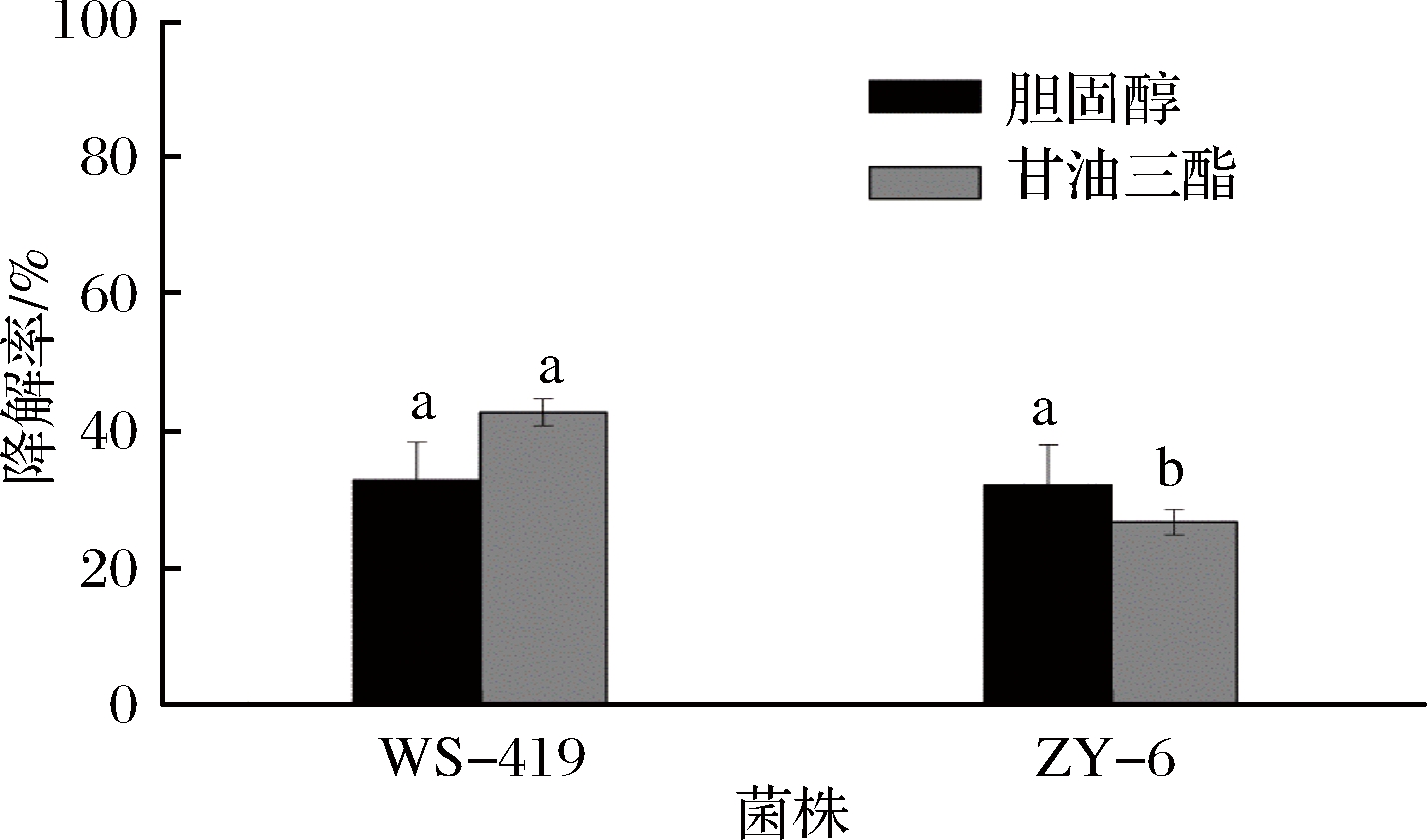
图6 菌株对胆固醇和甘油三酯的降解作用
Fig.6 Degradation of cholesterol and triglyceride by strains
2.6 表面特性
菌株的表面特性决定了菌株能否较好地黏附并定殖于消化道,以发挥其益生功效。测定2株菌的表面疏水性和表面凝集性,结果见表1。WS-419和ZY-6的表面疏水性分别为60.24%和61.41%,表面凝集性分别为67.30%和68.65%,2株菌具有相似的较好的表面特性(P>0.05),因此,都具备黏附在肠道上皮细胞和黏膜表面上,以发挥其益生功效的能力。
表1 菌株的表面疏水性和表面凝集性 单位:%
Table 1 Auto-aggregation and hydrophobicity of strains

菌株表面疏水性表面凝集性WS-41960.24±0.56a67.30±1.68aZY-661.41±1.03a68.65±0.82a
注:同列数据中的不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。
3 结论
绿色魏斯菌ZY-6和希腊魏斯菌WS-419是分离自传统发酵食品泡菜中的2株乳酸菌,本文对其益生特性进行了比较研究:耐酸性和抑菌特性方面,绿色魏斯菌ZY-6更优,其在pH为2时,3 h后的存活率为45.18%,高于WS-419的24.65%;pH为3和4时,存活率分别为118.58%和133.18%。对大肠杆菌、金黄色葡萄球菌、沙门氏菌的抑菌圈直径分别为22.61、27.02、30.53 mm,好于WS-419的22.59、 25.82、27.96 mm,这种抑制作用除来源于酸外,可能还和抑菌活性物质的产生有关。在降解胆固醇时,WS-419体现出更好的降解特性,降解率为42.80%,高于ZY-6的26.70%。ZY-6和WS-419益生特性大多相似:都具备较好的胆盐耐受性,在3 g/L的胆盐浓度中存活率分别为75.89%和72.05%;对人工肠液具有一定的抗性,3 h后的存活率维持在80%左右;2种菌具备降解胆固醇能力,降解率分别为32.79%和32.13%;表面疏水性分别为61.41%、60.24%;表面凝集性分别为68.65%、67.30%,皆显示出较好的表面特性。2株魏斯菌呈现出的良好的益生特性表明,它们能够克服体内环境,发挥其正常的益生作用,具备进行功能性食品开发的潜力。
绿色魏斯菌ZY-6和希腊魏斯菌WS-419同属于魏斯氏菌属,在某些益生特性如耐胆盐、耐人工肠液、降胆固醇、表面特性方面表现出一定的相似性,但在耐酸性、抑菌特性、降甘油三酯方面又呈现出一定的差异,这可能是由于其分属不同的种所致,后续可以深入探讨其机制,从而为益生菌益生特性的研究提供理论依据。
[1] CAGGIA C, DE A M, PITINO I, et al. Probiotic features of Lactobacillus strains isolated from Ragusano and Pecorino Siciliano cheeses[J]. Food Microbiology, 2015, 50: 109-117.
[2] CARR F J, CHILL D, MAIDAN. The lactic acid bacteria: a literature survey [J]. Critical Reviews in Microbiology, 2002,28(4):281-370.
[3] RUIZ R L, VERA P E, ROLLAN G, et al. Biodiversity and technological-functional potential of lactic acid bacteria isolated from spontaneously fermented quinoa sourdoughs[J]. Journal of Applied Microbiology, 2016, 120(5):1 289-1 301.
[4] 陈晓华, 肖苇苇, 田丰伟, 等. 具有拮抗幽门螺杆菌作用的植物乳杆菌特性研究[J]. 食品工业科技, 2012,33(2): 195-198.
[5] LEROY F, DEVUYSTL L. Lactic acid bacteria as functional starter cultures for the food fermentation industry[J]. Trends in Food Science & Technology,2004, 15(2):67-78.
[6] FOLIGNE B, NUTTEN S, GRANGETTE C, et al. Correlation between in vitro and in vivo immunomodulatory properties of lactic acid bacteria[J]. World Journal of Gastroenterology, 2007, 13(2): 236.
[7] DEL C S , ALEJANDRA L B, LEVIT R, et al. Anti-cancer effect of lactic acid bacteria expressing antioxidant enzymes or IL-10 in a colorectal cancer mouse model[J]. International Immunopharmacology, 2017, 42:122-129.
[8] BANSAL T, GARG S. Probiotics: From functional foods to pharmaceutical products[J]. Current Pharmaceutical Biotechnology, 2008, 9(4): 267-287.
[9] GOPAL P K, PRASAD J, SMART J, et al. In vitro adherence properties of Lactobacillus rhamnosus DR20 and Bifidobacterium lactis DR10 strains and their antagonistic activity against an enterotoxigenic Escherichia coli[J]. International Journal of Food Microbiology, 2001, 67(3):207-216.
[10] PARK J H, LEE Y, MOON E, et al. Immunoenhancing effects of a new probiotic strain, Lactobacillus fermentum PL9005[J]. Journal of Food Protection, 2005, 68(3): 571-576.
[11] 林龙镇,邹卫玲,李安章,等. 产酸、耐酸乳酸菌的分离鉴定及益生特性[J]. 华南农业大学学报, 2018, 39(2): 95-102.
[12] 周晏阳,孔雪英,吴梅,等.一株牦牛源产细菌素植物乳杆菌的益生特性分析[J].食品科学, 2018, 39(14): 132-137.
[13] SEDDIK H A, BENDALI F, GANCEL F, et al. Lactobacillus plantarumand its probiotic and food potentialities[J]. Probiotics and Antimicrobial Proteins,2017, 9(2):111-122.
[14] VERDENELLIMC, GHEFLI F, SILVI S, et al. Probiotic properties of Lactobacillus rhamnosus and Lactobacillus paracasei isolated from human faeces[J]. European Journal of Nutrition, 2009, 48(6):355-363.
[15] 李巧玉, 方芳, 堵国成, 等.魏斯氏菌在发酵食品中的应用[J]. 食品与发酵工业,2017, 43(10):246-252.
[16] 张卓丹, 张铁华, 李达, 等. 二株嗜热链球菌益生特性的体外研究[J]. 中国乳品工业, 2011, 39(7): 8-11.
[17] HUANG C H, QIAO S Y, LI D F, et al. Effect of Lactobacilli on the performance, diarrhea incidence, VFA concentration and gastrointestinal microbial flora of weaning pigs[J]. Asian-Australasion Journal of Animal Sciences, 2004,17(3): 401-409.
[18] 吕嘉枥, 闫亚梅, 王霄鹏, 等. 10株益生菌益生特性的比较研究[J]. 陕西科技大学学报, 2016, 34(1): 118-122.
[19] KO C Y, LIN H T V, TSAI G J. Gamma-aminobutyric acid production in black soybean milk by Lactobacillus brevis FPA 3709 and the antidepressant effect of the fermented product on a forced swimming rat model[J]. Process Biochemistry, 2013, 48(4): 559-568.
[20] 代永刚, 田志刚, 南喜平. 乳酸菌及其生理功能研究的进展[J]. 农产品加工, 2009(7): 24-26.
[21] 赵晴, 张甲耀, 陈兰洲, 等. 疏水性石油烃降解菌细胞表面疏水性及降解特性[J]. 环境科学, 2005, 26(5): 132-136.
[22] 刘秀侠, 徐海燕, 辛国芹,等. 11株枯草芽孢杆菌益生特性研究[J]. 中国畜牧兽医, 2017,44(8):2 333-2 341.
[23] 杨颖, 田丰伟, 陈卫, 等. 两株乳杆菌益生特性的体外研究[J]. 中国乳品工业, 2006, 34(6): 16-19.
[24] 朱振军, 黄国宏, 梁晓琳, 等. 罗伊氏乳杆菌的益生特性及安全性分析[J]. 现代食品科技,2016, 32(6): 315-320.
[25] 梁东梅, 李玉鹏, 杜艳芬. 三株乳酸杆菌的分离鉴定与益生特性研究[J].中国饲料, 2018(11): 24-29.