红葡萄酒颜色不仅是评价红葡萄酒质量的重要指标,也是消费者购买葡萄酒时重要的参考因素。花色苷(anthocyanins)是赋予葡萄酒颜色特性的一类天然色素,对葡萄酒的品质起着至关重要的作用。葡萄中的花色苷主要存在于红色葡萄的果皮中,其加工的食品因其特有的强烈色彩(主要是红色、蓝色和紫色的贡献)和相关的健康益处而成为人们备受青睐的色素化合物[1-3]。然而,由于它们有着缺电子的黄烊阳离子这种独特的化学结构导致该分子高度不稳定,容易发生降解使得颜色损失。此外,花色苷还受到外界一些因素(pH,温度,光,亚硫酸盐等)、花青素-3-O-葡萄糖苷结构、其他酚类化合物、加工和储存条件等的影响[4-5]。花色苷在水溶液中颜色的显示强烈依赖于溶液的pH值,随着pH值的改变,花色苷以不同的结构形式在溶液中动态转换。在pH<2时,红色黄烊阳离子占主导地位,随着pH值的增加,其他花色苷型式在平衡状态下转化形成(半缩酮,查耳酮和醌型碱)[6]。若依据其在pH中的转化机制,花色苷在弱酸性水醇溶液中主要以无色水合半缩酮形式存在,呈现略带颜色或几乎无色的状态。然而,在红葡萄酒中(pH 3.2~4.0),花色苷即使在弱酸性pH下也能表现出强烈的红色、蓝色或紫色。这说明葡萄酒溶液中存在一些稳定机制能够赋予葡萄酒理论之外的颜色特性,这些机制被描述为辅色作用(copigmentation),是植物和食品中的主要颜色稳定机制[7]。
辅色作用是花色苷的平面可极化核与辅色素(无色或具有富电子π-系统的酚类化合物)之间通过范德华力相互作用形成花色苷-辅色素复合物,该复合物采用夹心状结构将花色苷保护在中间,可稳定黄烊阳离子发色团,并部分保护其免受水分子的亲核攻击、减少无色半缩酮和查耳酮型式的形成,从而防止颜色损失[6]。辅助呈色作用主要包括分子内辅色作用、分子间辅色作用、自聚合和金属络合作用。红葡萄酒中主要以分子间辅色作用和分子内辅色作用为主。分子间辅助呈色作用指的是辅色素与花色苷之间以非共价键和氢键结合,形成垂直层叠或水平的复合产物。分子内辅色作用是中心花色苷发色团和其糖基部分共价连接的芳香酰基残基分子通过糖基的折叠共平面相互作用,保护花色苷发色团免受水分子的亲核侵袭[7-8]。辅色作用通常伴随着增色效应(其中吸光值Amax的增加)或/和红移效应(其中发生在吸收光谱的最大吸收波长λmax的偏移),同时也有文献报道添加辅色素可以延长花色苷半衰期[3,7,9]。研究证实在李子汁模拟溶液中探讨了花色苷和芦丁的辅色能力,结果显示芦丁能够提高颜色的稳定性[10]。HAN等[11]研究了花色苷结构在醇水溶液中的自缔合作用对颜色的影响。目前为止,二甲花翠素-3-O-葡萄糖苷与其他辅因子(阿魏酸,儿茶素,表儿茶素,槲皮素,原花青素,咖啡酸等)在模拟溶液中的辅色作用多有报道[12-15],但其他几种基本花色苷的辅色能力很少或未见报道[11,16-17],这使得很难评估各个基本花色苷对葡萄酒的贡献,也很难将结果外推到红葡萄酒中。羟基苯甲酸的特征在于它们的C6-C1结构,它们是葡萄和葡萄酒中最具代表性的酚酸类之一[15,18],而原儿茶酸是葡萄籽中含量较为丰富的苯甲酸类化合物[19]。因此,了解原儿茶酸作为不同花色苷辅因子的能力也是非常重要的。
为了明确不同结构花色苷和不同辅色素浓度改善干红葡萄酒颜色和稳定其色泽的机制,本实验在模拟葡萄酒中评估了不同辅色素浓度和颜色演变的关系,探讨了花色苷B环含有不同取代基种类和数量的5种基本花色苷的辅色能力以及对颜色演变的影响,有助于我们明晰干红葡萄酒颜色与辅色素浓度以及花色苷结构之间的关系,探明不同摩尔比下不同花色苷结构的作用效果,以便为后续研究提供关于花色苷结构和颜色之间关系的理论基础。
1 材料与方法
1.1 试剂与仪器
二甲花翠素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷、辅色素原儿茶酸(纯度均≥98%):购自美国Sigma公司;无水乙醇(色谱纯)、NaCl、酒石酸(分析纯):购自上海源叶生物科技有限公司。
TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;KO-500E型超声波清洗机,昆山市超声仪器有限公司;JXMIN-80生物指示器,衢州新芝生物科技有限公司;旋涡混合振荡器,南京东迈科技仪器有限公司。
1.2 方法
1.2.1 模拟酒溶液的配制
模拟溶液配制方法参照ZHANG等[20],称取酒石酸5 g于烧杯中充分溶解并定容到1 L的容量瓶中配得12%vol的模拟酒溶液,用NaCl调节模拟酒的离子强度为0.2 mol/L,并用强酸强碱将模拟酒溶液的pH值调至3.6,置于棕色带盖试剂瓶中保存。
1.2.2 不同种类花色苷对颜色的影响
称取适量的5种基本花色苷粉末,用pH 3.6含5 g/L酒石酸、12%(体积分数)乙醇水的模拟酒溶解。BOULTON[21]和CAVALCANTI等[22]认为中花色苷相对浓度达到1 mmol/L时会发生自缔合作用。为了避免自缔合发生,使用各花色苷浓度3.0×10-4 mol/L[23]。用同样的方法来溶解辅色素原儿茶酸,随后将5种基本花色苷分别同原儿茶酸等体积混合,配成色素/辅色素的摩尔比为1∶40的辅色溶液于2 mL离心管中,将离心管置于生物指示器中并调节温度20 ℃避光反应30 min后测定,以蒸馏水作为对照。
1.3 色素/辅色素摩尔比对辅色溶液颜色的影响
不同摩尔比溶液的配制:用pH 3.6含5 g/L酒石酸、12%(体积分数)乙醇水的模拟酒溶解,同样的方法来溶解花色苷和原儿茶酸,配成色素/辅色素摩尔比分别为1∶0、1∶1、1∶10、1∶20及1∶40的辅色溶液。将混合液置于2 mL离心管,在生物指示器中20 ℃下避光反应30 min后测定,以蒸馏水作为对照。
1.4 辅色效应的测定
通过比较520 nm下吸光值增加的百分比M以及最大吸收波长λmax(最大吸光值对应的波长)的偏移Δλ估计由于辅色作用产生的增色效应和红移效应。其中A0为未添加辅色素的花色苷溶液在520 nm处的吸光值,A为添加了辅色素后辅色溶液在520 nm处的吸光值[24];λ为偏移后的最大吸收波长,计算如公式(1)、(2):
(1)
Δλ=λ-λmax
(2)
1.5 CIELab颜色评估
使用TU-1810 UV-可见分光光度计,以蒸馏水作为对照,在2 mm路径比色皿中扫描400~700 nm的吸收光谱,扫描间隔为1 nm。在D65和10°的观察条件下,计算CIELab颜色参数:L亮度(从0到100表示着黑色到白色的变化),a(从负到正表示从绿色到红色),b(从负到正表示从蓝色到黄色),C色度(表示整体的颜色强度)以及h色调;并根据空间两点之间的欧几里得距离计算样品之间的颜色差异ΔE,ΔE>3表示产生了人眼可以辨别的颜色变化;此外,还计算了亮度,色度和色调对总色差的相对贡献ΔL、ΔC、ΔH[22],如公式(3)、(4)、(5)、(6)和(7):
(3)
(4)
(5)
(6)
(7)
1.6 数据统计分析
采用Microsoft Office Excel 2013进行数据处理,Origin 9.0画图,SPSS 22.0对数据进行单因素方差分析,利用Duncan’s多重比较在置信区间0.05下对数据进行差异显著性分析。
2 结果与分析
2.1 不同结构花色苷辅色作用的结果
2.1.1 不同结构花色苷产生的增色效应和红移效应
基本花色苷是欧亚种葡萄和葡萄酒中都含有的花色苷,也是合成其他花色苷的基础物质[25]。从化学结构上来看,花色苷基本苷元(表1)结构是C6-C3-C6碳架结构的类黄酮类化合物。葡萄酒中5种基本花色苷其差异主要是B环R1和R2位取代基团的种类和数量不同(表1)。通常花色素在3位连接糖分子形成基本花色苷后其糖分子又会和一些物质(常见的主要是一些酚类化合物)酰化形成更加稳定的酰化花色苷[8]。自然界中已经发现的花色素有23种,花色苷大约1 000种;但在葡萄酒中,基本花色苷是赋予新鲜葡萄酒色泽的主要部分[26-27]。BOULTON[28]在文献中报道在新葡萄酒中,花色苷的颜色占了颜色值的50%~70%;HAN等分析数据表明花色苷提供了新鲜葡萄酒红色色泽的64.56%~81.57%(CIELab,a值)[29]。
由表1和图1可以看出,花色苷B环上R1、R2位不同取代基的种类和数量对辅色效果有着不同的影响。二甲花翠素-3-O-葡萄糖苷(OCH3 OCH3)与甲基花青素-3-O-葡萄糖苷(OCH3 H)相比,二甲花翠素-3-O-葡萄糖苷B环R2位置多了一个甲氧基取代基,对应的增色效应二甲花翠素-3-O-葡萄糖苷和甲基花青素-3-O-葡萄糖苷的M值分别为23.4%、18.3%,前者比后者的增色效应高了28%;红移效应(Δλ)二者分别为3、2 nm;说明花色苷B环上R2位甲氧基取代更有利于辅色作用的进行,导致更高的辅色效果。花翠素-3-O-葡萄糖苷(OH OH)相对于花青素-3-O-葡萄糖苷(OH H)而言,R2位被羟基取代,M分别为16.9%、11.1%,相同的现象从甲基花翠素-3-O-葡萄糖苷(OCH3 OH)、甲基花青素-3-O-葡萄糖苷(OCH3 H)中也可以看到,2种花色苷R2位也含有不同的羟基,其M分别为23.3%、18.3%;可以看出B环上羟基的取代对辅色作用也有着积极的影响。此外,同一位置不同取代基下,被甲氧基取代的花色苷的辅色作用优于被羟基取代的作用,比如甲基花翠素-3-O-葡萄糖苷(OCH3 OH)、花翠素-3-O-葡萄糖苷(OH OH)B环上R1位置分别被甲氧基和羟基取代,其被甲氧基取代的甲基花翠素-3-O-葡萄糖苷产生的增色效应比被羟基取代的花翠素-3-O-葡萄糖苷高出了38%;R1被甲氧基取代甲基花青素-3-O-葡萄糖苷(OCH3H)比R1被羟基取代的花青素-3-O-葡萄糖苷(OH H)的增色效应高出了65%。二甲花翠素-3-O-葡萄糖苷(OCH3 OCH3)、甲基花翠素-3-O-葡萄糖苷(OCH3 OH)、花翠素-3-O-葡萄糖苷(OH OH)、花青素-3-O-葡萄糖苷(OH H)B环上取代基取代数目不同辅色能力也不同,M分别为23.4%、23.3%、16.9%、11.1%;可以看出花色苷B环上取代基数目越多辅色效果越好。结果表明,花色苷B环上甲氧基以及羟基的取代对辅色作用都有着积极的影响,且随着取代基数目的增加辅色能力也越强;同一位置不同取代基下被甲氧基取代的花色苷的辅色作用优于被羟基取代的作用。
表1 葡萄酒5种基本花色苷结构
Table 1 Structure of five basic anthocyanins in wine

基本结构花色苷R1R2Mv-3-O-GluOCH3OCH3Pt-3-O-GluOCH3OHPn-3-O-GluOCH3HDp-3-O-GluOHOHCy-3-O-GluOHH
注:Mv-3-O-Glu-二甲花翠素-3-O-葡萄糖苷;Pt-3-O-Glu-甲基花翠素-3-O-葡萄糖苷;Pn-3-O-Glu-甲基花青素-3-O-葡萄糖苷;Dp-3-O-Glu-花翠素-3-O-葡萄糖苷;Cy-3-O-Glu-花青素-3-O-葡萄糖苷。下同。
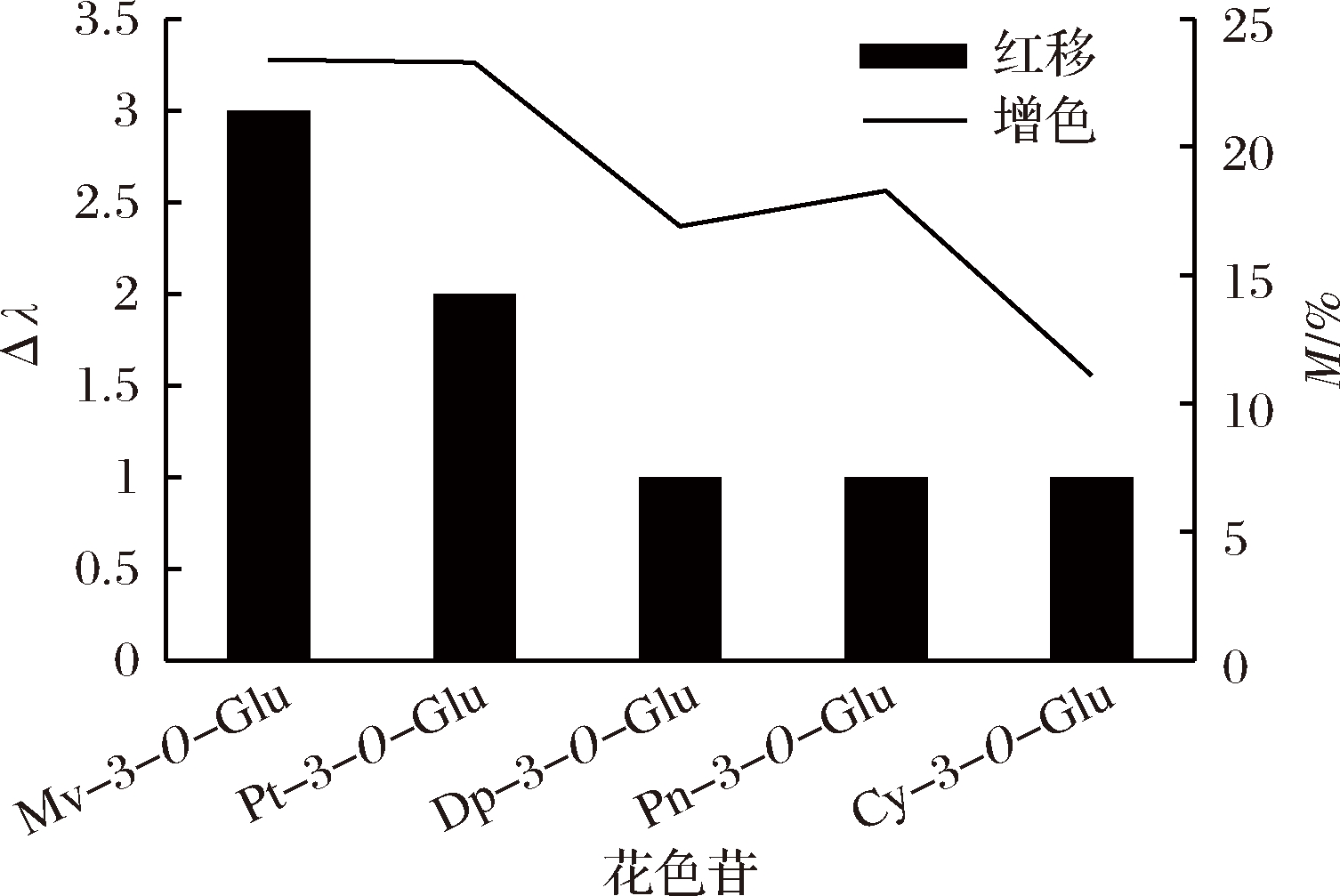
图1 不同花色苷与原儿茶酸的辅色效应
Fig.1 The copigmentation of different anthocyanins and protocatechuic acid
2.1.2 不同结构花色苷对颜色的影响
2.1.2.1 不同结构花色苷CIELab参数评估
对于不同结构花色苷,在未添加辅色素(1∶0)的情况下,几种基本花色苷自身的颜色特性也不一样,这主要由它们在520 nm下对应的吸光值A520和最大吸光值下吸收波长λmax不同。二甲花翠素-3-O-葡萄糖苷(A520=0.124,λmax=523)、甲基花翠素-3-O-葡萄糖苷(A520=0.090,λmax=524)、花翠素-3-O-葡萄糖苷(A520=0.083,λmax=524)、甲基花青素-3-O-葡萄糖苷(A520=0.060,λmax=517),花青素-3-O-葡萄糖苷(A520=0.190,λmax=515);说明花色苷B环中不同取代基的种类以及不同位置的取代都对花色苷自身颜色有着本质的影响。王宏也报道了花翠素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷和二甲花翠素-3-O-葡萄糖苷呈蓝红色,甲基花青素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷呈深橙红色[30]。所以,为了消除花色苷自身颜色的影响,计算了添加辅色素和未添加辅色素的辅色溶液之间的颜色参数差值Δa、ΔC、ΔL、Δb、Δh,来评估辅色作用引起的颜色演变。通过计算发现,不同结构花色苷发生辅色作用后引起的各辅色溶液CIELab颜色参数的变化存在差异(表2)。二甲花翠素-3-O-葡萄糖苷(OCH3 OCH3)、甲基花翠素-3-O-葡萄糖苷(OCH3 OH)、花翠素-3-O-葡萄糖苷(OH OH)这3种花色苷B环中的甲氧基取代数目不同,颜色参数也不同,且随着甲氧基取代数目的增加颜色参数的差异也越显著。由表2可以看出,含有2个甲氧基的二甲花翠素-3-O-葡萄糖苷具有最大的红色值、色饱和度、最高的蓝色值和最低的亮度、色调值,其次是含有1个甲氧基的甲基花翠素-3-O-葡萄糖苷,变化最小的为不含甲氧基的花翠素-3-O-葡萄糖苷。同时也可以看出,二甲花翠素-3-O-葡萄糖苷和花翠素-3-O-葡萄糖苷两者之间只有Δb和Δh没有发现显著性差异,其他的颜色参数之间均存在着显著性差异。这些结果表明,B环上的甲氧基取代越多越有助于更深的颜色(ΔL值的负向增加),更高的红色(Δa值增加),更饱和的色度(ΔC值增加),更浅的黄色和更深的蓝色(Δb和Δh值降低)。这与一些学者报道的辅色素中甲氧基化影响相同,FANZONE等认为简单肉桂酸的甲氧基化反应增加了含单糖苷花色苷增色效应和花色素苷衍生物的形成[31-32];也有学者报道甲氧基化羟基苯甲酸都显示出对颜色增强的更高贡献[33]。同甲氧基对颜色贡献一样,花色苷B环中的羟基也会提高辅色溶液的颜色,由表2可知,被2个羟基取代的花翠素-3-O-葡萄糖苷(OH OH)比被1个羟基取代的花青素-3-O-葡萄糖苷(OH H)拥有更低的的亮度,更高的红色、更高的色饱和度和更浅的黄色及更深的蓝色。这主要是由于辅色作用是通过花色苷和辅色素之间的π-π相互作用形成,π-π相互作用下的色散相互作用力的增强(较高的辅色极化率)有利于π-π堆积和随后非共价复合物形成,同时B环上额外的羟基进一步通过氢键增强了辅色效果;也有文献报道B环上的羟基取代导致花色苷中连接B环和C环C=C键的共振增加从而增加了颜色强度[17,34]。本研究中还发现,同一位置不同取代基对颜色的影响也不同,从本实验中可以看出,同一位置甲氧基取代对颜色的影响优于羟基的取代作用,表2中甲基花青素-3-O-葡萄糖苷(OCH3 H)、花青素-3-O-葡萄糖苷(OH H)R1位分别被甲氧基和羟基取代,但甲基花青素-3-O-葡萄糖苷相比于花青素-3-O-葡萄糖苷ΔL更低、颜色更深;Δa、ΔC更高,即红色和颜色强度更强;Δb、Δh更低,说明前者较低的黄色值和较高的蓝色值。
表2 五种葡萄酒基本花色苷对颜色演变的影响
Table 2 Influence of five basic anthocyanins in wine on color evolution

颜色参数单体花色苷Mv-3-O-GluPt-3-O-GluDp-3-O-GluPn-3-O-GluCy-3-O-GluΔL-4.23a-3.54a-2.35b-2.03b-1.55bΔa6.52d5.92c4.55b4.57b2.93aΔb-0.50a-0.34a-0.10a0.18a1.60bΔC6.52d5.93c4.55b4.57b3.19aΔh-0.58a0.32ab0.41ab0.10ab1.00bΔE7.78d6.91c5.13b5.00b3.68a
注:同列不同字母表示差异显著(P<0.05);样本量n=3。下同。
为了评估不同结构的花色苷引起的颜色参数的改变是否引起视觉上可察觉的变化,计算了色差值ΔE。可以看到所有花色苷均造成了人肉眼可察觉的颜色变化(ΔE>3),发现除了花翠素-3-O-葡萄糖苷和甲基花青素-3-O-葡萄糖苷两者之间色差不存在显著性差异,其他几种不同结构的花色苷之间均存在着显著性差异;二甲花翠素-3-O-葡萄糖苷(OCH3 OCH3)造成了最大的颜色差异(ΔE=7.78),分别是甲基花翠素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷的1.1、1.5、1.6、2.1倍。然后依次为甲基花翠素-3-O-葡萄糖苷(OCH3 OH)(ΔE=6.91)、花翠素-3-O-葡萄糖苷(OH OH)(ΔE=5.13)、甲基花青素-3-O-葡萄糖苷(OCH3 H)(ΔE=5.00)、花青素-3-O-葡萄糖苷(OH H)(ΔE=3.68)。由此可知,不管是甲氧基取代还是羟基取代均表明,超出酚环π-共轭体系的任何延伸对辅色溶液的色泽都有积极的影响,虽然不同取代基团影响效果不同。
2.1.2.2 不同结构花色苷颜色参数对总色差的贡献
由图2可知,不同结构花色苷颜色参数对总色差的贡献主要定量贡献(ΔL+ΔC)为二甲花翠素-3-O-葡萄糖苷(99.7%)、甲基花翠素-3-O-葡萄糖苷(99.9%)、花翠素-3-O-葡萄糖苷(99.7%)、甲基花青素-3-O-葡萄糖苷(99.9%)、花青素-3-O-葡萄糖苷(92.7%)。这说明不同花色苷引起总色差改变的主要机制是量变造成的。这与GORDILLO等[35]报道的辅色作用引起的绝对色差主要是由于定量变化(ΔL+ΔC= 87.5%)引起的结果一致。
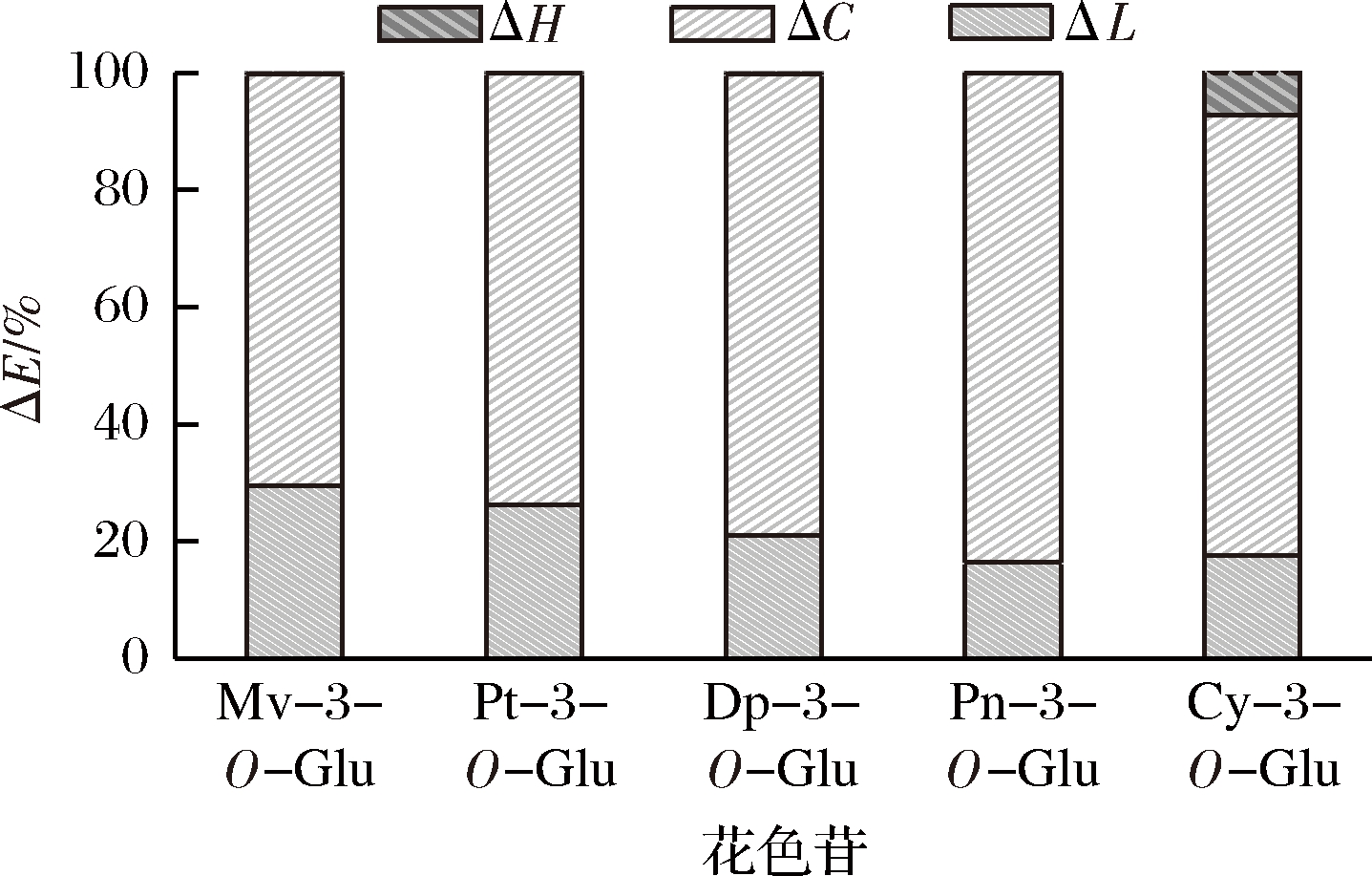
图2 不同种类花色苷颜色参数对总色差的贡献
Fig.2 Contribution of different types of anthocyanin color parameters to total color difference
2.2 不同色素/辅色素摩尔比下辅色作用的结果
2.2.1 不同摩尔比的增色效应和红移效应
不同辅色素浓度下5种基本花色苷辅色效应如图3和图4所示。
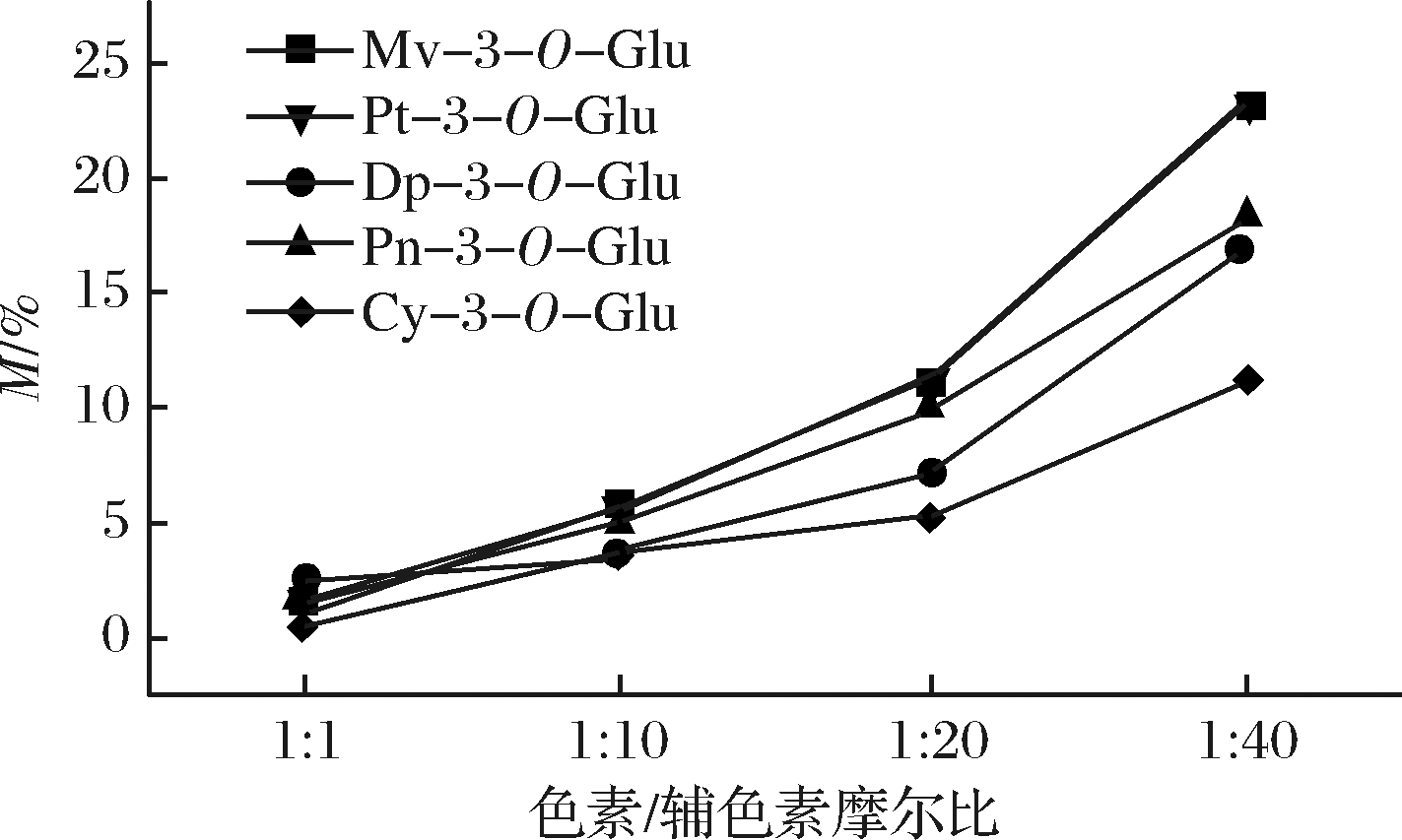
图3 不同辅色素浓度的增色效应
Fig.3 The hyperchromic effects at different copigment concentration
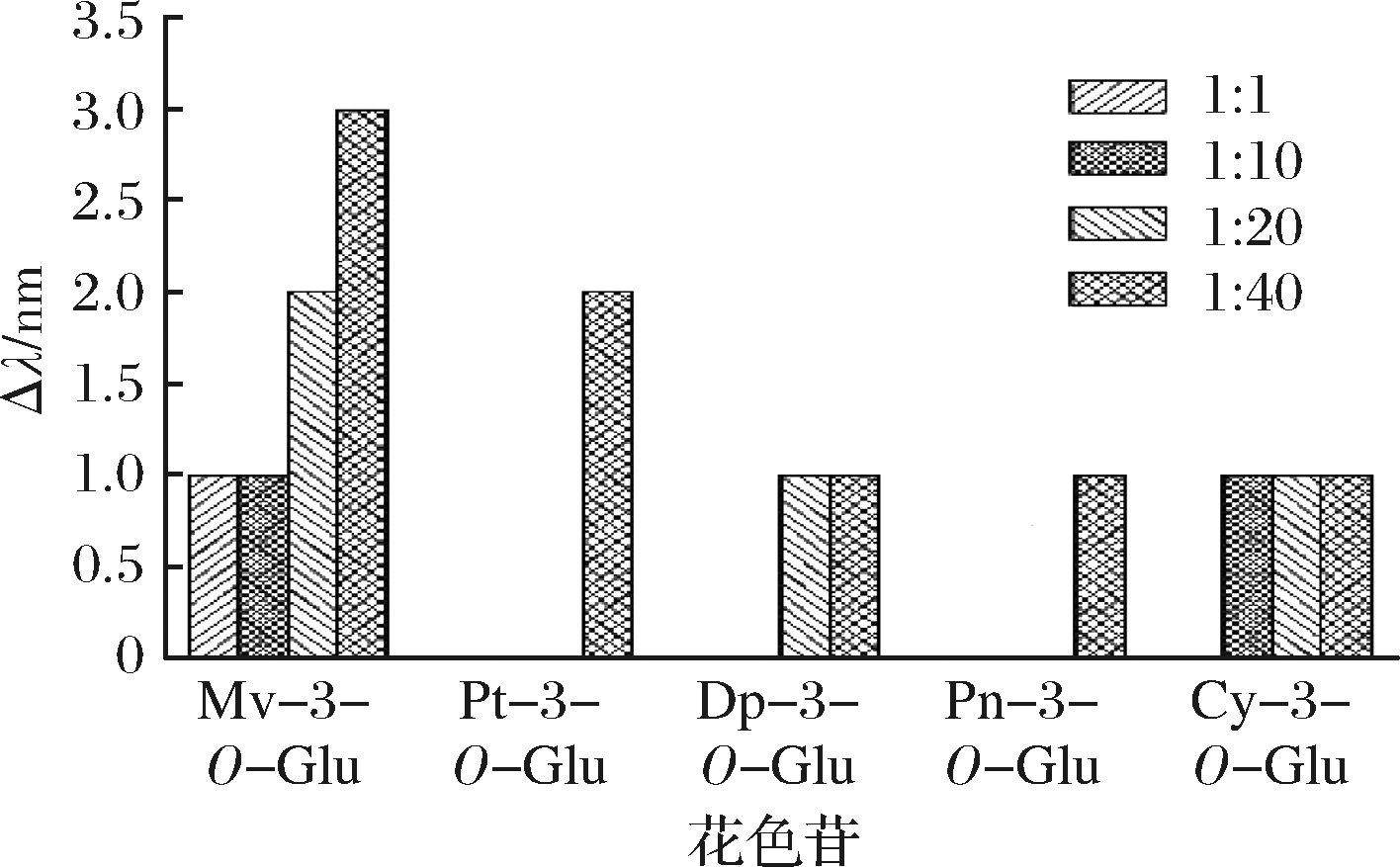
图4 不同辅色素浓度的红移效应
Fig.4 The bathochromic effects at different copigment concentration
由图3可知,所有花色苷添加辅色素原儿茶酸后,随着辅色素浓度的增加辅色溶液的增色效应M也增大,且在最高摩尔比时达到了最大。本实验中,未添加辅色素的花色苷溶液在520 nm处具有最低的吸光值,当色素/辅色素摩尔比从1∶1增加到1∶40时,A520也随之增加,分别为二甲花翠素-3-O-葡萄糖苷(0.124~0.153),甲基花翠素-3-O-葡萄糖苷(0.090~0.111),花翠素-3-O-葡萄糖苷(0.083~0.097),甲基花青素-3-O-葡萄糖苷(0.060~0.071),花青素-3-O-葡萄糖苷(0.190~0.211);这种随着辅色素浓度的增加吸光值增加的现象说明较高的辅色素浓度产生了更强烈的辅色作用。这主要是由于辅色素与花色苷发生了分子间辅色作用防止了水分子的亲核反应,分子间通过π-π堆积形成新的色素复合物使得吸光值发生改变。这与他人研究的色素对颜色的贡献取决于色素和辅色素的相对浓度对有相同结果[25,35]。有图4可知原儿茶酸的添加引起的红移变化较小,在较低摩尔比(1∶1)时发现只有二甲花翠素-3-O-葡萄糖苷产生了较小的红移现象,其他几种花色苷均未产生红移现象;随着摩尔比的增加,从1∶0到1∶40二甲花翠素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷分别仅增加了3、2、1、1、1 nm,且甲基花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷和花青素-3-O-葡萄糖苷仅在最高摩尔比时出现了红移现象。在这种情况下,观察到较小红移现象的原因可能是辅色过程中花色苷无色半缩酮形式部分转换回红色黄烊阳离子,导致水合平衡的改变高于花色苷黄烊阳离子的去质子化[31,36];也可能由于原儿茶酸属于羟基苯甲酸,其自身的非共轭空间构象引起的红移效应较小,ZHANG等[37]基于模拟解决方案中的理论计算和实验数据的基础上证明了具有延伸π-共轭体系的平面结构分子羟基肉桂酸的辅色性能普遍优于羟基苯甲酸。
2.2.2 不同摩尔比对颜色的影响
2.2.2.1 不同摩尔比下CIELab参数评估
为了评估不同摩尔比下辅色溶液颜色的改变,计算了添加辅色素和不添加辅色素之间的CIELAB颜色参数差异,如表3所示。由表3可知,向花色苷中添加原儿茶酸导致辅色溶液与未添加辅色素溶液之间的ΔL、Δa、ΔC均存在显著性差异,且随着辅色素浓度的增加差异越显著。当色素/辅色素摩尔比由1∶1增加到1∶40时,二甲花翠素-3-O-葡萄糖苷ΔL从-0.53到-4.23,甲基花翠素-3-O-葡萄糖苷从-0.09到-3.54,花翠素-3-O-葡萄糖苷从-0.59到-2.35,甲基花青素-3-O-葡萄糖苷从-0.37到-2.03,花青素-3-O-葡萄糖苷从-0.53到-1.55;ΔL的负向增大说明辅色素的添加导致溶液亮度更低、颜色更深,辅色素添加量越高这种效果越明显。与ΔL变化相反,Δa和ΔC随着辅色素浓度的增加正向增大且各摩尔比之间也均存在着显著性差异,其中Δa的增加说明辅色素的添加使得溶液的红色更强、而更高的ΔC说明溶液颜色的饱和度更好。因此,辅色作用与花色苷溶液的变暗、更强烈的颜色和视觉饱和度相关,表明辅色素的添加诱导了更高的整体颜色强度,这些变化随着辅色素浓度的增加更加显著,与GONZ LEZMA-NZANO等[24]、GORDILLO等[35]使用其他辅助因子的研究结果一致。不同的是,二甲花翠素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷摩尔比从1∶1到1∶40时颜色参数Δb、Δh降低,说明辅色溶液的颜色向蓝紫色转变;相反,甲基花青素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷的辅色溶液中观察到辅色素浓度的增加诱导溶液颜色向红橙色转变(Δb、Δh升高)。为了评估辅色素浓度增加引起的颜色参数改变是否引起视觉上可察觉的变化,计算色差值ΔE。GARC
LEZMA-NZANO等[24]、GORDILLO等[35]使用其他辅助因子的研究结果一致。不同的是,二甲花翠素-3-O-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷摩尔比从1∶1到1∶40时颜色参数Δb、Δh降低,说明辅色溶液的颜色向蓝紫色转变;相反,甲基花青素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷的辅色溶液中观察到辅色素浓度的增加诱导溶液颜色向红橙色转变(Δb、Δh升高)。为了评估辅色素浓度增加引起的颜色参数改变是否引起视觉上可察觉的变化,计算色差值ΔE。GARC A-AROMP等[38]认为当ΔE>3时,人眼就能够区分2种颜色的差异。由表3可以看出,辅色素的添加使得各摩尔比下ΔE均表现出了显著性差异,但在1∶1和1∶10 摩尔比下所有花色苷辅色溶液均未产生人眼能察觉的色差变化(ΔE<3),随着摩尔比的增加,在摩尔比1∶20时二甲花翠素-3-O-葡萄糖苷,甲基花翠素-3-O-葡萄糖苷产生视觉可觉察的颜色演变(ΔE分别为3.99、3.48),在1∶40时所有花色苷溶液均表现出了人肉眼可辨别的颜色变化(ΔE>3)[33]。这主要是因为随着辅色素浓度的增加,诱导了辅色素与黄烊阳离子的优先结合,花色苷水合平衡向着有色形式转移[6]。
A-AROMP等[38]认为当ΔE>3时,人眼就能够区分2种颜色的差异。由表3可以看出,辅色素的添加使得各摩尔比下ΔE均表现出了显著性差异,但在1∶1和1∶10 摩尔比下所有花色苷辅色溶液均未产生人眼能察觉的色差变化(ΔE<3),随着摩尔比的增加,在摩尔比1∶20时二甲花翠素-3-O-葡萄糖苷,甲基花翠素-3-O-葡萄糖苷产生视觉可觉察的颜色演变(ΔE分别为3.99、3.48),在1∶40时所有花色苷溶液均表现出了人肉眼可辨别的颜色变化(ΔE>3)[33]。这主要是因为随着辅色素浓度的增加,诱导了辅色素与黄烊阳离子的优先结合,花色苷水合平衡向着有色形式转移[6]。
表3 不同辅色素浓度下5种基本花色苷颜色参数评估
Table 3 Evaluation of color parameters of 5 basic anthocyanins at different copigment concentration
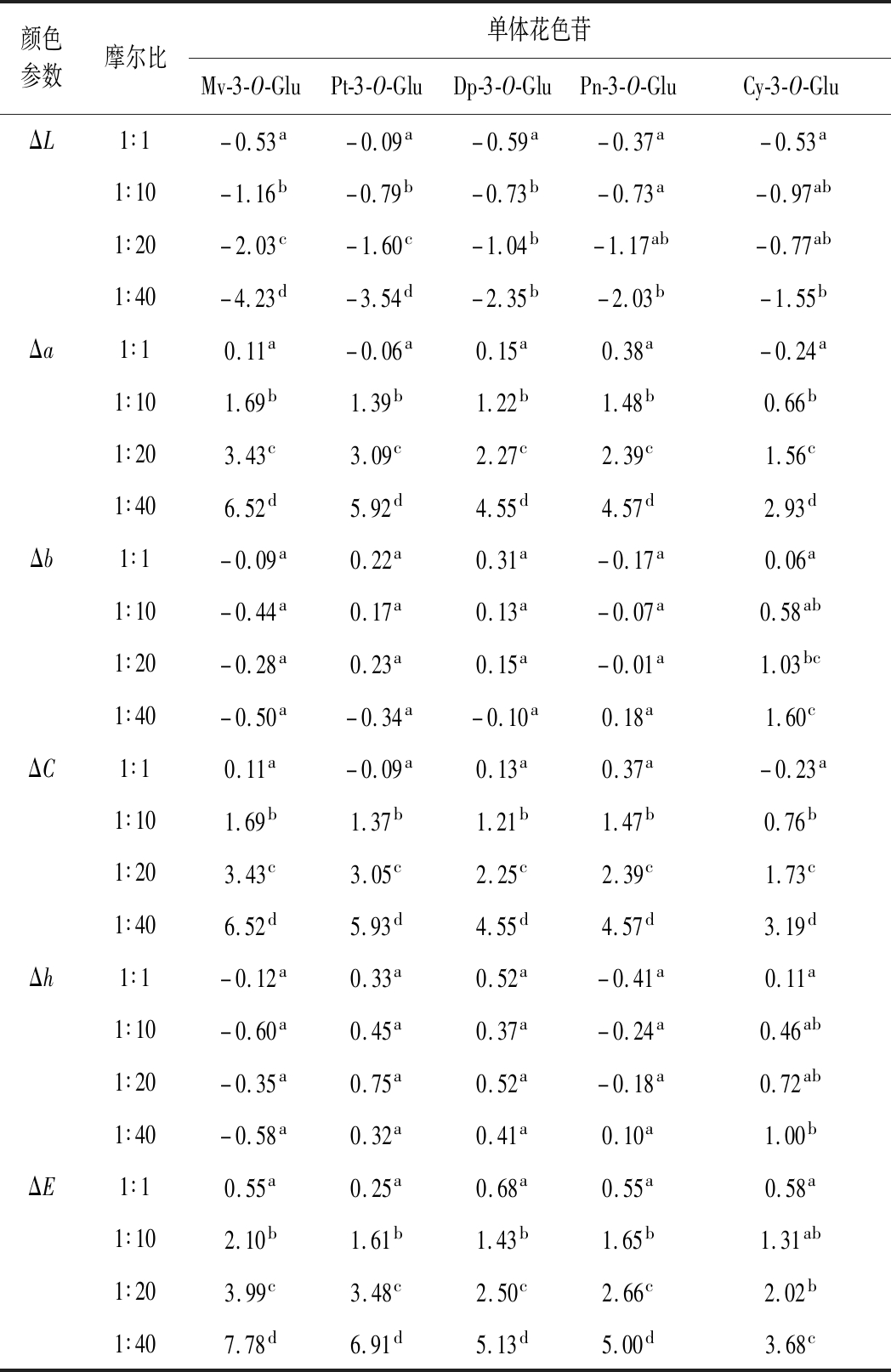
颜色参数摩尔比单体花色苷Mv-3-O-GluPt-3-O-GluDp-3-O-GluPn-3-O-GluCy-3-O-GluΔL1∶1-0.53a-0.09a-0.59a-0.37a-0.53a1∶10-1.16b-0.79b-0.73b-0.73a-0.97ab1∶20-2.03c-1.60c-1.04b-1.17ab-0.77ab1∶40-4.23d-3.54d-2.35b-2.03b-1.55bΔa1∶10.11a-0.06a0.15a0.38a-0.24a1∶101.69b1.39b1.22b1.48b0.66b1∶203.43c3.09c2.27c2.39c1.56c1∶406.52d5.92d4.55d4.57d2.93dΔb1∶1-0.09a0.22a0.31a-0.17a0.06a1∶10-0.44a0.17a0.13a-0.07a0.58ab1∶20-0.28a0.23a0.15a-0.01a1.03bc1∶40-0.50a-0.34a-0.10a0.18a1.60cΔC1∶10.11a-0.09a0.13a0.37a-0.23a1∶101.69b1.37b1.21b1.47b0.76b1∶203.43c3.05c2.25c2.39c1.73c1∶406.52d5.93d4.55d4.57d3.19dΔh1∶1-0.12a0.33a0.52a-0.41a0.11a1∶10-0.60a0.45a0.37a-0.24a0.46ab1∶20-0.35a0.75a0.52a-0.18a0.72ab1∶40-0.58a0.32a0.41a0.10a1.00bΔE1∶10.55a0.25a0.68a0.55a0.58a1∶102.10b1.61b1.43b1.65b1.31ab1∶203.99c3.48c2.50c2.66c2.02b1∶407.78d6.91d5.13d5.00d3.68c
2.2.2.2 不同摩尔比下颜色参数对总色差的贡献
比较了5种基本花色苷在各摩尔比下获得的亮度,色度和色调对总色差的相对贡献(ΔL、ΔC、ΔH)。由图5可知,模拟酒中不同花色苷不同摩尔比下,对总色差的贡献主要也是定量变化(ΔL+ΔC>80%),其中仅有较小部分是由于定性变化引起的(ΔH<20%)。同时也可得知,在较低的摩尔比下定量变化中主要贡献是亮度引起的(ΔL>ΔC),随着辅色素浓度增加定量贡献模式发生演变使得色度的贡献>亮度的贡献(ΔL<ΔC)。在给定的摩尔比下,受到花色苷结构不同的影响,色调(ΔH)贡献的大小通常具有可变性,没有明显的趋势。
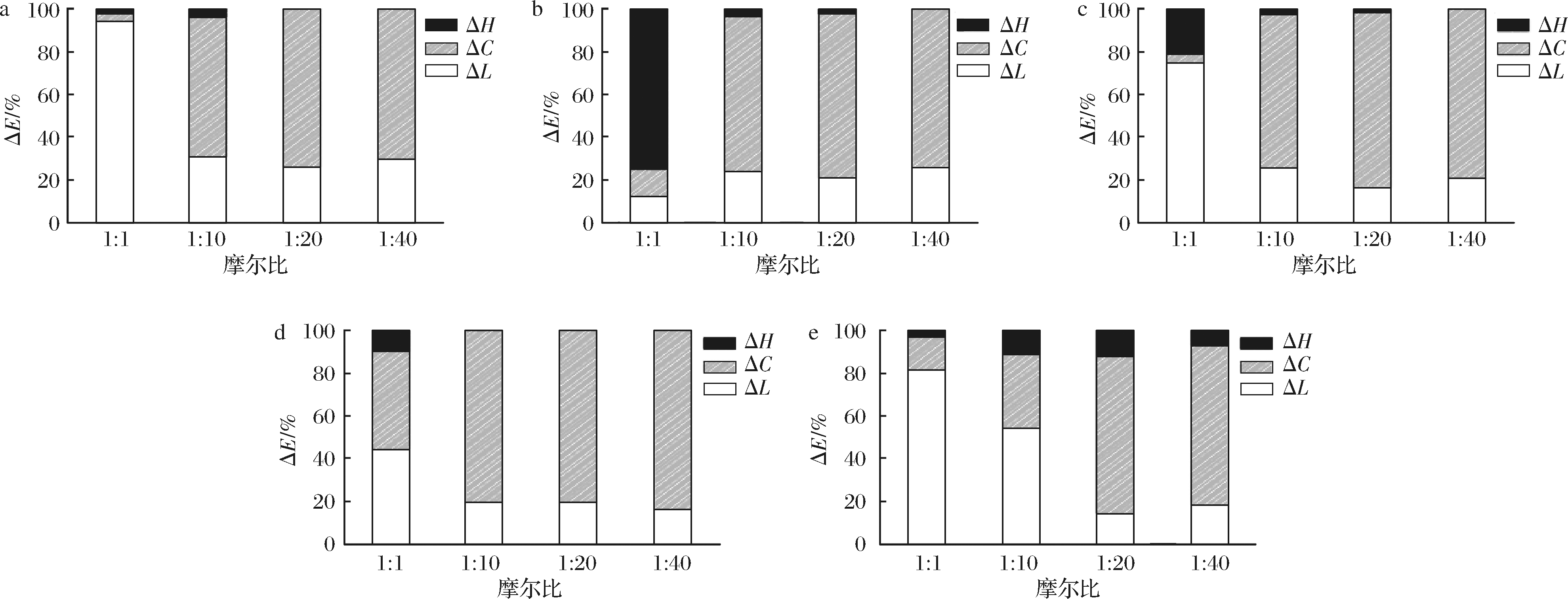
a-Mv-3-O-Glu;b-Pt-3-O-Glu;c-Dp-3-O-Glu;d-Pn-3-O-Glu;f-Cy-3-O-Glu
图5 不同辅色素浓度下颜色参数对总色差的贡献
Fig.5 Contribution of color parameters to total color difference at different copiment concentration
2.3 不同摩尔比下5种花色苷与原儿茶酸对颜色演变的热图分析
将5种花色苷与原儿茶酸在不同摩尔比下对颜色的影响进行分析,结果如图6所示。
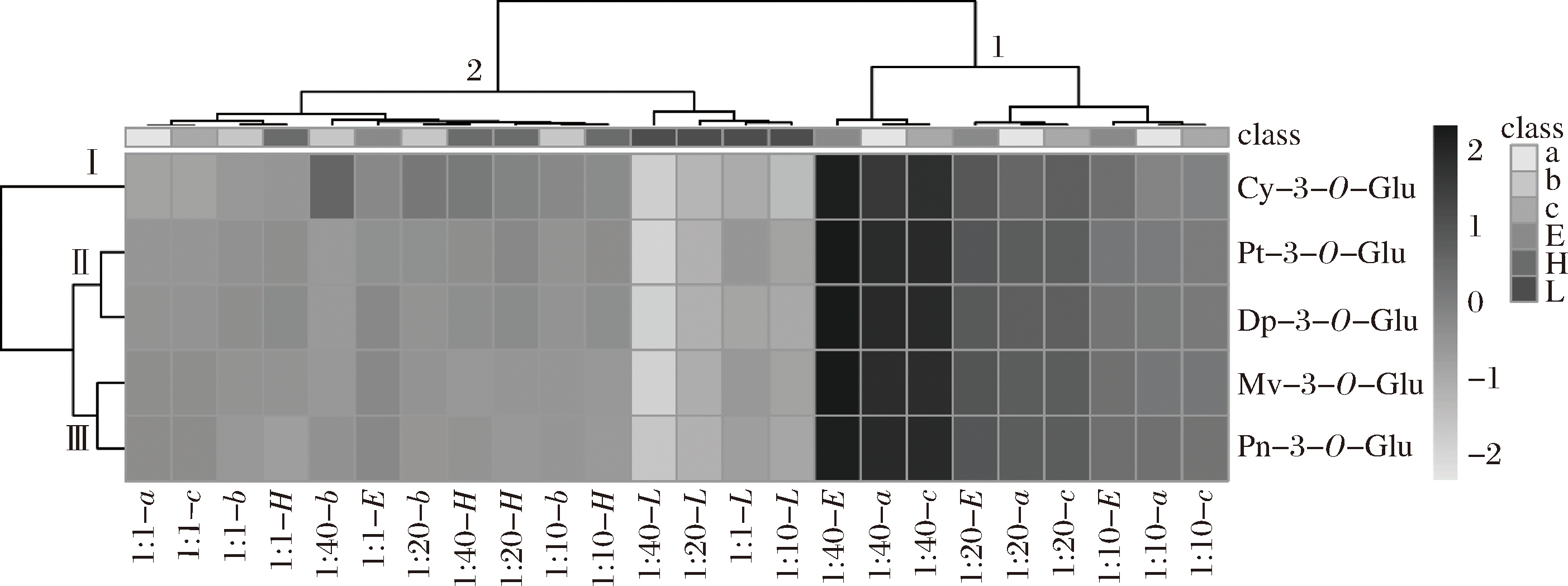
图6 不同摩尔比下5种花色苷与原儿茶酸对颜色演变影响的热图分析
Fig.6 Heat map analysis of the effects of five anthocyanins and protocatechuic acid on color evolution at different molar ratios
注:L=ΔL值; a= Δa值; b=Δb值; c= ΔC值; H= Δh值; E=ΔE值。
按照横向聚类分析,可以分为2类,ΔE、Δa、ΔC这几个颜色参数可以聚为第一类,主要呈现出较深的黑灰色色带,几个颜色参数与颜色的演变成正向关系;随着辅色素浓度的增加色带颜色也加深,在摩尔比1∶40时,ΔE、Δa、ΔC展现出最深的色带,说明辅色素浓度越高花色苷溶液的颜色整体强度越好。第二类是Δb、Δh、ΔL,这一类的色带主要以灰白为主,从图中可以看出颜色参数与颜色的变化成负向相关,ΔL在1∶40色带最浅。色带越浅说明ΔL值越小,花色苷溶液颜色越暗。
按照纵向聚类分析,可以将5种花色苷分为3类,第1类中包含1个花色苷,即Cy-3-O-Glu,该花色苷有着较低的Δa、ΔC值,是几种花色苷中辅色效应最小的。第2类包含Dp-3-O-Glu和Pt-3-O-Glu,这2种花色苷的Δa、ΔC值较高,其Δb值呈现负相关,表现出蓝色值。第3类包含Mv-3-O-Glu和Pn-3-O-Glu,这2种花色苷颜色参数的色带渐变趋势最为相似。
综合来看,使用CIELAB色度空间分析结合热图分析,可以更直观和形象地表征辅色溶液的颜色特征,为相关颜色特征研究提供基础的分析方法。
3 结论
在本研究中,辅色溶液的颜色受到色素与辅色素的摩尔比和花色苷B环中取代基的种类和数量的影响。研究结果表明,花色苷B环上甲氧基和羟基取代使得花色苷酚环π-共轭体系额外延伸对辅色溶液的色泽有着积极的影响;甲氧基和羟基取代数目越多越有助于更暗的颜色、更高的红色、更饱和以及更亮的色度,且R1位置被甲氧基取代的辅色效果优于羟基取代效果。辅色素浓度的增加导致了更大的增色效应,使得辅色溶液的颜色更深、红色和色饱和度更高。随着辅色素浓度的增加辅色效果越明显,色差也越大,在摩尔比1∶40时所有花色苷辅色溶液均造成了视觉可察觉的颜色变化且各花色苷之间存在着显著性差异。此外,通过计算颜色参数对总色差的相对贡献,发现辅色溶液总色差的改变主要是量变引起的。
[1] LIU Y X, LIANG N N, WANG J, et al. Effect of the prefermentative addition of five enological tannins on anthocyanins and color in red wines[J].Journal of Food Science, 2013,78(1): C25-C30.
[2] NICOLLE P, MARCOTTE C, ANGERS P, et al.Co-fermentation of red grapes and white pomace: A natural and economical process to modulate red hybrid wine composition[J].Food Chemistry,2018, 242:481-490.
[3] EIRO M J, HEINONEN M. Anthocyanin color behavior and stability during storage: Effect of Intermolecular Copigmentation[J].Journal of Agricultural & Food Chemistry,2002,50(25):7 461-7 466.
[4] XU H G, LIU X, YAN Q L, et al. A novel copigment of quercetagetin for stabilization of grape skin anthocyanins[J]. Food Chemistry,2015,166:50-55.
[5] GARCIAMARINO M, ESCUDEROGILETE M L, et al.Colorimetric study of the interactions between different families of red wine pigments using transmittance and reflectance measurements[J].Food Research International,2013,50(1):20-30.
[6] TEIXEIRA N, CRUZ L, BRAS N F, et al.Structural features of copigmentation of oenin with different polyphenol copigments[J].Journal of Agricultural and Food Chemistry,2013,61(28):6 942-6 948.
[7] ESCRIBANOBAILON M T,SANTOSBUELGA C.Anthocyanin copigmentation-evaluation, mechanisms and implications for the colour of red wines[J].Current Organic Chemistry,2012,16(6):715-723.
[8] 张波,韩舜愈,马腾臻,等.红葡萄酒中花色苷衍生物结构研究进展[J].食品科学,2018,39(5):284-295.
[9] GRIS E F,FERREIRA E ![]() L D,et al.Caffeic acid copigmentation of anthocyanins from Cabernet Sauvignon grape extracts in model systems[J].Food Chemistry,2007,100(3):1 289-1 296.
L D,et al.Caffeic acid copigmentation of anthocyanins from Cabernet Sauvignon grape extracts in model systems[J].Food Chemistry,2007,100(3):1 289-1 296.
[10] HERNANDEZHERRERO J A,FRUTOS M J.Influence of rutin and ascorbic acid in colour, plum anthocyanins and antioxidant capacity stability in model juices[J].Food Chemistry,2015,173:495-500.
[11] HAN F L,XU Y.Effect of the structure of seven anthocyanins on self-association and colour in an aqueous alcohol solution[J]. South African Journal for Enology and Viticulture,2015,36(1):105-116.
[12] BENEDICTE B, FREITAS V A P D. Influence of procyanidin structures on their ability to complex with oenin[J].Food Chemistry,2005,90(3):453-460.
[13] MARKOVIC J M, PETRANOVIC N A, BARANAC J M. A spectrophotometric study of the copigmentation of malvin with caffeic and ferulic acids[J].Journal of Agricultural & Food Chemistry,2000,48(11):5 530-5 536.
[14] LAMBERT S G, ASENSTORFER R E,WILLIAUSOW N M, et al. Copigmentation between malvidin-3-glucoside and some wine constituents and its importance to colour expression in red wine [J].Food Chemistry, 2011, 125(1): 106-115.
[15] ZHANG B, HE F, ZHOU P P, et al. Copigmentation between malvidin-3-O-glucoside and hydroxycinnamic acids in red wine model solutions: Investigations with experimental and theoretical methods[J].Food Research International, 2015, 78: 313-320.
[16] HERASROGER J, ALONSOALONSO O, GALLO-MONTESDEOCA A, et al. Influence of copigmentation and phenolic composition on wine color[J].Journal of Food Science and Technology,2016,53(6):2 540-2 547.
[17] TROUILLAS P,SANCHOGARCIA J C,DE FREITAS V,et al.Stabilizing and modulating color by copigmentation: Insights from theory and experiment[J].Chemical Reviews,2016,116(9):4 937-4 982.
[18] MALAJ N,DE SIMONE B C, QUARTAROLO A D,et al.Spectrophotometric study of the copigmentation of malvidin 3-O-glucoside with p-coumaric, vanillic and syringic acids[J]. Food Chemistry, 2013, 141(4): 3 614-3 620.
[19] RIVERO F J, GORDILLO B, JARAPALACIOS M J, et al. Effect of addition of overripe seeds from white grape by-products during red wine fermentation on wine colour and phenolic composition[J].LWT - Food Science and Technology,2017,84:544-550.
[20] ZHANG B, LIU R, HE F, et al. Copigmentation of malvidin-3-O-glucoside with five hydroxybenzoic acids in red wine model solutions: Experimental and theoretical investigations[J].Food Chemistry,2015,170:226-233.
[21] BOULTON R.The copigmentation of anthocyanins and Its role in the color of red wine: A critical review[J]. American Journal of Enology & Viticulture,2001,522(2):67-87.
[22] CAVALCANTI R N, SANTOS D T, MEIRELES M A A, et al. Non-thermal stabilization mechanisms of anthocyanins in model and food systems—An overview[J]. Food Research International,2011,44(2):499-509.
[23] CASTANEDAOVANDO A, PACHECOHERNANDEZ M D, ![]() D L, et al.Chemical studies of anthocyanins: A review[J]. Food Chemistry,2009,113(4):859-871.
D L, et al.Chemical studies of anthocyanins: A review[J]. Food Chemistry,2009,113(4):859-871.
[24] GONZALEZMANZANO S, DUENAS M, RICASGONZAL O J, et al.Studies on the copigmentation between anthocyanins and flavan-3-ols and their influence in the colour expression of red wine[J].Food Chemistry,2009, 114(2):649-656.
[25] 韩富亮,李杨,李记明,等.红葡萄酒花色苷结构和颜色的关系研究进展[J].食品与生物技术学报,2011,30(3):328-336.
[26] DI M F, SANCHO G J C, DANGLES O, et al.Highlights on anthocyanin pigmentation and copigmentation: A matter of flavonoid π-stacking complexation to be described by DFT-D[J]. Journal of Chemical Theory & Computation,2012,8(6):2 034-2 043.
[27] ZHANG B, HE F, LIU Y, et al.Impact of adding ellagic acid to red grapes on the phenolic composition and chromatic quality of Cabernet Sauvignon wines from a warm climate[J].Journal of Food Processing and Preservation,2017,41(4)e13-080.
[28] BOULTON R. The copigmentation of anthocyanins and Its role in the color of red wine: A critical review[J]. American Journal of Enology & Viticulture, 2001, 52(2):67-87.
[29] HAN F L, ZHANG W N, PAN Q H, et al. Principal component regression analysis of the relation between CIELAB color and monomeric anthocyanins in young Cabernet Sauvignon wines[J].Molecules,2008,13(11):2 859-2 870.
[30] 王宏.宁夏干红葡萄酒陈酿过程中酚类物质及颜色的变化规律研究[D].银川:宁夏大学,2015.
[31] FANZONE M, GONZALEZMANZANO S, ![]() J, et al. Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J]. Food Chemistry, 2015, 175:166-173.
J, et al. Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J]. Food Chemistry, 2015, 175:166-173.
[32] WILSKAJESZKA J, KORZUCHOWSKA A. Anthocyanins and chlorogenic acid copigmentation - influence on the colour of strawberry and chokeberry juices[J].Zeitschrift fuer Lebensmittel-Untersuchung und -Forschung,1996,203(1):38-42.
[33] RIVERO F J,GORDILLO B, JARA-PALACIOS J M, et al.Effect of addition of overripe seeds from white grape by-products during red wine fermentation on wine colour and phenolic composition[J].LWT - Food Science and Technology, 2017,84:544-550.
[34] DI MEO F, SANCHO GARCIA J C, DANGLES O, et al.Highlights on anthocyanin pigmentation and copigmentation: A matter of flavonoid π-stacking complexation to be described by DFTD[J].Journal of Chemical Theory & Computation,2012,8(6):2 034-2 043.
[35] GORDILLO B, RODRIGUEZPULIDO J F, ESCUDERO-GILETE L M, et al. Comprehensive colorimetric study of anthocyanic copigmentation in model solutions. Effects of pH and molar ratio[J]. Journal of Agricultural & Food Chemistry, 2012, 60(11): 2 896-2 905.
[36] GORDILLO B,SIGURDSON G T, FEI L,et al.Assessment of the color modulation and stability of naturally copigmented anthocyanin-grape colorants with different levels of purification[J].Food Research International, 2018, 106: 791-799.
[37] ZHANG X K, HE F, ZHANG B, et al.The effect of prefermentative addition of gallic acid and ellagic acid on the red wine color, copigmentation and phenolic profiles during wine aging [J].Food Research International, 2018,106:568-579.
![]() N M, et al.Colorimetric study of the interactions between different families of red wine pigments using transmittance and reflectance measurements[J].Food Research International, 2013, 50(1):20-30.
N M, et al.Colorimetric study of the interactions between different families of red wine pigments using transmittance and reflectance measurements[J].Food Research International, 2013, 50(1):20-30.