沙棘(Hippophae rhamnoides L.)为胡颓子科沙棘属植物。沙棘果实中含有Vc、类胡萝卜素、黄酮类化合物、多酚类化合物,以及丰富的不饱和脂肪酸、氨基酸等营养成分[1-3],具有增强人体免疫力、抗菌、抗氧化、抗衰老、抗辐射、预防心脑血管疾病以及美容护肤等作用[4-6]。我国是世界上沙棘属植物类群分布最多的国家,沙棘总面积占世界的95%以上。将沙棘发酵成沙棘酒,是其精深加工的一个方向。目前对沙棘酒的研究多集中于其发酵过程中生物活性物质变化和发酵工艺,如贺静[7]研究了沙棘酒主发酵过程中不同处理条件下类胡萝卜素、多酚及抗氧化性变化;牛广财等[8]采用Folin-Ciocalteu比色法测定了沙棘酒中总多酚含量;蔡文超等[9]采用响应面法优化了沙棘酒的发酵工艺,在此工艺条件下,所发酵沙棘酒的酒精度为12.0% vol。但是,尚未发现有关沙棘酒发酵过程中的酒精生成、基质糖消耗及酵母菌体生长规律方面的研究。
发酵动力学是对微生物生长和产物形成过程的定量描述,研究发酵过程中菌体的生长、底物消耗和产物合成之间的动态平衡及内在规律。胡永正对桑葚酒发酵过程中菌体生长、底物消耗和产物生成情况进行Logistic模型的非线性拟合,拟合效果较好,有利于其工业化发酵生产[10]。通过相应发酵动力学模型,可以对发酵过程进行定量分析和对实验最终指标进行预测。吴树坤等采用SGompertz模型、DoseResp模型、Boltzmanm模型对不同发酵时间山葡萄发酵液中酵母生长期数量的变化、酒精生成情况及还原糖消耗情况进行非线性拟合,建立发酵动力学模型,判定系数R2均大于0.995,能较好地描述发酵中的动力学特征[11]。
本试验采用经典的DoseResp模型、Boltzmann模型、SGompertz模型和Logistic模型,对沙棘果酒发酵过程中酵母生长期数量的变化、酒精生成和还原糖消耗情况进行非线性拟合,建立发酵动力学模型,为沙棘果酒实现工业化生产提供帮助。同时,本试验还测定了不同发酵时间沙棘果酒中总多酚、总黄酮和Vc含量,结合1,1-二苯基-2-三硝基苯肼(DPPH) 法、总抗氧化能力试剂盒法测定不同发酵时间沙棘果酒抗氧化活性。通过对沙棘果酒发酵动力学和抗氧化活性研究,为沙棘果酒发酵提供理论基础。
1 材料与方法
1.1 材料
冷冻沙棘果,深秋红俄罗斯大果沙棘,总糖含量65.02 mg/mL,总酸含量17.82 g/L,pH值为3.0,购于黑龙江省孙吴县大果沙棘展销中心。RV171型葡萄酒活性干酵母,安琪酵母股份有限公司;白砂糖,黑龙江北方糖业股份有限公司。
1.2 主要试剂及仪器
Pectinex XXL果胶酶(酶活10 000 U/mL),诺维信(中国)生物技术有限公司;1,1-二苯基-2-苦肼基自由基(DPPH),梯希爱(上海)化成工业发展有限公司;没食子酸标准品、芦丁标准品、VC标准品,国药集团化学试剂有限公司;3,5-二硝基水杨酸,草酸,2,6-二氯靛酚钠,NaOH,无水乙醇,Al(NO3)3,NaNO2,无水甲醇,福林酚,Na2CO3等,均为国产分析纯;总抗氧化能力(T-AOC)测定试剂盒,南京建成生物工程研究所。
WS108手持式折光仪,河北润联科技开发有限公司;HR7633打浆机,飞利浦家庭电器(珠海)有限公司;DK-8D型电热恒温水槽,上海森信实验仪器有限公司;UV-1100紫外可见分光光度计,上海凌析达仪器;L420台式低速离心机,湖南湘仪实验室仪器开发有限公司;DRP-9082型电热恒温培养箱;YS100尼康生物显微镜,日本尼康公司;EX324电子天平,奥豪斯仪器(上海)有限公司。
1.3 沙棘果酒发酵工艺流程与操作要点
工艺流程如下:
冷冻沙棘果→打浆→酶解→调整糖度→杀菌→接种→发酵→恒温培养→沙棘果酒→分析测定
操作要点:
(1)将冷冻沙棘果在室温下进行解冻后,用打浆机打浆,测其可溶性固形物的含量[12]。
(2)用果胶酶进行酶解,温度为45~50 ℃,酶解时间是3 h[13]。
(3)加白砂糖调整糖度至21 °Brix[14]。
(4) 活化酵母菌:用1/3的沙棘汁和2/3的蒸馏水溶解干酵母,在35 ℃下将酵母菌活化30 min。
(5)接种前在60 ℃条件下杀菌30 min,然后冷却至室温,接入质量浓度5 g/L活化好的酵母菌,于21 ℃条件下恒温发酵。每24 h取样1次,取发酵液离心后的上清液进行检测,3次重复。
1.4 发酵动力学数据的测定
1.4.1 酵母菌数量测定
将发酵液取出用蒸馏水稀释一定倍数,滴于血球计数板上,在光学显微镜下直接计数。
1.4.2 还原糖含量测定
采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid, DNS)比色法测定还原糖的质量浓度[15]。葡萄糖标准曲线方程为:y=0.538 9x-0.016 1,R2=0.997 2。
1.4.3 酒精度测定
采用蒸馏法和密度瓶法测定沙棘果酒的酒精度数[16]。
1.5 总多酚、总黄酮与Vc含量的测定
1.5.1 总多酚含量的测定
采用Folin-Ciocalteu法测定沙棘果酒中的总多酚的含量[17]。没食子酸标准曲线方程为:
y=0.179 2x+0.088 7,R2=0.998 6
根据标准曲线及样品吸光度,计算出发酵液总多酚的含量。
1.5.2 总黄酮含量的测定
采用NaNO2-Al(NO3)3-NaOH显色法测定沙棘果酒中总黄酮的含量[18]。芦丁标准曲线方程为:
y=0.080 2x+0.004 7,R2=0.997 5
根据标准曲线及样品吸光度,计算出发酵液总黄酮的含量。
1.5.3 Vc含量的测定
采用2,6-二氯靛酚滴定法[19]。
1.6 抗氧化性测定
1.6.1 DPPH自由基清除能力测定
采用李治龙等[20]的方法略有改动。配制DPPH溶液:用电子天平称取19.7 mg DPPH,然后用体积分数95%乙醇溶解后直接定容至100 mL,得到DPPH溶液,浓度为0.5 mmol/mL,配制好的溶液于0~4 ℃下避光保存。取2 mL稀释后的样液与0.5 mL DPPH溶液混合均匀后在37 ℃下黑暗处放置20 min,此时用无水甲醇为空白,在517 nm条件下测定其吸光度Ai;取2 mL无水甲醇与0.5 mL DPPH溶液混合,混合均匀后在37 ℃下黑暗处放置20 min,此时用无水甲醇为空白,在517 nm条件下测定其吸光度Ac;取2 mL处理好的样液与0.5 mL无水甲醇混合,混合均匀后37 ℃下黑暗处放置20 min,此时用无水甲醇为空白,在517 nm条件下测定其吸光度Aj。按照公式(1)计算DPPH自由基清除率。
DPPH自由基清除率![]()
(1)
式中:Ai,加发酵液反应后DPPH溶液的吸光度;Ac,加DPPH溶液,不加发酵液的吸光度;Aj,加发酵液,不加DPPH溶液的吸光度。
1.6.2 总抗氧化能力的测定
参考韦云路等的方法[21],总抗氧化能力测定采用总抗氧化能力(total antioxidant capacity, T-AOC)测定试剂盒方法。
1.7 数据处理与分析
每组实验进行3次重复,采用Origin 9.0软件进行作图分析,再选取适合的模型对酵母菌数量、酒精度以及还原糖含量进行非线性拟合。比较拟合相关系数,选取拟合度高的模型进行定量描述。
2 结果与分析
2.1 沙棘果酒发酵过程中酵母菌数量、酒精度以及还原糖含量的变化
由图1可知,酵母菌在24~96 h增长速度较快,为快速增长期,随后数量变化幅度较大,进入稳定期和衰亡期。到96 h左右时酵母菌数最高值达到7.8×108 CFU/mL,96 h后,酵母菌数量逐渐减少,其原因是在较高酒精浓度和较低还原糖浓度下进入平稳期而衰亡[22],出现菌体自溶和沉淀。还原糖含量随着发酵时间的增长而下降,0~192 h还原糖消耗速度较快,由酵母菌转化为酒精,192 h后基本保持稳定。酒精度数呈逐渐升高的趋势,在0~192 h升高较快,192 h后增幅变缓,在264 h时酒精度达到最高,为11.7% vol。表明在沙棘汁发酵过程中,酒精的生成与还原糖的消耗是对应的。
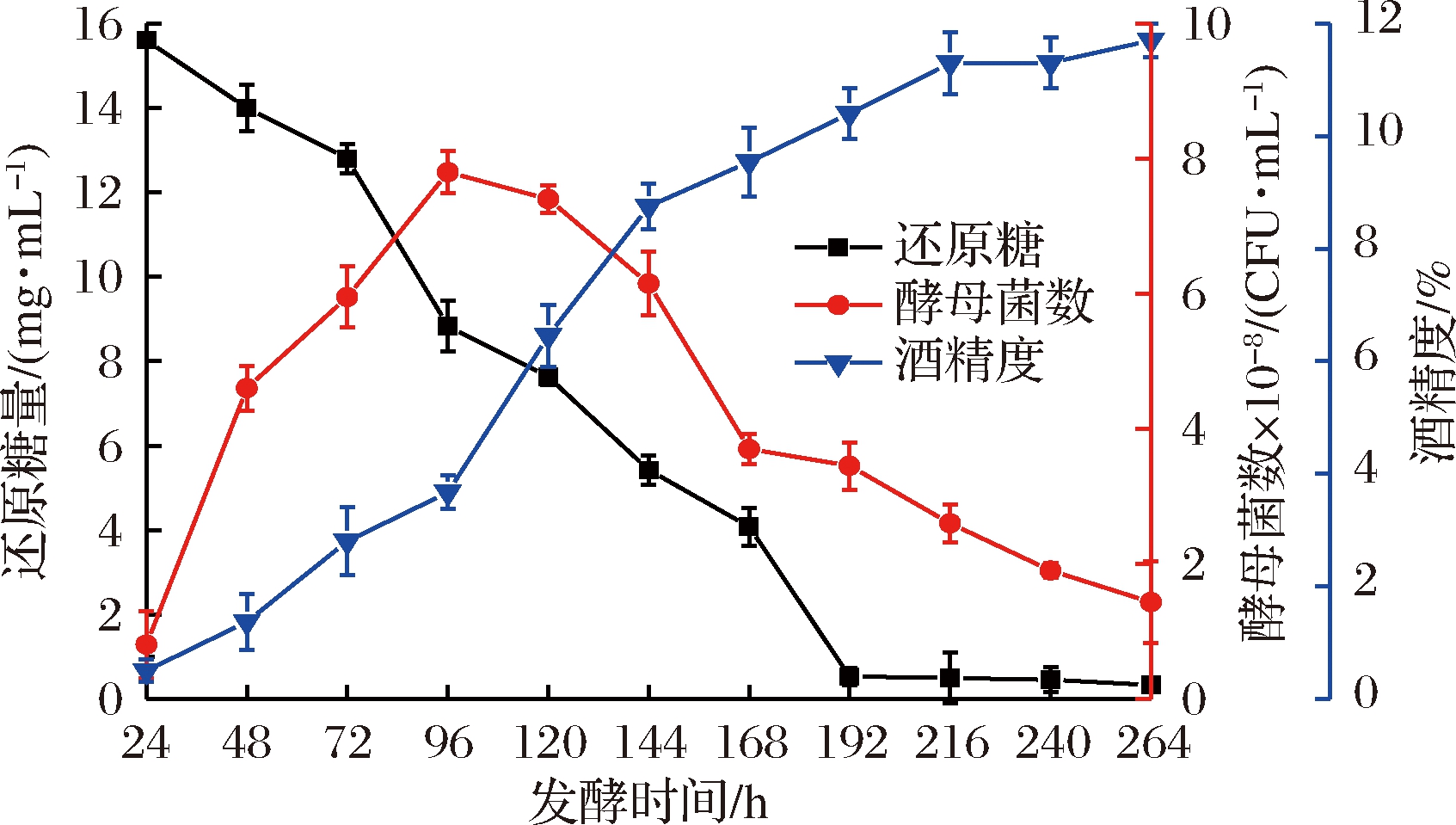
图1 沙棘果酒发酵过程中酒精度、酵母菌数、还原糖含量变化规律
Fig.1 Changes of alcohol content, yeast count, and reducing sugar content during fermentation of sea buckthorn wine
2.2 沙棘果酒的发酵动力学模型
2.2.1 酵母菌数生长动力学模型
表1 酵母菌数的拟合方程及其相关系数
Table 1 The fitting equation count of yeast and its correlation coefficients

模型拟合方程R2SGompertzy=76.3526×e-e-0.05355×(x-347.6500)0.9562DoseRespy=-352.59054+432.537731+100.01464×(23.89203-x)0.9308Logisticy=8.59273+-10.875431+x37.55103()2.060180.9273
由图1可知,酵母菌在96 h后开始进入衰亡期,因此,本研究拟对发酵0~120 h时期酵母菌生长情况进行非线性拟合(见表1)。对比SGompertz模型、DoseResp模型及Logistic模型的拟合相关系数,SGompertz模型对酵母菌生长情况拟合效果最好,相关系数R2为0.956 2。故选用SGompertz模型。
对沙棘果酒酵母菌数的生长情况进行拟合,得到拟合曲线如图2所示。由图2可知,酵母菌在沙棘果酒发酵24 h后生长速率开始提高,在96 h时菌体数量达到最高值。

图2 SGompertz模型下酵母菌生长拟合曲线
Fig.2 Fitting curve of yeast growth in the SGompertz model
2.2.2 酒精生成动力学模型
如表2所示,得出3种模型的拟合相关系数分别是0.995 1、0.991 5、0.992 1,可知Boltzmann模型拟合的效果最佳,所以,最终选取Boltzmann模型为沙棘果酒发酵中酒精生成的拟合模型。图3是Boltzmann模型的拟合曲线。
表2 酒精生成拟合方程及相关系数
Table 2 Fitting equation and correlation coefficient of alcohol formation

模型拟合方程R2Boltzmanny=12.02908+-0.266751+e33.765290.9951Logisticy=12.93662+-12.478691+x121.6182()3.392250.9915SGompertzy=12.6954×e-e-0.01884×(x-97.8810)0.9921
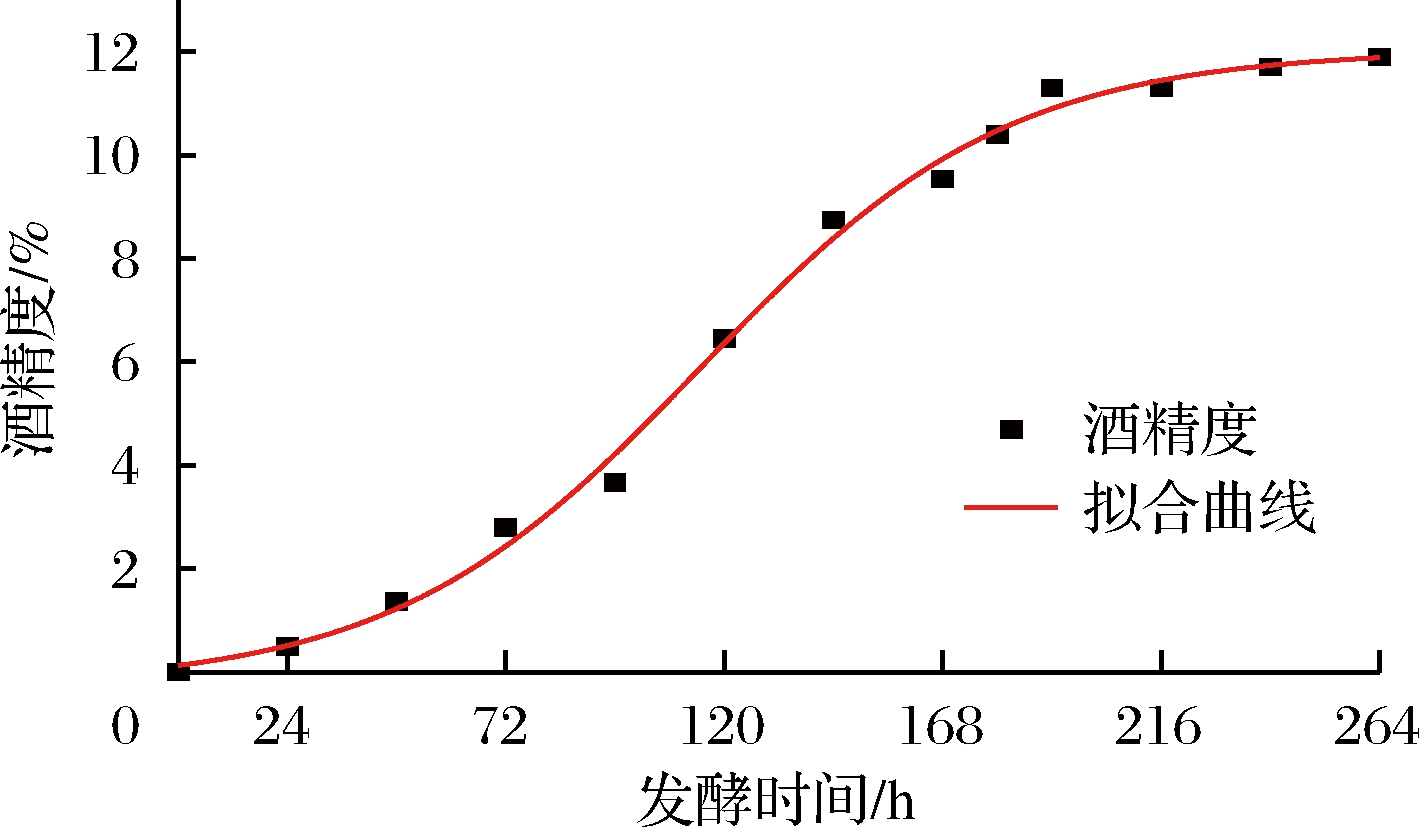
图3 Boltzmann模型下酒精生成拟合曲线
Fig.3 Fitting curve of alcohol formation in the Boltzmann model
由图3可知,酒精度在192 h后趋于平缓,最大值为11.7% vol。
2.2.3 还原糖消耗动力学模型
由表3可知,对比Boltzmann模型、DoseResp模型与Logistic模型这3种模型的拟合相关系数,Boltzmann模型和DoseResp模型拟合效果最好,相关系数R2均为0.979 6。因此,选取Boltzmann模型和DoseResp模型来拟合沙棘果酒发酵过程中的还原糖消耗过程。
表3 还原糖消耗拟合方程及相关系数
Table 3 Fitting equation and correlation coefficient of reducing sugar consumption

模型拟合方程R2Boltzmanny=-0.56474+17.976131+e39.767130.9796DoseRespy=-0.56474+17.976131+10-0.01029×(109.10308-x)0.9796Logisticy=-2.3835+18.307021+x121.26855()2.75750.9751
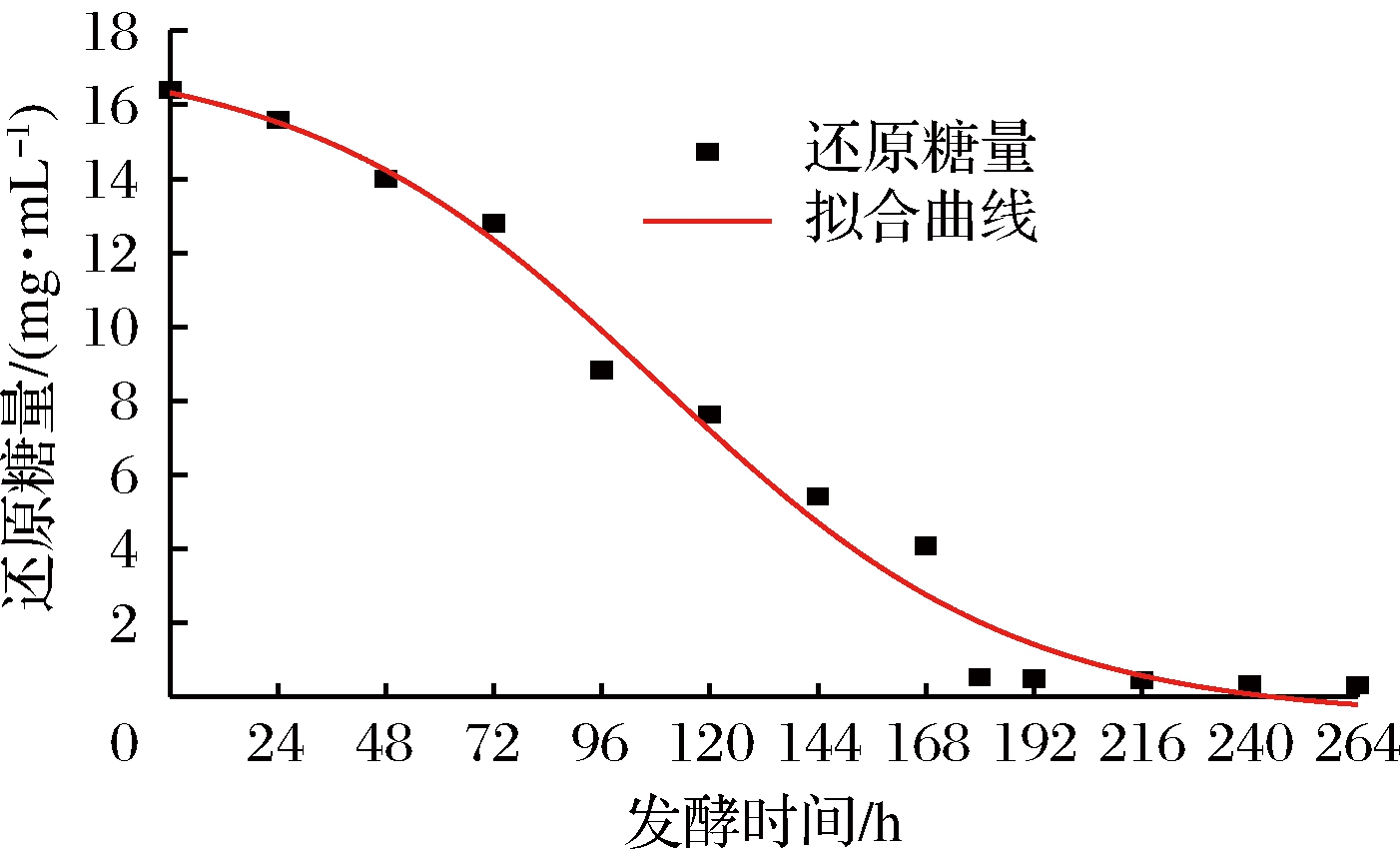
图4 Boltzmann模型下还原糖消耗拟合曲线
Fig.4 Fitting curve of reducing sugar consumption in the Boltzmann model
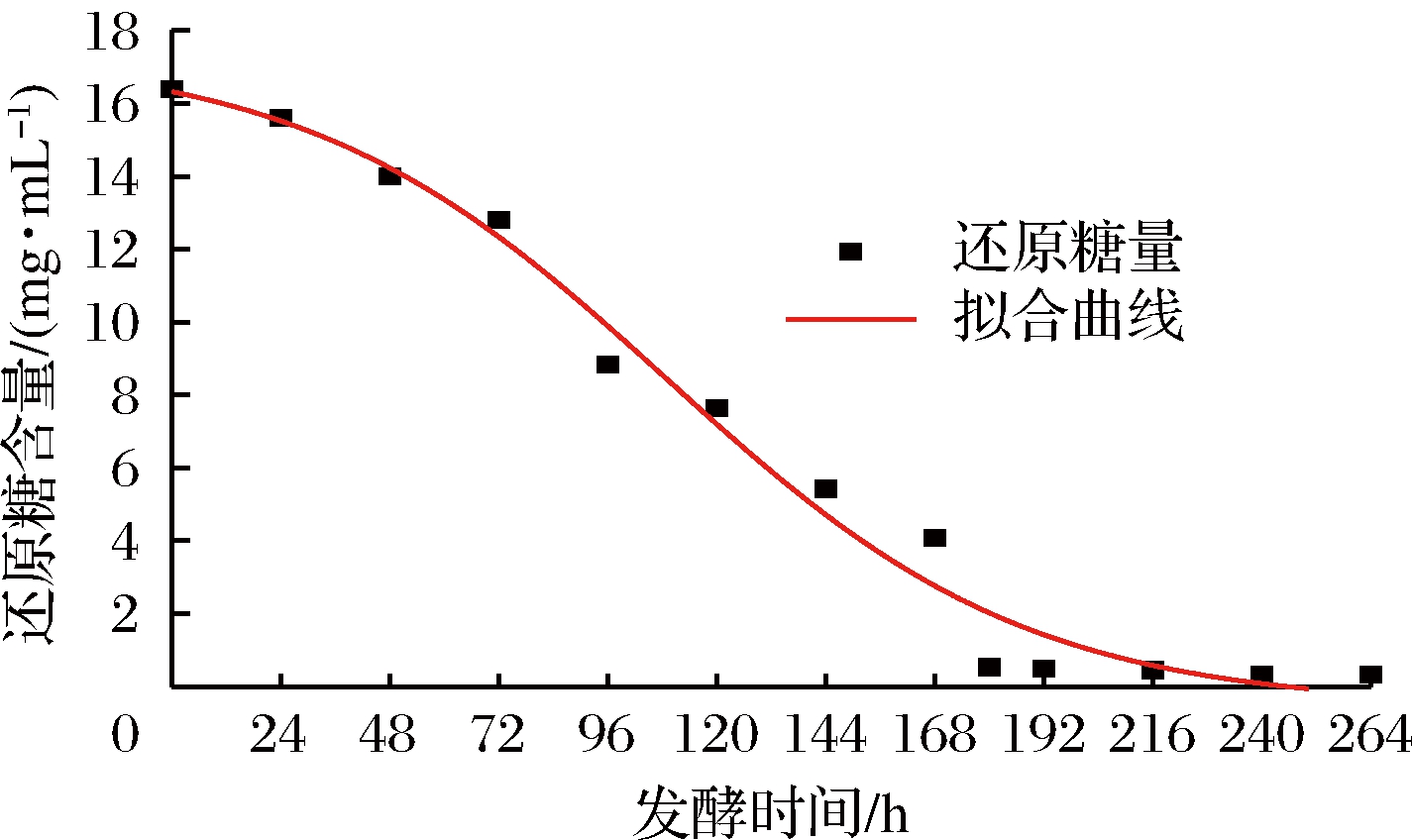
图5 DoseResp模型下还原糖消耗拟合曲线
Fig.5 Fitting curve of reducing sugar consumption in the DoseResp model
由图4和图5可知,在216 h之前,还原糖的消耗较快,之后消耗量放缓。这与吴树坤拟合模型一致[11]。
2.3 总多酚、总黄酮和Vc含量的变化
2.3.1 沙棘果酒发酵过程中总多酚含量的变化
由图6可知,总多酚含量呈先上升后下降的趋势,发酵时间在24~96 h为沙棘果酒最主要发酵阶段,此时沙棘果酒的出汁量比较多,可能是酵母菌把复杂的大分子酚类物质转化成小分子酚类物质,使得总多酚含量升高,沙棘果酒的总多酚含量由初始的61.75 mg/mL增长为146.01 mg/mL。在96 h之后的发酵中,总多酚含量开始逐渐下降,可能酵母菌生长代谢过程中产生了一些次级代谢产物,导致总多酚物质发生氧化、聚合或沉淀等反应,还可能是果酒利用总多酚物质发生褐变反应,造成总多酚含量下降。此结论与李雪等[14]关于仙人掌果酒发酵过程和于立梅等[22]在研究山竹酒发酵过程中的总多酚变化趋势的结论一致。
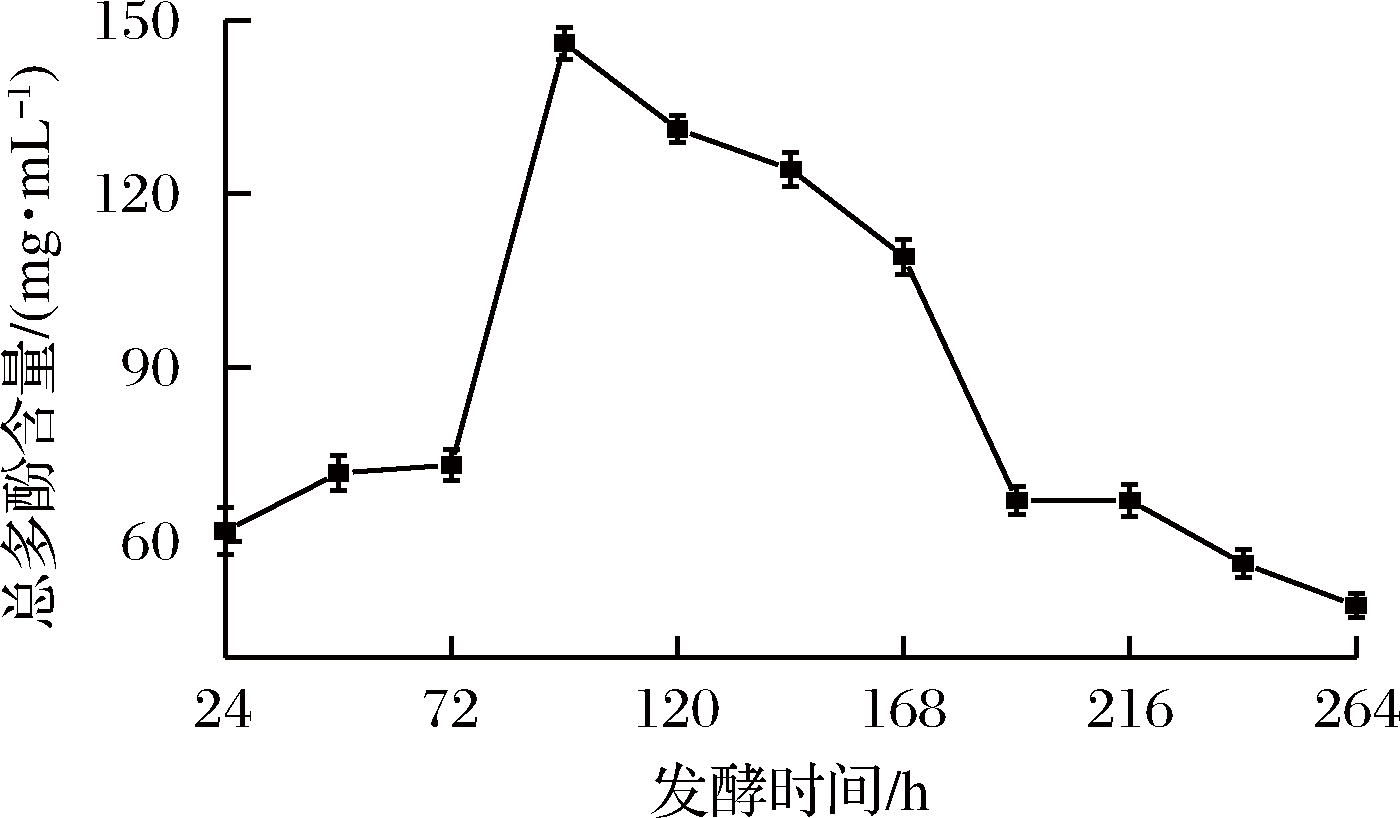
图6 沙棘果酒发酵过程中总多酚含量的变化
Fig.6 Changes of total polyphenols content during fermentation of sea buckthorn wine
2.3.2 沙棘果酒发酵过程中总黄酮含量的变化
由图7可知,沙棘果酒发酵过程中总黄酮含量呈先上升后降低的趋势。在24~72 h,总黄酮含量不断上升,在72 h时达到了最高值(12.60 mg/mL)。其原因可能是随着发酵的进行,沙棘果大量出汁,酒精度不断增加,使得黄酮类物质不断浸出,有利于醪液中黄酮的提取,且浸泡时间延长,黄酮的溶解量也不断增加。
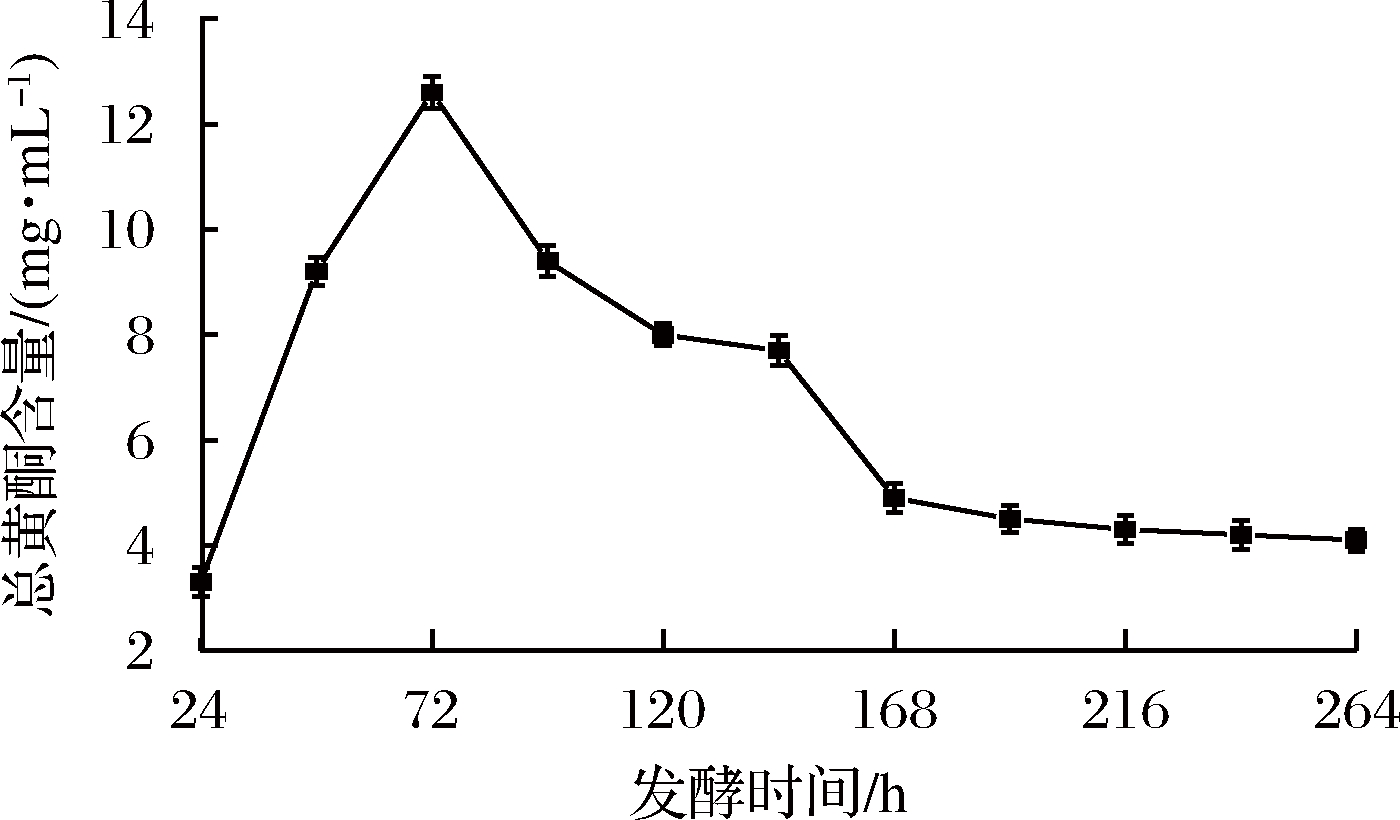
图7 沙棘果酒发酵过程中总黄酮含量的变化
Fig.7 Changes of total flavone content during fermentation of sea buckthorn wine
但是,在发酵后期,总黄酮含量呈下降趋势,可能是由于沙棘果酒在发酵过程中,丙酮酸、乙醛等酵母释放的次级代谢产物会与黄酮类物质发生反应,生成一些大分子衍生物所致,还可能是发酵后期多酚自身分解及氧化导致多酚黄酮含量下降[23]。
2.3.3 沙棘果酒发酵过程中Vc含量的变化
由图8可知,Vc含量呈现先增加后减少的趋势,与总多酚含量的变化趋势一致。当发酵至96 h左右,Vc含量达到最大值,为27.47 mg/100 mL。可能酶解处理沙棘果使其细胞壁被破坏,内容物流出以及随着发酵时间的延长,乙醇含量增加,活性物质增多,包括Vc含量升高。之后Vc含量开始逐渐降低,这可能是发酵后期Vc氧化和发生不同程度的降解所致。
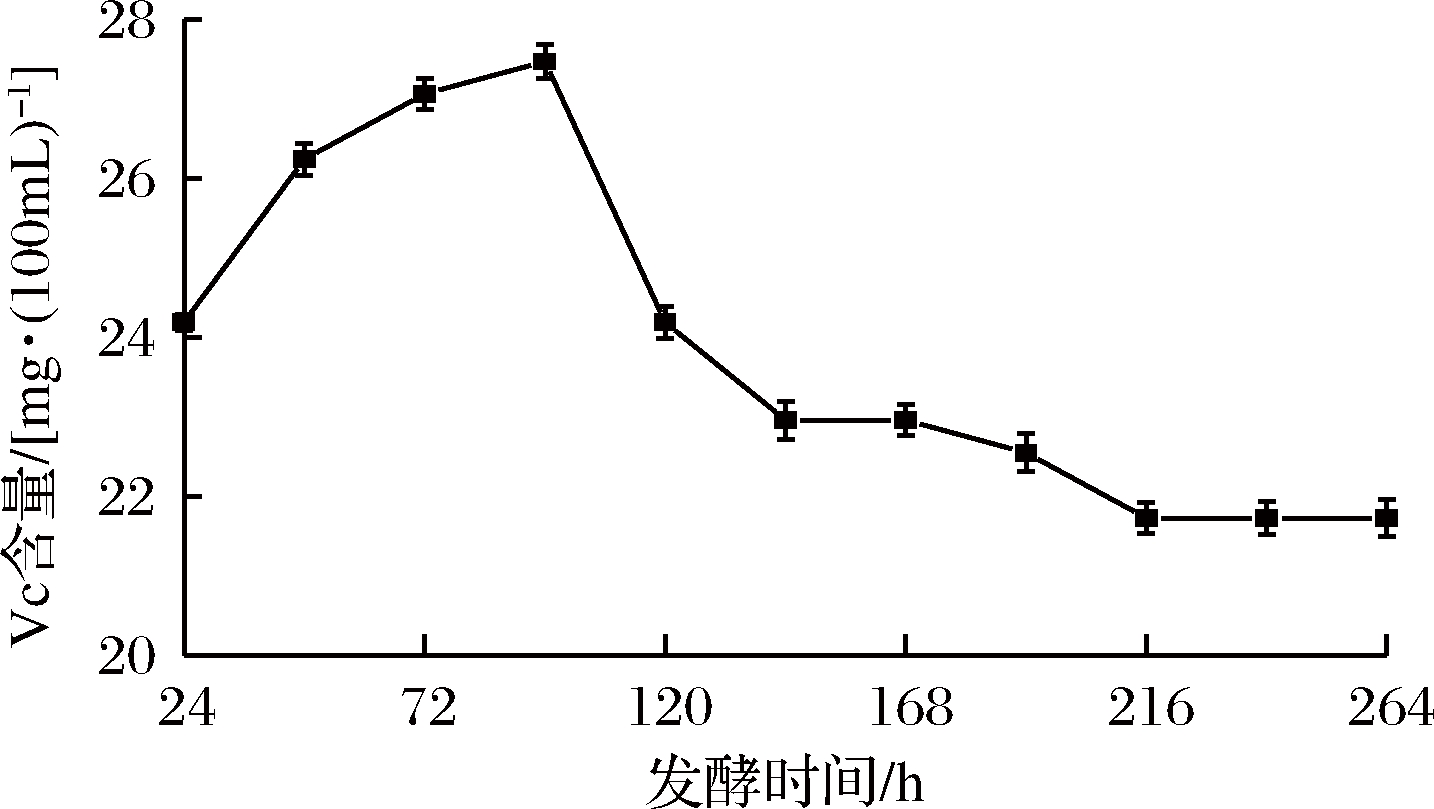
图8 沙棘果酒发酵过程中VC含量的变化
Fig.8 Changes of vitamin C content during fermentation of sea buckthorn wine
2.4 沙棘果酒发酵过程中抗氧化性的变化
2.4.1 沙棘果酒发酵过程中DPPH自由基清除率变化
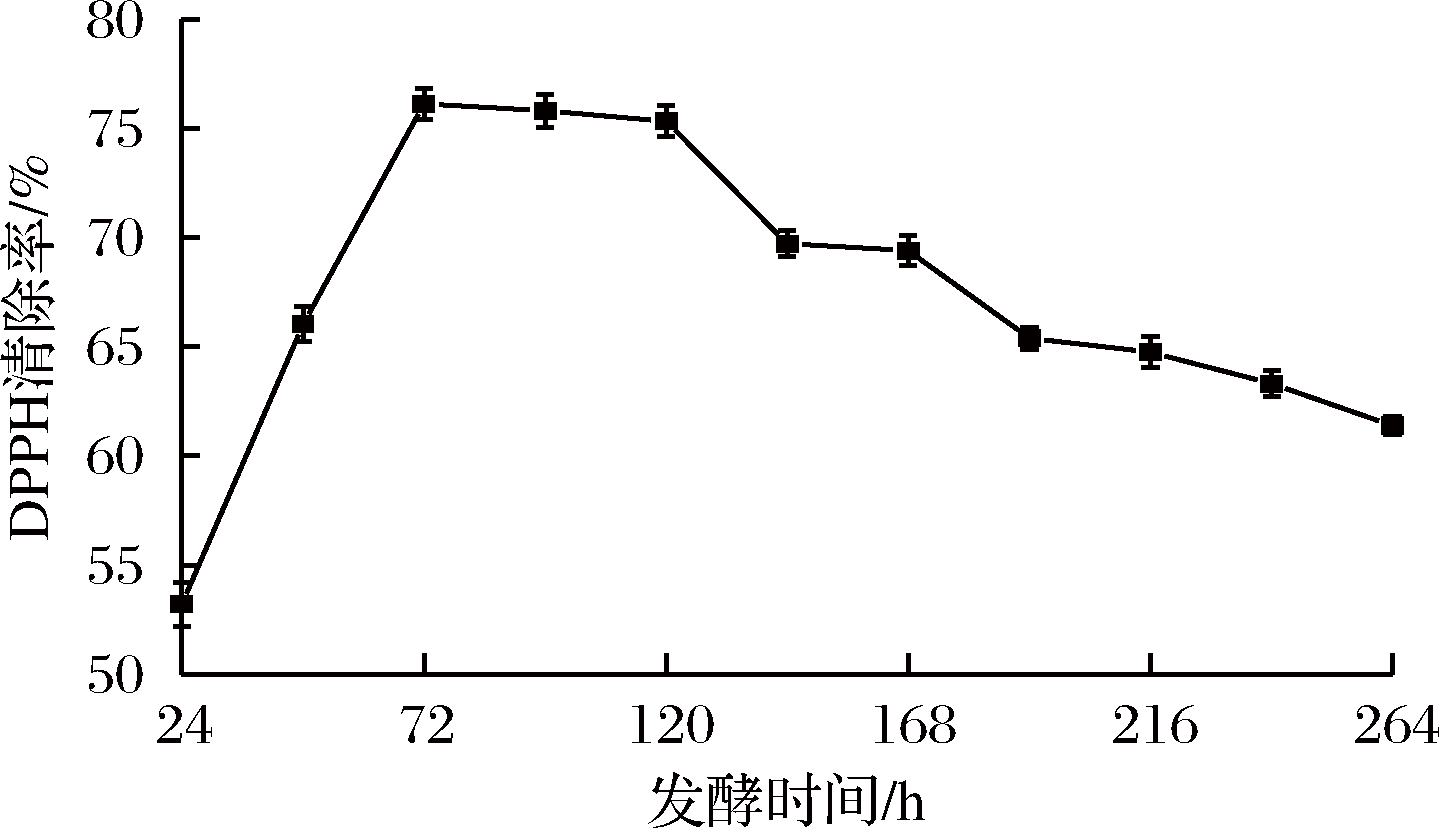
图9 沙棘果酒发酵过程中DPPH自由基清除率的变化
Fig.9 Changes of DPPH radical scavenging rate during fermentation of sea buckthorn wine
由图9可知,DPPH自由基清除率呈现先增加后减少的趋势。这是因为随着发酵时间的不断增加,自身的抗氧化物质不断浸出,总多酚含量逐渐增加[24],FEREIDOON等认为酚类物质很容易给出一个氢离子并通过共振杂化而稳定,是其具有高自由基清除能力的主要原因[25],这使得其对DPPH自由基清除率较强;在发酵72~120 h是发酵的较佳时期,是清除率较高阶段。在72 h时,沙棘果酒对DPPH自由基清除率最大,达到了76.12%;在120 h之后,DPPH自由基清除率则呈下降趋势,可能是在发酵的过程中,果酒中的多酚类物质与Vc含量降低,从而导致DPPH自由基清除能力下降[26]。
2.4.2 发酵过程中总抗氧化能力的变化
由图10可知,沙棘果酒在发酵过程中总抗氧化能力呈现先上升后降低趋势,与DPPH自由基清除率的变化相似。在发酵120 h时,总抗氧化能力达到最大,为145.53 U/mL。可能是随着总多酚和Vc含量的增加,提高了沙棘果酒的抗氧化能力[27];在发酵120 h之后,由于活性成分含量的逐渐下降,最终导致其总抗氧化能力下降[28]。
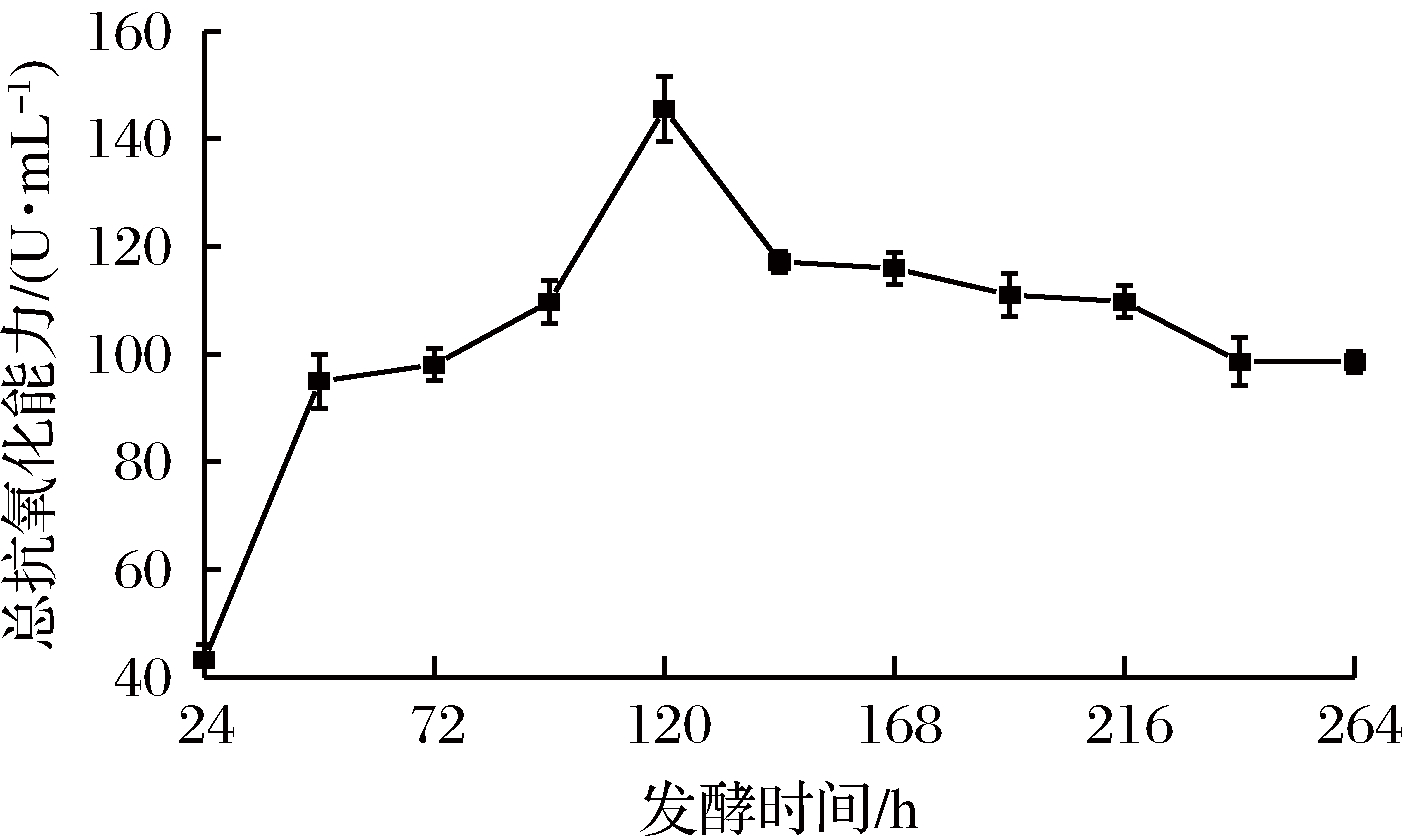
图10 沙棘果酒发酵过程中总抗氧化能力的变化
Fig.10 Changes of total antioxidant capacity during fermentation of sea buckthorn wine
3 结论
SGompertz模型、Boltzmann模型、DoseResp模型及Boltzmann模型能较好地对酵母菌生长、酒精生成和还原糖消耗进行非线性拟合,所选模型能较好地模拟沙棘果酒的发酵过程及描述其发酵动力学特征;沙棘果酒发酵过程中的总多酚含量、总黄酮含量、Vc含量、DPPH清除率以及总抗氧化能力均呈前期快速增加,后期逐渐下降的峰型变化趋势,其最大值分别达到了146.01、12.60、27.47 mg/100 mL、76.12%和145.53 U/mL。
[1] LI Zheng, SHI Longkai, ZHAO Chenwei, et al. Fatty acid, phytochemical, oxidative stability and in vitro antioxidant property of sea buckthorn (Hippopha⊇ rhamnoides L.) oils extracted by supercritical and subcritical technologies[J]. LWT-Food Science and Technology,2017, 86(12):507-513.
[2] CHEN Chu, XU Xuemin, CHEN Yang, et al. Identification, quantification and antioxidant activity of acylated flavonol glycosides from sea buckthorn (Hippophae rhamnoides ssp. sinensis) [J]. Food Chemistry,2013,141(3): 1 573-1 579.
[3] MA Xueying, MOILANEN J, OSKAR LAAKSONEN, et al. Phenolic compounds and antioxidant activities of tea-type infusions processed from sea buckthorn (Hippopha⊇ rhamnoides) leaves[J]. Food Chemistry, 2019, 272(1):1-11.
[4] BEATA OLAS. Sea buckthorn as a source of important bioactive compounds in cardiovascular diseases[J]. Food and Chemical Toxicology,2016,97(11):199-204.
[5] THOMAS MICHEL, EMILIE DESTANDAU, GAЁTAN LE FLOCH, et al. Antimicrobial, antioxidant and phytochemical investigations of sea buckthorn (Hippopha⊇ rhamnoides L.) leaf, stem, root and seed[J]. Food Chemistry, 2012,131(3):754-760.
[6] GEETHA SURYAKUMAR, ASHEESH GUPTA. Medicinal and therapeutic potential of Sea buckthorn (Hippophae rhamnoides L.) [J]. Journal of Ethnopharmacology, 2011,138(2): 268-278.
[7] 贺静.沙棘酒主发酵过程中不同处理条件下类胡萝卜素、多酚及抗氧化性变化的研究[D].杨凌:西北农林科技大学,2015.
[8] 牛广财,闫公昕,朱丹,等.Folin-Ciocalteu比色法测定沙棘酒中总多酚含量的工艺优化[J].食品与机械,2016,32(4): 80-83;142.
[9] 蔡文超,单春会,李文新,等.响应面法优化沙棘酒的发酵工艺[J].中国酿造,2018,37(1):133-138.
[10] 胡永正.桑葚酒发酵工艺优化及动力学研究[D].成都:西华大学,2018.
[11] 吴树坤,邓杰,范勇,等.山葡萄酒发酵动力学及抗氧化活性研究[J].食品与发酵工业,2018,44(4):42-48.
[12] 靳梦楚,李雪,张宇翔,等.红心火龙果果酒发酵动力学研究[J].食品科技,2017,42(6):106-110.
[13] 张震,丁洁昌,李亚萍,等.一种金银花柚子果酒及酿造方法[J].食品研究与开发,2015,36(18):127-129.
[14] 李雪,白新鹏,曹君,等.仙人掌果酒发酵动力学及其抗氧化性[J].食品科学,2017,38(4):87-92.
[15] 杨泉女,周权驹,吴松健,等.3,5-二硝基水杨酸法与酶法测定甜玉米还原糖和蔗糖含量的比较[J].中国农业科技导报,2017, 19(11): 125-131.
[16] 国家卫生和计划生育委员会. GB 5009.225—2016食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[17] 严红光,李丽,杨芩,等.蓝莓叶多酚及抗氧化研究[J].食品科技,2018,43(10):285-288.
[18] 陈宇,黄晓丹,林素英,等.枇杷酒中总黄酮的测定[J].莆田学院学报,2010,17(5):28-31.
[19] 李书静,李可,姚新建,等.2,6-二氯靛酚钠法测定果汁饮料中的维生素C[J].光谱实验室,2011,28(5): 2 391-2 394.
[20] 李治龙,刘新华,刘文杰,等.几种新疆特色干果清除自由基活性[J].光谱实验室, 2012,29(5): 2 680-2 684.
[21] 韦云路,李璐,李全宏.南瓜醋的澄清工艺优化及其抗氧化活性研究[J].中国酿造,2018,37(10):31-35.
[22] 于立梅,刘俊梅,冯卫华,等.山竹酒发酵过程中活性成分变化及成品香气分析[J].现代食品科技,2014,30(5): 287-291;296.
[23] 王胜利,李国薇,樊明涛.猕猴桃酒酿造过程中多酚及抗氧化性的研究[J].酿酒科技,2012,33(10):55-58.
[24] 程志华,龚霄,袁源,等.红心火龙果果酒发酵特性的研究[J].酿酒科技,2018,40(9):17-21.
[25] FEREIDOON S, CESARETTIN A, CHANDRIKA M L. Antioxidant phytochemicals in hazelnut kernel (Corylus avellana L.) and hazelnut byproducts[J].Journal of Agricultural and Food Chemistry, 2007,55(4):1 212-1 220.
[26] 王然,张春玉,贾燕妮.酸浆果蜂蜜酸奶发酵及贮藏过程中抗氧化活性的变化研究[J].中国酿造,2019,38(1):158-163.
[27] 孙浩本,颜鹏,陆鹏麒,等.外源添加维生素C对链霉菌ε-聚赖氨酸发酵的影响[J].食品与发酵工业,2018,44 (9):29-35.
[28] 孙小华.无花果(Ficus carica L.)果酒酿造工艺研究及抗氧化活性评价[D].哈尔滨:东北农业大学,2018.