传统青稞酒是以西藏粮食作物青稞为原料,加入青稞小曲糖化发酵而成,是西藏酒文化的代表,具有口感适宜、酒精度低以及营养功效高等特点[1]。
青稞小曲是采用传统自然接种方式制作的酿酒发酵剂,含有丰富的微生物及酶[2],参与酿酒过程中的糖化、液化、酒精发酵和风味的形成[3-4]。所以,青稞小曲中的微生物很大程度上决定了青稞酒的品质和风味。目前,由于地理位置、酿造工艺、制曲原料和环境等因素的影响致使青稞小曲质量不稳定[5-6]。
传统的微生物学方法,如微生物计数,使用不同的普通和选择性培养基,可以提供可培养的不同微生物数量以及用于酒发酵的分离的纯培养菌株[7]。本文收集了来自西藏5个地区的21个青稞小曲样品,采用传统培养法对微生物进行分离鉴定,并筛选淀粉酶活力和蛋白酶活力高的菌种,为丰富青稞小曲中微生物菌群的研究,以及生产适合西藏地区青稞酒酿造的小曲,稳定和提升青稞酒的品质的研究提供理论基础。
1 材料与方法
1.1 材料、试剂与培养基
青稞小曲:21种,均由西藏自治区农牧科学院提供,样品信息如表1所示。
牛肉膏蛋白胨琼脂培养基、平板计数琼脂(plate count agar,PCA)培养基、孟加拉红琼脂培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基,北京奥博星生物技术有限责任公司。
产糖化酶菌株初筛培养基[8]、产蛋白酶菌株初筛培养基[9]、麸皮培养基[1]。
细菌基因组DNA提取试剂盒、酵母基因组DNA提取试剂盒、植物基因组DNA提取试剂盒,天根生化试剂公司;6× Loading Buffer(上样缓冲液)、10× PCR Buffer、Tap酶、DL5 000 DNA Marker,宝日医生物技术(北京)有限公司;Gold View(核酸染色剂),北京博奥拓达科技有限公司;通用引物(27F和1492R、ITS-1和ITS-4),由华大基因公司合成;西班牙琼脂糖,北京索莱宝科技有限公司;乙酸-乙酸钠缓冲溶液(pH 4.6),可溶性淀粉溶液(20 g/L)、NaOH溶液(质量分数20%)、葡萄糖标准溶液(2.5 g/L)、费林溶液、酪氨酸,HCl、0.4 mol/L Na2CO3溶液、福林试剂、pH 7.5磷酸盐缓冲液、pH 3.0乳酸缓冲液、脱脂奶粉、0.4 mol/L三氯乙酸溶液、碘液,试剂均为分析纯,北京化工厂。
1.2 仪器与设备
SW-CJ-2FD超净工作台,苏州净化设备有限公司;LDZX-50KBS高压灭菌锅,上海申安医疗器械厂;
表1 青稞小曲样品的信息
Table 1 Information of highland barley Xiaoqu samples
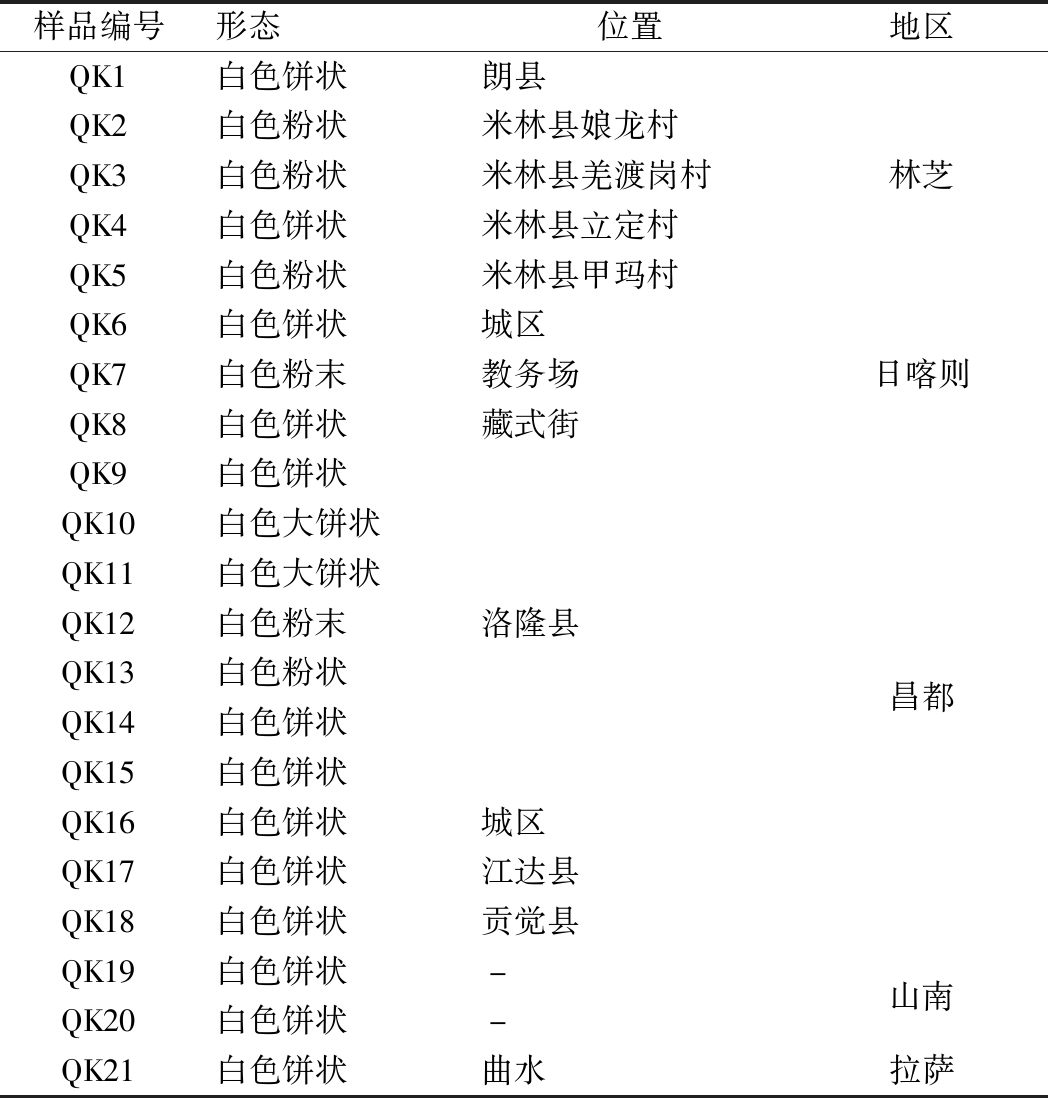
样品编号形态位置地区QK1白色饼状QK2白色粉状QK3白色粉状QK4白色饼状QK5白色粉状QK6白色饼状QK7白色粉末QK8白色饼状QK9白色饼状QK10白色大饼状QK11白色大饼状QK12白色粉末QK13白色粉状QK14白色饼状QK15白色饼状QK16白色饼状QK17白色饼状QK18白色饼状QK19白色饼状QK20白色饼状QK21白色饼状朗县米林县娘龙村米林县羌渡岗村米林县立定村米林县甲玛村城区教务场藏式街洛隆县城区江达县贡觉县--曲水林芝日喀则昌都山南拉萨
注:“-”表示只精确到地区具体位置信息未定。
BX51显微镜,奥林巴斯(中国)有限公司;LRH-250培养箱,上海一恒科学仪器有限公司;BC-C57 PCR仪,北京天林恒泰科技有限公司;BG-sub MIDI多用途水平电泳仪、BG-Power600通用电泳仪电源,北京百晶生物技术有限公司;Tanon 1600凝胶成像系统,上海天能科技有限公司。
1.3 方法
1.3.1 样品中微生物的分离与纯化
准确称取1 g粉碎的青稞小曲样品,无菌操作下,加入99 mL无菌生理盐水(0.9%)中,振荡2 min,使微生物均匀分散于生理盐水中,制成10-2稀释度的菌悬液,混合均匀,吸取1 mL 10-2菌悬液于9 mL无菌生理盐水中,制成10-3 菌悬液,混合均匀,依次作10倍逐级稀释,制成10-4、10-5、10-6、10-7菌悬液[10]。取适宜的3个稀释度的菌悬液100 μL涂布于牛肉膏蛋白胨琼脂培养基、PCA培养基上用于细菌菌落的培养和计数;涂布于孟加拉红培养基、PDA培养基上用于真菌菌落的培养和计数,每种培养基的每个稀释度都进行平行试验并做空白对照以确保准确性。对于细菌,37 ℃培养3 d,对于真菌,28 ℃培养3 d,计数菌落,结果表示为每克样品的菌落形成单位(colony-forming units,CFU)的对数(lg CFU/g)。另外,选取形态不同的菌落,进行划线分离纯化,并保藏于4 ℃冰箱备用。
1.3.2 菌落与菌体形态的观察
对分离纯化的菌落进行观察和描述;挑取纯化的菌落于载玻片上,在显微镜下观察菌体形态[10]。
1.3.3 微生物的分子生物学鉴定
1.3.3.1 DNA的提取
分别用细菌基因组DNA提取试剂盒、酵母基因组DNA提取试剂盒和植物基因组DNA提取试剂盒对分离纯化的细菌、酵母菌和霉菌DNA进行提取,提取步骤按试剂盒说明书进行。
1.3.3.2 PCR扩增及测序
PCR反应体系(25 μL):10×PCR Buffer 2.5 μL,dNTPs 2 μL,DNA模板1 μL,Taq酶0.3 μL,(细菌:27F;真菌:ITS1)上游引物1 μL,(细菌:1492R;真菌:ITS4)下游引物 1 μL,用ddH2O 补至25 μL[11-12];
细菌反应条件:95 ℃预变性3 min,95 ℃变性 45 s,50 ℃退火 30 s,72 ℃延伸 35 s(35次循环),最后72 ℃延伸5 min[13]。
真菌反应条件:95 ℃预变性3 min,95 ℃变性45 s,53 ℃退火 30 s,72 ℃延伸45 s(35次循环),最后72 ℃延伸8 min[14]。
PCR扩增产物使用1%琼脂糖凝胶电泳检测,120 V,20 min,恒压对PCR产物进行电泳[15],并在凝胶成像系统下观察,照相分析。
将PCR产物送生工生物工程(上海)股份有限公司进行纯化和测序。
1.3.3.3 序列分析
测序结果在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)nucleotide中进行Blast比对分析;另外,用ContigExpress软件对序列进行拼接及人工校正,生成Fasta格式文件,利用Mega 7软件按照Neighbor-Joining法聚类构建系统发育树。
1.3.4 优良细菌、霉菌菌株的筛选
1.3.4.1 初筛
用无菌牙签蘸取平板上的菌株点接于产糖化酶初筛培养基上,霉菌,28 ℃培养72 h;细菌,37 ℃培养48 h;测量菌落直径D,向培养皿中加入4 mL稀碘液,5 min后,测量透明圈直径d,选择比值d/D较大的菌株点接于产蛋白酶初筛培养基上,测量细菌菌落直径D和透明圈直径d,选择比值d/D较大的菌株进行复筛[16]。
1.3.4.2 复筛
(1)霉菌孢子悬浮液的制备:于活化的菌株斜面倒入10 mL的无菌生理盐水,用接种针刮下斜面上孢子,将试管中的孢子打散混匀,用血球计数板计数,并稀释孢子数至106个/mL左右[17]。
(2)细菌种子液的制备:挑取1环细菌接种于营养肉汤培养基中,37 ℃、180 r/min,培养12 h[18]。
(3)接种培养:种子液/悬浮液按10% 的接种量接入麸皮培养基,混匀,细菌,37 ℃培养3 d(每天摇瓶2次);霉菌,28 ℃培养72 h,进行扣瓶,继续培养至6 d。于鼓风干燥箱内,40 ℃烘干12 h,备用[19-20]。
(4)按照QB/T 4257—2011测定麸曲的糖化力、液化力,按照GB/T 23527—2009测定蛋白酶活力。
2 结果与分析
2.1 可培养微生物计数
将收集的西藏青稞小曲样品通过稀释涂布培养,选取菌落数在30~300 CFU的平板计数可培养微生物总数,结果如表2所示。
表2 青稞小曲中可培养微生物计数结果
Table 2 Results of culturable microbial counts in highland barley Xiaoqu
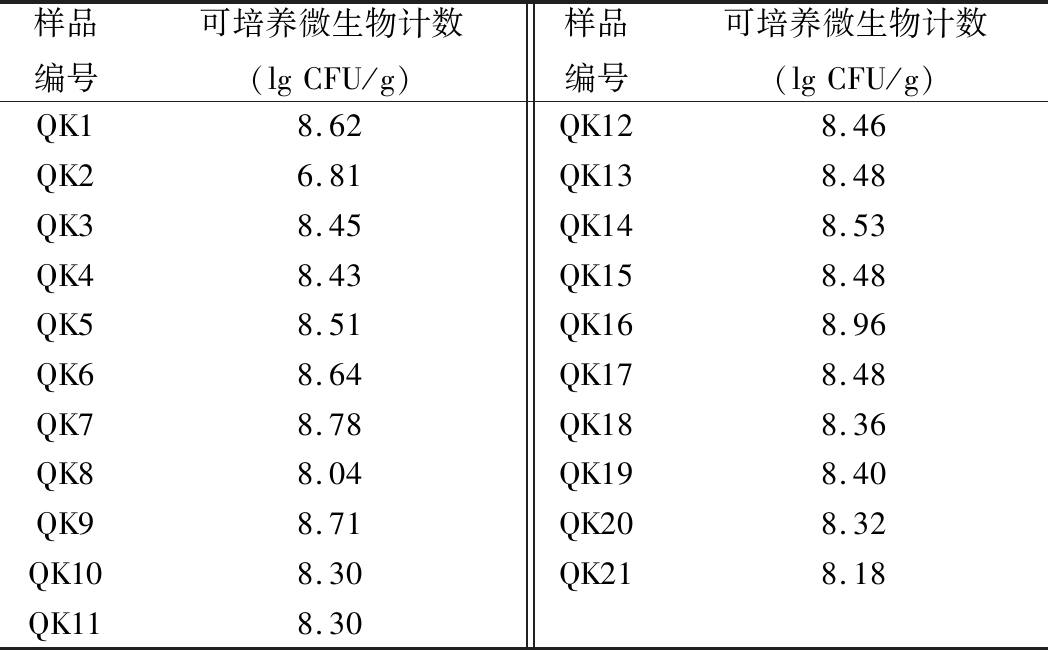
样品编号可培养微生物计数(lgCFU/g)样品编号可培养微生物计数(lgCFU/g)QK18.62QK128.46QK26.81QK138.48QK38.45QK148.53QK48.43QK158.48QK58.51QK168.96QK68.64QK178.48QK78.78QK188.36QK88.04QK198.40QK98.71QK208.32QK108.30QK218.18QK118.30
由表2可知,除了QK2外,其他青稞小曲的可培养微生物数均在108 CFU/g左右,而湖北、安徽和四川地区小曲以及贵州黄酒酒曲和麦曲中可培养微生物数为106~107 CFU/g左右[21-22],表明青稞小曲样品中的可培养微生物数量较多。
2.2 微生物的分离纯化结果
选取涂布培养的平板上不同形态的菌落,通过划线分离得到单一菌落。菌落形态如图1所示。
图1分别为酵母菌(a)、霉菌(b)和细菌(c)分离纯化后的形态,其中,酵母菌比细菌菌落形态大,圆形,菌落呈白色,湿润,菌落质地均匀,易挑取,有酒香味;霉菌菌落形态大,呈绒毛状,菌落为黑白相间,质地疏松,干燥,菌落正面与反面的颜色不一致;细菌菌落形态小,隆起圆,菌落呈白色,表面光滑黏稠,易挑取,有酸败味。另外,经传统的分离纯化培养法自西藏青稞小曲21个样品中共分离纯化得到优势微生物278株。
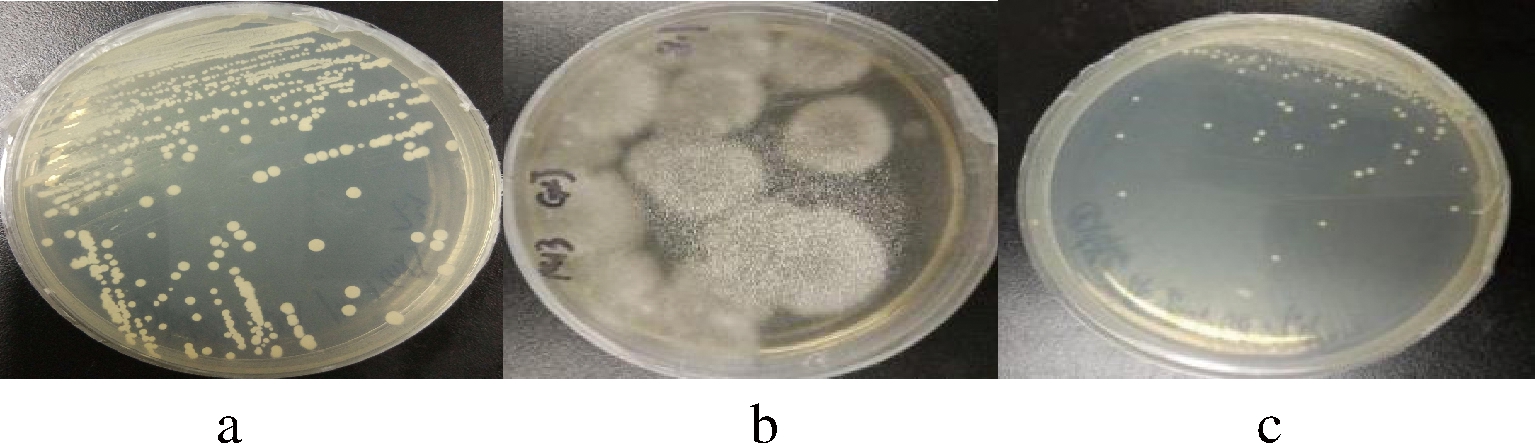
a-酵母菌;b-霉菌;c-细菌
图1 部分微生物的菌落形态
Fig.1 Colony morphology of partial microorganisms
2.3 菌落分子生物学鉴定结果及系统发育分析
通过对纯菌株的菌落和菌体形态的观察,挑选出57个单菌落进行鉴定。使用相应的试剂盒提取纯菌株的DNA,再进行PCR扩增,扩增产物通过琼脂糖凝胶电泳和紫外检测后,将电泳条带较清晰、符合真菌(500~750 bp)或细菌的条带长度(1 500~2 000 bp)的菌株送检测序,图2为部分菌株琼脂糖凝胶电泳图;然后对测序序列进行拼接及人工校正,再利用Mega 7和邻接法对测序菌株构建系统发育树,见图3。
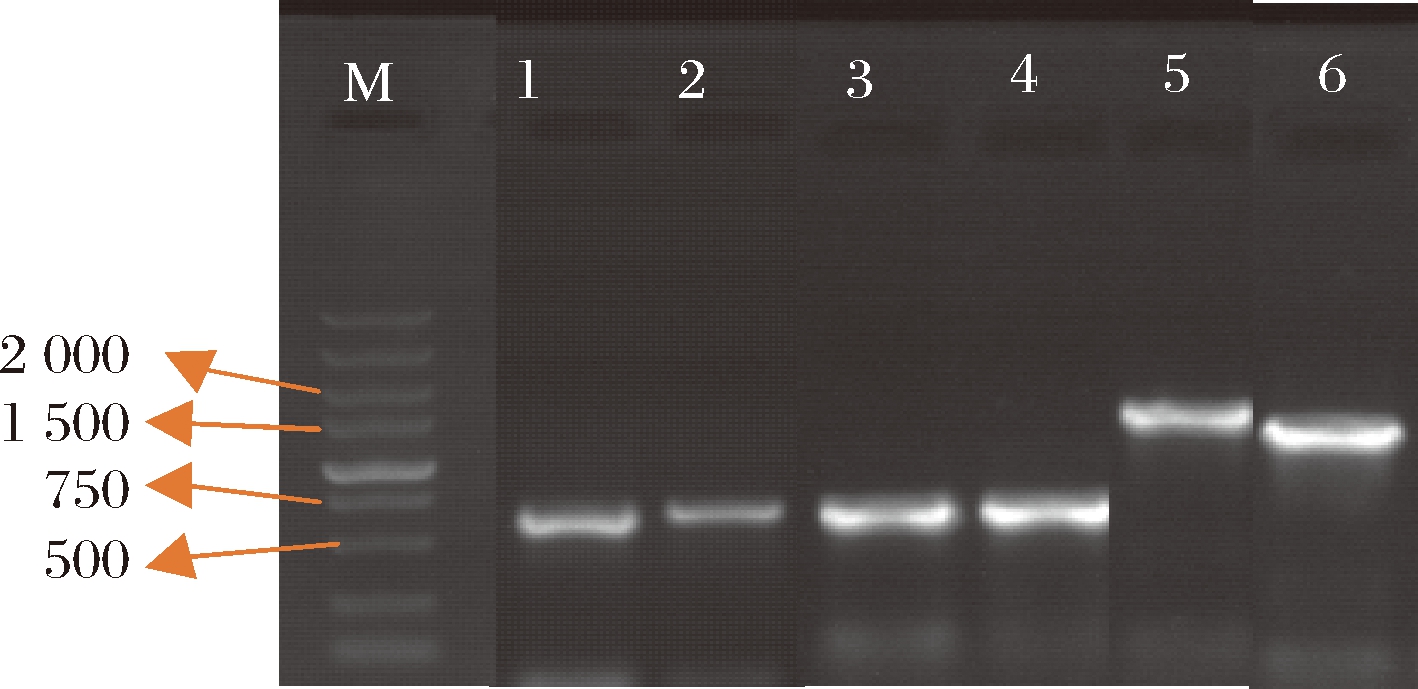
M-DL5000 DNA marker;1,2,3,4,5和6分别代表霉菌M6和M12、酵母菌J1和J2以及细菌Q11和Q12
图2 部分菌株的16S rRNA(细菌)和ITS基因(真菌)PCR产物的琼脂糖凝胶电泳
Fig.2 Agarose gel electrophoresis of PCR products of 16S rRNA (bacteria) and ITS gene (fungi) from partial strains
图2显示,所扩增的目的片段电泳条带较清晰,真菌条带大小约为600 bp,符合真菌的条带长度,细菌条带大小约为1 500 bp,符合细菌的条带长度,送检测序,并将结果通过NCBI nucleotide中进行Blast比对分析,鉴定结果如表3所示。
由表3可知,从青稞小曲中分离出的优势细菌分别是蜡样芽孢杆菌、沙福芽孢杆菌、短小芽孢杆菌、苏云金芽孢杆菌、解淀粉芽孢杆菌和Kocuria marina;真菌分别为扣囊复膜孢酵母、酿酒酵母、Saccharomycop-sis malanga、米根霉、Coriolopsis trogii、卷枝毛霉、总状毛霉、白囊耙齿菌、伞状毛霉菌、米曲霉、黄曲霉、黑曲霉和毛栓菌。研究结果表明,西藏青稞小曲中真菌多样性高于细菌,芽孢杆菌属、复膜孢酵母属和根霉属是青稞小曲中的主要菌群。另外,湖北、安徽和四川地区小曲中均含有芽孢杆菌[21],其也是低温大曲和高温大曲中的优势菌[23-24]。说明芽孢杆菌对于酒曲的稳定和酒风味物质的产生具有很大的作用。CAI等研究结果表明根霉菌是中国甜米酒发酵剂中的优势菌,并对酿造过程中的淀粉水解具有重要作用[25];CHI等发现扣囊复膜酵母能够分泌大量的淀粉酶、酸性蛋白酶和β -葡萄糖苷酶,在发酵行业具有很高的潜在利用价值[26]。因此,青稞小曲中筛选的优势菌属为优化制曲工艺提供了研究基础。
表3 青稞小曲中微生物鉴定结果
Table 3 Identification results of microbes in highland barley Xiaoqu
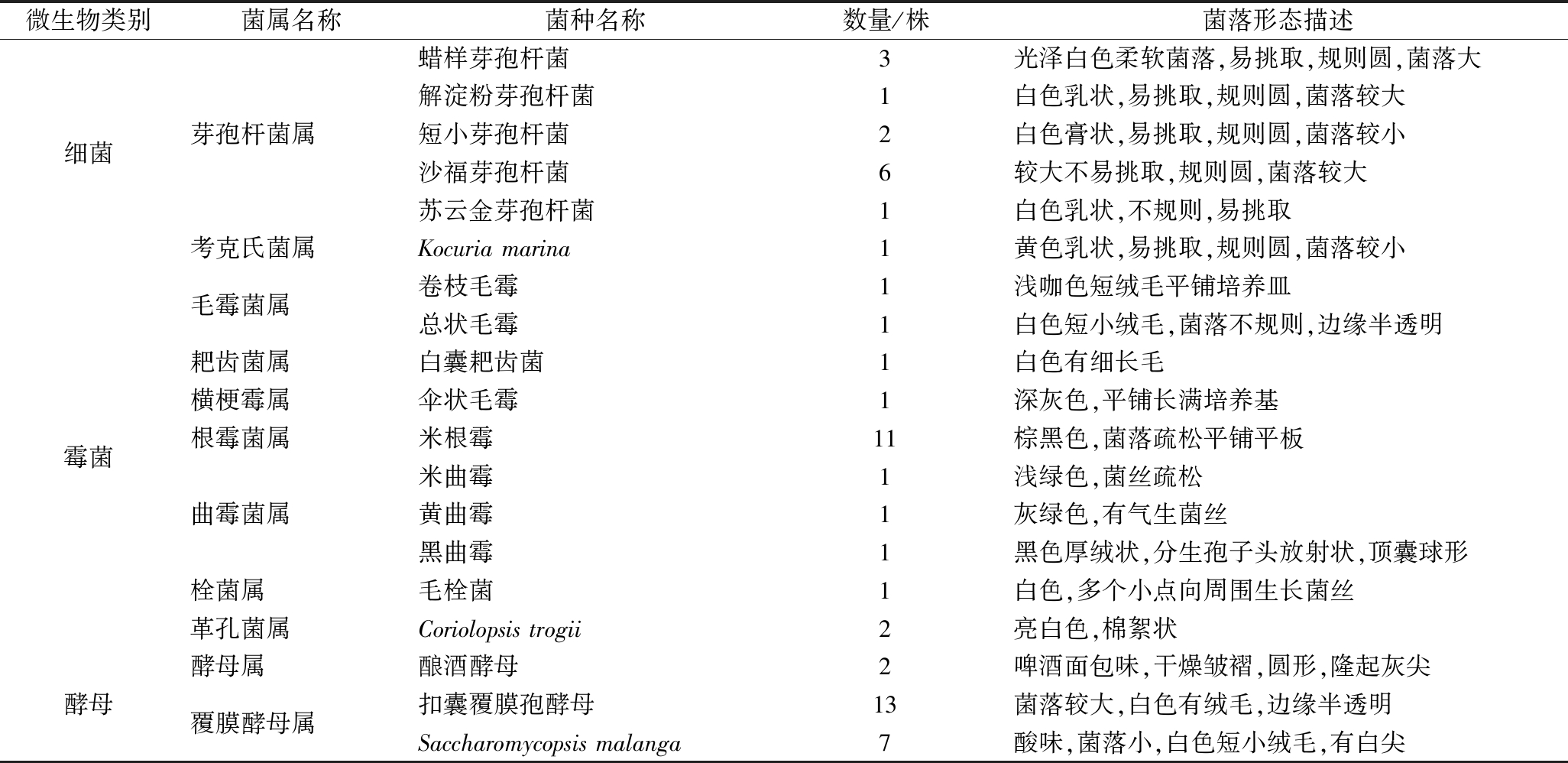
微生物类别菌属名称菌种名称数量/株菌落形态描述细菌霉菌酵母芽孢杆菌属考克氏菌属毛霉菌属耙齿菌属横梗霉属根霉菌属曲霉菌属栓菌属革孔菌属酵母属覆膜酵母属蜡样芽孢杆菌3光泽白色柔软菌落,易挑取,规则圆,菌落大解淀粉芽孢杆菌1白色乳状,易挑取,规则圆,菌落较大短小芽孢杆菌2白色膏状,易挑取,规则圆,菌落较小沙福芽孢杆菌6较大不易挑取,规则圆,菌落较大苏云金芽孢杆菌1白色乳状,不规则,易挑取Kocuriamarina1黄色乳状,易挑取,规则圆,菌落较小卷枝毛霉1浅咖色短绒毛平铺培养皿总状毛霉1白色短小绒毛,菌落不规则,边缘半透明白囊耙齿菌1白色有细长毛伞状毛霉1深灰色,平铺长满培养基米根霉11棕黑色,菌落疏松平铺平板米曲霉1浅绿色,菌丝疏松黄曲霉1灰绿色,有气生菌丝黑曲霉1黑色厚绒状,分生孢子头放射状,顶囊球形毛栓菌1白色,多个小点向周围生长菌丝Coriolopsistrogii2亮白色,棉絮状酿酒酵母2啤酒面包味,干燥皱褶,圆形,隆起灰尖扣囊覆膜孢酵母13菌落较大,白色有绒毛,边缘半透明Saccharomycopsismalanga7酸味,菌落小,白色短小绒毛,有白尖
由图3可知,菌株M16和M23、X1和X2、J5和J8、M3和M9、QJ2和QJ3遗传距离较近,表明亲缘关系较近,而其他菌株的遗传距离较远,则菌属差异较大,另外,系统发育树结果表明了青稞小曲中微生物的多样性。
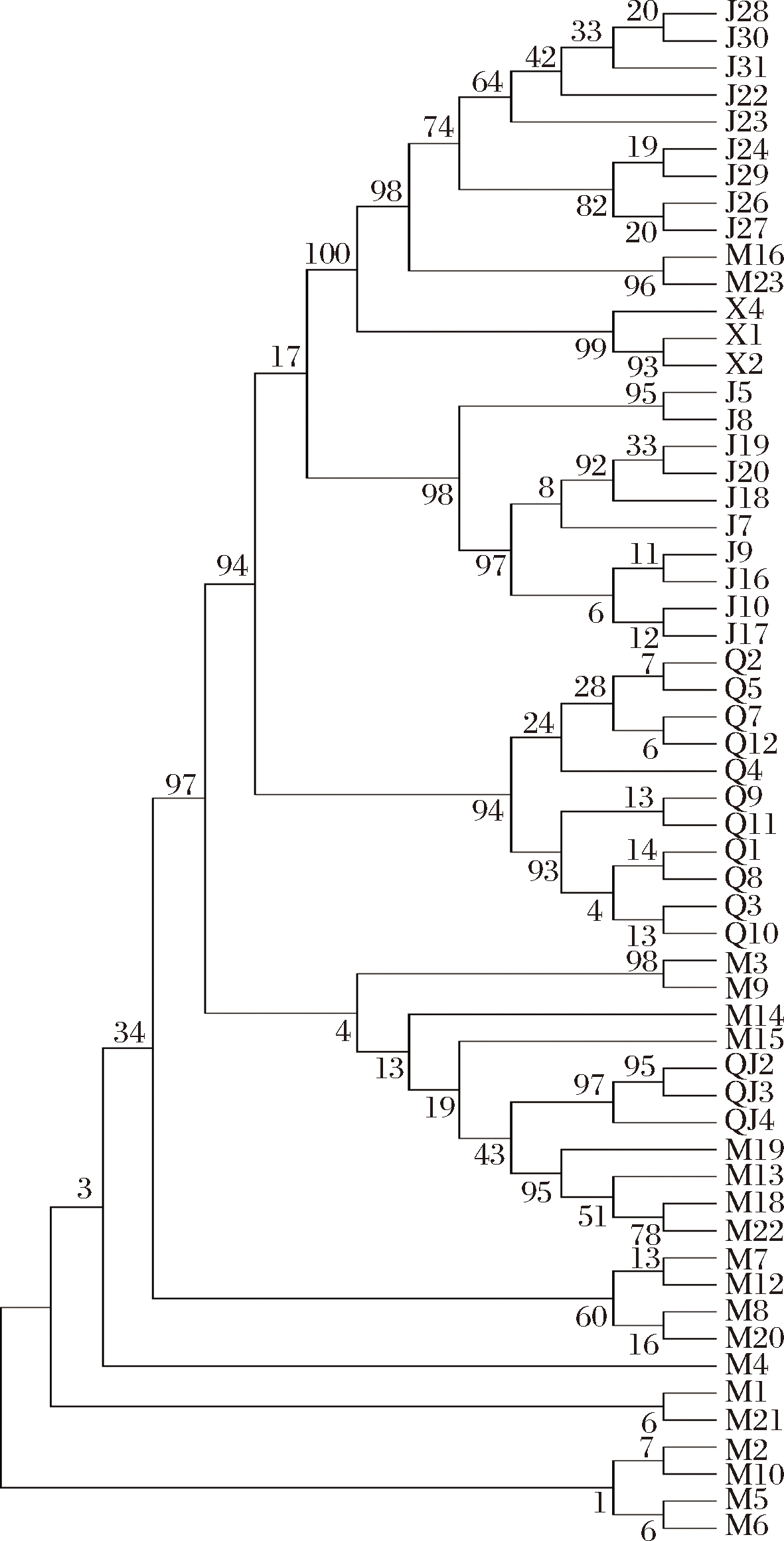
图3 西藏青稞小曲中微生物的系统发育树
Fig.3 Phylogenetic tree for microbials in highland barley Xiaoqu
2.4 优良微生物的筛选
2.4.1 优良霉菌菌株的初筛
2.4.1.1 产糖化酶霉菌菌株的初筛
小曲中的霉菌主要起糖化作用,将原料中的淀粉转化成还原糖用于其他微生物生长利用,本研究通过在含有可溶性淀粉的筛选培养基中培养分解淀粉的霉菌菌株,利用淀粉遇碘变蓝的原理[27],快速初筛得到糖化力较强的霉菌菌株,糖化透明圈如图4所示,产糖化酶菌株初筛结果如表4所示。
表4 霉菌产糖化酶菌株初筛结果
Table 4 Preliminary screening results of producing saccharification enzyme of molds
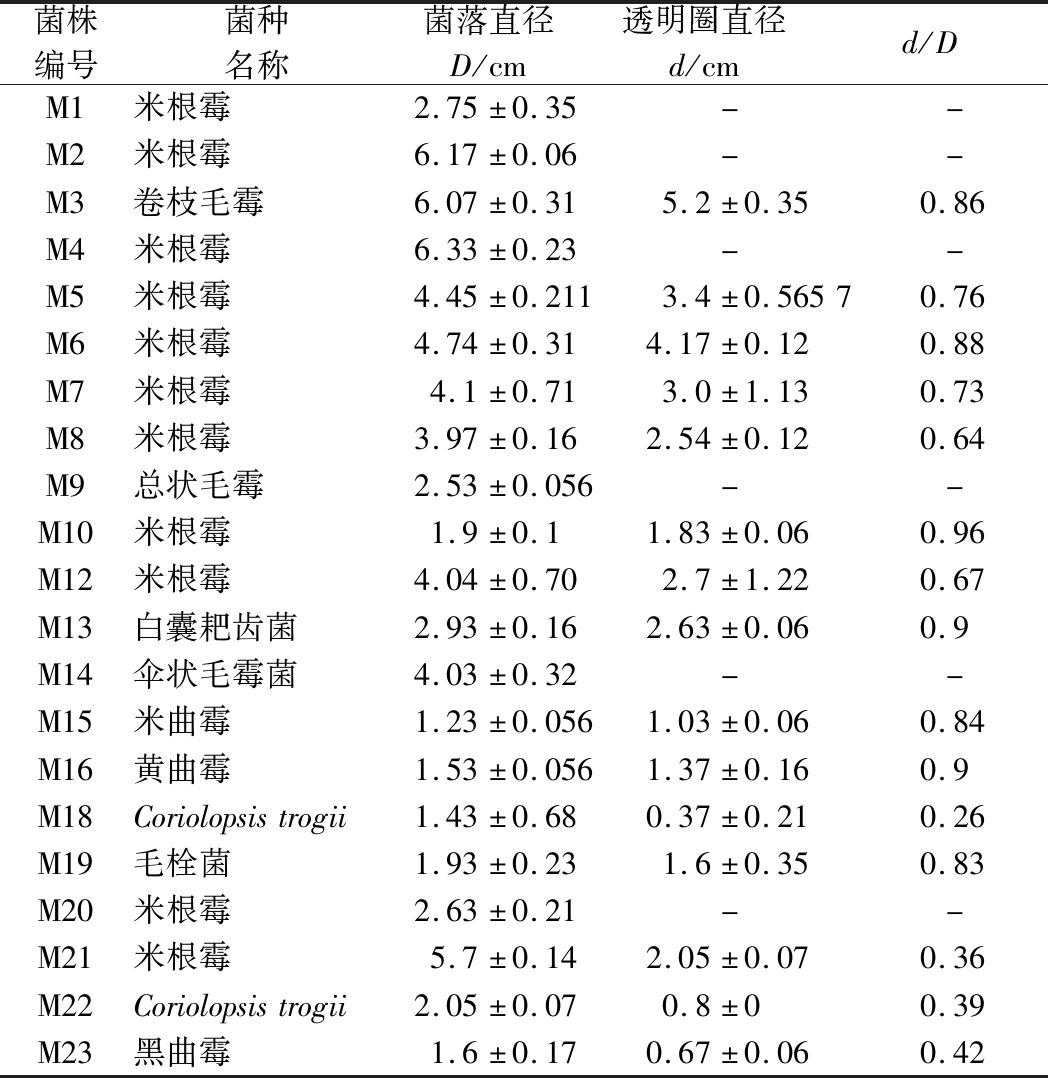
菌株编号菌种名称菌落直径D/cm透明圈直径d/cmd/DM1米根霉2.75±0.35--M2米根霉6.17±0.06--M3卷枝毛霉6.07±0.315.2±0.350.86M4米根霉6.33±0.23--M5米根霉4.45±0.2113.4±0.56570.76M6米根霉4.74±0.314.17±0.120.88M7米根霉4.1±0.713.0±1.130.73M8米根霉3.97±0.162.54±0.120.64M9总状毛霉2.53±0.056--M10米根霉1.9±0.11.83±0.060.96M12米根霉4.04±0.702.7±1.220.67M13白囊耙齿菌2.93±0.162.63±0.060.9M14伞状毛霉菌4.03±0.32--M15米曲霉1.23±0.0561.03±0.060.84M16黄曲霉1.53±0.0561.37±0.160.9M18Coriolopsistrogii1.43±0.680.37±0.210.26M19毛栓菌1.93±0.231.6±0.350.83M20米根霉2.63±0.21--M21米根霉5.7±0.142.05±0.070.36M22Coriolopsistrogii2.05±0.070.8±00.39M23黑曲霉1.6±0.170.67±0.060.42
注:“-”表示未有透明菌产生。下同。
糖化酶初筛培养基中以可溶性淀粉为唯一碳源,以碘作为显色剂,平板中透明圈越大说明淀粉被糖化酶分解的越多,糖化酶活力越高,反之,越低。从表4中可以看出,霉菌菌株M1、M2、M4、M9、M14和M20未出现糖化透明圈,菌株M18、M21、M22和M23的d/D比值较小,而M3、M5、M6、M7、M8、M10、M12、M13、M15、M16和M19是相对糖化透明圈较大的11株霉菌菌株,表明这些菌株的糖化酶活力较高,所以,选取这11株菌进行产蛋白酶菌株初筛。
2.4.1.2 产蛋白酶霉菌菌株的初筛
研究表明,酒中的高级醇,主要来源于蛋白酶分解蛋白质所生成的氨基酸,另外,酒中的高级醇及其派生出来的酸、醛、酮和酯等,都是酒香气的重要组分[9]。
所以,本研究通过在含有脱脂奶粉的筛选培养基中培养分解蛋白质的霉菌菌株,初筛得到糖化力较强且蛋白酶活力较强的霉菌菌株,产蛋白酶透明圈如图4所示,产蛋白酶菌株初筛结果如表5所示。
蛋白酶初筛培养基中以脱脂奶粉为氮源,平板中透明圈越大说明脱脂奶粉被蛋白酶酶分解的越多,蛋白酶活力越高,反之,越低。由表5可得,除了霉菌菌株M5和M10无透明圈产生,其他菌株均有产蛋白酶的透明圈,本实验拟筛选发酵性能优良的菌株。因此,选取糖化酶活力和蛋白酶活力都较高的菌株M3、M6、M7、M8、M12、M13、M15、M16和M19进行优良霉菌菌株复筛。
表5 霉菌产蛋白酶菌株初筛结果
Table 5 Preliminary screening results of producing protease of molds
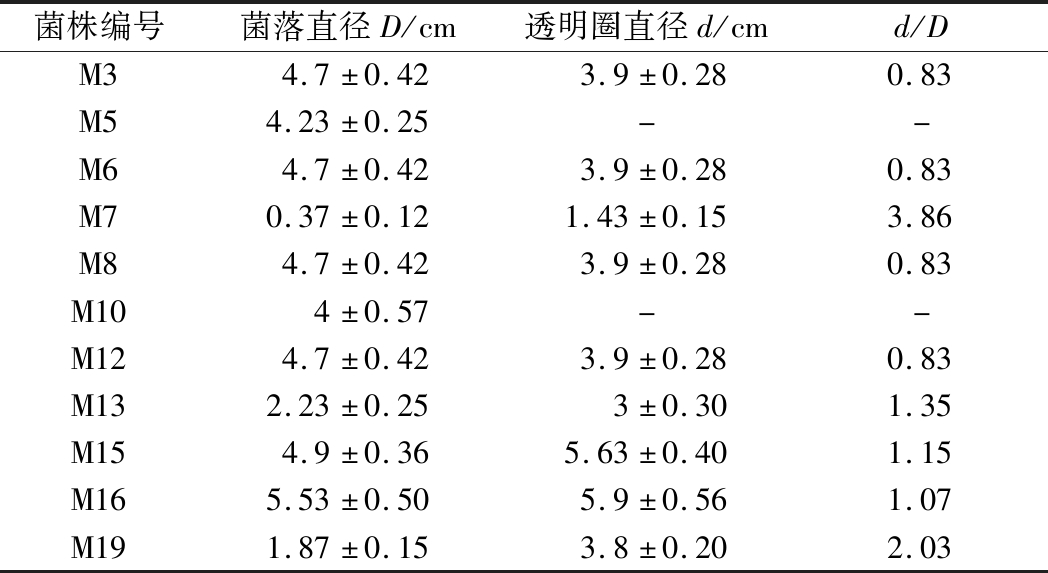
菌株编号菌落直径D/cm透明圈直径d/cmd/DM34.7±0.423.9±0.280.83M54.23±0.25- -M64.7±0.423.9±0.280.83M70.37±0.121.43±0.153.86M84.7±0.423.9±0.280.83M104±0.57- -M124.7±0.423.9±0.280.83M132.23±0.253±0.301.35M154.9±0.365.63±0.401.15M165.53±0.505.9±0.561.07M191.87±0.153.8±0.202.03
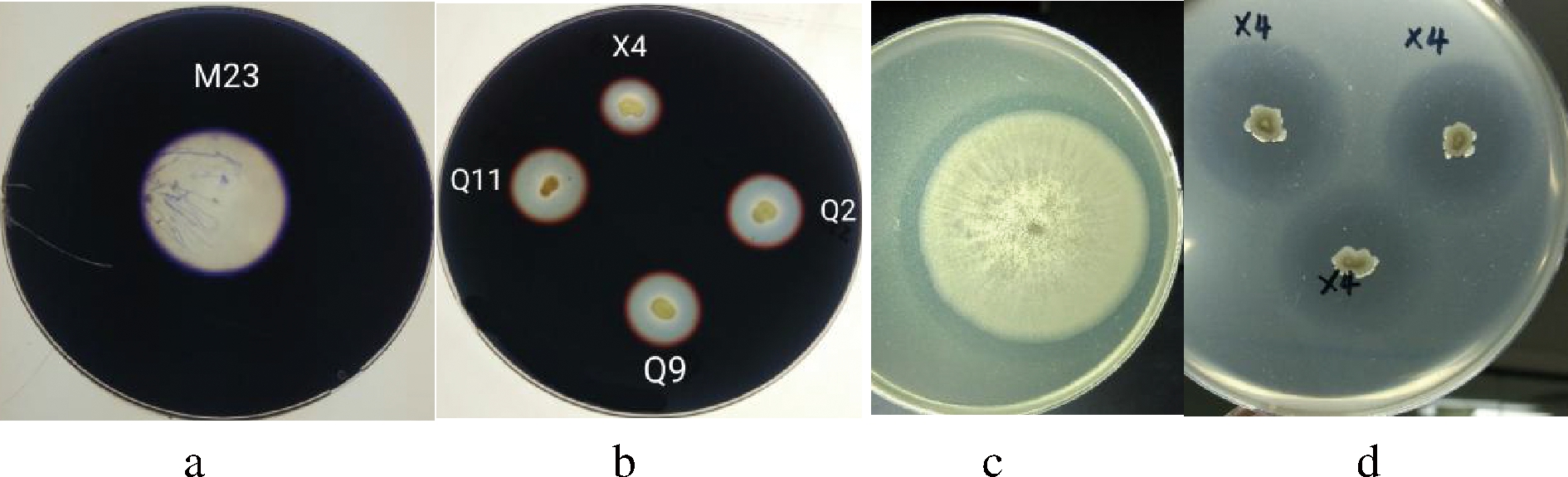
a-霉菌糖化透明圈;b-细菌糖化透明圈;c-霉菌产蛋白酶透明圈;d-细菌产蛋白酶透明圈
图4 部分微生物糖化和产蛋白酶透明圈
Fig.4 Transparent circles of saccharification and protease-producing of partial microorganisms
2.4.2 优良霉菌菌株的复筛
将初筛得到的9株霉菌菌株分别制成麸曲,测定霉菌麸曲具体的糖化力、液化力和蛋白酶活力值。
2.4.2.1 糖化力的测定
糖化酶可从淀粉的非还原性末端开始依次水解α - 1,4 -葡萄糖苷键产生葡萄糖,常应用于微生物发酵中。在35 ℃、pH 4.6条件下,1 g曲1 h转化可溶性淀粉生成葡萄糖的质量,用费林试剂测定所生成的葡萄糖量,即为糖化力。结果如图5所示。
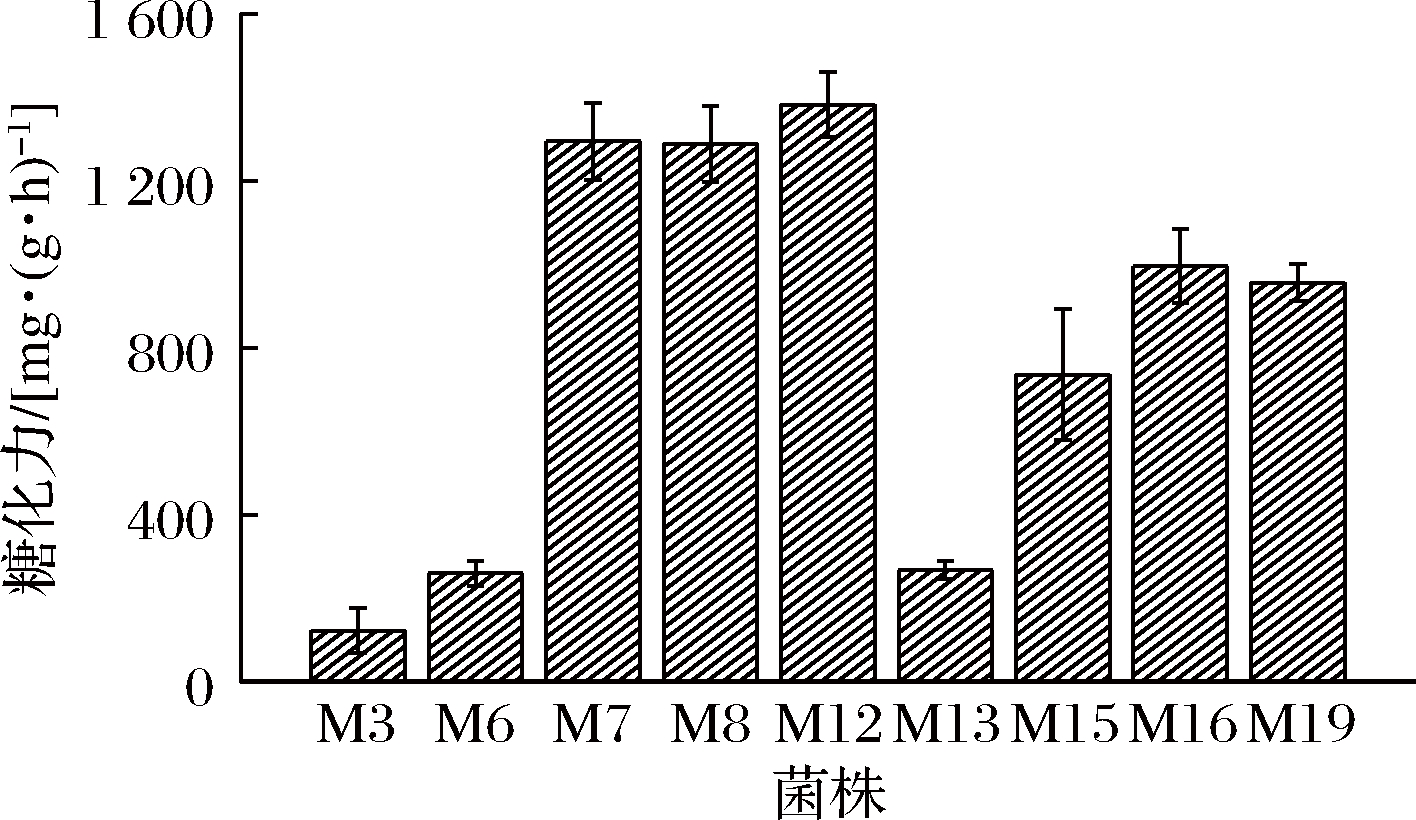
图5 9株霉菌糖化力测定结果
Fig.5 Determination results of saccharifying power of 9 molds
青稞小曲作为发酵青稞酒的糖化、发酵和生香剂,对酒体品质影响极大。糖化力是评价酒曲质量的重要指标之一,糖化力较高有利于对原料的充分利用且有利于提高出酒率。从图5中可以看出,菌株M12、M7、M8和M19糖化力较高,糖化力分别为(1 382±77.38)、(1 294±91.85)、(1 288±89.8)、(1 055 ±48.88)mg/(g·h),其他5株霉菌糖化力均低于1 000 mg/(g·h),其中M3最低,糖化力为124±54.11 mg/(g·h)。
2.4.2.2 液化力的测定
液化酶能使淀粉由高分子状态(淀粉颗粒)转变为较低分子状态(糊精),在酒发酵过程中尤为重要。而在35 ℃、pH 4.6条件下,1 g曲酶解1 h至试液对碘的蓝紫色特征反应消失,根据所需时间可以计算液化的淀粉质量,即为液化力。结果如图6所示。

图6 9株霉菌液化力测定结果
Fig.6 Determination results of liquefying power of 9 molds
从图6中可以看出,M16液化力最高,达到(4.65±0.25)g/(g·h),其次为M15、M19、M7、M12,液化力分别为(1.85±0.07)、(1.78±0.01)、(1.6±0.05)、(1.39±0.05)g/(g·h),其他菌株的液化力均小于1 g/(g·h),液化力较高的青稞小曲可以促进对酿酒原料的利用率。
2.4.2.3 蛋白酶活力的测定
蛋白酶能够水解原料中的蛋白质,增加碳源和氨基酸,加速其他微生物生长和风味氨基酸的产生[28],由于酿酒过程中,pH值处于中性或者酸性环境中,所以,利用L-酪氨酸制作标准曲线,采用Folin-酚法[29]测定霉菌麸曲的中性和酸性蛋白酶活力。结果如图7、图8所示。
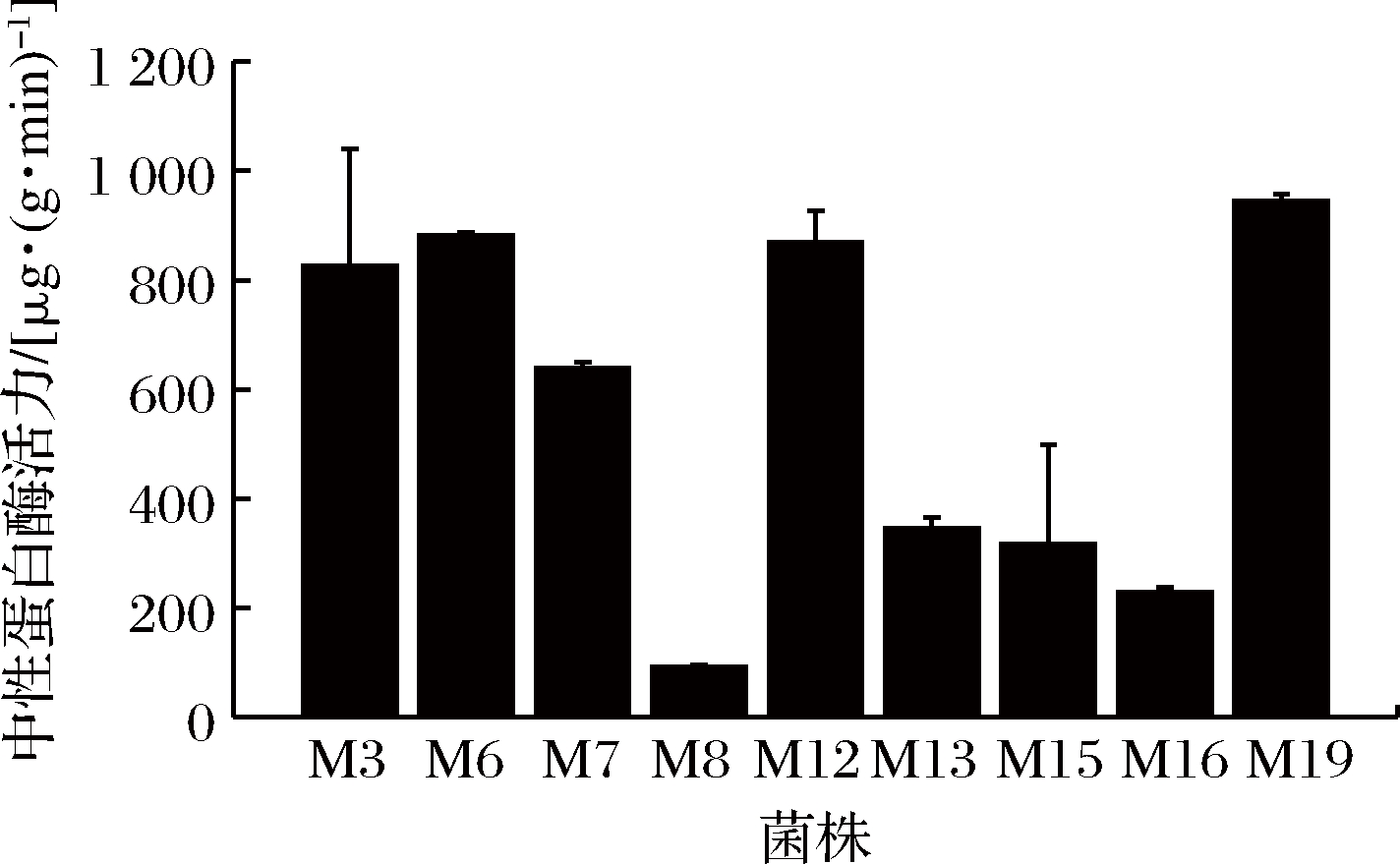
图7 9株霉菌中性蛋白酶活力测定结果
Fig.7 Determination results of neutral protease activity of 9 molds
蛋白酶活力主要的作用是降解原料中的蛋白质,从而分解为风味氨基酸等,促成青稞酒终产品的风味。从图7中可以看出,除了菌株M8、M16、M15和M13中性蛋白酶活力较低外,其他菌株中性蛋白酶活力都比较高,其中,菌株M19、M6、M12、M3均高于800 μg/(g·min),中性蛋白酶活力分别为(944.51±13.49)、(881.82±6.36)、(869.87±56.75)、(826.88±213.9)μg/(g·min)。

图8 9株霉菌酸性蛋白酶活力测定结果
Fig.8 Determination results of acid protease activity of 9 molds
由图8可知,M13、M6、M3、M19、M12的酸性蛋白酶活力较高,分别为(531.85±3.09)、(285.33±5.38)、(174.19±49.41)、(158.31±57.51)、(81.02±20.68)μg/(g·min),其他菌株均低于50 μg/(g·min)。结合糖化力、液化力和蛋白酶活力的测定结果,再加上霉菌在发酵过程中主要起糖化作用,M12糖化酶活力最高,为(1 382±77.38)mg/(g·h),其他酶活力较强,所以,发酵性能优良且适用于发酵的菌株是M12。
2.4.3 优良细菌菌株初筛
2.4.3.1 产糖化酶细菌菌株的初筛
研究表明,酒在糖化过程中的优势细菌通过环境诱导可产生耐高温淀粉酶菌,有利于青稞酒的酿造生产[30],所以,本研究通过糖化透明圈对细菌中产糖化酶菌株进行了初筛,细菌糖化透明圈如图4所示,结果如表6所示。由表6可知,细菌菌株X1、X2、Q3、Q5和Q8无糖化透明圈产生,选择产生透明圈的菌株Q1、Q2、Q4、Q7、Q9、Q10、Q11、Q12和X4进行产蛋白酶菌株初筛,而且由表4和表6可得,可能是由于霉菌菌丝较发达,所以,细菌相对透明圈高于霉菌。
表6 细菌产糖化酶菌株初筛结果
Table 6 Preliminary screening results of saccharification enzyme producing bacteria
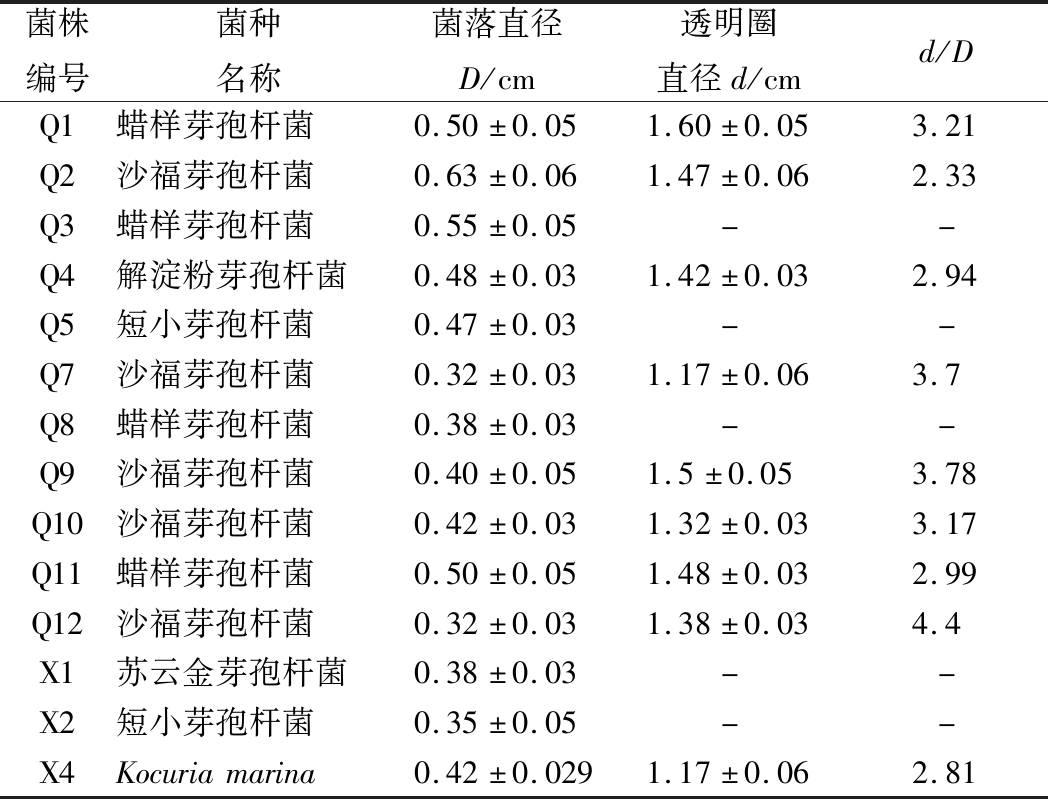
菌株编号菌种名称菌落直径D/cm透明圈直径d/cmd/DQ1蜡样芽孢杆菌0.50±0.051.60±0.053.21Q2沙福芽孢杆菌0.63±0.061.47±0.062.33Q3蜡样芽孢杆菌0.55±0.05--Q4解淀粉芽孢杆菌0.48±0.031.42±0.032.94Q5短小芽孢杆菌0.47±0.03--Q7沙福芽孢杆菌0.32±0.031.17±0.063.7Q8蜡样芽孢杆菌0.38±0.03--Q9沙福芽孢杆菌0.40±0.051.5±0.053.78Q10沙福芽孢杆菌0.42±0.031.32±0.033.17Q11蜡样芽孢杆菌0.50±0.051.48±0.032.99Q12沙福芽孢杆菌0.32±0.031.38±0.034.4X1苏云金芽孢杆菌0.38±0.03--X2短小芽孢杆菌0.35±0.05--X4Kocuriamarina0.42±0.0291.17±0.062.81
2.4.3.2 产蛋白酶细菌菌株的初筛
通过产蛋白酶透明圈试验,初筛得到糖化力较强且蛋白酶活力较强的细菌菌株,细菌产蛋白酶透明圈如图4所示,产蛋白酶菌株初筛结果如表7所示。
表7 细菌产蛋白酶菌株初筛结果
Table 7 Preliminary screening results of protease producing bacteria
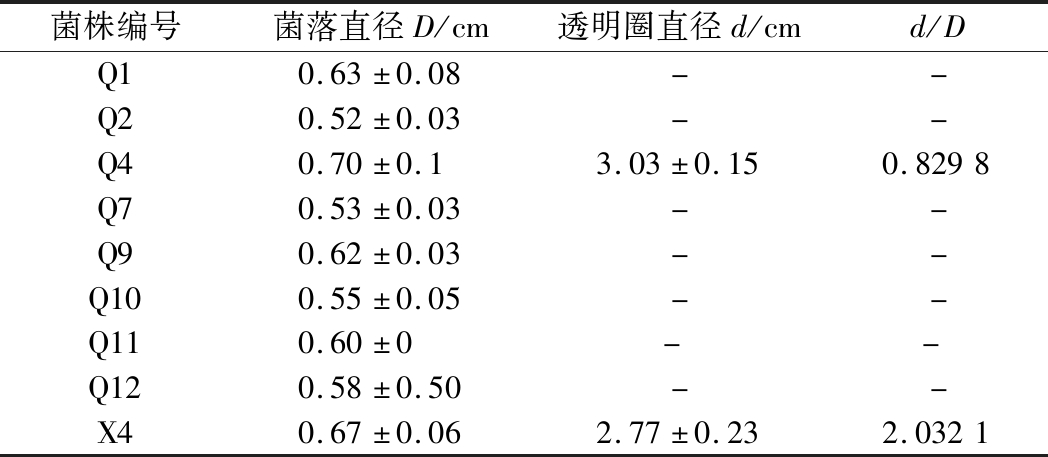
菌株编号菌落直径D/cm透明圈直径d/cmd/DQ10.63±0.08--Q20.52±0.03--Q40.70±0.13.03±0.150.8298Q70.53±0.03--Q90.62±0.03--Q100.55±0.05--Q110.60±0 - -Q120.58±0.50--X40.67±0.062.77±0.232.0321
由表7可知,产生糖化透明圈的细菌菌株中,只有X4和Q4产生蛋白酶筛选透明圈,说明没有蛋白酶活力,或蛋白酶活力较低,所以选择X4和Q4进行优良细菌菌株复筛。
2.4.4 优良细菌菌株复筛
由于细菌在青稞酒发酵过程中主要是产香类物质的作用,所以本研究将初筛得到的2株细菌菌株分别制成麸曲,只测定了细菌麸曲的蛋白酶活力,结果如表8所示。细菌菌株X4和Q4中性蛋白酶活力都较高,但是,菌株Q4略高于X4,且菌株Q4具有酸性蛋白酶活力,所以,发酵性能优良的细菌菌株是Q4。
表8 2株细菌酸性蛋白酶活力和中性蛋白酶活力测定结果
Table 8 Determination results of acid protease activity and neutral protease activity of 2 bacteria

菌株编号中性蛋白酶活力/[μg·(g·min)-1]酸性蛋白酶活力/[μg·(g·min)-1]Q41035.56±40.0910.66±0.12X4991.59±5.540
3 结论
本文通过传统培养法计数了西藏青稞小曲中可培养微生物,分离得到278株菌,其中细菌56株,真菌222株,通过形态学观察和分子生物学鉴定,将筛选出的57株菌鉴定为蜡样芽孢杆菌3株,沙福芽孢杆菌6株,短小芽孢杆菌2株,苏云金芽孢杆菌,解淀粉芽孢杆菌和Kocuria marina各1株;真菌分别为扣囊复膜孢酵母13株,酿酒酵母2株,S. malanga 七株,米根霉11株,C. trogii两株,卷枝毛霉、总状毛霉、白囊耙齿菌、伞状毛霉菌、米曲霉、黄曲霉菌、黑曲霉和毛栓菌各1株。研究结果表明,西藏青稞小曲中真菌多样性高于细菌,其优势菌属为芽孢杆菌属、复膜孢酵母属和根霉属。通过透明圈法初筛和制曲复筛,得到中性蛋白酶活力最高为(1 035.56±40.09)μg/(g·min),具有酸性蛋白酶活力的解淀粉芽孢杆菌1株以及糖化酶活力最高为(1 382±77.38)mg/(g·h),液化力、蛋白酶活力都较高的米根霉1株。
[1] 杜木英.西藏青稞酒发酵微生物及酿造技术研究[D].重庆:西南大学,2008.
[2] 王丽华.西藏传统青稞酒的生产菌株选育及生产技术研究[D].重庆:西南大学,2008.
[3] LIU Z B,WANG Z Y,LYU X C,et al. Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu, two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiology,2018,69:105-115.
[4] GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].Journal of the Institute of Brewing,2015,121(4):620-627.
[5] 郭小芳,王燕鸽,刘帅,等.西藏青稞酒曲中真菌的分离与鉴定[J].西藏大学学报(自然科学版),2014, 29(2):37-43.
[6] 李玉英,赵文娟,陈占秀,等.青稞酒生产工艺优化研究进展[J].酿酒,2018,45(5):50-52.
[7] ZHENG X W,YAN Z,HAN B Z,et al. Complex microbiota of a Chinese “Fen” liquor fermentation starter (Fen-Daqu), revealed by culture-dependent and culture-independent methods[J].Food Microbiology,2012,31(2):293-300.
[8] 刘杰雄,陈号,陆雯,等.淀粉酶高产菌株的筛选及其酶活的测定[J].食品工程,2010(1):45-47.
[9] 余培斌.改善绍兴黄酒麦曲品质的初步研究[D].无锡:江南大学,2013.
[10] 任清,侯昌.北宗黄酒麦曲微生物的分离鉴定[J].食品科学,2017,38(4):83-88.
[11] 翟磊,信春晖,许玲,等.芝麻香型白酒高温大曲产脂肪酶菌株的筛选与鉴定[J].食品与发酵工业,2015,41(12):36-39.
[12] 苏畅,窦晓,叶新,等.基于ITS4/5 rRNA区序列对不同时期大曲中霉菌的分离与鉴定[J].现代食品科技,2018,34(3):54-58.
[13] 毛祥,黄丹,沈才萍,等.酱香型大曲中产淀粉酶菌的分离鉴定及发酵特性研究[J].中国酿造,2015,34(12):24-27.
[14] 杜娟,艾小委,张乐怡,等.不同酒曲生料液态酿酒比较及优势真菌分离鉴定[J].蚌埠学院学报,2018,38(2):7-10.
[15] 王舸楠,马文瑞,全莉,等.酿酒葡萄DNA的提取方法[J].食品与发酵工业,2018,44(12):118-122.
[16] 刘茗铭,周阳子,袁乐梅,等.酒曲中高产糖化酶霉菌的筛选及其固态发酵产酶条件优化[J].食品与发酵工业,2018,44(10):118-123.
[17] 叶磊.小曲中优良根霉的分离筛选及产酶条件研究[D].重庆:西南大学,2009.
[18] 武顺,王德良,闫寅卓.产吡嗪类细菌的麸曲制作工艺优化[J].中国酿造,2016,35(2):13-17.
[19] 罗惠波,谢军,黄治国,等.纯种根霉麸曲制曲工艺优化研究[J].四川理工学院学报(自然科学版),2015,28(5):7-11.
[20] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998.
[21] 满都拉,刘昊,郑逸飞,等.不同地区小曲中可培养细菌的筛选及鉴定[J].中国酿造,2018,37(10):61-65.
[22] 梁香,吴天祥,敖锐,等.黄酒优良糖化菌株的筛选及其酶活性能的研究[J].酿酒科技,2015,249(3):12-15.
[23] ZHENG Xiaowei,YAN Zheng,NOUT M J,et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu, a Chinese industrial fermentation starter[J].International Journal of Food Microbiology,2014,182-183:57-62.
[24] WANG C L,SHI D J,GONG G L.Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J].World Journal of Microbiology and Biotechnology,2008,24(10):2 183-2 190.
[25] CAI H Y,ZHANG T,ZHANG Q,et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiology,2018,73:319-326.
[26] CHI Z M,CHI Z,LIU G L,et al.Saccharomycopsis fibuligera and its applications in biotechnology[J].Biotechnology Advances,2009,27(4):423-431.
[27] 王旭亮,王异静,王德良,等.白酒发酵高糖化性能霉菌的筛选及鉴定[J].酿酒科技,2012,219(9):22-28.
[28] 黄家驷,刘盾,陈玄阳,等.浓香型高温酒曲中蛋白酶产生菌的筛选与鉴定[J].安徽农学通报,2017,23(21):29-31.
[29] 张彩莹,肖连冬.生物化学实验[M].北京:化学工业出版社,2009:10-67.
[30] 张中义,畅晓霞,王琦.大曲酒糖化阶段一株优势细菌分离鉴定[J].中国酿造,2009,28(7):47-49.