乳酸菌是影响宿主健康的主要益生菌之一,有利于调节胃肠道平衡,具有抗氧化、抗炎和抗癌等作用[1]。高发酵及抗氧化能力的乳酸菌不仅能提升酸奶制作效率,还有助于提升酸奶的抗氧化能力,在食品工业方面可以改善食品品质、延长保质期、增加功能特性[2-3]。依据哈曼的衰老自由基理论(free radical theory of aging, FRTA),机体氧化应激和老化密切相关,通过减少氧化损伤可延长寿命[4-5],合成抗氧化剂已被广泛用于延缓食品脂质氧化,但由于对人体肝损伤和致癌等有副作用,使其安全性受到质疑[6]。寻找天然与高性价比的食品抗氧化剂以保护细胞免受ROS的影响显得极其重要[7]。发酵乳品是我国农牧区的传统食物,从传统发酵食品中分离高发酵及高抗氧化能力的乳酸菌株在国内外已有较多的研究。DING等[8]从西藏牦牛酸奶中筛选出的德氏乳杆菌(Lactobacillus delbrueckii)F17,具有较强的抗氧化能力与耐胆盐能力,整体可提高食品的抗氧化能力。SHAKIBAIE等[9]从伊朗传统乳制品中分离的短乳杆菌Lse,具有良好的益生和抗氧化能力。乳酸菌不仅具有降解亚硝酸以保护食品的作用[10],而且产生的胞外多糖具有优良的抗氧化性能[11]。
有研究将乳酸菌的抗氧化性能归因于传统食物的发酵过程[12],而从自然发酵牦牛乳中分离到的乳酸菌株的抗氧化特性尚未得到重视。在强烈紫外线辐射的条件下,菌株具备承受氧化应激的能力[8]。因此,从高原牦牛酸奶中筛选出高发酵及抗氧化活性的乳酸菌菌株有十分重要的意义。
本研究通过对甘南地区传统发酵牦牛酸奶中高发酵及抗氧化能力的乳酸菌株的筛选,得到了1株发酵能力强、菌体抗氧化活性高的副干酪乳杆菌M5,这对开发我国西部传统牦牛牧区的天然乳酸菌种资源、生产功能性乳制品和提高乳品附加值,具有一定的实用和参考价值。
1.1.1 样品采集
在甘南州合作市佐盖曼玛乡不同区域,采集4份传统发酵牦牛酸奶。采用无菌注射器吸取样品,并放进灭菌后的玻璃瓶内,密封存放于低温采样箱中,24 h之内运送回实验室。
1.1.2 试剂
1,1-二苯基-2-三硝基苯肼(DPPH),Solarbio;邻菲啰啉、邻苯二酚紫、邻苯三酚,天津市光复精细化工研究所;MRS、BCP、YPD和MEA培养基采用的各种原料均符合国标。
LX-B35 高压灭菌锅,深圳市佳博特试验设备有限公司;JJ-CJ-2FD超净工作台,吴江市净化设备总厂;TGL-20 高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;JY92-IIDN超声波细胞粉碎机,宁波新芝生物科技服务有限公司。
1.3.1 乳酸菌的分离纯化
参照刘慧[13]方法,在无菌条件下,取25 mL样品,加入到含有225 mL无菌水的三角瓶中(含玻璃珠),振荡摇匀后进行10倍梯度稀释,涂布于MRS(含有质量分数为0.5%CaCO3)固体培养基中,于37 ℃下培养24 h。挑选出不同形状并具有溶钙圈的菌落接种于BCP培养基中,挑选能使BCP培养基由紫变黄的菌落,于MRS培养基上反复划线分离纯化为单菌落。
1.3.2 乳酸菌革兰氏染色、过氧化氢酶试验和产乳酸定性试验[14]
将纯化后的菌株进行革兰氏染色和H2O2(3%)触酶试验,选择革兰氏阳性、H2O2酶阴性试验的菌株接种于MRS液体培养基中,于37 ℃培养24 h,菌悬液经4 000 r/min离心取上清液,采用纸层析法进行产乳酸的定性试验。
1.3.3 筛选具有高过氧化氢耐受能力乳酸菌
参照王桢等[15]方法,将产乳酸的菌株,以3%的量(体积分数)接种于MRS液体培养基中。试验组中H2O2浓度为1 mmol/L,对照组不进行任何处理。置于37 ℃恒温振荡摇床中培养24 h后,测量菌液在600 nm下的OD值。以耐受率高于60%为依据,筛选出具有高H202耐受性的菌株。
1.3.4 筛选具有优良益生性能与凝乳性能的乳酸菌
1.3.4.1 耐酸耐胆盐能力测定
参照周晏阳等[16]方法,菌液以2%(体积分数)接种于MRS液体培养基,培养基的pH值调整为2.0与3.0,另一部分培养基中牛胆盐的终质量分数为0.3%,将未经任何处理的培养基作为对照,于37 ℃下恒温培养3 h,采用稀释涂布平板法分别计算活菌数,并按公式(1)计算细菌的存活率,即菌株对酸与胆盐的耐受能力。公式(1)如下所示。
存活率![]()
(1)
1.3.4.2 凝乳性能测定
参考罗璠等[17]的方法,取新鲜牛奶4 000 r/min脱脂,95 ℃下灭菌5 min后,放置于42 ℃水浴锅中。按照3%的接种量(体积分数)分别接入脱脂牛奶后,放入42 ℃恒温培养箱中培养,计算各菌种的发酵凝乳时间。凝乳后放置于4 ℃冰箱中,发酵24 h后进行形态基本观察。
1.3.5 乳酸菌不同组分制备
乳酸菌接种于MRS液体培养基,37 ℃培养24 h后,菌培液经6 000 r/min离心10 min后,分别收集上清液和菌体。上清液经过10 000 r/min离心5 min后,再用0.22 μm微孔膜过滤器过滤,即得无细胞的发酵上清液(cell-free supernatants,CFS);菌体用无菌水洗涤2~3次,调整细胞密度OD600=1.0(约为1×109 CFU/mL),将所得菌悬液分为2组,1组作为完整细胞组(intact cells,IC),另1组在冰浴条件下进行超声破碎(300 W,25 min,处理5 s,间隔5 s),经镜检没有完整细胞后,进行8 000 r/min离心5 min处理,收集上清液,即可得无细胞提取物(cell free extracts,CFE)。
1.3.6 抗氧化活性的测定
1.3.6.1 DPPH清除率的测定
参考ZHANG[18]与LI等[19]的方法。取样品1 mL,加入浓度为0.2 mmol/L的DPPH无水乙醇溶液2 mL,混匀后避光反应30 min后,在517 nm下测定吸光度,用1 mL蒸馏水和2 mL无水乙醇进行空白调零。计算见公式(2)。
DPPH清除率![]()
(2)
式中:Ai,样品组吸光度;Aj,对照组(乙醇+被测量物质)吸光度;A0,对照组(水+DPPH)吸光度。
1.3.6.2 ·OH清除率的测定
参考DING等[8]的方法。将1%(质量分数)的邻菲啰啉1 mL加入到离心管中,依次加入2 mL的PBS(0.02 mol/L,pH 7.4),1 mL蒸馏水,1 mL 2.5 mmol/L FeSO4,1 mL 20 mmol/L H2O2,于37 ℃恒温水浴1.5 h。计算见公式(3)。
·OH清除率![]()
(3)
式中:Ap,在536 nm下测吸光度;As,1 mL样品代替1 mL蒸馏水的吸光度;Ab,1 mL蒸馏水代替1 mL H2O2吸光度。
1.3.6.3 ![]() 清除率测定
清除率测定
参考陈明等[20]的方法,取2.8 mL Tris-HCl(50 mmol/L,pH 8.2)溶液,加入0.1 mL邻苯三酚(0.05 mol/L)和0.1 mL样品。将反应液混匀,于25 ℃避光反应4 min后。迅速添加1 mL 8 mol/L HCl终止反应,在320 nm下测吸光度。按公式(4)计算。
![]() 清除率
清除率![]()
(4)
式中:A0,没有添加样品的空白对照;Ai,添加样品的吸光度。
1.3.7 酵母存活细胞模型测定
参考林祥娜[21]的方法并做修改,将意大利Enartis公司的红佳酿酵母接种于YPD液体培养基中,28 ℃摇床培养12 h。将制备好的无细胞上清液、完整细胞组和破壁细胞在沸水中灭菌20 min。吸取0.1 mL酵母菌于5 mL的灭菌样品中,于28 ℃摇床培养1 h后,加入终浓度为30 mmol/L的H2O2。继续培养1 h后,吸取0.1 mL的菌悬液进行梯度稀释,并涂布于MEA培养基上计数,如公式(5)。
增长率![]()
(5)
式中:处理组,采用CFS、IC、CFE分别和H2O2处理;对照组,只用H2O2进行处理。
1.3.8 益生性与抗氧化菌株的鉴定
1.3.8.1 菌株生理生化鉴定
参照《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》[22]对菌株进行初步鉴定。
1.3.8.2 16S rDNA鉴定以及系统发育树的构建
将对数期的菌株用甘油保存好,送样于青岛派森诺基因生物科技有限公司进行菌种测序鉴定,包括细菌基因组DNA的提取、PCR的扩增、PCR产物的回收、序列的测定与回收。得到序列结果后在NCBI数据库中进行比对,并用MEGA5软件构建系统发育树。
采用Excel 2010分析处理数据,所有数据均重复3次试验所得,并计算平均值和标准误差,绘制图表;采用SPSS 18.0软件对数据进行差异显著性分析。
从甘南传统牦牛酸奶中初筛得到了18菌株,都具有较大溶钙圈并使BCP培养基由紫变黄的能力;经过试验发现有13株菌呈现出革兰氏阳性;H2O2触酶阴性;菌株发酵液的Rf值为0.7~0.8。进一步筛选发现,9株在1 mmol/L H2O2中的耐受率高于60%,结果见表1。
表1不同菌株初筛结果
Table 1 Preliminary screening results of different strains
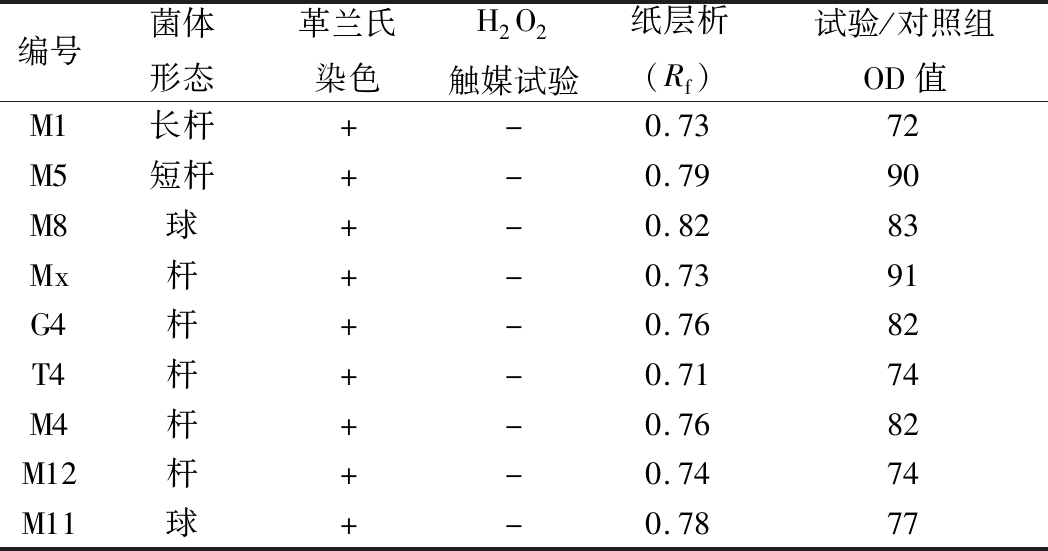
编号菌体形态革兰氏染色H2O2触媒试验纸层析(Rf)试验/对照组OD值M1长杆+-0.7372M5短杆+-0.7990M8球+-0.8283Mx杆+-0.7391G4杆+-0.7682T4杆+-0.7174M4杆+-0.7682M12杆+-0.7474M11球+-0.7877
注:“+”代表阳性;“-”代表阴性;Rf为样品与2 %乳酸移动路径的比值。
不同的菌株在pH 2.0与pH 3.0的生长环境下表现出不同的耐受性,存活率整体随pH值升高呈现上升趋势。在pH值为2.0的存活率为8.5%~25.5%。pH值为3.0的存活率为14.2%~70.2%,其中菌株M8在pH=3条件下存活率高达70%。大部分菌株耐胆盐效果较好,存活率在高达30%以上。其中6株菌株的凝乳时间较短,凝乳时间为5~9 h,菌株M5的凝乳时间为6.2 h,表现出较好的凝乳发酵性能(表2)。
表2 不同菌株耐酸耐胆盐与凝乳性能
Table 2 Acid tolerance and milk clotting ability of different strains
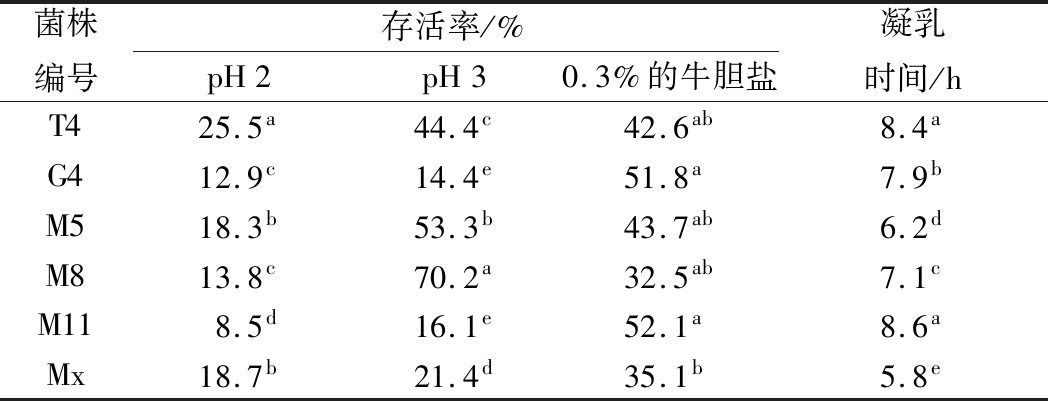
菌株编号存活率/%pH2pH30.3%的牛胆盐凝乳时间/hT425.5a44.4c42.6ab8.4aG412.9c14.4e51.8a7.9bM518.3b53.3b43.7ab6.2dM813.8c70.2a32.5ab7.1cM118.5d16.1e52.1a8.6aMx18.7b21.4d35.1b5.8e
注:同一处理的不同小写字母表示处理内的差异显著(P<0.05)。
2.3.1 DPPH自由基清除率
如图1所示,6株乳酸菌的CFS、IC和CFE处理组均表现出了DPPH自由基清除能力,但不同菌株对DPPH自由基清除能力表现不同。CFS和CFE组中较强清除能力的为M5,IC组中清除能力较强的为T4和M11。总体来看,菌株M5的DPPH自由基清除能力最强,其中CFS处理组中清除率高达47.8%,显著高于其他菌株的CFS处理组,其IC组合CFE组的清除率分别为42.7%和48.4%。
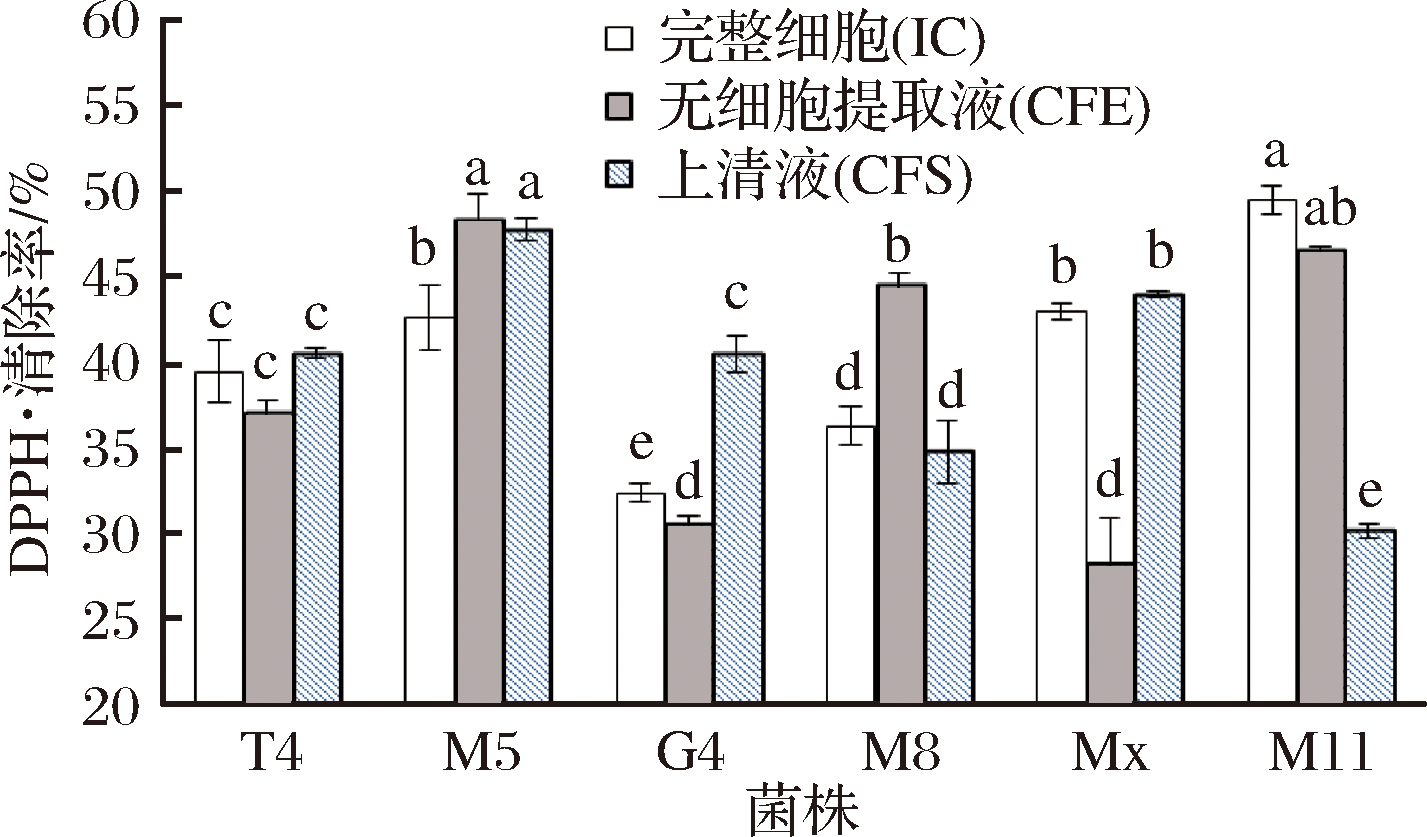
图1 各菌株对DPPH自由基的清除效果
Fig.1 DPPH radical-scavenging ability of 6 screened strains
注:同一处理的不同小写字母表示处理内的差异显著(P<0.05)。
(以下各图与此相同)。
2.3.2 ·OH自由基清除率
由图2可知,M5的CFS组对·OH的清除率为54.4%显著高于其他组;CFE组中M8的清除能力较高为29.3%;IC组中M5、M8和Mx表现出较高的清除能力,分别为36.9%、34.4%和33.5%。相同菌株的·OH自由基清除能力中,CFS处理组高于IC和CFE处理组,乳酸菌清除羟自由基的活性物质主要存在菌体表面以及代谢产物中而非胞内。
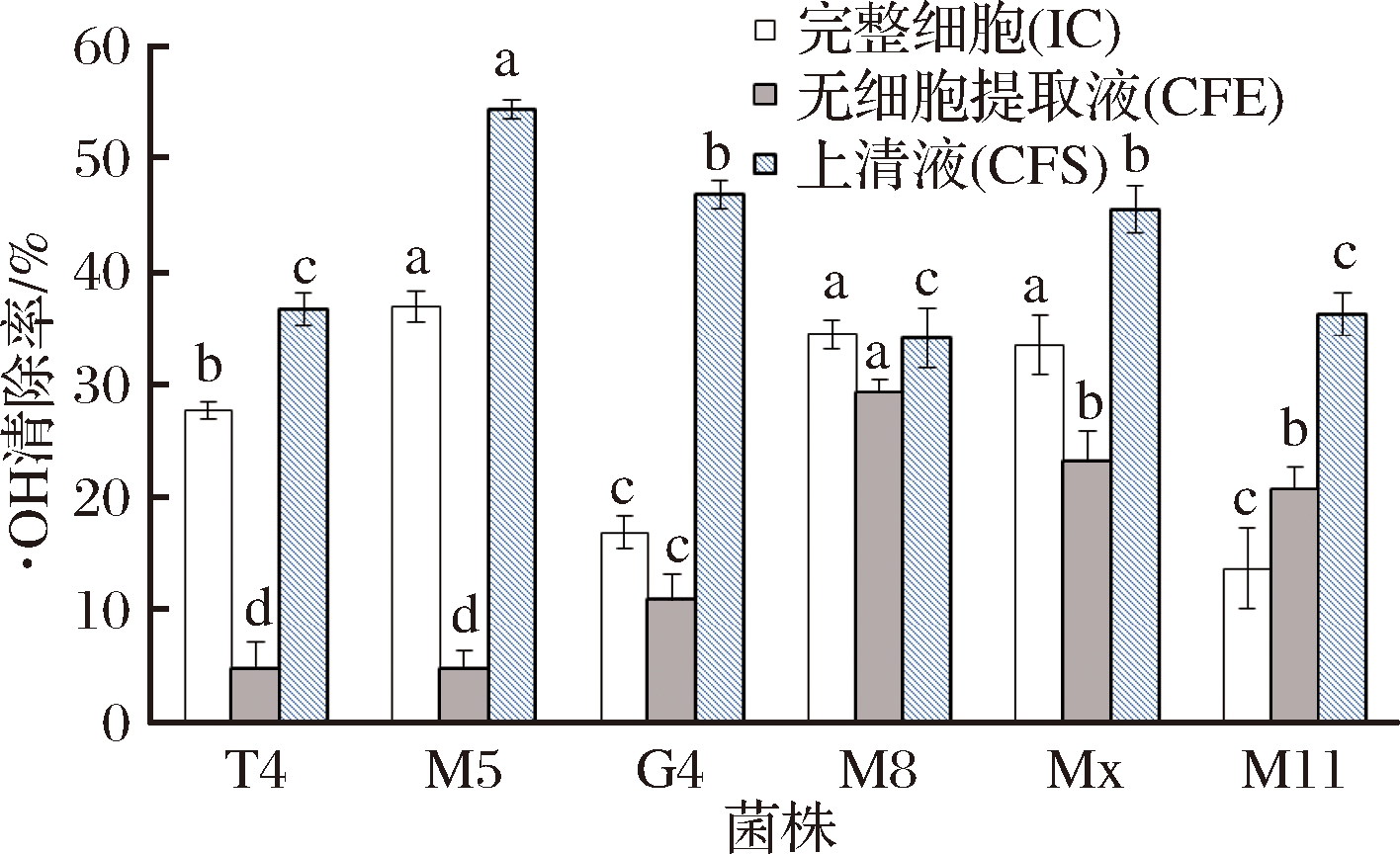
图2 各菌株对·OH自由基清除结果
Fig.2 Hydroxyl radical-scavenging ability of 6 screened strains
![]() 清除率
清除率
从图3中可以看出,CFE组表现极高的清除能力为M5;IC处理组当中能力较强清除能力的为G4;CFS处理组当中表现较好的菌株为M5。不同菌株对![]() 的清除能力表现出很大的差异性能。菌株M5的CFE清除率为49.9%;IC清除率为26.7%;CFS处理组的为25.9%。菌株CFS处理组的清除
的清除能力表现出很大的差异性能。菌株M5的CFE清除率为49.9%;IC清除率为26.7%;CFS处理组的为25.9%。菌株CFS处理组的清除![]() 的能力低于相同菌株的CFE处理组。试验结果表明乳酸菌清除
的能力低于相同菌株的CFE处理组。试验结果表明乳酸菌清除![]() 的活性物质大部分存在于胞内。
的活性物质大部分存在于胞内。
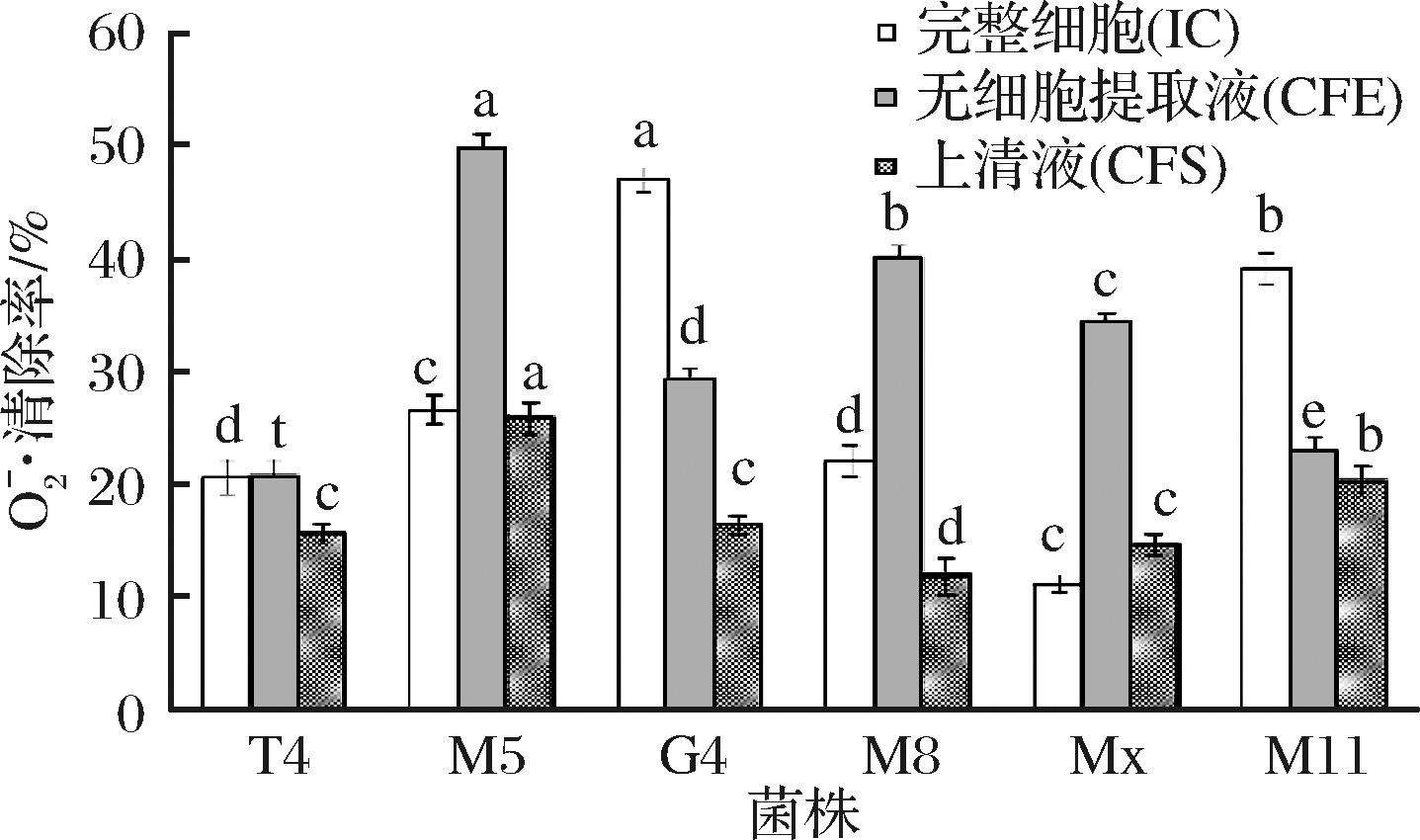
图3 各菌株对![]() 的清除效果
的清除效果
Fig.3 Superoxide anion radical-scavenging ability of 6 screened strains
以菌株的抗氧化能力为主,结合菌株的耐酸性以及高耐胆盐和凝乳发酵性能,综合选择M5菌株进行后续试验。
酵母细胞的衰老代谢机制与人体细胞衰老机制相似[23]。在研究氧化应激损伤中,酿酒酵母是理想的生物模型,具有简单而独特的生长代谢规律[24]。由图4可知,在加入乳酸菌的发酵上清液、完整细胞组和无细胞提取物后,经H2O2处理的酵母细胞的增长率都有所提高。增长率分别为130%、29%和95%,其中菌株M5的发酵上清液的氧化应激保护作用更加明显,其增长率高达130%。
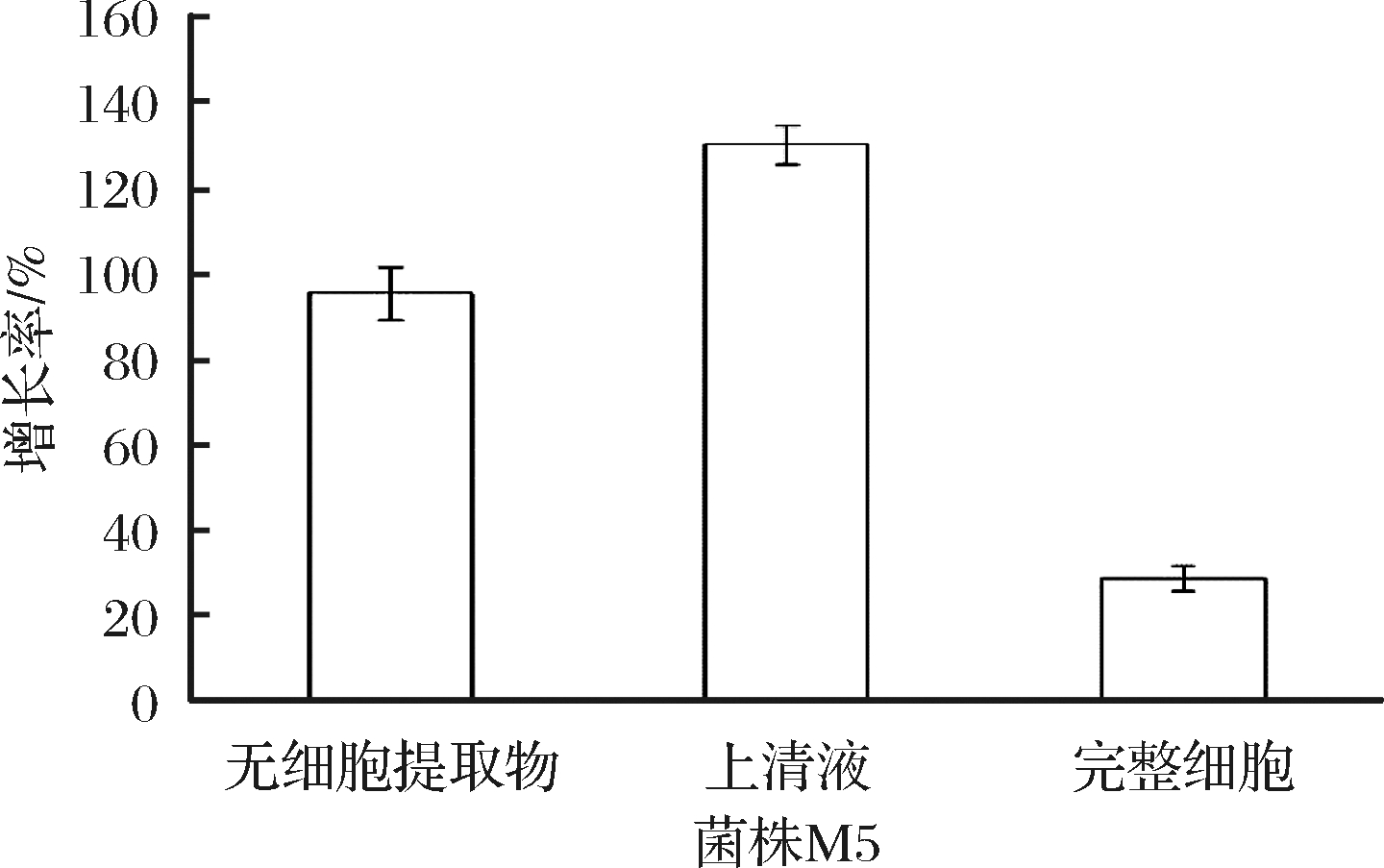
图4 菌株M5对酵母细胞的保护
Fig.4 Protective effect of strains on S. cerevisiae
在MRS培养基上,菌株M5呈现乳白色圆形菌落;长度为1~2 μm,表面光滑湿润凸起,边缘整齐;为革兰氏阳性、无芽孢、细长有弯曲的杆菌。通过该菌株的兼性厌氧触媒试验阴性、兼性异型发酵乳糖、不液化明胶的结果。根据《乳酸细菌分类鉴定及试验方法》和《常见细菌系统鉴定手册》初步将M5菌株鉴定为乳杆菌属(表3)。
表3 菌株M5生理生化鉴定结果
Table 3 Physiological and biochemical identification results of strain M5

试验项目结果试验项目结果葡萄糖+甘露醇+阿拉伯糖-松三糖+果糖+蜜二糖-半乳糖+棉籽糖-乳糖d纤维二糖-麦芽糖+核糖+葡萄糖糖酸盐+海藻糖+甘露糖+木糖-精氨酸产NH3-明胶液化-
注:“+”表示90%以上菌株为阳性;“-”表示90%以上出来为阴性;“d”表示 11%~89%菌株为阳性。
由于干酪乳杆菌与鼠李糖乳杆菌等其他亚种亲缘关系接近,很难利用传统的发酵特性再进一步的区分,因此需要将表型特征和分子生物学技术结合起来对其进行鉴定[25]。目前在菌种鉴定中应用最广泛的分子生物学技术是16S r DNA序列同源分析。将测序得到的序列在NCBI中进行同源性比对,并用MEGA5.0构建系统发育树,结果见下图5。由系统发育树可知,M5菌株与副干酪乳杆菌JCM1171处于同一小分支,亲缘关系最近,这跟形态及生理生化鉴定结果一致(图6)。因此可以进一步将M5菌株确定是副干酪乳杆菌。

图5 菌株M5的系统发育树
Fig.5 Phylogenetic tree of strain M5
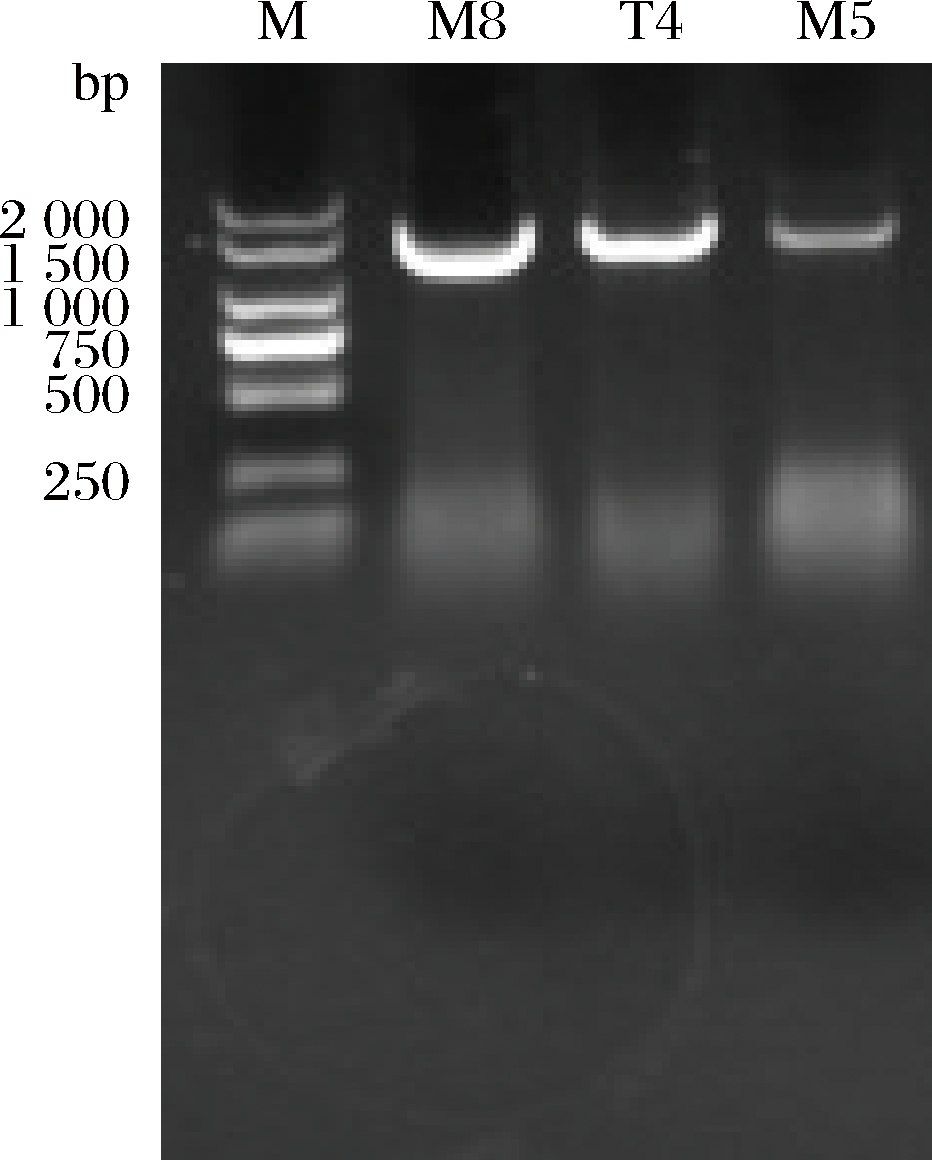
图6 菌株M8、T4和M5的16S rRNA基因PCR扩增效果
Fig.6 Amplification of 16S rRNA gene of strains M8,T4 and M5 by PCR
菌种的发酵性能直接关系到酸奶质量的好坏[26],不仅影响酸奶的生产效率,而且影响酸奶的风味物质形成。发酵性能强的菌株,使牛奶中酸度下降过快,不利于凝乳质地的构建与后发酵中风味物质的形成,发酵时间过长则直接影响生产效率。凝乳时间是酸奶生产中非常重要的指标之一,对于工业化生产而言,一般要求发酵乳凝乳时间在5 h左右[27]。试验筛选的菌株凝乳时间为6.2 h,低于市场上的商业菌株。菌株的凝乳状态光滑细腻,可以通过后期的驯化和制备直投式发酵剂以增加菌株的发酵性能,用于工业化生产。
研究表明,从食物中筛选的戊糖乳杆菌、植物乳杆菌、德氏乳杆菌、发酵乳杆菌、乳酸乳球菌和嗜酸乳杆菌等都具有抗氧化活性[28]。在抗氧化体外评价方法中,DPPH分光测定法是一种有效筛选与评价抗氧化效果的方法[29]。CHOORUK等[30]报道的副干酪乳杆菌完整细胞的DPPH自由基清除率为34.65%,本研究所筛选的M5菌株其DPPH自由基的清除率为42.7%,较高于CHOORUK等的研究结果;·OH是体内氧化性很强的自由基,在病理学试验中常用其清除作用解释某些病变原因和衰老机理。SHI等[31]从东北地区传统奶酪中筛选出副干酪乳酸菌27154,其羟基自由基清除率高达64%,高于本课题筛选出的同类菌株;同时TAKASHI等[32]从食物中筛选出的植物乳酸杆菌具有的高![]() 自由基清除能力高于菌株M5,但菌株M5的
自由基清除能力高于菌株M5,但菌株M5的![]() 清除率显著高于HUAYI等[33]从酸奶中筛选出的同类副干酪乳杆菌(Lactobacillus paracasei)YBJ01的清除能力。
清除率显著高于HUAYI等[33]从酸奶中筛选出的同类副干酪乳杆菌(Lactobacillus paracasei)YBJ01的清除能力。
本研究从甘南牧区传统牦牛酸奶中筛选出的副干酪乳杆菌M5在菌株发酵、抗氧化、耐酸与抗胆盐能力方面表现优良。该菌株凝乳发酵时间为6.2 h,发酵上清液对DPPH和羟自由基清除率分别为47.8%和54.4%,无细胞提取物对超氧阴离子的清除率为49.9%,由于抗氧化物质聚集部位的不同以及种类和数量存在差异。菌株M5的不同处理组对DPPH自由基![]() 和·OH自由基的清除能力表现出显著差异,但酵母存活细胞模型验证表明菌株M5具有良好的抗氧化性,其在功能性食品方面具有较大的开发利用价值。
和·OH自由基的清除能力表现出显著差异,但酵母存活细胞模型验证表明菌株M5具有良好的抗氧化性,其在功能性食品方面具有较大的开发利用价值。
[1] 武万强, 王琳琳,赵建新,等.植物乳杆菌生理特性及益生功能研究进展[J]. 食品与发酵工业, 2019,45(1):1-13.
[2] SWETWIWATHANA A, VISESSANGUAN W. Potential of bacteriocin-producing lactic acid bacteria for safety improvements of traditional Thai fermented meat and human health[J]. Meat Science, 2015, 109:101-105.
[3] LIU H, GONG J S, CHABOT D, et al. Improved survival of Lactobacillus zeae LB1 in a spray dried alginate-protein matrix[J]. Food Hydrocolloids, 2018, 78: 100-108.
[4] ISHII N. Oxidative stress and aging in Caenorhabditis elegans[J]. Free Radical Research, 2000, 33(6): 857-864.
[5] MULLER F L, LUSTGARTEN M S, JANG Y, et al. Trends in oxidative aging theories[J]. Free Radical Biology and Medicine, 2007, 43(4): 477-503.
[6] LUO D H, FANG B S. Structural identification of ginseng polysaccharides and testing of their antioxidant activities[J]. Carbohydrate Polymers, 2008, 72(3): 376-381
[7] DAS D, GOYAL A. Antioxidant activity and γ-aminobutyric acid (GABA) producing ability of probiotic Lactobacillus plantarum DM5 isolated from Marcha of Sikkim[J]. LWT-Food Science and Technology, 2015, 61(1): 263-268.
[8] DING W R, WANG L N, ZHANG J, et al. Characterization of antioxidant properties of lactic acid bacteria isolated from spontaneously fermented yak milk in the Tibetan Plateau[J]. Journal of Functional Foods, 2017, 35: 481-488.
[9] SHAKIBAIE M, MOHAMMADI-KHORSAND T, ADELI-SARDOU M, et al. Probiotic and antioxidant properties of selenium-enriched Lactobacillus brevis LSe isolated from an Iranian traditional dairy product[J]. Journal of Trace Elements in Medicine and Biology, 2017, 40: 1-9.
[10] LIU D M, WANG P, ZHANG X Y, et al. Characterization of nitrite degradation by Lactobacillus casei subsp. rhamnosus LCR 6013[J]. PLoS one, 2014, 9(4): e93 308.
[11] 杜瑞平,郭帅,潘娜,等. 乳酸菌胞外多糖益生功能研究进展[J].动物营养学报,2018,30(7):2 439-2 444.
[12] HUANG Y H, LAI Y J, CHOU C C. Fermentation temperature affects the antioxidant activity of the enzyme-ripened sufu, an oriental traditional fermented product of soybean[J]. Journal of bioscience and bioengineering, 2011, 112(1): 49-53.
[13] 刘慧.现代食品微生物学试验技术[M].北京:中国轻工出版社, 2006:143-163.
[14] 洪松虎. 抗氧化活性乳酸菌的筛选及其在水产品加工贮藏中的应用[D]. 宁波:宁波大学, 2009.
[15] 王桢, 李阳,车帅,等. 北极海洋沉积物高抗氧化活性菌株的筛选及其多样性分析[J]. 海洋科学进展, 2015, 33(1):63-70.
[16] 周晏阳, 孔雪英,吴梅,等.1株牦牛源产细菌素植物乳杆菌的益生特性分析[J]. 食品科学, 2018, 39(14):132-137.
[17] 罗璠,杨丽雪,魏婕,等. 不同原料乳对发酵酸奶品质的影响[J].西南民族大学学报(自然科学版),2018,44(1):14-18.
[18] ZHANG L, LIU C, LI D, et al. Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J]. International Journal of Biological Macromolecules, 2013, 54(1): 270-275.
[19] LI S, ZHAO Y, ZHANG L, et al. Antioxidant activity of Lactobacillus plantarum strains isolated from traditional Chinese fermented foods[J]. Food Chemistry, 2012, 135(3): 1 914-1 919.
[20] 陈明, 柯文灿,保安安,等. 青藏高原牦牛酸奶中具高抗氧化能力乳酸菌的筛选[J].食品工业科技,2016,37(8):201-205.
[21] 林祥娜,夏永军,王光强,等. 抗氧化活性乳酸菌的筛选[J]. 中国食品学报,2017,17(6):103-109.
[22] 凌代文,东秀珠. 乳酸细菌分类鉴定及试验方法[M]. 北京:中国轻工业出版社,1993: 6.
[23] FONTANA L, PARTRIDGE L, LONGO V D. Extending healthy life span—from yeast to humans[J]. Science, 2010, 328(5976): 321-326.
[24] BURTNER C R, MURAKAMI C J, KENNEDY B K, et al. A molecular mechanism of chronological aging in yeast[J]. Cell cycle, 2009, 8(8): 1 256-1 270.
[25] 巨晓英,寇晓虹.副干酪乳杆菌的功能及其在食品工业中的应用研究进展[J].中国乳品工业,2009,37(8):48-50.
[26] ANCOS B D, PILAR C M, G MEZ R. Characteristics of stirred low-fat yoghurt as affected by high pressure[J]. International Dairy Journal, 2000, 10(1):105-111.
MEZ R. Characteristics of stirred low-fat yoghurt as affected by high pressure[J]. International Dairy Journal, 2000, 10(1):105-111.
[27] 华鹤良. 乳酸菌的分离鉴定及其抗菌肽与发酵性能研究[D].扬州:扬州大学,2014.
[28] REJINIEMON T S, HUSSAIN R R, RAJAMANI B. In-vitro functional properties of Lactobacillus plantarum isolated from fermented ragi malt[J]. South Indian Journal of Biological Sciences, 2015, 1(1): 15-23.
[29] 张凤敏,田丰伟,陈卫,等. 具抗氧化活性乳酸菌的筛选[J]. 中国乳品工业, 2007, 35(2):4-7.
[30] CHOORUK A, PIWAT S, TEANPAISAN R. Antioxidant activity of various oral Lactobacillus strains[J]. Journal of applied microbiology, 2017, 123(1): 271-279.
[31] SHI Y, CUI X, GU S, et al. Antioxidative and probiotic activities of lactic acid bacteria isolated from traditional artisanal milk cheese from northeast China[J]. Probiotics and antimicrobial proteins, 2018: 1-14.
[32] KUDA T, KANEKO N, YANO T, et al. Induction of superoxide anion radical scavenging capacity in Japanese white radish juice and milk by Lactobacillus plantarum isolated from aji-narezushi and kaburazushi[J]. Food Chemistry, 2010, 120(2): 517-522.
[33] SUO H, LIU S, LI J, et al. Lactobacillus paracasei ssp. paracasei YBJ01 reduced d-galactose-induced oxidation in male Kuming mice[J]. Journal of dairy science, 2018, 101(12): 10 664-10 674.