纤维素是目前世界上含量最丰富的天然可再生资源,纤维素资源的高效开发利用是当前研究热点[1-2]。微生物处理纤维素是1种高效、绿色环保的方法,主要利用微生物产生纤维素酶将纤维素降解为葡萄糖,然后再通过发酵转化为其他有价值的化合物,比如乙醇和单细胞蛋白等[3]。纤维素酶由多种复合酶系组成,主要包括内切葡聚糖酶、外切葡聚糖酶和β-1,4葡萄糖苷酶,3种酶协同作用于纤维素物质并将其降解[4-5]。它广泛存在于微生物、原生动物和植物中,目前发现具有纤维素降解功能的微生物菌属很多,如木霉属(Trichoderma)、曲霉属(Aspergillus)和青霉属(Penicillium)等[6-7]。国内外对降解纤维素菌株研究多集中在真菌,因为真菌产纤维素酶系较全,分解纤维素能力较强[8]。纤维素酶在饲料、纺织、食品、医药等领域有良好的市场前景[9]。
目前由于纤维素酶产量低、成本高等问题,导致纤维素酶的工业应用受到限制。高酶活菌株的选育仍然是重要的研究方向,国内外许多学者做了相关研究,如曾思泉等[10]从红树林根际土壤中获得1株产纤维素酶的枝孢属菌(Cladosporium sp.),SWAIN等[11]从牛粪中筛选得到5株具有较高纤维素酶活力的枯草芽孢杆菌等。但自然筛选获得的菌株产酶能力有限,通过诱变提高产酶能力是常见的方法,比如常用的紫外诱变能使相邻的嘧啶形成二聚体,导致菌株遗传物质发生改变从而提高酶活[12-13]。常压室温等离子体(atmospheric and room temperature plasma, ARTP)诱变技术是近年来发展的1种新型诱变技术,在高纯度的氦气作为出发气体的条件下,大量非平衡性等离子体流作用于微生物的遗传物质,破坏单核苷酸的磷酸二酯键,诱发细胞SOS修复机制,从而导致遗传物质突变[14]。周罗娜等[15]利用ARTP诱变黑曲霉提高产单宁酶的能力,其酶活提高2倍。SANGWIJIT等[16]利用ARTP诱变解淀粉芽孢杆菌提高其产纤维素酶能力。ARTP诱变方法具有突变率高、遗传稳定性强,操作简单、安全的优点,因此受到越来越多的关注和应用[17]。
本研究以实验室前期筛选获得的高产纤维酶枝孢菌B03作为出发菌株[2],通过紫外诱变和ARTP诱变,用刚果红染色进行初筛,酶活作为复筛,获得产酶能力提高、遗传稳定的菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
枝孢菌(Cladosporium)B03,本实验室选育保藏。
1.1.2 培养基
种子培养基(g/L):羧甲基纤维素钠(CMC-Na) 10,蛋白胨3,KH2PO4 4,MgSO4·7H2O 0.3。
CMC培养基(g/L):CMC-Na 10,(NH4)2SO4 4,蛋白胨1,MgSO4·7H2O 0.5,KH2PO4 1,琼脂20。
液体产酶培养基(g/L):CMC-Na 10,蛋白胨3,酵母膏0.2,(NH4)2SO4 2,KH2PO4 4,MgSO4·7H2O 0.3。
1.1.3 试验试剂
柠檬酸钠缓冲液(0.05 mol/L,pH 4.8)、0.9%生理盐水、3,5-二硝基水杨酸(DNS)溶液、刚果红溶液(1 mg/mL)、CMC-Na、蛋白胨、KH2PO4、MgSO4·7H2O、酵母膏、(NH4)2SO4、甘油、脱脂棉等(均为分析纯),成都市科龙化工试剂厂。
1.1.4 仪器与设备
ARTP-Ⅱ型诱变育种仪,无锡源清天木生物科技有限公司;MJ-250恒温培养箱、TG-16医用离心机,四川蜀科仪器有限公司;Phs-3C酸度计、YX280A型高压蒸汽灭菌锅、SW-CJ-1F净化工作台、HH-6D数显恒温水浴锅,常州普天仪器制造;V-1000可见分光光度计,翱艺仪器有限公司;SKY-2102C恒温振荡器,上海苏坤实业有限公司。
1.2 试验方法
1.2.1 菌株活化及发酵培养
菌株活化:将-4 ℃斜面保存的菌株取出,在CMC培养基上连续3~4次划线培养(28 ℃),然后将菌株斜面培养,制备孢子悬浮液。活化后的菌株以牙签3点法点种在CMC培养基中,28 ℃培养3 d后用1 mg/mL的刚果红溶液染色30 min,蒸馏水漂洗后用1 mol/L NaCl溶液脱色30 min,测定菌落直径与透明圈直径,计算透明圈与菌落的直径比[18]。
发酵液培养:将活化后的菌株接种于种子培养液中,在28 ℃、180 r/min条件下培养36 h,然后按5%的接种量接种于液体产酶培养基中,28 ℃、180 r/min条件下培养3 d,将发酵液过滤,滤液6 000 r/min离心10 min,上清液即为粗酶液。测定菌株羟甲基纤维素(CMC)酶活和滤纸(FPA)酶活。
CMC酶活测定:4根25 mL比色管,1根作空白对照,4根管中都加入1.5 mL浓度为1%的CMC溶液,3根实验管中加入0.5 mL粗酶液,空白管不加粗酶液,在50 ℃下反应30 min,取出后都加入1.5 mL DNS溶液,空白管加入0.5 mL粗酶液后迅速与实验管一起放入沸水浴10 min,冷却至室温后定容到25 mL,540 nm下测定吸光值,计算酶活。
FPA酶活测定:4根25 mL比色管,1根作空白对照,4根管中都加入折成M形的质量为50 mg的滤纸(长6 cm,宽1 cm),然后加入1.5 mL pH 4.8的磷酸缓冲液,3根实验管中再加入0.5 mL粗酶液,空白管不加酶液,50 ℃下反应60 min,取出后都加入1.5 mL DNS溶液,空白管加入0.5 mL粗酶液后与实验管迅速放入沸水浴10 min,冷却至室温后定容到25 mL,540 nm下测定吸光值,计算酶活。
酶活定义:在一定条件下,1 mL粗酶液1 min水解底物产生1 μg葡萄糖所需酶量定义为1个酶活单位U。
1.2.2 菌株紫外诱变选育
孢子悬浮液:将斜面培养好的菌株用灭菌的生理盐水冲洗孢子,在28 ℃、180 r/min条件下活化3 h后用灭菌的脱脂棉过滤孢子溶液,然后用血细胞计数板计数,使孢子浓度在106~108 CFU/mL范围内。
将配制好的孢子悬浮液装入灭菌的空平板内,置于超净工作台上,黑暗条件下使用20 W紫外灯在30 cm处分别照射0、1、2、4、6、8、10和13 min,分别取不同照射时间的孢子液稀释适合倍数,取200 μL涂布于CMC平板,在28 ℃下暗培养,计数并计算致死率。
紫外诱变及筛选:选择致死率在90%左右的时间进行诱变育种。将诱变处理后的孢子液涂布于CMC培养基中,28 ℃暗培养后把单菌落分别挑出编号进行划线培养,纯培养后将菌株以3点法点种于CMC培养基中,28 ℃培养3 d后用1 mg/mL的刚果红溶液染色30 min,蒸馏水漂洗后用1 mol/L NaCl溶液脱色30 min,测定菌落直径与透明圈直径,筛选出直径比大的菌株进行CMC酶活和FPA酶活测定复筛。筛选出酶活能力提高的菌株进行ARTP诱变选育。
1.2.3 ARTP诱变选育
孢子悬浮液:将经过紫外处理酶活提高的菌株在28 ℃条件下进行斜面培养,用灭菌的生理盐水将孢子洗下,洗涤前可用接种环适当刮下孢子,然后再28 ℃、180 r/min条件下活化3 h后用灭菌的脱脂棉过滤孢子溶液,并用血细胞计数板计数,使孢子浓度在106~108范围内。将调节好浓度的孢子液在8 000 r/min的条件下离心5 min,弃上清液,加入1 mL 2%甘油溶液并振荡均匀作为孢子悬浮液。
在高纯的氦气作为ARTP的工作气源,电源功率100 W,气体流量10 SLM,照射距离2 mm的条件下,对8个载片上10 μL孢子液进行诱变处理,处理时间依次为0、20、60、80、100、120、150、180和210 s[19]。处理后稀释相应倍数涂布于CMC平板上,28 ℃培养至出现单菌落,计数并计算致死率。选取致死率在90%左右时作为诱变处理时间。筛选方法同紫外诱变,得到酶活提高的菌株。
1.2.4 突变菌株遗传稳定性检测
将筛选得到的突变菌株连续传代培养,检测1、2、3、4、5和6代菌株发酵液中CMC酶活、FPA酶活,以确定突变菌株的遗传稳定性。
2 结果与分析
2.1 菌株B03的活化、透明圈及酶活测定
将菌种B03从斜面保存连续划线纯培养3~4代,测定菌株的透明圈与菌落直径比为2.53。活化后的菌株接种到种子培养基中,在28 ℃、180 r/min条件下培养36 h,5%的接种量接种到液体产酶培养基中,相同条件下培养3 d,测定菌株CMC酶活为(427.62±2.78)U/mL,FPA酶活为(46.83±1.85) U/mL。以该菌株作为诱变的出发菌株。
2.2 紫外诱变选育
由图1可知,随着照射时间的增长,菌株的致死率也增大,一般选择致死率为90%左右作为诱变处理量。当照射时间为8 min时,菌株致死率为91.67%,因此选择8 min作为紫外诱变照射时间。

图1 菌株B03紫外诱变致死曲线
Fig.1 Lethal rate curve of strain B03 by UV mutagenesis
以菌株B03作为出发菌株,经过紫外处理8 min后涂布于CMC培养基上,黑暗条件下28 ℃培养3 d,将单菌落分别挑出编号,共计菌株63株,编号为UV-01~UV-63,对筛选出的63株菌株测定其透明圈与菌落比值,将比值较大菌株进行酶活测定,结果如表1所示。(由于透明圈在测定时与菌株生长状态有关,菌落较小可能比值较大,但菌落较小可能说明菌株生长缓慢,因此透明圈与菌落比值大小应选择相对较大值的菌株进行酶活测定)。将菌株透明圈较大的10株菌测定其酶活,发现菌株UV-10、UV-42的FPA酶活有所提高,其中UV-42相对B03的FPA酶活提高17.85%,菌株UV-03、UV-29的CMC酶活有所提高,UV-03较原菌株CMC酶活提高18.79%(表2)。因为FPA酶活测定底物为滤纸,滤纸较难分解,所以酶活较低,而出发菌株具有较高的CMC酶活,因此以CMC酶活作为主要筛选指标,将菌株UV-03作为ARTP诱变的出发菌株进行诱导。
表1 紫外诱变后的初筛结果
Table 1 Primary screening results of uv mutagenesis
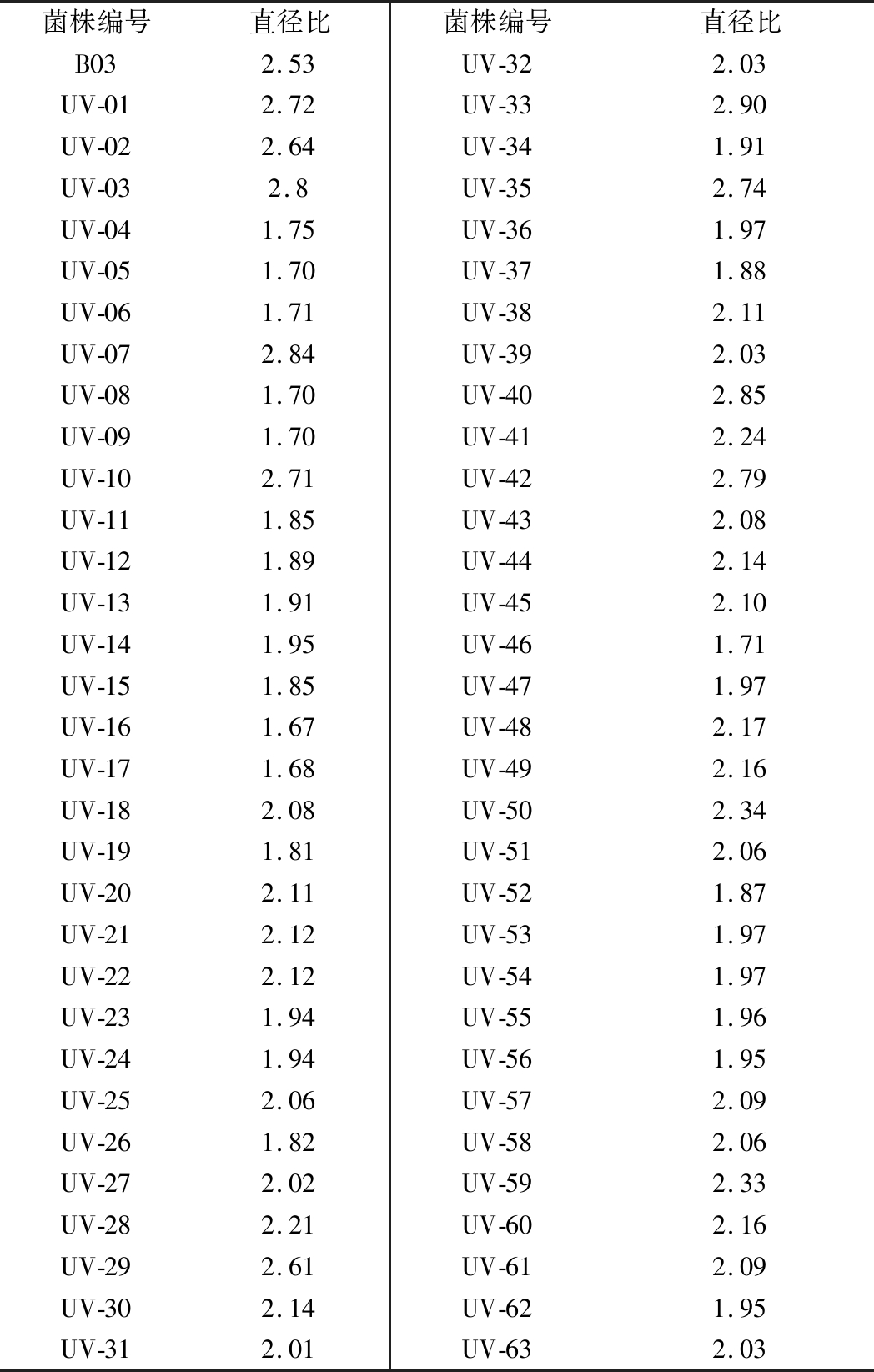
菌株编号直径比菌株编号直径比B032.53UV-322.03UV-012.72UV-332.90UV-022.64UV-341.91UV-032.8UV-352.74UV-041.75UV-361.97UV-051.70UV-371.88UV-061.71UV-382.11UV-072.84UV-392.03UV-081.70UV-402.85UV-091.70UV-412.24UV-102.71UV-422.79UV-111.85UV-432.08UV-121.89UV-442.14UV-131.91UV-452.10UV-141.95UV-461.71UV-151.85UV-471.97UV-161.67UV-482.17UV-171.68UV-492.16UV-182.08UV-502.34UV-191.81UV-512.06UV-202.11UV-521.87UV-212.12UV-531.97UV-222.12UV-541.97UV-231.94UV-551.96UV-241.94UV-561.95UV-252.06UV-572.09UV-261.82UV-582.06UV-272.02UV-592.33UV-282.21UV-602.16UV-292.61UV-612.09UV-302.14UV-621.95UV-312.01UV-632.03
表2 紫外诱变后酶活力 单位:U/mL
Table 2 Enzyme activity of different mutants after uv mutagenesis
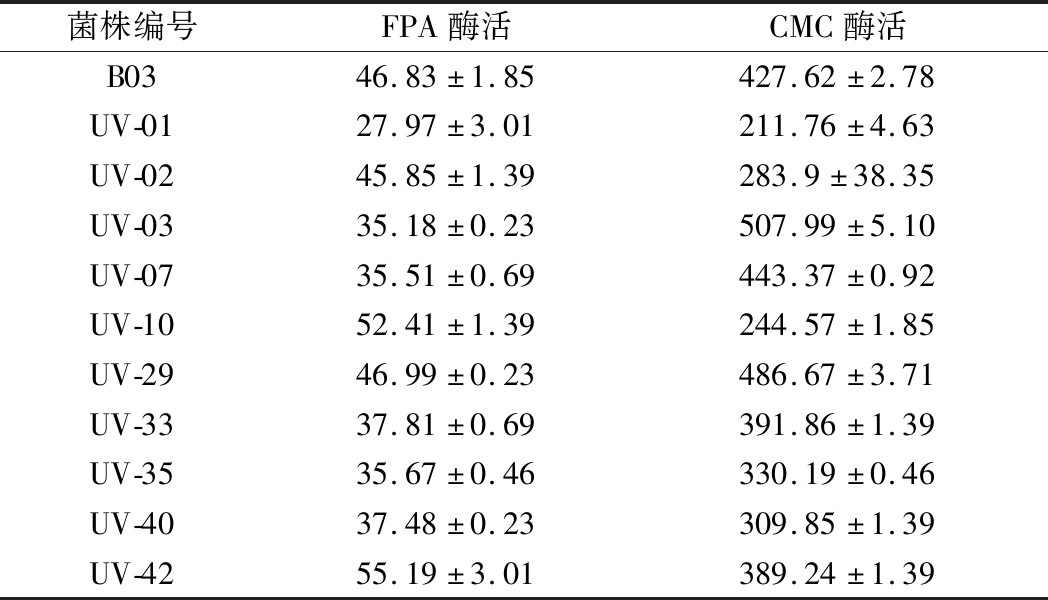
菌株编号FPA酶活CMC酶活B0346.83±1.85427.62±2.78UV-0127.97±3.01211.76±4.63UV-0245.85±1.39283.9±38.35UV-0335.18±0.23507.99±5.10UV-0735.51±0.69443.37±0.92UV-1052.41±1.39244.57±1.85UV-2946.99±0.23486.67±3.71UV-3337.81±0.69391.86±1.39UV-3535.67±0.46330.19±0.46UV-4037.48±0.23309.85±1.39UV-4255.19±3.01389.24±1.39
2.3 ARTP诱变选育
对菌株UV-03进行ARTP诱变操作,测定ARTP致死曲线,结果显示ARTP处理时间越长,致死率越大(图2)。菌株在20 s时致死率将近60%,可能因为开始菌株对ARTP较为敏感所致。在处理120 s时,致死率为90.85%,超过120 s后致死率接近100%,因此选择120 s作为ARTP诱变的处理时间。
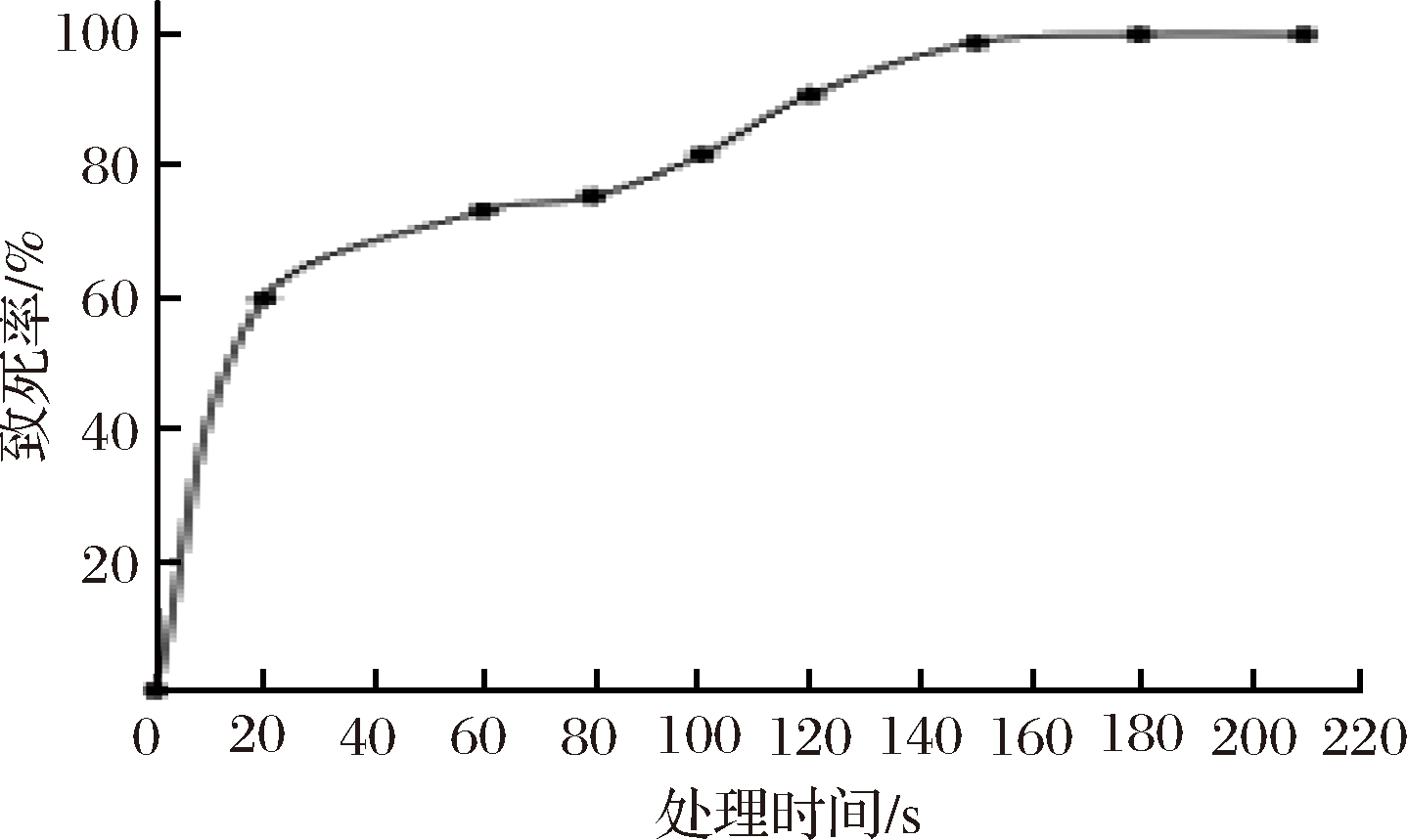
图2 菌株UV-03 ARTP致死曲线
Fig.2 Lethal rate curve of strain UV-03 by ARTP
将菌株UV-03在ARTP仪上诱变处理120 s,稀释涂布于CMC平板上,28 ℃培养3~4 d后将单菌落挑出继续划线纯化培养,最终共培养诱变后菌株81株(图3)。测定经ARTP诱变处理后的81株菌株的透明圈与菌落直径比,测定比值较大的部分菌株的酶活,结果如表3所示。菌株AY-42、AY-70的FPA酶活分别为(92.27±0.23)、(93.58±3.02) U/mL,较原B03的FPA酶活提高97%左右,并且AY-42的CMC酶活达(582.14±2.32) U/mL,较B03提高36.14%。
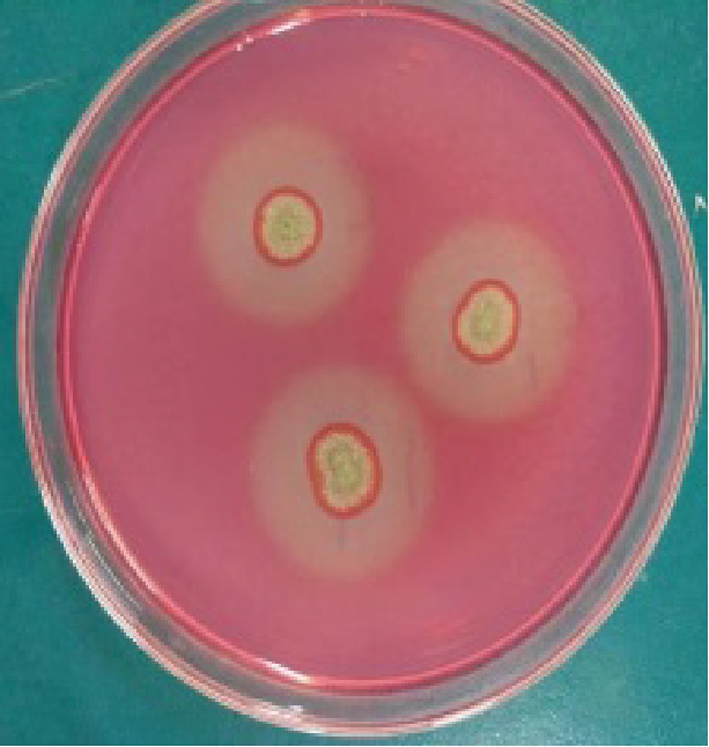
图3 菌株AY-42刚果红染色
Fig.3 Transparent hydrolysis circle by Congo red staining of strain AY-42
2.4 突变菌株的遗传稳定性
对突变菌株AY-42进行遗传稳定性试验,结果如图4所示。经过6代连续划线培养并测定每1代的酶活力,突变菌株AY-42具有较好的稳定性。能够稳定高效地产纤维素酶。
表3 菌株UV-03 ARTP诱变结果
Table 3 Results of ARTP mutants from UV-03
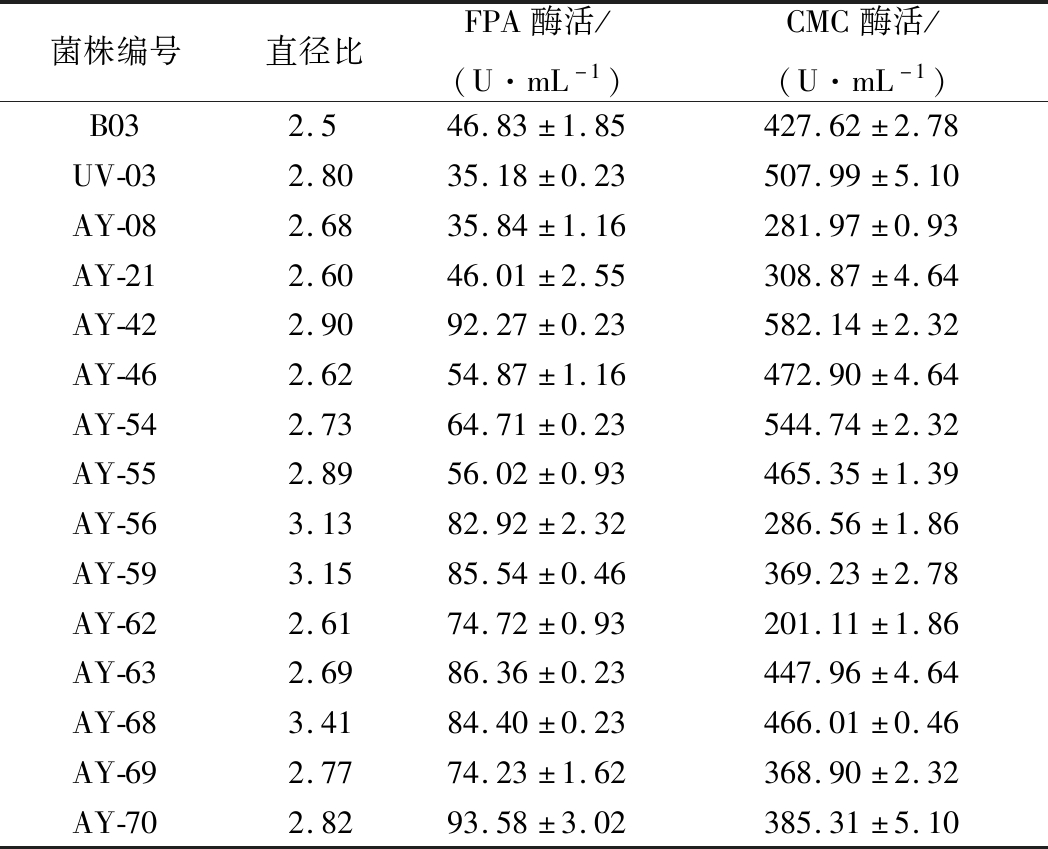
菌株编号直径比FPA酶活/(U·mL-1)CMC酶活/(U·mL-1)B032.546.83±1.85427.62±2.78UV-032.8035.18±0.23507.99±5.10AY-082.6835.84±1.16281.97±0.93AY-212.6046.01±2.55308.87±4.64AY-422.9092.27±0.23582.14±2.32AY-462.6254.87±1.16472.90±4.64AY-542.7364.71±0.23544.74±2.32AY-552.8956.02±0.93465.35±1.39AY-563.1382.92±2.32286.56±1.86AY-593.1585.54±0.46369.23±2.78AY-622.6174.72±0.93201.11±1.86AY-632.6986.36±0.23447.96±4.64AY-683.4184.40±0.23466.01±0.46AY-692.7774.23±1.62368.90±2.32AY-702.8293.58±3.02385.31±5.10
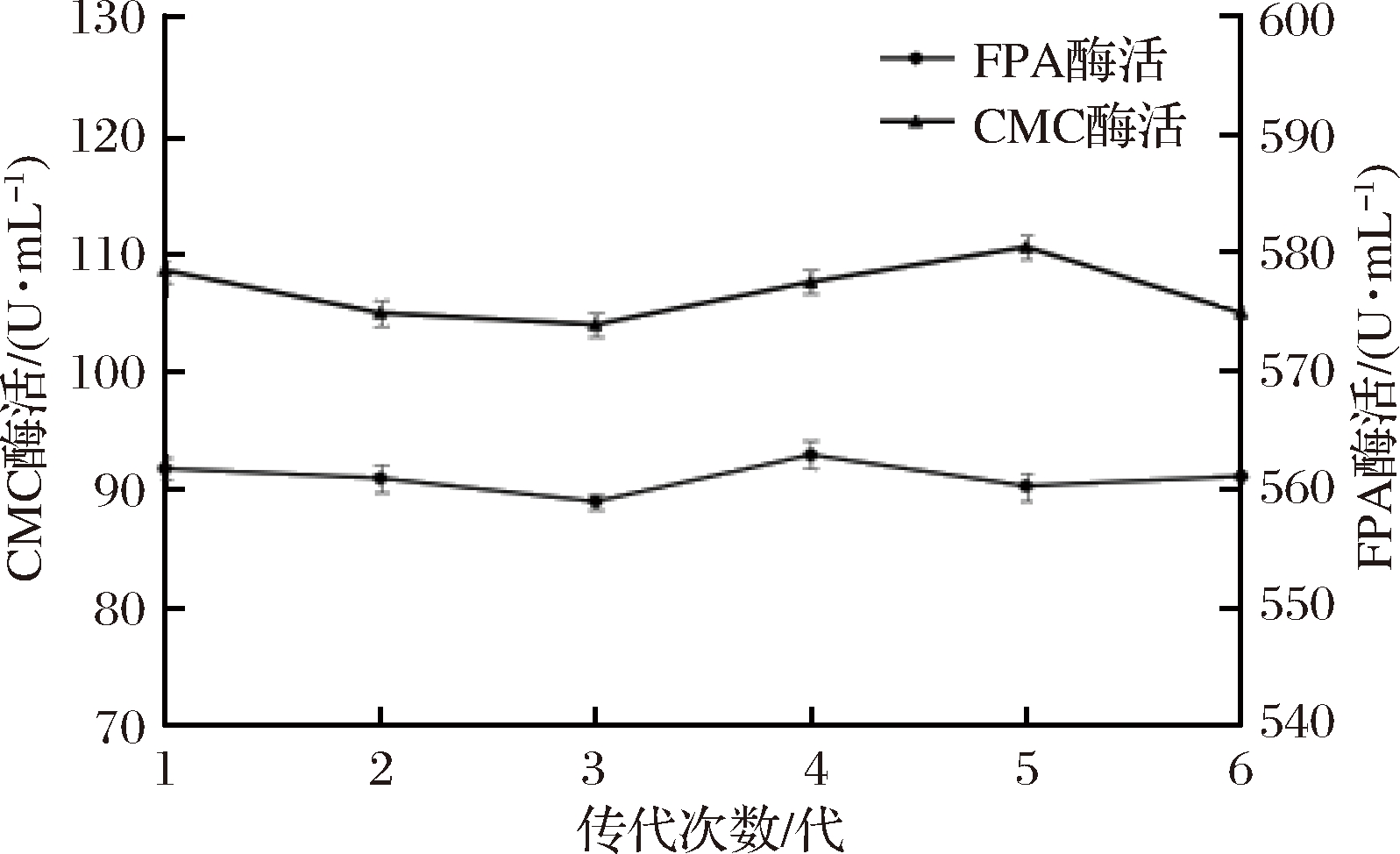
图4 突变菌株AY-42产纤维素酶的遗传稳定性
Fig.4 Cellulase production genetic stability of the strain AY-42
3 结论与讨论
目前生物质资源在向能源转化的过程中仍存在不少技术难题和成本制约,纤维素酶价格过高是其中之一,筛选高产纤维素酶菌株并提高其产酶能力具有重要研究意义[20]。前期此类研究主要通过自然筛选、诱变育种、基因工程等方法对产纤维素酶菌株进行改造,以达到提高菌株产酶能力的目的[21]。如IKE等[22]对里氏木霉进行紫外诱变,筛选后获得2株产纤维素酶能力分别提高1.1和1.2倍的突变菌株。郭建强等[23]使用紫外-亚硝基胍复合诱变芽孢杆菌使纤维素酶活力提高3.23倍。DINA等[24]使用紫外和化学试剂复合诱变使米曲霉滤纸酶活提高4倍多。诱变育种能使菌株产酶能力提高,目前使用ARTP技术提高真菌产纤维素酶能力报道较少。
本研究以实验室前期筛选获得的高产纤维素酶菌株枝孢菌(Cladosporium)B03为出发菌株,经过紫外和ARTP复合诱变,采用透明圈法初筛、酶活复筛的方法筛选出产酶能力提高的菌株AY-42,经遗传稳定性试验,该菌株具有高产纤维素酶的稳定性。突变菌株AY-42最终CMC酶活为(582.14±2.32)U/mL,FPA酶活为(92.27±0.23) U/mL,与原始菌株B03相比CMC酶活提高36.14%,FPA酶活提高97.03%,其CMC酶活显著高于陈丽燕等[25]报道的菌株。在菌株初筛时主要依据透明圈与菌落直径比值大小,比值大小与菌株生长状态有很大关联,在点种后培养过程中菌株生长不规则会导致数据不准,总体上直径比能够在菌株数量较多时快速地筛选出产酶能力可能提高的菌株,减少了工作量,提高了筛选效率。同时本实验采用的ARTP也表现出良好的诱变效果,等离子体能够破坏核苷酸的磷酸二酯键,使细胞启动SOS修复机制[14],对微生物的遗传物质产生强烈的畸变作用,进而诱发菌株产生遗传稳定的突变。总之,菌株AY-42具有较高的应用价值,可用于后期生物质资源开发。
[1] HIMMEL M E, DING S Y, JOHNSON D K, et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production [J]. Science, 2007, 315(5 813): 804-807.
[2] 李豪, 邹伟,白光剑,等. 高产纤维素酶真菌的筛选及鉴定[J]. 食品与发酵工业,2019,45(6):54-58.
[3] SHU G, MAN H, WANG S, et al. Effect of some factors on production of cellulase by Trichoderma reesei HY07 [J]. Procedia Environmental Sciences, 2011, 8:357-361.
[4] GUPTA P, SAMANT K, SAHU A. Isolation of cellulose-degrading bacteria and determination of their cellulolytic potential [J]. International Journal of Microbiology, 2012(6): 578 925.
[5] CHIMTONG S, TACHAAPAIKOON C, PASON P, et al. Isolation and characterization of endocellulase-free multienzyme complex from newly isolated Thermoanaerobacterium thermosaccharolyticumstrain NOI-1 [J]. Journal of Microbiology & Biotechnology, 2011, 21(3): 284.
[6] KAUR J, CHADHA B S, SAINI H S. Regulation of cellulase production in two thermophilic fungi Melanocarpus sp. MTCC 3922 and Scytalidium thermophilum MTCC 4520 [J]. Enzyme & Microbial Technology, 2006, 38(7): 931-936.
[7] ZHANG Q, LO C M, JU L K. Factors affecting foaming behavior in cellulase fermentation by Trichoderma reesei Rut C-30 [J]. Bioresource Technology, 2007, 98(4): 753-760.
[8] 王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7): 870-875.
[9] NI J, TOKUDA G. Lignocellulose-degrading enzymes from termites and their symbiotic microbiota [J]. Biotechnology Advances, 2013, 31(6): 838-850.
[10] 曾思泉, 凌娟,林丽云,等. 1株红树林来源枝孢属真菌的分离鉴定及纤维素酶性质分析[J]. 微生物学杂志, 2018, 38(2): 37-42.
[11] SWAIN M R, RAY R C. Biocontrol and other beneficial activities of Bacillus subtilis isolated from cowdung microflora [J]. Microbiological Research, 2009, 164(2): 121-130.
[12] 王芳. 里氏木霉的复合诱变及酶系优化[D]. 长沙:中南林业科技大学, 2015.
[13] MENG F, MA L, JI S, et al. Isolation and characterization of Bacillus subtilis strain BY-3, a thermophilic and efficient cellulase-producing bacterium on untreated plant biomass [J]. Letters in Applied Microbiology, 2014, 59(3): 306-312.
[14] 戴剑漉, 张晓婷,卢智黎,等. 新型常压室温等离子体-紫外复合诱变选育埃莎霉素Ⅰ高产菌株[J]. 中国抗生素杂志, 2018, 43(2): 182-188.
[15] 周罗娜, 吴鑫颖,邱树毅,等. 常压室温等离子体快速诱变选育单宁酶高产黑曲霉菌株[J]. 食品科技, 2016, 41(7): 14-19.
[16] SANGWIJIT K, JITONNOM J, PITAKRATTANANUKOOL S, et al. Low-energy plasma immersion ion implantation modification of bacteria to enhance hydrolysis of biomass materials [J]. Surface & Coatings Technology, 2016, 306: 336-340.
[17] 秦艳飞, 余飞,朱振坤,等. 常压室温等离子(ARTP)诱变选育恩拉霉素高产菌株[J]. 食品与发酵科技, 2018, 54(3): 32-36.
[18] 李洋. 纤维素酶产生菌的筛选及产酶条件优化[D]. 大连:大连理工大学, 2015.
[19] 林晓琼, 孙旸,陈光,等. 常压室温等离子体快速诱变筛选高产纤维素酶生产菌株[J]. 吉林农业大学学报, 2016, 38(5): 543-547.
[20] LI Yanhong, ZHAO F K. Advances in cellulase research [J]. Chinese Bulletin of Life Sciences, 2005, 17(5):392-397.
[21] 蒋倩婷, 宋斌,闫文娟. 产纤维素酶菌株选育技术研究进展[J]. 江苏农业科学, 2011, 39(6): 584-587.
[22] IKE M, PARK J Y, TABUSE M, et al. Cellulase production on glucose-based media by the UV-irradiated mutants of Trichoderma reesei [J]. Applied Microbiology and Biotechnology, 2010, 87(6):2 059-2 066.
[23] 郭建强, 柴秀娟,庞学兵,等. 芽胞杆菌高产纤维素酶菌株的诱变选育与培养基优化[J]. 核农学报, 2017, 31(2): 263-270.
[24] EI-GHONEMY D H, ALI T H, EI-BONDKLY A M, et al. Improvement of Aspergillus oryzae NRRL 3484 by mutagenesis and optimization of culture conditions in solid-state fermentation for the hyper-production of extracellular cellulase [J]. Antonie Van Leeuwenhoek, 2014, 106(5): 853-864.
[25] 陈丽燕, 张光祥,黄春萍,等. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J]. 微生物学通报, 2011, 38(4): 531-538.