L-鸟氨酸(L-Ornithine)和L-精氨酸(L-Arginine)作为尿素循环的中间代谢产物,具有多种重要的生理生化功能,在食品、医药和保健品等领域具有广泛的应用[1]。L-精氨酸是合成肌酸、蛋白质的重要原料,是体内信号分子NO的唯一前体,可用于治疗心绞痛、神经性疾病和肝硬化等[2]。L-鸟氨酸有益于创伤、烧伤、感染甚至癌症等疾病的恢复,对肝病也有治疗作用[3-4],还具有良好的减肥保健作用[5]。L-精氨酸的生产方法主要有毛发水解液提取和微生物发酵法。目前,L-鸟氨酸可以通过精氨酸酶水解L-精氨酸和微生物好氧发酵2种方法来生产[6]。
谷氨酸棒杆菌(Corynebacterium glutamicum)是一种环境友好的非致病性革兰氏阳性土壤细菌,已广泛应用于多种有机酸和氨基酸的工业生产[7]。在谷氨酸棒杆菌中,合成氨基酸通常需要消耗大量的NADPH。在L-精氨酸合成途径中每生产1 mol L-精氨酸,需要消耗3 mol的NADPH[8],对于L-鸟氨酸的合成,至少需要消耗2 mol NADPH才能合成1 mol L-鸟氨酸[9],因此,胞内NADPH的供给被认为是L-精氨酸及L-鸟氨酸合成的限制因素。
TAKENO等[10]用变异链球菌来源的NADP+依赖型甘油醛-3-磷酸脱氢酶(GAPDH)替代内源性NAD+依赖型甘油醛-3-磷酸脱氢酶,来改善谷氨酸棒杆菌NADPH水平和提高L-赖氨酸产量。郭雯等[11]通过加强胞内NAD+依赖型的GAPDH表达,L-丝氨酸的产量和生产强度均提高了17.4%[11],说明GAPDH是谷氨酸棒杆菌中的限速酶,通过增加该酶的表达可以增强糖酵解途径代谢流。
谷氨酸棒状杆菌SNK118(C. glutamicum SNK118)是本实验室构建的L-精氨酸生产菌株[12]。如图1所示,在谷氨酸棒杆菌中,L-谷氨酸可以通过由ArgC、ArgJ、ArgB和ArgD组成的代谢途径生成L-鸟氨酸,再由ArgF、ArgG和ArgH 3个酶催化生成L-精氨酸。采用CRISPR-Cpf1技术[13]敲除argF基因以积累L-鸟氨酸,通过敲除argR(精氨酸操纵子阻遏蛋白基因[14])可增加L-鸟氨酸产量。本研究拟在谷氨酸棒杆菌中重组表达梭菌来源的NADP+依赖型的GAPDH编码基因,以增加糖酵解途径代谢流,同时提高胞内NADPH含量,提高L-精氨酸以及L-鸟氨酸的产量。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒及引物
本研究中所涉及到的菌株与质粒和引物及其相关性质等描述见表1和表2。
表1 本文所用的菌株与质粒
Table 1 Strains and plasmids used in this study

菌株/质粒性质来源菌株E.coliJM109克隆宿主TakaraE.coliBL21(DE3)表达宿主TakaraSNK118谷氨酸棒杆菌突变菌株,用于生产L-精氨酸本研究室LR1SNK118ΔargR本研究室LA1SNK118/pXMJ19本研究LA2SNK118/pXMJ19-CbgapC本研究LA3SNK118/pXMJ19-CagapC本研究LA4SNK118/pXMJ19-CsgapC本研究LO1SNK118ΔargFΔargR本研究LO2SNK118ΔargFΔargR/pXMJ19本研究LO3SNK118ΔargFΔargR/pXMJ19-CsgapC本研究质粒pXMJ19Cmr,穿梭质粒(Ptac,lacIq)[15]pXMJ19-CbgapCCbgapC来源于C.beijerinckiiDSM1739本研究pXMJ19-CagapCCagapC来源于C.acetobutylicum1.7本研究pXMJ19-CsgapCCsgapC来源于C.saccharobutylicumDSM13864本研究pJYS3_ΔcrtYfKanr,穿梭质粒[13]pJYS3_ΔargFΔargRKanr,穿梭质粒(用于敲除argF和argR)本研究
表2 本研究所用的引物
Table 2 The primers used in this study

引物名称引物序列(5’-3’)用途CbgapC-FGAAACAGAATTAATTAAGCTTAAAGGAGGACACGCATGTTTAATCATATAAAAAATAAAAACAATAC扩增基因、构建重组质粒CbgapC-RGGTACCCGGGGATCCTCTAGATTAATTATGTATTGATAGATTTATTATAGTAGCC扩增基因、构建重组质粒CagapC-FGAAACAGAATTAATTAAGCTTAAAGGAGGACACGCATGTTTGAAAATATATCATCAAATGGAG扩增基因、构建重组质粒CagapC-RGGTACCCGGGGATCCTCTAGATTATAGGTTTAAAACTATTGATTTATGCC扩增基因、构建重组质粒CsgapC-FGAAACAGAATTAATTAAGCTTAAAGGAGGACACGCATGTTTGAGCATATAAAGGATGAAAAC扩增基因、构建重组质粒CsgapC-RGGTACCCGGGGATCCTCTAGATTATTTAATTGATAAATTTATTATAGTTG扩增基因、构建重组质粒pXMJ19-FGAATTGTGAGCGGATAACAATTTCACAC重组质粒验证与测序pXMJ19-RGGCTGAAAATCTTCTCTCATCCGC重组质粒验证与测序crRNA_argFR-FGTTGTAGATGTCCCTCGAGTGGACGCTCCGATTTAAATAAAACGAAAGGCTCAGTCGAAAGA构建基因敲除质粒crRNA_argFR-RCCACTCGAGGGACATCTACAACAGTAGAAATTCGGATCCATTA构建基因敲除质粒pJYS3-FCTAGATTGACAGCTAGCTCAGTCCTAG构建基因敲除质粒pJYS3-RGGCCCGGTGAACAGTTGTT构建基因敲除质粒argFR-D-FGAACAACTGTTCACCGGGCCAGCCGACCTCGAAACGAACC构建基因敲除质粒argFR-D-FAACTTGATATCACCCAGGCCACCTTG构建基因敲除质粒argFR-U-FGGCCTGGGTGATATCAAGTTTAAGTCCTTTATGCGATTG构建基因敲除质粒argFR-U-FTGAGCTAGCTGTCAATCTAGTGCACGCTTGACTGGTCGT构建基因敲除质粒YcrRNA-FTCAGATTCCTACCTACATAACGGA验证基因敲除质粒YcrRNA-RTAACTAAGTCGACCTGCAGGCAT验证基因敲除质粒DF-FACTTCACGGACTGCTCGATT基因敲除验证DF-RGGTCGCCGAGGAGCTCATCAA基因敲除验证
1.1.2 试剂
非连接酶依赖型单片段快速一步克隆试剂盒,南京诺唯赞生物科技有限公司;Gibson无缝连接试剂盒,NEB公司;DL-三磷酸甘油醛,Sigma-Aldrich公司;限制性核酸内切酶、Primer STAR DNA聚合酶,Takara宝生物工程有限公司;其他试剂,国药集团(上海)化学试剂,有限公司。
1.1.3 培养基
(1)谷氨酸棒杆菌活化用BHI培养基(g/L):NaCl 5,蛋白胨10,脑心浸液18.5,酵母粉5,pH值调至7.2~7.4。固体培养基添加17的琼脂粉,115 ℃灭菌20 min。
(2)谷氨酸棒状杆菌感受态细胞制备用EPO培养基(g/L):蛋白胨10,酵母粉 5,NaCl 10,甘氨酸 25,吐温-80 1,异烟肼 0.4,脑心浸液18.5,121 ℃灭菌20 min。
(3)谷氨酸棒状杆菌电转恢复用LB-HIS培养基(g/L):NaCl 5,蛋白胨20,脑心浸液18.5,酵母粉10,D-山梨醇91,pH值调至7.2~7.4。固体培养基添加17 g/L的琼脂粉,121 ℃灭菌20 min。
(4)种子培养基:葡萄糖30 g/L(115 ℃灭菌16 min,分消),生物素 50 μg/L(滤膜过滤除菌),玉米浆干粉25 g/L,(NH4)2SO45 g/L,尿素 0.8 g/L,MgSO4·7H2O 0.5 g/L,KH2PO4 1.5 g/L,K2HPO4·3H2O 0.5 g/L,pH值调至7.2~7.4,121 ℃灭菌20 min。
(5)发酵培养基:KH2PO4 1.5 g/L,K2HPO4·3H2O 0.5 g/L,尿素0.75 g/L,MgSO4·7H2O 1 g/L,玉米浆干粉20 g/L,(NH4)2SO4 40 g/L,MnSO4·H2O 22.38 mg/L,FeSO4·7H2O 18.3 mg/L,pH调至7.2~7.4,121 ℃灭菌20 min;葡萄糖100 g/L(115 ℃灭菌15 min,分消),CaCO3 30 g/L(160 ℃干热灭菌1.5~2 h),生物素 100 μg/L,维生素B1 200 μg/L。装液量30 mL/500 mL。
1.2 试验方法
1.2.1 重组表达质粒的构建
本研究共克隆了3个GAPDH编码基因:CagapC、CbgapC和CsgapC,分别来源于梭菌C. beijerinckii DSM 1739、C. acetobutylicum 1.7和C. saccharobutylicum DSM 13864。以构建pXMJ19-CsgapC的方法为例,首先以pXMJ19为载体质粒,选取Hind III和Xba I双酶切质粒使其线性化,将酶切产物纯化回收。同时以Clostridium saccharobutylicum DSM 13864基因组为模板,以CsgapC-F/CsgapC-R为引物,PCR扩增得到CsgapC片段,其中片段两端带有质粒的同源臂片段,凝胶电泳验证并通过胶回收试剂盒纯化。将纯化好的CsgapC片段与pXMJ19片段通过快速一步克隆试剂盒连接。连接产物转化至E. coli JM109感受态细胞,通过pXMJ19多克隆位点上下游序列设计的通用引物pXMJ19-F/pXMJ19-R进行菌落PCR,验证并提取质粒测序确认。质粒pXMJ19-CbgapC和pXMJ19-CagapC的构建参考本方法。重组质粒pXMJ19-CsgapC构建流程见图1、图2。

图1 谷氨酸棒杆菌中L-鸟氨酸和L-精氨酸的合成途径
Fig.1 The biosynthesis pathway of L-ornithine and L-arginine in C. glutamicum

图2 pXMJ19-CsgapC质粒构建
Fig.2 Construction of pXMJ19-CsgapC plasmid
1.2.2 CRISPR-Cpf1系统基因敲除质粒pJYS3_ΔargFΔargR的构建
基因argF和argR在谷氨酸棒状杆菌基因组上的位置相距48 bp。首先以质粒pJYS3_ΔcrtYf作为模板,通过引物crRNA_argFR-F/crRNA_argFR-F引入定点突变,即通过全质粒PCR反应将crtYf基因的crRNA序列(GAATTTCTACTGTTGTAGATCAGGCAACCA-TAGGGCAGGAA)替换为argF基因的crRNA序列(GAATTTCTACTGTTGTAGATGTCCC-TCGAGTGGACGCTCCG)。Dpn I消化掉PCR产物中的母本质粒,消化液转入克隆宿主E. coli JM109。测序验证正确后获得pJYS3-I质粒。然后,以pJYS3-F/pJYS3-R为引物,pJYS3-I为模板,PCR扩增得到不包含crtYf基因上下游同源臂的pJYS3-H片段。同时以C. glutamicum SNK118基因组为模板,分别以引物argFR-D-F/argFR-D-R与argFR-U-F/argFR-U-R扩增出基因的下游D与上游U同源片段。胶回收纯化以上3个目的片段,通过Gibson组装法[16]将这3个片段进行组装连接。构建成功获得质粒pJYS3_ΔargFΔargR。质粒的构建流程如图3所示。

图3 敲除质粒pJYS3_ΔargFΔargR的构建
Fig.3 Construction of knockout plasmid pJYS3_ΔargFΔargR
1.2.3 异源基因表达重组菌株的构建
(1)重组大肠杆菌的构建
参考SAMBROOK的方法[17],将构建成功的异源基因重组表达质粒转化到感受态宿主表达细胞E. coli BL21(DE3)中,并涂布于30 mg/L氯霉素平板上,37 ℃培养12 h后菌落PCR验证。
(2)重组谷氨酸棒状杆菌的构建
将上述初筛到的2种重组质粒电转到C. glutamicum感受态细胞中,获得4株重组谷氨酸棒状杆菌菌株SNK118/pXMJ19-CagapC、SNK118/pXMJ19-CsgapC、SNK118 ΔargFΔargR/pXMJ19-CagapC、SNK118ΔargFΔargR/pXMJ19-CsgapC。谷氨酸棒杆菌电转方法与感受态制备见REST的方法[18]。
1.2.4 基因敲除菌SNK118ΔargRΔargF的构建
将成功构建的基因敲除质粒电转至C. glutamicum SNK118感受态细胞中,均匀涂布于含卡那霉素平板,30 ℃静置培养3~4 d,培养过程中Cpf1会对crRNA进行加工,成熟的crRNA会引导Cpf1结合到DNA的特异性位点上,对目标基因进行切割,在菌体内重组酶的作用下,通过同源重组将基因argF、argR进行敲除,培养结束后菌落PCR验证筛选出成功敲除的突变株。对成功敲除的突变株划线于无抗平板,34 ℃培养16 h以消除pJYS3_ΔargFΔargR。
1.2.5 GAPDH酶活力的测定
在30 ℃条件下,通过分光光度法测量340 nm波长下NADP(或NAD+)还原的吸光值变化来计算GAPDH活力[19]。标准反应混合物含有300 μL 100 mmol/L Tris-HCl(pH 8.5),60 μL 10 mmol/L H3PO4,60 μL 10 mmol/L NADP+(或NAD+),60 μL 10 mmol/L甘油醛3-磷酸,50 μL的β-巯基乙醇和70 μL粗酶液。通过添加细胞破碎粗酶液引发催化反应。1单位GAPDH活力定义为在上述条件下1 min内还原1 μmol NAD(或NADP+)所需的酶量。
使用牛血清蛋白标准液,通过Bradford方法计算蛋白质浓度,按公式(1)计算:
比活力![]()
(1)
1.2.6 胞内辅酶水平的测定
30 ℃培养46 h后收获菌体细胞,并洗涤2次。使用NADP+/NADPH试剂盒(BioAssay Systems,Hayward,CA)抽提并测定胞内NADPH/NADP+的辅酶参数。
1.2.7 菌体浓度、氨基酸浓度、葡萄糖浓度的测定
菌体浓度的测定:取一定量的菌液用0.2 mol/L盐酸稀释50~100倍后,用分光光度计在660 nm波长下测定吸光值。
氨基酸浓度测定:采用高效液相色谱(high performance liquid chromatography, HPLC)分析仪进行邻苯二甲醛(O-phthalaldehyde, OPA)在线衍生化法测定[20]。
葡萄糖浓度的测定:发酵上清液稀释100倍,采用SBA-40C生物传感器分析仪进行测定。
2 结果与分析
2.1 NADP+依赖型的GAPDH的克隆与表达筛选
在NCBI数据库中,通过BLAST搜索,选择不同梭菌的3个编码NADP+依赖型的GAPDH基因:CagapC、CbgapC、CsgapC。将这3个基因克隆到穿梭载体pXMJ19中,并在大肠杆菌BL21(DE3)中诱导表达。之后测定细胞提取物中重组GAPDH的比活力,如表3所示。
表3 重组GAPDH在E. coli和C. glutamicum的酶活力
Table 3 Specific activities of recombinant GAPDHs in E. coli and C. glutamicum

菌株比活力/(mU·mg-1)CaGapCCsGapCNAD+NADP+NAD+NADP+E.coli<52000±100<55263±300SNK118<5<5<577±3
结果显示,重组CaGapC和CsGapC在30 ℃下的比活力分别为2 000 mU/mg和5 263 mU/mg,而CbGapC没有显示出催化活性。基于以上结果,将重组质粒pXMJ19-CagapC、pXMJ19-CsgapC分别转入SNK118菌株,评估这2个重组酶在谷氨酸棒杆菌中合成NADPH的催化活性。据报道,丙酮丁醇梭菌来源的编码NADP+依赖型GAPDH的gapC的表达改善了谷氨酸棒杆菌胞内NADPH的供应[21]。然而,在甘油醛-3-磷酸和NADP+作为底物时,只有CsGapC显示出77 mU/mg的酶活力(表3),表明CsGapC具有催化3-磷酸甘油醛生成3-磷酸甘油酸的活性,同时可以为C. glutamicum SNK118提供额外的NADPH来源。
2.2 重组菌发酵产L-精氨酸性能评价
将重组菌LA4(SNK118/pXMJ19-CsgapC)与对照菌LA1(SNK118/pXMJ19)的种子液接种于发酵培养基中进行发酵,考察CsgapC的重组表达对谷氨酸棒杆菌产L-精氨酸的影响。结果如图4所示,发酵过程中菌浓并无明显差异。在40 h时重组菌LA4的L-精氨酸浓度超过对照菌LA1;最终发酵至70 h,LA4的L-精氨酸产量为11.55 g/L,较LA1(9.17 g/L)对照菌株L-精氨酸产量提高了26%,糖酸转化率提高了10%(见表4),说明CsgapC的表达能有效提高谷氨酸棒杆菌产L-精氨酸的能力。同时,通过测定对数生长期时胞内NADPH/NADP+参数,发现重组菌LA4中的NADPH/NADP+比值为0.31,显著高于对照菌LA1(0.21),说明重组菌LA4的胞内NADPH水平得到了提高。KABUS等[22]和ZHAN等[12]在谷氨酸棒杆菌中异源表达烟酰胺核苷酸转氢酶PntAB催化NADP+生成NADPH,分别提高了L-赖氨酸和L-精氨酸产量。YAMAMOTO等[23]在谷氨酸棒杆菌中过表达GAPDH编码基因,增加了从3-磷酸甘油醛到1,3-二磷酸甘油酸代谢流的流量,从而提高了L-丙氨酸产量。因此,L-精氨酸积累量的提高可能是糖酵解途径代谢流的增加和胞内NADPH水平的提高共同作用的结果。
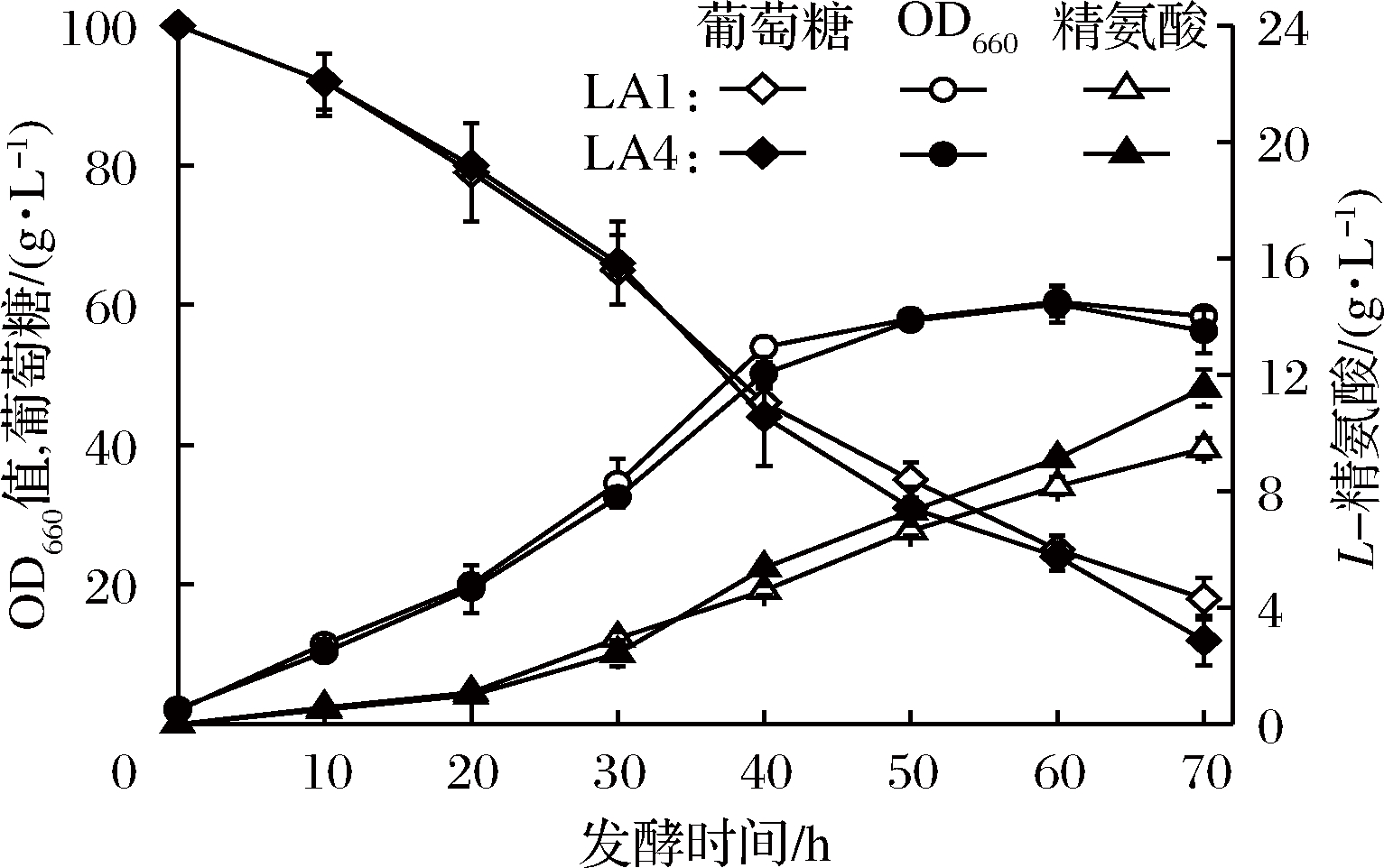
图4 对照菌LA1(SNK118/pXMJ19)和重组菌LA4(SNK118/pXMJ19-CsgapC)发酵产L-精氨酸的比较
Fig.4 Fermentative production of L-arginine by SNK118/ pXMJ19 and SNK118/pXMJ19-CsgapC
2.3 构建L-鸟氨酸生产菌株SNK118ΔargFΔargR
L-鸟氨酸是L-精氨酸合成的中间代谢产物。C. glutamicum SNK118可用作合成L-鸟氨酸代谢改造的出发菌株。将菌落PCR验证成功敲除argF和argR的C. glutamicum SNK118ΔargFΔargR进行L-鸟氨酸摇瓶发酵,结果如图5所示。经过68 h的发酵,菌株LO1(SNK118ΔargFΔargR)的L-鸟氨酸产量达到22.3 g/L,L-精氨酸产量为0.14 g/L。对照菌株LR1(SNK118ΔargR)L-鸟氨酸产量仅为0.23 g/L,而L-精氨酸积累了8.62 g/L。说明敲除编码鸟氨酸氨基甲酰基转移酶的基因argF可以阻断L-鸟氨酸降解为L-瓜氨酸和L-精氨酸,从而有效积累L-鸟氨酸。此外,argF与精氨酸操纵子阻遏蛋白基因argR在基因组上毗邻,可同时被敲除,以解除反馈抑制。
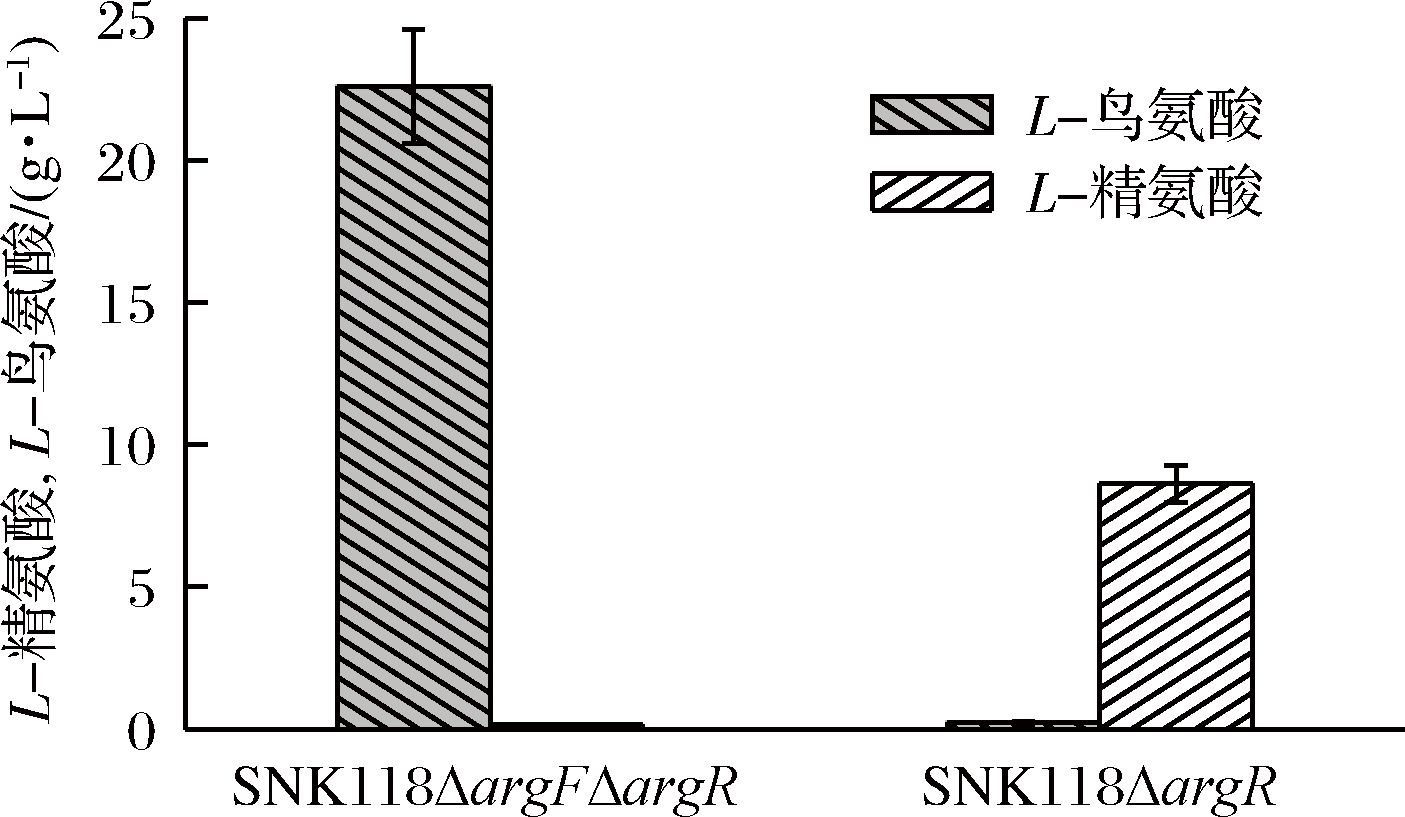
图5 SNK118ΔargR与SNK118ΔargFΔargR的L-鸟氨酸和L-精氨酸产量的比较
Fig.5 Production of L-arginine and L-ornithine by SNK118ΔargR and SNK118ΔargFΔargR
2.4 重组菌发酵产L-鸟氨酸性能评价
NADPH的供给被认为是L-精氨酸、L-瓜氨酸和L-鸟氨酸等氨基酸合成的至关重要因素[9]。GAPDH是糖酵解途径中的关键酶,其催化的反应是糖酵解途径的限速步骤[11]。因此,为了评估CsgapC的表达对发酵生产L-鸟氨酸的影响,构建了重组菌株LO3(SNK118ΔargFΔargR/pXMJ19-CsgapC)和空白对照菌株LO2(SNK118ΔargFΔargR/pXMJ19)。在L-鸟氨酸发酵培养基中比较了菌株LO2和LO3的发酵性能。结果如图6所示,发酵30 h后重组菌LO3的L-鸟氨酸产量高于对照菌LO2。发酵70 h后对照菌株LO2的L-鸟氨酸产量为23.11 g/L,糖酸转化率为0.237 g/g葡萄糖。LO3的L-鸟氨酸产量为27.76 g/L,糖酸转化率为0.274 g/g葡萄糖(表4),较对照菌株LO2分别提高了20.1%和15.6%。在细胞生长方面,菌株LO2和LO3相差不大,最终OD660均达到41。同时重组菌LO3胞内NADPH/NADP+比值较对照菌株LO2提高了60%。说明重组表达NADP+依赖型的GAPDH基因CsgapC可提高辅酶NADPH的含量,增强糖酵解途径的代谢流量,从而提高重组谷氨酸棒杆菌的L-鸟氨酸产量。
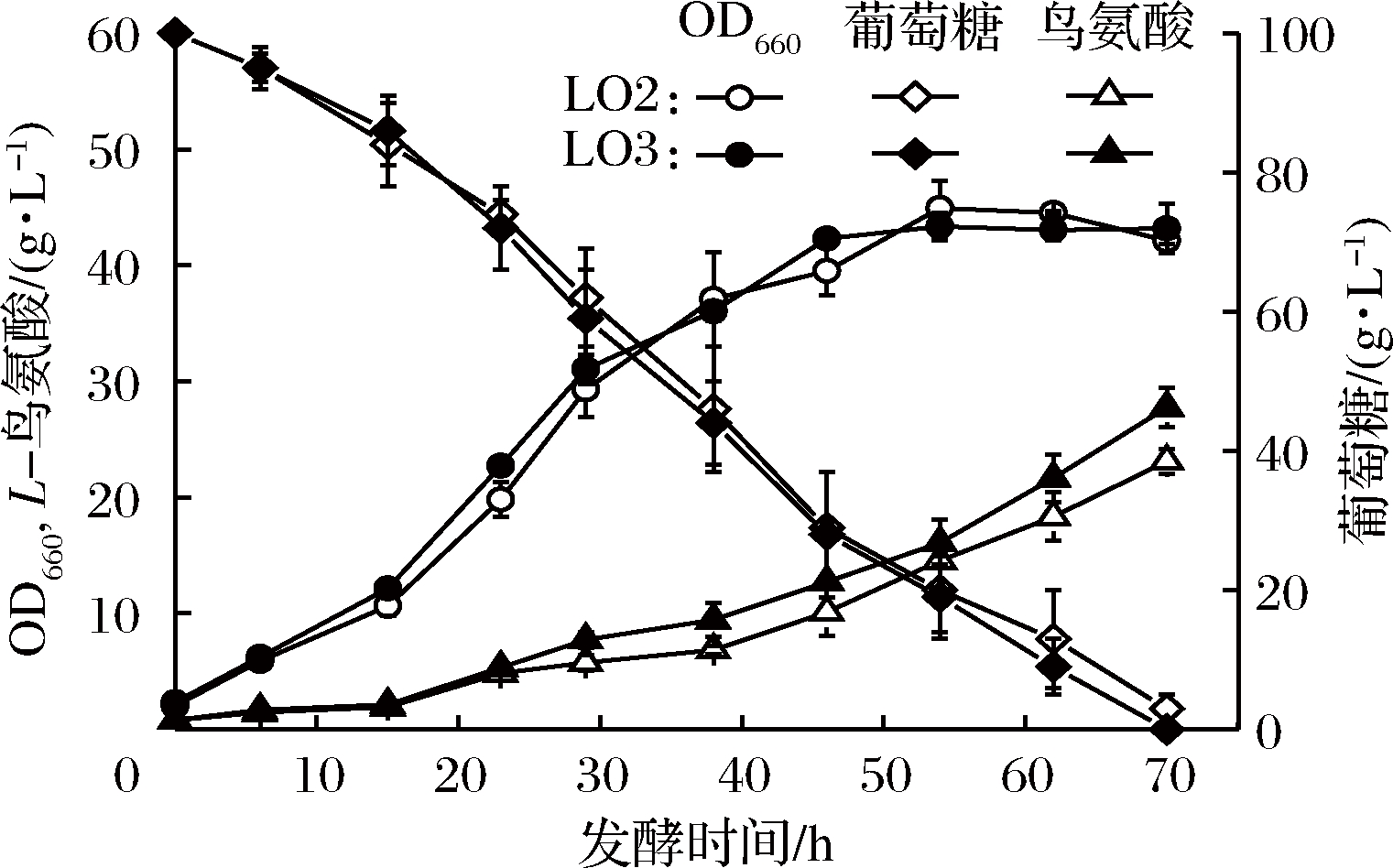
图6 菌株LO2(SNK118ΔargFΔargR/pXMJ19)和LO3(SNK118ΔargFΔargR/pXMJ19-CsgapC)发酵产L-鸟氨酸的比较
Fig.6 Fermentative production of L-ornithine by SNK118 ΔargFΔargR/pXMJ19 and SNK118ΔargFΔargR/ pXMJ19-CsgapC
在L-鸟氨酸生产菌SNK118ΔargFΔargR中,L-鸟氨酸产量可达22.3 g/L(168.7 mmol/L),在L-精氨酸生产菌SNK118ΔargR中,L-精氨酸产量为8.62 g/L(49.5 mmol/L),可以推断在C. glutamicum SNK118中,L-精氨酸合成途径中由ArgF、ArgG、和ArgH组成的代谢途径是限制步骤,后续研究在以上的基础上围绕提高ArgG和ArgH的酶活力来提高L-精氨酸的产量。
表4 谷氨酸棒状杆菌生产L-精氨酸、L-鸟氨酸的发酵参数
Table 4 Fermentation parameters of L-arginine and L-ornithine production by engineered C. glutamicum strains

菌株NADPH/NADP+产物产量/(g·L-1)产率/(g·g-1)SNK118/pXMJ190.21±0.10L-精氨酸9.17±0.170.118±0.005SNK118/pXMJ19-CsgapC0.31±0.12L-精氨酸11.55±0.640.130±0.002SNK118ΔargFΔargR/pXMJ190.20±0.09L-精氨酸23.11±3.100.237±0.025SNK118ΔargFΔargR/pXMJ19-CsgapC0.32±0.11L-精氨酸27.76±1.970.274±0.030
3 结论
本文以C. glutamicum SNK118为出发菌株,考察了糖丁基梭菌来源的NADP+依赖型的GAPDH基因CsgapC的表达对发酵产L-精氨酸和L-鸟氨酸的影响。重组菌SNK118/pXMJ19-CsgapC的L-精氨酸产量比对照菌株SNK118/pXMJ19提高了26%,糖酸转化率提高了10%。采用CRISPR-Cpf1基因编辑工具成功敲除了SNK118的基因argF和argR,构建了L-鸟氨酸生产菌株SNK118ΔargFΔargR,有效实现了L-鸟氨酸的积累,产量可达22.3 g/L。进一步将糖丁基梭菌来源的CsgapC引入SNK118ΔargFΔargR得到重组菌LO3,评估了CsgapC的重组表达对谷氨酸棒杆菌产L-鸟氨酸的影响。与对照菌相比,重组菌LO3的L-鸟氨酸产量为27.76 g/L,糖酸转化率为0.274 g/g,较对照菌株LO2分别提高了20.1%和15.6%。说明重组表达梭菌来源的NADP+依赖型的GAPDH编码基因可增强糖酵解途径的代谢流量,并提高胞内NADPH的含量,从而提高L-精氨酸和L-鸟氨酸的产量。本文首次报道了通过异源表达糖丁基梭菌来源的CsgapC改造策略实现谷氨酸棒状杆菌更高效合成L-精氨酸及L-鸟氨酸,也为提高其他氨基酸产量提供了依据。
[1] SHIN J H,LEE S Y.Metabolic engineering of microorganisms for the production of L-arginine and its derivatives[J].Microb Cell Fact,2014,13(1):166.
[2] PALMER R M,ASHTON D S,MONCADA S.Vascular endothelial cells synthesize nitric oxide from L-arginine[J].Nature,1988,333:664-666.
[3] SALVATORE F,CIMINO F,D’AYELLO-CARACCIOLO M,et al.Mechanism of the protection by L-ornithine-L-aspartate mixture and by l-arginine in ammonia intoxication[J].Arch Biochem Biophys,1964,107(3):499-503.
[4] SHI H P,FISHEL R S,EFRON D T,et al.Effect of supplemental ornithine on wound healing[J].J Surg Res,2002,106(2):299-302.
[5] ZAJAC A,POPRZECKI ![]() A,et al.Arginine and ornithine supplementation increases growth hormone and insulin-like growth factor-1 serum levels after heavy-resistance exercise in strength-trained athletes[J].J Strength Cond Res,2010,24(4): 1 082-1 090.
A,et al.Arginine and ornithine supplementation increases growth hormone and insulin-like growth factor-1 serum levels after heavy-resistance exercise in strength-trained athletes[J].J Strength Cond Res,2010,24(4): 1 082-1 090.
[6] 孙安然,宋伟,刘佳,等. 生物酶法合成L-精氨酸衍生物的研究进展[J].生物工程学报,2018,34(2):165-176.
[7] BECKER J,WITTMANN C.Advanced biotechnology: metabolically engineered cells for the bio-based production of chemicals and fuels, materials, and health-care products[J].Angew Chem Int Ed Engl,2015,54(11):3 328-3 350.
[8] PARK S H,KIM H U,KIM T Y,et al.Metabolic engineering of Corynebacterium glutamicum for L-arginine production[J].Nat Commun,2014,5:4 618.
[9] KIM S Y,LEE J,LEE S Y.Metabolic engineering of Corynebacterium glutamicum for the production of L-ornithine[J].Biotechnol Bioeng,2015,112(2):416-421.
[10] TAKENO S,HORI K,OHTANI S,et al.L-lysine production independent of the oxidative pentose phosphate pathway by Corynebacterium glutamicum with the Streptococcus mutans gapN gene[J].Metab Eng,2016,37:1-10.
[11] 郭雯,赖联贺,张晓梅,等. 加强表达3-磷酸甘油醛脱氢酶对谷氨酸棒杆菌产L-丝氨酸的影响[J].食品与发酵工业,2016,42(9):15-20.
[12] ZHAN Milin, KAN Baojun,DONG Jinjun,et al.Metabolic engineering of Corynebacterium glutamicum for improved l-arginine synthesis by enhancing NADPH supply[J].J Ind Microbiol Biotechnol,2018,46:45-54.
[13] JIANG Yu,QIAN Fenghui,YANG Junjie,et al.CRISPR-Cpf1 assisted genome editing of Corynebacterium glutamicum[J].Nat.Commun,2017,8:15 179.
[14] XU Meijuan,RAO Zhiming,DOU Wenfang,et al.The role of ARGR repressor regulation on L-arginine production in Corynebacterium crenatum[J].Appl Biochem and Biotechnol,2013,170(3):587-597.
[15] JAKOBY M,NGOUOTO-NKILI C E,BURKOVSKI A.Construction and application of new Corynebacterium glutamicum vectors[J].Biotechnol Tech,1999,13(6):437-441.
[16] GIBSON D G,CHUANG R Y,VENTER J C,et al. Enzymatic assembly of DNA molecules up to several hundred kilobases[J].Nat Methods,2009,6(5):343-345.
[17] SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning: a laboratory manual[M].Cold Spring Harbor Laboratory Press,1989.
[18] REST M E V D,LANGE C,MOLENAAR D.A heat shock following electroporation induces highly efficient transformation of Corynebacterium glutamicum with xenogeneic plasmid DNA[J].Appl Microbiol and Biot,1999,52(4):541-545.
[19] IDDAR A,VALVERDE F,SERRANO A,et al.Expression, purification, and characterization of recombinant nonphosphorylating NADP-dependent glyceraldehyde-3-phosphate dehydrogenase from Clostridium acetobutylicum[J].Protein Expression Purif,2002,25(3):519-526.
[20] XU Meijuan,RAO Zhiming,DOU Wenfang,et al.Site-directed mutagenesis and feedback-resistant N-acetyl-L-glutamate kinase (NAGK) increase Corynebacterium crenatum L-arginine production[J].Amino Acids,2012,43(1):255-266.
[21] JIANG Lingyan, ZHANG Yuanyuan,LI Zhen,et al.Metabolic engineering of Corynebacterium glutamicum for increasing the production of L-ornithine by increasing NADPH availability[J].J Ind Microbiol Biotechnol,2013, 40(10):1 143-1 151.
[22] KABUS A,GEORGI T,WENDISCH V F,et al.Expression of the Escherichia coli pntAB genes encoding a membrane-bound transhydrogenase in Corynebacterium glutamicum improves L-lysine formation[J]. Appl Microbiol Biot,2007,75(1):47-53.
[23] YAMAMOTO S,GUNJI W,SUZUKI H,et al.Overexpression of genes encoding glycolytic enzymes in Corynebacterium glutamicum enhances glucose metabolism and alanine production under oxygen deprivation conditions[J].Appl Environ Microb,2012,78(12):4 447-4 457.