兔肉因高蛋白质、低脂肪,且低热量、高消化率的营养特性[1-2],比较符合当代人们所追求的“营养与健康”的饮食理念,逐渐被世界肉类消费者所接受[3]。据联合国粮农组织(FAO)的数据显示[4],2017年世界兔肉的总产量为148.2万t,较2016年增长2.9%,我国继续以93.1万t产量居世界第一。
蛋白质作为兔肉的重要组成成分,对兔肉品质有着决定性的作用。按照溶解性的不同,肉类的蛋白质可以分为水溶性蛋白质、盐溶性蛋白质和盐不溶性蛋白质3大类,即肌浆蛋白、肌原纤维蛋白和肌基质蛋白,其三者的组成比例直接影响着肉品的加工品质[5],肉品的色泽、风味、口感和质构等品质特性与其蛋白质组成情况息息相关[6],但目前缺乏关于兔肉蛋白质组成的详细报道。
蛋白质组学是研究蛋白质组中蛋白质特征、表达和功能的动态变化的学科[7]。近年,随着科学技术的进步,蛋白质组学技术得到了快速发展。特别是以质谱为基础的蛋白质组学技术,因其大规模、高通量和可系统分析等优点被广为接受,shotgun蛋白质组学技术就是其中的代表[8]。YU等[9]利用shotgun蛋白质组学技术研究了熟羊肉中蛋白质组成的变化,证明了烧烤会降低蛋白质的可提取性;此外,shotgun蛋白质组学技术还被用来检测肉中的微量污染物[10]和鉴定掺假肉制品中的生物性标记肽[11]。尽管LIU等[12]对兔肉骨骼肌中肌质网的蛋白质组成进行了分析,ALMEIDA等[13]也建立了兔肉腓肠肌的第一个蛋白质组参考图,但是关于家兔在生长过程中蛋白质组的变化情况还有待了解。鉴于此,本研究以雄性伊拉兔为研究对象,比较了不同日龄兔肉中肌浆蛋白、肌原纤维蛋白和肌基质蛋白的组成比例情况,并运用shotgun蛋白质组学技术深入探讨了兔肉的蛋白质组成,以期能为兔肉蛋白质的研究和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
雄性伊拉兔,重庆阿兴记食品有限公司,分35、70和105三个日龄,每个日龄各10只;十二烷基硫酸钠(SDS)、尿素(Urea)、碘乙酰胺(IAA)、二硫苏糖醇(DTT),美国Bio-Rad公司;三羟甲基氨基甲烷(Tris)、碳酸氢铵(NH4HCO3)、三氟乙酸(TFA),美国Sigmag公司;甲酸(FA)和乙腈(ACN)(LC-MS级),德国Merck公司;KCl、KH2PO4、HCl(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
L-8900氨基酸分析仪,日本日立公司;5430R低温高速离心机,德国Eppendorf公司;EPS601电泳仪,美国GE Healthcare公司;色谱系统Easy nLC、质谱仪Q Exactive、酶标仪Multiskcan FC,美国Thermo Scientific公司;MP Fastprep-24匀浆仪,美国MP Biomedicals公司;JY92-II超声破碎仪,宁波新芝生物科技股份有限公司;GNP-9080恒温培养箱,上海精宏实验设备有限公司;振荡器Votex,上海琪特分析仪器有限公司。
1.3 试验方法
1.3.1 样品处理
不同日龄的兔子经过屠宰后,立即去皮、去爪、去头和去内脏,然后取出背最长肌做好标记,放入装有冰袋的采集箱中,尽快运回实验室。用于shotgun蛋白组学分析的样品放在-80 ℃的冰箱中保存,其他样品放在-20 ℃的冰箱中保存,用于后续的研究分析。
1.3.2 分析测定
1.3.2.1 化学成分分析
样品中水分、蛋白质、脂肪和灰分的测定按照AOAO[14]的方法。
1.3.2.2 氨基酸的测定
样品中氨基酸的测定参考LUO[15]的方法,即先用酸水解法对样品进行处理,然后运用氨基酸自动分析仪对样品中的天门冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)、胱氨酸(Cys)、缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr)、苯丙氨酸(Phe)、赖氨酸(Lys)、脯氨酸(Pro)、组氨酸(His)、精氨酸(Arg)17种氨基酸进行测定。但由于酸水解法破坏样品中的色氨酸(Trp),因此色氨酸的测定参考DAWOOD[16]的方法。
1.3.2.3 肌浆蛋白、肌原纤维蛋白、肌基质蛋白比例的测定
样品中肌浆蛋白、肌原纤维蛋白、肌基质蛋白的提取参考HASHIMOTO[17]的方法并稍作改动,即取25 g兔肉加入100 mL磷酸盐缓冲液(15.6 mmol/L Na2HPO4, 3.5 mmol/L KH2PO4, pH 7.5)中,在10 000 r/min下均质1 min,随即将均质液在4 ℃和5 000×g条件下离心20 min,得到上清液和沉淀,分别记为上清液I和沉淀I,然后沉淀I重复上述步骤,得到上清液II和沉淀II,将上清液I和II混合起来,向其中缓慢加入丙酮使蛋白质沉淀,随后将混合物在4 ℃和5 000×g条件下离心20 min,所得沉淀即为肌浆蛋白;向上述沉淀II中加入10倍体积冰冷的磷酸盐缓冲液(0.05 mol/L Na2HPO4, 0.05 mol/L NaH2PO4, 1.1 mol/L KCl, pH 7.5),在10 000 r/min下均质1 min,随即将均质液在4 ℃和5 000×g条件下离心20 min,得到上清液III和沉淀III。上清液III备用,然后将沉淀III重复上述步骤得到上清液Ⅳ和沉淀Ⅳ,上清液Ⅳ备用,而沉淀IV即为肌基质蛋白。将上清液III和IV在4 ℃下用去离子水透析48 h,得到的固体物即为肌原纤维蛋白,最后运用凯氏定氮法对蛋白进行定量分析。3种蛋白质的比例按照公式(1)、(2)、(3)进行计算:
(1)
(2)
P3/%=1-P1-P2
(3)
式中:P1, P2和P3分别代表样品中肌浆蛋白、肌原纤维蛋白和肌基质蛋白占总蛋白的比例,P肌浆蛋白, P肌原纤维蛋白和P总蛋白分别代表样品中肌浆蛋白、肌原纤维蛋白和总蛋白的含量。
1.3.2.4 肌浆蛋白、肌原纤维蛋白和肌基质蛋白氨基酸组成的分析
将70日龄伊拉兔中的肌浆蛋白、肌原纤维蛋白和肌基质蛋白按照1.3.2.3的方法进行提取,然后真空冷冻干燥24 h后参考1.3.2.2中的方法对其进行氨基酸分析。
1.3.2.5 Shotgun蛋白组学分析
样品处理:参考ZHU[18]的方法对兔肉进行处理,即向兔肉中加入适量SDT裂解液(4% SDS, 150 mmol/L Tris-HCl, 100 mmol/L DTT, pH 8.0),然后转移至预先装有适量石英砂的离心管中,再应用匀浆仪对其进行匀浆破碎,超声处理(80 W,工作10 s,间歇15 s,循环10次)后在沸水浴中保持15 min。然后在离心力为14 000×g的条件下离心40 min,最后取上清液采用0.22 μm滤膜过滤,收集滤液,采用BCA法对滤液中的蛋白质进行定量分析。对样品进行分装,并于-80 ℃条件下保存。
聚丙烯酰胺凝胶电泳(SDS-PAGE):各样品分别取20 μg蛋白质,分别加入5倍上样缓冲液(10% SDS, 0.5% 溴酚蓝, 50%甘油, 500 mmol/L DTT, 250 mmol/L Tris-HCl, pH 6.8),沸水浴保持5 min后进行12.5% SDS-PAGE电泳(恒流14 mA,90 min),最后进行考马斯亮蓝染色。
FASP酶解[19]:取30 μL蛋白质溶液,分别加入DTT溶液至终蛋白质浓度为100 mmol/L,沸水浴5 min后冷却至室温;再加入200 μL UA buffer(8 mol/L urea, 150 mmol/L Tris-HCl, pH 8.0)混匀后转入10 kDa的超滤离心管中,在14 000×g的条件下离心 15 min,除去滤液(重复该步骤1次);加入100 μL IAA buffer,600 r/min振荡1 min,在室温避光条件下反应30 min,然后以14 000×g离心 15 min;随后加入100 μL UA缓冲液在14 000×g的条件下离心15 min,重复该步骤2次;加入100 μL 25 mmol/L NH4HCO3溶液在离心力为14 000×g的条件下离心 15 min,重复该步骤2次;加入40 μL胰蛋白酶缓冲液(4 μg胰蛋白酶溶于 40 μL 100 mmol/L NH4HCO3),以600 r/min振荡1 min后在37 ℃下放置 16~18 h;随后换新收集管,在14 000×g的条件下离心 15 min;再加入40 μL 25 mmol/L NH4HCO3,以14 000×g离心15 min,收集滤液。最后采用C18柱对肽段进行脱盐处理,在肽段冻干后加入40 μL 0.1% FA溶液复溶,随后进行肽段定量分析。
质谱分析:样品采用纳升流速的高效液相色谱系统Easy nLC进行分离。缓冲液A液为0.1% FA水溶液,B液为0.1% FA-ACN水溶液(ACN为84%)。色谱柱用95%的A液平衡,流速为300 nL/min。样品经高效液相色谱分离后用Q-Exactive质谱仪进行质谱分析。分析时长为60min,检测方式为正离子,母离子扫描范围m/z 300~1 800。
1.4 数据分析
运用SPSS 22.0软件对数据进行方差分析;用MaxQuant 1.5.3.17对质谱数据进行分析;利用Origin 8.0和Photoshop CS6软件作图。
2 结果与分析
2.1 日龄对兔肉营养成分的影响
不同日龄伊拉兔肌肉的营养成分如表1所示。新鲜兔肉中水分含量通常在70%~77%,并且肉中的水分和脂肪含量往往存在着一定程度的负相关,即水分含量高的肉中脂肪含量较低,反之亦然[20]。由表1可知,35日龄的伊拉兔肌肉中的水分含量显著高于105日龄(P<0.05),105日龄的伊拉兔肌肉中脂肪含量显著高于35日龄(P<0.05),与METZGER[21]的研究结果相一致,可见,年龄会显著影响兔肉中的水分和脂肪含量。在3个日龄组中,105日龄伊拉兔的肌肉中灰分含量最高(P<0.05)。蛋白质作为肌肉的主要组成成分,其含量的多少直接影响着肉的品质,如肉的嫩度、多汁性和颜色等,从而影响消费者对肉制品的整体接受度[22]。从表1中可以看出,35日龄的伊拉兔肌肉中的蛋白质含量显著低于其他2个日龄(P<0.05),这主要是由不同日龄兔肉中水分含量的差异引起的[23]。
表1 不同日龄伊拉兔肌肉的营养成分
Table 1 Nutritional components of meat samples from different old rabbits
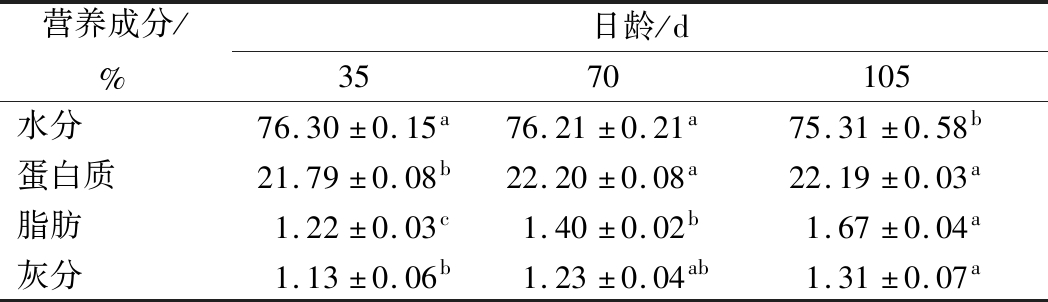
营养成分/%日龄/d3570105水分76.30±0.15a76.21±0.21a75.31±0.58b蛋白质21.79±0.08b22.20±0.08a22.19±0.03a脂肪1.22±0.03c1.40±0.02b1.67±0.04a灰分1.13±0.06b1.23±0.04ab1.31±0.07a
注:不同小写字母表示不同日龄之间有显著性差异(P<0.05),下同。
2.2 日龄对兔肉蛋白质构成的影响
雄性伊拉兔肌肉的蛋白质构成如图1所示。一般而言,蛋白质的构成对肉的品质有着决定性的作用,特别是肌原纤维蛋白,它主要负责肌肉的收缩特性,影响肉制品的质构、嫩度和保水性[24]。本研究中,伊拉兔肌肉中肌浆蛋白和肌原纤维蛋白占总蛋白的32.32%和57.35%,且其不受日龄的影响(P>0.05);这与TOMBERG[25]结果相一致,他发现肌肉中肌浆蛋白占总蛋白的30%~35%,肌原纤维蛋白占总蛋白的55%~60%。肌基质蛋白作为肌肉蛋白质的另一重要组成部分,主要由胶原蛋白组成,与肉的嫩度息息相关。从图1可以看出,雄性伊拉兔肌肉中肌基质蛋白占总蛋白的比例受到日龄的影响比较显著(P<0.05),这是因为随着日龄的增加,其胶原蛋白的结构和数量也会发生相应的变化[26]。此外,伊拉兔肌肉中肌基质蛋白占总蛋白的10.33%,高于鱼肉中的比例3%~5%[27],侧面验证了鱼肉嫩度高于兔肉。

图1 不同日龄伊拉兔肌肉的蛋白质构成
Fig.1 The protein quantity of meat samples from different old rabbits
2.3 伊拉兔肌肉中不同类型蛋白质的氨基酸组成
肌浆蛋白主要是由参与肌肉收缩的酶和肌红蛋白组成[28];肌原纤维蛋白主要由肌动蛋白和肌球蛋白等蛋白组成[29];胶原蛋白是肌基质蛋白的主要成分。每种蛋白质都有其独特的氨基酸组成,所以肌浆蛋白、肌原纤维蛋白和肌基质蛋白的氨基酸组成存在着差异。可以看出,肌原纤维蛋白的必需氨基酸含量最高,达到了41.67 g/100 g蛋白质。Lys和Glu分别是蛋白质中含量最高的必需氨基酸和非必需氨基酸,这与2.4中的研究结果一致。除Glu外,肌基质蛋白中非必需氨基酸Pro、Ala和Gly的含量较高,这主要是因为Ala、Pro和Gly是胶原蛋白的主要组成氨基酸,胶原蛋白是肌基质蛋白的主体成分[30]。
表2 不同类型蛋白质的氨基酸含量
Table 2 The amino acid content of different proteins
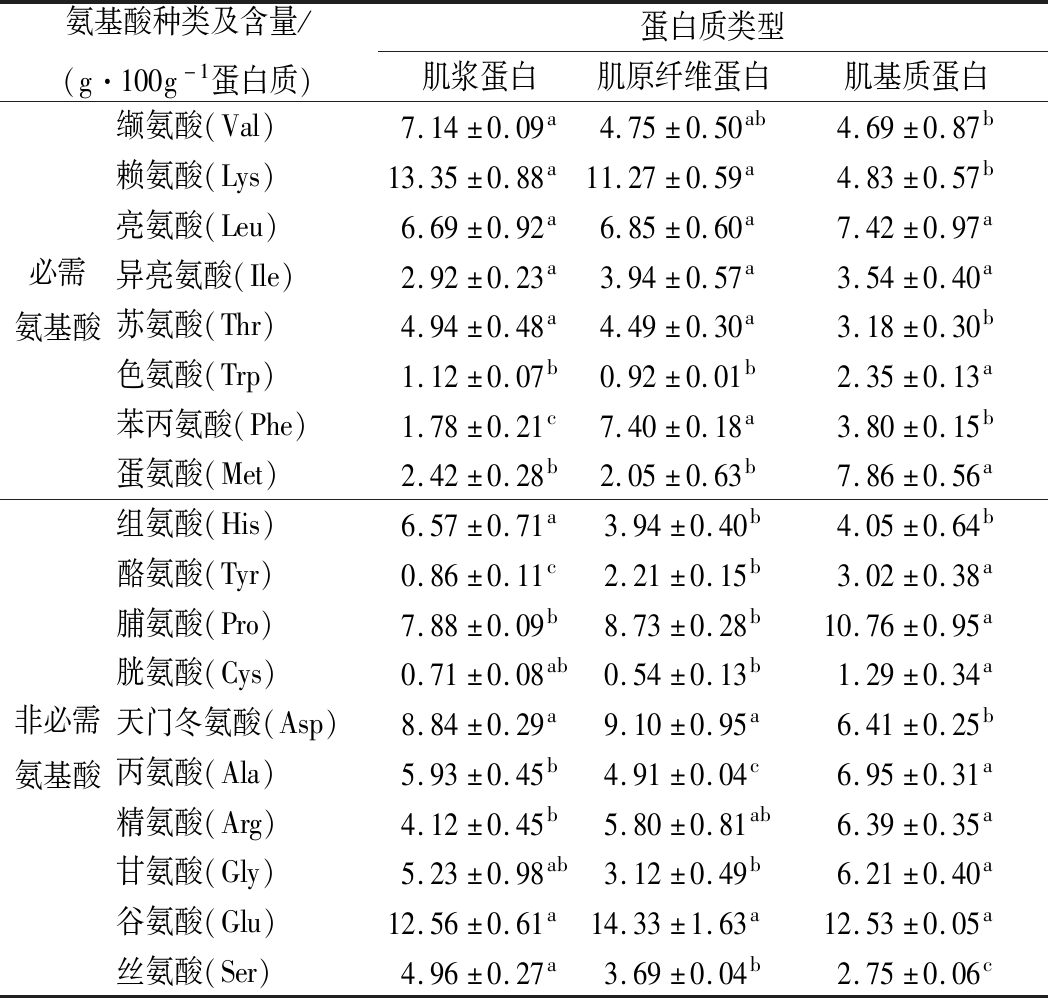
氨基酸种类及含量/(g·100g-1蛋白质)蛋白质类型肌浆蛋白肌原纤维蛋白肌基质蛋白必需氨基酸缬氨酸(Val)7.14±0.09a4.75±0.50ab4.69±0.87b赖氨酸(Lys)13.35±0.88a11.27±0.59a4.83±0.57b亮氨酸(Leu)6.69±0.92a6.85±0.60a7.42±0.97a异亮氨酸(Ile)2.92±0.23a3.94±0.57a3.54±0.40a苏氨酸(Thr)4.94±0.48a4.49±0.30a3.18±0.30b色氨酸(Trp)1.12±0.07b0.92±0.01b2.35±0.13a苯丙氨酸(Phe)1.78±0.21c7.40±0.18a3.80±0.15b蛋氨酸(Met)2.42±0.28b2.05±0.63b7.86±0.56a非必需氨基酸组氨酸(His)6.57±0.71a3.94±0.40b4.05±0.64b酪氨酸(Tyr)0.86±0.11c2.21±0.15b3.02±0.38a脯氨酸(Pro)7.88±0.09b8.73±0.28b10.76±0.95a胱氨酸(Cys)0.71±0.08ab0.54±0.13b1.29±0.34a天门冬氨酸(Asp)8.84±0.29a9.10±0.95a6.41±0.25b丙氨酸(Ala)5.93±0.45b4.91±0.04c6.95±0.31a精氨酸(Arg)4.12±0.45b5.80±0.81ab6.39±0.35a甘氨酸(Gly)5.23±0.98ab3.12±0.49b6.21±0.40a谷氨酸(Glu)12.56±0.61a14.33±1.63a12.53±0.05a丝氨酸(Ser)4.96±0.27a3.69±0.04b2.75±0.06c
2.4 日龄对兔肉氨基酸组成的影响
从表3中可以看出,日龄对伊拉兔肌肉中部分氨基酸的含量有显著影响。与35日龄的伊拉兔相比,105日龄的伊拉兔肌肉中含有较高的Leu、Tyr、Pro、Asp、Ala、Arg,较低的Thr和Ser(P<0.05),这主要与它们食物的原料不同有关,35日龄的伊拉兔刚刚断奶,母乳是它们的主要食物来源,105日龄的伊拉兔则以商业饲料为主,其食物营养成分的不同导致了它们肌肉氨基酸组成的差异。这一研究结果与BIVOLARSKI[31]相似,他发现家兔断奶日龄显著影响兔肉蛋白质的生物价值和氨基酸组成。食物的不同也会显著影响脂肪酸组成[32]、感官特性[33]等理化品质。必需氨基酸作为生物体的必需物质,经常被用来评价蛋白质的生物价值[34]。伊拉兔肌肉中必需氨基酸的平均含量为9.10 g/100 g肉,其中Lys的含量最高,达到了2.25 g/100 g肉;在非必需氨基酸中Glu的含量最高,达到了2.59 g/100 g肉。可见,兔肉蛋白质具有较高的生物价值,是人体必需氨基酸的良好来源。
表3 不同日龄伊拉兔肌肉的氨基酸含量
Table 3 The amino acid content of meat samples from different old rabbits
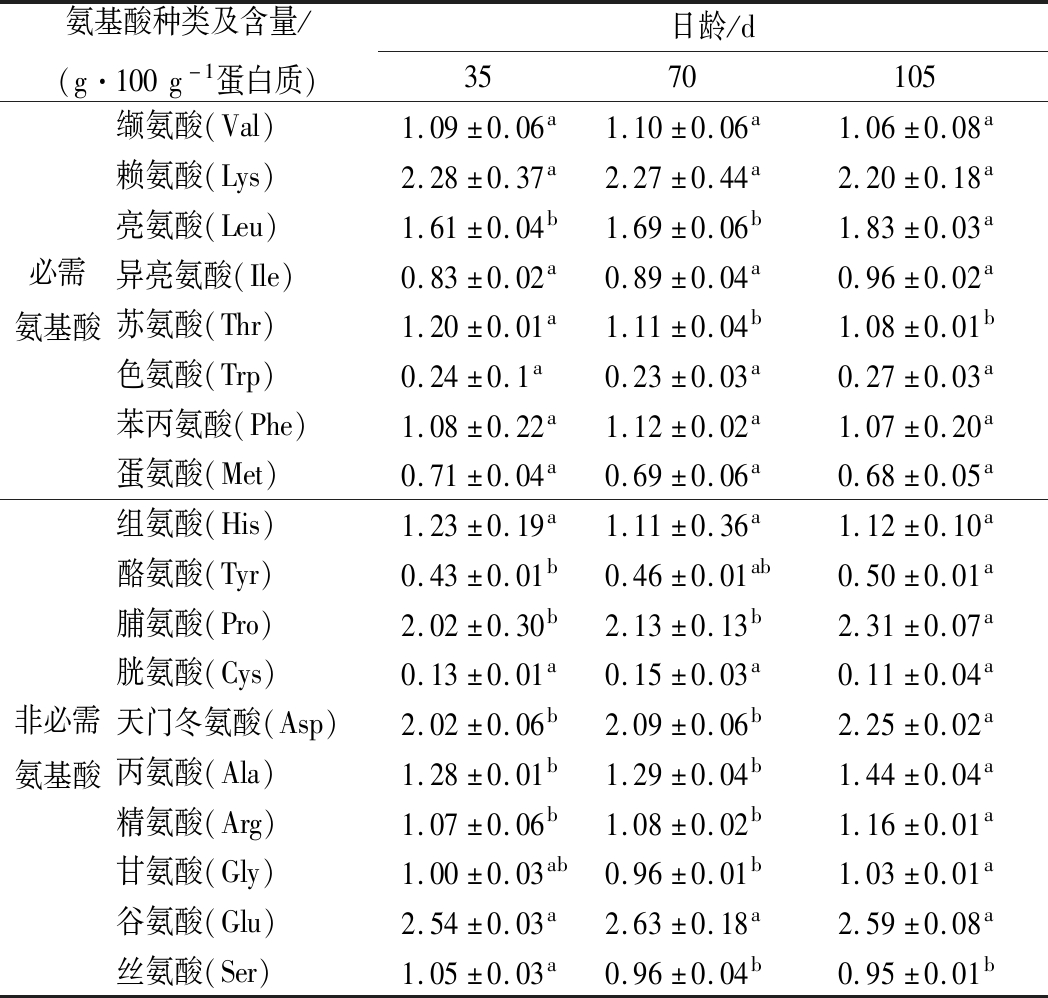
氨基酸种类及含量/(g·100g-1蛋白质)日龄/d3570105必需氨基酸缬氨酸(Val)1.09±0.06a1.10±0.06a1.06±0.08a赖氨酸(Lys)2.28±0.37a2.27±0.44a2.20±0.18a亮氨酸(Leu)1.61±0.04b1.69±0.06b1.83±0.03a异亮氨酸(Ile)0.83±0.02a0.89±0.04a0.96±0.02a苏氨酸(Thr)1.20±0.01a1.11±0.04b1.08±0.01b色氨酸(Trp)0.24±0.1a0.23±0.03a0.27±0.03a苯丙氨酸(Phe)1.08±0.22a1.12±0.02a1.07±0.20a蛋氨酸(Met)0.71±0.04a0.69±0.06a0.68±0.05a非必需氨基酸组氨酸(His)1.23±0.19a1.11±0.36a1.12±0.10a酪氨酸(Tyr)0.43±0.01b0.46±0.01ab0.50±0.01a脯氨酸(Pro)2.02±0.30b2.13±0.13b2.31±0.07a胱氨酸(Cys)0.13±0.01a0.15±0.03a0.11±0.04a天门冬氨酸(Asp)2.02±0.06b2.09±0.06b2.25±0.02a丙氨酸(Ala)1.28±0.01b1.29±0.04b1.44±0.04a精氨酸(Arg)1.07±0.06b1.08±0.02b1.16±0.01a甘氨酸(Gly)1.00±0.03ab0.96±0.01b1.03±0.01a谷氨酸(Glu)2.54±0.03a2.63±0.18a2.59±0.08a丝氨酸(Ser)1.05±0.03a0.96±0.04b0.95±0.01b
2.5 日龄对兔肉蛋白质组成的影响
2.5.1 不同日龄伊拉兔肌肉中特有蛋白质的组成
如图2所示,在雄性伊拉兔背最长肌中共检测出790种蛋白质,并且每个日龄都有其特定的蛋白质,其中35日龄的兔肉含有的蛋白质数量最多,这主要是因为兔肉在生长过程中部分基因的表达发生了变化,从而导致部分蛋白质的合成出现差异[35]。TELTATHUM[36]也发现年龄越小的鸡,其肌肉中含有的蛋白质数量越多。35日龄的伊拉兔肌肉中共发现96种蛋白质,这些蛋白质大部分都参与机体的生理代谢过程,例如G1U3l5(烯酰辅酶A水合酶1)和G1SWU1(琥珀酰辅酶A: 3-酮酸辅酶A转移酶),还有部分蛋白质拥有特定的分子功能,如离子结合和酶蛋白结合等。此外,70日龄和105日龄的伊拉兔肌肉中分别发现23和7种特定蛋白质,这些蛋白质大部分具有分子结合功能,参与机体的代谢过程,还有部分蛋白质是细胞骨架的主要组成成分,对保持细胞的正常生理活动起着重要作用。
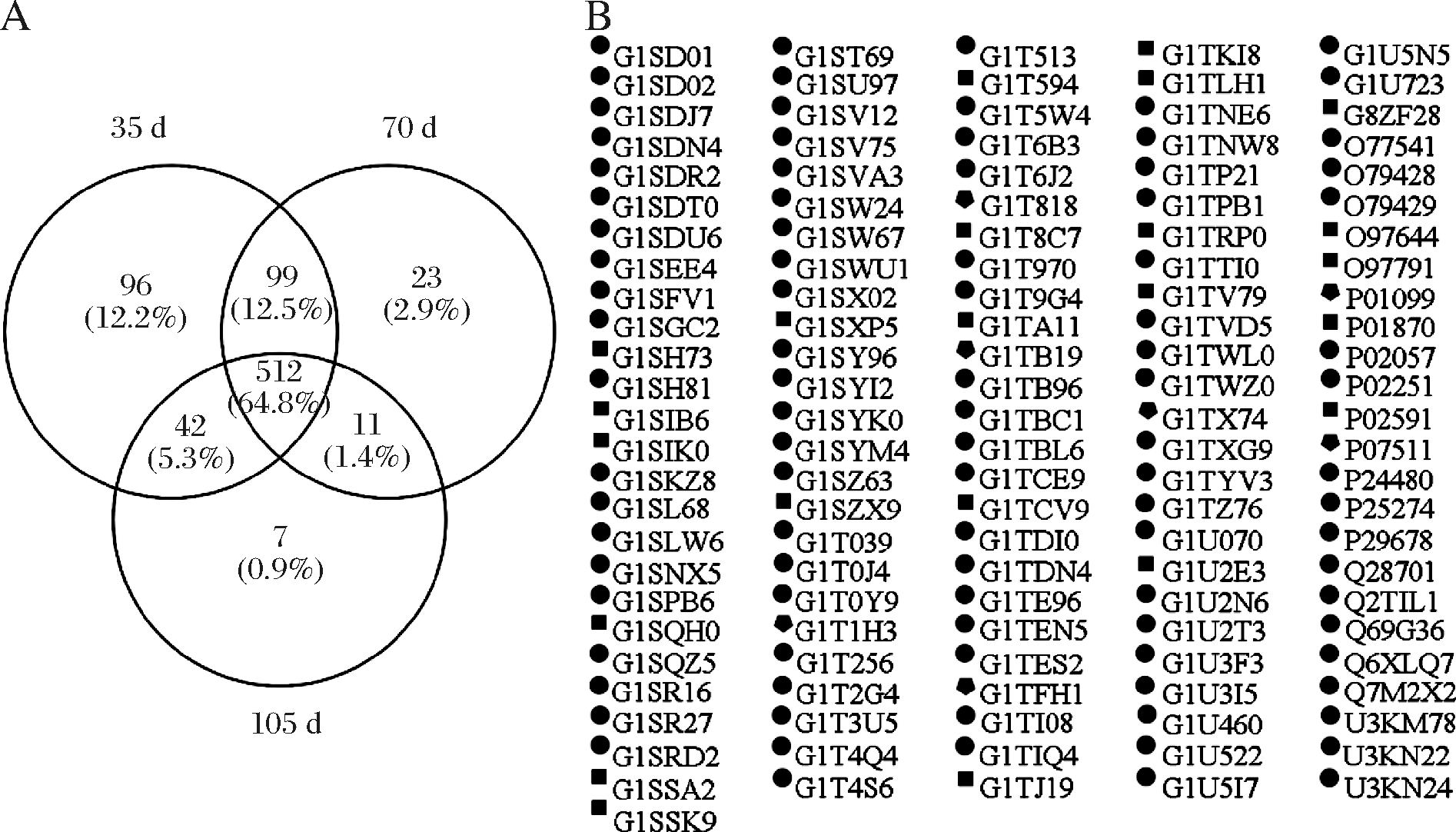
A-蛋白质数量;B-特有蛋白质的ID号,其中圆形、正方形和五边形分别代表35、70和105日龄伊拉兔肌肉中的特有蛋白质
图2 不同日龄伊拉兔肌肉的蛋白质组成
Fig.2 Protein profile of meat samples from Ira rabbit of different ages
2.5.2 不同日龄伊拉兔肌肉中含有的共同蛋白质组成情况
从图2得出,有512种蛋白质共同存在于35、70和105日龄的伊拉兔肌肉中,这些蛋白质的分子功能如图3所示。在这些共同蛋白质中,有接近2/3的蛋白质具有蛋白质结合、离子结合、核苷酸结合和核酸结合功能,还有一部分蛋白质与机体内酶的活性息息相关,这些蛋白质主要参与机体的能量代谢、物质运输和生化反应等,对机体正常的生理生命活动有着决定性的作用。同时,种类功能丰富的蛋白质组成也间接地表明了在动物体内肌肉是代谢高度活跃的组织之一,这与YU[37]的研究结果相一致。
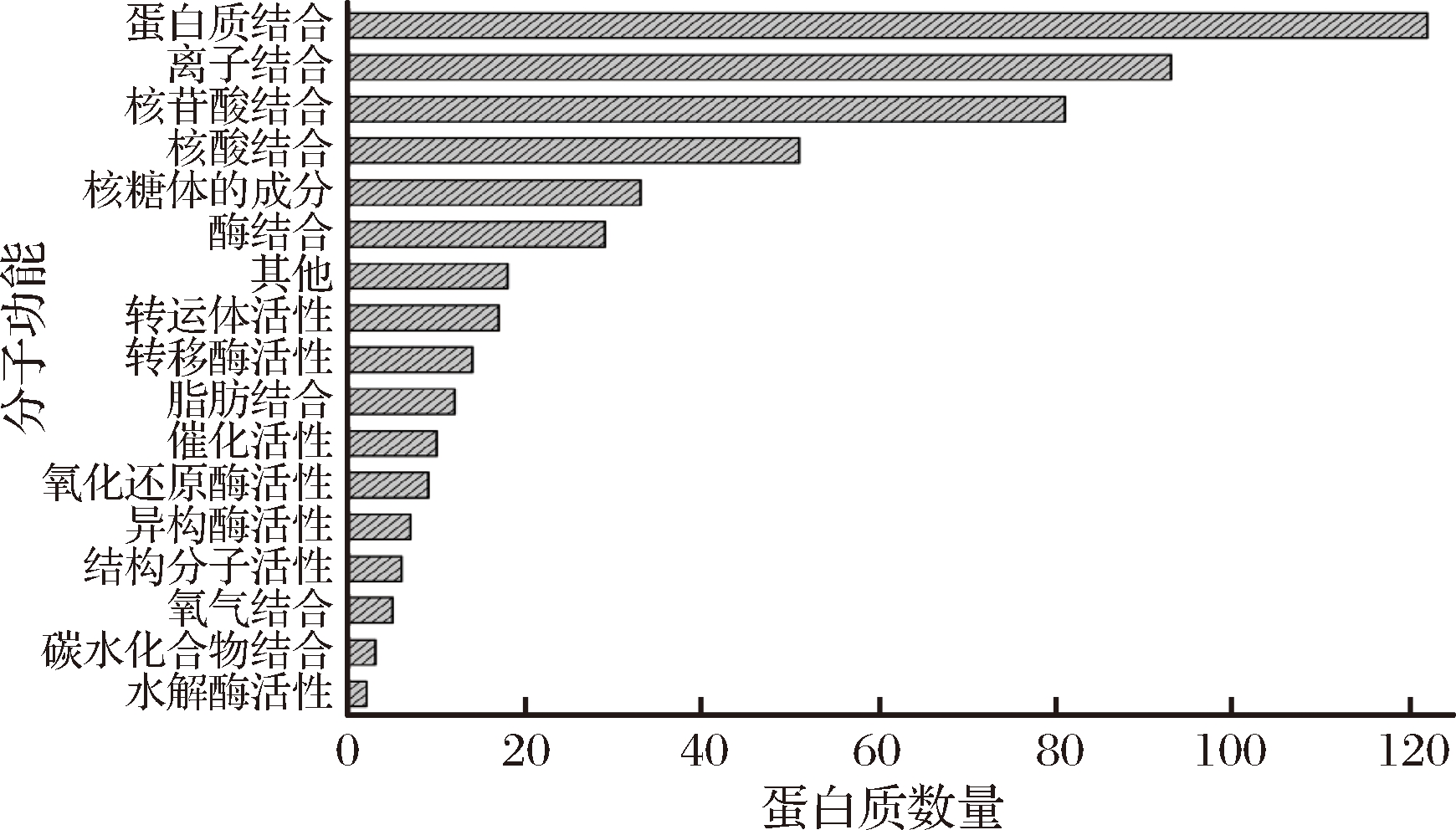
图3 不同日龄伊拉兔肌肉中共同蛋白质的分子功能分布
Fig.3 Molecular function of the common proteins identified in meat samples from Ira rabbit of three ages
3 结论
伊拉兔肌肉中含有丰富的蛋白质,是必需氨基酸的良好来源;日龄会显著影响兔肉肌基质蛋白的含量以及肌浆蛋白、肌原纤维蛋白和肌基质蛋白的氨基酸组成;同时,采用shotgun蛋白组学技术在兔肉中共检测出790种蛋白质,并且日龄显著影响其蛋白质组成,35日龄的伊拉兔肌肉中特有蛋白数量最多,然而这些蛋白与兔肉质量之间的关系还需进一步的深入研究。
[1] 谢跃杰,贺稚非,李洪军. 兔肉挥发性风味成分提取效果的比较[J].食品科学,2015, 36(24):147-151.
[2] 杨佳艺,李洪军. 我国兔肉加工现状分析[J].食品科学,2010, 31(17):429-432.
[3] ANTONELLA D Z, ZSOLT S. The role of rabbit meat as functional food [J]. Meat Science, 2011, 88(3):319-331.
[4] Food and Agriculture Organization of the United Nations. Food and Agriculture Organization Statistics [EB/OL]. [2019-2-17]. http: //faostat3.fao.org/browse/Q/QL/E.
[5] ITO Y, TATSUMI R, WAKAMATSU J I, et al. The solubilization of myofibrillar proteins of vertebrate skeletal muscle in water[J]. Animal Science Journal, 2003, 74(5):417-425.
[6] MUDALAL S, BABINI E, CAVANI C, et al. Quantity and functionality of protein fractions in chicken breast fillets affected by white striping[J]. Poultry Science, 2014, 93(8):2 108-2 116.
[7] GRAVES P R, HAYSTEADT A. Molecular biologist’s guide to proteomics[J]. Microbiology and Molecular Biology Reviews, 2002, 66(1):39-63.
[8] COX J, MANN M. Quantitative, high-resolution proteomics for data-driven systems biology[J]. Annual Review of Biochemistry, 2011, 80:273-299.
[9] YU T, MORTON J D, CLERENS S, et al. Proteomic investigation of protein profile changes and amino acid residue-level modification in cooked lamb longissimus thoracis et lumborum: The effect of roasting[J]. Meat Science, 2016, 119:80-88.
[10] BARGEN C, DOJAHN J, WAIDELICH D, et al. New sensitive high-performance liquid chromatography-tandem mass spectrometry method for the detection of horse and pork in halal beef [J]. Journal of Agricultural and Food Chemistry, 2013, 61:11 986-11 994.
[11] YUSWAN M H, AIZAT W M, LOKMAN A A, et al. Chemometrics-assisted shotgun proteomics for establishment of potential peptide markers of non-halal pork (sus scrofa) among halal beef and chicken[J]. Food Analytical Methods, 2018, 11(12):3 505-3 515.
[12] LIU Z, DU X, YIN C, et al. Shotgun proteomic analysis of sarcoplasmic reticulum preparations from rabbit skeletal muscle[J]. Proteomics, 2013, 13:2 335-2 338.
[13] ALMEIDA A M, CAMPOS A, HARTEN S, et al. Establishment of a proteomic reference map for the gastrocnemius muscle in the rabbit (Oryctolagus cuniculus)[J]. Research in Veterinary Science, 2009, 87:196-199.
[14] AOAC. Official Methods of Analysis. 17th edn. AOAC International, Gaithersburg, MD, 2000.
[15] LUO F, XING R, WANG X, et al. Proximate composition, amino acid and fatty acid profiles of marine snail Rapana venosa meat, visceral mass and operculum[J]. Journal of the Science of Food and Agriculture, 2017, 97:5 361-5 368.
[16] DAWOOD A A, ALKANHAL M A. Nutrient composition of Najdi-camel meat[J]. Meat Science, 1995, 39(1): 71-78.
[17] HASHIMOTO K, WATABE S, KONO M, et al. Muscle protein-composition of sardine and mackerel[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1979, 45(11):1 435-1 441.
[18] ZHU Y, XU H, CHEN H, et al. Proteomic analysis of solid pseudopapillary tumor of the pancreas reveals dysfunction of the endoplasmic reticulum protein processing pathway[J]. Molecular & Cellular Proteomics, 2014, 13(10):2 593-2 603.
[19] WISNIEWSKI J R, ZOUGMAN A, NAGARAJ N, et al. Universal sample preparation method for proteome analysis[J]. Nature Methods, 2009, 6(5):359-362.
[20] HOFFMAN L C, MOSTERT A C, KIDD M, et al. Meat quality of kudu (Tragelaphus sterpsiceros) and impala (Aepyceros melampus): Carcass yield, physical quality and chemical composition of kudu and impala Longissimus doris muscle as affected by gender and age[J]. Meat Science, 2009, 83:788-795.
[21] METZGER S, ODERMATT M, SZABO A, et al. Effect of age and body weight on carcass traits and meat composition of rabbits [J]. Archiv Fur Tierzucht-Archives of Animal Breeding, 2011, 54(4):406-418.
[22] SPENCER M, CIENFUEGOS C, GUINARD J. The flexitarian flipTM in university dining venues: student and adult consumer acceptance of mixed dishes in which animal protein has been partially replaced with plant protein [J]. Food Quality and Preference, 2018, 68:50-63.
[23] MAJ D, BIENIEK J, BEKAS Z. Effect of age and gender of rabbits on indices of their meat quality[J]. Zywnosc-Nauka Technologia Jakosc, 2012, 19(1):142-153.
[24] CHOI Y M, KIM B C. Muscle fiber characteristics, myofibrillar protein isoforms, and meat quality[J]. Livestock Science, 2009, 122:105-118.
[25] TOMBERG E. Biophysical aspects of meat tenderness[J]. Meat Science, 1996, 43(S):175-191.
[26] KLONT R E, BROCKS L, EIKELENBOOM G. Muscle fibre type and meat quality [J]. Meat Science, 1998, 49(Suppl 1):S219-S229.
[27] VENUGOPAL V, SHAHIDI F. Structure and composition of fish muscle [J]. Food Research International, 1996, 12:175-197.
[28] MARINO R, ALBENZIO M, MALVA A, et al. Changes in meat quality traits and sarcoplasmic proteins during aging in three different cattle breeds[J]. Meat Science, 2014, 98:178-186.
[29] CHEN X, TUME R K, XU X, et al. Solubilization of myofibrillar proteins in water or low ionic strength media: Classical techniques, basic principles, and novel functionalities[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(15):3 260-3 280.
[30] GAUZA-WLODARCZYK M, KUBISZ L, WLODARCZYK D. Amino acid composition in determination of collagen origin and assessment of physical factors effects[J]. International Journal of Biological Macromolecules, 2017, 104:987-991.
[31] BIVOLARSKI B, VACHKOVA E, RIBARSKI S, et al. Amino acid content and biological value of rabbit meat proteins, depending on weaning age[J]. Bulgarian Journal of Veterinary Medicine, 2011, 14(2):94-102.
[32] LIU H, GAI F, GASCO L, et al. Effects of chestnut tannins on carcass characteristics, meat quality, lipid oxidation and fatty acid composition of rabbits[J]. Meat Science, 2009, 83(4):678-683.
[33] VOLEK Z, BURES D, UHLIROVA L. Effect of dietary dehulled white lupine seed supplementation on the growth, carcass traits and chemical, physical and sensory meat quality parameters of growing-fattening rabbits[J]. Meat Science, 2018, 141:50-56.
[34] BOHRER B M. Review: Nutrient density and nutritional value of meat products and non-meat foods high in protein[J]. Trends in Food Science & Technology, 2017, 65:103-112.
[35] HOLLUNG K, GROVE H, FRGESTAD E M, et al. Comparison of muscle proteome profiles in pure breeds of Norwegian Landrace and Duroc at three different ages[J]. Meat Science, 2009, 81(3):487-492.
[36] TELTATHUM T, MEKCHAY S. Proteome changes in Thai Indigenous chicken muscle during growth period[J]. International Journal of Biological Sciences, 2009, 5(7):679-685.
[37] YU T, MORTON J D, CLERENS S. In-depth characterization of the lamb meat proteome from longissimus lumborum[J]. Eupa Open Proteomics, 2015, 6:28-41.