枯草芽孢杆菌(Bacillus subtilis)作为革兰氏阳性菌的模式菌,在食品、医药、饲料、纺织等工业领域具有重要的应用价值[1-2]。随着基因工程技术和蛋白工程技术的发展,B. subtilis凭借其清晰的遗传背景,良好的生物安全性,丰富的遗传操作工具以及成熟的发酵工艺等优势,逐渐发展成为一种成熟的合成生物学底盘[3-5]。不仅实现了一批工业和食品用酶的高水平制备,如蛋白酶,淀粉酶,脂肪酶,角质酶等,而且成功合成多种生物基平台化合物。
异源蛋白在原核细胞,如Escherichia coli和B. subtilis中,蛋白表达受到转录和翻译两个水平的调控。因此,大多数研究将异源蛋白在宿主中表达水平归于重组表达元件的性能上。如启动子的强度对mRNA合成速率的影响,核糖体结合位点的强度对翻译起始频率的影响,以及终止子的效率对mRNA稳定性的影响等[6-8]。基于这些理论,在B. subtilis中进行异源基因表达的策略也相应地从启动子改造、核糖体结合位点(ribosomebinding site,RBS)调控、密码子优化、终止子等角度出发[9-11]。ZHANG等[12]利用双串联启动子PHpaⅡ-PamyQ提高胞外蛋白β环糊精转移酶、α环糊精转移酶和普鲁兰酶产量。GUIZIOU等[13]设计一个包括启动子库、RBS和蛋白质降解标记的基因工具箱,实现了枯草芽孢杆菌中基因的精确调节。基因异源表达时,密码子偏爱性对翻译效率的影响机制已有报道[14-16]。利用转运稀有密码子的tRNA过表达策略,可以提高蛋白表达[17]。
然而,近期研究发现,核糖体与mRNA结合或占用率的增加能够提高mRNA的稳定性[18]。并且mRNA稳定性和RBS强度之间存在显著且普遍的相关性,在RBS翻译效率相差87倍时对应的mRNA水平有4.3倍的增加[19]。这些模块化的基本元件,如启动子、UTR(非编码区)、RBS、终止子在与异源基因进行组合时,功能会受到特定遗传环境的影响,如mRNA的二级结构[18]。这种结构通常会在转录后水平影响翻译的起始效率。具体体现在mRNA分子的5′-UTR区域内存在的二级结构对翻译水平的影响[19]。近期,研究同样发现mRNA转录后参与的对翻译起始效率的调节作用还表现在异源基因5′-UTR与编码区5′端数个核苷酸之间形成的二级结构上,这些二级结构能够从影响mRNA稳定性,蛋白质翻译速率等方面对蛋白的表达进行调节[20]。最新研究同样发现,mRNA分子中,编码蛋白质N端的序列与核糖体在这一区域覆盖的序列发生互作形成的二级结构能够抑制翻译的速率[21]。当mRNA二级结构位于起始密码子下游+1~+13,与mRNA的编码区重叠时,翻译起始显著受到抑制,并且5′端RNA结构折叠自由能与mRNA的翻译效率之间存在定量关系[21]。由于不同的异源基因转录后产生各种不同序列的5′编码区,在与标准化的合成生物学元件匹配后产生的二级结构也具有极大的不确定性。难以通过单纯改造表达元件的方法来普遍提升不同异源基因对表达元件的相容性。然而,这种异源基因转录出mRNA分子后,5′UTR与翻译起始区域的编码序列之间相互作用的特征和规律尚不明确。因此,难以有针对性地开发有效的手段来消除这种mRNA分子内部的相互作用给异源蛋白翻译带来的负面效应。目前解决此类问题的一个新的思路是利用绝缘序列(insulator)从空间上隔绝关键元件之间的相互作用,从而消除给转录和翻译带来的不利效应[22]。
本研究前期发现,赤拟谷盗Tribolium castaneum来源的L-天冬氨酸-α-脱羧酶(PanD)在强启动子和强RBS调控下表达水平仍然极低,推测造成这一问题的原因是由于RBS序列与panD基因mRNA编码区5′端的核酸序列相互作用形成了二级结构,导致翻译抑制。因此,基于这一问题,本实验深入探讨panD基因转录后水平的调节影响蛋白质翻译效率的机理,同时探索利用在PanD蛋白N端融合肽段作为绝缘序列,缓解蛋白质翻译抑制现象。这一结果能为提升异源蛋白的表达提供一种通用、可靠的新策略。
1 材料与方法
1.1 试剂材料
1.1.1 菌种、质粒和引物
大肠杆菌(Escherichia coli) JM109和枯草芽孢杆菌B. subtilis 168,分别用于质粒构建以及目的蛋白的表达,均为本实验室保藏。大肠杆菌-枯草芽孢杆菌穿梭质粒由本实验室构建和保藏;实验涉及的质粒见表1。所用到的引物及序列见表2。
表1 本研究所用质粒
Table 1 Plasmids used in this study

质粒 特性 来源pBsigW206-sfgfp (6WG)pMA09携带PsigW, RBS206, sfgfp, Kmr实验室保藏pBspovG206-sfgfp (6HG)pMA09携带PspovG, RBS206, sfgfp, Kmr实验室保藏pBsigW206-panD (6WP)pMA09携带PsigW, RBS206, panD, Kmr本实验pBspovG206-panD (6HP)pMA09携带PspovG, RBS206, panD, Kmr本实验pBsigW206-panD-sfgfp (6WPG)来自6WP, panD-sfgfp融合基因本实验pBspovG206-panD-sfgfp (6HPG)来自6HP, panD-sfgfp融合基因本实验pBsigW206-sfgfp-panD (6WGP)来自6WG, sfgfp-panD融合基因本实验pBspovG206-sfgfp-panD (6HGP)来自6HG, sfgfp-panD融合基因本实验pBspovG206-D3-panD-sfgfp (D3-6HPG)来自6HPG, panD-sfgfp基因5'端截去了9 bp本实验pBspovG206-D6-panD-sfgfp (D6-6HPG)来自6HPG, panD-sfgfp基因5'端截去了18 bp本实验pBspovG206-D9-panD-sfgfp (D9-6HPG)来自6HPG, panD-sfgfp基因5'端截去了27 bp 本实验pBspovG206-D12-panD-sfgfp (D12-6HPG)来自6HPG, panD-sfgfp基因5'端截去了36 bp本实验pBspovG206-D15-panD-sfgfp (D15-6HPG)来自6HPG, panD-sfgfp基因5'端截去了45 bp本实验pBspovG206-D18-panD-sfgfp (D18-6HPG)来自6HPG, panD-sfgfp基因5'端截去了54 bp本实验pBspovG206-sfgfp50-panD (G50P)来自6HP, sfgfp的N端前50个氨基酸与panD融合本实验pBspovG206-sfgfp91-panD (G91P)来自6HP, sfgfp的N端前91个氨基酸与panD融合本实验pBspovG206-sfgfp143-panD (G143P)来自6HP, sfgfp的N端前143个氨基酸与panD融合本实验pBspovG206-mcherry-panD (6HMP)来自6HP, mCherry-panD融合基因本实验pBspovG206-mcherry62-panD (M62P)来自6HP, mCherry的N端前62个氨基酸与panD融合本实验pBspovG206-mcherry144-panD (M144P)来自6HP, mCherry的N端前144个氨基酸与PanD融合本实验
注:括号里表示质粒的缩写,6表示RBS206, W表示启动子PsigW, H表示启动子PspovG, P表示PanD,G表示sfGFP,M表示mCherry。
1.1.2 主要试剂
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、质粒小提试剂盒、PCR产物纯化试剂盒,购于天根生化科技有限公司;酵母提取物、胰蛋白胨、抗生素、DNA Marker、蛋白质分子质量标准(Broad)、Prime STAR MIX DNA聚合酶、DpnI DNA消化酶,购于TaKaRa;衍生试剂苯异硫氰酸酯(PITC),购于Sigma公司; L-天冬氨酸钠、β-丙氨酸、磷酸吡哆醛(PLP)、0.45 μm、0.22 μm无菌针头式有机滤膜,购买于上海生工生物工程公司;K2HPO4、KH2PO4、琼脂粉,购于国药集团化学试剂有限公司。
1.1.3 仪器与设备
基因扩增(PCR)仪、凝胶成像仪、蛋白电泳仪,美国伯乐有限公司;超声波细胞破碎仪,美国SONICS公司;立式高压蒸汽灭菌器,上海博迅实业医疗设备厂;HYG-A全温摇瓶柜,江苏太仓实验设备厂;KQ-100超声波清洗器,昆山市超声仪器有限公司;磁力搅拌器\漩涡振荡器,IKA公司;电子天平、pH计,梅特勒-托利多仪器(上海)有限公司;UV-1800PC型紫外可见分光光度计,上海美谱达有限公司;多功能酶标仪,BioTeck公司(美国);高效液相色谱仪,安捷伦(Agilent)公司。
表2 本研究中使用的引物
Table 2 Primers used in this study

引物名称引物序列 PB-H-1CATCATCACCATCACCATTAAGAATTCGCCTGATGCGGTPB-206-2GATCTTCGCCTGTTGCCGGCATATGTGGACCTCCTTTACTTTAPanD-1CCGGCAACAGGCGAAGATCPanD-H-2TTAATGGTGATGGTGATGATGCAGATCTGATCCCAGTCTCPG-1GAGAGACTGGGATCAGATCTGAGCAAAGGAGAAGAACTTTTCPanD-2CAGATCTGATCCCAGTCTCTC206-2ATGTGGACCTCCTTTACTTTAsfGFP-2TTTGTAGAGCTCATCCATGCCAD3-1TAAAGTAAAGGAGGTCCACATAT-GGGCGAAGATCAGGATCTTGTGD6-1TAAAGTAAAGGAGGTCCACATATGCAG-GATCTTGTGCAAGATCTTD9-1TAAAGTAAAGGAGGTCCACATATGGTG-CAAGATCTTATTGAAGAAD12-1TAAAGTAAAGGAGGTCCACATATGCTTAT-TGAAGAACCGGCAACAD15-1TAAAGTAAAGGAGGTCCACATATGGAAC-CGGCAACATTTTCTGATD18-1TAAAGTAAAGGAGGTCCACATATGA-CATTTTCTGATGCGGTGCTGG50-2TCGCCTGTTGCCGGCATAGTAGTG-CAAATAAATTTAAGGGTGAGG91-2TCGCCTGTTGCCGGCATACCTTCGGGCATGGCACTCTG143-2TCGCCTGTTGCCGGCATCTCGAGTTTGTGTCCAAGAATGM62-2TCGCCTGTTGCCGGCATAGCGAAAGGAAGAGGGCCGM144-2TCGCCTGTTGCCGGCATTTTTTTTTGCATAACAGGGCCATM-1ATTTAAAGTAAAGGAGGTCCACATATG-GTTTCTAAAGGCGAAGAAGM-2GATCCTGATCTTCGCCTGTTGCCGGTTTG-TAAAGTTCATCCATGCCG
1.1.4 培养基
LB培养基(g/L):酵母粉 5.0,蛋白胨 10.0,NaCl 10.0。固体培养基添加20 g/L琼脂粉。抗性筛选时补加终质量浓度为100 mg/L的氨苄青霉素(Ampicillin)或 50 mg/L的卡那霉素(Kanmycin)。
1.1.5 主要溶液
高效液相色谱(high performance liquid chromatography,HPLC)流动相:A液:体积分数为80%的乙腈-水溶液;B液:体积比为97 ∶3的0.1 mmol/L醋酸钠-乙腈溶液。使用前用0.22 μm有机滤膜抽滤去除杂质。
β-丙氨酸衍生试剂:0.1 mmol/L PITC-乙腈:取1 mL 苯异硫氰酸酯(phenyl isothiocyante,PITC)充分溶解于83 mL色谱纯乙腈溶液中。1 mmol/L三乙胺-乙腈∶14 mL色谱纯三乙胺溶液与86 mL色谱纯乙腈溶液充分混匀。密封、避光低温保存。
1.2 实验方法
1.2.1 重组质粒的构建与转化
L-天冬氨酸-α-脱羧酶表达质粒的构建:实验室前期克隆并鉴定了强启动子PsigW (缩略为W)和PspovG (缩略为H),并且利用在线预测软件(RBS Calculator)为这两个启动子配置强RBS序列,RBS206 (序列为TCGAACATCATATTTAAAGTAAAGGAGGTCCACAT,缩略为6)。编码绿色荧光蛋白基因sfgfp的E. coli-B. subtilis穿梭载体pBsigW206-sfgfp (缩略为6WG)和pBspovG206-sfgfp (缩略为6HG)为本实验室构建并保存。以质粒6WG和6HG为模板,用引物PB-H-1/ PB-206-2(表2)扩增质粒骨架。将密码子优化合成后的赤拟谷盗来源的panD基因用引物PanD-1/ PanD-H-2(表2)扩增。PCR产物加入Dpn I酶消化2 h,纯化后进行Gibson组装[23],然后转化大肠杆菌感受态细胞并提取质粒测序验证。重组质粒命名为pBsigW206-panD (缩略为6WP)和pBspovG206-panD (缩略为6HP)。将正确的重组质粒用化学转化方法转化入枯草芽胞杆菌168中[24],获得基因工程菌进行摇瓶检测。
L-天冬氨酸-α-脱羧酶C末端融合sfGFP质粒的构建:分别以质粒6WG和6HG为模板,用引物PB-206-2/ PG-1(表2)扩增质粒骨架,引物PanD-1/ PanD-2(表2)扩增panD基因,分别得到重组质粒pBsigW206-panD-sfgfp (缩略为6WPG)和pBspovG206- panD-sfgfp (缩略为6HPG)。
L-天冬氨酸-α-脱羧酶N末端融合sfGFP质粒的构建:分别以质粒6WG和6HG为模板,以PB-H-1/ sfGFP-2为引物扩增质粒骨架,以PanD-1/ PanD-H-2为引物克隆panD基因,利用Gibson组装的方法,将panD基因插入到sfgfp基因下游,分别得到重组质粒pBsigW206-sfgfp-panD (缩略为6WGP)和pBspovG206- sfgfp-panD (缩略为6HGP)。
为了探讨panD基因5′端翻译起始区域mRNA序列对翻译水平的影响,采用截断策略,从panD基因mRNA 5′端起始密码子后依次截去9、18、27、36、45和54 nt,构建出PanD酶N端不同长度截断片段的突变体。为了使用胶上荧光监测(In-gel) SDS-PAGE的方法检测融合蛋白,PanD酶的C端融合sfGFP。构建方法:以6HPG为模板,以D3-1, D6-1, D9-1, D12-1, D15-1, D18-1/ 206-2为引物,PCR扩增带有同源臂到的片段,55 ℃反应50 min进行片段组装,之后产物转化E. coli JM109感受态,获得6种含有N端截断长度逐个递增的融合蛋白突变体质粒:pBspovG206-D3-panD-sfgfp (D3-6HPG), pBspovG 206-D6-panD-sfgfp (D6-6HPG), pBspovG206-D9-panD- sfgfp (D9-6HPG), pBspovG206-D12-panD-sfgfp (D12-6HPG), pBspovG206-D15-panD-sfgfp (D15-6HPG)和pBspovG206-D18-panD-sfgfp (D18-6HPG)。测序验证后保存备用。
为了对融合肽长度进行精简,根据sfGFP和mCherry的蛋白质序列和蛋白结构,以N端含有的β折叠或α螺旋的不同长度结构域作为短融合肽,保留sfGFP N端前50、91和143个氨基酸分别与PanD进行N端融合表达,进行以下构建:以6HGP为模板,以G50-2, G91-2, G143-2/ PanD-1为引物,构建质粒pBspovG206-sfgfp50-panD (G50P), pBspovG206-sfgfp91-panD (G91P)和pBspovG206-sfgfp143-panD (G143P)。保留mCherry N端前62和144个氨基酸分别与PanD进行N端融合表达。以6HP为模板,以PanD-1/ PB-206-2为引物扩增质粒骨架,以M-1/M-2,M62-2,M144-2为引物扩增mcherry基因,通过组装的方法构建质粒pBspovG206-mcherry-panD (6HMP), pBspovG206-mcherry62-panD (M62P)和pBspovG206-mcherry144-panD (M144P)。
1.2.2 sfGFP荧光水平的测定
将包含正确质粒的B. subtilis菌株在终质量浓度50 mg/L的卡那霉素LB平板上划线,37 ℃培养长出单菌落。再接种单菌落到5 mL的LB试管培养基37 ℃,200 r/min过夜培养。再以1%的接种量接种到终质量浓度为50 mg/L的卡那霉素的50 mL LB液体培养基中扩大培养,37 ℃,200 r/min培养24 h。取200 μL发酵液至96孔板,检测OD600和sfGFP荧光强度(fluorescence intensity,FI)。在激发光495 nm,发射光525 nm处进行检测。
1.2.3 PanD酶活水平的测定
酶活水平检测方法:参考之前相关报道[25],取200 μL细胞破碎后PanD粗酶液,加入终浓度为100 mmol/L的L-天冬氨酸溶液和0.1 mol/L PLP,50 mmol/L磷酸盐缓冲液补加到1 mL, 37 ℃反应30 min。反应结束后将反应体系于100 ℃灭活10 min,12 000 r/min离心5 min,取上层溶液进行衍生。
β-丙氨酸的衍生:由L-天冬氨酸和β-丙氨酸在进行HPLC检测时较难分离,因此参考文献[26],在检测前用PITC进行衍生。衍生方法为取500 μL反应液,加入250 μL 1 mol/L三乙胺-乙腈溶液和250 μL 0.1 mol/L PITC-乙腈溶液,振荡混匀,避光反应1 h。待衍生结束后,700 μL正己烷,振荡30 s萃取出残余的衍生试剂,静置,待反应液有明显分层后吸取下层溶液,用0.22 μm针头式有机滤膜过滤。
HPLC检测β-丙氨酸生成:选择C18色谱柱La Chrom C18(5 μm 4.6×250 mm),参考相关文献[27],用梯度洗脱的方法进行检测。A流动相为体积分数80%的乙腈溶液,B流动相为体积比97∶3的0.1 mol/L乙酸钠-乙腈溶液;梯度洗脱条件为:0~35 min,B流动相由95%降至65%;35~40 min,B流动相由65%升至95%;40~45 min,B流动相浓度不变。检测温度为40 ℃,检测波长为254 nm。
酶活定义:在37 ℃,pH 7.0的条件下,每小时转化L-天冬氨酸生成1 mmol β-丙氨酸所需酶量为一个酶活力单位1 U。
1.2.4 蛋白表达水平检测
SDS-PAGE:取培养24 h的发酵液1 mL, 2 000 r/min离心5 min收集菌体,PBS缓冲液洗涤3次,再用含有200 μg/mL溶菌酶的500μL的TE缓冲液Buffer悬浮,37 ℃温育30 min,未完全裂解的菌液用超声适当破碎;取100 μL细胞裂解液,加入25 μL 5 ×上样缓冲液,沸水浴10 min。使用5%的浓缩胶和12%的分离胶进行蛋白分离,考马斯亮蓝R250染色显示条带。
In-gel[28]检测:取100 μL裂解好的细胞破碎液,加入25 μL 5×上样缓冲液混匀。用不含SDS的蛋白胶进行分离,凝胶成像仪在紫外灯下成像,可特异性地显示目的蛋白,过滤掉其他不发光的背景蛋白。
2 结果与分析
2.1 赤拟谷盗L-天冬氨酸-α-脱羧酶在B. subtilis中表达抑制效应的鉴定
为了实现赤拟谷盗L-天冬氨酸-α-脱羧酶在B. subtilis中的高效表达,对实验室前期构建的PsigW-206和PspovG-206启动子-RBS强表达元件介导sfGFP表达的6WP和6HP表达水平在B. subtilis 168中进行SDS-PAGE检测,结果如图1-A,含有206的2个启动子均介导sfGFP的高水平表达。随后将密码子优化后的panD基因克隆到这2个表达元件的下游,进行重组表达验证。结果如图1-B所示,在PsigW-206和PspovG-206这2种表达元件介导的PanD重组表达系统中,PanD蛋白的理论分子质量62 kDa处均没有明显条带,这一结果表明,这2种高效表达元件并不能介导PanD在B. subtilis168中的高水平表达。综合图1-A和图1-B的结果,推测PanD表达量低是由于翻译抑制引起的。
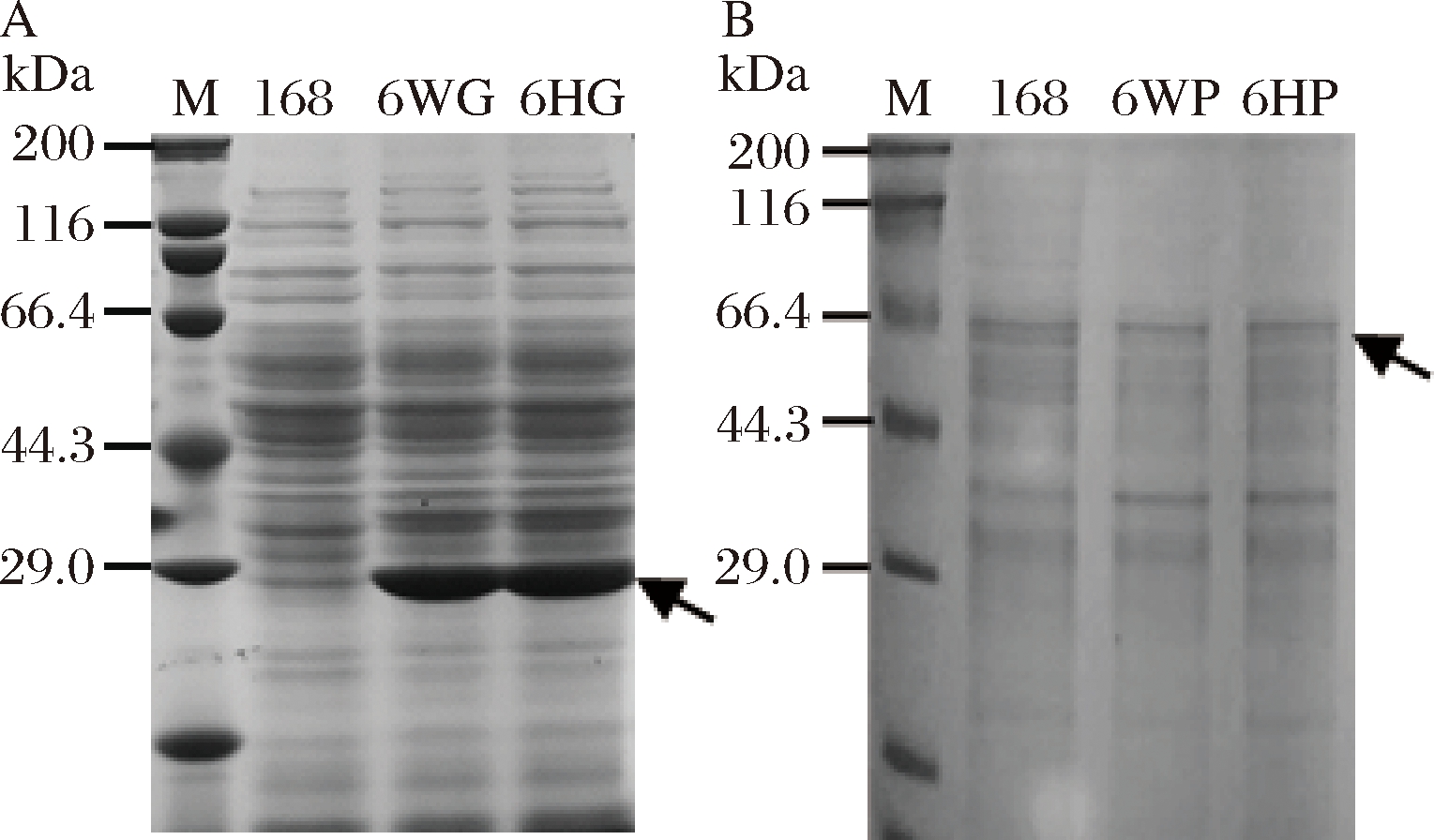
A-PsigW-206与PspovG-206介导sfGFP表达;
B-PsigW-206与PspovG-206介导PanD表达;
图1 SDS-PAGE检测启动子-RBS组合介导
PanD和sfGFP的表达水平
Fig.1 SDS-PAGE analysis to measure the expression levels
of PanD and sfGFP mediated by promoter-RBS combination
注:M-蛋白Marker;168-对照;W-启动子PsigW;H-启动子
PspovG;G-sfGFP;P-PanD;黑色箭头所指位置为目的条带位置。
2.2 panD基因mRNA 5′端二级结构对重组蛋白表达水平的调控作用
为了阐明PanD翻译抑制的机理,着重探讨panD基因转录后的mRNA 5′编码区与5′-UTR之间相互作用形成的二级结构对翻译的影响。因此,从起始密码子AUG开始,以每次缺失9 bp(3个氨基酸残基)的方式逐步截断mRNA 5′端序列,构建一系列5′端序列逐步缩短的突变体。为了使用In-gel方法对蛋白进行检测,以编码融合蛋白PanD-sfGFP的 panD-sfgfp基因(6HPG)为模板,构建mRNA 5′端分别缺失9 nt (D3-6HPG), 18 nt (D6-6HPG), 27 nt (D9-6HPG), 36 nt (D12-6HPG), 45 nt (D15-6HPG)和54 nt (D18-6HPG)的截断突变体。随后转入B. subtilis 168宿主,确定各突变体表达水平。SDS-PAGE和In-gel检测结果如图2-A,图2-B所示,5′端缺失9 bp后对应重组融合蛋白D3-6HPG的表达水平相比野生型6HPG有提升。与此类似,突变体D12-6HPG、D15-6HPG和D18-6HPG均有不同程度的提升。而D6-6HPG和D9-6HPG的表达水平相对于野生型融合蛋白没有明显提升。In-gel与SDS-PAGE结果一致,如图2-C所示。
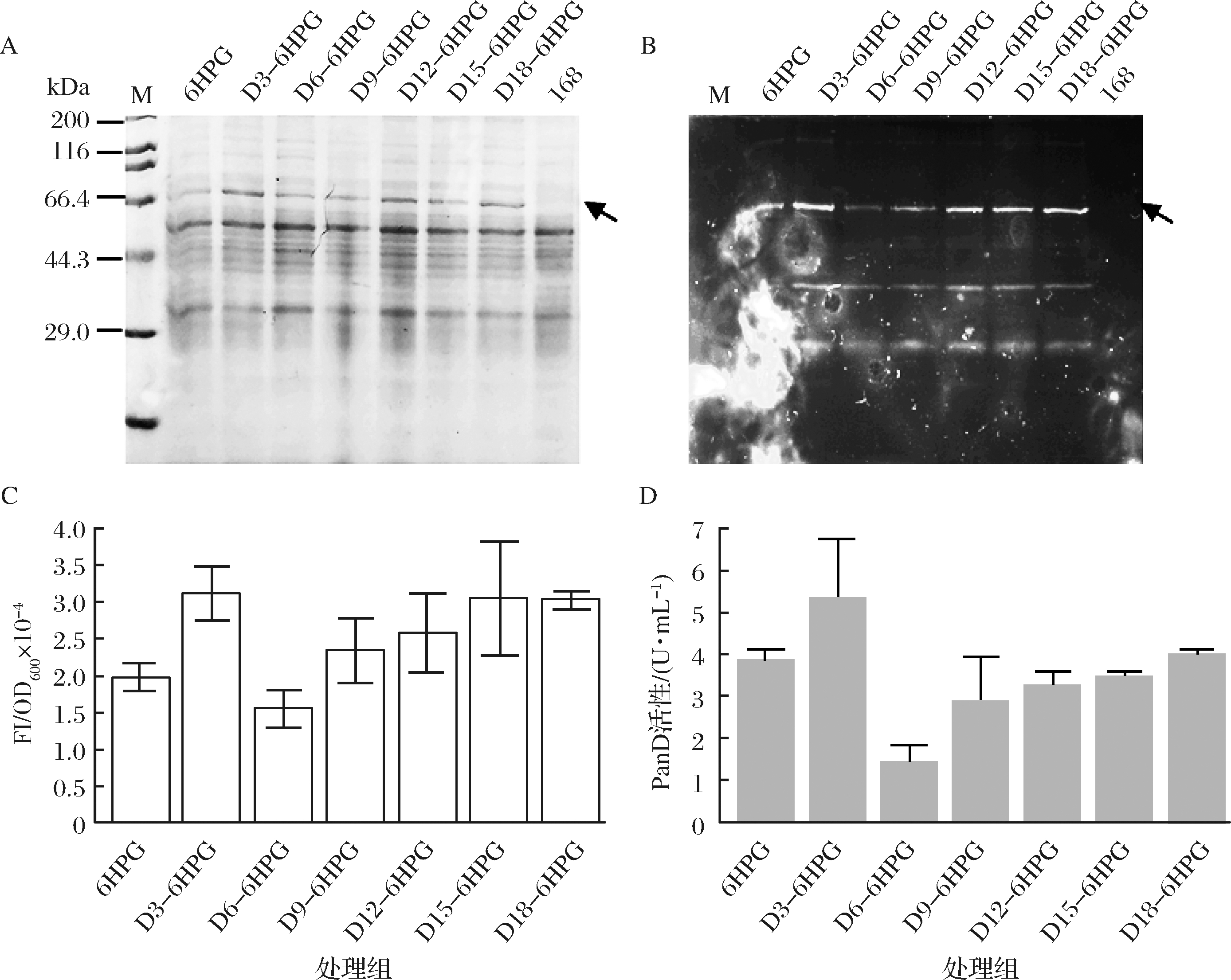
A-SDS-PAGE检测;B-In-gel检测;C-截断融合蛋白荧光水平检测;D-酶活性检测
图2 panD-sfgfp基因5′端序列的梯度截断突变体表达量的检测
Fig.2 Detection of mutants expression of the panD-sfgfp gene 5′-terminal sequence gradient truncation
注:M:蛋白marker;6HPG:PspovG-206介导C端融合蛋白PanD-sfGFP的表达;D3-6HPG、D6-6HPG、D9-6HPG、
D12-6HPG、D15-6HPG和D18-6HPG:panD-sfgfp序列5′端依次截去9、18、27、36、45和54 nt后的突变体;黑色箭头所指位置为目的条带位置。
这一结果表明,panD转录本中mRNA 5′端结构是影响重组蛋白表达水平的一个重要因素。对各突变体的酶活水平进行检测,结果如图2-D所示,突变体D3-6HPG酶活水平相较于野生型有所提升,与突变体蛋白质表达水平一致。而D6-6HPG、D9-6HPG和D12-6HPG突变体酶活水平有所降低,这一结果与蛋白表达水平也趋于一致。但D15-6HPG和D18-6HPG酶活水平与野生型无显著差异,结合图2-B中蛋白表达水平的结果,提示这2个经过截断的突变体虽然蛋白质表达水平有所提升,但对酶活性有一定影响。
为进一步揭示mRNA转录本中5′-UTR区域和翻译起始覆盖的编码区域之间的相互作用对翻译水平的影响,通过RNAfold在线软件分析野生型panD和截断突变体mRNA 5′端二级结构的特征。结果如图3-A~图3-G所示,在转录出的野生型panD的mRNA(6HPG)二级结构中,RBS序列形成一个小发卡结构,同时起始密码AUG下游12 nt的序列形成了较稳定的发卡结构,推测这种较稳定的双发卡结构阻碍了翻译起始过程中核糖体的结合,从而对PanD的表达造成极大的抑制。
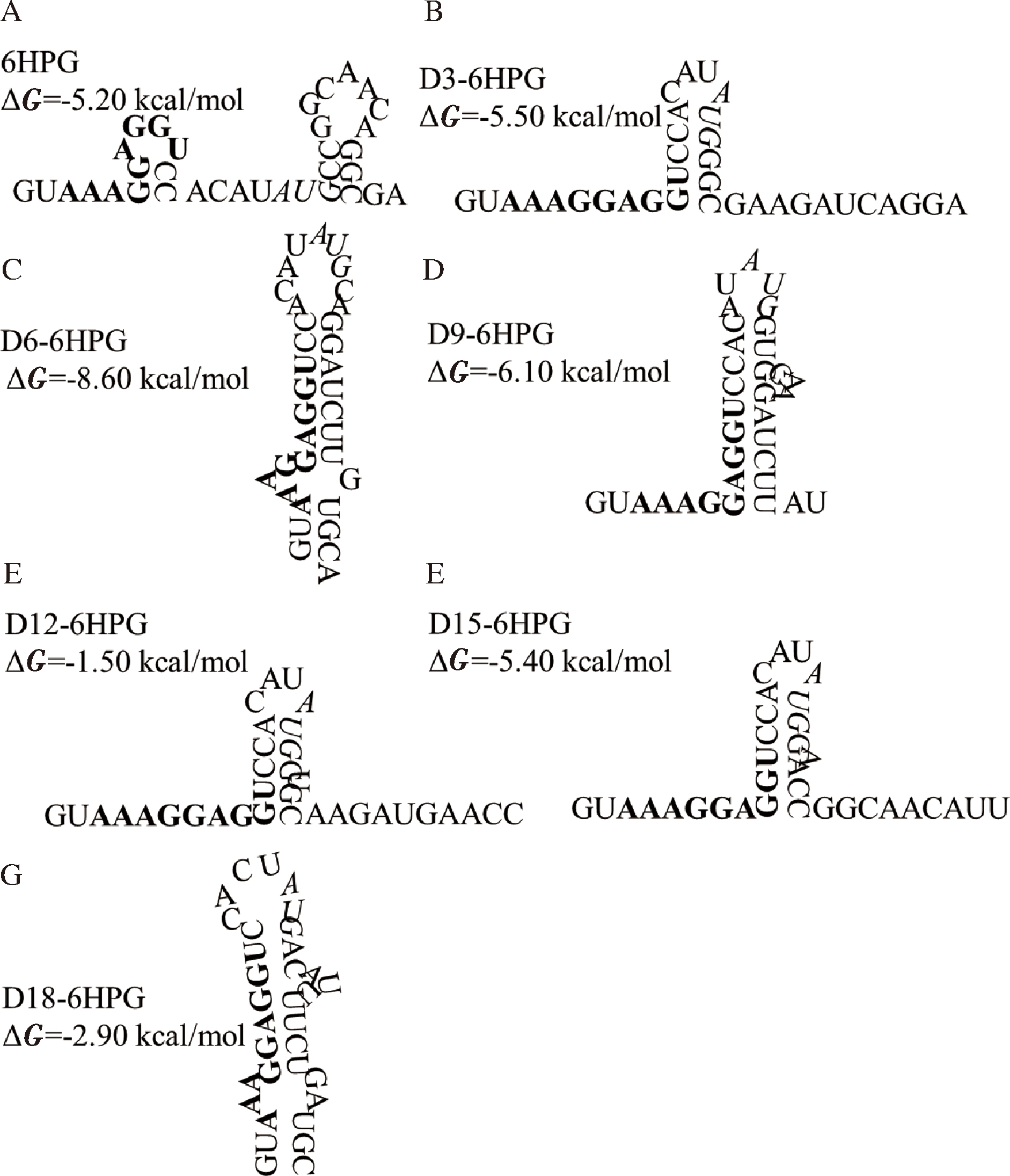
图3 panD-sfgfp基因5′端序列的梯度截断突变体的
mRNA二级结构及最小自由能ΔG值
Fig.3 mRNA secondary structure and minimum free energy
ΔG value of gradient truncation mutants of the panD-sfgfp
gene 5′-terminal sequence
注:黑体标注为RBS序列AAAGGAGGU;斜体标注为起始密码子AUG。
为了验证这一推测,对5′端截断的突变体基因序列进行进一步分析。结果表明,与6HPG相比,删除起始密码子下游9 pb (D3-6HPG)后,5′-UTR中RBS序列所在的发卡结构被消除,与核糖体紧密结合的保守序列AAGGAG序列处于有利于核糖体结合的延展状态。而蛋白表达相对较低的D6-6HPG和D9-6HPG的mRNA 5′端序列则半覆盖或完全覆盖在发夹结构中,并且其二级结构的最小自由能ΔG值也相对较低,表明这种抑制性的结构稳定。同时D12-6HPG和D15-6HPG mRNA的RBS序列只有2个或3个碱基存在于发夹茎的基部。D18-6HPG mRNA的RBS虽然完全覆盖在发夹茎结构中但是ΔG值相对较高。因此,结合图2-B,这一结果表明,mRNA 5′端编码序列通过与5′-UTR中的核糖体结合位点相互作用形成的二级结构,影响核糖体结合,并最终导致对mRNA的翻译效率的抑制。值得注意的是mRNA二级结构与mRNA的蛋白编码区重叠且最小自由能最低的D6-6HPG突变体的蛋白表达水平和酶活也是最低的,说明蛋白编码序列与5′-UTR形成的二级结构能够显著抑制翻译效率,并且这种抑制效应与最小自由能相关。
2.3 利用N端融合策略消除PanD翻译抑制
为了降低mRNA编码区序列与5′-UTR形成的二级结构对蛋白质翻译起始效率的影响,研究选取能够适用于大多数表达元件或系统的且蛋白结构解析清楚的sfGFP作为N端融合肽,构建N端融合蛋白6WGP和6HGP。同时与PanD C端融合sfGFP的6WPG和6HPG的表达水平进行比较。SDS-PAGE检测结果如图4-A、图4-B所示,N端融合蛋白6HGP的表达水平明显高于N端融合蛋白6WGP、C端融合蛋白6WPG和C端融合蛋白6HPG。In-gel与SDS-PAGE结果一致,如图4-C所示。这一结果表明N端融合sfGFP可以有效解除翻译抑制效应,显著提升蛋白表达水平。为进一步考察融合策略对酶活性的影响,测定融合蛋白的酶活水平,结果如图4-D所示,C端融合蛋白6WPG与6HPG相比较,酶活水平有所降低,这一差异与蛋白表达水平相关。N端融合蛋白6HGP与6WGP比较,酶活水平提升8倍,但融合蛋白的荧光表达水平提升17.5倍。结果表明,虽然N端融合sfGFP可以使蛋白质表达水平有大幅度的提升,但可能会对酶分子的空间结构有一定影响,造成酶活性不同程度的降低。
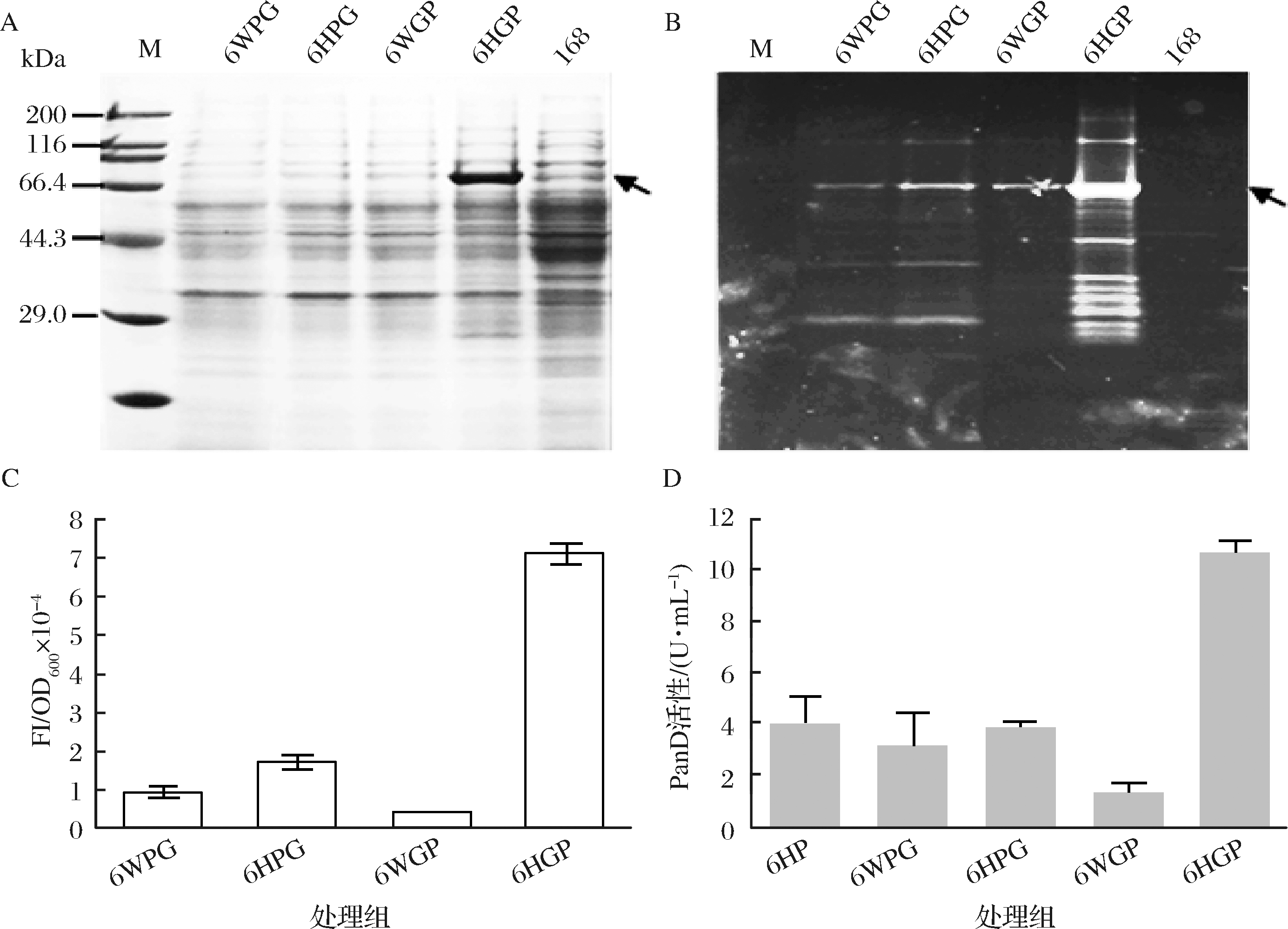
A-SDS-PAGE检测;B-In-gel检测;C-融合蛋白荧光水平检测;D-酶活性检测
图4 PanD与sfGFP融合蛋白表达量的检测
Fig.4 Detection of fusion protein expression of PanD and sfGFP
注:M-蛋白marker;6WPG和6HPG:C端融合sfGFP;6WGP和6HGP:N端融合sfGFP;黑色箭头所指位置为目的条带位置。
2.4 融合肽长度精简及筛选
为了保证N端融合sfGFP在提高蛋白质表达水平的同时又减少对融合蛋白酶活性的影响,我们采用精简sfGFP和mCherry两种蛋白的N端策略,保留N端含有的β折叠或α螺旋的不同长度的结构域作为融合肽段,分别与PanD进行N端融合,构建新的融合蛋白。不同融合肽段的长度如图5-A、图5-B竖向箭头所指位置。在图5-A竖向箭头所指位置,分别保留sfGFP N端前50(G50)、91(G91)和143(G143)个氨基酸与PanD进行融合,构建G50P、G91P和G143P融合蛋白突变体;在图5-B竖向箭头所指位置,分别保留mCherry N端的前62(M62)和144(M144)个氨基酸与PanD进行N端融合,构建M62P和M144P融合蛋白突变体。SDS-PAGE和In-gel检测蛋白质表达水平,结果如图5-C所示,保留sfGFP N端前50个氨基酸后对应重组融合蛋白G50P的表达水平相比野生型6HP有的提升。与此类似,突变体G91P和G143P随着保留结构域长度的增加表达水平均有不同程度提升。保留mCherry N端前62个氨基酸后对应重组融合蛋白M62P的表达水平相比野生型6HP有提升。M144P表达水平虽也有提升但没有M62P高。综上,通过对融合肽长度的缩短,构建含有结构域的短融合肽的融合蛋白,可以提高蛋白质的表达水平。
3 讨论
本研究揭示了一种影响赤拟谷盗L-天冬氨酸-α-脱羧酶PanD在枯草芽孢杆菌中重组表达水平机制。编码L-天冬氨酸-α-脱羧酶的基因panD在含有人工强核糖体结合位点元件的表达框架中受mRNA 5′-UTR和5′-编码区序列相互作用形成的二级结构的调控,这种调控发生在转录后水平和翻译起始阶段。在这种机制调控下,PanD即使在强启动子和强RBS序列的介导下也呈现低表达。这一问题极大限制了重组酶在B. subtilis中的高效制备。同时,PanD是一种重要的工业酶,可用来构建β-丙氨酸的生物催化途径或代谢途径[29]。传统上用于提升异源基因在B. subtilis中表达水平的策略集中于改造天然启动子,增强转录水平,设计强核糖体结合位点提升翻译起始效率等[13,30]。然而,高效的顺式作用元件对异源蛋白的适配性有一定的局限,许多异源蛋白的基因序列内部存在一些制约重组表达的天然因素。其中,最重要的一类就是异源基因mRNA 5′端形成的二级结构[21]。这种作用会导致核糖体结合位点被全部或部分封闭在由5′编码区与5′-UTR相互作用形成的发卡或茎环等二级结构中[22]。

A-sfGFP的蛋白序列;B-mCherry的蛋白序列;C-SDS-PAGE检测
图5 保留sfGFP和mCherry的不同长度结构域与
PanD进行N端融合表达
Fig.5 The N-terminal fusion expression of different
length domains of sfGFP and mCherry with PanD
注:灰色箭头代表β折叠;黑色矩形代表α螺旋;竖向箭头所指位置
表示缩短后的融合肽序列;斜向箭头所指位置为目的条带位置。
M-蛋白marker;168-对照;6HP-PspovG-206 介导PanD的表达;
M62P和M144P-mCherry N端前62和144个氨基酸分别与PanD
的N端融合;6HMP-PspovG-206介导mCherry-PanD的表达;
G50P, G91P和G143P-sfGFP N端前50、91和143个氨基酸分别与
PanD的N端融合;6HGP-PspovG-206介导sfGFP-PanD的表达
本研究发现PsigW-206和PspovG-206这两种高强度表达组件没有产出高水平的PanD重组酶。然而,在PanD的N端融合了sfGFP后,融合蛋白的表达水平显著提升。通过进一步对截断融合蛋白mRNA 5′端核酸序列二级结构的分析,我们发现使用强核糖体结合位点后,panD基因mRNA 5′端编码区序列通过与5′-UTR的核糖体结合位点形成不同程度的包含RBS序列的二级结构,从而不同程度地抑制翻译起始,并且这种抑制效应与mRNA中核糖体结合位点和起始密码子形成二级结构的最小自由能和相对位置有密切的关系。
如何使高效基因表达组件能够兼容更多的异源基因,产出合理的表达水平对于合成生物学和代谢工程的研究具有至关重要的作用。并且在面对各种异源基因多样化的mRNA 5′末端序列以及其可能和核糖体结合位点等关键组件形成二级结构的这些问题时,采用何种更为通用的策略能够消除翻译抑制,提升异源基因的表达量对构建人工基因线路和代谢途径尤为重要。本研究采用融合蛋白策略,逐步筛选与人工表达组件兼容性好的融合肽段与PanD酶融合,以期缓解或消除由于5′端编码区参与形成的二级结构对翻译的抑制效应。为此,研究选取普适性较好sfGFP作为N端融合肽,证明了在PanD的N端存在sfGFP能够极大消除翻译的抑制。结果充分证明了这一策略的合理性和适用性。并且通过逐步缩减融合肽的长度,最大程度降低融合肽对PanD酶活性的影响。有效平衡了融合蛋白表达水平和酶活性两方面的指标。这种类似于融合“绝缘子”的策略近年在构建高稳定性、高正交性的基因转录元件中使用较多[31],而直接将肽段作为“绝缘子”,依赖编码肽段的序列不与5′-UTR产生二级结构的特性消除翻译抑制的策略尚无报道。本研究通过构建基于sfGFP和mCherry的融合肽段,考察了不同长度的融合肽段对PanD表达水平的影响,筛选出了具有成为“绝缘子”应用潜能的肽段,验证结果同时表明,全长的sfGFP介导的PanD蛋白表达水平最高,但保留sfGFP的N端143个氨基酸的肽段后融合蛋白的表达效果也能达到与之相当的水平。而在利用mCherry的融合体中,全长的mCherry介导的融合蛋白表达水平均高于N端为不同长度肽段的融合蛋白的表达水平。这表明融合肽段的选择对于这一策略具有重要的影响。研究中仅选取了两种蛋白作为融合肽段的来源,今后的研究还可以利用这种策略设计全人工短肽序列,进一步扩展肽段“绝缘子”的适用范围。因此,这一策略有望被开发成为一种便捷的技术平台,用于系统提升不同异源基因在底盘细胞中的表达水平,为合成生物学和代解途径的构建提供通用型解决方案。
[1] GU Y, XU X, WU Y, et al. Advances and prospects of Bacillus subtilis cellular factories: From rational design to industrial applications [J]. Metabolic Engineering, 2018, 50:109-121.
[2] VAN DIJL J M, HECKER M. Bacillus subtilis: From soil bacterium to super-secreting cell factory [J]. Microbial Cell Factories, 2013, 12(1): 3.
[3] CUI W, HAN L, SUO F, et al. Exploitation of Bacillus subtilis as a robust workhorse for production of heterozygous proteins and beyond [J]. World Journal of Microbiology and Biotechnology, 2018, 34(10): 145.
[4] CHEN P T, CHEN Y C, LIN Y Y, et al. Strategy for efficient production of recombinant Staphylococcus epidermidis lipase in Bacillus subtilis [J]. Biochemical Engineering Journal, 2015, 103:152-157.
[5] WESTERS L, WESTERS H, QUAX W J. Bacillus subtilis as cell factory for pharmaceutical proteins: A biotechnological approach to optimize the host organism [J]. Biochimica et Biophysica Acta(BBA)-Molecular Cell Research, 2004, 1 694(1-3): 299-310.
[6] MENG F, ZHU X, NIE T, et al. Enhanced expression of pullulanase in Bacillus subtilis by new strong promoters mined from transcriptome data, both alone and in combination [J]. Frontiers in Microbiology, 2018, 9(2 635): 11.
[7] SEGALL-SHAPIRO T H, SONTAG E D, VOIGT C A. Engineered promoters enable constant gene expression at any copy number in bacteria [J]. Nature Biotechnology, 2018, 36(4): 352-358.
[8] MUTALIK V K, GUIMARAES J C, CAMBRAY G, et al. Precise and reliable gene expression via standard transcription and translation initiation elements [J]. Nature Methods, 2013, 10(4): 354.
[9] CUI W, SUO F, CHENG J, et al. Stepwise modifications of genetic parts reinforce the secretory production of nattokinase in Bacillus subtilis [J]. Microbial Biotechnology, 2018, 11(5): 930-942.
[10] JAN J, VALLE F, BOLIVAR F, et al. Construction of protein overproducer strains in Bacillus subtilis by an integrative approach [J]. Applied Microbiology and Biotechnology, 2001, 55(1): 69-75.
[11] GUAN C, CUI W, CHENG J, et al. Development of an efficient autoinducible expression system by promoter engineering in Bacillus subtilis [J]. Microbial Cell Factories, 2016, 15(1): 66.
[12] ZHANG K, SU L, DUAN X, et al. High-level extracellular protein production in Bacillus subtilis using an optimized dual-promoter expression system [J]. Microbial Cell Factories, 2017, 16(1): 32.
[13] GUIZIOU S, SAUVEPLANE V, CHANG H J, et al. A part toolbox to tune genetic expression in Bacillus subtilis [J]. Nucleic Acids Research, 2016, 44(15): 7 495-7 508.
[14] LITHWICK G, MARGALIT H. Hierarchy of sequence-dependent features associated with prokaryotic translation [J]. Genome Research, 2003, 13(12): 2 665-2 673.
[15] WU J, LEI J, ZHANG L, et al. Improving production and bioactivity of recombinant human disintegrin domain of ADAM15 (rhADAM15) in Escherichia coli [J]. Acta Microbiologica Sinica, 2008, 48(8): 1 067-1 074.
[16] BURGESS-BROWN N A, SHARMA S, SOBOTT F, et al. Codon optimization can improve expression of human genes in Escherichia coli: A multi-gene study [J]. Protein Expression and Purification, 2008, 59(1): 94-102.
[17] NOβMANN M, PIEPER J, HILLMANN F, et al. Generation of an arginine-tRNA-adapted Saccharomyces cerevisiae strain for effective heterologous protein expression [J]. Current Genetics, 2018, 64(3): 589-598.
[18] MACDONALD L E, DURBIN R K, DUNN J J, et al. Characterization of 2 types of termination signal for Bacteriophage T7 RNA polymerase [J]. Journal of Molecular Biology, 1994, 238(2): 145-158.
[19] OSTERMAN I A, EVFRATOV S A, SERGIEV P V, et al. Comparison of mRNA features affecting translation initiation and reinitiation [J]. Nucleic Acids Research, 2013, 41(1): 474-486.
[20] KOSURI S, GOODMAN D B, CAMBRAY G, et al. Composability of regulatory sequences controlling transcription and translation in Escherichia coli [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(34): 14 024-14 029.
[21] ESPAH BORUJENI A, CETNAR D, FARASAT I, et al. Precise quantification of translation inhibition by mRNA structures that overlap with the ribosomal footprint in N-terminal coding sequences [J]. Nucleic Acids Research, 2017, 45(9): 5 437-5 448.
[22] DEL VECCHIO D. Modularity, context-dependence, and insulation in engineered biological circuits [J]. Trends in Biotechnology, 2015, 33(2): 111-119.
[23] GIBSON D G, YOUNG L, CHUANG R Y, et al. Enzymatic assembly of DNA molecules up to several hundred kilobases [J]. Nature Methods, 2009, 6(5): 343.
[24] SPIZIZEN J. Transformation of Biochemically deficient Strains of Bacillus subtilis by deoxyribonucleate [J]. Proceedings of the National Academy of Sciences of the United States of America, 1958, 44(10): 1 072-1 078.
[25] 杨扬,秦强,郭伟忠. 苯基异硫氰酸酯衍生氨基酸的高效液相色谱分析[J]. 色谱, 1994,12(4): 295-296.
[26] RAMJEE M K, GENSCHEL U, ABELL C, et al. Escherichia coli L-aspartate-alpha-decarboxylase: Preprotein processing and observation of reaction intermediates by electrospray mass spectrometry [J]. Biochemical Journal, 1997, 323(3): 661-669.
[27] 高宇. 一釜双酶法转化富马酸制备β-丙氨酸催化体系的构建及工艺优化[D]. 无锡:江南大学, 2017.
[28] WITTIG I, KARAS M, SCHAEGGER H. High resolution clear native electrophoresis for In-gel functional assays and fluorescence studies of membrane protein complexes [J]. Molecular & Cellular Proteomics, 2007, 6(7): 1 215-1 225.
[29] QIAN Y, LIU J, SONG W, et al. Production of β-alanine from fumaric acid using a dual-enzyme cascade [J]. ChemCatChem, 2018, 10(21): 4 984-4 991.
[30] GUAN C, CUI W, CHENG J, et al. Construction of a highly active secretory expression system via an engineered dual promoter and a highly efficient signal peptide in Bacillus subtilis [J]. New Biotechnology, 2016, 33(3): 372-379.
[31] ZONG Y, ZHANG H M, LYU C, et al. Insulated transcriptional elements enable precise design of genetic circuits [J]. Nature Communications, 2017, 8(1): 52.