香椿是我国特有的集材、菜、药为一体的珍贵木本植物,具有抗逆性强、不易发生病虫害的特点[1]。据文献记载,香椿含有多酚、黄酮、生物碱、皂苷、萜类等多种活性物质[2-3],具有重要的生物活性,如降血糖[4-5]、抗氧化[6-7]和抗菌活性[8-9]等。
内生真菌是一类生活在宿主植物组织中,并对其组织不引起明显病症的微生物。根据共生理论,内生真菌可以产生与宿主植物相同或相似的生物活性物质[10-11],且具有生长速度快、发酵周期短、易于工业化等特点[12],因此,植物内生真菌已成为寻找和发现各种天然生物活性物质的新资源。
α-葡萄糖苷酶抑制剂是一类治疗Ⅱ型糖尿病的口服降糖药,主要通过抑制α-葡萄糖苷酶的活性,降低餐后高血糖[13-14]。因此,α-葡萄糖苷酶抑制剂的开发对糖尿病患者控制餐后血糖水平具有重要意义。活性氧是细胞代谢中所产生的自由基,会导致蛋白质、脂肪、DNA等生物大分子的氧化损伤,而长期处于氧化损伤状态会导致诸如心血管疾病、慢性炎症等慢性疾病[15]。因此,抗氧化剂的研究对治疗心血管疾病、延缓机体衰老也具有重要意义。随着抗菌药物的广泛应用和滥用,耐药菌株不断增加,抗感染治疗陷入耐药菌危机之中。为了应对耐药菌感染,人们不断研究和开发新型抗菌药物。而香椿内生真菌作为一种天然活性物质资源库,对开发具有降糖、抗氧化和抗菌活性的活性物质具有重要的研究意义。
因此,本研究首次以河南香椿植物为材料,进行内生真菌的分离纯化,并以α-葡萄糖苷酶抑制活性、抗氧化活性和抗细菌活性为指标,筛选出高活性菌株。然后通过rDNA序列分析,在NCBI上进行序列比对和构建系统发育树,并结合传统的形态学观察进行菌株的分类鉴定。这为后期香椿内生真菌的开发利用提供了理论参考,为从香椿内生真菌中获得结构新颖、生物活性多样高效的次生代谢产物提供了研究基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
红油香椿,采自河南省郑州市中牟县田庄村河南省农业科学院香椿示范基地;Ezup柱式真菌基因组DNA抽提试剂盒及PCR相关试剂,生工生物工程(上海)股份有限公司;α-葡萄糖苷酶、对硝基苯基葡萄糖苷,美国Sigma公司;阿卡波糖,拜耳医药保健有限公司;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、链霉素,北京索莱宝生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH),东京化成工业株式会社;其他分析纯试剂,郑州博越商贸股份有限公司。
1.1.2 仪器与设备
YXQ-LS-75SII-01-00立式压力蒸汽灭菌锅,上海博讯实业有限公司;SJ-CJ-2FD超净工作台,苏州苏洁净化设备有限公司;GHP-9160恒温培养箱,上海一恒科学仪器有限公司;恒温培养摇床,上海一恒科技有限公司;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;R-1001型旋转蒸发仪,郑州长城科工贸有限公司;XHF-D高速分散器,宁波新芝生物科技股份有限公司;GENESYS 10S UV-VIS紫外-可见分光光度计,美国Thermo公司;XSP-BM8A型生物显微镜,上海光学仪器厂;2720 thermal cycler PCR仪,Applied Biosystems;DYCP-31DN电泳仪,北京六一仪器厂;FR980凝胶成像仪,上海复日科技仪器有限公司。
1.2 实验方法
1.2.1 内生真菌的分离纯化[16]
表面消毒:用流水将香椿茎表面浮土冲洗干净,然后用无菌水漂洗2次,风干表面水分,转移至超净工作台,在无菌条件下,将香椿茎用体积分数为70%乙醇浸泡1 min,次氯酸钠溶液(有效氯30 g/L)浸泡1min,70%乙醇浸泡30 s,无菌水漂洗3次,无菌吸水纸吸干表面备用。
菌株的分离、纯化:表面消毒好的香椿茎,无菌条件下,用灭菌剪刀剪成0.5 cm左右的小块放在马铃薯固体培养基(PDA)上,每板3~5根,于28℃恒温培养箱培养3 d。当植物组织内部向培养基周围长出菌丝时,将内生真菌转移到新的PDA平板培养基上对其划线培养,3~5 d后分离纯化得到单菌落,然后转移到PDA斜面上,4℃冰箱保存,编号备用。其中,PDA固体培养基(g/L):土豆200,葡萄糖20,琼脂20。
1.2.2 次级代谢产物的制备
发酵:将4℃冰箱保藏的香椿内生真菌接种到PDA固体培养基平板上,28℃培养箱活化培养4 d,然后接种到盛有200 mL液体发酵培养基的锥形三角瓶中,28 ℃ 150 r/min摇床发酵培养7 d。其中,PDA液体发酵培养基(g/L):土豆200,葡萄糖10,麦芽糖20,甘露醇20,蛋白胨5,酵母膏3,味精5,pH 6.0。
提取:菌株发酵完成后,发酵培养液先用匀浆搅拌机搅碎,再用布氏漏斗抽滤,得到发酵液和菌丝体。然后分别采用等量乙酸乙酯对发酵液和菌丝体进行萃取,重复3次,合并得到乙酸乙酯提取液。
浓缩:将乙酸乙酯提取液用旋转蒸发仪于40 ℃减压浓缩蒸干,即得到菌株的次级代谢产物浸膏。
样品液配制:将浓缩后的发酵浸膏用无水乙醇溶解配制成10 g/L的溶液。备用待测。
1.2.3 体外活性评价
1.2.3.1 α-葡萄糖苷酶抑制活性[17]
在620 μL 0.1 mol/L磷酸钾缓冲液(pH 6.8)中,加入5 μL α-葡萄糖苷酶溶液与10 μL待测样品液,37.5 ℃预热20 min,加入10 μL对硝基苯基葡萄糖苷(pNPG,10 mmol/L)作为反应底物以启动反应,37.5 ℃下反应30 min。然后加入650 μL 1 mol/L Na2CO3终止反应,在 410 nm处测定酶活。同时以相同浓度的阿卡波糖溶液为对照,平行测定3次。样品液用量如表1所示。
表1 反应条件 单位:μL
Table 1 Reaction conditions
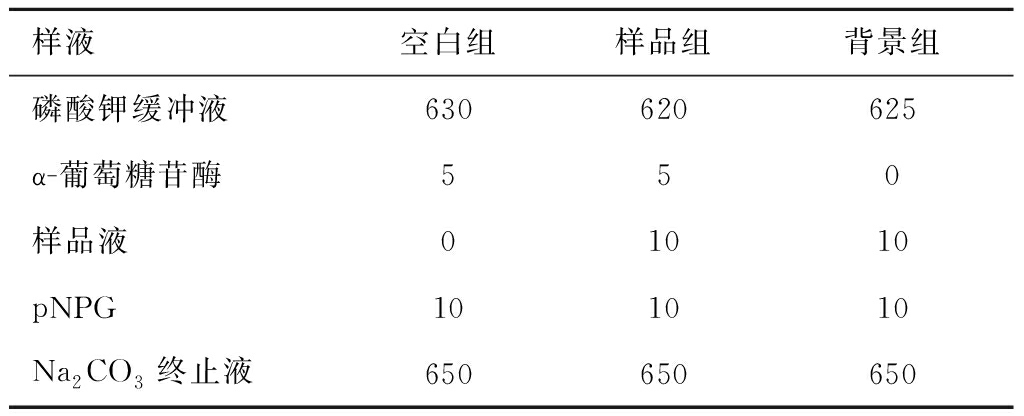
样液空白组样品组背景组磷酸钾缓冲液630620625α-葡萄糖苷酶550样品液01010pNPG101010Na2CO3终止液650650650
计算公式(1)如下:
酶活性抑制率![]()
(1)
式中:A空白为未知样品液的改光度值;A样品为样品与酶反应后的吸光度值;A背景为样品空白吸光度值。
1.2.3.2 抗氧化活性
(1)ABTS+·清除活性[18-19]
参照OZCAN[18]提出的用H2O2/ABTS/醋酸盐缓冲液体系来生成ABTS+·,这种方法产生的ABTS+·十分稳定。具体方法如下:
将0.549 g ABTS+·溶解在100 mL的2 mmol/L H2O2醋酸钠盐溶液中(最终浓度10 mmol/L),室温放置1 h,有特征的蓝绿色ABTS+·产生。然后将10 mmol/L 的ABTS+·用醋酸钠盐缓冲液(pH 3.6)稀释到734 nm下吸光度(0.70±0.02)。取150 μL无水乙醇溶解的样品溶液,加入3 mL ABTS+·溶液,准确振荡30 s,测定反应液在734 nm下的吸光度值。同时以相同浓度的Vc溶液为对照,平行测定3次。ABTS+·清除率计算如公式(2):
清除率![]()
(2)
式中:A0为未加样的ABTS+·的吸光度值;At为样品与ABTS+·反应后的吸光度值;B为样品空白的吸光度值。
(2)DPPH·清除活性[20]
准确称取0.019 7 g DPPH,用无水乙醇定容至250 mL,配成2×10-4mol/L的DPPH溶液。取样品液和2×10-4mol/L DPPH溶液各2 mL分别加入试管中,摇匀,室温下避光放置30 min,使其充分反应。以无水乙醇为参比在517 nm波长处比色,测定其吸光度Ai;同时测定2 mL无水乙醇与2 mL DPPH溶液的混合液的吸光度Ac和2 mL样品溶液与2 mL无水乙醇的吸光度Aj。同时以相同浓度的Vc溶液为对照,平行测定3次。计算DPPH·清除率见公式(3):
清除率![]()
(3)
1.2.3.3 抗细菌活性[21]
病原细菌:欧文氏菌(Erwinia sp.) (ATCC 02203)、茄科雷尔氏菌(Ralstonia solanacearum) (ATCC 01474)、水稻白叶枯(Xanthomonas oryzae) (ATCC 11602)、豪氏变形杆菌(Proteus hauseri) (ATCC 10497)、铜绿假单孢菌(Pseudomonas aeruginosa) (ATCC 10500)、大肠杆菌(Escherichia coli) (ATCC 25922)、金黄色葡萄糖球菌Staphylococcus aureus (ATCC 25923)。
测试细菌接种于液体培养基中,培养12 h。
将培养基在121 ℃下高压灭菌30 min,冷却至约40~50 ℃后,在净化工作台上将无菌培养基倒入90 mm 无菌培养皿中,培养基凝固后,吸取200 μL菌悬液置于培养皿中央,用涂布棒涂布均匀,然后用灭菌镊子在培养皿中放入无菌牛津杯(直径Φ=6 mm),在其中加入200 μL供试样液(平行3次),同时作溶剂和阳性对照实验。平板于30 ℃培养12 h后观察并测定抑菌圈的直径(mm)。其中,阳性对照为相同浓度的链霉素溶液,阴性对照为无水乙醇溶剂。
其中,液体培养基:
营养肉汁培养基(g/L):蛋白胨10,牛肉提取物3,NaCl 5,pH 7.0。
胰化酪蛋白胨大豆肉汁培养基(g/L):胰蛋白胨大豆肉汤(TSB)30。
溶菌肉汤(LB)培养基(g/L):酵母提取物5,蛋白胨10,NaCl 10,pH 7.0。
固体培养基:
营养肉汁琼脂培养基(g/L):蛋白胨10,牛肉提取物3,NaCl 5,琼脂20,pH 7.0。
胰化酪蛋白胨大豆肉汁琼脂培养基(g/L):TSB 30,琼脂20。
LB琼脂培养基(g/L):酵母提取物5,蛋白胨10,NaCl 10,琼脂20,pH 7.0。
1.2.4 菌株鉴定
1.2.4.1 菌株的形态学鉴定
将待鉴定的内生真菌接种到PDA固体培养基上,28 ℃连续培养4~5 d,观察菌落形态特征。挑取菌落边缘菌丝,制作水浸片,在光学显微镜下观察菌丝体的形态特征。
1.2.4.2 菌株的分子生物学鉴定[22]
(1)DNA提取:从保藏菌种的斜面培养基中挑取菌丝转接到PDA平板上,28 ℃培养4~5 d。基因组DNA的提取采用Ezup柱式真菌基因组DNA抽提试剂盒(SK8259),严格按照说明书操作。提取的基因组DNA在1%琼脂糖凝胶中电泳检测(150 V,100 mA、20 min)。4 ℃保存备用,或于-20 ℃中长期保存。
(2)PCR扩增18S序列
18S rDNA扩增引物:NS1(5′-GTAGTCATATGCTTGTCTC-3′)/NS6(5′-GCATCACAGACCTGTTATTGCCTC-3′),PCR反应条件为预变性94 ℃、4 min,变性94 ℃、45 s,退火55 ℃、45 s,延伸72 ℃、1 min, 共30个循环,最后修复延伸72 ℃、10 min。
PCR扩增采用25 μL的反应体系,包括ddH2O 19.8 μL,PCR缓冲液(10×, Mg+ plus) 2.5 μL,dNTP(各2.5 mmol/L) 1 μL,引物-F(10 μmol/L) 0.5 μL,引物-R(10μmol/L) 0.5 μL,DNA 0.5 μL,Taq 聚合酶 0.2 μL。
(3) PCR扩增产物的电泳检测:产物经1%琼脂糖凝胶电泳检测后4℃保存备用。
(4) PCR产物纯化和测序:由生工生物工程(上海)股份有限公司进行。
1.3 数据统计与分析[23-24]
采用DPS软件对数据进行单因素方差分析(One-Way ANOVA),用Tukey多重比较法检验差异显著性,5%为显著水平。
系统进化树的构建:将所测得的序列在NCBI中进行Blast比对,下载与供试菌株序列同源性相近的菌株序列,利用ClustalX软件进行序列的多重比对,利用MEGA7.0软件N-J方法(neighbor-joining)构建系统发育树,自展数为1 000。
2 结果与分析
2.1 香椿内生真菌的活性筛选
香椿经分离、纯化,共分离得到6株内生真菌。将分离得到的内生真菌进行液体发酵培养,制备得到其次级代谢产物,然后对其进行α-葡萄糖苷酶抑制活性、抗氧化和抗细菌活性的测定,结果见表2~表4。
表2 六株香椿内生真菌的α-葡萄糖苷酶抑制活性
Table 2 The inhibition activities of α-glucosidase of
six endophytic fungi of Toona sinensis

样品菌株抗α-葡萄糖苷酶活性/%TS319.48±1.89abTS524.73±1.51aTS817.80±2.18abTS1322.50±6.51abTS4712.76±1.67b56-5024.98±1.89a对照19.64±1.00ab
注:同列小写字母不同表示差异显著(P<0.05)。下同。
由实验结果表明,在10 g/L的样品质量浓度下,6株香椿内生真菌的次级代谢产物均具有一定程度的抑制α-葡萄糖苷酶活性。其中,菌株56-50抑制活性最高,为(24.98±1.89)%,高于对照品(19.64±1.00)%,但两者无显著差异(P>0.05),与菌株TS47的α-葡萄糖苷酶抑制活性差异显著(P<0.05)。
表3 六株香椿内生真菌的抗氧化活性
Table 3 The antioxidant activities of six endophytic
fungi of Toona sinensis

样品菌株ABTS+·清除率/%DPPH·清除率/%TS338.05±4.43d76.07±2.42bTS522.20±1.07e52.03±0.45cTS848.20±2.68c74.68±1.06bTS136.93±0.95f 12.29±1.06dTS4771.16±0.81b94.55±0.15a56-5095.92±0.40a91.77±0.45a对照92.41±0a 95.62±0.15a
由实验结果,可以看出,在10 g/L的样品质量浓度下,菌株56-50和TS47均具有较好的抗氧化活性。其中,菌株56-50对ABTS+·的清除活性为(95.92±0.40)%,与对照品Vc无显著差异(P>0.05),与其他样品差异显著(P<0.05)。菌株56-50和TS47对DPPH·的清除活性分别为(91.77±0.45)%和(94.55±0.15)%,均与对照品Vc无显著差异(P>0.05),与其他样品差异显著(P<0.05)。
表4 六株香椿内生真菌的抗细菌活性 单位:mm
Table 4 The antibacterial activities of six endophytic fungi of Toona sinensis

样品菌株指示菌欧文氏菌茄科雷尔氏菌水稻白叶枯豪氏变形杆菌铜绿假单孢杆菌大肠杆菌金黄色葡萄糖球菌TS3------8.16±0.05c TS5------7.87±0.06dTS815.11±0.07a10.01±0.06b-----TS13----12.89±1.31b-9.63±0.03bTS47----12.32±0.78b11.00±0.66b-56-50---20.33±0.08a14.22±0.05b--阳性对照16.01±0.58a27.75±0.84a27.80±0.1421.66±0.85a22.39±0.12a15.37±0.32a15.00±0.13a阴性对照-------
注:抗菌活性以菌圈直径(mm)计;“-”表示未检出活性。
抑菌圈的大小表示抑菌活性高低。其中抑菌圈越大,表示抑菌活性越高,反之,抑菌活性越低。由表4可看出,阴性对照乙醇没有抑菌圈,说明没有抑菌活性,从而排除溶剂影响。在10 g/L的质量浓度下,阳性对照链霉素抑菌效果明显。菌株TS8对软腐病欧文氏菌具有较强的抑制活性,与阳性对照无显著差异(P>0.05)。菌株56-50对豪氏变形杆菌具有较强抑制活性,与阳性对照无显著差异(P>0.05)。
内生真菌与植物的长期协同进化,可能导致了内生真菌与宿主植物有基因交流,致使内生真菌与宿主植物有相同或相似的代谢途径,因而可能会产生与宿主植物相同或相似的活性次级代谢产物[25]。这为在植物内生真菌中寻找与其宿主相同或相似的活性化合物提供理论基础。据文献报道,香椿能产生降糖、抗氧化或抗菌的活性物质,其内生真菌也可能会产生此类或者相似的生物活性物质。因此,香椿植物内生真菌是一类亟待开发的微生物资源,在食品、生物制药、农业生产等领域具有潜在的应用价值。
本研究对香椿植物内生真菌进行了活性测试,结果表明菌株56-50的次级代谢产物具有较好的α-糖苷酶抑制活性、抗氧化活性以及抗细菌活性,提示该菌株可能产生具有降糖、抗氧化和抗菌作用的活性物质。因此,选择菌株56-50对后续开发天然α-糖苷酶抑制剂、抗氧化剂和抗菌剂具有潜在的研究价值。
2.2 菌株56-50的鉴定
2.2.1 形态学特征
菌落形态特征:菌株56-50在PDA平板培养基上培养1 d,可产生零星的放射状白色菌丝,4 d后菌落直径为6.0 cm,绒毛状或棉絮状,具明显的同心轮纹,中央为墨绿色,外部淡黄色至灰绿色,菌落平坦,表面具少量稀疏的白色气生菌丝(图1-a),8 d后菌落布满培养皿。
孢子形态特征:分生孢子顶生,暗褐色,近卵形;分生孢子梗单生,深褐色,具明显的横隔(图1-b、图1-c)。

a-在PDA培养基上28 ℃培养4 d后的菌落正面形态;
b~c-菌丝、分生孢子及分生孢子梗(×100)
图1 内生真菌56-60的菌落特征
Fig.1 Morphological characteristics of the
endophytic fungus 56-60
2.2.2 分子生物学鉴定
由于形态学特征无法准确判定菌株56-50的种属地位,因此采用分子生物学方法对其进行鉴定:以提取出的菌株56-50的DNA为模板,对其18S rDNA基因片段进行PCR扩增,产物经1%琼脂糖凝胶电泳,扩增产物为1 300 bp左右的特异性扩增条带,大小与期望值相符。PCR扩增产物由上海生工有限公司进行测序,测序结果表明,该菌株的18S rDNA基因序列长度为1 322bp。菌株56-50交由中国普通微生物菌种保藏管理中心保藏(保藏号:CGMCC No.12980)。
将PCR扩增获得的18S rDNA序列在NCBI中进行BLAST分析,结果表明,菌株56-50的18S rDNA序列与链格孢属Alternaria sp.的18S序列同源性最高,相似性达100%。利用ClastalX与Mega 5.0软件,基于18S rDNA序列构建系统发育树,见图2,从系统进化树上可以看出,每一个属分别形成一个独立的分枝,菌株56-50与Alternaria sp.(KT192438.1)和Alternaria sp.(GQ253348.1)处于同一分枝,亲缘关系最近,判断该菌株为链格孢属Alternaria sp.。
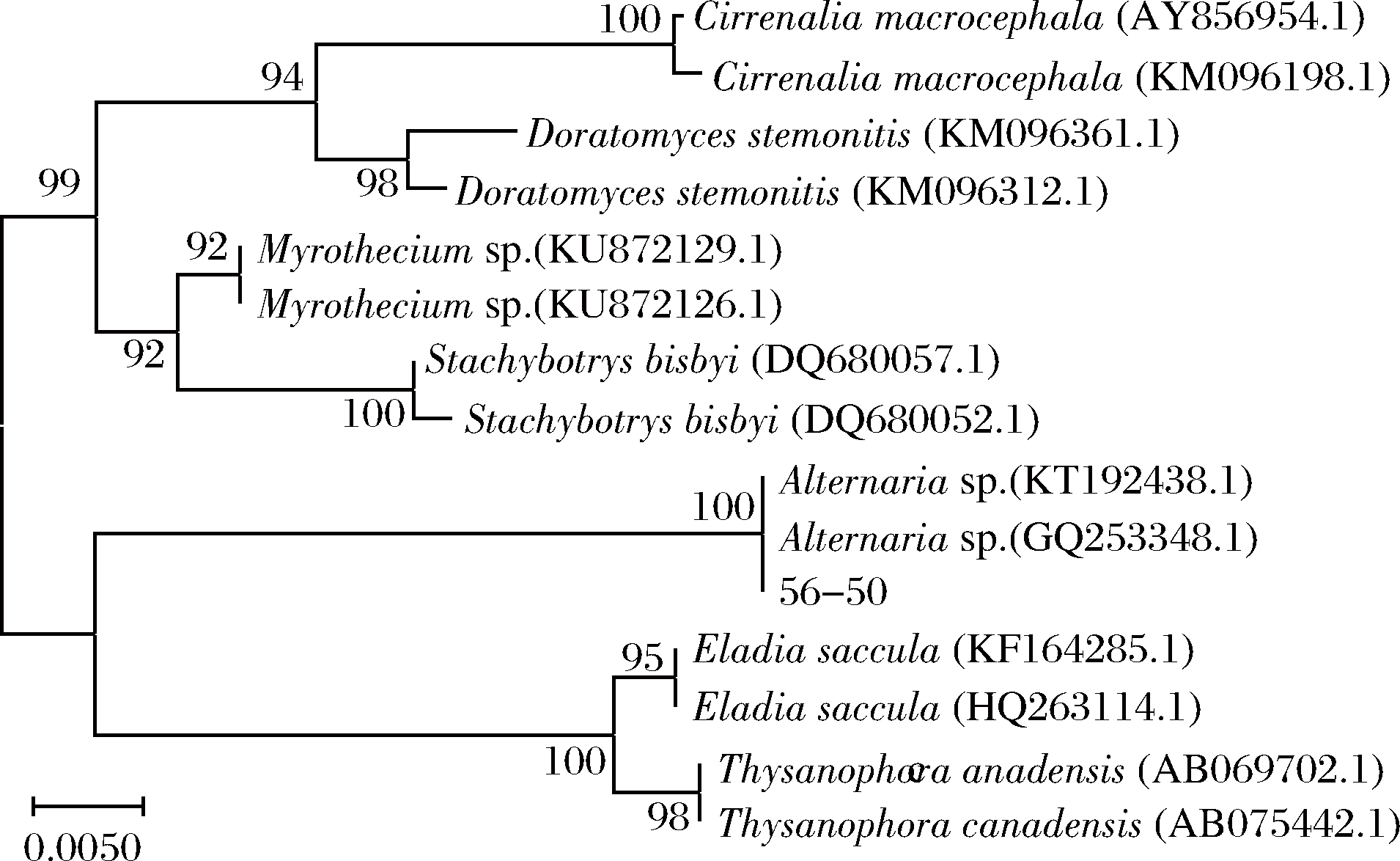
图2 基于18S rDNA基因序列构建的邻接树
Fig.2 Neighbor-joining tree based on 18S rDNA
gene sequences
3 讨论与结论
1993年,STIERLE等[26]首次从短叶红豆杉中分离得到1株能产生抗癌物质紫杉醇的内生真菌,表明内生真菌具有合成和宿主植物相同或相似活性物质的能力,从而使植物内生真菌成为寻找和发现各种天然生物活性物质的新资源。周生亮等[27]研究了4株薯蓣(Dioscorea zingiberensis)内生真菌的发酵液和菌丝的抗氧化活性,发现这4株菌株的菌丝和发酵液具有不同的抗氧化活性。刘军生等[28]从七叶树Aesculus chinensis根和茎中分离得到1株内生真菌EA-LJS80,发现其发酵产物具有较强的抑菌活性,这为挖掘对人体有益的活性物质提供了理论基础。
真菌传统的主要分类依据是形态结构、生化特征等,但由于真菌种类繁多,形态复杂,因此,在传统真菌分类中常引起误鉴或错鉴。随着分子生物学、遗传学等学科的快速发展,在真菌现代分类学中引入了分子生物学技术的鉴定方法,通过提取真菌DNA基因组进行测序分析,确定菌株的属种地位,使真菌分类研究变得简便快捷、准确可靠。
本文首次以河南红油香椿为研究材料,从其体内分离纯化出6株内生真菌,并以α-葡萄糖苷酶抑制活性、抗氧化和抗细菌活性为靶标,筛选出1株具有最好生物活性的菌株56-50。然后采用分子生物学和形态学特征相结合的方法对其进行鉴定,根据18S rDNA基因测序结果在NCBI上进行同源性比对,并通过MEGA 5.0序列分析软件构建系统进化树,根据进化树结果,结合培养特征,将菌株56-50鉴定为链格孢属Alternaria sp.。
香椿植物本身具有重要的降糖、抗氧化和抗细菌等生理活性,而在本实验中,从香椿中分离出来的Alternaria sp.也表现出较好的α-糖苷酶抑制能力、抗氧化能力以及抗细菌能力,这显示出内生真菌与宿主在功能上的一致性,将为进一步丰富该真菌的功能多样性提供了证据,也为从香椿内生真菌中寻找新的天然α-糖苷酶抑制剂、抗氧化剂和抗菌剂提供了可能。今后,将进一步对该菌进行大量发酵,通过采用分离纯化技术,进一步研究其中的单体化合物结构,为深入揭示内生真菌和宿主香椿之间的关系以及挖掘天然α-糖苷酶抑制剂、抗氧化剂和抗菌剂提供理论依据。
[1] 王赵改, 陈丽娟,张乐,等. 不同采收期红油香椿营养成分和抗氧化活性分析[J]. 食品科学, 2015, 36(4): 158-163.
[2] MENG Q Q, PENG X R, LU S Y, et al. Lactam triterpenoids from the bark of Toona sinensis[J]. Natural Products and Bioprospecting, 2016, 6(5): 239-245.
[3] WANG C Y, LIN K H, YANG C H, et al. Toona sinensis extracts induced cell cycle arrest and apoptosis in the human lung large cell carcinoma[J]. The Kaohsiung Journal of Medical Sciences, 2010, 26(2): 68-75.
[4] ZHAO J, ZHOU X W, CHEN X B, et al. α-Glucosidase inhibitory constituents from Toona sinensis[J]. Chemistry of Natural Compounds, 2009, 45(2): 244-246.
[5] 任美萍, 李春红, 李蓉. 香椿总黄酮对糖尿病小鼠及正常小鼠血糖的影响[J]. 泸州医学院学报, 2012, 35(3): 261-262.
[6] ZHANG W, LI C, YOU L J, et al. Structural identification of compounds from Toona sinensis leaves with antioxidant and anticancer activities[J]. Journal of functional foods, 2014,10: 427-435.
[7] HSEU Y C, CHANG W H, CHEN C S, et al. Antioxidant activities of Toona Sinensis leaves extracts using different antioxidant models[J]. Food and Chemical Toxicology, 2008, 46(1): 105-114.
[8] WU J G, PENG W, YI J, et al. Chemical composition, antimicrobial activity against Staphylococcus aureus and a pro-apoptotic effect in SGC-7901 of the essential oil from Toona sinensis (A.Juss.) Roem. leaves[J]. Journal of Ethnopharmacology, 2014, 154(1), 198-205.
[9] 陈丛瑾. 香椿有效成分的提取纯化和生物活性研究[D]. 长沙:中南林业科技大学, 2010: 168-172.
[10] LI X, WANG J, ZHANG S, et al. Distribution of fungal endophytes in roots of Stipa krylovii across six vegetation types in grassland of northern China[J]. Fungal Ecology, 2018, 31: 47-53.
[11] 曾松荣, 徐成东,王海坤,等. 药用植物内生真菌及其具宿主相同活性成分的机制初探[J]. 中草药, 2000, 31(4): 306-308.
[12] 赵凯,宇璐,金昱言,等.内生真菌紫衫醇生物合成的研究现状与展望[J].生物工程学报, 2016, 32(8): 1 038-1 051.
[13] KIM Y M, WANG M H, RHEE H I. A novel a-glucosidase inhibitor from pine bark[J]. Carbohydrate Research, 2004, 339(3): 715-717.
[14] 马燕燕, 鲁晓翔. 天然产物α-葡萄糖苷酶抑制剂筛选研究进展[J]. 粮食与油脂, 2010, 170(6): 7-10.
[15] CHEN C, YOU L J, ABBASI A M, et al. Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohydrate Polymers, 2015, 130(5): 122-132.
[16] GUO L D, HYDE K D, LIEW E C Y. Identification of endophytic fungi from Livistona chinensis based on morphology and rDNA sequences[J]. New Phytologist, 2000, 147(3): 617-630.
[17] 赵文竹. 玉米须功能因子活性评价及其降血糖机理研究[D]. 长春:吉林大学, 2014: 63-64.
[18] OZCAN E.A novel autmated direct measurement method for total antioxidant capacity using a new generation,more stable ABTS radical cation[J].Clinical Biochemistry,2004,37(4):277-285.
[19] 赵呈雷. 芦蒿秸秆提取物抗氧化作用及其制剂学初步研究[D]. 镇江:江苏大学, 2007: 37-38.
[20] SUN T, HO C T. Antioxidant activities of buckwheat extracts[J]. Food Chemistry, 2005, 90 (4): 743-749.
[21] GOMEZ S, COSSON C, DESCHAMPS A M. Evidence for a bacteriocin-like substance produced by a new strain of Streptococcus sp., inhibitory to Gram-positive food-borne pathogens [J]. Research in Microbiology, 1997, 148(9): 757-766.
[22] 王晓敏, 王惠, 刘天行,等. 一株不产生孢子的盐生海芦笋内生真菌鉴定[J]. 食品科学, 2013, 34(17): 146-149.
[23] 谌小立, 陈文莹, 夏吉跃,等. 红酸汤烹调过程中全反式番茄红素含量变化规律研究[J]. 中国调味品, 2018, 43(2): 68-71.
[24] 谌小立, 黄先静, 杨旭芹,等. 三种食用油对红酸汤烹调中全反式番茄红素含量影响研究[J]. 中国调味品, 2019, 44(3): 91-94.
[25] 郑红梅, 叶耀辉,王婷,等. 药用植物内生真菌及其代谢产物活性的研究概况[J]. 江西中医药, 2016, 47(4): 71-73.
[26] STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew [J]. Science, 1993, 260(5 105): 214-216.
[27] 周生亮, 陈双林. 薯蓣内生真菌抗氧化活性的初步研究[J]. 微生物学杂志, 2006,26(1): 40-43.
[28] 刘军生, 解修超, 罗阳兰,等. Aspergillus sp. EA-LJS80的分离及其发酵液提取物七叶皂苷C的生物活性[J]. 菌物学报, 2018,37(1): 79-87.