近年来,随着人们生活水平的提高和营养保健意识的增强,果实中天然生物活性的研究和开发已成为国内外食品研究和生命科学研究的热点,如越橘、树莓、黑穗醋栗、蓝莓忍冬和沙棘等果实天然生物活性物质的开发和利用受到国内外学者的广发关注和青睐[1-3]。花色苷具有一定营养和药理作用,具有抗氧化、抗衰老、抗癌、心血管保护等生物活性,是一种潜在的功能性着色剂[4]。在食品、化妆品、医药领域有巨大应用潜力,是替代合成色素的理想材料,其作为一种天然的、无公害的、绿色环保型食用色素,安全性能极高,无毒,物料来源丰富。
欧李(Cerasus humilis (Bge.) Sok.) 又称“钙果”,是我国特有的蔷薇科樱桃属多年生小灌木,主要分布于我国的黑龙江、吉林、辽宁、内蒙古、山西等13个省区[5]。欧李果实颜色鲜艳,富含丰富的花色苷色素,具有红色、紫色或紫黑等多种类型。欧李‘农大4号’果实为红皮红肉类型,含有丰富的花色苷色素,但作为我国特有的一种富含花色苷色素的果树,对果实花色苷色素生物活性研究报道较少。本文研究了欧李‘农大4号’花色苷色素的抗氧化性以及对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑制作用,以期为开发利用欧李花色苷色素与后续功能农业产品的开发提供参考。
1 材料与方法
1.1 材料
欧李‘农大4号’:于2017年9月,在山西省太谷县巨鑫试验基地采摘,作为试验材料。
供试菌种:大肠杆菌(Escherichia.coli),由山西农业大学园艺学院欧李团队提供;金黄色葡萄球菌(Staphylococcus.aureus)、枯草芽孢杆菌(Bacillus subtilis),购买于中国典型培养物保藏中心。
1.2 试剂
无水乙醇(分析纯),天津市天力化学试剂有限公司;NaOH(分析纯),天津市凯通化学试剂有限公司;乙酸钠(分析纯),天津市化学试剂三厂;AB-8大孔树脂,沧州宝恩吸附材料科技有限公司;1,1-二苯基-2-苦肼基自由基,上海化成工业发展有限公司;30%H2O2(分析纯),天津市天力化学试剂有限公司;FeSO4(分析纯),天津市北辰方正试剂厂;水杨酸(分析纯),天津市北辰方正试剂厂。
1.3 仪器
UV-5200紫外可见分光光度计,上海元析仪器有限公司;JJ224BC型电子天平,常熟市双杰测试仪器厂;SB25-12D超声波清洗机,宁波新芝生物科技有限公司;HC-2518R高速冷冻离心机,安徽中科中佳科学仪器有限公司;SW-CJ-1D型单人净化工作台,苏州净化设备有限公司;RE-2000B旋转蒸发器,上海亚荣生化仪器厂;SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;DH系列电热恒温培养箱,天津市通利信达仪器厂。
1.4 实验方法
1.4.1 花色苷含量的测定
采用pH示差法测定,参考LEE等[6]的方法稍作修改。取pH=1.0 KCl-HCl缓冲液和pH=4.5乙酸钠-盐酸缓冲液各4.5 mL分别加入到0.5 mL的提取液中,摇匀,平衡15 min,在最大吸收波长520 nm和700 nm下测定吸光值,计算公式如式(1):
花色苷含量![]()
(1)
式中:A=(A520nm-A700nm)pH=1.0-(A520nm-A700nm)pH=4.5;MW=449.2 g/mol;摩尔消光系数ε=26 900 L/(mol·cm);DF为稀释倍数;L 为光程(cm);V为提取液体积(mL);m为原料质量(g)。
1.4.2 欧李‘农大4号’花色苷提取工艺优化
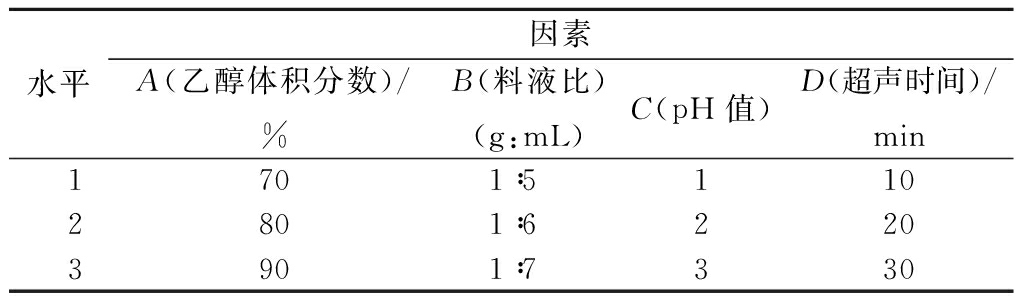
通过4因素(乙醇浓度,料液比,pH值,超声时间)3水平(乙醇浓度:70%、80%、90%;料液比:1∶5, 1∶6, 1∶7;pH值:1、2、3;超声时间:10、20、30 min)正交试验确定欧李‘农大4号’花色苷提取工艺。
1.4.3 欧李‘农大4号’花色苷的制备
称取一定量的欧李‘农大4号’果实,液氮研磨,按照料液比1∶5加入90%酸化乙醇溶液,超声提取10 min于10 000× g下离心30 min提取2次,合并上清液,得到粗提液,冷冻干燥得到粗制花色苷粉末。粗提液蒸发浓缩后通过AB-8大孔树脂吸附至饱和后先用蒸馏水洗至流出液为中性,再用乙醇洗脱,当流出液为无色时洗脱完成,收集洗脱液。洗脱液在40 ℃条件下旋转蒸发后经冷冻干燥,得到欧李‘农大4号’花色苷粉末,纯制品中花色苷含量为13.03 mg/g花色苷粉末。记录花色苷粉末质量m,根据公式计算提取率。计算公式如式(2):
花色苷提取率![]()
(2)
式中:m,花色苷质量,g;m0,果实质量,g。
1.4.4 树脂的预处理
将AB-8大孔树脂用4%的NaOH溶液浸泡12 h,用蒸馏水洗至中性;再用4%的HCl浸泡12 h,用蒸馏水洗至中性;最后用体积分数有95%乙醇浸泡12 h,用蒸馏水洗至中性,备用(此处中性以流出液的pH来判断)[6]。
1.4.5 欧李‘农大4号’花色苷抗氧化实验
1.4.5.1 DPPH·清除率的测定
参照文献方法并稍作改动[7]。将提取液稀释适宜倍数后,取2.8 mL的DPPH·溶液,加入0.2 mL稀释后的提取液,充分振荡混合,室温避光反应30 min,与517 nm下测定吸光度,记做A1,空白为加入0.2 mL的体积分数为90%乙醇溶液,测定吸光度记做A2,每个样品平行测定3次。按公式(3)计算DPPH·的清除率。
DPPH·清除率![]()
(3)
1.4.5.2 FRAP还原力测定
将提取液稀释至适宜浓度后,取0.1 mL稀释液,加入4.9 mL FRAP试剂,避光反应10 min后在593 nm下测定吸光值,0.1 mL的体积分数为90%乙醇作为空白对照,每个样品平行测定3次[8]。
1.4.5.3 ·OH清除率的测定
取0.4 mL提取液加入,加入1 mL浓度为9 mmol/L FeSO4溶液,摇匀后再加入9 mmol/L水杨酸溶液1 mL, 2 mL浓度为8.8 mmol/L H2O2和4.6 mL蒸馏水,混匀后,37 ℃条件下反应1 h,反应结束后,取出冷却,用蒸馏水调零,在510 nm处测定吸光值,记做A1。蒸馏水代替提取液做空白组,记做A2,蒸馏水代替水杨酸作为对照组,记做![]() 按公式(4)计算·OH的清除率。
按公式(4)计算·OH的清除率。
·OH清除率![]()
(4)
1.4.6 欧李‘农大4号’花色苷抑菌性实验
1.4.6.1 敏感性实验[10]
采用牛津杯法。将灭菌的培养基倒入平板,凝固后将0.2 mL的菌悬液均匀涂布于培养基上,每个培养皿中均匀放入3个牛津杯,其中2个牛津杯中加0.1 mL一定浓度的欧李‘农大4号’花色苷纯化液;另一个牛津杯加0.1 mL无菌水作对照。置于恒温培养箱中37 ℃培养24 h,通过抑菌圈判断抑菌效果。
1.4.6.2 最小抑菌浓度测定
取欧李‘农大4号’花色苷粉末,用一定无菌水稀释后后,采用二倍稀释法加入培养基中,然后将稀释后的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌接种于各培养基中,分别于37 ℃培养箱内恒温培养24 h,以出现透明抑菌圈的最低稀释浓度为最小抑菌浓度(minimum inhibitory concentration,MIC)。
1.4.6.3 高温处理对欧李‘农大4号’花色苷的抑菌效果的影响
根据MIC配制花色苷溶液,分别于40、60、80、100 ℃下处理30 min,加入到对应的菌液中,以未经热处理(25 ℃)的花色苷溶液作对照。在0、2、4、6、8、12、20 h取样,测OD600值,计算抑菌率。
1.5 统计分析
采用Excel软件进行数据计算和作图,采用SAS 8.0和SPSS 20.0软件进行显著性分析。
2 结果与分析
2.1 欧李‘农大4号’花色苷提取条件
采用4因素3水平正交试验(L9(34)),确定最佳提取条件。正交试验因素水平见表1。
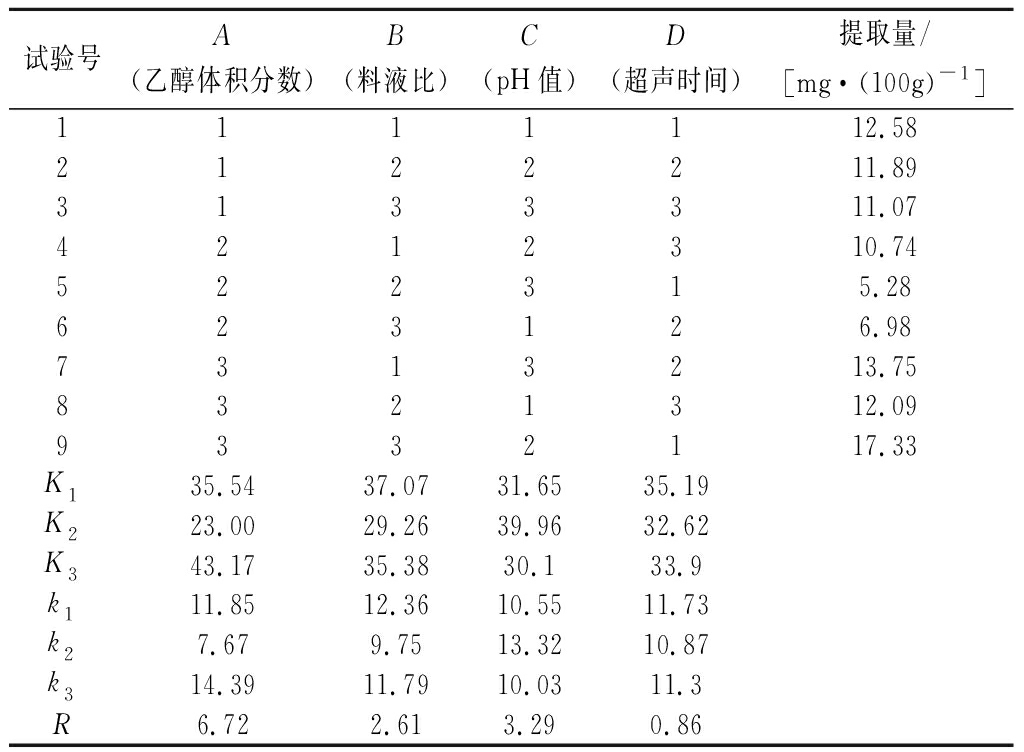
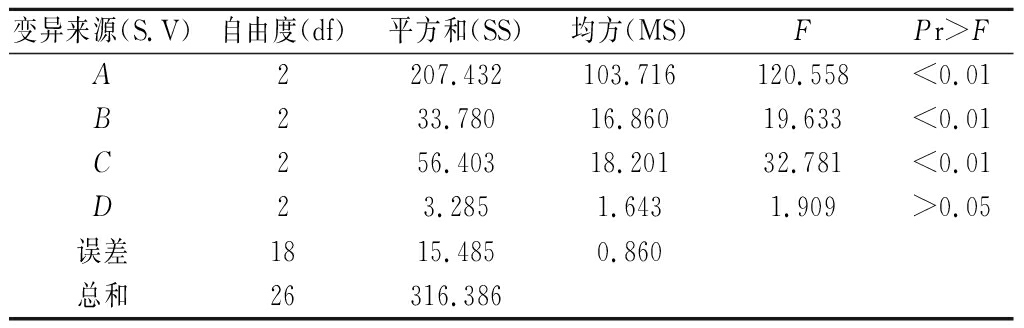
经极差分析(见表2)可知,RA>RC>RB>RD,因此,影响提取量大小的因素依次为:A>C>B>D,即乙醇体积分数>pH>料液比>超声时间。由图1正交试验因素水平直观分析图可以看出,优选方案为A3B1C2D1,即乙醇体积分数90%,料液比1∶5,pH值2.0,超声时间10 min。由于这个组合在以上9组试验中没有出现,因此,进一步试验,得到该处理下提取量为24.21 mg/100 g, 高于以上9组试验。因此,确定最终提取条件为乙醇体积分数为90%(pH=2.0),料液比1∶5,超声时间为10 min。由表3方差分析可见,因素A、B、C对花色苷提取量的影响极显著(P<0.01)。
表1 正交试验因素水平表
Table 1 Levels and factors of orthogonal experiment
水平因素A(乙醇体积分数)/%B(料液比)(g:mL)C(pH值)D(超声时间)/min1701∶51102801∶62203901∶7330
表2 正交试验结果
Table 2 The results of orthogonal test
试验号A(乙醇体积分数)B(料液比)C (pH值)D(超声时间)提取量/[mg·(100g)-1]1111112.582122211.893133311.074212310.74522315.28623126.987313213.758321312.099332117.33K135.5437.0731.6535.19K223.0029.2639.9632.62K343.1735.3830.133.9k111.8512.3610.5511.73k27.679.7513.3210.87k314.3911.7910.0311.3R6.722.613.290.86
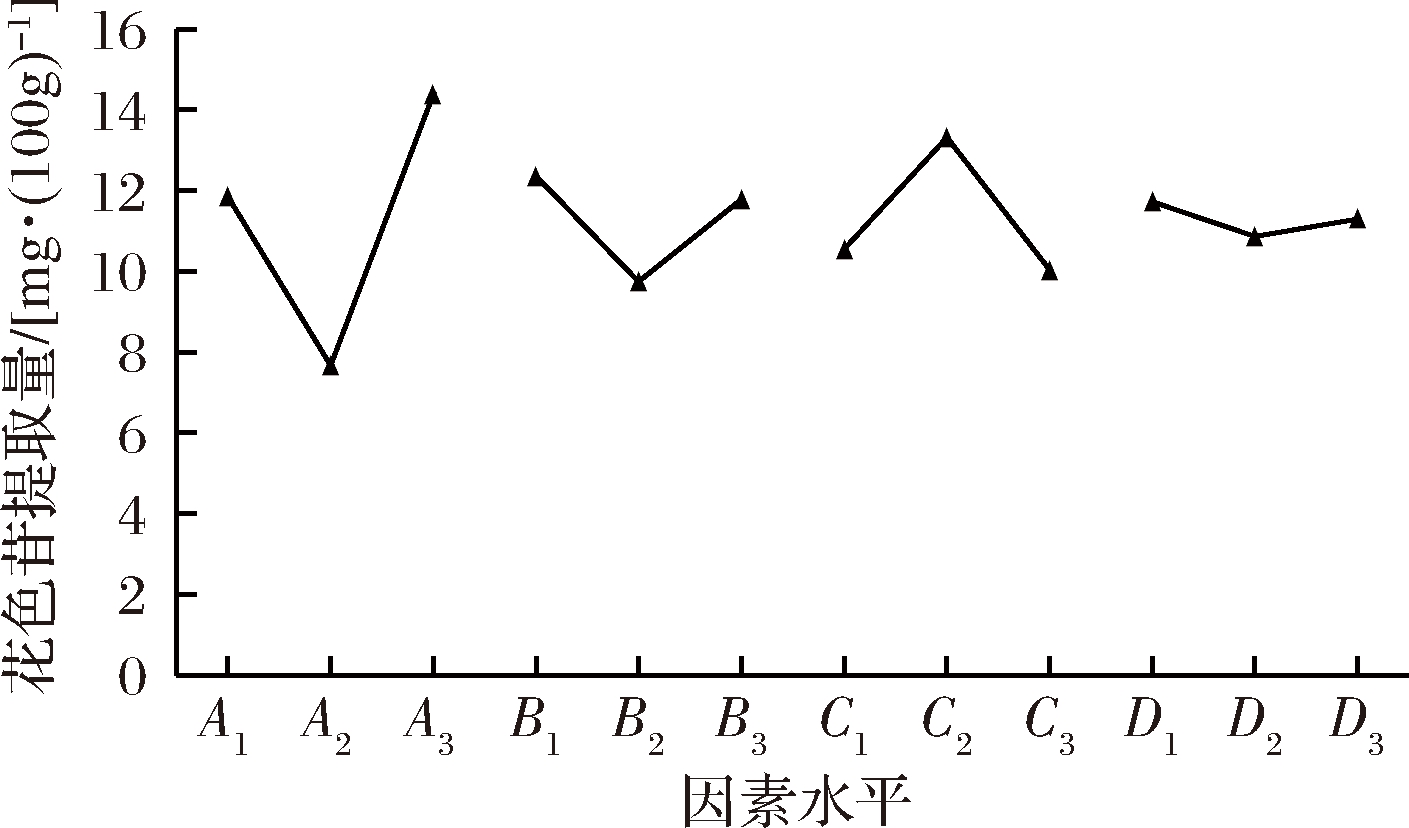
图1 正交试验因素水平直观分析图
Fig.1 Direct observation analysis figure of orthogonal test
表3 方差分析
Table 3 Analysis of variance components of orthogonal test
变异来源(S.V)自由度(df)平方和(SS)均方(MS)FPr>FA2207.432103.716120.558<0.01B233.78016.86019.633<0.01C256.40318.20132.781<0.01D23.2851.6431.909>0.05误差1815.4850.860总和26316.386
注:P<0.05表示差异达显著水平,P<0.01表示差异达极显著水平。
2.2 欧李‘农大4号’花色苷提取
称取72.00 g欧李‘农大4号’果实,通过超声,冷冻离心,AB-8大孔树脂吸附,真空冷冻干燥等工艺,得到深红色粉末0.48 g,提取率0.67%。
2.3 欧李‘农大4号’花色苷抗氧化能力
由图2可知,欧李‘农大4号’花色苷粗提液DPPH·清除力、FRAP还原力、·OH清除力的TEAC值分别为32.66、24.38、9.59 mg/g花色苷;欧李‘农大4号’花色苷纯化液DPPH·清除力、FRAP还原力、·OH 清除力的TEAC值分别为35.47、33.33、12.01 mg/g花色苷。欧李‘农大4号’花色苷纯化液的DPPH·清除力、FRAP还原力、·OH清除力显著高于粗提液。
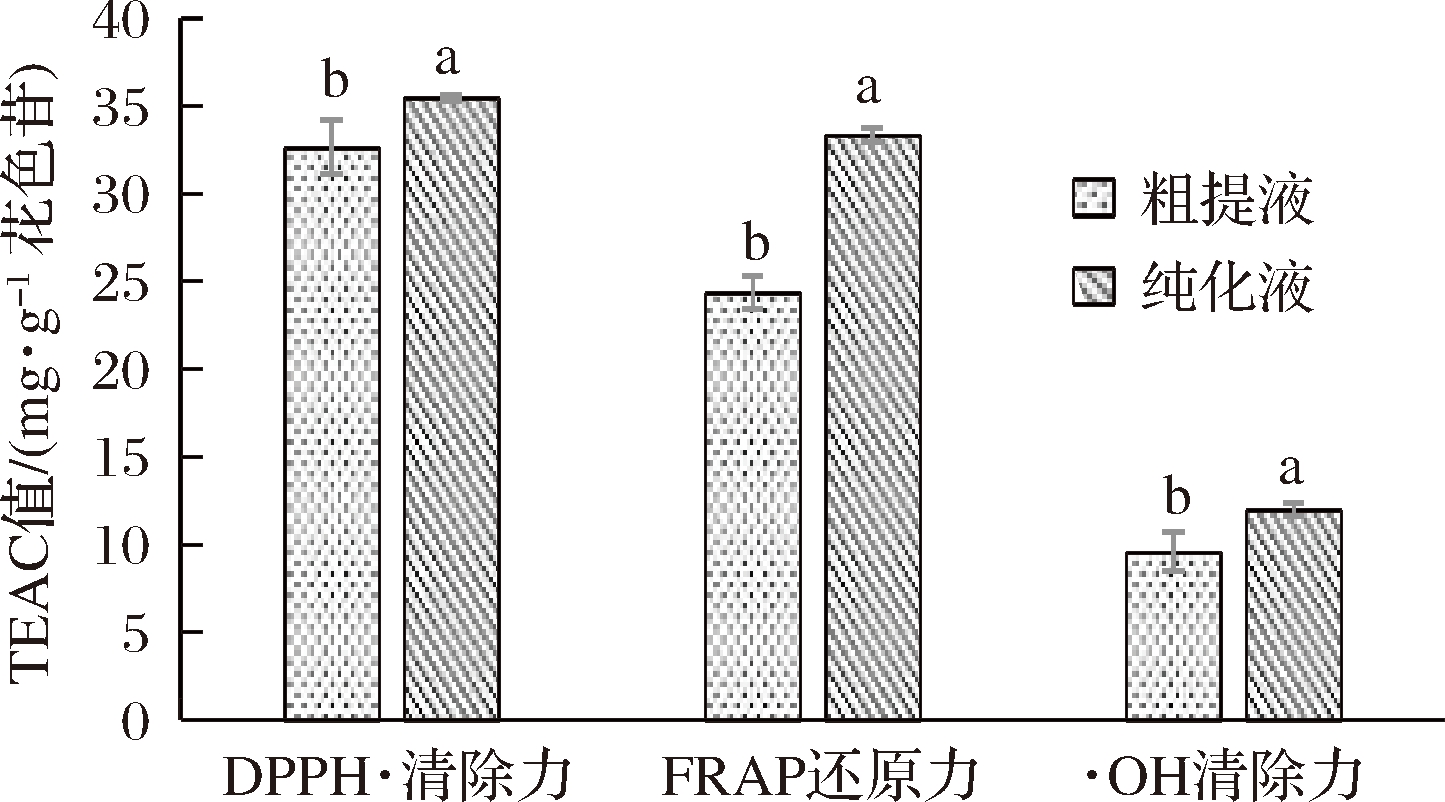
图2 欧李‘农大4号’花色苷粗提液与
纯化液抗氧化能力比较
Fig.2 Compare antioxidant activity of anthocyanins the
crude product and the refined product from the
Chinese dwarf cherry ‘Nongda No 4’
注:不同小写字母表示差异显著。
欧李‘农大4号’花色苷粗提液DPPH·清除力显著高于FRAP还原力和·OH清除力;欧李‘农大4号’花色苷纯化液DPPH·清除力显著高于FRAP还原力和·OH清除力。因此,欧李‘农大4号’花色苷的抗氧化能力从高到低依次是:DPPH·清除力>FRAP还原力>·OH清除力。
2.4 敏感性试验
由图3可知,欧李‘农大4号’花色苷提取液对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌有明显的抑制作用。
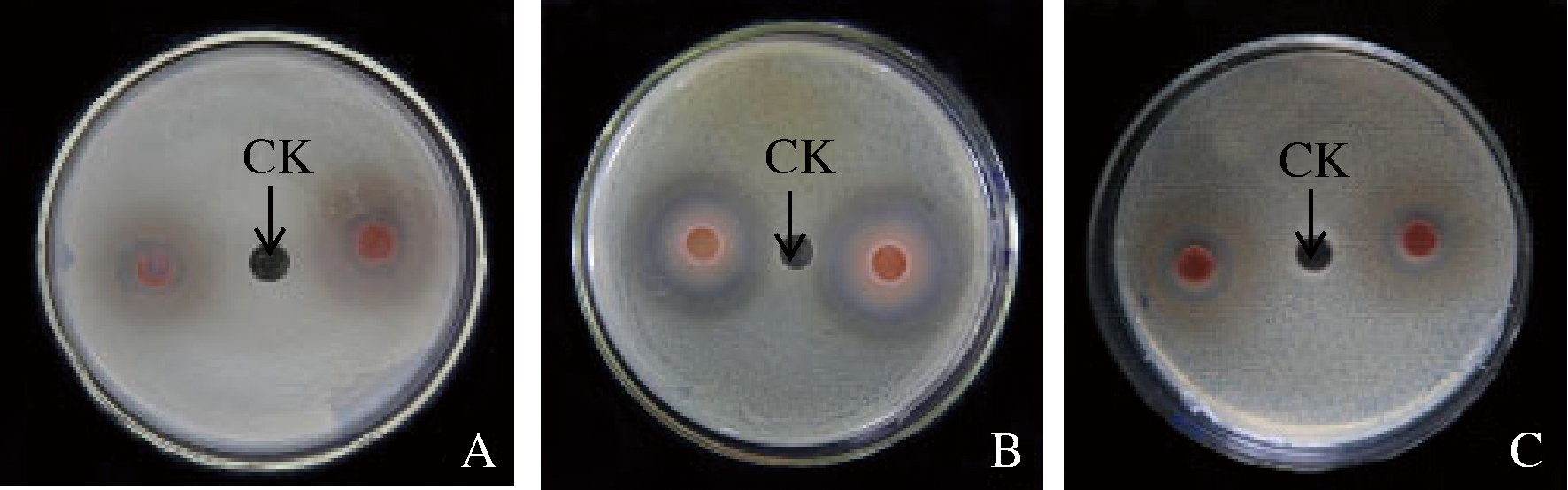
A-大肠杆菌;B-枯草芽孢杆菌;C-金黄色葡萄球菌
图3 欧李‘农大4号’花色苷抑菌效果
Fig.3 Antibacterial effect of anthocyanins from the
Chinese dwarf cherry ‘Nongda No 4’
2.5 最小抑菌浓度(MIC)
由表4可知,对于不同菌种,花色苷对其抑制效果不一样。欧李‘农大4号’花色苷对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌的最低抑菌浓度分别是1 040、520、130 μg/mL。
表4 欧李‘农大4号’花色苷最小抑菌浓度(MIC)测定结果
Table 4 MIC of anthocyanins from the Chinese dwarf
cherry ‘Nongda No 4’ on different microorganisms
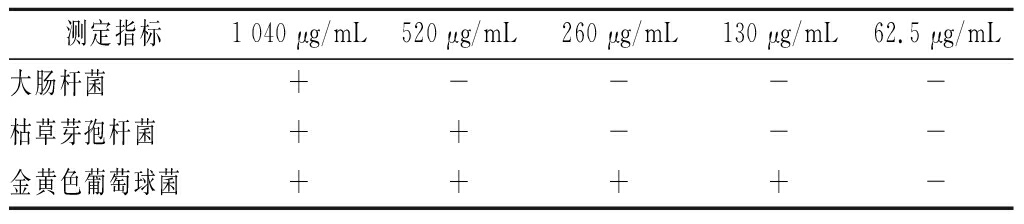
测定指标1 040 μg/mL520 μg/mL260 μg/mL130 μg/mL62.5 μg/mL大肠杆菌+----枯草芽孢杆菌++---金黄色葡萄球菌++++-
注:“+”表示有抑菌圈;“-”表示无抑菌圈。
2.6 高温处理对欧李‘农大4号’花色苷抑菌效果的影响
由图4~图6可知,欧李‘农大4号’花色苷提取液对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌在短时间内抑菌率达到最高,随时间的延长呈下降的趋势,总体呈现先上升后下降的趋势。在相同的作用时间内,欧李‘农大4号’花色苷提取液对60 ℃以上的高温较敏感,在高温下易被破坏,抑菌效果随温度的升高而下降。

图4 高温处理欧李‘农大4号’花色苷对
抑制金黄色葡萄球菌的影响
Fig.4 Inhibitory effect of temperature on anthocyanins from the
Chinese dwarf cherry ‘Nongda No 4’ on Staphlococcus aureus
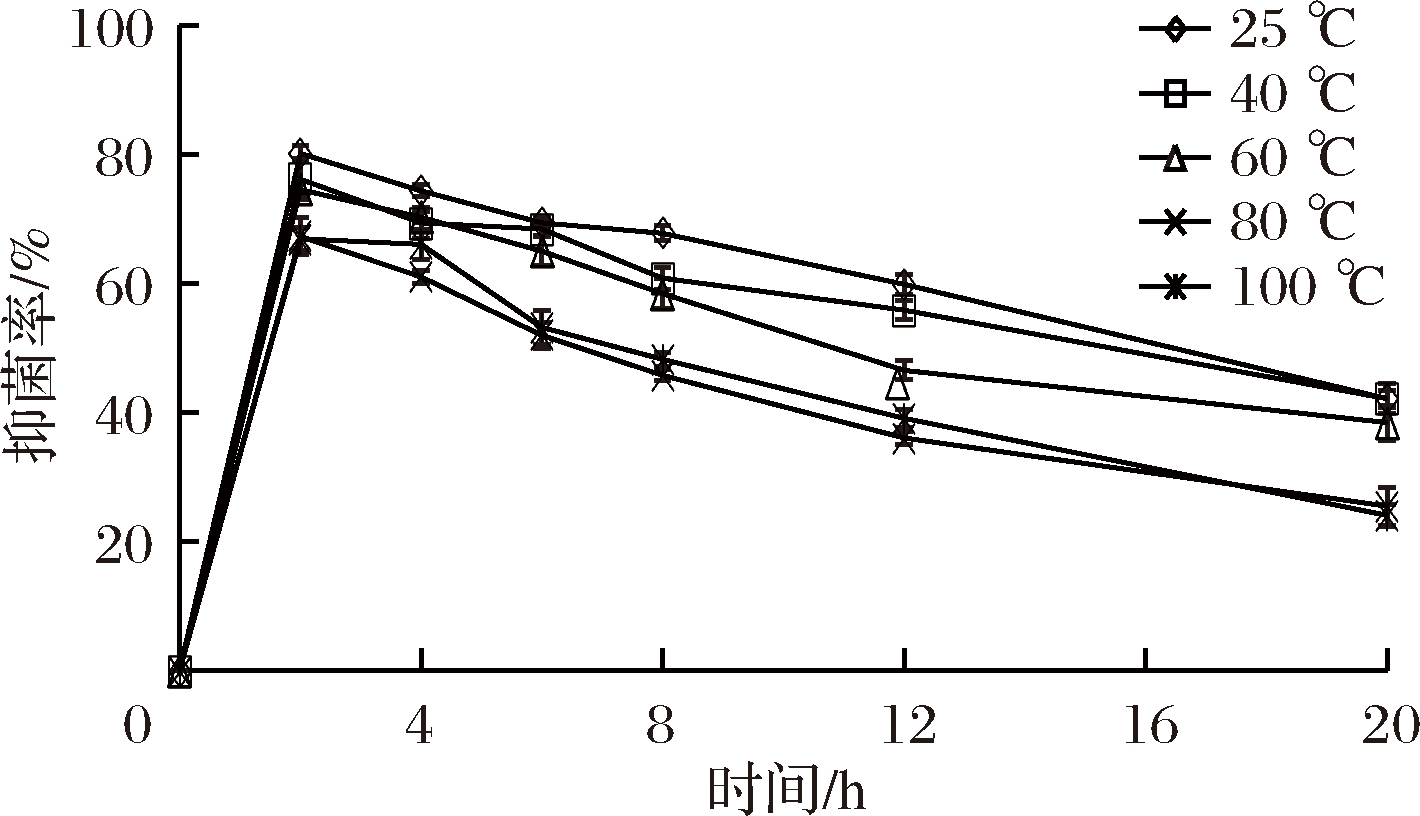
图5 高温处理欧李‘农大4号’花色苷对
抑制枯草芽孢杆菌的影响
Fig.5 Inhibitory effect of temperature on anthocyanins from
the Chinese dwarf cherry ‘Nongda No 4’ on Bacillus subtilis
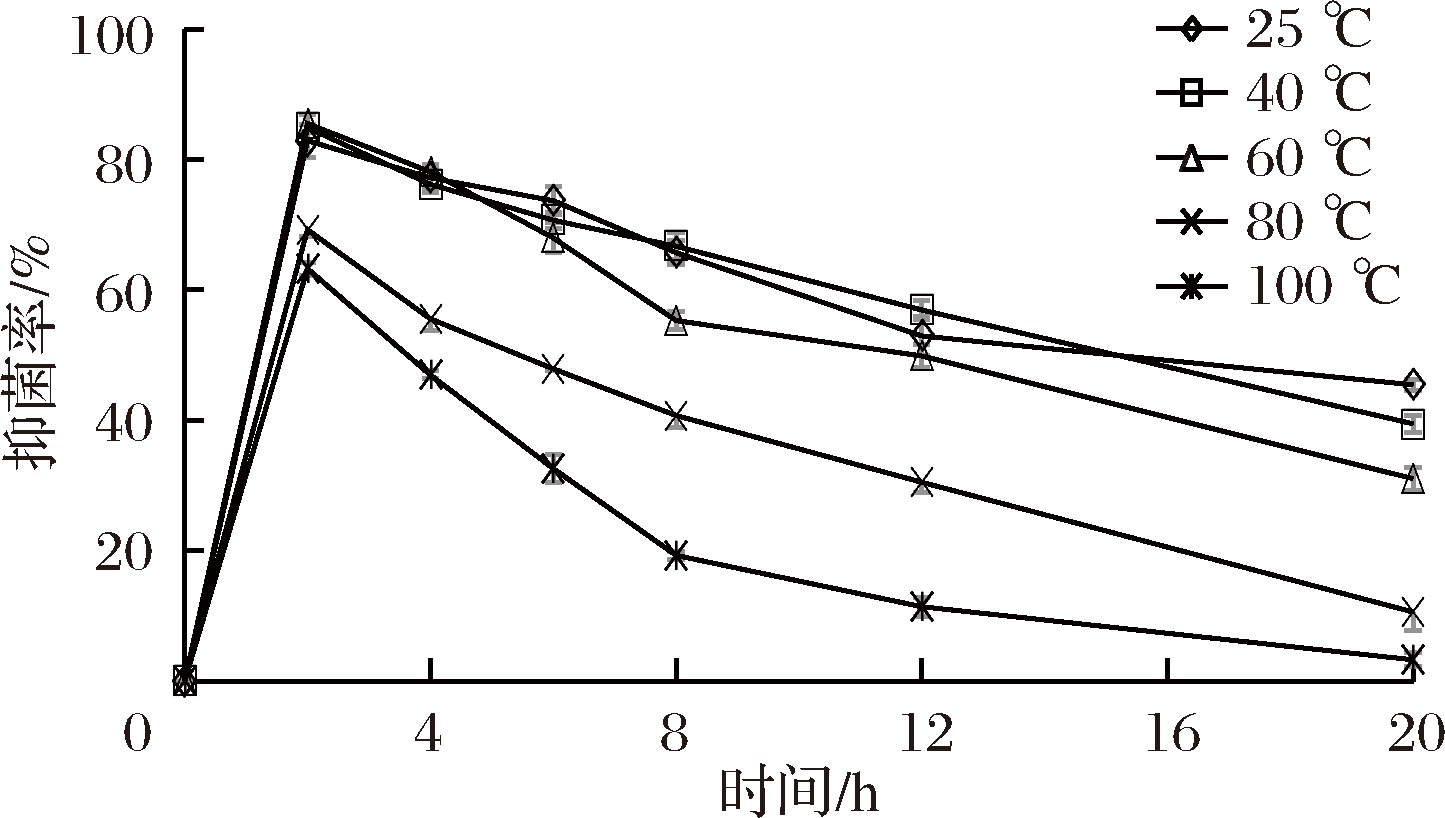
图6 高温处理欧李‘农大4号’花色苷对
大肠杆菌抑制率的影响
Fig.6 Inhibitory effect of temperature on anthocyanins from the
Chinese dwarf cherry ‘Nongda No 4’ on Escherichia.coli
3 讨论
欧李花色苷为水溶性色素,在醇溶液和水溶液中溶解性都比较好,本试验选用酸化乙醇溶剂进行提取。花色苷在酸化条件下较为稳定,因此,提取过程通常采用酸化乙醇溶液。酸化乙醇溶液在破坏植物细胞膜的同时溶解花色苷,可提高花色苷的提取率[11]。大量花色苷提取方法表明,植物花色苷的提取率受乙醇浓度、pH值、料液比、超声时间的影响[12-15]。这与本试验从乙醇体积分数、料液比、pH值、超声时间4个方面确定最优提取工艺一致。
果实中的花色苷除作为天然色素外,还具有很强的抗氧化、清除自由基的能力,是一种具有保健功能的天然生理活性物质。雷月等[16]研究表明,蓝靛果粗制及精制花色苷具有较强的还原能力、清除DPPH·、·OH的能力,且花色苷的精制品的抗氧化能力明显强于粗制品。刘敬华等[17]研究表明,蓝靛果高纯度花色苷在抗氧化性、稳定性方面比精制花色苷更好。张泽生等[18-19]从葡萄皮提取的花青苷能有效清除DPPH·、·OH,尤其对·OH的清除能力强于抗坏血酸。LINDA等[20]检测了12种可食用的果实,发现其中9种果实的半提纯成分表现出高的抗氧化性,在半提纯部分检测到了花青素-3-葡萄糖苷和飞燕草色素-3-葡萄糖苷。本实验对欧李‘农大4号’花色苷粗提液及纯化液进行DPPH·、·OH、FRAP还原力的测定,结果显示纯化液的抗氧化能力性强于粗提液,并且抗氧化能力从高到低依次为DPPH·清除力>FRAP还原力>·OH自由基清除力。
近年来对花色苷的抑菌性有很多研究报道。蒋丽施等[18]对紫薯花色苷抑菌作用的探究表明,紫薯花色苷对伤寒沙门氏菌和福氏志贺氏菌有明显的抑菌效果且高温处理会是紫薯花色苷的抑菌作用减弱。申杰等[21]研究表明杨梅花色苷提取物对灰莓葡萄孢有抑制作用,且55 ℃处理30 min和90 ℃处理15 min 能使花色苷提取物的抑菌率下降。本实验进行了欧李‘农大4号’花色苷提取液对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的抑制效果的研究,结果表明,欧李‘农大4号’花色苷对以上3种菌有较强的抑制效果。经花色苷作用后的Escherichia.coli和Staphylococcusanreus aureus菌体出现质壁分离,细胞质稀薄,菌体解体成空泡、菌体细胞溶解死亡,这表明花色苷能够影响细胞壁的通透性[22]。王关林等[23]对中药抑菌研究中曾报道,皂苷类化合物与蛋白结合成复合物的作用,从而影响了细胞生物膜的通透性。花色苷属苷类物质可能有同样的作用机理。欧李‘农大4号’花色苷对60 ℃以上高温较敏感,抑菌率随温度上升而下降。高温处理可能破坏了花色苷的功能结构,使其抑菌效果降低。
[1] 王华,徐榕,李娜,等.几种小浆果生物活性物质研究进展[J].北方园艺,2011(8):198-203.
[2] 黄爱萍,胡文舜,郑少泉.天然生物活性物质及其功能食品的研究进展[J].南方农业学报,2013,44(3):497-500.
[3] 张元梅,张桂伟,席万鹏.柑桔果实酚类物质及其生物活性研究进展[J].中国南方果树,2015,44(5):135-138.
[4] 梁敏,包怡红.花色苷生物学功能的研究进展[J].天然产物研究与开发,2017,29(10):1 785-1 790.
[5] 杜俊杰,杨怀义.欧李生物学特性的研究[J].山西农业大学学报,1992(4):311-314.
[6] LEE J, DURST R W, WROLSTAD R E.Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: Collaborative study[J]. Journal of AOAC International, 2005, 88(5):1 269-1 278.
[7] 夏锦锦,王睿,祝缘,等.利用AB-8大孔树脂纯化‘黑宝石’李果实花色苷的研究[J].食品工业科技,2017,38(6):266-270;275.
[8] GORINSTEIN S, HARUENKIT R, PARK Y S, et al. Bioactive compounds and antioxidant potential in fresh and dried Jaffa sweeties, a new kind of citrus fruit[J]. Journal of the Scienee of Food and Agriculture, 2004,84(12): 1 459-1 463.
[9] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma (FRAP) as a measure of "antioxidant power":The FRAP assay[J].Analytical biochemistry, 1996, 239(1): 70-76.
[10] 李欧.种质与产地对欧李果实品质及其抗氧化活性的影响[D].北京:北京中医药大学,2013.
[11] 李颖畅.蓝莓花色苷提取纯化及生理功能研究[D].沈阳:沈阳农业大学,2008.
[12] 魏婷,曾永明,何伟,等.超声波辅助提取伊犁薰衣草花色苷工艺及其抗氧化活性研究[J].食品科技,2018,43(12):244-252.
[13] 雷良波,周剑丽,黄叶强,等.蓝莓果渣花色苷提取工艺优化及抗氧化活性比较研究[J].食品工业科技,2018,39(21):178-184.
[14] 郑覃.黑果枸杞花色苷的提取、纯化及活性组分研究[D].天津:天津商业大学,2018.
[15] 管敬喜,文仁德,成果,等.野生毛葡萄皮渣花色苷稳定性研究[J].食品科技,2017,42(12):210-214.
[16] 雷月,黎盛,智红涛,等.粗制及精制蓝靛果花色苷的稳定性和抗氧化性研究[J].食品工业科技,2016,37(2):113-118;124.
[17] 刘敬华,王振宇.精制及高纯度蓝靛果花色苷的抗氧化性及稳定性研究[J].食品工业科技,2013,34(19):87-92.
[18] 蒋丽施,孟晓,杨凡.紫薯花色苷色素抑菌作用的探究[J].中国食品添加剂,2017(3):106-110.
[19] 张泽生,李博轩,王冀.葡萄皮中花色苷的体外抗氧化研究[J].食品研究与开发,2007,28(2):148-151.
[20] EINBOND L S. REYNERTSON K A, LUO X D, et al. Anthocyanin antioxidants from edible fruits[J]. Food Chemistry,2004,84(1):23-28.
[21] 申杰.杨梅落果花色苷的提取、纯化及其抑菌活性研究[D].南京:南京农业大学,2010.
[22] 韩永斌.紫甘薯花色苷色素的抑菌作用研究[J].微生物学通报,2008,35(6):913-917.
[23] 王关林,蒋丹,方宏筠.天南星的抑菌作用及其机理研究[J].畜牧兽医学报,2004,35(3):280-285.