生物发酵是高能耗产业[1-2],在工业生产中,加压蒸汽高温灭菌是发酵液灭菌的主要方式[3-4],节约发酵液灭菌的蒸汽消耗,将对整个生物发酵产业的节能减排起到积极作用[5]。臭氧具有强氧化性,对细菌有极强的氧化作用,可以破坏细菌的细胞壁,导致细菌死亡[6],因此广泛应用于食品、环境和水的消毒[7-8]。但是国内外对臭氧用于发酵液的灭菌研究较少,一方面因为臭氧具有强氧化性,对培养基有机物有较大的破坏作用[9-10],影响发酵效率,另一方面,臭氧在发酵液里的残留会影响发酵的顺利进行[11]。考虑以上两方面因素,本文研究采用蒸汽灭菌培养基有机物,臭氧灭菌发酵液中50%的水,分别灭菌后混合,最终实现节约发酵液灭菌蒸汽的目的。用臭氧灭菌后的培养基进行发酵多糖试验,并进行了10 m3 发酵罐的中试试验验证。最后,计算了该工艺节约的蒸汽量和冷却水用量,为该项技术进一步研究和应用提供基础和依据。
1 材料与方法
1.1 试验材料
产多糖菌种:为自主筛选的芽孢杆菌,现保存于山东省食品发酵工程重点实验室。
种子培养基(g/L):葡萄糖 10、蛋白胨 5、NaCl 2、酵母膏 1,pH自然;发酵培养基(g/L):葡萄糖 35、豆粕粉 6、CaCO3 2,pH 7.5~8.0。
1.2 仪器与设备
XM-K-G50臭氧发生器,南京鑫盟环保科技有限公司、DOZ7600臭氧浓度检测仪检测限(0~10.00 mg/L),精度(±0.01 mg/L),上海诺博环保科技有限公司。
1.3 试验方法
1.3.1 培养基灭菌方法
摇瓶灭菌:按配方配制好培养基,采用臭氧灭菌水发酵摇瓶,加水量减半,在蒸汽灭菌锅中120 ℃灭菌30 min;
发酵罐灭菌:按配方配制好培养基,采用臭氧灭菌水的发酵罐,加水量减半,采用夹套通蒸汽加热到90 ℃,再直接向罐中通入蒸汽,加热到120 ℃,维持30 min。
1.3.2 培养方法
种子培养:接种1环斜面种子到种子培养基,摇床(30±2)℃、180 r/min培养20 h;
摇瓶培养:向灭菌完的培养基中接种种子培养液,接种量10%,接种后(30±2)℃、220 r/min培养66 h;发酵罐培养:向灭菌完的培养基中接种种子培养液,接种量10%,接种后(30±2)℃、通风比0.6、搅拌速度220 r/min培养66 h;
1.3.3 检测方法
臭氧浓度检测:采用臭氧浓度检测仪检测水中臭氧浓度;自来水中菌落总数检测:参照GB 5749—2006《生活饮用水卫生标准》中关于生活饮用水中菌落总数检测方法[12];葡萄糖含量测定:参照GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》中直接滴定法测定发酵液中葡萄糖含量[13]。
1.3.4 多糖得率测定
称取一定量的多糖发酵液,加入1.5倍体积的95%(体积分数)的酒精,充分混合,在4℃放置过夜,使得多糖沉淀,滤出沉淀,再用95%(体积分数)的酒精洗涤沉淀2次。烘干沉淀,得到多糖样品的质量。多糖提取得率计算如公式(1):
多糖提取得率![]()
(1)
1.3.5 臭氧水制备方法
1.3.5.1 实验条件臭氧水制备
实验臭氧水的制备是直接向自来水中通入臭氧气体,通气时气体经过一个曝气头曝气,这样有利于臭氧更好的溶解[14],当水中臭氧浓度达到要求浓度值时,调节臭氧流量,将臭氧在水中质量浓度维持在(设定目标值±0.2)mg/L。
1.3.5.2 中试条件臭氧水制备
中试时制备臭氧水的流程如图1所示,来自发酵车间的无菌空气经过臭氧发生器后转变为含臭氧气体,再经过气液混合器与自来水混合变为臭氧水,再进入到臭氧水罐,当臭氧水罐满时,关闭自来水,打开罐底阀门,进行循环,待罐中水的臭氧质量浓度达到(5±0.2) mg/L时,继续循环灭菌40 min。
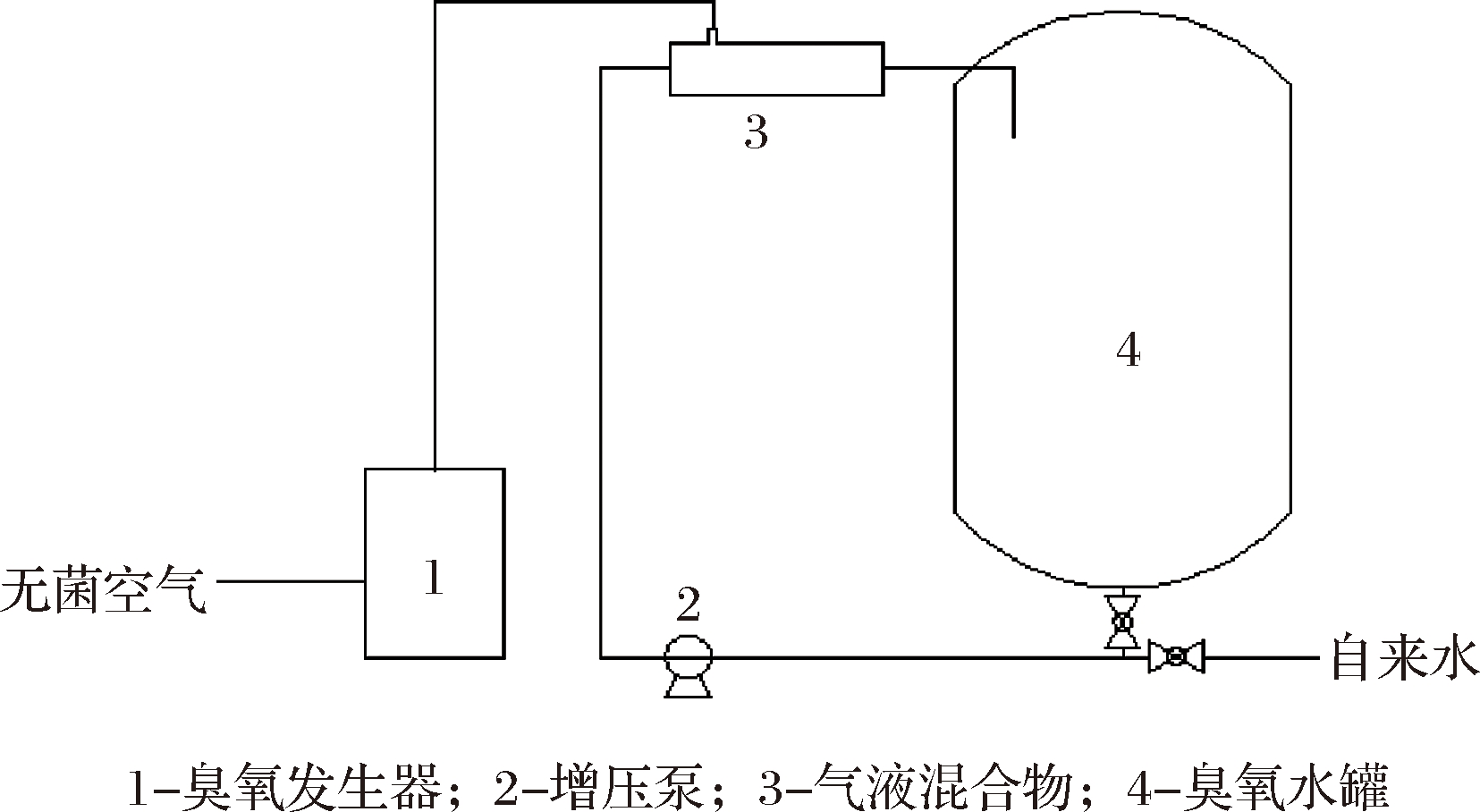
图1 中试制备臭氧水流程图
Fig.1 Flowchart of ozone water preparation in pilot production
1.3.6 臭氧灭菌水用于发酵液方法
按照发酵培养基的配方,配制2倍浓度的培养基,调节pH值到8.5,采用蒸汽灭菌,灭菌结束后将预先使用臭氧灭菌好的臭氧水按照1∶1的体积比趁热加入到培养基中,加入的过程是在无菌的条件下进行。
1.4 发酵罐蒸汽耗量及冷却水量计算
1.4.1 培养基比热
对照培养基含固量w=4.3%,采用臭氧灭菌50%的水,剩余需要实罐消毒的发酵液培养基含固量为8.6%,固形物比热[15]C0=1.55 kJ/(kg·℃),水的比热Cs=4.2 kJ/(kg·℃)。
则对照培养基比热:C=C0×w+Cs(1-w)=1.55×4.3%+4.2×95.7%=4.09 kJ/(kg·℃)。
臭氧培养基比热:C=C0×w+Cs(1-w)=1.55×8.6%+4.2×91.4%=3.97 kJ/(kg·℃)。
1.4.2 间接换热蒸汽耗量S1
蒸汽间接升温发酵液所耗蒸汽量如公式(2):
(2)
式中:S1,间接升温蒸汽用量,kg;G,培养基质量,kg;C,培养基比热,kJ/(kg·℃);t2,间接加热结束时培养基温度,℃;t1,培养基初始温度,℃;r,蒸汽汽化潜热,kJ/kg;f,热损失率,%;
1.4.3 直接蒸汽加热蒸汽耗量S2
蒸汽直接升温发酵液所耗蒸汽量如公式(3):
(3)
式中:S2,直接升温蒸汽用量,kg;t3,培养基灭菌所需温度,℃;I,蒸汽的焓值,kJ/kg;CS,水的比热,kJ/(kg·℃)。
1.4.4 发酵罐保温阶段蒸汽耗量S3
保温阶段蒸汽耗量与发酵罐设计有关,也与工人的操作习惯有关,这部分蒸汽耗量很难准确计算,一般根据经验估算[16],如公式(4):
S3=(30%~50%)×S2
(4)
式中:一般发酵罐容量<5 m3,取50%;发酵罐容量>5 m3,取30%。
1.4.5 发酵灭菌总蒸汽耗量S
发酵罐实罐灭菌总蒸汽耗量计算如公式(5):
S=S1+S2+S3
(5)
1.4.6 冷却水耗量M
降温热量和冷却水量计算如公式(6)、公式(7):
Q=G×C×(t4-t5)
(6)
(7)
式中:Q,降温热量,kJ;M,冷却水耗量,kg;t4,开始通冷却水时发酵液温度,℃;t5,停止通冷却水时发酵液温度,℃;t6,冷却水排水温度,℃;t7,冷却水初始温度,℃。
2 结果与分析
2.1 臭氧浓度与维持时间对灭菌效果的影响
研究了不同臭氧浓度下1 mL自来水中菌落情况,结果如图2所示。当臭氧质量浓度为3、4、5 mg/L时,自来水达到无菌状态所需要的时间分别为120、60和40 min。但是当臭氧质量浓度低于2 mg/L时,臭氧作用时间3 h仍不能保证每个批次处理的自来水都检不出菌落,达不到可以在发酵工业化应用的稳定的无菌状态。从图中可以看出,臭氧浓度越高,自来水达到无菌状态所需时间越短。从工业应用价值与效率来说,选用臭氧4 mg/L以上的质量浓度灭菌自来水具有可行性。

图2 不同浓度臭氧水中菌落数量随时间变化情况
Fig.2 Changes of the amount of colonies in
different ozone concentrations with time
2.2 发酵应用条件下臭氧的残留
臭氧在水中具有自分解特性[17-18],其分解速率随温度和pH值的升高而加快[19-20]。本文实验模拟发酵生产过程中发酵液的pH和温度条件,对100 ℃热水和刚灭菌完100 ℃发酵液按照体积比1∶1加入5 mg/L 臭氧水,混匀后温度降到(60±5)℃,pH降到8.0,此时测定混合液中臭氧浓度。结果显示,臭氧灭菌水与100 ℃热水混合样及发酵液混合样,都未检测到臭氧残留。这可能是在60 ℃、pH 8.0条件下,臭氧分解速度极快,在检测过程中就已经分解。根据张晖等[21]研究的臭氧在水中自分解的动力学方程,在pH 8.0,60 ℃的条件下,5 mg/L 的臭氧水,完全分解仅需要0.53 s,因此,在实验条件下未能检测到发酵液中臭氧残留,符合张晖等的研究结果。综合以上研究结果,臭氧在发酵应用条件下,残留时间极短,对发酵液的影响较小,具有较高的工业应用价值。
2.3 臭氧灭菌后发酵实验
2.3.1 臭氧灭菌水用于摇瓶发酵对发酵结果的影响
臭氧灭菌水配制摇瓶培养基发酵,结果如表1所示。从表中可以看出,采用臭氧灭菌后的发酵液发酵,多糖提取得率与对照组相当,这说明,采用50%的臭氧水作培养基发酵,对发酵水平没有影响。对发酵结束后的发酵液进行镜检,对照组和臭氧实验组都未检测出杂菌,这说明臭氧灭菌自来水的效果较佳,符合发酵的无菌要求。从摇瓶实验结果看,臭氧灭菌发酵液可以应用于该多糖的发酵。
表1 多糖摇瓶发酵情况(n=3)
Table 1 Fermentation of polysaccharide in shake flask
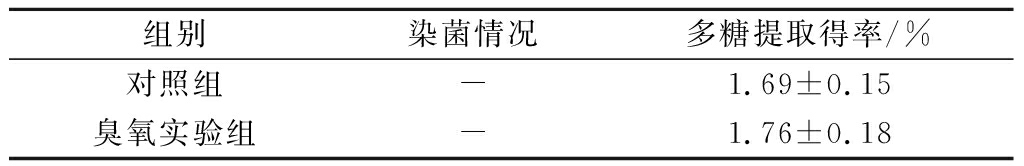
组别染菌情况多糖提取得率/%对照组-1.69±0.15臭氧实验组-1.76±0.18
注:“-”表示发酵结束后,镜检未染杂菌。
2.3.2 臭氧灭菌水用于10 m3发酵罐对发酵的影响
将使用臭氧灭菌完的3.5 m3自来水用无菌压缩空气压入到刚蒸汽灭菌完的培养基中,混匀后发酵液温度降到60℃,检测培养基中臭氧的残留浓度,结果未检测到残留臭氧。发酵液继续降温到(30±2)℃,按培养基体积的10%接种种子液,220 r/min搅拌,通风比0.6的条件下发酵66 h过程中取样并分析参数指标,结果如表2和图3所示。
表2 10 m3发酵罐发酵过程中染菌情况
Table 2 Microbiological contamination during fermentation
in 10 m3 fermentation tanks
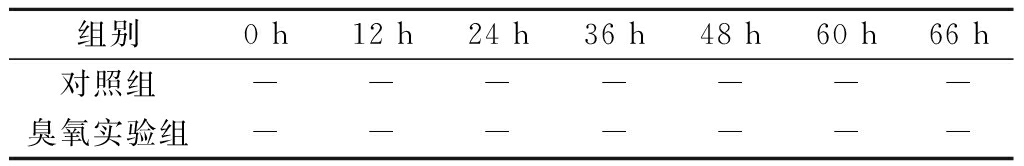
组别0 h12 h24 h36 h48 h60 h66 h对照组-------臭氧实验组-------
注:“-”表示发酵液镜检未染杂菌。
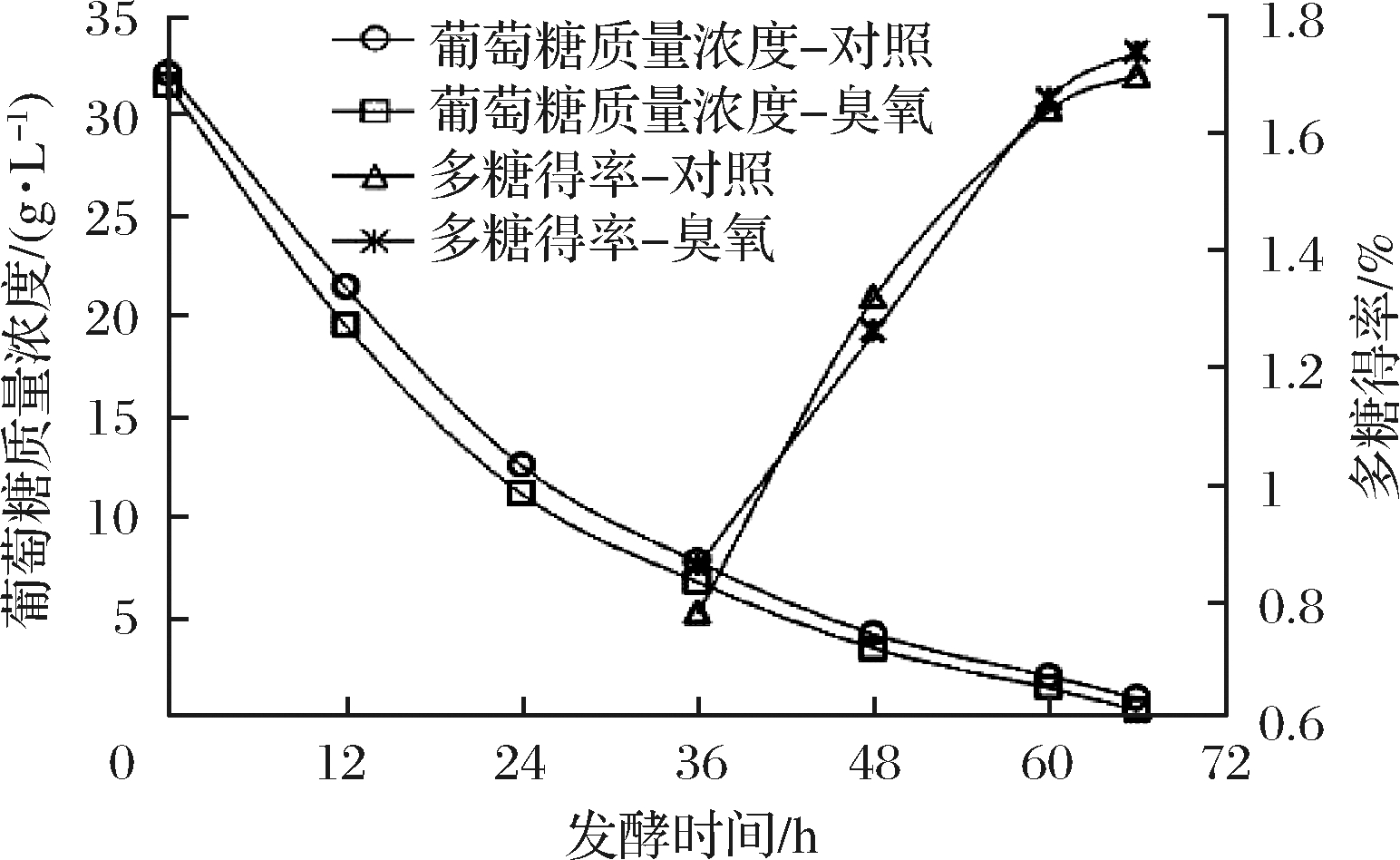
图3 10 m3发酵罐中使用臭氧水发酵多糖的影响
Fig.3 Effect of ozone water on polysaccharide fermentation
in 10 m3 fermentation tank
臭氧实验组与对照组从发酵开始到发酵结束都未发现有杂菌,这说明采用臭氧灭菌发酵液对微生物的灭菌效果能够达到传统蒸汽灭菌效果。此外,与对照试验罐相比,采用臭氧灭菌的发酵液,碳源葡萄糖的变化趋势与对照罐的变化趋势一致,多糖的生成与对照罐相比变化趋势相同,试验罐与对照罐数值的微小差别应该是不同批次发酵过程中的正常差异。从10 m3发酵罐发酵多糖中试的结果来看,采用臭氧灭菌发酵液,对发酵过程与发酵结果都没有影响,利用臭氧灭菌部分发酵液的方案经验证可行。
2.4 10 m3发酵罐采用臭氧灭菌发酵液节约蒸汽和冷却水计算
2.4.1 灭菌蒸汽耗量计算
10 m3发酵罐装发酵液量为7 m3,蒸汽灭菌采用实罐灭菌,灭菌使用蒸汽压力为表压0.2 MPa,臭氧水罐培养基50%水采用臭氧灭菌,其余采用蒸汽实罐灭菌。实罐灭菌分为3个阶段:间接换热升温(20~90 ℃)、直接蒸汽加热(90~120 ℃)、120 ℃保温维持。下面为各个阶段消耗蒸汽计算:
(1)间接换热升温蒸汽耗量
培养基密度取1 070 kg/m3,热损失率一般取5%~15%[9],本文计算取10%。按照公式(2)计算结果如下。
对照罐蒸汽耗量:S1=7×1 070×4.09×(90-20)×(1+0.1)/2 165=1 089.5 kg;
臭氧罐蒸汽耗量:S1’=3.5×1 070×3.97×(90-20)×(1+0.1)/2 165=528.7 kg。
(2)直接蒸汽加热蒸汽耗量
按照公式(3)计算直接加热蒸汽耗量,结果如下。
对照罐蒸汽耗量:S2=7×1 070×4.09×(120-90)×(1+0.1)/(2 726-120×4.2)=455.0 kg;
臭氧罐蒸汽耗量:S2’=3.5×1 070×3.97×(120-90)×(1+0.1)/(2 726-120×4.2)=220.8 kg。
(3)发酵罐保温维持阶段蒸汽耗量
采用10 m3发酵罐灭菌,按照公式(4),经验系数取30%,由于对照和臭氧水罐都是在10 m3发酵罐灭菌,在维持阶段对照罐与臭氧消毒罐消耗的蒸汽相当,以经验值估算S3=30%×S2=136.5 kg。
(4)发酵罐灭菌总耗蒸汽量
按照公式(5)计算发酵液灭菌总蒸汽耗量,结果如下。
对照罐蒸汽总耗量:S=S1+S2+S3=1 681.0 kg;
臭氧罐蒸汽总耗量:S’= S1’+ S2’+ S3=8 8 6.0 kg。
从10 m3发酵罐灭菌蒸汽耗量来看,采用臭氧灭菌50%的水,与实罐灭菌相比,每罐发酵液灭菌可以节约0.2 MPa的蒸汽795 kg,整个发酵液灭菌节约蒸汽比例达到47.3%。
2.4.2 冷却水耗量计算
在生产中,发酵液降温通常在通风情况下自然降到100 ℃,然后通入冷却水降温,本文实验采用臭氧灭菌后的自来水,直接通入降温到100 ℃的发酵液中,最终混合后,培养基温度能够迅速降到60 ℃,可以减少从100 ℃降温到60 ℃的冷却水使用,按照公式(6)、(7),减少冷却水量计算如下:
降温热量Q =7×1 070×4.09×(100-60)=1 225 364 kJ;
冷却水初始温度取20 ℃,在发酵液100 ℃到60 ℃降温段,降温水平均排水温度约70 ℃,则减少冷却水用量为:
根据以上计算,10 m3发酵罐培养基降温,采用臭氧灭菌50%的水加入到发酵罐中,每罐可以减少5 835 kg 冷却水的使用。
3 结论
本文研究了臭氧灭菌水用于发酵液发酵,当臭氧质量浓度为3、4、5 mg/L时,达到无菌状态所需要的时间分别为120、60和40 min。在pH 8.0、60 ℃下,臭氧在水中分解极快,检测不到发酵液中臭氧残留,符合水中臭氧自分解动力学方程。臭氧灭菌好的发酵液发酵结果显示,没有不利影响。10 m3发酵罐灭菌的蒸汽耗量可以节约47.3%,每罐可以减少5 835 kg冷却水的使用。
本文通过对臭氧灭菌水用于发酵研究,发现臭氧灭菌水对发酵未产生不利影响,同时可以大幅度节约灭菌蒸汽和减少冷却水用量。但本文只研究了多糖发酵的影响,对其他发酵产业的应用没有进一步研究,还需要更多的研究结果来验证这项技术在行业中的应用效果。
[1] 陈坚.发酵工程与轻工生物技术的创新任务和发展趋势[J].水产学报,2019,43(1):206-210.
[2] 罗虎,周勇,俞建良,等.我国传统工业生物发酵产业面临的挑战[J].生物产业技术,2016(2):12-17.
[3] 党建章.发酵工艺教程[M].北京:中国轻工业出版社,2016:95-98.
[4] 唐欣昀,张明,赵海泉,等.高压蒸汽灭菌器中温度与压力的关系[J].微生物学通报,2003,30(3):14-17.
[5] 祝学敏.生物发酵工厂灭菌工艺的设计[J].化工设计通讯,2004,30(2):26-28.
[6] 鲁建云,李苗苗,高丽华,等.臭氧水浓度衰减及其杀菌作用[J].中南大学学报(医学版),2018,43(2):143-146.
[7] BIALOSZEWSKI D, BOCIAN E, BUKOWSKA B, et al.Antimicrobial activity of ozonated water[J]. Med Sci Monit, 2010, 16(9): 71-75.
[8] 邹华生,吕雪营.饮用水消毒技术的研究进展[J].工业水处理,2016,36(6):17-21.
[9] 张春燕,蔡静平,巩芳芳,等.不同灭菌预处理方法对低水分调味料带菌状况的影响[J].食品与发酵工业,2006,32(12):91-94.
[10] 石岩昌,杜金锁,陈健,等.臭氧无菌水在黄原胶发酵中的应用[J].食品与发酵工业,2014,40(10):133-136.
[11] 袁亚茹,申哲民,郭卫民.臭氧氧化对有机物降解的构效关系[J].净水技术,2017,36(9):8-13.
[12] GB5749-2006,生活饮用水卫生标准[S].北京:中国标准出版社,2007.
[13] GB5009.7-2016,食品安全国家标准食品中还原糖的测定[S].北京:中国标准出版社,2017.
[14] 何华名,栗亚飞,耿鑫辉,等.不同制备方式臭氧水溶解规律及喷雾特性研究[J].沈阳农业大学学报,2013,44(5):678-682.
[15] 梅进义.发酵罐培养基灭菌能耗计算[J].发酵科技通讯,1999,28(1):32-35.
[16] 陈国豪.生物工程设备[M].北京:化学工业出版社,2007:19.
[17] 钟理,张浩,陈英,等.臭氧在水中的自分解动力学及反应机理[J].华南理工大学学报(自然科学版),2002,30(2):83-86.
[18] 陈英,李艳莉,张浩,等.水中臭氧的分解动力学研究[J].高校化学工程学报,2001,15(5):500-504.
[19] 谭桂霞,陈烨璞,徐晓萍.臭氧在气态和水溶液中的分解规律[J].上海大学学报(自然科学版),2005,11(5):510-512.
[20] 方敏,沈月新,方竞,等.臭氧水稳定性的研究[J].食品科学,2002,23(9):39-43.
[21] 张晖,杨卓如.水中臭氧分解动力学研究[J].环境科学研究,1999,12(1):17-19.