蜈蚣藻属(Grateloupia)隶属于红藻门、杉藻目、海膜科,广泛分布于世界各地沿海地区,一般生长在泥沙滩的碎沙石上或潮间带的石沼中[1],我国南海、黄海及浙江沿海等地区均有分布。不同地方的蜈蚣藻生长周期不同,南方蜈蚣藻生长阶段在1~4月,而北方蜈蚣藻生长阶段主要在6~9月。蜈蚣藻全球报道的约有91多种,我国报道的有42种[2]。蜈蚣藻药食两用,不同品种蜈蚣藻在外形、质地、口感等品质方面差异很大。关于蜈蚣藻的研究从20世纪50年代就开始,但主要围绕在药用方面的化学成分和活性物质开展进行,研究最多的种类是舌状蜈蚣藻和带状蜈蚣藻,研究发现其除含有脂肪酸、氨基酸、蛋白质、多糖等基本营养物质外[3-5],还含有牛磺酸、硫酸盐甾化物、磷酸盐及其他微量元素,从而使得蜈蚣藻具有抗肿瘤[6-7]、抗氧化[8-9]、抗病毒[10-11]等作用。而关于适宜食用的蜈蚣藻的研究较少见诸报道。本课题组从南方诸多蜈蚣藻品种中筛选出披针形蜈蚣藻(Grateloupia lanceolata),对其在不同生长阶段的营养成分进行分析和评价,期望能为南方可食用蜈蚣藻的开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
披针形蜈蚣藻:鲜样于2018年1~4月采集于福建省东山岛蜈蚣藻海域扇贝养殖筏架的绠绳上,鲜样加冰装于泡沫箱中于48 h内运回实验室。采回来的鲜样于60 ℃烘干7 h,粉碎机粉碎,过40目筛,分装于样品袋中,置于4 ℃冰箱中保存备用。
试剂:浓H2SO4、浓HNO3、石油醚、氯仿-甲醇(2∶1)、 14%三氟化硼-甲醇、0.85%生理盐水、NaOH、0.1 mol/L HCl标准溶液、硼酸、正己烷、苯酚等,均为分析纯,HNO3为优级纯。
1.2 仪器与设备
Kjeltec TM 2300型蛋白自动分析仪,丹麦Foss公司;3-550A高分马弗炉,美国Ney VULCAN公司;QP2010Plus气相色谱-质谱联用仪,日本岛津公司;SoxtecTM2050脂肪自动分析仪,丹麦Foss公司;UV3000紫外分光光度计,上海美谱达公司。
1.3 实验方法
1.3.1 常规营养成分测定
水分:按照《GB 5009.3—2010 食品安全国家标准食品中水分的测定》中的方法测定。
灰分:按照《GB 5009.4—2010 食品安全国家标准食品中灰分的测定》中的方法测定。
蛋白质:按照《GB 5009.5—2016 食品安全国家标准食品中蛋白质的测定》中的方法测定。
脂肪:按照《GB 5009.5—2016 食品安全国家标准食品中蛋白质的测定》中的方法测定。
总糖:参考《GB/T 15672—2009 食用菌中总糖含量的测定》中的方法测定。称取样品0.25 g置于 250 mL的锥形瓶中,加入50 mL水和15 mL浓HCl。利用冷凝回流装置,在100 ℃的水浴中加热3 h进行水解,冷却定容至250 mL,置于分光光度计中测其吸光值,根据葡萄糖标准溶液的标准曲线得到最终总糖含量。
1.3.2 无机元素含量测定
参考《SN/T 2208—2008水产品中钠、镁、吕、钙、铬、铁、镍、铜、锌、砷、锶、钼、镉、铅、汞、硒的测定微波消解-电感耦合等离子体-质谱法》中的方法测定。称取样品0.500 g置于聚四氟乙烯消解管中,加入10 mL HNO3,按照微波消解程序消解样品,冷却至室温,将消化液转移至50 mL离心管中,用超纯水清洗消解管2~3次后定容至50 mL。采用电感耦合等离子体质谱法测定Na、Mg、K、Ca、Zn、Cu、Fe、Mn、Se等元素含量。
1.3.3 脂肪酸测定
按照《GB 5009.168—2016 食品安全国家标准食品中脂肪酸的测定》中的方法测定。
1.3.4 氨基酸
按照《GB 5009.124—2016 食品安全国家标准食品中氨基酸的测定》中的方法测定,色氨酸按照《GB/T 18246—2000 饲料中氨基酸的测定》中的方法测定。
1.3.5 氨基酸营养价值评定方法
根据1973年联合国粮农组织(Food and Agriculture Organization,FAO)/世界卫生组织(World Health Organization,WHO)推荐的理想蛋白质模式,提出了鸡蛋蛋白氨基酸评定模式对比分析,氨基酸评分(amino acid score,AAS)、化学评分(chemical score,CS),按公式(1)、(2)、(3)计算:
(1)
(2)
被测样品蛋白质中氨基酸含量(mg/g)=
(3)
1.4 感官评定
参照顾赛麒等[12]和张东等[13]的方法略作修改,主要以披针形蜈蚣藻鲜样的外观、气味、滋味和质地进行评定。评定人员由经过专门培训的10名人员组成,具体评分标准见表1。
表1 感官评分标准
Table 1 Sensory evaluation of grouper

外观气味滋味质地分值色泽明亮,藻体饱满偏大无明显腥味及异味咸味适宜,无苦味,口感适宜藻体结实,咀嚼性好,脆爽度好9~10色泽较明亮,藻体大部分偏大有较淡的腥味,无异味咸味适宜,轻微苦味,口感一般藻体较结实,咀嚼性较好,脆爽度较好7~8色泽正常,藻体大小区别明显有较淡的腥味,有较淡异味咸味较淡,苦味明显,口感不适藻体硬度一般,咀嚼性一般,脆爽度一般5~6色泽较暗淡,藻体大部分偏小有明显的腥味,有较淡异味咸味较重,轻微苦味,口感不宜藻体较软,咀嚼性较差,脆爽度较差3~4色泽暗淡,藻体偏小有明显腥味及异味咸味较重,苦味较重,口感不适藻体很软,咀嚼性较差,脆爽度较差1~2
1.5 数据处理
用SPSS 20.0和Excel软件进行数据分析处理,采用单因素方差分析法(ANOVE,Tukey检验)进行显著性检验,并通过Duncan’s法进行单因素多重比较分析,P<0.05为差异显著。
2 结果与分析
2.1 披针形蜈蚣藻在不同生长阶段的一般营养成分含量分析
测定样品的灰分、蛋白质、脂肪和总糖等一般营养成分含量,披针形蜈蚣藻鲜样的水分含量为91.2%,测定结果以干重计,见表2。由表2可知,披针形蜈蚣藻在不同生长时期,其灰分、蛋白质、脂肪和总糖含量均具有显著性差异(P<0.05)。在1~3月份中,随着生长时间的延长,披针形蜈蚣藻灰分和蛋白质含量均呈显著增加趋势,在3月份达到最高,分别为达到19.47%、23.42%,进入4月份灰分和蛋白质含量均显著下降,分别为15.70%和13.76%;披针形蜈蚣藻中的脂肪含量在1月份含量最低为0.10%,2月份显著增加,为所有月份中最高达到0.47%,随后3、4月份脂肪含量均开始下降,但2、3月份的含量没有显著差异。披针形蜈蚣藻总糖含量是一般营养成分中最高的,1月份达到最高为63.77%,2、3月份逐渐下降分别为53.63%和32.20%,4月份略有回升为45.07%。在1~4月份中,披针形蜈蚣藻中蛋白含量较高,3月份达到最高为23.42%,远高于海带(10.7%)、裙带菜(16.43%)、麒麟菜(3.17%)等食用海藻[14-16],披针形蜈蚣藻灰分含量不低于10%,同时粗脂肪含量均低于1%,是一种高蛋白低脂肪海藻食品。
表2 四个不同月份披针形蜈蚣藻一般营养
成分的含量 单位:%干重
Table 2 The general nutritional components of four
months Grateloupia lanceolata
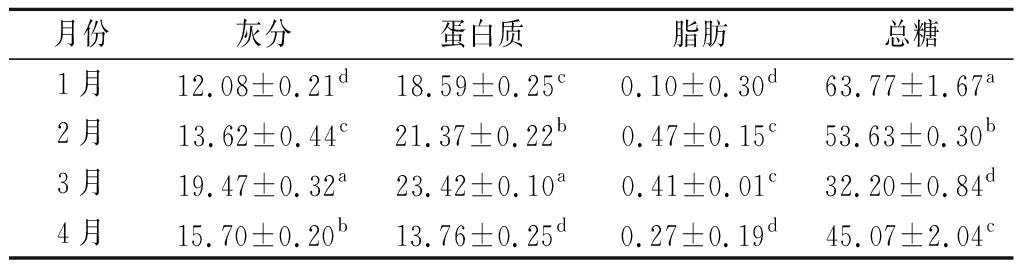
月份灰分蛋白质脂肪总糖1月12.08±0.21d18.59±0.25c0.10±0.30d63.77±1.67a2月13.62±0.44c21.37±0.22b0.47±0.15c53.63±0.30b3月19.47±0.32a23.42±0.10a0.41±0.01c32.20±0.84d4月15.70±0.20b13.76±0.25d0.27±0.19d45.07±2.04c
注:同列数据中含不同字母的两项间具有显著差异(P<0.05)。
2.2 披针形蜈蚣藻中主要无机元素含量
检测了9种矿物质元素含量,包括Na、Ca、K、Mg 4种常量元素和Zn、Cu、Fe、Mn、Se 5种微量元素,结果见表3。由表3可知,披针形蜈蚣藻富含多种无机元素,在1~4月份中,含量最大的4种矿物质均为Na、Mg、K、Ca,而且大小顺序均为Na>Mg>K>Ca。Na、K在人体内主要起到维持体内酸和碱的平衡的作用[17];K、Mg影响细胞的多种生物功能,例如参与能量代谢、蛋白质和核酸的合成,催化酶的激活和抑制等[18-19]。Na、Mg、Ca、Zn、Cu和Mn含量均在2月或3月最高。在1月和2月,Fe的含量要明显高于3月和4月的含量。与其他3个月的蜈蚣藻相比,3月份的披针形蜈蚣藻所含元素含量略高。
表3 不同月份中披针形蜈蚣藻的常量元素和微量元素含量 单位:mg/100g
Table 3 Four months of inorganic salts and trace
elements in Grateloupia lanceolata

元素1月2月3月4月Na50.87±4.4682.02±4.2397.19±3.0251.20±2.14Mg11.20±0.7516.26±0.7514.28±0.5910.44±0.29K14.67±1.2110.83±0.6013.20±0.139.36±0.49Ca0.49±0.040.68±0.030.55±0.020.44±0.01Zn0.17±0.030.22±0.010.11±0.000.09±0.00Cu0.005±0.000.037±0.000.025±0.000.026±0.00Fe0.46±0.030.42±0.010.08±0.000.06±0.00Mn0.03±0.000.03±0.000.01±0.000.01±0.00Se0.000 1±0.000.000 2±0.000.000 2±0.000.000 2±0.00总量77.90110.50125.4571.63
2.3 披针形蜈蚣藻中脂肪酸组成及含量
由表4可见,披针形蜈蚣藻的脂肪酸种类和含量在不同生长时期有较大差异,检测了14种脂肪酸,其中饱和脂肪酸(SFA)5种,单不饱和脂肪酸(MUFA)3种,多不饱和脂肪酸(PUFA)6种。在1~4月份,披针形蜈蚣藻含量最高的3种脂肪酸均为棕榈酸(C16∶0)、油酸(C18∶1)和硬脂酸(C18∶0);其中饱和脂肪酸主要为棕榈酸和硬脂酸,二者之和占总脂肪酸含量的55%以上。棕榈酸的含量在1月份最高,达到60.64%,然后随着月份的增加开始明显下降,在4月份是最低为44.26%。硬脂酸的含量基本没有变化,含量在11.48%~12.44%。
在相同生长阶段,披针形蜈蚣藻3种单不饱和脂肪酸中的含量大小顺序为C18∶1>C16∶1>C15∶1。随着生长时间的延长,C15:1含量逐渐变小,而C16∶1和C18∶1含量则逐渐增加,在4月份含量均达到最高分别为5.33%和12.59%。
在相同的生长阶段,披针形蜈蚣藻的5种多不饱和脂肪酸总含量要高于3种单不饱和脂肪酸总含量。1月份多不饱和脂肪酸总量最低为15.92%,随着生长时间的延长,披针形蜈蚣藻中多不饱和脂肪酸总量呈先上升后下降的趋势,2月份采收的样品中多不饱和脂肪酸总含量最高为26.09%,其中C20∶5含量就达到了达到15.61%。但只有3月份的样品检测出了6种多不饱和脂肪酸,其他3个月份采收的样品中检测出的脂肪酸种类为3~5种。在1~4月份的生长期间,披针形蜈蚣藻中的C20∶1、C20∶5含量逐渐减少,而C17∶4、C21∶4和C22∶6含量则逐渐增加。多不饱和脂肪酸可以降低缺血性心脏病的风险,有助于大脑的健康[20-22],同时促进生长发育,调节人体代谢,在减肥等方面有显著效果[23-24]。
表4 四个不同月份披针形蜈蚣藻的脂肪酸组成和比例 %
Table 4 Fatty acid compositions and relative contents of
four months of Grateloupia lanceolata

脂肪酸组成1月2月3月4月C14∶03.12±0.063.08±1.144.45±0.035.67±0.23C15∶00.41±0.170.22±0.190.48±0.150.59±0.12C16∶060.64±3.0252.26±3.1247.68±2.2444.26±1.12C17∶0--0.32±0.320.57±0.04C18∶011.48±0.0312.44±4.0512.23±3.6711.68±1.01∑SFA75.6268.0165.1662.76C15∶10.73±0.820.32±0.060.14±0.18-C16∶11.31±0.401.37±0.533.89±0.215.33±0.86C18∶16.23±0.014.21±0.268.34±0.0612.59±0.42∑MUFA8.265.912.3717.61C17∶40.95±0.721.35±0.181.84±0.552.02±0.52C18∶21.51±0.430.92±0.030.82±0.061.01±0.02C20∶413.47±4.078.21±0.314.38±0.72-C20∶5(EPA)-15.61±0.3813.45±1.498.55±2.12C21∶4--0.66±0.123.86±0.92C22∶6(DHA)--1.32±0.643.86±0.87∑PUFA15.9226.0922.4719.3
注:∑SFA指饱和脂肪酸总和;∑MUFA指单不饱和脂肪酸总和;∑PUFA指多不饱和脂肪酸总和;-为未检测出此脂肪酸。
2.4 披针形蜈蚣藻中氨基酸组成分析及营养评价分析
由表5可知,17种常见氨基酸在不同生长时期的披针形蜈蚣藻样品中均有检出。
表5 四个月份披针形蜈蚣藻的氨基酸组成和比例 单位:g/100g
Table 5 Amino acid compositions and relative contents of
four months of Grateloupia lanceolata
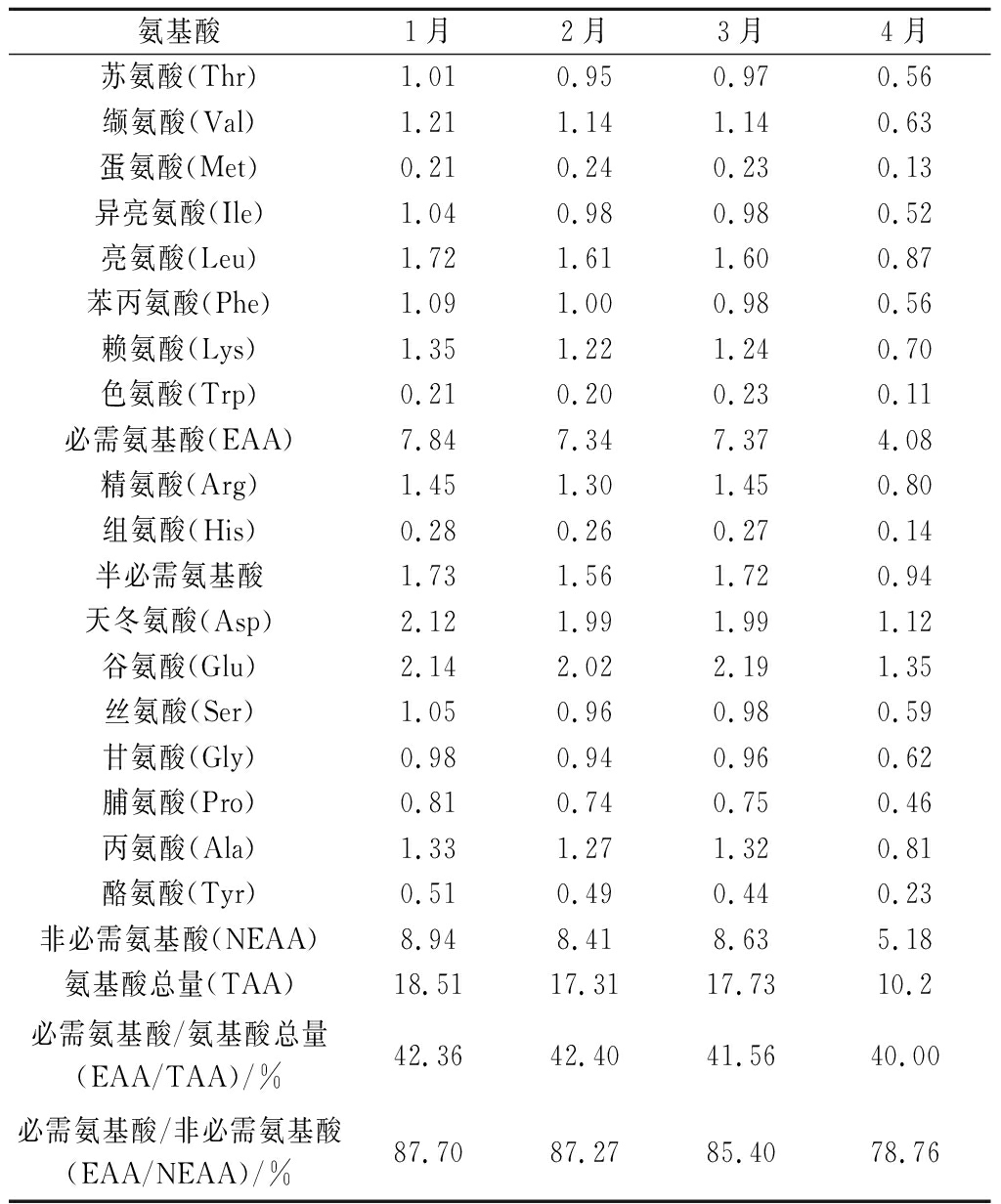
氨基酸1月2月3月4月苏氨酸(Thr)1.010.950.970.56缬氨酸(Val)1.211.141.140.63蛋氨酸(Met)0.210.240.230.13异亮氨酸(Ile)1.040.980.980.52亮氨酸(Leu)1.721.611.600.87苯丙氨酸(Phe)1.091.000.980.56赖氨酸(Lys)1.351.221.240.70色氨酸(Trp)0.210.200.230.11必需氨基酸(EAA)7.847.347.374.08精氨酸(Arg)1.451.301.450.80组氨酸(His)0.280.260.270.14半必需氨基酸1.731.561.720.94天冬氨酸(Asp)2.121.991.991.12谷氨酸(Glu)2.142.022.191.35丝氨酸(Ser)1.050.960.980.59甘氨酸(Gly)0.980.940.960.62脯氨酸(Pro)0.810.740.750.46丙氨酸(Ala)1.331.271.320.81酪氨酸(Tyr)0.510.490.440.23非必需氨基酸(NEAA)8.948.418.635.18氨基酸总量(TAA)18.5117.3117.7310.2必需氨基酸/氨基酸总量(EAA/TAA)/%42.3642.4041.5640.00必需氨基酸/非必需氨基酸(EAA/NEAA)/%87.7087.2785.4078.76
从氨基酸总量上分析,1~3月份采收的样品含量分别是17.31、17.73、18.51 g/100g,三者相差不大,但4月份采样的样品氨基酸总量明显偏低,为10.2 g/100g。17种氨基酸中,必需氨基酸有8种,非必需氨基酸有7种,半必需氨基酸有2种,1~3月份采收的样品中必需氨基酸、非必需氨基酸和半必需氨基酸含量均无明显差异,4月份采收的样品中必需氨基酸、非必需氨基酸含量和半必需氨基酸含量均明显下降。从氨基酸组成来看,在同一生长时期,样品中的氨基酸含量大小顺序基本一致,含量较高的前5种氨基酸依次为:谷氨酸>天冬氨酸>亮氨酸>精氨酸>赖氨酸,含量最低的为色氨酸。披针形蜈蚣藻的呈味氨基酸中鲜味氨基酸(谷氨酸和天冬氨酸)含量为2.47~4.26 g/100g, 甜味类氨基酸(丝氨酸、甘氨酸、丙氨酸和脯氨酸)含量为2.48~4.17 g/100g,其呈味氨基酸占总氨基酸的45.5%~48.5%,因此披针形蜈蚣藻具有甘鲜味浓的良好口感[25-26]。蛋白质氨基酸组成EAA/TAA在40%左右,EAA /NEAA在60%以上时蛋白质的质量较好[27]。1~4月份中的披针形蜈蚣藻的EAA/TAA和EAA/NEAA均超过40%和75%,因此披针形蜈蚣藻适合食用[28]。
为进一步了解东山披针形蜈蚣藻的营养高低,根据1.3.5氨基酸评分准备方法计算AAS和CS,结果见表6。4个月的蜈蚣藻氨基酸组成差异不大,根据AAS评分可知,蛋氨酸的评分均为最低,在0.25~0.37, 为第一限制氨基酸。评分最高为异亮氨酸,最高达到1.32。其次为苏氨酸、苯丙氨酸与酪氨酸和赖氨酸,其中为大部分必需氨基酸的评分均大于1,则高于FAO/WHO理想模式。根据CS评分可知,蛋氨酸的评分最低,3月份最低为0.14,因此蛋氨酸为第一限制氨基酸。综上所述,在披针形蜈蚣藻必需氨基酸营养价值评价中异亮氨酸和苏氨酸分数较高,说明蜈蚣藻可提高人体所需的异亮氨酸和苏氨酸。
表6 不同生长时期蜈蚣藻必需氨基酸组成的评价
Table 6 Evaluation on essential amino acid composition of four months of lanceolata
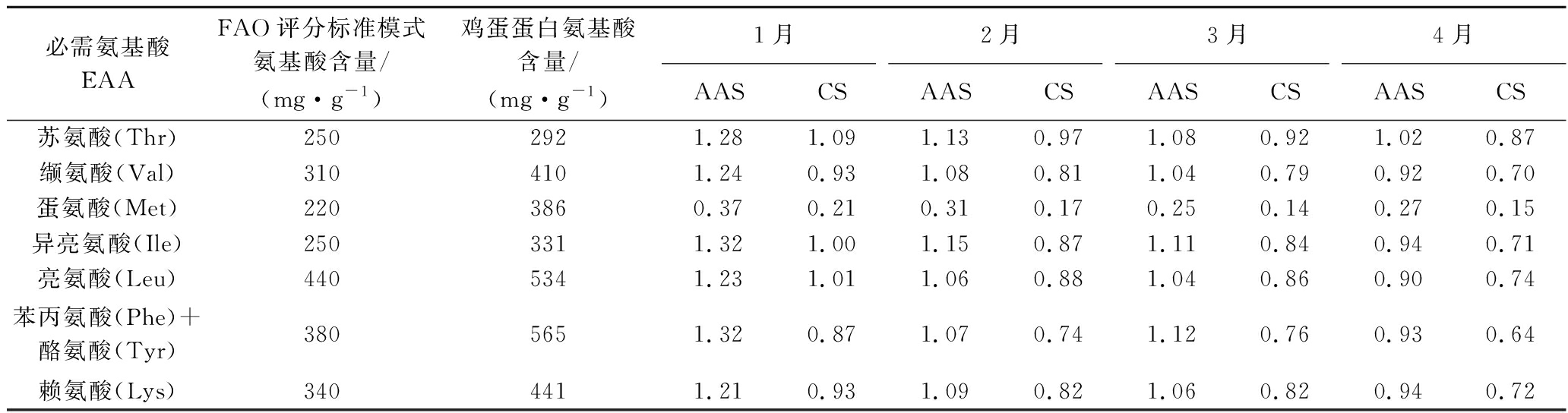
必需氨基酸EAAFAO评分标准模式氨基酸含量/(mg·g-1)鸡蛋蛋白氨基酸含量/(mg·g-1)1月2月3月4月AASCSAASCSAASCSAASCS苏氨酸(Thr)2502921.281.091.130.971.080.921.020.87缬氨酸(Val)3104101.240.931.080.811.040.790.920.70蛋氨酸(Met)2203860.370.210.310.170.250.140.270.15异亮氨酸(Ile)2503311.321.001.150.871.110.840.940.71亮氨酸(Leu)4405341.231.011.060.881.040.860.900.74苯丙氨酸(Phe)+酪氨酸(Tyr)3805651.320.871.070.741.120.760.930.64赖氨酸(Lys)3404411.210.931.090.821.060.820.940.72
2.5 披针形蜈蚣藻感官评分分析
为确保实验准确性,我们的感官评分均在披针形蜈蚣藻采收后第3天进行感官实验,感官评定结果如表7所示。由表7可知,披针形蜈蚣藻的感官评分随着生长期的递增而增加,达到最大值时逐渐下降。3月份的蜈蚣藻感官品质最佳,评分最高达到36.98±0.92,保持固有气味,藻体呈红色,厚度相对较厚,硬度较硬,适口。蜈蚣藻在1~4月份生长过程中,气味和体表均未有太大的变化,而质地和色泽却有明显的差距,1、4月份的蜈蚣藻在质地和色泽方面均达不到较好状态,2月份相比1、4月,蜈蚣藻有较好的质地和色泽。因此3月份的蜈蚣藻更适合食用,制作海洋蔬菜。
表7 4个月披针形蜈蚣藻的感官评定
Table 7 Sensory evaluation of four kinds months of
Grateloupia filicina
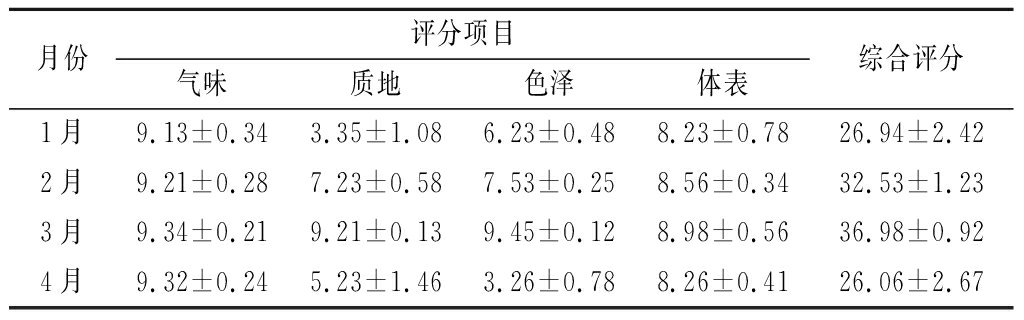
月份评分项目气味质地色泽体表综合评分1月9.13±0.343.35±1.086.23±0.488.23±0.7826.94±2.422月9.21±0.287.23±0.587.53±0.258.56±0.3432.53±1.233月9.34±0.219.21±0.139.45±0.128.98±0.5636.98±0.924月9.32±0.245.23±1.463.26±0.788.26±0.4126.06±2.67
3 结论
披针形蜈蚣藻的一般营养成分随生长时期的不同而发生变化。在1~3月份,其灰分和蛋白质含量随着生长时期的延长而逐渐增加,至4月份时略有下降;而总糖含量在1~3月份显著降低,至4月份时又略有上升;脂肪含量则一直变化不大。在相同生长时期,披针形蜈蚣藻中的总糖含量最高,其次是蛋白质、灰分和脂肪。
在1~3月份,披针形蜈蚣藻的无机元素总量随着生长时间的延长增加,但4月份降至最低。脂肪酸的组成及其相对含量在不同生长时期变化差异较大,其中3月份检测出来的多不饱和脂肪酸种类最多;在相同生长时期,相对含量最高的脂肪酸均是棕榈酸。氨基酸总量在1~3月份差异不大,4月份则明显降低;17种氨基酸中,呈味氨基酸占总氨基酸总量的比例为45.5%~48.5%,EAA/TAA、EAA/NEAA均满足FAO/WHO推荐的理想蛋白质模式。
在1~4月份,披针形蜈蚣藻鲜样的感官评分结果差异较大,其中在3月份采收的鲜样更适合食用,其气味、质地、色泽和体表都达到最佳。
[1] 李颖博, 马家海,孙彬,等. 东海枸杞岛蜈蚣藻属形态学与分子生物学的初步研究[J]. 海洋渔业, 2015,37(3):215-222.
[2] 陈素文, 冯彬,李婷,等. 蜈蚣藻属生物学与养殖研究进展[J]. 南方水产科学, 2019,15(1):119-123.
[3] CHAN P T, MATANJUN P. Chemical composition and physicochemical properties of tropical red seaweed, Gracilaria changii[J]. Food Chemistry, 2017,221:302-310.
[4] 侯萍, 马军,李铭,等. 海藻多糖用于食品涂膜保鲜的研究现状[J]. 热带农业科学, 2016,36(4):82-85.
[5] 李娜, 邓永智,李文权. 蜈蚣藻中萜类化合物的超临界CO2流体萃取及GC-MS分析[J]. 食品科学, 2009,30(12):131-134.
[6] ZHANG C, YANG F, ZHANG X W, et al. Grateloupia longifolia polysaccharide inhibits angiogenesis by downregulating tissue factor expression in HMEC-1 endothelial cells[J]. British Journal of Pharmacology, 2006,148(6):741-751.
[7] 李雅琪, 张朝晖,潘俊芳,等. 蜈蚣藻抗肿瘤活性及其化学成分研究[J]. 中国海洋药物, 2010,29(6):29-33.
[8] JUNG S M, PARK J S, SHIM H J, et al. Antioxidative effect of phycoerythrin derived from Grateloupia filicina on rat primary astrocytes[J]. Biotechnology and Bioprocess Engineering, 2016,21(5):676-682.
[9] ATHUKORALA Y, LEE K, SONG C, et al. Potential antioxidant activity of marine red alga Grateloupia filicina extracts [J]. Journal of Food Lipids, 2010,10(3):251-265.
[10] 张颖, 岑颖洲,黄日明,等. 南海七种海藻多糖的抗病毒活性初步研究[J]. 病毒学报, 2006,22(4):282-285.
[11] 芮雯, 岑颖洲,李药兰,等. 带形蜈蚣藻硫酸多糖的提取、分析及其抗病毒活性[J]. 2006,25(2):12-16.
[12] 顾赛麒, 唐文燕,周洪鑫,等. 响应面法优化海带脱腥工艺及其色泽品质评价[J]. 食品科学, 2018,39(18):217-226.
[13] 张东, 李洪军,王鑫月,等. 食盐添加量对腊肉品质的影响[J]. 食品与发酵工业, 2017,43(11):159-164.
[14] 姚海芹, 王飞久,刘福利,等. 食用海带品系营养成分分析与评价[J]. 食品科学, 2016,37(12):95-98.
[15] 李兴霞, 董淑风,刘禾蔚. 烟台海域裙带菜营养成分分析及评价[J]. 安徽农业科学, 2010,38(33):18 768-18 769.
[16] 戚勃, 李来好,章超桦. 麒麟菜的营养成分分析及评价[J]. 现代食品科技, 2005,21(1):115-117.
[17] 陈俊宇, 王苗苗,韩飞. ICP-OES测定乌苏柳花茶中无机元素含量[J]. 安徽农业科学, 2017,45(16):113-114.
[18] 赵明军. 食用海藻的营养学评价[J]. 水产科学, 1990(1):28-31.
[19] 高新, 李卫娟,李银江,等. 云南省常见青绿饲草营养成分分析评价[J]. 饲料与畜牧, 2017(21):60-64.
[20] BANG H O, DYERBERG J , SINCLAIR H M. The composition of the Eskimo food in north western Greenland[J]. Journal of Chinical Numtrition, 1980,33(12):2 657-2 661.
[21] HOEVENAAR-BLOM M P, NOOYENS A C J, KROMHOUT D, et al. Mediterranean style diet and 12-year incidence of cardiovascular diseases: The EPIC-NL cohort study[J]. Plos One, 2012,7(9):e45458.
[22] 朱怡静, 李琪,张景晓,等. 5种壳色长牡蛎不同组织常规营养成分分析与评价[J]. 中国水产科学, 2018,25(2):354-360.
[23] USYDUS Z, SZLINDER-RICHERT J, ADAMCZYK M. Protein quality and amino acid profiles of fish products available in Poland[J]. Food Chemistry, 2009,112(1):139-145.
[24] SEKI H, TANI Y, ARITA M. Omega-3 PUFA derived anti-inflammatory lipid mediator resolvin E1.[J]. Prostaglandins and other Lipid Mediators, 2009,89(3-4):126-130.
[25] 陈伟洲, 蔡少佳,刘婕,等. 养殖海藻皱紫菜和脆江蓠的主要营养成分分析[J]. 营养学报, 2013,35(6):613-615.
[26] 曹增梅, 王伟伟,曲艳艳,等. 海带“东方7号”氨基酸季节变化分析与评价[J]. 水产科学, 2017,36(2):132-137.
[27] FAO/WHO. Energy and protein requirement. Report of Joint FAO/WHO[R]. Geneva: WHO, 1973.
[28] 刘学勤, 杨帆,郭爱萍. 沙芥腌制过程中护绿工艺研究[J]. 安徽农业科学, 2018(19):167-169.