喹诺酮类兽药是人工合成的广谱性抗菌类抗生素,其吸收效果好、毒性较低,因而被广泛应用于畜禽动物的疾病防治[1-2]。但此类兽药的滥用容易在动物体内残留蓄积,通过食物链进入人体内,形成对其耐药性从而影响相关临床疗效[3]。欧盟、联合国粮农组织等均已指定多种喹诺酮类兽药的最高残留限量[4],我国农业部发布的第235号和2 292号公告也对喹诺酮类兽药的使用做出了明确规定。目前动物性食品中喹诺酮类兽药残留的检测方法主要有高效液相色谱法(high performance liquid chromatography, HPLC)[5-8]和高效液相色谱串联质谱法(high performance liquid chromatography-tandem mass spectrometry, HPLC-MS/MS)[9-10],但复杂基质干扰使得液相色谱法的应用受到限制,同时现行检测方法还存在着前处理复杂、固相萃取耗时、回收率较低等问题。而QuEChERS(quick, easy, cheap, effective, rugged, safe)是一种快速、简单、廉价、高效、可靠和安全的分散固相萃取技术,目前已广泛应用于食品中的农药[11-13] 兽药的残留检测[14-16],但是将该样品前处理方法运用于检测禽蛋中喹诺酮类兽药残留的方法不多。针对以上问题,以市售生鸭蛋为例,本研究建立了一种QuEChERS-超高效液相色谱串联质谱法快速测定禽蛋中恩诺沙星、环丙沙星、氧氟沙星、培氟沙星、诺氟沙星、洛美沙星和沙拉沙星共7种喹诺酮类兽药残留的分析方法。
1 材料与方法
1.1 仪器与试剂
XEVO TQD超高效液相色谱-串联质谱仪,美国Waters公司;ME2002E和XS204电子天平,梅特勒-托利多仪器(上海)有限公司;RKTS-23050快速溶剂蒸发系统,英国Genevac公司;QuEChERS净化剂(含PSA、C18、无水Na2SO4的混合粉末,混合质量比为1∶1∶60),实验室自配。
恩诺沙星(enrofloxacin,纯度99.9%)、盐酸环丙沙星(ciprofloxacin hydrochloride,纯度94.0%)、氧氟沙星(ofloxacin,纯度99.3%)、甲磺酸二水培氟沙星(pefloxacin mesylate dihydrate,纯度99.0%)、诺氟沙星(norfloxacin,纯度99.1%)、盐酸洛美沙星(lomefloxacin hydrochloride,纯度98.7%)、盐酸沙拉沙星(sarafloxacin hydrochloride,纯度91.2%)共7种标准品(均为固体),德国Dr. Ehrenstorfer公司;乙腈和甲酸(均为色谱纯),美国Thermo Fisher Scientific公司;NaCl(分析纯),国药集团化学试剂有限公司;超纯水系统,Millipore公司;禽蛋,来自本实验室日常抽检所用试验样品。
1.2 标准溶液的配制
准确称取适量的恩诺沙星、盐酸环丙沙星、氧氟沙星、甲磺酸二水培氟沙星、诺氟沙星、盐酸洛美沙星和盐酸沙拉沙星标准品,用乙腈配制成质量浓度为100 μg/mL的单一标准储备溶液,必要时可加入少量甲酸超声助溶。将以上各标准储备溶液用体积分数为90%的乙腈稀释,配制成各标准品质量浓度均为1 μg/mL 的混合标准储备溶液。将混合标准储备溶液用初始流动相稀释成4~200 ng/mL的系列标准溶液,称取与试样基质相同的阴性样品,分别加入系列标准溶液各1.0 mL,同1.3项下处理,作为基质加标标准工作溶液。
1.3 样品溶液的制备
称取已均质的禽蛋试样5 g于50 mL离心管中,加入20 mL体积分数为5%的甲酸-乙腈和2 g NaCl,摇匀分散后涡旋提取2 min,以4 000 r/min离心2 min。 取全部上清液向其中加入QuEChERS净化剂5 g,涡旋混匀2 min,以4 000 r/min离心2 min。上清液于45 ℃条件下快速溶剂蒸发至近干,加入初始比例流动相2.0 mL涡旋复溶,过0.22 μm微孔滤膜,滤液待分析。
1.4 色谱及质谱条件
1.4.1 色谱条件
WatersAcquity UPLC超高效液相色谱仪;Waters BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相:A相为体积分数0.1%的甲酸,B相为乙腈;流速0.3 mL/min; 柱温35 ℃;样品池温度10 ℃;进样量5 μL; 梯度洗脱条件见表1。
表1 梯度洗脱程序
Table 1 Gradient elution conditions
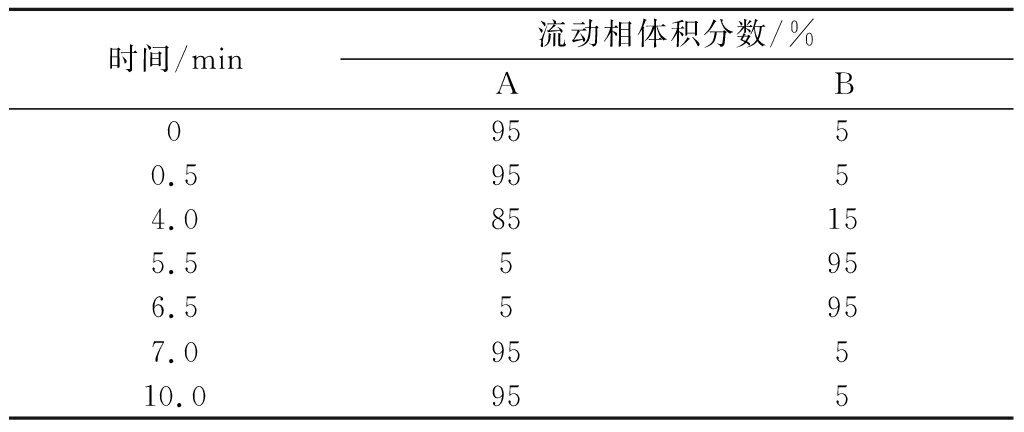
时间/min流动相体积分数/%AB09550.59554.085155.55956.55957.095510.0955
1.4.2 质谱条件
质谱仪选择电喷雾离子源,正离子模式(ESI+),毛细管电压为2.65 kV,脱溶剂气和锥孔气流量分别设定为900和50 L/h,离子源温度和脱溶剂气温度分别为150和350 ℃。在优化的色谱和质谱条件下7种喹诺酮类兽药混合标准溶液(60 ng/mL)的总离子流色谱图如图1所示。
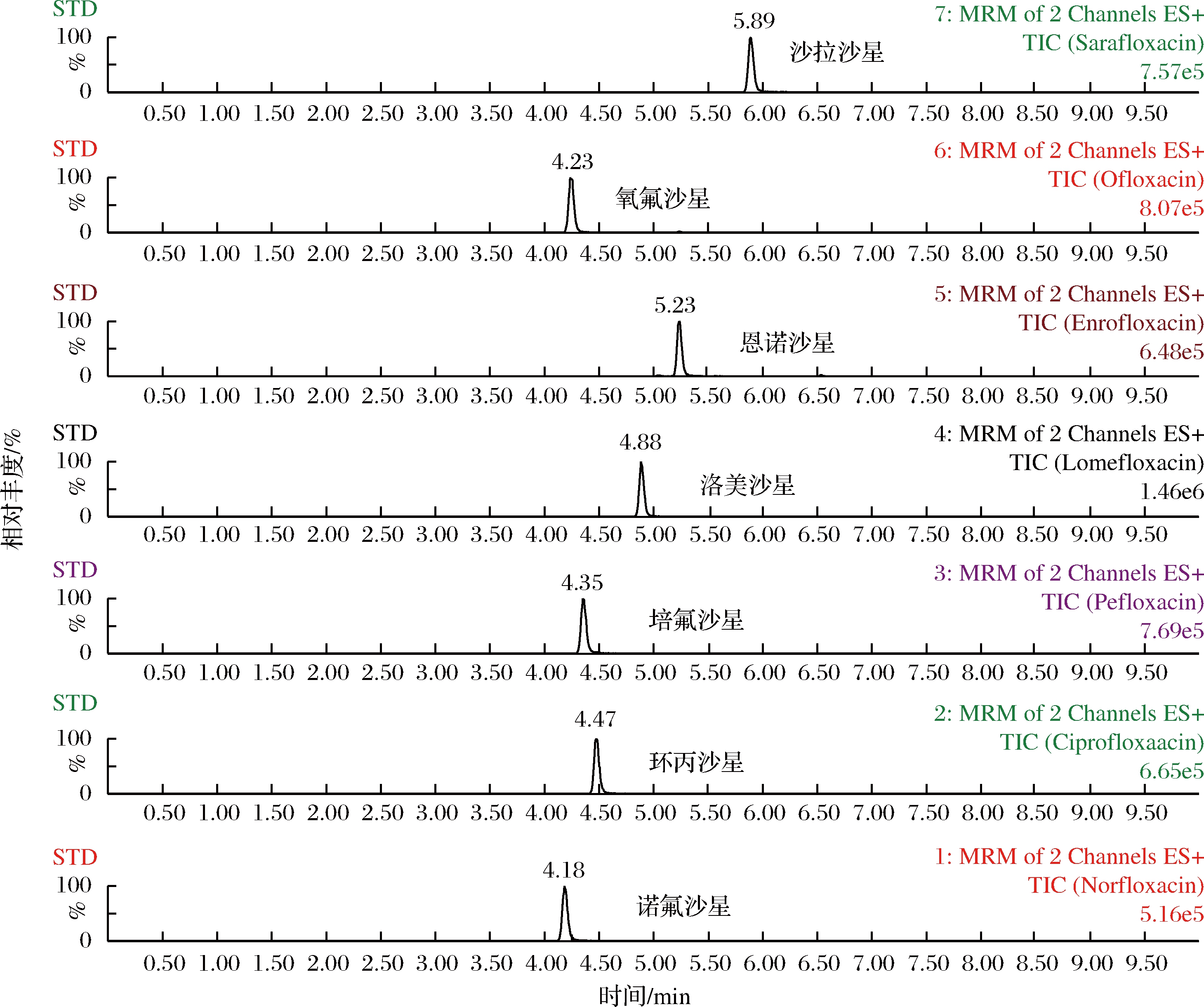
图1 7种喹诺酮类兽药标准溶液的总离子流色谱图
Fig.1 Total ion chromatograms(TIC) for the standard solution of 7 quinolones
2 结果与分析
2.1 色谱和质谱参数的选择
2.1.1 色谱参数的选择
本研究分别考察了乙腈-0.1%三乙胺、乙腈-水、乙腈-0.1%乙酸铵和乙腈-0.1%甲酸(均为体积分数)作为流动相体系对喹诺酮类兽药的分离效果。结果发现乙腈-0.1%三乙胺体系信号响应较低,乙腈-水体系峰型拖尾,而乙腈-0.1%乙酸铵和乙腈-0.1%甲酸2种体系峰型较好,综合分离效果、响应强度、测定时间以及系统稳定性考虑,最终选择非盐体系:乙腈和0.1%的甲酸作为流动相进行梯度洗脱,使得喹诺酮类兽药的峰型尖锐对称、保留时间适宜。
2.1.2 质谱参数的选择
以10 μL/min的针泵流速注入200 ng/mL的7种喹诺酮类兽药混合标准溶液,进行一级质谱扫描,确定较为合适的母离子扫描条件,再对母离子进行二级扫描,筛选信号最强的离子对作为定量离子,信号次强的离子对作为定性离子对,得到多反应监测条件(MRM):定量及定性离子对、锥孔电压和碰撞能量,详见表2。
表2 7种喹诺酮类兽药的质谱分析参数
Table 2 MS conditions for 7 quinolones
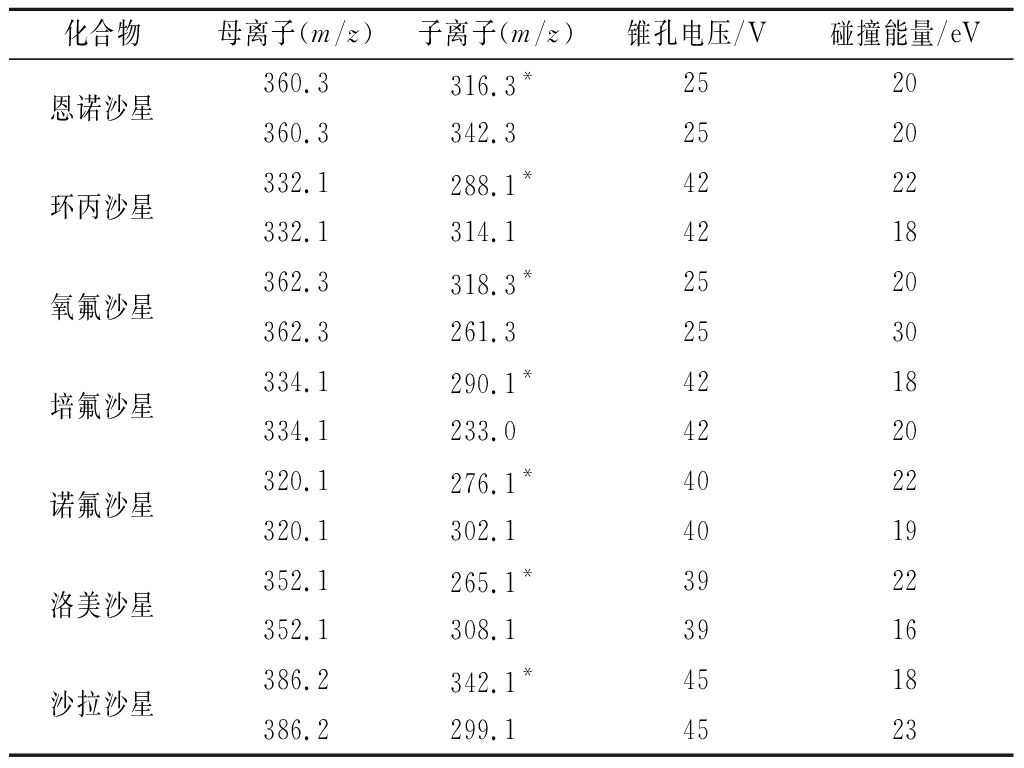
化合物母离子(m/z)子离子(m/z)锥孔电压/V碰撞能量/eV恩诺沙星360.3316.3*2520360.3342.32520环丙沙星332.1288.1*4222332.1314.14218氧氟沙星362.3318.3*2520362.3261.32530培氟沙星334.1290.1*4218334.1233.04220诺氟沙星320.1276.1*4022320.1302.14019洛美沙星352.1265.1*3922352.1308.13916沙拉沙星386.2342.1*4518386.2299.14523
注:*为定量子离子。
2.2 样品前处理条件的选择
大多数样品中喹诺酮类兽药残留都是采用酸化或碱化的溶剂提取,现行国家标准GB/T 20366—2006《动物源产品中喹诺酮类残留量的测定液相色谱-串联质谱法》[17]和GB/T 21312—2007《动物源性食品中14
种喹诺酮兽药残留检测方法液相色谱-质谱/质谱法》[18]分别采用了酸化乙腈和EDTA-Mcllvaine缓冲液(pH=4.0)。有研究表明高比例乙腈的提取液会导致常规固相萃取柱的回收率较低,而EDTA-Mcllvaine缓冲液提取时由于溶液难以澄清而导致堵塞固相萃取柱,2种提取方式均存在不足[19]。本实验选择无需过柱的QuEChERS粉末进行净化处理,分别考察了5%甲酸-乙腈、5%甲酸-水、100%乙腈(均为体积分数)作为提取液进行均质提取的回收率,结果表明沉淀蛋白方面5%甲酸-水效果欠佳,5%甲酸-乙腈与100%乙腈效果相当,而5%甲酸-乙腈提取回收率高于100%乙腈。因此采用5%甲酸-乙腈作为提取液,保证较高回收率的同时可大幅度提高实验效率。
2.3 方法的线性范围、检出限和定量限
按照1.2处理得到质量浓度分别为2、5、10、20、40、60、80、100 ng/mL的基质加标标准工作溶液,按照1.4和2.1项下所确定的色谱和质谱条件进行检测,以基质加标标准工作溶液浓度X对定量离子的峰面积Y绘制各化合物标准曲线,结果表明7种喹诺酮类兽药浓度在2~100 ng/mL线性关系良好,R2均大于0.995,详见表3。以信噪比S/N=3结合空白基质噪音响应确定方法的检出限(LOD)为0.3 μg/kg, 以S/N=10确定方法的定量限(LOQ)为1.0 μg/kg。
表3 线性方程和相关系数
Table 3 Linear equations and coefficients
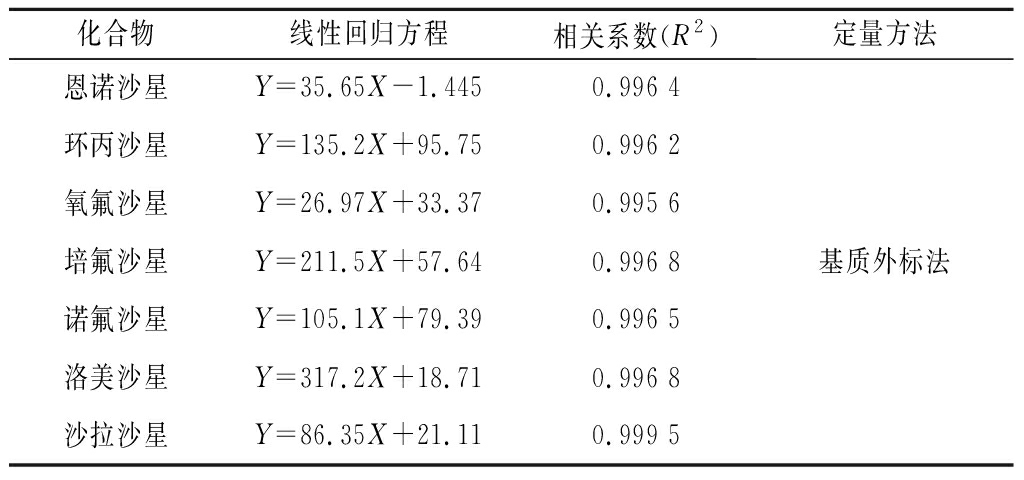
化合物线性回归方程相关系数(R2)定量方法恩诺沙星Y=35.65X-1.4450.996 4环丙沙星Y=135.2X+95.750.996 2氧氟沙星Y=26.97X+33.370.995 6培氟沙星Y=211.5X+57.640.996 8诺氟沙星Y=105.1X+79.390.996 5洛美沙星Y=317.2X+18.710.996 8沙拉沙星Y=86.35X+21.110.999 5基质外标法
2.4 方法的准确度和精密度
为了验证本方法测定禽蛋中7种喹诺酮类兽药残留的可行性和准确性,试验采用空白生鸭蛋基质样品(已检测过的阴性样品)进行加标回收率验证,加标水平分别为2、5、10 μg/kg,按照1.3项下方法处理,每个水平重复6次试验,计算平均回收率和相对标准偏差,见表4。结果表明,平均回收率为77.20%~98.47%,相对标准偏差为1.5%~6.2%,方法的准确度和精密度符合实验室测定需求[20]。
表4 加标回收率和相对标准偏差(n=6)
Table 4 Average recoveries and relative standard deviation
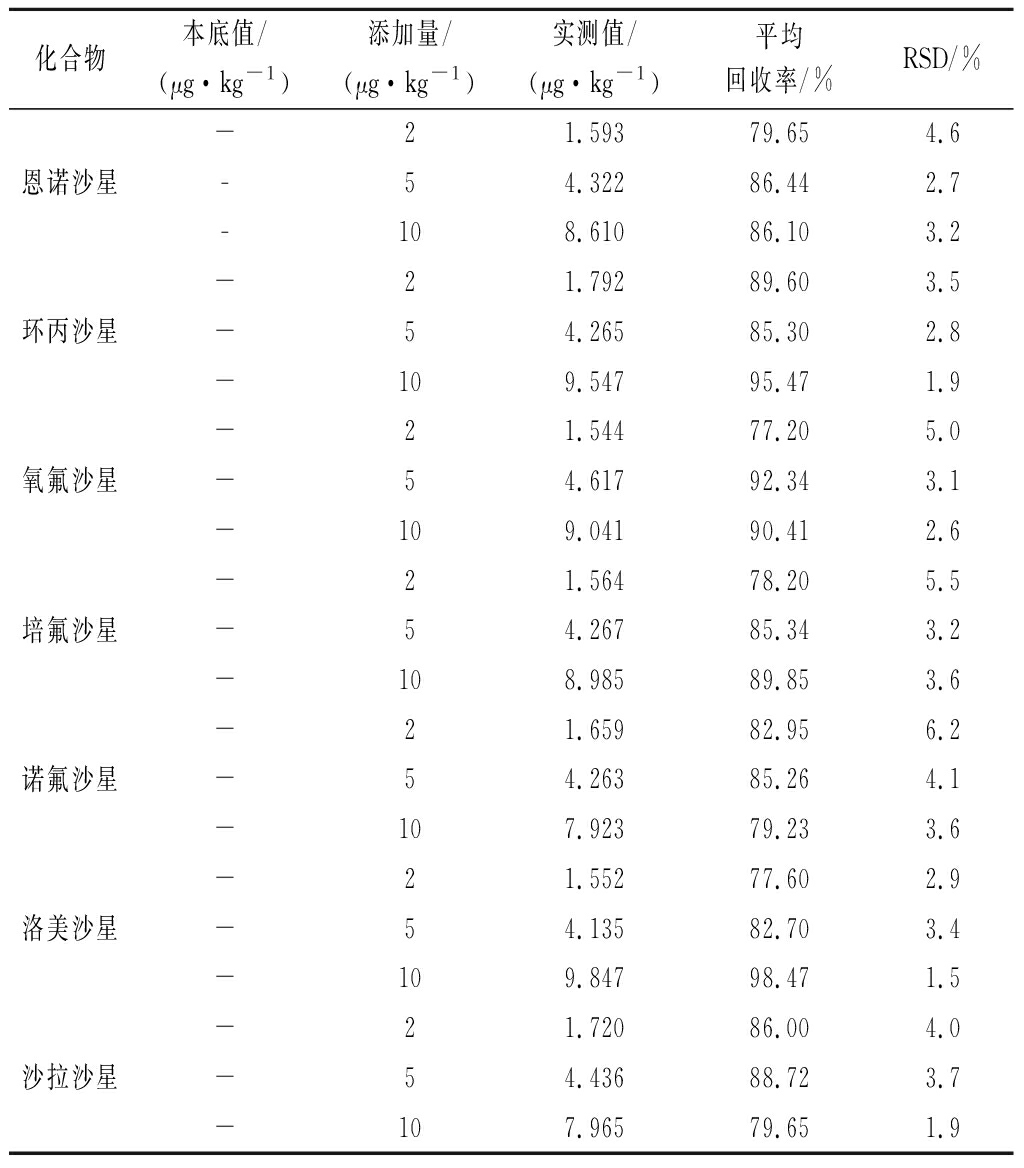
化合物本底值/(μg·kg-1)添加量/(μg·kg-1)实测值/(μg·kg-1)平均回收率/%RSD/%恩诺沙星-21.59379.654.6-54.32286.442.7-108.61086.103.2环丙沙星-21.79289.603.5-54.26585.302.8-109.54795.471.9氧氟沙星-21.54477.205.0-54.61792.343.1-109.04190.412.6培氟沙星-21.56478.205.5-54.26785.343.2-108.98589.853.6诺氟沙星-21.65982.956.2-54.26385.264.1-107.92379.233.6洛美沙星-21.55277.602.9-54.13582.703.4-109.84798.471.5沙拉沙星-21.72086.004.0-54.43688.723.7-107.96579.651.9
注:-为未检出。
2.5 实际样品的测定
按本研究所建立的方法,对实验室抽检的一批80份产地各异的禽蛋样品中喹诺酮类兽药残留进行了检测,结果测得其中1份鸡蛋和1份鸭蛋样品不合格,分别是恩诺沙星(以恩诺沙星与环丙沙星之和计)82.1 μg/kg和氧氟沙星18.6 μg/kg,表明相关养殖行业存在喹诺酮类兽药滥用的风险,对该项目的风险监测与安全评估显得极为重要。同时采用现行国标方法GB/T 20366—2006和GB/T 21312—2007对不合格样品进行复测,测定结果与本方法完全一致。
3 结论
本研究建立了一种快速测定禽蛋中恩诺沙星、环丙沙星、氧氟沙星、培氟沙星、诺氟沙星、洛美沙星、沙拉沙星共7种喹诺酮类兽药残留的QuEChERS-超高效液相色谱串联质谱法,该方法有效解决了样品处理过程中固相萃取柱堵塞与复杂基质干扰等问题,与常规方法相比分析过程快速、简单、回收率好、灵敏度高,满足对禽蛋中喹诺酮类兽药残留测定的限量要求,能够为禽蛋及相关农产品的安全监测及质量控制提供技术支撑。
[1] 李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002:365-390.
[2] HE Xiuting, DENG Maosheng, WANG Qi, et al.Residues and health risk assessment of quinolones and sulfonamides in cultured fish from Pearl River Delta,China[J].Aquaculture,2016,A58(2):38-46.
[3] 张萍.鸡蛋中抗生素类药物残留的研究进度[J].北方药学,2015,12(4):90-92.
[4] HERN NDEZ-ARTESEROS J A, BARBOSA J, COMPA
NDEZ-ARTESEROS J A, BARBOSA J, COMPA
 R, et al. Analysis of quinolone residues in edible animal products[J].Journal of Chromatography A,2002,945(1-2):1-24.
R, et al. Analysis of quinolone residues in edible animal products[J].Journal of Chromatography A,2002,945(1-2):1-24.
[5] 洪波,曾春芳,高峰,等.高效液相色谱-紫外法测定水产品中四环素类、喹诺酮类抗生素残留[J]. 湖南农业科学,2013 (11):81-84.
[6] 占春瑞,温志海,卜延刚,等.禽肉中多种喹诺酮类兽药残留量的高效液相色谱测定研究[J].食品科学,2005,26(10):172-176.
[7] 刘平,李安运,陈星斌,等.同时分离与测定禽血中的五种喹诺酮兽药的高效液相色谱法研究[J].广东化工,2011,38(5):211-212.
[8] YAO Kai, ZHANG Wei, YANG Linyan, et al.Determination of 11 quinolones in bovine milk using immunoaffinity stir bar sorptive microextraction and liquid chromatography with fluorescence detection[J].J Chromatogr B, 2015,1003(10):67-73.
[9] 杨朝琳,黄方取,洪华嫦,等.液相色谱-质谱联用法检测禽蛋中 8种氟喹诺酮类兽药残留[J].浙江师范大学学报(自然科学版), 2016, 39(1):53-59.
[10] 钱卓真,朱世超,魏博娟,等.高效液相色谱-串联质谱法测定水产品中 19 种喹诺酮类兽药残留量[J].中国渔业质量与标准, 2012,2(3):68-76.
[11] 李迎东,侯新港,齐颖慧,等.QuEChERS结合高效液相色谱串联质谱法同时测定马铃薯中的噻虫嗪、氟啶虫酰胺及其代谢物[J].农药,2019,58(3):199-203.
[12] 许秀敏,龙朝阳,黄伟雄,等.QuEChERS-超高效液相色谱-串联质谱法同时快速检测果蔬中35种甲氧基丙烯酸酯类和三唑类杀菌剂的残留量[J].食品安全质量检测学报,2019,10(4):227-235.
[13] 吴南村,刘春华,乐渊,等.QuEChERS-超高压液相色谱-串联质谱法检测黑胡椒中6种农药残留[J].分析试验室,2018,37(12):73-77.
[14] 刘畅.改良QuEChERS/超高效液相色谱-串联质谱法同时检测蔬菜中14种喹诺酮类抗生素残留[J].分析科学学报,2019,35(1):130-134.
[15] 方从容,高洁,王雨昕,等.QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中125种兽药残留[J].色谱, 2018, 36(11):57-69.
[16] 刘艳,汪建明,王敏,等. QuEChERS-HPLC-MS/MS测定猪肉猪肝中苯乙醇胺A[J].中国农业科技导报,2018,20(10):131-137.
[17] 中华人民共和国山东出入境检验检疫局.GB/T 20366 —2006动物源产品中喹诺酮类残留量的测定液相色谱-串联质谱法[S].北京:中国标准出版社,2006.
[18] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 21312—2007动物源性食品中14 种喹诺酮药物残留检测方法液相色谱-质谱/质谱法[S].北京:中国标准出版社,2007.
[19] 廖艳华,周劭桓,林文斯,等.超高效液相色谱-串联质谱法测定禽蛋中11 种喹诺酮类抗生素残留的样品前处理方法优化[J].中国卫生检验杂志,2012,28(8):910-914.
[20] 中国合格评定国家认可中心. GB/T 27404—2008实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.