泡菜是一种起源于中国周朝的传统发酵蔬菜,传承千年,深受各地消费者喜爱。其是利用本土微生物自然发酵而成,受温度、盐度、pH、工艺等因素的影响,呈现出多样化,风味迥异的特点[1]。根据水分的差异,泡菜可以分为湿态发酵泡菜(四川泡菜、东北酸菜等)和半干态发酵泡菜(宜宾芽菜、川/津冬菜等)[2]。由此看出,水分是区分泡菜工艺种类的一个最重要因素,其对泡菜发酵菌群、品质和风味等起着至关重要的作用。
风味是泡菜的灵魂,是评价泡菜品质的重要指标。不同发酵工艺的泡菜风味成分已有一些报道。如湿态发酵泡菜研究中,XIAO等[3]采用GC-MS和GC-O发现泡辣椒含有67种挥发性化合物,结合多重分析发现,主成分为乙酸、2-乙基苯酚、L-芳樟醇、十三烷、丁酸丁酯和3-蒈烯。徐丹萍等[4]研究发现,四川泡萝卜发酵以后主体风味为酯类,酯类主要为1-异硫代氰酸丁酯、异硫氰酸乙酯,相对含量在10%以上。侯晓艳等[5]采用接种发酵和自然发酵对比发现,泡萝卜中挥发性风味物质主要是烯类、酯类和酮类。KANG等[6]和CHA等[7]研究发现,韩国泡菜的主要风味物质为二甲基二硫醚、二甲基三硫醚等含硫化合物。半干态发酵泡菜研究中,YAO等[8]采用GC-MS和电子鼻研究不同腌渍年限冬菜的挥发性成分,结合主成分可以清楚区分冬菜样品。左勇等[9]采用GC-MS结合主成分分析发现影响芽菜的主要风味物质为顺-4-(1-甲基乙基)环己醇、2-十一酮、5-甲基-2-异丙基-3-环已烯-1-酮、对异丙基环己醇等12种。石磊[10]采用GC-MS在自然发酵冬菜中检出较高含量的二甲基二硫醚、二烯基甲基二硫醚、硫茚等含硫类物质。刘大群等[11]使用电子鼻和GC-MS从风脱水和盐脱水萧山萝卜干中检测出58和35种挥发性香气物质,风脱水萝卜干挥发性香气成分种类高于盐脱水萝卜干。
因此,湿态发酵和半干态发酵泡菜风味迥异,而目前少有研究报道两种工艺在相同实验条件下挥发性成分的差异。本研究利用AW的差异模拟传统典型湿态和半干态泡菜,基于GC-MS代谢途径探讨湿态和半干态萝卜泡菜发酵过程中水分活度对风味的影响,确定各主体风味成分及其差异,为泡菜加工和品质调控提供数据支撑。
1 材料与方法
1.1 材料与试剂
新鲜长萝卜、食盐,购于眉山当地农贸市场;MRS培养基,北京奥博星生物技术有限公司;其他均为国产分析纯试剂。
1.2 实验仪器
GC-MSQP2010气相色谱质谱联用仪,日本岛津仪器公司;DB-WAX(60 m×0.25 mm,0.25 μm)色谱柱,美国安捷伦公司;SPME装置(50/30 μm, DVB/CAR/PDMS萃取头)顶空进样瓶(15 mL),美国Supelco公司;HD-3A智能水分活度检测量仪,无锡市华科仪器仪表有限公司;JN-400i无菌均质器,宁波江南仪器厂。
1.3 实验方法
1.3.1 泡菜制作及取样
湿态泡菜(P):将萝卜洗干净晾干切成长宽高为2~4 cm的块状,按菜和灭菌盐水质量比1∶1进行25 ℃发酵,每坛5 L,装满至坛沿处,平衡后加入3%食盐(质量分数),坛沿加水密封,平行2坛。半干态泡菜(Y):将萝卜洗干净晾干切成长6~8 cm,宽 1 cm 的条状,晒干后用水清洗干净后再拧干除去多余水分,装坛发酵,压紧至坛沿处,控制平衡后加入7%食盐(质量分数),坛沿加水密封,恒温25 ℃发酵,每坛2 kg,平行2坛。取发酵0、3、6、10、20、30 d的萝卜固体样品进行分析。
1.3.2 泡菜微生物数量和理化特性变化
将25 g泡菜固体加入到225 g含0.85%(质量分数)NaCl无菌生理盐水的均质袋中,用拍击式均质器拍打2 min,匀浆后进行1∶10梯度稀释,采用倾注法将制成的样品菌悬液接入MRS培养基中,37 ℃培养48 h后选取菌落数在30~300的平板记录菌落数。平行重复3次,取其平均值,以未接菌株的培养基作为空白对照。
1.3.3 总酸和水分活度变化
总酸含量采用酸碱滴定法,含量以乳酸计。取粉碎混匀后的样品约20 g,置于恒重后的康氏皿中,放置于水分活度测试仪器中进行测试,水分活度仪常温下测定30 min结束。
1.3.4 挥发性成分分析
(1)样品处理和检测条件:样品的前处理参照BLEVE等[12]的方法微改,取捣碎后的泡菜样品2 g于15 mL顶空进样瓶中,加入2 g NaCl混匀后密封置于40℃恒温槽中水浴加热平衡30 min,将老化后的SPME萃取头插入到顶空进样瓶中吸附30 min,然后拔出萃取头插入到GC-MS气相色谱进样口,于250 ℃条件下解析5 min,每个样品平行2次。GC条件:不分流进样模式;进样温度:40 ℃;进样口温度:250 ℃;总流量:50 mL/min;进样时间:1 min;控制流量方式:线速度;载气:He;载气流量:1.2 mL/min。柱温程序升温参考TRIPATHI等[13]和汪冬冬等[14]的方法并作优化:40℃(0 min)以16 ℃/min到75 ℃(保持0 min),以2 ℃/min到94 ℃(保持1 min),以2 ℃/min到110 ℃(保持1 min),以3 ℃/min到122 ℃(保持1 min), 以2 ℃/min到130 ℃(保持1 min),以2 ℃/min到136 ℃(保持1 min),以2 ℃/min到143 ℃(保持1 min),以6 ℃/min到200 ℃(保持5 min)。MS条件:电子离子源(EI),电子能量70 eV,离子源温度:230 ℃;接口温度:250 ℃;检测器电压:0.1 kV;Scan采集方式,扫描质量范围:m/z 35.00~350.00 amu。
(2)定性和定量分析:由GC-MS得到的谱图,经计算机在(NIST.11 library)标准谱库进行检索匹配,选取相似度(SI)>80(最大值为100)的物质进行分析。并结合已发表的文献报道,确定出挥发性风味成分。采用气相色谱峰面积归一化法定量确定出不同泡菜样品中各化合物的相对含量。
1.3.5 数据处理和多元分析
本研究通过Excel 2007软件进行实验数据的汇总处理,总离子强度数据和特征挥发性成分变化数据导入Origin 9.1中作图分析。将同时在3个以上萝卜泡菜样品中均检测到的挥发性成分导入SIMCA 14.1统计软件中进行主成分、层次聚类和偏最小二乘法判别分析方法[15]。层次聚类(hierchical clutering,HCA)按照样本数大小分类,使用离差平方和算法。主成分分析(principal component analysis,PCA)图中椭圆为Hotelling的T2区域,表示建模变异的95%置信区间。PCA模型的质量由R2(数据的方差)和Q2值(模型的预测)表示。进行200 次迭代置换测试以避免模型过度拟合,得到偏最小二乘法判别分析(partial least squanres disscrimination analysis,PLS-DA)模型后,分析变量重要性得分值(variable importance)> 1.2且P <0.05的具有可变重要性的峰,这些物质被认为是造成差异的原因。
2 结果与分析
2.1 微生物数量和理化特性变化
图1-A所示,湿态泡菜在发酵过程中,AW相对稳定,处于0.98附近,半干态泡菜AW整体为0.81~0.84,在发酵3 d处有一定波动。BEUCHAT [16]认为AW决定微生物生长所需要水的下限值,大多数细菌在水分活度0.91以下停止生长,大多数霉菌在水分活度0.8 以下停止生长。因此,湿态发酵泡菜可能更有利于微生物的生长,这对泡菜挥发性成分有一定影响。
酸度是泡菜重要的理化参数,不仅显示泡菜品质,而且还显示泡菜微生物生长情况[17-18]。水分影响泡菜乳酸菌代谢产物的生成,导致不同水分下泡菜总酸不同。湿态和半干态泡菜总酸含量变化如图1-B,随着发酵的进行,湿态泡菜总酸含量呈先上升后下降的趋势。一般认为,当泡菜酸度升高到0.30 g/100 g,泡菜就基本成熟[17],说明湿态泡菜发酵6 d接近成熟,发酵20 d时酸度达到0.66 g/100 g。发酵后期总酸逐渐下降,这可能与乳酸菌数量降低和乳酸被其他微生物利用有关。半干态泡菜的总酸含量呈现缓慢上升至稳定的趋势,含量远高于湿态泡菜,这可能是原料经过脱水,原料中的有机酸出现富集的原因。
泡菜发酵过程中伴随着微生物不断演替和数量变化,来自环境的微生物附着在蔬菜表面,发酵过程中利用蔬菜营养物质迅速繁殖。泡菜发酵主要是细菌中乳酸菌主导发酵,乳酸菌数量的变化反映泡菜发酵的程度[19]。湿态和半干态发酵泡菜乳酸菌数量变化如图1-C,湿态发酵泡菜乳酸菌数量呈现先上升后降低的趋势,发酵初期乳酸菌快速生长,发酵到3 d时达到峰值1.5×107 CFU/g,发酵10 d时开始下降,这与发酵后期整体环境酸度高、营养物质被大量消耗有关。半干态发酵泡菜乳酸菌数量呈下降的趋势,表明低AW有利于抑制微生物生长,防止食品腐败。这也清晰地说明湿态相比半干态泡菜更利于乳酸菌生长。
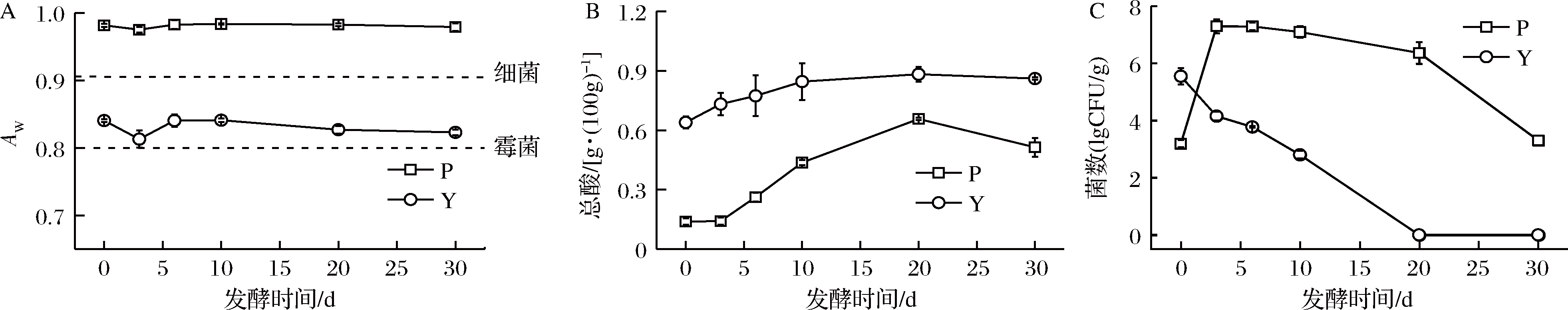
A-AW;B-总酸;C-乳酸菌数量
图1 泡菜发酵过程中AW、总酸和乳酸菌数量动态变化
Fig.1 Dynamic changes of AW, total acid and lactic acid bacteria in paocai fermentation process
注:P,湿态泡菜发酵,Y,半干态泡菜发酵。下同。
2.2 发酵过程中挥发性成分
基于GC-MS代谢途径分析湿态和半干态发酵泡菜中挥发性成分,得到总离子色谱图,如图2。湿态泡菜和半干态泡菜离子强度大的物质出峰时间类似,但强度差异较大,表明有共同挥发性物质,但含量存在差异。湿态泡菜原料在50 min附近的离子强度随着发酵进行逐渐减弱;而半干态发酵泡菜在20 min附近的离子强度随着发酵进行逐渐增强。说明水分的差异影响了初始风味成分,且差异性明显,随着发酵的进行,特征性风味物质逐渐累积或被降解。
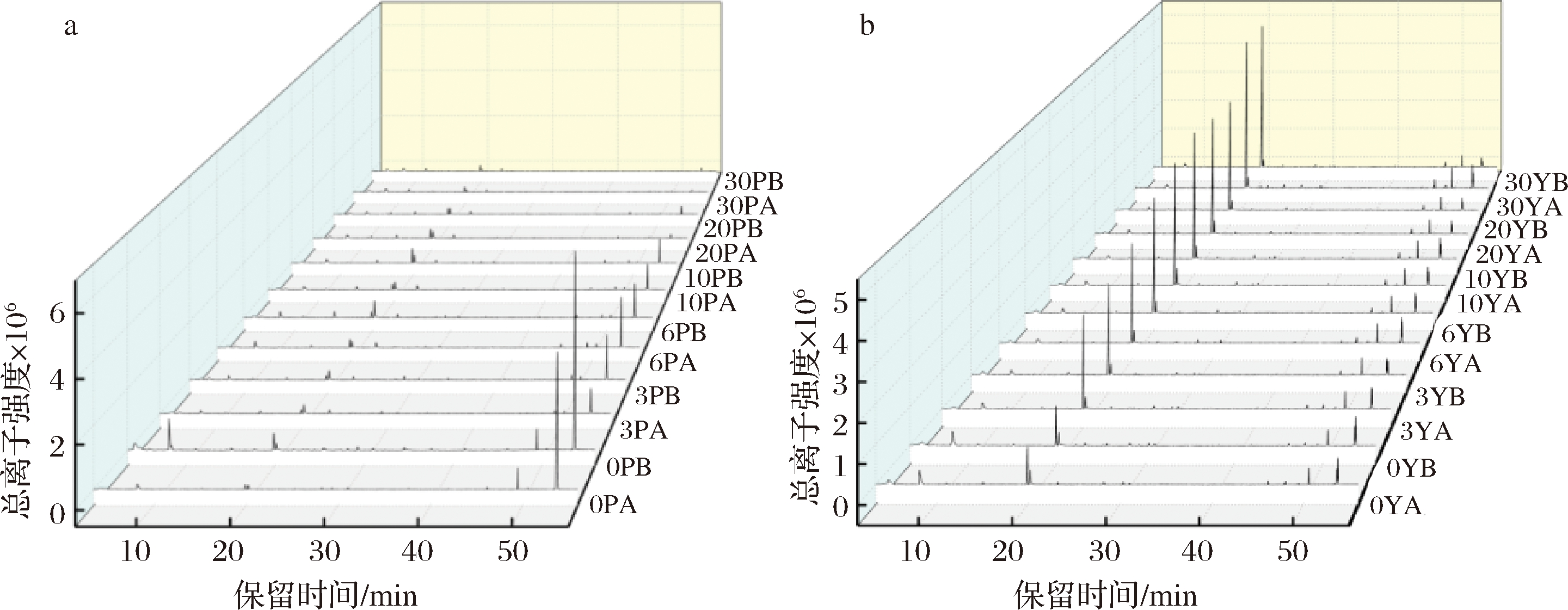
a-湿态泡菜;b-半干态泡菜
0P、3P、6P、10P、30P为湿态发酵0、3、6、10、30 d;0Y、3Y、6Y、10Y、30Y为半干态发酵0、3、6、10、30 d(A、B为平行样)
图2 泡菜挥发性成分GC-MS总离子色谱图
Fig.2 GC-MS total ion chromatogram of volatile components in paocai
通过GC-MS得到湿态和半干态发酵30 d挥发性成分共48 种,其中湿态发酵泡菜41 种,半干态发酵泡菜33 种,结果如表1。这些挥发性化合物中包括含硫化合物(13 种)、酸类(6种)、醇类(11 种)、烃类(8种)、醛类(4种)、酮类(2种)和其他类化合物(4种)。湿态发酵泡菜主要为含硫化合物和醇类,
表1 湿态和半干态泡菜发酵过程中挥发性风味成分
Table 1 Volatile flavor components in the fermentation process of wet and semi-drypaocai

编号挥发性化合物相对峰面积(平均值±标准偏差)0 P3 P6 P10 P20 P30 P0 Y3 Y6 Y10 Y20 Y30 Y含硫化合物A1甲硫醇9.44±5.3-----------A2异硫脲硫酸甲酯-0.83±0.45--0.81±0.33.21±0.83------A3二甲基二硫醚16.98±2.9813.03±0.2417.14±3.2714.38±5.9117.83±0.0426.08±3.1822.17±2.610.65±1.354.96±1.774.73±0.114.52±0.923.73±0.19A4硫氰酸甲酯0.82±0.26-----------A5二甲基三硫醚7.33±2.548.22±1.9211.97±4.4620.89±11.5216.78±2.117.02±3.3324.53±0.6951.65±1.9360.98±3.4667.52±0.6873.19±3.6476.43±7.8A6异硫氰酸戊酯0.24±0.34--0.2±0.29--------A71-异硫氰酸戊酯------0.21±0.030.26±0.050.27±0.040.21±00.16±0.050.14±0.11A84-异硫代氰酸甲基戊酯1.2±0.43-0.96±0.721.42±0.760.38±0.17-1.27±0.032.32±1.271.53±0.491.41±0.161.2±0.120.85±0.2A91-异硫代氰酸丁酯1.58±0.491.72±0.351.86±0.191.9±0.920.6±0.11-0.83±0.010.81±0.171.01±0.360.93±0.060.75±0.020.54±0.19A105-甲硫基戊腈-0.35±0.120.37±0.220.34±0.010.17±0.030.33±0.190.59±00.59±00.59±0.070.53±0.030.55±0.010.47±0.14A114-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯33.92±2.917.75±0.760.58±0.573.77±1.161.96±0.242.73±0.0621.34±0.5814.15±1.9914.16±2.2511.16±0.736.67±0.218.62±3.35A12异硫氰酸丙酯10.8±5.283.95±1.284.56±0.732.99±0.330.45±0.34-0.56±0.050.49±0.130.5±0.080.37±0.030.25±00.19±0.07A135-甲硫基-2-戊烯-4-炔醇-------0.17±00.18±00.16±0.030.12±0.010.11±0.01酸类B1L-乳酸----0.35±0.031.11±0------B2乙酸-6.91±1.078.99±2.728.84±3.567.97±0.177.57±0.391.79±0.211.01±0.030.78±0.20.66±0.030.88±0.030.81±0.17B3己酸-0.27±0.050.61±0.530.25±0.110.39±0.03------0.11±0.04B42-戊酮酸1.27±1.080.52±0.412.13±2.672.91±0.682.36±0.98-0.81±0.780.65±0.84---0.16±0.23B5辛酸-0.36±0.041.44±1.370.5±0.050.56±0.160.58±0.08------B6壬酸0.16±0.050.85±0.350.33±0.060.43±0.320.38±0.08-------醇类C1乙醇0.71±0.78.48±0.514.43±1.842.98±1.1512.41±0.4416.85±1.89------C22-庚醇----0.29±0.220.43±0.01------C32-壬烯-1-醇4.54±0.1921.24±0.3418.02±9.7215.79±0.2914.36±1.165.79±0.5410.24±1.096.47±0.156.65±0.677.36±1.786.4±1.313.73±1.19C44-甲基-2-乙基-1-戊醇0.58±0.490.6±00.65±0.30.71±0.070.43±0.040.53±0.10.13±00.2±0.030.16±0.010.14±00.1±00.07±0.01C52-癸烯-1-醇-1.32±0.470.7±0.210.47±0.050.55±00.37±0.110.35±0.010.28±0.060.17±0.010.13±0.020.18±0.030.05±0.07C62-癸醇---0.54±0.270.47±0.010.47±0.14------C72,3-丁二醇------2.34±0.041.34±0.060.58±0.060.68±0.020.84±0.120.51±0.2C81-壬醇-0.37±0.01----------C92-十一烷醇---0.44±0.030.62±0.010.54±0.09------C10苯甲醇-0.57±0.441.36±1.45---0.51±0.330.18±0.010.46±0.440.07±0.010.15±0.060.12±0.07C11苯乙醇----0.36±0.171.18±0.4---0.07±00.07±00.06±0.01烃类D13-甲基十三烷0.34±0.48----------0.06±0.08D2己烯-0.61±0.13----0.21±0.020.3±0.060.24±0.060.15±0.040.16±0.02-D34-甲基十三烷0.34±0.49-----0.45±0.410.08±0.110.18±0.26--0.71±1.01D42-甲基-4-丙基氧杂环丁烷-------0.24±0.060.2±0.030.15±0.010.13±0.040.06±0.01D52-甲基十一烷-0.31±0.030.45±0.240.35±0.26--0.8±0.76-0.33±0.30.05±0-0.56±0.79D62-甲基十七烷0.69±0.85-0.23±0.03---------D73-十一烯1.55±0.34.35±0.711.95±0.672.14±0.441.37±0.090.73±0.070.36±0.080.2±0.050.27±0.070.24±0.060.24±0.020.14±0.11D8苯乙烯--------0.3±0.080.36±0.03-0.8±0.58醛类E1庚醛0.1±0.092.63±0.562.01±0.51.68±0.191.73±0.030.82±0.291.11±0.330.55±0.230.41±0.110.36±00.48±0.160.13±0.01E22,4-庚二烯醛-----------0.27±0.08E32-甲基戊醛--0.34±0.1---------E42-癸烯醛---0.33±0.010.3±0.02-------酮类F1丙酮3.35±0.836.6±2.859.53±3.026.22±0.742.49±1.02-7.4±1.575.31±1.843.91±01.44±0.071.68±0.98-F2甲基庚烯酮-0.85±00.64±0.290.52±0.060.29±00.32±0.060.26±0.010.31±0.04----其他G1庚基氢过氧化物3.45±1.445.89±0.537.55±1.817.56±0.7412.1±0.5112.12±0.171.4±0.731.49±0.540.71±0.060.78±0.050.95±0.170.35±0G2甲氧基苯肟0.52±0.381.29±0.530.56±0.580.7±0.330.61±0.10.44±00.23±0.020.17±0.060.13±00.09±0.010.14±0.020.08±0G33-乙基苯酚--0.52±0.220.6±0.210.49±0.050.65±0.09------G44-乙烯基-2-甲氧基苯酚--------0.19±0.020.13±0.010.06±0-
注:“-”表示未检测出,“P”表示湿态泡菜发酵,“Y”表示半干态泡菜发酵,“0~30”表示发酵时间,d。
半干态发酵主要为含硫化合物。通过发酵前后对比发现,一些挥发性化合物主要是经过发酵产生的,包括异硫脲硫酸甲酯、L-乳酸、乙酸、己酸、辛酸、乙醇、2-癸烯-1-醇、甲基庚烯酮、3-乙基苯酚等成分;另一部分挥发性化合物如甲硫醇、二甲基二硫醚、二甲基三硫醚、4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯、异硫氰酸丙酯、庚基氢过氧化物等成分来自原料自身,其中二甲基二硫醚等在半干态发酵过程中逐渐累积。
2.3 发酵过程中挥发性成分变化
GC-MS用于监测泡菜发酵过程中的挥发性成分变化,使用PCA得分图表示湿态和半干态泡菜发酵30 d筛选的物质成分的变化,如图3-A。其中R2=0.638,Q2=0.342,两种工艺泡菜特征变量63.7%的累积差异被描述,包含45.7%PC1和18.0%PC2。同一95%置信区域显示出湿态和半干态发酵泡菜得到了明显的区分,根据发酵周期,湿态发酵泡菜样品点逐渐从第一象限向第四象限移动,表明发酵过程中连续的挥发性成分变化,发酵前后差异大。另一组为半干态发酵泡菜,分布在第二、三象限,但分布较集中,表明发酵过程中挥发性成分较稳定,变化缓慢。
两种工艺发酵泡菜与挥发性风味成分在主成分上分布得到biplot图,显示出两种工艺泡菜挥发性成分种类和相对含量的共性和个性,如图3-B。挥发性成分距离样品位置越近,表明其影响越大。在湿态泡菜中,发酵在3~10 d时,特征性成分为2-壬烯-1-醇、2-癸烯-1-醇、3-十一烯、己酸、2-戊酮酸、辛酸等,发酵在20~30 d时,主要挥发性成分为二甲基二硫醚、苯乙醇、异硫脲硫酸甲酯、2-癸醇、2-十一烷醇、乙醇、3-乙基苯酚等。半干态发酵泡菜风味成分变化较小,主要挥发性成分为4-异硫氰酸基-1-(甲基亚磺酰基)-1-丁烯、4-甲基十三烷、苯乙烯、4-乙烯基-2-甲氧基苯酚、2,3-丁二醇、5-甲硫基戊腈、4-异硫代氰酸甲基戊酯和2-甲基-4-丙基氧杂环丁烷等。
为更好地显示水分活度对两种工艺泡菜挥发性成分的差异性,采用HCA分析,基于挥发性成分和样本数计算,按照样本数大小分类,如图3-C。在样本数为160~600时,可以将所有样品分为两类,其中一类为湿态发酵3~30 d样品,另一类为0 d的新鲜蔬菜原料和所有的半干态发酵泡菜样品。表明水分活度的差异使两种工艺发酵泡菜挥发性风味成分明显区分,说明该方法在聚类识别中的稳定性。湿态发酵的样品大小差异大,而半干态发酵的样品差异不明显,表明半干态泡菜保留了大量原料自身携带的挥发性成分。
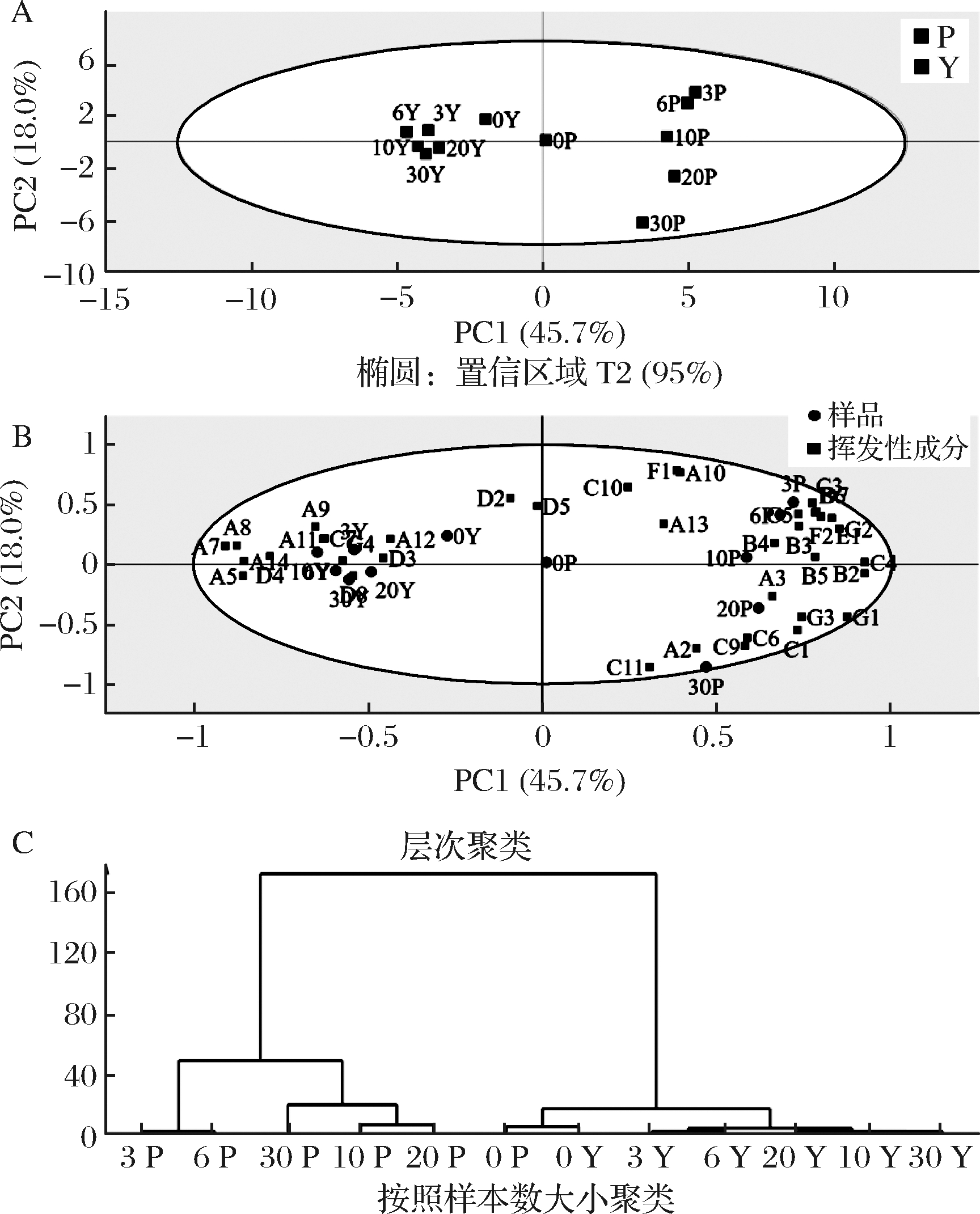
A- PCA得分图; B-biplot;C-HCA分析
图3 湿态和半干态泡菜挥发性成分分析
Fig.3 Analysis of volatile components in wet
and semi-dry paocai
2.4 不同水分活度发酵泡菜挥发性成分差异性
为了将泡菜样品之间最大化分离,去除未控制变量对数据分析的影响,量化特征挥发性成分造成组分差异的程度,应用了监督模式识别方法PLS-DA,如图4-A。PLS-DA得分图显示泡菜样品之间明显分离。模型解释率R2X、R2Y和模型预测能力Q2值分别为0.569,0.986和0.876,其中R2Y和Q2都>0.5,说明模型质量较好[20]。根据PCA模型显示所有泡菜样品同一95%置信区域得到了明显的区分。湿态发酵泡菜样品点处在第二、三象限移动,但0 d的泡菜原料与其他样品分布距离远,表明发酵后样品风味差异大。半干态发酵泡菜分布在第一、四象限,但分布较集中,表明发酵过程中挥发性成分较稳定,变化缓慢。两种工艺泡菜的差异是由于AW影响了泡菜原料的风味,同时发酵过程中细菌群落结构差异大也是非常重要的原因。
经过200次置换测试以验证PLS-DA模型,通过该测试发现,Q2和R2值高于其原始值(最右边>左边),证明了该模型的适用性和有效性,如图4-B。
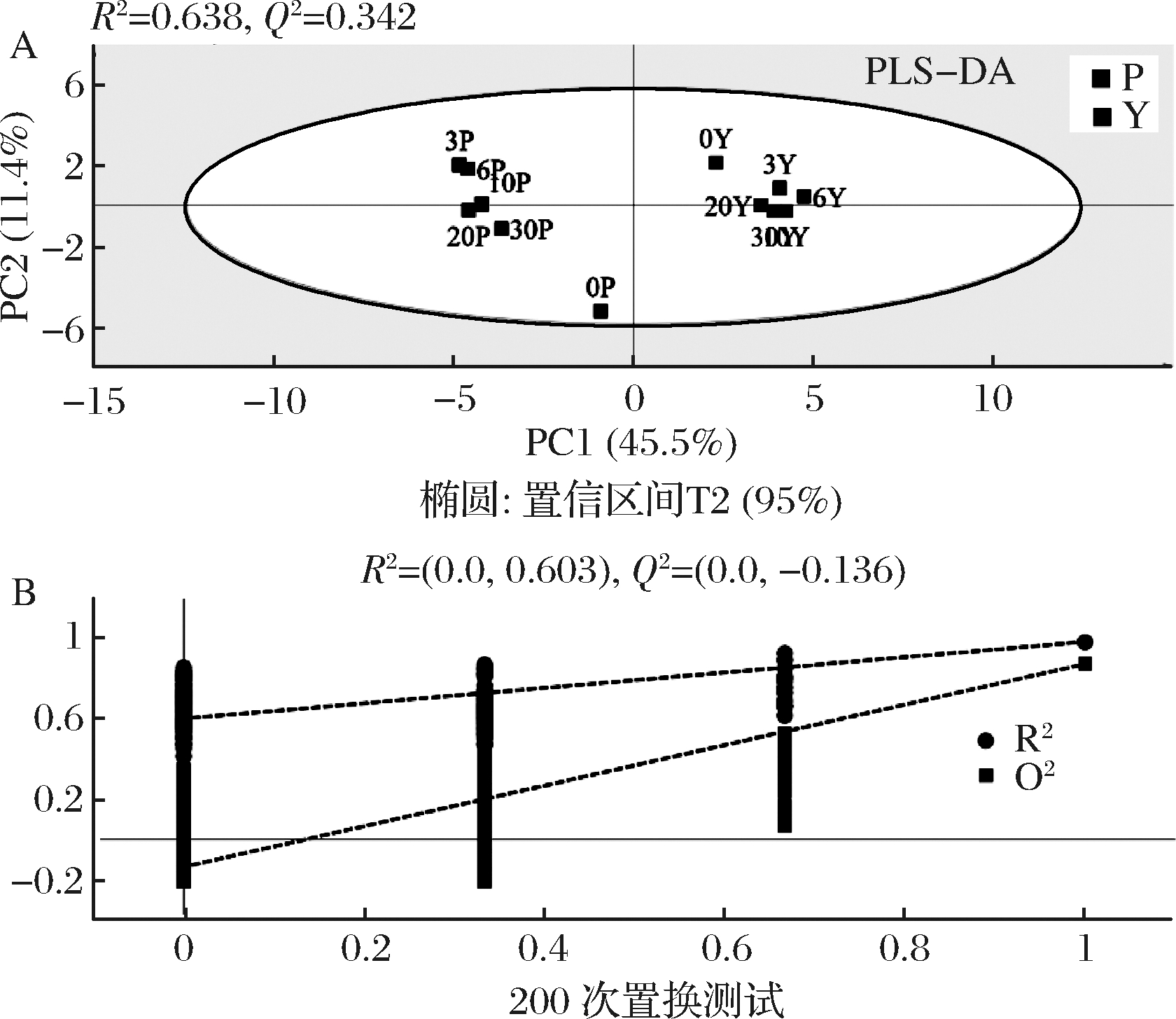
A-PLS-DA得分图; B-PLS-DA模型置换测试
图4 泡菜挥发性成分PLS-DA图及置换检验图
Fig.4 PLS-DA diagram and replacement test diagram of
volatile components in paocai
为了确定差异性的挥发性成分,通过PLS-DA模型筛选对挥发性物质差异具有贡献的标志物,筛选出重要度(VIP>1.2)以及t 检验(P<0.05)的特征性挥发性风味成分有8种,重要性由大到小为二甲基三
硫醚、1-异硫氰酸戊酯、5-甲硫基戊腈、5-甲硫基-2-戊烯-4-炔醇、乙酸、2,3-丁二醇、庚基氢过氧化物和甲氧基苯肟。
8种特征性挥发性风味成分中1-异硫氰酸戊酯、5-甲硫基-2-戊烯-4-炔醇和2,3-丁二醇为半干态泡菜特有的差异性物质,可作为湿态和半干态发酵属性区分物质。1-异硫氰酸戊酯具有辛辣味,阈值低,为十字花科植物中的硫甙物质降解产物[21-22],说明在盐渍过程中萝卜组织因盐渍、低水分等原因而破坏,芥子酶与芥子苷接触而发生酶解。而在湿态发酵中未检测出,表明产酸发酵能降解辛辣味,使泡菜风味更柔和。甲氧基苯肟为两种工艺共有物质,在湿态发酵中先增加后减少,在半干态中呈现逐渐减少的趋势,该物质在其他植物、罗非鱼中常被检测出[23-25],可能为萝卜原料自身携带的物质成分;5-甲硫基戊腈在所有样品中除0 d外都有发现,该物质为萝卜原料中的硫甙物质降解产物[21]。
8种特征性挥发性风味成分相对含量>2%的有二甲基三硫醚、乙酸、2,3-丁二醇和庚基氢过氧化物,对其在湿态和半干态泡菜中的动态变化描述如图5。
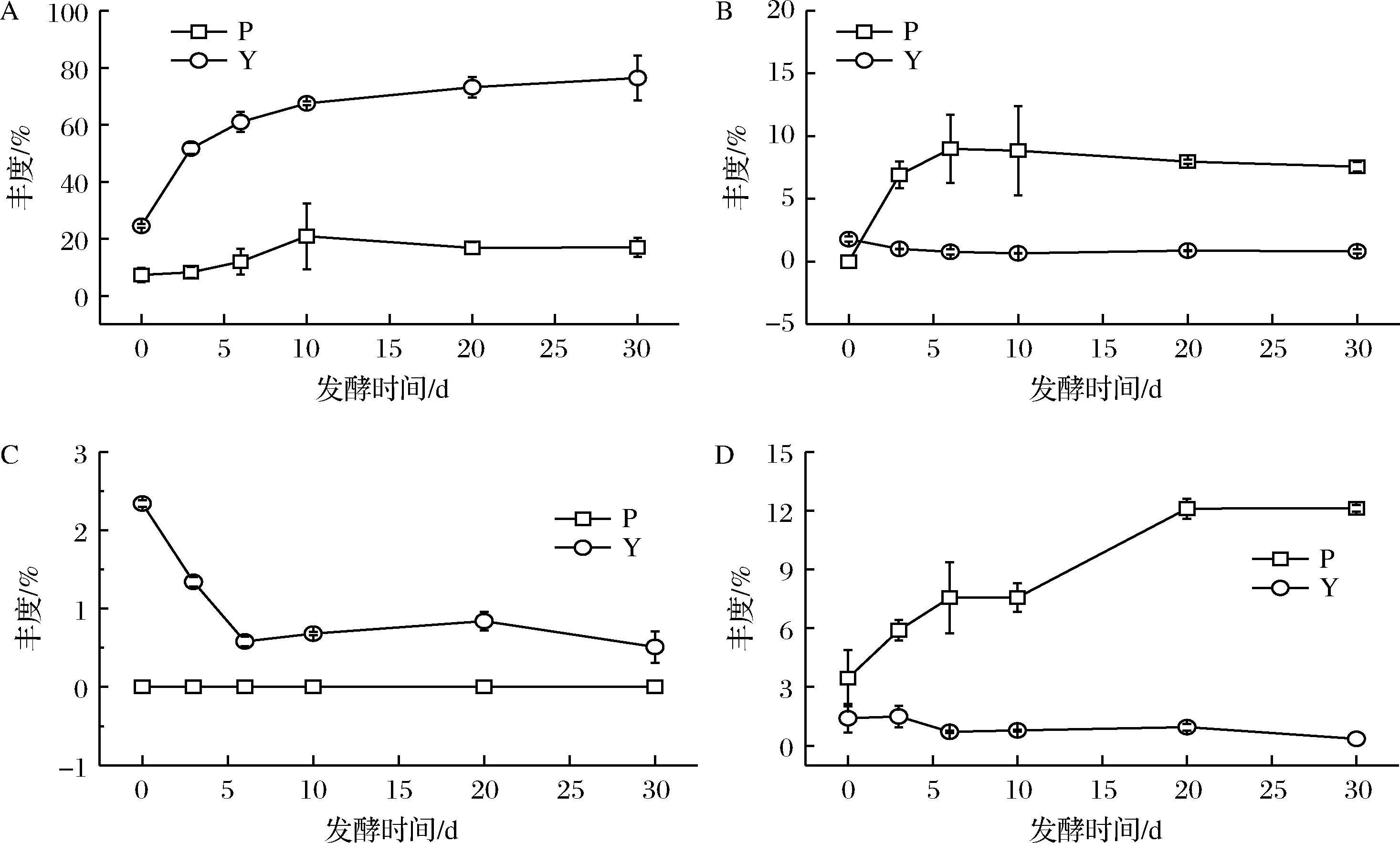
A-二甲基三硫醚; B-乙酸; C-2,3-丁二醇; D-庚基氢过氧化物
图5 湿态和半干态泡菜发酵过程中差异性标志物丰度变化
Fig.5 Changes in abundance of differential markers during fermentation of wet and semi-dry paocai
二甲基三硫醚是半干态中主要挥发性物质,相对含量随发酵时间逐渐增加,30 d时达到76%,在湿态发酵中呈现先增加后减少的趋势。二甲基三硫醚常被报道是四川泡菜[26-27]、韩国泡菜[6-7]等主要风味物质,其阈值低,呈葱香味[26]。乙酸和庚基氢过氧化物为两种工艺发酵共有物质,其中乙酸在湿态中含量相对较高,湿态中发酵2 d出现乙酸,随着发酵进行先增加后稳定的过程,在半干态发酵中含量逐渐减少。乙酸是泡菜中重要的挥发性有机酸,其风味刺激,适量的乙酸对泡菜风味具有提升作用[28],如产生乙酸乙酯等香味物质。乙酸主要为泡菜发酵前期出现的醋酸菌或肠膜明串珠菌等微生物代谢产生[29],也有报道为大肠杆菌等分解葡萄糖产酸的代谢物[30],这与大量报道泡菜发酵前期出现丰度较高的肠杆菌科细菌相一致[31-32]。发酵后期不耐酸微生物的减少,乙酸含量出现稳定和下降,可能与醇类物质发生酯化反应或形成其他成分有关。庚基氢过氧化物在湿态发酵中含量逐渐增加,而在半干态中含量逐渐减少,氢过氧化物在其他食品中常作为脂肪酶促反应的产物[33]。2,3-丁二醇在半干态发酵中含量逐渐减少,其是酒[34]、发酵豆制品[35]等中常见风味成分,可改善食品风味,在工业中作为香精物料。
有些结论与本研究一致,但也有报道存在明显的差异,这主要是其风味物质还受泡菜发酵原辅料、盐度和检测条件等因素影响,研究结果难以相互比较。本文泡菜采用理想的状态(恒温、不含香辛料)进行分析,但现实的泡菜往往是一个复杂的环境,要进一步弄清楚泡菜风味产生机理、风味协同和释放关系等,才更有利于泡菜风味物质的调控。
3 结论
本研究采用HS-SPME-GC-MS结合多元统计分析湿态和半干态泡菜发酵过程中挥发性成分的变化及其差异,结果表明,湿态和半干态发酵工艺泡菜AW差异明显,湿态泡菜更有利于乳酸菌快速生长和总酸的形成。湿态泡菜挥发性成分主要为发酵过程中产生的含硫化合物和醇类,半干态泡菜挥发性成分主要为原料自身的含硫化合物。二甲基三硫醚、1-异硫氰酸戊酯、5-甲硫基戊腈、5-甲硫基-2-戊烯-4-炔醇、乙酸、2,3-丁二醇、庚基氢过氧化物和甲氧基苯肟为湿态和半干态泡菜差异性标志物,其可以用于区分湿态和半干态发酵泡菜工艺和发酵状态。然而,泡菜需要更详细的研究来理解泡菜感官特征、微生物群落和挥发性风味物质的关系,才能有助于调控泡菜品质。
[1] 陈功. 中国泡菜加工技术[M]. 北京:中国轻工业出版社, 2011.
[2] 徐莹. 发酵食品学[M]. 郑州:郑州大学出版社, 2011.
[3] XIAO Z B, ZHU J C, FENG T, et al. Comparison of volatile components in Chinese traditional pickleed peppers using HS-SPME-GC-MS, GC-O and multivariate analysis[J]. Natural Product Research, 2010, 24(20):1 939-1 953.
[4] 徐丹萍,蒲彪,陈安均,等.传统四川泡菜中挥发性成分分析[J]. 食品与发酵工业,2014,40(11):227-232.
[5] 侯晓艳, 陈安均,罗惟,等. 不同乳酸菌纯种发酵萝卜过程中品质的动态化[J]. 食品工业科技, 2015, 36(2):181-185.
[6] KANG J H, LEE J H, MIN S, et al. Changes of volatile compounds, lactic acid bacteria, pH, and headspace gases in Paocai, a traditional Korean fermented vegetable product[J]. Journal of Food Science, 2003, 68(3):849-854.
[7] CHA Y J, KIM H, CADWALLADER K R. Aroma-active compounds in Paocai during fermentation[J]. Journal of Agricultural and Food Chemistry, 1998, 46(5):1 944-1 953.
[8] YAOY, PAN S, FAN G, et al. Evaluation of volatile profile of Sichuan dongcai, a traditional salted vegetable, by SPME-GC-MS and E-nose[J]. LWT - Food Science and Technology, 2015, 64(2):528-535.
[9] 左勇, 王小龙,江鹏,等. 主成分分析法在研究宜宾芽菜风味物质变化中的应用[J]. 食品工业科技, 2015, 36(16):68-74.
[10] 石磊. 接种发酵冬菜及其风味物质的研究[D]. 天津:天津科技大学,2010.
[11] 刘大群,华颖.基于电子鼻与SPME-GC-MS法分析不同脱水方式下萧山萝卜干中的挥发性风味物质[J]. 现代食品科技,2014,30(2):279-284.
[12] BLEVE G, TUFARIELLO M, DURANTE M, et al. Physico-chemical and microbiological characterization of spontaneous fermentation of Cellina di Nardò and Leccino table olives[J]. Front Microbiol, 2014, 5(5):570.
[13] TRIPATHI J, CHATTERJEE S, GAMRE S, et al. Analysis of free and bound aroma compounds of pomegranate (Punica granatum L.)[J]. LWT - Food Science and Technology, 2014, 59(1):461-466.
[14] 汪冬冬, 张其圣,陈功,等. 不同蔬菜原料发酵泡菜挥发性成分解析[J]. 食品工业科技, 2018,39(3):234-242.
[15] 李春林, 陈旭红. 应用多元统计分析[M]. 北京:清华大学出版社, 2013.
[16] BEUCHAT L R. Microbial stability as affected by water activity[J]. Cereal Foods World, 1981, 26(7):345-349.
[17] ZHANG Q, CHEN G, SHEN W, et al. Microbial safety and sensory quality of instant low-salt Chinese paocai[J]. Food Control, 2016, 59:575-580.
[18] CHEIGH H, PARK K Y, LEE C Y. Biochemical, microbiological, and nutritional aspects of paocai (Korean fermented vegetable products)[J]. C R C Critical Reviews in Food Science&Nutrition, 1994, 34(2):175-203.
[19] HAMADY M, WALKER J J, HARRIS J K, et al. Error-correcting barcoded primers for pyrosequencing hundreds of samples in multiplex[J]. Nature Methods, 2008, 5(3):235-237.
[20] YIN P, WAN D, ZHAO C, et al. A metabonomic study of hepatitis B-induced liver cirrhosis and hepatocellular carcinoma by using RP-LC and HILIC coupled with mass spectrometry[J]. Molecular Biosystems, 2009, 5(8):868-876.
[21] MITHEN R, ARMAH C, TRAKA M. Cruciferous Vegetables-and Biological Activity of Isothiocyanates and Indoles[M].Vegetables, Whole Grains, and Their Derivatives in Cancer Prevention. Springer Netherlands, 2011.
[22] 李晨, 薛峰,缪文华,等. 硫甙葡萄糖苷降解研究进展[J]. 食品科学, 2010, 31(9):313-317.
[23] 邓娇,郑金萍.6种莲花花瓣的挥发性物质成分的分析[J]. 贵州师范大学学报(自然科学版),2017,35(4):56-63.
[24] NIU Y, HARFY G, AGARWAL M, et al. Characterization of volatiles Tribolium castaneum (H.) in flour using solid phase microextraction-gas chromatography mass spectrometry (SPME-GCMS)[J]. Food Science and Human Wellness, 2016, 5(1): 24-29.
[25] 张志平. 罗非鱼皮明胶的脱腥、流变性质及其对酸奶品质的影响[D]. 上海:上海海洋大学,2016.
[26] 徐丹萍. 结球甘蓝泡菜发酵过程中挥发性成分分析[D]. 雅安:四川农业大学,2015.
[27] 陈功, 张其圣,余文华,等. 四川泡菜挥发性成分及主体风味物质的研究(二)[J]. 中国酿造, 2010(12):19-23.
[28] KANDLER O. Carbohydrate metabolism in lactic acid bacteria[J]. Antonie Van Leeuwenhoek, 1983, 49(3):209-224.
[29] 彭飞. 我国传统泡菜自然发酵与接种发酵中微生物及其代谢特性研究[D]. 南昌:南昌大学,2015.
[30] 任涛, 王瑛. 微生物对蔬菜腌制品风味及品质的影响[J]. 中国调味品, 1989(7):5-8.
[31] JEONGS H, LEE S H, JUNG J Y, et al. Microbial succession and metabolite changes during long-term storage of Kimchi[J]. Journal of Food Science, 2013, 78(5):M763-M769.
[32] ZHANG Q, CHEN G, SHEN W, et al. Microbial safety and sensory quality of instant low-salt Chinese paocai[J]. Food Control, 2016, 59:575-580.
[33] 蔡琨, 方云,夏咏梅. 植物脂肪氧合酶的研究进展[J]. 现代化工, 2003, 23(z1):23-27.
[34] 李东, 胥春平,严志勇,等. 四川酱酒风味成分与风格的探讨[J]. 酿酒, 2016, 43(1):39-42.
[35] 刘莹,胡茂丰,刘素纯.不同菌种发酵对蚕豆酱风味成分的影响[J]. 现代食品科技,2015,31(3):190-196;201.